Hak Cipta pada Kementerian Pendidikan dan Kebudayaan Dilindungi Undang-Undang
Penulis:
1. Ratna Dewi Kusumaningtyas 2. Sri Haryani
750.014 BAS k
Kotak Katalog dalam terbitan (KDT)
2017
Disusun dengan huruf Times New Roman, 11 pt
Milik Negaraiv
KATA PENGANTAR
Undang-Undang Dasar Negara Republik Indonesia Tahun 1945 Pasal 31 ayat (3) mengamanatkan bahwa Pemerintah mengusahakan dan menyelenggarakan satu sistem pendidikan nasional, yang meningkatkan keimanan dan ketakwaan serta akhlak mulia dalam rangka mencerdaskan kehidupan bangsa, yang diatur dengan undang-undang. Atas dasar amanat tersebut telah diterbitkan Undang-Undang Republik Indonesia Nomor 20 Tahun 2003 tentang Sistem Pendidikan Nasional.
Implementasi dari undang-undang Sistem Pendidikan Nasional tersebut yang dijabarkan melalui sejumlah peraturan pemerintan, memberikan arahan tentang perlunya disusun dan dilaksanakan delapan standar nasional pendidikan, diantaranya adalah standar sarana dan prasarana. Guna peningkatan kualitas lulusan SMK maka salah satu sarana yang harus dipenuhi oleh Direktorat Pembinaan SMK adalah ketersediaan bahan ajar siswa khususnya bahan ajar Peminatan C1 SMK sebagai sumber belajar yang memuat materi dasar kejuruan.
Kurikulum yang digunakan di SMK baik kurikulum 2013 maupun kurikulum KTSP pada dasarnya adalah kurikulum berbasis kompetensi. Di dalamnya dirumuskan secara terpadu kompetensi sikap, pengetahuan dan keterampilan yang harus dikuasai peserta didik serta rumusan proses pembelajaran dan penilaian yang diperlukan oleh peserta didik untuk mencapai kompetensi yang diinginkan. Bahan ajar Siswa Peminatan C1 SMK ini dirancang dengan menggunakan proses pembelajaran yang sesuai untuk mencapai kompetensi yang telah dirumuskan dan diukur dengan proses penilaian yang sesuai.
v dilakukan peserta didik untuk mencapai kompetensi yang diharapkan. Sesuai dengan pendekatan kurikulum yang digunakan, peserta didik diajak berani untuk mencari sumber belajar lain yang tersedia dan terbentang luas di sekitarnya. Bahan ajar ini merupakan edisi ke-1. Oleh sebab itu Bahan Ajar ini perlu terus menerus dilakukan perbaikan dan penyempurnaan.
Kritik, saran, dan masukan untuk perbaikan dan penyempurnaan pada edisi berikutnya sangat kami harapkan; sekaligus, akan terus memperkaya kualitas penyajian bahan ajar ini. Atas kontribusi itu, kami ucapkan terima kasih. Tak lupa kami mengucapkan terima kasih kepada kontributor naskah, editor isi, dan editor bahasa atas kerjasamanya. Mudah-mudahan, kita dapat memberikan yang terbaik bagi kemajuan dunia pendidikan menengah kejuruan dalam rangka mempersiapkan Generasi Emas seratus tahun Indonesia Merdeka (2045).
vi
DAFTAR ISI
Kata Pengantar ... iv
Daftar Isi ... vi
Daftar Gambar ... vii
Daftar Tabel ... ix
Pendahuluan ... x
Bab 1 Hidrokarbon Dan Minyak Bumi ... 1
A. Senyawa Hidrokarbon (Identifikasi Atom C,H Dan O) ... 1
B. Klasifikasi Senyawa Hidrokarbon ... 6
C. Kekhasan Atom Karbon ... 9
D. Atom C Primer, Sekunder, Tertier Dan Kuartener ... 13
E. Struktur Alkana, Alkena, Dan Alkuna ... 17
F. Isomer... 39
G. Sifat-Sifat Fisik Alkana, Alkena, Dan Alkuna ... 49
H. Reaksi Senyawa Hidrokarbon ... 58
Bab 2 Minyak Bumi ... 78
A. Minyak Bumi ... 78
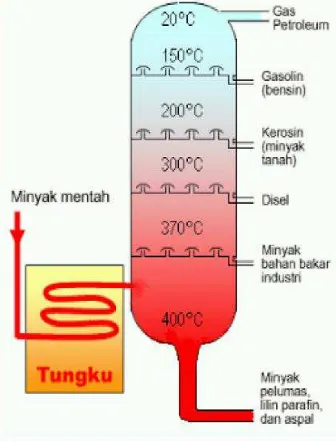
B. Fraksi Minyak Bumi ... 97
C. Mutu Bensin ... 117
D. Dampak Pembakaran Bahan Bakar Dan Cara Mengatasinya ... 126
E. Senyawa Hidrokarbon Dalam Kehidupan Sehari-Hari ... 139
Daftar Pustaka ... 151
Glosarium ... 152
vii
DAFTAR GAMBAR
Gambar 1.1 Contoh senyawa karbon dalam kehidupan sehari-hari ... 2
Gambar 1.2 Percobaan adanya karbon dan hidrokarbon pada senyawa organik ... 4
Gambar 1.3 Kegunaan hidrokarbon dalam kehidupan sehari-hari ... 5
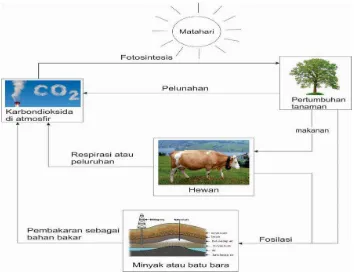
Gambar 1.4 Siklus karbon yang berkaitan dengan senyawa ... 9
Gambar 1.5 Gugus yang terikat pada karbon sp2 berkedudukan tetap relatif satu ... 28
Gambar 1.6 Pengelasan menggunakan karbit ... 33
Gambar 1.7 Tabung Gas Asetilen ... 33
Gambar 1.8 Bagan kesiomeran ... 41
Gambar 1.9 Struktur molekul senyawa ester (etil butanoat) ... 71
Gambar 1.10 Senyawa ester sebagai pemberi aroma makanan ... 71
Gambar 1.11 Senyawa ester sebagai parfum ... 71
Gambar 1.12 Molekul surfaktan ... 71
Gambar 2.1 Ensiklopedi Britannica ... 78
Gambar 2.4 Sistem distilasi minyak bumi ... 80
Gambar 2.5 Kolonel Drake ... 81
Gambar 2.6 Aeiko Jana Zijker ... 82
Gambar 2.7 Profil Batuan ... 83
Gambar 2.8 Dimitri Mendeleyev ... 85
Gambar 2.9 Proses pembentukan minyak bumi ... 88
Gambar 2.10 Proses pembentukan minyak bumi ... 88
Gambar 2.11 Proses pembentukan minyak bumi ... 89
Gambar 2.12 Proses pembentukan minyak bumi ... 90
Gambar 2.13 Wujud minyak mentah dari hasil kilang minyak ... 98
Gambar 2.14 Struktur molekul siklopentana dan sikloheksana ... 99
Gambar 2.15 Struktur molekul dekalin ... 100
Gambar 2.16 Struktur molekul bensen ... 100
Gambar 2.17 Struktur molekul naftalen dan antrasen ... 101
Gambar 2.18 Struktur molekul etilen ... 101
Gambar 2.19 Korosi pada besi ... 104
Gambar 2.20 Pabrik Gas LNG ... 108
viii
Gambar 2.22 Transportasi LNG melalui jalur pemipaan ... 109
Gambar 2.23 Tabung gas kemasan elpiji ... 109
Gambar 2.24 Rumus molekul petroleum eter ... 110
Gambar 2.25 Petroleum eter ... 110
Gambar 2.26 Logo bahan bakar bensin jenis Pertamax dan Pertalite ... 110
Gambar 2.27 Produk turunan nafta ... 111
Gambar 2.28 Kode SAE Pada kemasan pelumas ... 113
Gambar 2.29 Katoda pada baterai ... 114
Gambar 2.30 Polusi udara akibat pembakaran bahan bakar alat transportasi ... 126
Gambar 2.31 Ilustrasi efek rumah kaca akibat CO2 ... 129
Gambar 2.32 Kerusakan hutan akibat hujan asam ... 131
Gambar 2.33 Partikulat pada gas buang industri ... 134
Gambar 2.34 Gula monosakarida (madu) ... 139
Gambar 2.35 Molekul senyawa monosakarida ... 140
Gambar 2.36 Gula disakarida (gula meja) ... 140
Gambar 2.37 Molekul senyawa disakarida ... 141
Gambar 2.38 Molekul senyawa oligisakarida ... 141
Gambar 2.39 Gula polisakarida pada umbi dan selulosa ... 141
Gambar 2.40 Molekul Senyawa Amilum ... 142
Gambar 2.41 Molekul senyawa selulosa ... 142
Gambar 2.42 Molekul Senyawa Glikogen ... 142
Gambar 2.43 Molekul Senyawa P-Xylene ... 143
Gambar 2.44 Serat kain poliester ... 144
Gambar 2.45 Dakron dan kain poliester ... 144
Gambar 2.46 Contoh produk hasil olahan LDPE... 145
Gambar 2.46 Contoh produk hasil olahan HDPE ... 145
Gambar 2.47 Pipa PVC ... 146
Gambar 2.49 Papan selancar ... 146
Gambar 2.50 Perkakas melamin ... 146
Gambar 2.51 Pupuk hasil industri petrokimia ... 147
Gambar 2.51 Selang karet sintetis... 148
ix
DAFTAR TABEL
Tabel 1.1 Perbedaan senyawa organik dan anorganik ... 2
Tabel 1.2 Beberapa gugus fungsi dan golongan senyawa... 18
Tabel 1.3 Sepuluh alkana rantai lurus pertama ... 20
Tabel 1.4 Lima gugus alkil rantai lurus pertama... 21
Tabel 1.5 Alkena rantai lurus ... 26
Tabel 1.6 Struktur Trivial Alkena ... 28
Tabel 1.7 Alkuna rantai lurus ... 34
Tabel 1.8 Perbedaan dari Alkana, Alkena,dan Alkuna ... 35
Tabel 1.9 Data titik didih dan titik leleh senyawa alkanapada kondisi atmosferik ... 50
Tabel 1.10 Data titik didih dan titik leleh senyawa alkena pada kondisi atmosferik ... 51
Tabel 1.11 Beberapa jenis polimer adisi ... 61
Tabel 1.12 Beberapa jenis polimer kondensasi ... 62
Tabel 2.1 Senyawa belerang yang terdapat dalam minyak bumi dan produknya ... 102
Tabel 2.2 Distribusi belerang dalam produk hasil distilasi minyak mentah ... 103
Tabel 2.3 Senyawa nitrogen basa yang terdapat dalam minyak bumi dan produknya ... 105
Tabel 2.4 Senyawa nitrogen bukan basa yang terdapat dalam minyak bumi ... 106
x
PENDAHULUAN
A. Deskripsi
Buku Kimia untuk SMK Teknologi dan Rekayasa Kelas XI ini terdiri dari 2 paket buku, yaitu paket buku 1 untuk semester 1 dan paket buku 2 untuk semester 2. Buku ini merupakan paket buku 1 yang akan mempelajari tentang hidrokarbon dan minyak bumi serta senyawa hidrokarbon dalam kehidupan sehari-hari.
B. Prasyarat
Untuk mempelajari Buku Kimia untuk SMK Teknologi dan Rekayasa Kelas XI ini tidak diperlukan prasyarat mata pelajaran tertentu.
C. Petunjuk Penggunaan Buku
Untuk mempermudah penggunaan paket buku perlu diperhatikan petunjuk berikut ini:
1. Pelajari daftar isi serta peta konsep setiap materinya.
2. Perhatikan langkah-langkah dalam melakukan pekerjaan dengan benar untuk mempermudah dalam memahami suatu proses pekerjaan, sehingga diperoleh hasil yang maksimal.
3. Pahami setiap materi teori dasar yang akan menunjang penguasaan suatu pekerjaan dengan membaca secara teliti. Apabila terdapat evaluasi, maka kerjakan evaluasi tersebut sebagai sarana latihan.
4. Jawablah tes formatif dengan jawaban yang singkat dan jelas serta kerjakan sesuai dengan kemampuan Anda setelah mempelajari paket buku ini.
5. Bila terdapat penugasan, kerjakan tugas tersebut dengan baik dan jika perlu konsultasikan hasil tersebut pada guru/instruktur.
6. Catatlah kesulitan yang Anda dapatkan dalam paket buku ini untuk ditanyakan pada guru pada saat kegiatan tatap muka. Bacalah referensi yang lain yang berhubungan dengan materi paket buku agar Anda mendapatkan pengetahuan tambahan.
D. Tujuan Akhir
Setelah mempelajari buku ini diharapkan Anda dapat: 1. Menjelaskan tentang hidrokarbon dan minyak bumi,
1
BAB 1
HIDROKARBON DAN MINYAK BUMI
A.
Senyawa Hidrokarbon (Identifikasi Atom C,H dan O)
Senyawa organik yang paling sederhana adalah senyawa hidrokarbon. Senyawa hidrokarbon merupakan senyawa karbon yang hanya tersusun dari atom hidrogen dan atom karbon, akan tetapi senyawa karbon di samping atom-atom C dan H, mengandung pula atom yang lain seperti atom O. Adanya atom- atom C, H, dan atom O dapat dilihat dari adanya fenomena pembakaran sebagai berikut .
Suatu pembakaran merupakan reaksi cepat suatu senyawa dengan oksigen. Pembakaran terjadi disertai dengan pembebasan kalor (panas) dan cahaya, yaitu suatu bentuk energi yang dicari manusia karena api dapat menghangatkan, hampir semua senyawa organik dapat terbakar. Pembakaran campuran organik, seperti kayu, tidak selalu berupa pengubahan CO2 dan H2O. Pembakaran merupakan salah satu reaksi yang rumit. Salah satu macam reaksi yang terjadi adalah pirolisis, yaitu pemecahan termal molekul besar menjadi suatu molekul yang lebih kecil tanpa adanya oksigen. Pirolisis molekul-molekul besar dalam pembakaran kayu misalnya, menghasilkan molekul gas yang lebih kecil, yang kemudian bereaksi dengan oksigen di atas permukaan kayu tersebut. Suatu kontak reaksi dengan oksigen inilah yang menyebabkan terjadinya nyala api. Permukaan kayu terjadi oksidasi lambat tetapi permukaan sangat paans dari residu karbon. Sebagian besar kalor dari api kayu ataupun dari batu bara disebabkan karena oksidasi yang lambat tadi, bukan dari api yang dihasilkan.
2
Gambar 1.1 Contoh senyawa karbon dalam kehidupan sehari-hari
Fenomena pembakaran bahan organik yang menghasilkan suatu unsur penyusun senyawa karbon memberikan suatu pernyataan bahwa senyawa hidrokarbon merupakan senyawa organik. Tetapi suatu fenomena yang terjadi pada urea yaitu pemanasan senyawa sianat yang merupakan senyawa anorganik, reaksi yang terjadi adalah sebagai berikut :
Pada reaksi senyawa sianat pada pembentukan urea merupakan eksperimen yang dilakukan oleh Wohler yang sedang menguapkan pelarut sianat untuk memperoleh kristal amonium sianat, akan tetapi karena pemanasan yang dilakukan terlalu lama sehingga amonium sianat berubah menjadi urea. Penemuan ini memperlihatkan bahwa suatu senyawa organik tidak selamanya berasal dari senyawa organik, namun dapat disintesis dari senyawa anorganik, misalnya karet, pipa, dan lain sebagainya. Beberapa perbedaan antara senyawa organik dan anorganik, dicantumkan pada tabel 1.1 berikut:
Tabel 1.1 Perbedaan senyawa organik dan anorganik
Senyawa organik Senyawa anorganik
Pada umumnya tidak tahan panas (terurai pada suhu rendah)
Pada umumnya tahan panas (terurai pada suhu tinggi)
Sebagian besar tidak larut dalam air Sebagian besar larut dalam air
Semuanya berikatan kovalen Ada yang berikatan kovalen dan ion
Reaksi berjalan lambat Reaksi berjalan cepat
Jika dibakar menghasilkan karbon (arang) atau gas CO2
Jika dibakar tidak menghasilkan arang atau gas CO2
Sudah dijelaskan bahwa suatu senyawa hidrokarbon terdiri dari unsur hidrogen dan karbon. Senyawa hidrokarbon termasuk senyawa organik. Senyawa organik umumnya mengandung unsur hidrogen dan karbon, walaupun masih ada unsur penyusun lainnya
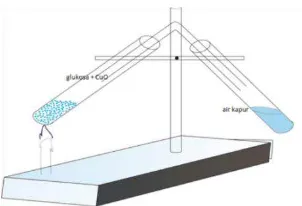
3 seperti oksigen, halogen , nitrogen, belerang, dan logam lainnya. Pembuktian adanya karbon sebagai penyusun senyawa hidrokarbon dapat dilakukan dengan dilakukan percobaan berikut ini :
a. Masukan satu senduk gula pasir ke dalam tabung reaksi. b. Tutup ujung tabung reaksi dengan kapas
c. Tabung reaksi yang sudah tertutup kemudian di jepit tabung reaksi tersebut dengan penjepit yaitu klem dan statif (penjepit kayu).
d. Setelah tabung reaksi dijepit dengan statif dan klem kemudian panaskan sampai terbentuk zat cair yang menempel pada dinding dalam tabung reaksi tersebut. e. Tabung reaksi yang sudah tertutup dengan kapas, kemudian dilepaskan dan di
masukkan kertas kobalt (II) klorida sampai menempel pada dinding bagian dalam tabung yang terdapat zat cair.
f. Amati yang terjadi bila kertas kobal (II) ditetesi dengan air.
g. Lakukan pemanasan pada tabung reaksi tersebut sampai terbentuk zat padat hitam h. Ulangi percobaan di atas dengan bahan yang berbeda yaitu gula pasir diganti
dengan glukosa, amati perubahan yang terjadi setelah bahan yang lain digunakan i. Campurkan satu sendok glukosa tersebut dengan setengah sendok tembaga (II)
oksida pada selembar kertas, kemudian masukkan campuran tersebut kedalam tabung reaksi
4
Gambar 1.2 Percobaan adanya karbon dan hidrokarbon pada senyawa organik
Suatu kadar karbon senyawa hidrokarbon dapat diketahui dengan uji pembakaran, yaitu dengan cara mengukur suatu karbondioksida dan air yang dihasilkan dari pembakaran, sehingga suatu massa molekul dan rumus molekul suatu senyawa hidrokarbon dapat diketahui.
Contoh Latihan :
Pada pembakaran sempurna suatu senyawa hidrokarbon terbentuk 8,8 gram karbondioksida dari 5,4 gram uap air. Tentukan rumus molekul senyawa hidrokarbon jika massa molekul senyawa adalah 30.
Reaksi : CXHY + O2 CO2 + H2O
Penyelesaian :
Diketahui : massa CO2 =8,8 gram
massa H2O = 5,4 gram
Mr senyawa = 30
5 Perbandingan mol C dan H adalah :
C : H = 0,2 mol : 0,6 mol = 1 : 3
Jadi rumus empiris senyawa tersebut adalah Mr CXHY = 30
(CXHY)n = 30 (24n + 6n) = 30 30n = 30 n = 1 maka, CXHY = (C2H6)1
= C2H6
Kegunaan senyawa hidrokarbon dalam kehidupan sehari- hari contohnya yaitu mengisi bensin, mencuci dengan detergen, atau memasak dengan menggunakan LPG.
Kegunaan hidrokarbon dalam kehidupan sehari – hari dicantumkan pada uraian berikut ini :
a) Sebagai bahan baku industri pada pengolahan minyak bumi dan gas alam, misalnya industri plastik, deterjen, karet sintesis, dan lain sebagainya.
b) Bahan baku untuk pembuatan senyawa, misalnya alkohol, asam cuka, dan lain sebagainya
c) Dapat digunakan sebagai bahan pelarut , misalnya petroleum eter.
d) Sebagai bahan bakar dan sumber energi, misalnya yaitu LPG, bensin, solar , kerosin (minyak tanah).
6
B.
Klasifikasi Senyawa Hidrokarbon
Hidrokarbon dan senyawa-senyawa turunannya dapat diklasifikasikan ke dalam tiga kategori, yaitu sebagai berikut :
a. Hidrokarbon alifatik, yaitu senyawa hidrokarbon yang mempunyai rantai karbon terbuka (tidak berlingkar atau siklik), Contohnya adalah:
CH3CH2CH2CH3 CH3CH2CH2CH2CH3
Butana Pentana
7 c. Hidrokarbon aromatik, merupakan bagian dari senyawa siklik yang biasanya
memiliki cincin dengan enam atom karbon, dengan ikatan tunggal dan ikatan rangkap dua terletak berselang seling didalam rantainya, contohnya adalah :
Contoh Latihan :
Suatu minyak dan lemak tergolong hidrokarbon,pada suhu kamar, minyak berwujud cair, sedangkan suatu lemak berwujud padat. Jelaskan mengapa fenomena itu bisa terjadi.
Penyelesaian:
Minyak mengandung ikatan rangkap tidak jenuh, sedangkan dalam lemak sendiri memiliki ikatan rangkap yang jenuh. Adanya kandungan ikatan rangkap ini yang menimbulkan gaya antarmolekul kurang kuat sehingga minyak mudah mencair dan sebaliknya.
Soal Latihan! Pilihan Ganda
Petunjuk: Pilihlah salah satu jawaban yang paling tepat! 1. Di bawah ini yang termasuk senyawa karbon adalah . . . .
a. alkohol d. kalsium oksida
b. natrium karbonat e. natrium hidroksida c. garam dapur
2. Pada proses percobaan identifikasi senyawa C, H, dan O saat gas hasil pemanasan campuran antara glukosa dengan CuO yang dapat mengeruhkan air kapur adalah . . . .
a. H2 d. CO
b. H2O e. N2
8 3. Cara untuk membuktikan adanya CO2 dari hasil pembakaran senyawa hidrokarbon
adalah . . .
a. dicairkan dan dibakar b. dibakar dan direduksi c. direaksikan dengan larutan d. direaksikan dengan uap H2o
e. direaksikan dengan uap H2o kemudian dialiri arus listrik
4. Pernyataan berikut dapat dijadikan pembenaran adanya unsur dalam hdrokarbon setelah dibakar adalah . . . .
a. terbentuk asap putih dari hasil pembakaran
b. adanya tetesan – tetesan embun di dalam pipa pengalir akibat pendinginan c. larutan menjadi keruh setelah dilewati gas hasil pembakaran
d. terbentuk gas yang dapat dilihat dari gelembunf dalam larutan
e. tidak dapat dilihat dengan kasat mata karena air yang terbentuk berupa gas 5. Senyawa hidrokarbon siklik adalah senyawa hidrokarbon yang . . . .
a. rantai atom karbonnya terbuka dan tidak bercabang
b. rantai atom karbonnya tertutup (berlingkar) dan jumlah lingkar atom C tidak tertentu
c. rantai atom karbonnya terbuka dan bercabang
d. rantai atom karbonnya tertutup dengan cincin yang biasanya terdiri atas enam atom C di mana ikatan rangkap dan tunggal terletak berselang seling.
e. rantai atom karbonnya tak terbuka dan tak bercabang
Essay
Kerjakan soal-soal berikut dengan benar!
1. Bagaimana membuktikan adanya unsur C dan H dalam hidrokarbon ? Bagaimana cara untuk mengidentifikasinya ?
2. Sebutkan perbedaan-perbedaan antara senyawa karbon dan senyawa anorganik ? 3. Siapakah yang pertama-tama menyusun senyawa-senyawa organik dalam satu
golongan ?
4. Apakah yang di maksud dengan senyawa hidrokarbon ?
9
C.
Kekhasan Atom Karbon
1. Karbon dan senyawa karbon
Karbon (C) merupakan unsur yang sangat lazim. Dalam kehidupan sehari hari, kita dapat mengenal beberapa bentuk karbon yaitu arang, grafit dan intan. Bentuk-bentuk berbeda dari unsur yang sama dikenal dengan istilah alotropi . perbedaan sifat antara bentuk alotropi tersebut terjadi karena perbedaan strukturnya.
Kelimpahan karbon di kulit bumi sekitar 0,08 %. Sekitar 50 % dari karbon tersebut terdiri dari karbonat , contohnya kalsium karbonat (CaCO3) sebagian terdapat senyawa organik, sebagai karbondioksida, dan berbagai senyawa karbon lainnya. Hanya sebagian kecil yang terdapat sebagai unsur, yaitu dalam intan dan grafit, tetapi senyawa karbon merupakan pambangun sel hidup.
Karbon merupakan satu unsur di antara unsur dalam susunan berkala. Atom- atom karbon yang terkandung di dalam senyawa disebut senyawa karbon. Jumlah senyawa karbon saat ini lebih banyak daripada jumlah senyawa bukan karbon. Atom karbon dapat membentuk senyawa- senyawa yang stabil dan jumlahnya sangat banyak, karena suatu atom karbon mempunyai beberapa sifat yang khas. Di dalam siklus karbon selalu berkaitan dengan senyawa-senyawa karbon, seperti terlihat pada Gambar 1.4
10 Kekhasan atom karbon, di antaranya sebagai berikut :
1. Atom karbon terdiri dari empat pasang elektron
Atom karbon membentuk empat pasang elektron persekutuan dengan atom-atom lain sehingga tidak ada pasangan elektron bebas atau adanya orbital yang kosong akibatnya secara kinetik senyawa karbon dapat stabil.
2. Atom karbon mempunyai 4 elektron valensi,
Suatu atom karbon untuk mencapai konfigurasi oktet atom karbon dapat membentuk 4 ikatan kovalen yang relatif kuat. senyawa atom C membentuk ikatan dengan hibridisasi sp3 dengan ikatan tunggal, tetapi tidak untuk senyawa yang berisi ikatan ganda. Ikatan kimia antara atom-atom dalam senyawa karbon bersifat kovalen. Keadaan dasar atom karbon mempunyai dua buah elektron yang tidak berpasangan, sehingga atom karbon seharusnya hanya bervalensi dua. Atom karbon dalam keadaan dasar adalah sebagai berikut :
126 C : 1s2 2s2 2px1 2py1
Atom karbon dalam senyawanya bervalensi empat. Untuk memenuhi kenyataan itu atom karbon harus mengadakan hibridisasi (percampuran) antara orbital 2s dan 2pyang membentuk hibrida sp3.
1s2 2s1 2px1 2py1 2pz1 Atom karbon tereksitasi :
1 1 1 1
Bentuk orbital hibrida sangat berbeda dari orbital asalnya. Hibridisasi sp3 masing-masing orbital mengarah pada sudut-sudut suatu tetrahedron dengan inti atom karbon sebagai titik berat dari tetrahedron tersebut. Rantai karbon dapat juga membentuk ikatan rangkap dua atau rangkap tiga, sehingga dalam hal itu suatu atom karbon mengalami hibridisasi sp2 dan sp.
3. Terjadinya peristiwa katenasi pada atom karbon
Atom-atom karbon dapat mengadakan katenasi yaitu suatu kemampuan untuk membentuk rantai karbon. Rantai karbon itu mungkin terbuka atau lingkar dan bercabang atau tidak. Adanya katenasi tersebut mengakibatkan timbulnya peristiwa
1s 2s
sp3
11 isomeri, yaitu zat-zat kimia yang mempunyai rumus molekul yang sama tetapi rumus strukturnya berbeda.
4. Atom karbon dapat membentu ikatan kimia
Atom karbon dapat membentuk ikatan-ikatan kimia yang kuat, baik sebagai ikatan tunggal, ikatan rangkap atau sebagai ganda tiga. Ikatan-ikatan kimia yang kuat terbukti dari besarnya energi ikatan yang dapat dilihat di bawah ini :
Ikatan tunggal : C – C dengan energi ikatan : +356 Kj mol-1
Disebut ikatan tunggal jika hanya satu pasang elektron ikatan yang terjadi antara dua atom C yang berikatan 2. Ikatan rangkap dua
Disebut ikatan rangkap dua jika ada dua pasang elektron ikatan yang terjadi antara dua atom C yang berikatan
3. Ikatan rangkap tiga
Disebut ikatan rangkap tiga jika ada tiga pasang elektron ikatan yang terjadi antara dua atom C yang berikatan
Berdasarkan jenis ikatan yang dibentuk sesama atom C dalam rantai karbon, maka senyawa hidrokarbon dibedakan menjadi dua yaitu :
1. Senyawa hidrokarbon jenuh
Senyawa hidrokarbon jenuh adalah senyawa hidrokarbon yang ikatan antar atom C dalam rantai karbon semuanya berupa ikatan tunggal
2. Senyawa hidrokarbon tidak jenuh
Senyawa hidrokarbon tidak jenuh adalah senyawa hidrokarbon yang ikatan antar atom C dalam rantai karbon semuanya berupa ikatan rangkap, baik rangkap dua, maupun rangkap tiga.
Suatu senyawa karbon bila terkena udara menjadi tidak stabil, terbukti jika suatu senyawa karbon terkena udara maka langsung terbakar dengan reaksi yang eksoterm,
C −
− =C C C
12 sehingga senyawa karbon secara kinetik stabil, tetapi belum tentu stabil secara energetik karena jika suatu senyawa karbon langsung bereaksi bila ada udara. Adapun senyawa karbon yang tidak langsung terbakar yaitu metana yang berasal dari gas bumi bila kontak dengan udara, tetapi harus dipanaskan terlebih dahulu, sehingga pada reaksi dibutuhkan energi aktivasi yang tinggi. Jadi suatu campuran itu tidak akan bereaksi sebelum diberi energi dengan memanaskannya terlebih dahulu.
Soal Latihan:
Pilihan Ganda
Petunjuk: Pilihlah salah satu jawaban yang paling tepat!
1. Kekhasan suatu atom karbon dapat diketahui dengan kemampuan suatu atom karbon untuk melakukan katenasi, apa yang disebut dengan katenasi . . . .
a. suatu kemampuan atom karbon dalam membentuk rantai karbon b. suatu peristiwa yang tidak menimbulkan isomer
c. suatu kemampuan atom karbon yang tidak dapat membentuk rantai karbon d. suatu kemampuan atom karbon terhibridisasi
e. suatu kemampuan atom karbon untuk terpolimerisasi
2. Di bawah ini yang merupakan kekhasan atom karbon, kecuali . . . . a. atom karbon terdiri dari empat pasang elektron
b. atom karbon mempunyai 4 elektron valensi c. terjadinya peristiwa katenasi pada atom karbon d. atom karbon dapat membentu ikatan kimia
e. suatu atom karbon tidak dapat membentul ikatan kimia
3. Senyawa hidrokarbon berdasarkan jenis ikatan sesama atom C dibedakan menjadi 2, yaitu… a. senyawa alifatik dan senyawa aromatik
b. senyawa jenuh dan senyawa tak jenuh c. senyawa jenuh dan senyawa alifatik d. senyawa jenuh dan senyawa aromatik e. senyawa tak jenuh dan senyawa alifatik
13 5. Suatu atom karbon untuk mencapai konfigurasi oktet atom karbon dapat membentuk
4 ikatan kovalen yang relatif kuat. senyawa atom C membentuk ikatan dengan hibridisasi sp3 dengan ikatan tunggal, tetapi tidak untuk senyawa . . . .
a. Ikatan rangkap d. Ikatan ganda
b. Ikatan tunggal e. Ikatan ganda tunggal
c. Ikatan ganda tiga
Essay
Kerjakan soal-soal berikut dengan benar!
1. Apakah yang dimaksud dengan katenasi? Bagaimana?
2. Ikatan kimia umum apakah yang terdapat pada senyawa-senyawa karbon?
3. Sebutkan beberapa senyawa karbon yang banyak digunakan dalam kehidupan sehari-hari?
4. Apakah sebabnya ikatan-ikatan kimia dalam senyawa karbon pada umumnya bersifat kovalen?
5. Unsur-unsur apakah yang terdapat dalam senyawa-senyawa karbon?
D.
Atom C Primer, Sekunder, Tertier Dan Kuartener
Kedudukan atom karbon dalam rantai karbon tergantung dari jumlah atom karbon lain, sehingga kedudukan atom karbon dapat dibedakan sebagai berikut:
1. Atom C primer: atom C yang terikat pada sebuah atom C yang lain. 2. Atom C sekunder: atom C yang terikat pada dua buah atom C yang lain. 3. Atom C tersier: atom C yang terikat pada tiga buah atom C lain.
4. Atom C kuartener: atom C yang terikat pada empat buah atom C yang lain.
14 Keterangan :
1° = atom C primer 3° = atom C tersier 2° = atom C sekunder 4° = atom C kuartener
Contoh latihan:
1. Tunjukkan atom C primer , sekunder, tersier , dan kuartener dari senyawa di bawah ini:
Penyelesaian:
a. Beri nomor atom C dalam senyawa tersebut :
b. Identifikasi atom C primer: 1,4,5,6 atom C sekunder : 3 atom C tersier: - atom C kuartener : 2
15
Penyelesaian:
a. Beri nomer atom C tersebut :
b. Identifikasi atom C primer : 1, 7, 8, 9, 11, 12, 13 atom C sekunder : 4, 6, 10
atom C tersier : 2 atom C kuartener : 3,5
Soal latihan!
Pilihan Ganda
Petunjuk: Pilihlah salah satu jawaban yang paling tepat! 1. Diketahui struktur berikut:
Atom C primer ditunjukkan pada atom C bernomor . . . .
a. 2, 4, 6 d. 3,7
b. 3, 5, 7 e. 2,4
c. 1, 8
2. Suatu senyawa alkana memiliki rumus struktur :
Atom C kuartener pada struktur alkana tersebut adalah atom C dengan nomor . . . .
a. 1 d. 4
b. 2 e. 7
16 3. Atom C tersier dalam senyawa berikut terdapat pada atom karbon nomor . . . .
a. 3, 5, 8 d. 3, 4, 5
b. 2, 4, 7 e. 4
c. 3, 6, 7
4. Atom C sekunder dalam senyawa berikut terdapat pada atom karbon nomor . . .
a. 1, 4, 7 d. 1, 3, 5
b. 2, 4, 7 e. 3, 4, 5
c. 3, 6, 7
5. Atom C primer dalam senyawa berikut terdapat pada atom karbon nomor . . . .
a. 1, 7 d. 2, 4, 7
b. 3, 6, 7 e. 1, 3, 5
c. 3, 6
Essay
Kerjakan soal-soal berikut dengan benar!
1. Apakah yang dimaksud dengan atom C primer, C sekunder, C tersier dan C kuartener? 2. Apakah yang dimaksud dengan:
17 c. senyawa siklik
d. senyawa karbonsiklik
3. Apakah yang dimaksud dengan: a. senyawa alisiklik
b. senyawa aromatik c. senyawa heterosiklik
4. Sebutkan tiga nama lain untuk golongan hidrokarbon jenuh? 5. Bagaimana kedudukan atom karbon dalam rantai C?
E.
Struktur Alkana, Alkena, dan Alkuna
1. Gugus Fungsi
Suatu ikatan karbon – karbon sp3 – sp3 dan ikatan karbon – hidrogen sp3 merupakan ikatan yang secara umum hampir ada pada semua senyawa organik, namun ikatan tersebut tidak berperan utama dalam suatu reaksi organik. Adanya ikatan pi atau atom lain dalam struktur organiklah yang menimbulkan suatu kereaktifan. Kedudukan kereaktifan kimia dalam molekul disebut sebagai gugus fungsi. Ikatan pi atau dalam suatu atom elektronegatif ( atau elektropositif) dalam molekul organik dapat menuju ke suatu reaksi kimia, sehingga dapat dianggap sebagai gugus fungsi atau bagian dari gugus fungsi.
Beberapa gugus fungsi (yang diwarnai )
Br CH2 CH = C H2 CH3CH2 NH2 CH3CH2OH
Senyawa dengan gugus fungsi yang sama cenderung mengalami reaksi kimia yang sama. Sebagai contoh, masing – masing senyawa dalam deret berikut ini mengandung gugus hidroksil (OH). Semua senyawa ini termasuk dalam golongan senyawa yang disebut alkohol, dan semua mengalami reaksi yang sama
Beberapa alkohol :
CH3CH2OH (CH3)3COH
18
Tabel 1.2 Beberapa gugus fungsi dan golongan senyawa
Gugus Fungsi Golongan Senyawa
Struktur Nama Rumus Umum Nama Golongan
C = C Ikatan rangkap R2C = CR2 alkena
C ≡ C Ikatan ganda tiga RC ≡ CRa alkuna
−NH2 Gugus amino RNH2 amina
−OH Gugus hidroksil ROH alkohol
−OR Gugus alkosil R’OR” eter
aR’ merujuk gugus alkil yang dapat sama atau berbeda dari R
Berdasarkan jenis ikatan yang dibahas sebelumnya menurut atom C dalam rantai karbon, suatu senyawa hidrokarbon dibedakan menjadi dua yaitu :
• Senyawa hidrokarbon jenuh • Senyawa hidrokarbon tak jenuh
Hidrokarbon jenuh terdiri atas alkana, sedangkan hidrokarbon tak jenuh terdiri atas alkena dan alkuna. Alkana disebut sebagai hidrokarbon jenuh karena atom – atom C nya telah mengikat empat atom lain yang berbeda, kemudian senyawa ini tak bereaksi dengan hidrogen, dalam kondisi reaksi yang tepat, senyawa ini bereaksi dengan hidrogen, menghasilkan produk yang jenuh.Senyawa yang mengandung ikatan-pi yang merupakan senyawa hidrokarbon dengan jumlah atom hidrogennya kurang dari pada alkana disebut tak jenuh terdiri atas alkena dan alkuna.
19 Hidrokarbon tak jenuh:
Dalam hal ini akan dibahas struktur alkana, alkena , dan alkuna yang merupakan bagian dari hidrokarbon jenuh dan hidrokarbon tidak jenuh, sebagai berikut :
2. Alkana
Apabila suatu hidrokarbon jenuh mengandung n buah atom karbon, maka berdasarkan suatu tetravalensi dari karbon, rumus umum dari senyawa hidrokarbon jenuh dapat ditentukan. Jumlah ikatan dari n atom karbon adalah 4n ikatan. Membutuhkan 2 ikatan untuk membentuk rantai karbon pada masing- masing atom karbon, kecuali pada 2 buah atom karbon yang berada paling ujung yaitu pada ujung kiri dan ujung kanan yang masing- masing hanya membutuhkan 1 ikatan, sehingga jumlah ikatan yang diperlukan untuk pembentukan suatu rantai karbon menjadi 2n-2. Jadi sisa ikatan yang harus diisi dengan atom- atom hidrogen adalah 4n – (2n-2), atau 2n + 2, sehingga rumus alkana dapat disimpulkan yaitu : CnH2n + 2.
Kebanyakan senyawa organik mempunyai bagian dari strukturnya , yang terdiri dari atom karbon dan hidrogen. Lemak merupakan suatu contoh senyawa organik yang memiliki gugus- gugus ester dan rantai hidrokarbon yang panjang. Rantai ini dapat berupa alkil atau alkenil (mengandung ikatan rangkap.
propana Propuna
+ 3H2 Katalis Ni
Kalor, tekanan
sikloheksana
20 a. Struktur Alkana rantai lurus
Struktur dan nama sepuluh alkana rantai lurus dicantumkan dalam tabel 1.3. senyawa dalam tabel 1.3 menunjukkan bahwa kenaikan panjang rantai dalam senyawa alkana selalu berselisih CH2. Kenaikan panjang rantai dengan selisih yang sama disebut deret homolog. Deret homolog alkana beserta namanya dapat dilihat dalam tabel berikut
Tabel 1.3 Sepuluh alkana rantai lurus pertama
Banyak karbon Struktur Nama
1 CH4 Metana
2 CH3CH3 Etana
3 CH3CH2CH3 Propana
4 CH3(CH2)2CH3 Butana
5 CH3(CH2)3CH3 Pentana
6 CH3(CH2)4CH3 Heksana
7 CH3(CH2)5CH3 heptana
8 CH3(CH2)6CH3 Oktana
9 CH3(CH2)7CH3 Nonana
10 CH3(CH2)8CH3 Dekana
b. Sikloalkana
Suatu sikloalkana diberi nama menurut banyaknya atom karbon dalam cincin, dengan penambahan awalan siklo-.. suatu sikloalkana merupakan hidrokarbon jenuh dengan rantai karbon lingkar, jadi merupakan senyawa alisiklik. Jika alkana mempunyai rumus umum CnH2n+2, maka rumus umum sikloalkana adalah CnH2n karena suatu sikloalkana dapat dianggap sebagai alkana yang kehilangan 2 atom hidrogen karena atom- atom karbon ujung dan pangkal harus saling terikat. Suku pertama deret homolog sikloalkana mempunyai nilai n = 3 yaitu C3H6 yang dinamakan siklopropana.
21 Untuk sikloalkana yang berantai cabang tempat rantai C terikat pada lingkaran dinyatakan dengan suatu nomor dan jika rantai simpangnya lebih dari satu maka urutannya harus sedemikian sehingga jumlah nomor-nomornya menjadi sekecil-kecilnya. Untuk lebih sederhana lagi rumus- rumus siklopropana, siklobutana, siklopenta a, siklo heksana, dan seterusnya biasa dinyatak sebagai segi tiga, segi empat, segi lima, dan segi enam dan seterusnya seperti contoh di atas dan di bawah ini.
c. Rantai samping
Bila suatu gugus alkil atau gugus fungsional diletakkan pada suatu rantai alkana, rantai lurus yang disebut sebagai akar atau induk. Gugus-gugus itu ditandai dalam nama senyawa oleh awalan dan akhiran pada nama induknya.
Suatu rantai samping atau cabang adalah suatu gugus alkil sebagai cabang dari suatu rantai induk. Suatu gugus alkil rantai-lurus dinamai menurut induk alkananya sendiri, dengan merubah akhiran –ana menjadi –il (CH4 ialah metana, maka gugus CH3 ialah gugus metil. CH3CH3 ialah etana, maka gugus CH3CH2 ialah gugus etil). Nama gugus alkil rantai lurus dicantumkan dalam tabel 1.4.
Tabel 1.4 Lima gugus alkil rantai lurus pertama
22 Prosedur umum dalam menamai alkana bercabang :
1. Carilah rantai lurus yang terpanjang (rantai induk, yang ditunjukkan lurus maupun tidak)
2. Nomori rantai induk, dimulai dari ujung yang paling dekat dengan percabangan 3. Kenali cabang dan antar posisinya
4. Letakkan nomor dan nama cabang pada nama induknya.
Contoh latihan : 1.
Penyelesaian :
Rantai lurus terpanjang terdiri dari 8 atom karbon. Jadi, nama induk oktena Penomoran :
Gugus alkil : etil pada karbon 4 Nama : 4- etiloktan
2. Mengapa senyawa di bawah ini tidak dinamai 1-metilheksana ? dan bagaimana nama yang benar ?
Penyelesaian :
a. Beri penomoran atom C terlebih dahulu
CH
3CH
2CHCH
2CH
2CH
2CH
3CH
2CH
2CH
3Dimulai dari ujung yang lebih dekat ke cabang
C
−
C
−
C
−
C
−
C
−
C
−
C
1 2 3
4 5 6 7 8
23 b. Identifikasi bahwa struktur di atas mengandung rantai lurus terdiri dari 7 atom karbon,
sehingga nama yang benar yaitu heptana.
3. Nama senyawa alkana berikut adalah
Penyelesaian :
a. Beri penomoran atom C terlebih dahulu
b. Identifikasi nama struktur metana yaitu : 4-etil-3-metilheptana
Soal latihan Pilihan Ganda
Petunjuk: Pilihlah salah satu jawaban yang paling tepat! 1. Spesies berikut yang termasuk deret alkana adalah . . . .
a. C2H2 d.CH2
b. C2H4 e. CH3
c. C2H6
2. Nama senyawa dengan rumus struktur sebagai berikut adalah . . . .
a. 2 - etil - 4, 5 – dimetil-heptana b. 2 – etil – 3, 5 – dimetil – heptana c. 2, 5 – dietil – 3 – metil – heksana d. 3, 4, 6 – trimetil – oktana
24 3. Alkana termasuk senyawa hidrokarbon . . . .
a. Alifatik jenuh d. Aromatik
b. Alifatik tidak jenuh e. Parafin siklik tidak jenuh c. Alisiklik tidak jenuh
4. Di antara senyawa berikut, yang bukan alkana rantai lurus adalah . . . .
a. C3H8 d. C20H42
b. C4H8 e. C5H12
c. C6H14
5. Senyawa dengan nama 2-metil-3-isopropiloktana memiliki rumus struktur …. a.
b.
c.
d.
25 Essay
Kerjakan soal-soal berikut dengan benar!
1. Tuliskan rumus struktur dari alkana berikut : a. 2, 2 – dimeil butana
b. 3 – etil – 2 – metil pentana c. 2, 2, 4 – trimetil pentana d. 4, 5 – dimetil oktana 2. Tuliskan rumus struktur dari :
a. 2 – metil propana b. 2, 3 – dimetilbutana
c. 2, 4 – dimetil – 4 – etilheptana d. 2 – bromo – 1 – kloropropana 3. Tuliskan rumus struktur dari :
a. 3 – kloro – 3 – metilpentana b. 2 – metil - - ( 1 – metiletil) pentana
c. 2, 2, 3 – trimetil – 3 – (1, 1-dimetiletil) heksana d. 4 – metil – 3, 3 – dietil – 5 – (1 – metilpropil) nonana 4. Tulis nama senyawa berikut ini :
5. Tuliskan struktur dari senyawa berikut a. 2,3-dimetil pentana
b. 3-etil-2,4,4-trimetil heptana
3. Alkena
26 etilena (CH2 = CH2). Sebuah ikatan rangkap karbon-karbon adalah sebuah gugus fungsional biasa dalam hasil alam. Suatu contoh menarik dari senyawa yang terdapat dalam alam yang mengandung ikatan rangkap karbon – karbon pada gambar dibawah ini. Kedua senyawa ini merupakan contoh dari feramon serangga, senyawa ini dikeluarkan oleh suatu serangga untuk meneruskan informasi ke serangga lainnya dari jenis yang sama.
Ikatan dalam alkena yang terikat pada karbon berikatan rangkap memiliki karbon sp2
Struktur alkena
Secara umum alkena dirumuskan sebagai berikut : CnH2n
Deret homolog alkena beserta namanya dapat dilihat dalam tabel 1.5
Tabel 1.5 Alkena rantai lurus
Struktur Nama
C2H4 Etena
CH 3CHCH2 Propena
27
Struktur Nama
CH3CH(CH2)3 Pentena
CH3CH(CH2)4 Heksena
CH3CH(CH2)5 Heptena
CH3CH(CH2)6 Oktena
CH3CH(CH2)7 Nonena
CH3CH(CH2)8 Dekena
Pemberian tatanama alkena berantai lurus diberi nama menurut alkana induknya, dengan mengubah akhiran –ana menjadi –ena, misalnya , CH3CH3 adalah etena dan CH2=CH2 adalah etena.
Sebuah hidrokarbon dengan dua ikatan rangkap disebut diena, sementara hidrokarbon dengan tiga ikatan rangkap : triena. Contoh diena dan triena yaitu sebagai berikut
CH3
CH2=CHCH=CH2 CH2=CCH=CH2 CH2=CHCH=CHCH=CH2
1,3 – butadiena 2-metil, 1,3-butadiena 1,3,5-heksatriena
Suatu diena Suatu diena Suatu triena
Suatu sikloalkena diberi nama menurut banyaknya atom karbon dalam cincin, dengan penambahan awalan siklo-.
sikloheksena
Beberapa alkena dan gugus alkenil mempunyai nama trivial yang telah lazim digunakan.
Beberapa contoh nama trivial dicantumkan pada tabel 1.6.
28 Molekul bukanlah suatu partikel yang teridam diri. Suatu molekul bergerak , bergasing, memutar dan membengkokkan diri. Atom dan gugus yang terikat hanya oleh ikatan sigma yang dapat berputar (rotasi) sedemikian rupa, sehingga bentuk keseluruhan sebuah molekul selalu berubah berkesinambungan, tetapi gugus-gugus yang terikat oleh ikatan rangkap tidak dapat berputar dengan ikatan rangkap sebagai sumbu, tanpa mematahkan ikatan-pi itu sendiri. Energi yang diperlukan untuk mematahkan ikatan pi karbon – karbon (sekitar 68 kkal/mol) tak tersedia untuk molekul pada temperatur kamar. Karena kekuatan ikatan-pi inilah gugus-gugus yang terikat pada karbon berikatan pi terletak tetap dalam relatif satu sama lain,.
Biasanya struktur alkena ditulis menyerupai atom-atom karbon sp2 dan atom-atom yang terikat pada atom-atom terletak pada bidang kertas. Seperti dicantumkan pada gambar
Gambar 1.5 Gugus yang terikat pada karbon sp2 berkedudukan tetap relatif satu
Dalam gambar tertera suatu struktur dengan dua atom Cl (satu pada setiap karbon sp2 pada satu sisidari ikatan pi dan dua atom H pada sisi yang lain. Karena ikatan rangkap maka suatu molekul tidak mudah saling mengubah dengan senyawa atom-atom Cl berada pada sisi ikatan pi yang berlawanan.
Tabel 1.6 Struktur Trivial Alkena
Struktur Nama Contoh
CH2= metilenaa
= CH2
CH2=CH- Vinil Vinil Klorida CH2=CHCI
CH2=CH CH2- Alil CH2==CHCH2Br
29 Contoh Latihan :
1. Nama senyawa dari alkena di bawah ini adalah : CH3− CH = CH − CH3
Penyelesaian :
a. beri penomoran pada atom C terlebih dahulu :
b. identifikasi nama struktur adalah : 2-butena
2. Nama senyawa dari struktur berikut adalah :
Penyelesaian :
a. Beri penomoran pada atom C terlebih dahulu :
b. Identifikasi bahwa suatu molekul mempunyai rantai berkarbon sebanyak tujuh, namun rantai terpanjang yang mengandung ikatan rangkap hanya berisi lima atom karbon. Jadi ,struktur ini dinamakan sebagai 2 propil 1 pentena.
30
Penyelesaian :
a. Beri penomoran pada atom C terlebih dahulu :
b. Menentukan gugus alkil
c. Identifikasi nama senyawa tersebut adalah 4,5 dimetil 4 propil 2 heptena
Soal latihan
Pilihan Ganda
Petunjuk: Pilihlah salah satu jawaban yang paling tepat!
1. Rumus struktur suatu senyawa sebagai berikut
Maka nama senyawa tersebut adalah . . . .
a. 2 – metil 3 – butena d. 2 – metil 1 – butena b. 3 – metil 1 – butena e. 3 – metil 2 – butena c. 2 – metil 3 – butena
2. Nama senyawa dengan rumus struktur berikut ini :
31 d. 3, 7, 7 – trimetil – 4 – nonena
e. 3, 7, 7, - trimetil – nonena
3. Nama yang tepat untuk senyawa alkena dibawah adalah . . .
a. 2, 3, 4 – metil – 1 – heksena b. 2, 3, 4 – trimetil – 1 – heksena c. 2, 3, 4 – trimetil – heksena
d. 2 – metil – 3, 4 – dimetil – 1 – heksena e. 2 – metil – 3 – metil – 4 – metil – 1 – heksena 4. Alkena termasuk senyawa hidrokarbon . . . .
a. Alifatik jenuh d. Aromatik
b. Alifatik tidak jenuh e. Parafin siklik tidak jenuh c. Alisiklik tidak jenuh
5. Kenaikan panjang rantai dalam senyawa alkana selalu berselisih CHR2R. Kenaikan panjang rantai dengan selisih yang sama disebut . . . .
a. monomer d. resonansi
b. polimer e. isomer
c. deret homolog
Essay
Kerjakan soal-soal berikut dengan benar! 1. Buatlah struktur dari nama senyawa berikut
a. 3,3-dimetil-1-butena
b. b. 2,3,4-trimetil-1-pentena 2. Tulisan rumus struktur dari :
a. 2, 3 – dimetil – 2 – pentena
32 3. Berilah nama dari struktur senyawa berikut
a. b.
4. Tuliskan rumus struktur berikut ini :
a. 3 – bromo – 2 – pentena
b. 2, 4, 4 – trimetil – 2 – 2 – pentena 5. Tulis nama senyawa berikut ini :
4. Alkuna
Alkuna merupakan hidrokarbon tak jenuh yang mengandung ikatan rangkap tiga dalam rantai karbonnya, sehingga suatu alkuna mempunyai rumus umum adalah : CRnRHR2n -2R. Kedua atom karbon yang ikat mengikat dengan ikatan rangkap tiga masing-masing mempunyai orbital hibrid sp dan ikatan antara kedua atom karbon tersebut terdiri dari sebuah ikatan sigma dan 2 buah ikatan pi. Akhiran untuk suatu alkuna adalah –una dan sebuah nomor posisi digunakan untuk menandai ikatan ganda tiga dalam rantai hidrokarbon induk. Kecuali jika terdapat gugus fungsional yang lebih berprioritas.
a. Ikatan alkuna
Sebuah karbon ganda tiga ada dalam keadaan hibridisasi sp. Suatu orbital sp bersifat setengah s, sedangkan orbital sp2
PP sepertiga s dan orbital sp3PP hanya seperempat s.karena orbital sp lebih memiliki karakter s, maka elektron-elektron dalam orbital ini lebih dekat ke inti karbon daripada elektron-elektron dalam orbital sp2
PP atau sp3
33 Salah satu contoh senyawa alkuna yang terkenal adalah etuna atau asetilena, atau dikenal juga sebagai gas karbit. Asetilena ditemukan oleh Edmund T DavyTpada 183T 6.T Nama asetilena diberikan oleh kimiawaT nTPeranciT s T TMarcellin Berthelot,T pada T1860.T Pada 181T 2,T sebuah ledakan asetilena membutakan fisikawaT n T GT ustaf Dalén,T yang kemudian pada tahun yang sama memperoleh hadiah NobeT l T di bidang fisikT a.T Gas asetilena memiliki banyak kegunaan, di antaranya untuk bahan bakar las karbid. Pengelasan dilakukan dengan jalan membakar bahan bakar gas asetilen dengan oksigen sehingga menimbulkan nyala api dengan suhu yang dapat mencair logam induk dan logam pengisi. Ketika asetilena dibakar dengan oksigen maka dapat mencapai suhu 3000º C. Suhu tinggi tersebut mampu digunakan untuk melelehkan logam dan menyatukan pecahan-pecahan logam. Karena gas asetilen paling banyak digunakan sebagai bahan bakar sehingga las pada umumnya diartikan sebagai las oksiasetilen.
Gas Asetilen diproduksi melalui reaksi antara Kalsium Karbit (CaCR2R) dengan air (HR2R0). CaCR2R + 2HR2RO → Ca(OH)R2R + CR2RHR2
Sumber: http:// search.google.com
Gambar 1.6 Pengelasan menggunakan karbit
Sumber: http://search.google.com
34 Bahaya-bahaya yang dapat ditimbulkan oleh gas asetilen antara lain sebagai berikut.
1. Polimerisasi
Peristiwa ini akan menyebabkan suhu gas meningkat jauh lebih tinggi dalarn waktu yang sangat singkai. Polimerisasi akan terjadi pada suhu 300°C, jika berada pada tekanan i atm. Oleh sebab itu, gas asetilen tidak boleh disimpan atau digunakan pada suhu di atas 300°C.
2. Disosiasi
Yaitu adanya panas yang ditimbulkan oleh proses pembentukan zat-zat. disosiasi teijadi.Pada suhu 600°c, jika berada pada tekanan i atm atau 530°C jika tekanan 3 atm. Jika teijadi disosiasi maka tekanan gas akan meningkat dan bisa menimbulkan ledakan.
Terjadinya polimerisasi dan disosiasi akan mengakibatkan naiknya suhu dan tekanan gas menjadi jauh akan lebih tinggi dari keadaan semula, sehingga gas asetilen merupakan gasyang sangat mudah meledak ataupun cepat terbakar akibat tekanan dan suhu. Untuk menghindari hal-hal di alas gas asetilen dalam tabung gas dilarutkan dalam aceton juga diisi dengan bahan-bahan berpori misalnya keramik, yang dapat rnenempatkan dan melarutkan gas asetilen secara baik.
b. Struktur alkuna
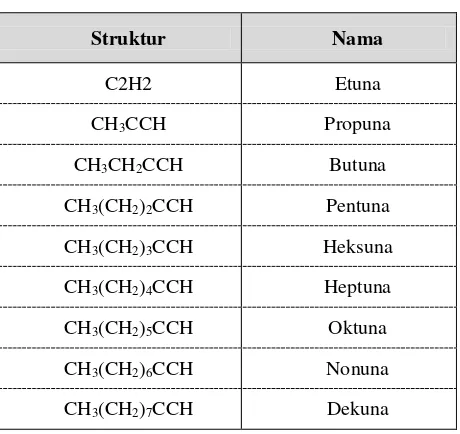
Deret homolog alkuna beserta namanya dapat dilihat dalam tabel 1.7
Tabel 1.7 Alkuna rantai lurus
35 Berikut ini terdapat rumus struktur dan nama beberapa alkuna :
CH ≡ CH CH3 –C ≡ C – CH (CH2)2 CH ≡ C – CH3
Etuna (asetilena) Metilisopropilasetilena Propuba (metilasetilena)
CH3 –C ≡ C- CH (CH3)2 CH ≡ C – CH2 – CH3
2-Butana (Dimetilasetilena) Butana (Etilasetilena)
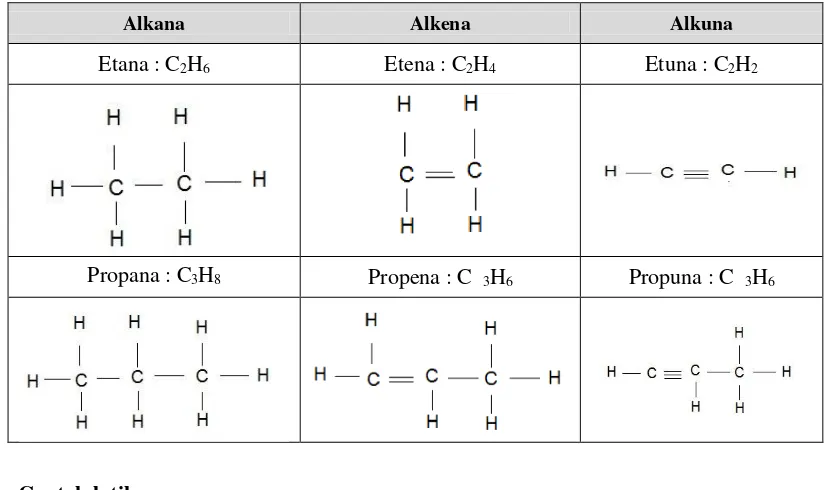
Setelah dijelaskan tentang struktur alkana, alkena, dan alkuna yang memiliki rumus struktur berbeda, sehingga disajikan perbandingan antara alkana, alkena, dan alkuna yang dicantumkan pada tabel 1,8 berikut :
Tabel 1.8 Perbedaan dari Alkana, Alkena,dan Alkuna
Alkana Alkena Alkuna
Etana : C2H6 Etena : C2H4 Etuna : C2H2
Propana : C3H8 Propena : C 3H6 Propuna : C 3H6
Contoh latihan
Kerjakan soal-soal berikut dengan benar!
1. Nama dari struktur alkuna berikut adalah
Penyelesaian :
a. Beri penomoran pada atom C terlebih dahulu :
36 2. Beri nama senyawa di bawah ini :
Penyelesaian :
a. Beri penomoran pada atom C terlebih dahulu :
b. Menentukan gugus alkil
c. Identifikasi nama senyawa tersebut adalah 4 etil 5 metil 2 heptuna
3. Beri nama senyawa di bawah ini :
Penyelesaian :
a. Beri penomoran pada atom C terlebih dahulu :
b. Menentukan gugus alkil
37 Soal Latihan
Pilihan Ganda
Petunjuk: Pilihlah salah satu jawaban yang paling tepat! 1. Nama senyawa dari rumus struktur berikut adalah ….
a. 4-propil-2-pentuna d. 4-propil-2-pentuna b. 4-metil-2-heptuna e. 4-metil-4-propil-2-butuna c. 4-metil-2-pentuna
2. Gas etuna sebanyak 10 liter dibakar sempurna dengan udara, bila udara mengandung 20% oksigen maka volum udara yang diperlukan sebanyak . . .
a. 10 liter d. 100 liter
b. 25 liter e. 125 liter
c. 50 liter
3. Senyawa dengan nama 3, 3 -dimetil-1- heksuna memiliki rumus struktur …. a.
b.
38 d.
e.
4. Alkena termasuk senyawa hidrokarbon . . . .
a. alifatik jenuh d. aromatik
b. alifatik tidak jenuh e. parafin siklik tidak jenuh c. alisiklik tidak jenuh
5. Berikut ini yang merupakan rumus umum alkuna adalah . . . a. CRnRHR2n + 4 d. CRnRHRn
b. CRnRHR2n e. CRnRHR2n + 4
c. CRnRHR2n -2
Essay
Kerjakan soal-soal berikut dengan benar! 1. Tulis nama senyawa berikut ini:
a.
39 2. Tulis nama senyawa berikut ini :
a. b.
3. Tuliskan rumus struktur berikut ini : a. 1, 2 – dimetilbutana
b. 2 – butuna
4. Bagaimana rumus umum pada alkuna? 5. Tuliskan rumus struktur berikut ini :
a. 3, 3 – dimetil – 1 – pentuna b. 4 – etil – 4 – metil – 2 - heksuna
F.
Iso
m
er
Isomer adalah senyawa-senyawa yang mempunyai rumus molekul sama, tetapi mempunyai rumus bangun atau struktur yang berbeda. Isomer berasal dari Bahasa Yunani yang diadaptasi dari kata isomerès, dimana isos berarti sama dan mèros berarti bagian. Peristiwa ini lazim terdapat pada kimia karbon tetapi jarang ditemukan dalam kimia anorganik. Isomer mempunyai jumlah atom yang sama untuk masing-masing unsur, tetapi mempunyai perbedaan susunan penempatan atomatomnya. Isomer belum tentu mempunyai sifat-sifat yang sama kecuali mempunyai gugus fungsi yang sama sehinga isomer penting untuk dipelajari. Senyawa dengan rumus molekul sama antara senyawa satu dengan senyawa lainnya dapat memiliki sifat yang sangat berbeda yang menyebabkan penanganan terhadap senyawa tersebut juga berbeda-beda. Oleh karena itu, untuk menghindari kesalahpahaman, suatu senyawa karbon selalu dinyatakan dalam rumus bangunnya.
Dalam senyawa karbon, pada tiga deret pertama alkana tidak terdapat isomer. Isomer baru ditemukan pada senyawa butana (C4H10), yaitu:
40 pada senyawa pentana (C5H12) memiliki 3 buah isomer, yaitu:
Pada senyawa heksana (C6H14) memiliki 5 buah isomer, yaitu:
3-metilpentana (IUPAC)
2,2-dimetilbutana(IUPAC) neoheksana (trivial)
2,3-dimetilbutana
41 Soal Latihan
Kerjakan soal-soal berikut dengan benar!
1. Senyawa C7H16 memiliki 9 isomer. Tuliskan rumus struktur isomer-isomernya dan tata nama masing-masing isomer?
2. Senyawa C8H18 memiliki 18 isomer. Tuliskan rumus struktur isomer-isomernya dan tata nama masing-masing isomer?
3. Mengapa pada 3 deret pertama senyawa alkana tidak terdapat isomer? 4. Apakah sifat fisik suatu senyawa sama seperti sifat isomernya, mengapa?
Tipe Isomer
Ada dua tipe isomer yaitu isomer struktur (geometri) dan isomer ruang (stereo). Isomer struktur adalah keisomeran yang disebabkan karena perbedaan struktur atau ikatan antara atomatom unsur. Isomer struktur terbagi atas isomer rantai (kerangka), isomer posisi (tempat), isomer gugus fungsi (fungsional), matemeri, dan tautomer. Isomer ruang adalah keisomeran yang disebabkan perbedaan konfigurasi atau susunan atom dalam ruang. Isomer ruang terbagi atas isomer geometri dan isomer optik.
Gambar 1.8 Bagan kesiomeran
1. Keisomeran Struktur a. Isomer Rantai
Senyawa-senyawa yang merupakan isomer rantai memiliki rumus molekul dan gugus fungsi yang sama, tetapi memiliki rantai induk yang berbeda.
Contoh:
42 Isomer rantai pada pentanol dan 2-metil-1-butanol
b. Isomer Posisi
Senyawa-senyawa yang merupakan isomer posisi memiliki rumus molekul, gugus fungsi, dan kerangka yang sama tetapi berbeda letak (posisi) gugus fungsinya.
Contoh:
Keisomeran pada 1-propanol dan 2-propanol (keduanya memiliki rumus molekul, gugus fungsi, dan kerangka yang sama)
c. Isomer Gugus Fungsi
Keisomeran gugus fungsi terjadi antara senyawa dengan rumus molekul sama tetapi berbeda gugus fungsinya. Isomer gugus fungsi terjadi pada senyawa:
1) Alkanol (alkohol) dengan alkoksialkana (eter) 2) Alkanal (aldehid) dengan alkanon (keton)
3) Asam alkanoat (asam karboksilat) dengan alkil alkanoat (ester) 4) Alkena dengan sikloalkana
43 Isomer yang terjadi jika dua gugus alkil atau lebih tidak sama terikat pada suatu gugus fungsional yang sama, misalnya pada 1-butena, 2-butena, dan 2-metilpropena.
e. Tautomer
Isomer antara senyawa-senyawa yang susunan atomnya berbeda tetapi zat-zat tersebut berada dalam keadaan kesetimbangan, misalnya kesetimbangan antara
vinilalkohol dan etanal yang umumnya disebut disebut kesetimbangan keto-etanal.
2. Keisomeran Ruang a. Isomer Geometri
Keisomeran geometri terdapat pada senyawa yang molekulnya mempunyai bagian yang kaku, seperti ikatan rangkap. Atom karbon yang berikatan rangkap tidak dapat diputar satu terhadap lainnya. Keisomeran geometri mempunyai dua bentuk yang ditandai dengan cis dan trans.
Cis : Gugus sejenis berada pada sisi yang sama. Trans : Gugus sejenis terletak berseberangan. Contoh:
Keisomeran antara cis-2-butena dan trans-2-butena
Keisomeran geometri pada alkena terjadi jika kedua atom karbon yang berikatan rangkap masingmasing mengikat dua gugus yang berbeda.
44 gugus fungsi sama sehingga tidak
mempunyai isomer geometri
b. Isomer Optik
Dari ilmu fisika telah kita ketahui apa yang dimaksud dengan cahaya terpolarisasi, yaitu cahaya yang hanya bergetar pada satu bidang. Bidang getar tersebut dinamakan bidang polarisasi.
Cahaya biasa dipolarisasikan dengan menggunakan polarisator.
Berbagai jenis senyawa karbon menunjukkan suatu kegiatan optis yaitu dapat memutarkan bidang polarisasi. Sebagian memutarkannya searah jarum jam (ke kanan) dan sebagian yang lain memutarkannya berlawanan dengan arah jarum jam (ke kiri). Arah putaran ke kanan pada umumnya dinyatakan dengan tanda (+) atau d (baca: dekstro) sedangkan arah putaran ke kiri dinyatakan dengan tanda (-) atau l (baca: levo). Senyawa-senyawa yang dapat memutar bidang polarisasi disebut Senyawa-senyawa yang bersifat optis aktif.
Keisomeran optis berkaitan dengan sifat optis suatu senyawa. Contoh senyawa yang menunjukkan kegiatan optis adalah 2-butanol. Senyawa 2-butanol dikenal memiliki 2 jenis yaitu senyawa 2-butanol yang memutarkan bidang polarisasi 13,52° ke kanan dan senyawa butanol yang memutarkan bidang polarisasi 13,52° ke kiri. Jadi senyawa 2-butanol mempunyai 2 isomer optik yaitu d-2-butanol dan l-2-butanol.
Menurut Label dan van’t Hoff keisomeran optik dapat terjadi karena adanya atom
C asimetris dalam molekul, yaitu atom karbon yang mengikat 4 gugus senyawa yang berbeda. Dalam kasusu senyawa 2-butanol, atom C nomor 2 merupakan atom C asimetris karena mengikat 4 gugus yang berbeda, yaitu C2H5, H, OH, dan CH3. Semakin banyak jumlah atom C asimetris dalam molekul, semakin banyak pula kemungkinan konfigurasi molekulnya dan semakin banyak isomer optiknya. Senyawa yang mempunyai n atom asimetris dapat mempunyai sebanyak-banyaknya 2n isomer optik.
45 Soal Latihan
Kerjakan soal-soal berikut dengan benar!
1. Tentukan dan gambarkan isomer geometri dari senyawa 2-pentena dan 2-kloro-2-butena!
2. Tentukan dan gambarkan isomer rantai dari senyawa C6H14O! 3. Tentukan dan gambarkan isomer posisi dari senyawa C5H11Cl!
4. Tentukan dan gambarkan isomer fungsi dari senyawa propanol, butanal, dan asam butanoat!
5. Tentukan isomer yang mungkin dari senyawa C5H8!
Soal Latihan Pilihan Ganda
Petunjuk: Pilihlah salah satu jawaban yang paling tepat! 1. Senyawa 2-metil-1-pentanol berisomer dengan...
a. metil propil eter d. etil propil eter
Pasangan senyawa yang berisomer fungsi ialah...
a. I dan II d. III dan V
b. I dan III e. IV dan V
c. II dan IV
3. Jumlah isomer struktur senyawa dengan rumus molekul C3H8O adalah...
a. 1 d. 4
b. 2 e. 5
c. 3
4. Senyawa karbon yang mmperlihatkan gejala optis mempunyai...
a. ikatan rangkap d. semua ikatan tunggal
46 5. Pernyataan berikut tentang isomer yang paling tepat adalah ….
a. isomer memiliki rumus struktur sama b. isomer mengandung kumpulan gugus sama c. isomer adalah hidrokarbon
d. isomer menghasilkan zat yang sama jika terbakar sempurna dalam oksigen e. isomer memiliki titik didih yang sama
6. Salah satu dari senyawa berikut yang tidak berisomer dengan 2,3-dimetil butana
adalah …
a. n-heksana d. 2-metil pentana
b. 2,2-dimetil butana e. 2-etil pentana c. 3-metil pentana
7. Jumlah isomer C7H16 adalah …
a. 10 d. 7
b. 9 e. 6
c. 8
8. Senyawa berikut yang tidak memiliki isomer geometri adalah
a. 2-pentena d. 2-metil-2-butena
b. 2-butena e. 2-kloro-2-butena
c. 2,3-dikloro-2-butena
9. Apa yang dimaksud dengan atom C asimetris?
a. atom C yang mengikat 2 gugus senyawa yang berbeda b. atom C yang mengikat 3 gugus senyawa yang berbeda c. atom C yang mengikat 4 gugus senyawa yang berbeda d. atom C yang mengikat senyawa OH- dan CH3
e. atom C yang berdiri sendiri
10. Di bawah ini yang tidak termasuk isomer struktur adalah..
a. isomer geometri d. isomer fungsional
b. isomer posisi e. tautomer
c. matemeri
11. Siklobutana merupakan isomer dari ….
a. C4H10 d. CH2=CHCH=CH2
b. C6H6 e. CH3CH=CHCH3
47 12. Senyawa karbon berikut yang tidak membentuk isomer cis- dan trans- adalah ….
a. CH3CH=CH(C2H5) b. CH3(Cl)C=CH(C2H5) c. H2C=CH(C2H5)
d. (CH3)(C2H5)C=CH(CH2OH) e. CH3CH=CHCH3
13. Senyawa yang bukan merupakan isomer posisi dari 2-dekuna adalah… a. 4-metil-2-nonuna
b. 2,2-dimetil-4-oktuna c. 5-dekuna
d. 2,3,4-trimetil-6-dokuna e. 2-etil-3-metil-5-heptuna
14. Senyawa yang bukan isomer dari oktana adalah …. a. 2-metilheptana
b. 2,3-dimetilheksana c. 2,3,4-trimetilpentana d. 2,2-dimetilpentana e. 2,2,3,3,-tetrametilbutana
15. Isoheptana memiliki rumus struktur ….
a. C7H14 d. (CH3)3C(CH2)2CH3
b. CH3(CH2)5CH3 e. (CH3)2CH(CH2)3CH3
c. C6H5CH3
16. Senyawa berikut yang memiliki lebih dari satu isomer adalah ….
a. C2F6 d.C2H5F
b. C3H6 e. C6H14
c. C2H4F2
17. Keisomeran alkuna mulai terjadi pada ….
a. etuna d. heksuna
b. propuna e. heptuna
c. butuna
18. Suku alkana yang memiliki tiga buah isomer adalah…
a. heptana d. butana
b. heksana e. propana
48 19. Senyawa berikut yang berisomer dengan 2,3-dimetilbutana adalah ….
a. 3-etilpentana d. 3-metilheksana
b. 2,2-dimetilpropana e. 2,4-dimetilpentana c. 2-metilpentana
Senyawa yang merupakan isomer dari heptana adalah ….
a. 1, 2, dan 3 d. 1, 2, 3, dan 4
b. 1, 3, dan 4 e. 1, 2, 3, dan 5
c. 1, 3, dan 5
21. Di antara senyawa hidrokarbon berikut yang mempunyai isomer geometri adalah ….
a. alkana d. alkadiena
b. alkena e. alkadiuna
c. alkuna
22. Senyawa yang memiliki rumus molekul sama tetapi struktur molekul berbeda disebut ….
a. monomer d. polimer
b. isomer e. deret homolog
c. tautomer
23. Jumlah isomer dari senyawa C5H10 adalah…
a. 1 d. 4
b. 2 e. 5
c. 3
24. 3-etilpentana berisomer dengan ….
a. 3-metilheptana d. 2,2,3-trimetilpentana
b. n-heksana e. tetrametilmetana
c. isoheptana
25. Jumlah isomer heksana adalah ….
a. 3 d. 6
b. 4 e. 7
49
2. berikanlah masing-masing contoh untuk keisomeran: a. posisi
b. rangka c. fungsional d. geometris e. optis
3. tentukan jenis keisomeran yang terjadi diantara senyawa berikut a. 2-pentanol dan 3-pentanol
b. CH3 CH2 COOH dengan H COOC2H5 c. 1-butanol dengan 2-metil-1-propanol d. Etil metil eter dengan 2propanol
G.
Sifat-Sifat Fisik Alkana, Alkena, Dan Alkuna
1. Sifat Fisik Alkana
Alkana adalah suatu senyawa organik yang semua atom karbonnya berikatan tunggal (tidak memiliki ikatan rangkap) sehingga alkana merupakan senyawa hidrokarbon yang bersifat jenuh. Alkana hanya terdiri dari atom karbon dan hidrogen dengan rumus empiris CnH2n+2. Pada sub-bab ini, akan dibahas sifat-sifat fisik alkana pada umumnya.
a. Wujud alkana
1) Semua alkana memiliki bau yang khas dan tidak berwarna.
2) Alkana rantai pendek (C1-C4) berwujud gas, alkana rantai sedang (C5-C17) berupa cairan, dan alkana rantai panjang berbentuk padatan.
3) Bila rantai C semakin panjang viskositas (kekentalan) semakin tinggi.
b. Massa jenis alkana
50 Dengan kata lain, massa jenis alkana paling besar adalah 0,76 g/mL, sehingga semua alkana lebih ringan dari air.
c. Kelarutan alkana
Merupakan senyawa nonpolar, sehingga tidak larut dalam air. Alkana mudah larut dalam pelarut organik. Pelarut yang baik untuk hidrokarbon adalah pelarut nonpolar, seperti CCl4 atau sedikit polar (dietil eter atau benzena).
d. Titik didih dan titik leleh alkana
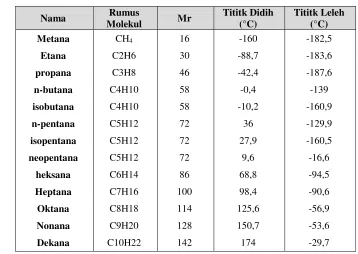
Tabel 1.9 Data titik didih dan titik leleh beberapa senyawa alkana pada kondisi atmosferik
Nama Rumus
Secara umum titik didih dan titik lebur alkana mempunyai pola sebagai berikut: 1) Semakin banyak atom karbon atau semakin panjang rantai karbon suatu alkana,
semakin tinggi titik didih. Hal ini disebabkan karena meningkatnya gaya van der Waals seiring dengan kenaikan berat molekul
2) Cabang alkana menyebabkan penurunan luas permukaan yang mengakibatkan menurunnnya gaya van der Waals sehingga semakin bercabang rantai suatu alkana, titik didihnya semakin kecil. Itulah mengapa titik didih n-pentana > isopentana > neopentana.
51 leleh kemungkinan karena alkana dengan atom ganjil memiliki atom karbon di sisi berlawanan. Jadi alkana dengan rantai genap dapat dikemas erat dalam kisi kristal membuat gaya tarik antar molekul lebih besar.
2. Sifat Fisik Alkena
Alkena adalah suatu senyawa organik yang salah satu atom karbonnya berikatan rangkap dua sehingga alkena merupakan senyawa hidrokarbon yang bersifat tak jenuh. Alkena terdiri dari atom karbon dan hidrogen dengan rumus empiris CnH2n.
a. Wujud alkena
1) Alkena rantai pendek (C2-C4) berwujud gas, alkena rantai sedang (C5-C17) berupa cairan, dan alkena rantai panjang (C18 dst) berbentuk padatan.
2) Bila rantai C semakin panjang viskositas (kekentalan) semakin tinggi. b. Massa jenis alkana
Jika cairan alkena dicampur dengan air maka kedua cairan itu akan membentuk lapisan yang saling tidak bercampur. Karena kepekatan cairan alkena lebih kecil dari 1 maka cairan alkena berada di atas cairan air.
c. Kelarutan alkena
Alkena bersifat non-polar sehingga sukar larut dalam pelarut polar seperti air, tetapi mudah larut dalam pelarut organik non-polar seperti etanol.
d. Titik didih dan titik leleh alkena
Tabel 1.10 Data titik didih dan titik leleh beberapa senyawa alkena pada kondisi atmosferik