PENGARUH PROPOLIS
Trigona
spp ASAL
PANDEGLANG TERHADAP BEBERAPA ISOLAT
BAKTERI USUS SAPI DAN PENELUSURAN
KOMPONEN AKTIFNYA
GERARDUS DIRI TUKAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Pengaruh Propolis Trigona spp Asal Pandeglang Terhadap Beberapa Isolat Bakteri Usus Sapi dan Penelusuran Komponen Aktifnya adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2008
ABSTRACT
GERARDUS DIRI TUKAN. Effect of Trigona spp Propolis of Pandeglang on Some Cattle Intestine Bacterial Isolates and Analysis of its Active Components. Under Direction of I MADE ARTIKA, KUSWANDI and A. E. ZAINAL HASAN
Propolis has been shown to have antimicrobial activity.This research dealts with analysis of effect of Trigona spp propolis on some bacterial isolated from cattle intestine and analysis of propolis active components. In the first step, propolis was extracted from bee hives by maceration technique using ethanol 70 percent. In the second step, propolis was subjected to antibacterial activity tests against pathogenic and nonpathogenic bacteria isolated from cattle intestine using agar diffusion method. The third step was phytochemycal analysis to test the presence of terpenoid, alkaloid, and flavonoid using Harborne method. The fourth step was analysis of active compounds of propolis through fractination using the Thin Layer Chromatography (TLC) and column chromatography methods. The fifth step, examination of antibacterial activity from factions to E. coli bacteria. And the last step was determination of active agents from the fraction of propolis which had higher antibacterial activity, by GC-MS technique. The results showed that yield of propolis was 17.23%. Antibacterial activity tests showed that propolis inhibited growth of pathogenic bacteria was 64.102 %, and non pathogen bacteria was 35.89%. The results of phytochemical analysis showed that propolis contained tanin, flavonoid and steroid. Determination of active agents showed the presence of eight fractions. Test on antibacterial activity of fractions to E. coli bacteria, showed that fraction C has the highest antibacterial activity. GC-MS analysis showed that fraction C contained 24 compounds. The biggest compound from fraction C was similar to 9,19-cyclolanost-24-en-3-ol, ( 3.beta). This compound had retention time of 40.25 minute and wide area of 49.91%. This compound can inhibit the growth of bacteria.
RINGKASAN
GERARDUS DIRI TUKAN. Pengaruh Propolis Trigona spp Asal Pandeglang Terhadap Beberapa Isolat Bakteri Usus Sapi dan Penelusuran Komponen Aktifnya. Dibimbing oleh I MADE ARTIKA, KUSWANDI dan A. E. ZAINAL HASAN
Propolis merupakan resin yang dihasilkan oleh lebah madu, setelah lebah mengkonsumsi resin kuncup bunga dari flora-flora di sekitar lingkungan hidupnya. Propolis yang dihasilkan oleh lebah ini merupakan salah satu komponen pembangun struktur sarang lebah madu dan menjadi sistem pertahanan lebah dari serangan bakteri.
Dewasa ini banyak penemuan yang mengungkapkan sifat propolis, yakni sebagai bahan antibakteri, antivirus, antifungi dan pengobatan untuk berbagai jenis penyakit yang lain. Berdasarkan sifatnya sebagai bahan antimikroba alamiah, maka propolis sarang lebah madu tidak hanya digunakan sebagai bahan baku obat-obatan, melainkan juga dapat digunakan sebagai bahan penyeimbang populasi mikroflora saluran pencernaan, yang dapat memacu pertumbuhan ternak.
Studi terhadap propolis lebah madu telah berkembang ke pengungkapan fraksi-fraksi senyawa yang terkandung di dalam sampel propolis, dari berbagai daerah asal. Propolis di Iran diketahui mengandung pinokembrin, asam kafeat, kaemferol, phenethyl caffeate, chrysin, dan galangin. Total kandungan flavonoid adalah 7,3% dan fenolik 36% dan keduanya menghambat aktivitas mikroba secara kuat. Propolis merah asal Brazil mengandung fenol sederhana, triterpenoid, isoflavonoid, prenilated benzophenon dan naptoquinon epoksida Tiga di antara komponen itu diketahui menghambat aktivitas bakteri dan bersifat antijamur. Dua komponen yang lain mampu menarik radikal bebas dalam uji antioksidan DPPH. Propolis asal Kroasia mengandung asam kafeat, gulagin dan pinocembrin yang mampu menghambat radikal bebas 1,1-diphenyl-2-picrylhhydrazyl (DPPH) dan ABST. Berbagai studi yang telah dilakukan terhadap propolis, terungkap bahwa propolis sarang lebah madu sebagai bahan antimikroba dan jenis komponen senyawa aktif yang terkandung, berkaitan erat dengan lingkungan flora sekitarnya.
Penelitian ini bertujuan untuk menguji daya antibakteri dan mengetahui Konsentrasi Hambat Tumbuh Minimum (KHTM) dari propolis Trigona spp asal Pandeglang terhadap beberapa isolat bakteri patogen dan nonpatogen usus sapi, serta penelusuran komponen-komponen aktifnya. Penelitian ini dilakukan melewati empat tahapan utama yaitu ekstraksi propolis dari sampel sarang lebah jenis Trigona spp asal Pandeglang yang dilakukan dengan metode Hasan (2006), uji aktivitas antibakteri dilakukan dengan metode difusi agar, analisa fitokimia dengan metode Harborn (1996), dan fraksinasi komponen aktifnya dilakukan dengan metode kromatografi kolom.
tingkat konsentrasi. Konsentrasi terendah adalah 0,26% dan tertinggi adalah 16,67%.
Hasil uji aktivitas antibakteri dan penentuan KHTM terhadap beberapa jenis bakteri usus sapi, diperoleh data konsentrasi minimum dari propolis ini yang mampu menghambat pertumbuhan bakteri untuk tia-tiap bakteri uji adalah sebagai berikut; E. coli 0,26%, Salmonella sp 0,52%, Klebsiella sp 8,33%, Campylobacter sp 1,04%, Bacteroides sp 2,08%, Lactoacillus casei 4,17% dan Bifidobacterium 8,33%. Konsentrasi propolis tertinggi (16,67%) merupakan konsentrasi berspektrum luas terhadap semua bakteri uji, dengan hambatan tertinggi terhadap bakteri Campylobacter sp. Untuk penyeimbangan populasi mikroflora usus sapi, maka konsentrasi optimum propolis yang diperoleh dalam penelitian ini adalah 1,04%.
Hasil analisis fitokimia terhadap ekstrak propolis Trigona spp asal Pandeglang menunjukan adanya kandungan tanin, flavonoid dan steroid. Kandungan senyawa-senyawa bioaktif ini membuktikan bahwa ekstrak propolis jenis tersebut memiliki aktivitas antibakteri.
Hasil fraksinasi terhadap ekastrak propolis, diperoleh delapan kelompok fraksi berbentuk pasta yang lengket. Dua di antara kelompok fraksi itu berwarna kuning muda dan keruh, sedangkan kelompok fraksi lain berwarna putih keruh. Uji aktivitas antibakteri fraksi-fraksi terhadap pertumbuhan bakteri E. coli, menunjukan bahwa semua kelompok fraksi memiliki aktivitas antibakteri, dan kelompok fraksi C memiliki aktivitas antibakteri terbesar.
Hasil penelusuran komponen-komponen aktif di dalam kelompok fraksi C melalui teknik GC-MS, diketahui mengandung 24 komponen senyawa yang memiliki kemiripan struktur dengan senyawa-senyawa pada bank data. Jenis senyawa lain yang memiliki kelimpahan tertinggi di dalam fraksi C propolis Trigona spp. adalah yang memiliki kemiripan dengan struktur senyawa 9,19-cyclolanost-24-en-3-ol, (3.beta.)-(CAS), atau Cycloartenol. Komponen senyawa ini muncul melalui peak ke 20, dengan waktu retensi 40,25 menit, dan persen area sebesar 49,91%. Peluang kemiripan struktur senyawa ini dengan senyawa yang ada di dalam fraksi C propolis Trigona spp adalah sebesar 99%. Senyawa
9,19-cyclolanost-24-en-3-ol, (3.beta.)-(CAS), atau cycloartenol merupakan prekursor pembentukan steroid dalam jaringan tumbuhan, dan bersama lanosterol, terbentuk dari pengubahan asam asetat melalui asam mevalonat dan squalen (suatu terpenoid), dalam rangkaian biosintesis steroid. Strukturnya menyerupai triterpenoid lanosterol. Pada pemanfaatannya dalam kehidupan, sikloartenol merupakan salah satu komponen pembuatan K-liquid chlorophyll, yakni suatu sediaan minuman kesehatan, yang berkhasiat untuk membantu detoksifikasi dan mengurangi racun di dalam tubuh, menyeimbangkan sistem hormoral serta keseimbangan asam-basa di dalam tubuh, meningkatkan pemasukan nutrisi dalam darah untuk menaikkan oksigen dalam darah, membantu regenerasi sel darah merah, menghambat proses oksidasi, dan menstimulasi regenerasi sel, serta menjadi bahan penghambat pertumbuhan bakteri. Kandungan senyawa sikloartenol di dalam sampel propolis Trigona spp asal Pandeglang memiliki kesamaan dengan kandungan propolis merah asal Brazil, demikian pula kesamaan sifat aktivitas antibakterinya.
yang dapat mencapai usus hewan uji serta toksisitasnya. Untuk kepentingan pemurnian komponen senyawa maka perlu dilakukan fraksinasi yang lebih lebar. Demikian pula, perlu dilakukan identifikasi jenis tumbuhan di sekitar sumber perolehan propolis ini, yang berkaitan dengan jenis senyawa aktif serta sifat dan kemampuan antibakteri yang ditimbulkan.
© Hak cipta milik IPB, tahun 2008
Hak cipta dilindungi undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencamtumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan, atau makalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
PENGARUH PROPOLIS
Trigona
spp ASAL
PANDEGLANG TERHADAP BEBERAPA ISOLAT
BAKTERI USUS SAPI DAN PENELUSURAN
KOMPONEN AKTIFNYA
GERARDUS DIRI TUKAN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Biokimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Pengaruh Propolis Trigona spp Asal Pandeglang Terhadap Beberapa Isolat Bakteri Usus Sapi dan Penelusuran Komponen Aktifnya
Nama : Gerardus Diri Tukan
NIM : G851060041
Disetujui
Komisi Pembimbing :
Dr. Ir. I Made Artika, M.AppSc Ketua
Dr. Ir. Kuswandi,M.Sc Anggota
Ir. H. A. E. Zainal Hasan,M.Si Anggota
Diketahui
Ketua Program Studi
Prof. Dr. drh. Maria Bintang,MS
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil A. Notodiputro.MS
PRAKATA
Propolis sarang lebah merupakan salah satu bahan alam yang saat ini mendapat perhatian pemanfaatannya sebagai antibiotik dan pengawet alamiah. Penelitian ‘Pengaruh Propolis Trigona spp Asal Pandeglang Terhadap Beberapa Isolat Bakteri Usus Sapi dan Penelusuran Komponen Aktifnya’ yang dilakukan ini merupakan salah satu upaya ke arah itu, dan telah dilaksanakan selama kurang lebih 11 bulan (Agustus 2007 sampai Juni 2008). Hasil-hasil yang dicapai sesuai tujuan penelitian, tersaji di dalam bab IV dan disimpulkan di dalam bab V.
Sambil mengangkat Puji dan syukur kepada Tuhan karena berkat dan penyelenggaraanNya sehingga penelitian dan penulisan makalah hasil penelitian ini dapat terselesaikan sebagai salah satu syarat untuk mendapatkan gelar Magister Sains, penulis mengucapkan terima kasih kepada semua pihak yang telah membantu, khususnya kepada: 1) Bapak Dr. Ir. I Made Artika,M.App.Sc selaku ketua komisi pembimbing, serta bapak Dr. Ir. Kuswandi M.Sc dan bapak Ir. H. A. E. Zainal Hasan,M.Si selaku anggota komisi pembimbing yang telah banyak memberi arahan dan masukan selama penyusunan makalah hasil penelitian ini. 2) Ibu Prof. Dr. drh. Maria Bintang, MS, selaku Ketua Program Studi Pascasarjana Biokimia IPB yang telah memberi masukan untuk perbaikan makalah hasil penelitian ini. 3) keluarga dan orang tua serta kakak-kakak dan adik-adikku yang banyak memberi dukungan moril. 4) Yayasan Pendidikan Katolik Arnoldus (YAPENKAR) Kupang yang telah membiayai penulis mengikuti studi program magister di Departemen Biokimia Sekolah Pascasarjana Institut Pertanian Bogor, 5) FMIPA Universitas Katolik Widya Mandira Kupang yang telah mengajukan penulis untuk mengikuti pendidikan magister, 6) para staf PSB-IPB khususnya pada departemen Biokimia IPB yang telah banyak memberi semangat dan bantuan dalam studi dan penelitian ini, 5) Teman-teman seangkatan (2006), teristimewa Dimas Andrianto dan Waras Nurcholis yang telah membantu penulis belajar dan memahami bidang ilmu Biokimia.
Penulis menyadari bahwa makalah hasil penelitian ini jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang untuk perbaikkannya.
RIWAYAT HIDUP
Penulis dilahirkan di Aliuroba Lembata Nusa Tenggara Timur pada tanggal 14 Desember 1970 dari ayah Petrus Pana Tukan dan ibu Perpetua Palang Lewuras. Penulis merupakan putra kelima dari sepuluh bersaudara.
DAFTAR ISI Manfaat Hasil Penelitian ... Ruang Lingkup Penelitan ... Dugaan...
TINJAUAN PUSTAKA ... Propolis ... Komposisi Kimiawi Propolis ... Kegunaan Propolis Bagi manusia ... Kegunaan Propolis Dalam Dunia Peternakan ... Propolis Trigona spp ... Usus Sapi Sebagai Bagian Sistem Pencernaan Sapi ... Senyawa Antibakteri ... Aktivitas Antibakteri ...
METODOLOGI PENELITIAN ... Waktu dan Tempat Penelitian ... ... Alat dan Bahan ... Metode Penelitian ... Pengambilan Sampel ... Ekstrasi Propolis Trigonaspp... Uji Aktivitas Antibakteri dan Penentuan Konsentrasi Hambat
Tumbuh Minimum (KHTM) ... Uji KHTM Kertas cakram Untuk Bakteri Campylobacter... Analisis Fitokimia Propolis ... Penelusuran Senyawa Aktif di dalam Propolis ... Analisis Data ...
HASIL PENELITIAN DAN PEMBAHASAN ... Hasil Ekstraksi Propolis ... …...… Hasil Uji Aktivitas Antibakteri dan KHTM ………...….... Hasil Analisa Fitokimia Ekstrak kasar propolis ... Hasil Analisis Komponen Aktif ... Komponen-komponen senyawa di dalam propolis...………....
Saran ... DAFTAR PUSTAKA ... LAMPIRAN ...
48 49
DAFTAR TABEL
Halaman
1 Komponen kimia propolis ... 2 Aktivitas biologis komponen propolis ... 3 Komponen propolis berdasarkan daerah asal ... 4 Hasil uji aktivitas antibakteri dan penentuan Konsentrasi Hambat Tumbuh
Minimum (KHTM) ekstrak propolis terhadap beberapa bakteri usus sapi...
5 Rata-rata daya hambat tumbuh propolis Trigona spp asal Pandeglang terhadap beberapa bakteri patogen dan non patogen dari usus sapi ...
6 Hasil analisis fitokimia ... 7 Persamaan dan perbedaan hasil analisis fitokimia propolis Trigona spp
asal Pandeglang ... ...
8 Hasil uji aktivitas antibakteri dari fraksi-fraksi propolis Trigona spp asal Pandeglang terhadap bakteri E. coli...
9 Ringkasan persen perkiraan persamaan struktur senyawa dari fraksi C ... 7 8 10
32
34
37
37
40
DAFTAR GAMBAR
Halaman 1 Struktur kimia senyawa di dalam fraksi Propolis (pendekatan) ...
2 Lebah Trigona spp dan sarang lebah Trigona spp ... 3 Anatomi sistem pencernaan sapi ... 4 Bakteri E.coli dan Salmonella sp ... 5 Bakteri Campyllobacter sp ... 6 Bakteri Klebsiella sp ... 7 Bakteri Bacteroides sp ... 8 Bakteri Bifidobacterium adolescentis sp ... 9 Satu seri uji KHTM bakteri ... 10 Grafik daya hambat pertumbuhan bakteri oleh propolis Trigona spp asal
Pandeglang pada konsentrasi 16,67% ...
11 Grafik diameter zona hambat fraksi-fraksi propolis Trigona spp asal Pandeglang terhadap bakteri E.coli ...
DAFTAR LAMPIRAN
Halaman 1 Bagan alur penelitian ...
2. Peta lokasi pengambilan sampel propolis ... 3 Hasil Ekstraksi propolis Trigona spp asal Pandeglang ... ... 4 Pembuatan larutan propolis dengan berbagai seri konsentrasi... 5 Pembuatan larutan standar ampicilin... 6 Pembuatan media PYG untuk pembiakan bakteri... 7 Formulasi media untuk menumbuhkan bakteri Campylobacter ... 8 Pembuatan larutan standar McFarland (Andrews, 2001)... 9 Data Luas zona bening uji aktivitas antibakteri Propolis Trigona spp asal
Pandeglang terhadap beberapa isolat bakteri usus sapi ...
10 Hasil analisis zona hambat propolis Trigona spp asal Pandeglang menggunakan faktor tunggal dengan program SPSS...
11 Foto zona bening hasil hji aktivitas antibakteri propolis Trigona spp asal Pandeglang ...
12 Foto hasil uji fitokimia ... 13 Foto hasil penentuan eluen menggunakan plat KLT ... 14 Foto pemisahan fraksi pada plat KLT preparatif... 15 Pengelompokan fraksi hasil kromatografi kolom ... ... 16 Kadar fraksi hasil kromatografi kolom ... 17 Foto uji antibakteri fraksi-fraksi terhadap bakteri E. coli ... 18 Analisis data zona hambat fraksi-fraksi propolis terhadap bakteri E. coli, menggunakan ANOVA faktor tunggal dengan bantuan program SPSS 15…...
BAB I PENDAHULUAN
Latar Belakang
Propolis adalah suatu resin yang merupakan suatu zat yang dihasilkan oleh lebah madu, dan merupakan salah satu komponen pembangun struktur sarang lebah madu. Propolis, yang merupakan resin pembangun struktur sarang lebah madu, diperoleh lebah dari resin kuncup bunga dari flora-flora di sekitar lingkungan hidupnya. Dalam struktur sarang lebah, komponen propolis berperan sebagai penambal bagian sarang yang retak, penutup celah sarang, pelindung telur dari ancaman serangan bakteri atau kebusukan, dan juga mensterilkan makanan (Sarwono, 2007)
Propolis dewasa ini mendapat perhatian penggunaannya. Pemanfaatan propolis sarang lebah madu secara umum, adalah dikaitkan dengan aktivitas antibakteri. Banyak penemuan yang telah mengungkapkan sifat propolis, yakni sebagai bahan antibakteri, antivirus, dan antifungi dan pengobatan untuk berbagai jenis penyakit yang lain. Propolis dinyatakan memiliki sifat disinfektan
(antibakteri) yang berperan membunuh semua kuman yang masuk ke sarang lebah, dan melindungi semua yang ada di dalam sarang tersebut, misalnya ratu lebah, telur, bayi lebah dan madu, dari serbuan kuman, virus, atau bakteri. Sifat desinfektan ini terbukti, ketika pada tahun 1963, ditemukan seekor tikus dalam sarang lebah dan dalam keadaan tidak membusuk, meskipun telah mati selama kurang lebih 5 tahun dan mummy lebah di dalam sarangnya selama ribuan tahun yang dan tidak membusuk atau hancur (Kariim, 2006). Kemudian terungkap pula bahwa di dalam sarang lebah terdapat komponen propolis yang memiliki sifat antimikroba.
Walaupun demikian, sejak perang dunia pertama penggunaan propolis sebagai bahan antimikroba alamiah mulai ditinggalkan dan diganti dengan bahan antibiotik sintetik, misalnya amoksilin dan ampisilin. Hal itu karena kondisi menuntut untuk disediakan bahan antimikroba dalam jumlah besar dan cepat, guna mengobati luka dan pencegahan infeksi terhadap luka para korban perang. Dan, setelah diketahui sifat resistensi bakteri terhadap antibiotik sintetik serta dampak negatif lainnya, maka propolis alamiah dari sarang lebah madu mulai kembali diminati.
Berdasarkan sifatnya sebagai bahan antimikroba alamiah, maka propolis sarang lebah madu tidak hanya digunakan sebagai bahan obat-obatan, melainkan juga untuk menyeimbangkan populasi mikroflora saluran pencernaan, yang dapat memacu pertumbuhan ternak. Penelitian dan pengembangan ke arah itu, marak dilakukan di berbagai negara seperti di Brazil, Venezuela, Jepang dan lain-lain.
Studi terhadap khasiat propolis dari berbagai jenis lebah madu sebagai bahan antimikroba pun telah dilakukan. Di antaranya; Boyanova et al. (2005) melakukan studi penggunaan ekstrak propolis lebah madu asal Bulgaria terhadap aktivitas bakteri 94Helicobacter pylori dan ditemukan bahwa aktivitas bakteri ini dapat dihambat. Angraini (2006) menemukan bahwa propolis lebah madu Trigona spp efektif menghambat pertumbuhan 4 jenis bakteri uji, yakni Staphylococcus aureus, Baccillus subtilis, Escherichia coli dan Pseudomonas aeruginosa. Lasmayanti (2007) meneliti potensi antibakteri propolis lebah madu jenis Trigona spp terhadap aktivitas bakteri kariogenik (Streptococcus mutans), suatu bakteri penyebab karies gigi. Hasil penelitiannya dilaporkan bahwa ekstrak propolis Trigona spp dapat dijadikan zat antikaries alternatif dalam pasta gigi, oleh karena kemampuannya dalam menekan jumlah dan pertumbuhan koloni bakteri S. Mutans. Copi et al. (2007) melaporkan bahwa propolis merah Brazil mampu menghambat aktivitas protozoa Leishamnia penyebab penyakit Leishamnia amazoneasis.
sapi ketika ditambahkan bersama dengan tembaga dan kobal dalam ransum sapi (Fearnley, 2001).
Studi terhadap propolis lebah madu pun telah berkembang ke pengungkapan fraksi-fraksi senyawa yang terkandung di dalam sampel propolis, dari berbagai daerah asal. Di antaranya; Yaghoubi et al. (2007) melaporkan bahwa propolis di Iran mengandung pinokembrin, asam kafeat, kaemferol, phenethyl caffeate, chrysin, dan galangin. Total kandungan flavonoid adalah 7,3% dan fenolik 36%, yang mana keduanya menghambat aktivitas mikroba secara kuat. Burdock, (1998) dalam Bakmaz, (2002) mengungkapkan bahwa raw propolis mengandung 50% resin (fraksi polifenolik), 30% lilin, 10% asam lemak esensial, 5% polen dan 5% senyawa organik dan mineral lainnya. Komposisi kimiawi propolis sangat kompleks, dan memiliki lebih dari 200 jenis senyawa.
Trusheva et al. (2006) melakukan analisis komponen-komponen aktif di dalam propolis merah asal Brazil dengan menggunakan teknik kromatografi kolom silika gel dan spektrofotometri Nuclear Magnetic Resonance (NMR). Dari studi itu ditemukan 14 jenis senyawa yang terkandung. Di antaranya adalah fenol sederhana, triterpenoid, isoflavonoid, prenilated benzophenon dan naptokuinon epoksida (merupakan suatu senyawa yang diisolasi dari sumber bahan alam). Dari komponen-komponen senyawa itu dilaporkan bahwa tiga komponen di antaranya berpengaruh kuat menghambat aktivitas bakteri dan bersifat antijamur, yang diamati melalui metode cawan-agar. Dan, dua komponen memiliki kemampuan menarik radikal bebas dalam uji antioksidan 1,1-diphenyl-2-picrylhhydrazyl (DPPH).
Dari berbagai studi yang telah dilakukan, diketahui pula bahwa daya efektivitas kerja propolis sarang lebah madu sebagai bahan antimikroba dan jenis komponen senyawa aktif yang terkandung, berkaitan erat dengan daya dukung lingkungan flora sekitarnya yang menjadi sumber resin bagi lebah untuk membangun struktur sarangnya (Trusheva et al. 2006)
Terkait dengan pemikiran ini maka dilakukan penelitian penelusuran komponen aktif propolis Trigona spp asal Pandeglang, dan pengaruhnya terhadap beberapa bakteri usus sapi. Hal ini berkaitan dengan jenis lebah Trigona spp yang merupakan suatu lebah penghasil propolis. Dan jenis lebah ini telah diternak secara intensif oleh masyarakat Pandeglang.
Perumusan Masalah
Tiga masalaha pokok yang hendak dipelajari di dalam penelitian ini adalah : 1. Apakah propolis Trigona spp asal Pandeglang dapat memberikan efek
aktivitas antibakteri untuk beberapa jenis bakteri pada usus sapi?
2. Berapa konsentrasi minimum propolis Trigona spp yang dapat memberikan efek aktivitas antibakteri untuk beberapa jenis bakteri usus sapi?
3. Komponen-komponen bioaktif apa saja yang terdapat di dalam propolis Trigona spp yang memiliki aktivitas antibakteri terhadap beberapa jenis bakteri usus sapi potong?
Tujuan Penelitian
Tujuan dari penelitian ini adalah :
1. Untuk mengetahui kemampuan aktivitas antibakteri dari propolis Trigona spp asal Pandeglang terhadap beberapa jenis bakteri pada usus sapi. 2. Untuk mengetahui konsentrasi minimum propolis Trigona spp yang
dapat memiliki aktivitas antibakteri terhadap beberapa jenis bakteri pada usus sapi.
Manfaat Hasil Penelitian
Manfaat dari hasil penelitian ini adalah menyediakan informasi tentang jenis senyawa aktif propolis Trigona spp yang berpotensi untuk dikembangkan sebagai sebagai bahan pemacu pertumbuhan sapi.
Ruang Lingkup Penelitian
Dalam penelitian ini, lingkup kajian adalah sebagai berikut :
1. Propolis Trigona spp yang digunakan adalah yang berasal dari sarang lebah Trigona spp asal Pandeglang.
2. Jenis isolat bakteri usus sapi yang digunakan di dalam uji ini adalah: (a) bakteri non patogen, yang terdiri dari : Bachteriodes, Lactobacillus casei,
Bifidobacteria
(b) bakteri patogen, yang terdiri dari : E. coli, Salmonella typhymurium, Campylobacter.
3. Penelitian ini dilakukan secara in vitro.
Dugaan
Propolis dari lebah madu jenis Trigona spp asal Pandeglang, merupakan suatu bahan antibiotik alamiah yang mempunyai kemampuan aktivitas antibakteri serta mengandung komponen-komponen senyawa bioaktif yang berkhasiat antibakteri terhadap beberapa bakteri usus sapi.
BAB II
TINJAUAN PUSTAKA
Propolis
lebah, propolis merupakan resin berbentuk pasta yang lengket, sehingga disebut sebagai bee-glue (Melia Propolis, 2006).
Di dalam proses pembuatan sarangnya, lebah mengumpulkan resin dari berbagai kuncup bunga tumbuhan, kemudian bercampur dengan saliva dan berbagai enzim dalam lebah, sehingga menghasilkan resin baru. Resin baru yang terbentuk di dalam sarang dan merupakan suatu komponen pembentuk sarang lebah ini, berbeda dengan resin asalnya. Resin baru yang terbentuk (propolis) berwarna kuning, coklat tua, merah atau bahkan transparan, yang dipengaruhi oleh kandungan flavonoidnya (Bankova et al. 2000).
Di dalam struktur sarang lebah, propolis merupakan lapisan tipis pada dinding bagian dalam, atau lubang-lubang tempat tinggal lebah. Propolis juga dimanfaatkan untuk memperbaiki, membuat pertahanan sarang, atau untuk membalut predator yang terbunuh yang tidak dapat dikeluarkan dari sarang (Ghisalberti, 1978).
Propolis sudah mulai diteliti dan dipelajari sejak tahun 1960-an. Hal ini berdasar pada sifat uniknya yakni dipergunakan sejak dahulu oleh bangsa Yunani dan Romawi sebagai bahan antimikroba. Propolis diketahui mempunyia khasiat aktivitas antibakteri, antifungi, antivirus dan anti aktivitas biologi lain seperti antiinflamasi, anestesi lokal, hepatoprotektif, antitumor, dan imunostimulasi. Selama 40 tahun terakhir, banyak diungkapkan tentang propolis yang meliputi komposisi kimia, aktivitas biologi, farmakologi dan terapi penggunaan propolis. Diketahui pula bahwa komposisi kimia propolis sarang lebah serta aktivitas biologisnya dapat berbeda antar daerah, tempat propolis sarang lebah itu diperoleh. Hal ini diduga sebagai adanya perbedaan jenis atau ekosistem tumbuhan (flora) sebagai sumber utama propolis (Bankova et al. 2000).
Komposisi Kimiawi Propolis
mengandung flavonoid yang sangat tinggi, sehingga banyak peneliti yang mensejajarkan propolis dengan flavonoid (Chinthapally 1993, diacu dalam Angraini, 2006).
Khismatullina, 2005 (diacu dalam Anggraini, 2006) mengungkapkan bahwa propolis dengan sejumlah senyawanya menunjukkan bermacam-macam efek biologis dan aktivitas farmakologis. Telah diketahui lebih dari 200 senyawa yang terkandung di dalam propolis, dengan komponen kimianya seperti tertera dalam Tabel 1 berikut :
Tabel 1. Komponen Kimia Propolis
Kelas senyawa Golongan senyawa Jumlah
Resin Flavonoid, asam aromaik dan esternya. 50%
Lilin Asam lemak dan esternya 30%
Minyak esensial Volatil 10%
Polen Protein dan asam amino bebas 5%
Senyawa organik dan mineral
Mineral, keton, lakton, quinon, steroid, vitamin dan gula
5%
Sumber : (Khismatullina 2005, dalam Angraini, 2006)
Menurut Bankova et al. (2000), sifat fisik dan komposisi kimia propolis dan khasiat propolis sangat bergantung pada botani tempat lebah memperoleh resin, serta musim dan kondisi geografis daerah atau tempat dimana propolis ditemukan. Pada daerah yang beriklim sedang seperti Eropa, Asia dan Amerika Utara, propolis yang diperoleh dari daerah ini mempunyai komposisi kimia yang mirip dengan bahan utama fenolik : flavonoid aglikon, asam aromatik dan esternya. Propolis dari daerah tropis, khususnya Brazil, menunjukkan beberapa komponen kimia serta aktivitas biologisnya (Tabel 2).
Tabel 2. Aktivitas Biologis Komponen Propolis
Jenis senyawa Jenis aktivitas
Prenylated p-coumaric acids: 3,5-diprenyl-4-hydroxycinnamic
acid, 3-prenyl-4-dihydrocinnamoy-loxycinnamic acid, dan 2,2-dimethyl-6-carboxy-ethenyl-2H-1-benzopyran.
3-acetoxymethyl-5-[(E)-2-formylethen-1-yl]-2-(4-hydroxy-3-methoxyphenyl)-7-methoxy-2,3-dihydrobenzofuran, sesamin, achantin, dan sesartenin.
Diterpenic acids : 15-oxo-3,13Z-kolavadiene-17-oic acid and its E-isomer, communic acid, imbricatoloic acid, dan isocupressic acid.
Antibakteri
Flavonoid : aromadendrine-4’methyl ether dan
3,5,7-trihydroxy-6,4’-dimethoxyflavon.
Prenylated p-coumaric acids: 3,5-diprenyl-4-hydroxynnamic acid dan 9-E-,2-dimethyl-6-carboxyethenyl-8- prenyl-2H-
1-benzopyran.
Lignans : 1-(4-hydroxy-3-methoxyphenyl)-2-{4-[(E)-3-acetoxy-
propen-1-yl]-2-ethoxyphenoxy}propan-1,3-diol 3-acetate (erythro- and treo) dan Yangambin.
Diterpenic acid : ent-17-hydroxy-3,13Z-clerodadien-15-oic acid
Sitotoksik
Caffeoylquinic acids : 3-caffeoylquinic (chlorogenic) acid,
4-caffeoylquinic acid, 5-caffeolyquinic acid, 3,5-di4-caffeoylquinic acid dan 4,5-dicaffeoylquinic acid methyl ester.
Imunomodulasi
Caffeoylquinic acids : 4,5-dicaffeoylquinic acid dan
3,4-dicaffeoylquinic acid
antihepatotoksik
Sumber : Bankova et al. (2000)
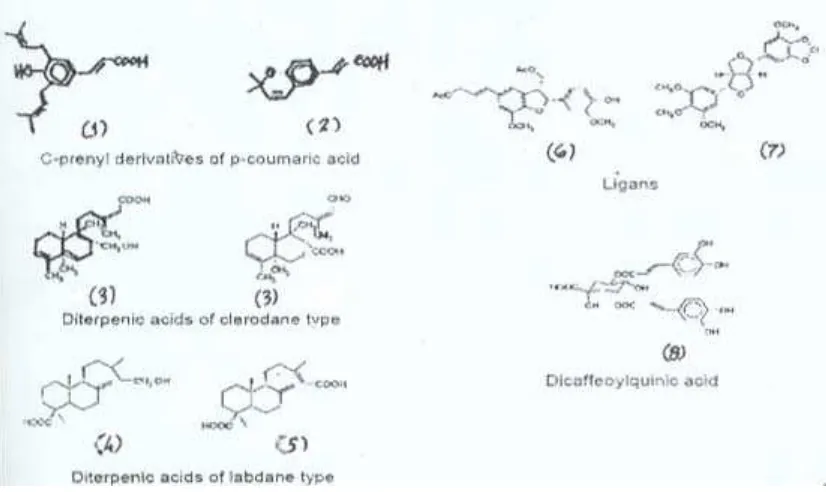
Struktur kimia golongan senyawa dalam propolis yang mempunyai aktivitas biologi penting, tampak pada Gambar 1.
Gambar 1, Struktur kimia senyawa di dalam fraksi propolis (Pendekatan). 1). 3,5-diprenyl-4-hydroxy-cinnamic acid; 2). 2,2-dimethyl-6-carboxyethenyl-2H-1-benzopyran; 3).
ent-17-hydroxy-3,13Z-clerodadien-15-oic acid; 3). 15-oxo-3, 13Z-kolava-diene-17-oic acid; 4). imbricatoloic acid; 5). 8(17),13E-labdadien-15,19-dioic acid; 6).
3-acetoxymethyl-5-[(E)-2-formylethen-1-yl]-2-(4-hydroxy-3-methoxyphenyl)-7-methoxy-2,3-dihydrobenzofuran; 7). sesartenin; 8). 3,5-dicaffeoylquinic acid (Bankova et al. 2000)
Berdasarkan tumbuhan asal resin pembentuknya serta pengetahuan tentang senyawa aktif propolis, maka telah ditentukan komponen-komponen yang terkandung di dalam propolis lokal. Misalnya propolis asal Rusia, Brasilia dan Eropa. Komponen umum propolis yang berasal dari berbagai daerah tertera pada Tabel 3.
Tabel 3 Komponen Propolis Berdasarkan Daerah Asal Daerah asal Tumbuhan sumber resin Komponen utama
Eropa, Asia, Amerika Utara
Populus spp (poplar) Pinocembrin, pinobanksin, pinobanksin-3-O-acetate, chrysin, galangin, caffeates (benzyl, phenylethyl, prenyl)
Rusia Utara Betula verrucosa (birch) Acacetin, apigenin, ermanin, rhamnocitrin, kaemferid, α -acetoxybetulenol.
Brazil Baccahris spp. Araucaria
spp.
Prenylated p-coumaric acids, prenylated acetophenones, diterpenic acids
Kepulauan Canary
- Furoruran lignans
Sumber : Bankova et al. (2000)
Kegunaan Propolis Bagi Manusia
Kegunaan Propolis bagi manusia adalah, pertama, sebagai suplementasi. Propolis mengandung zat-zat yang dibutuhkan untuk membangun kekebalan tubuh dan mengaktifkan kelenjar thymus. Zat-zat tersebut adalah semua vitamin
(kecuali vitamin K), semua mineral yang dibutuhkan tubuh kecuali sulfur, 16 rantai asam amino esensial yang dibutuhkan untuk regenerasi sel, dan
bioflavonoid. Para ahli menemukan bahwa kandungan bioflavonoid pada satu tetes propolis setara dengan bioflavonoid yang dihasilkan dari 500 buah jeruk (Anonim, 2006a)
Kedua, propolis digunakan sebagai bahan pengobatan alami karena mengandung zat aktif yang berfungsi sebagai obat untuk berbagai macam penyakit. Fungsi pengobatan meliputi beberapa hal, yakni : sebagai antibiotik,
antivirus dan sekaligus antifungi alami tanpa efek samping. Mengobati penyakit yang berhubungan dengan bakteri, misalnya : tifus, diare atau muntaber dan sebagainya. Dapat juga untuk membunuh bakteri atau jamur di lipatan ketiak, untuk menghilangkan bau ketiak. Mengobati penyakit yang berhubungan dengan virus, misalnya : demam berdarah, flu, TBC dan sebagainya. Mengobati penyakit yang berhubungan dengan jamur, misalnya : eksim, panu, keputihan, dan
atau pembuangan racun, misalnya : asam urat, kolesterol, trigliserin, darah tinggi,
jantung, stroke, diabetes melitus dan sebagainya (Rohmin, 2006).
Moriyasu et al. (1994) dalam penelitiannya menemukan bahwa ekstrak propolis dapat menyebabkan aktivitas mikrofag, yang berhubungan dengan fungsi kekebalan tubuh pada manusia.
Kegunaan Propolis dalam Dunia Peternakan
Studi pemanfaatan propolis dalam dunia peternakan telah banyak dilakukan. Penelitian yang dilakukan oleh Kwon et al. (1999) (dalam Fearnley 2001) menunjukkan bahwa propolis berpotensi mengurangi diare pada anak sapi yang terinfeksi oleh bakteri E.coli. Dunyavin (1971, diacu dalam Fearnley 2001) menemukan bahwa propolis yang dipadukan dengan logam tembaga dan kobalt dalam pakan yang diberikan kepada ternak sapi berkhasiat meningkatkan kekebalan tubuh sapi, mengaktifkan produksi antibodi dan fagositosis yang disebabkan oleh antigen paratyphoid. Selain sebagai obat dalam mengurangi kejadian diare, propolis juga dapat dipakai sebagai pemacu pertumbuhan anak sapi dengan cepat (Budicza, 1987 dalam Fearnley 2001). Pemberian ekstrak propolis 20% sebanyak 2 – 5 ml setiap pagi dan siang bersamaan dengan pemberian susu pada anak sapi, dapat mengurangi kejadian diare, dan mempercepat pertumbuhan berat badan.
Propolis Trigona spp
Trigona spp merupakan jenis lebah yang tidak menyengat (stingless bee). Jenis lebah ini termasuk di dalam famili Apidae. Lebah Trigona spp ditemukan di daerah tropis dan sub tropis, seperti Australia, Afrika, Asia Tenggara dan sebagian Meksiko dan Brazil. Lebah Trigona spp di daerah tropis selalu aktif sepanjang tahun, tetapi menjadi tidak aktif di musim dingin. Lebah Trigona spp merupakan salah satu serangga yang hidup berkelompok dan membentuk koloni. (Free, 1982). Trigona spp diklasifikasikan dalam divisi Animalia, filum Arthopoda, kelas Insecta, ordo Hymenoptera, famili Apidae, genus Trigona, dan species Trigona spp (Sihombing, 1997).
Lebah Trigona spp biasanya bersarang di lubang pohon, ranting pohon atau celah batu karang. Kadang pula bersarang di lubang dinding rumah dan kayu lapuk. Mudah dipelihara dan jarang berpindah tempat. Lebah ini menyimpan polen tempat telur besar dari lilin lebah, yang biasanya dicampur dengan resin tumbuhan (propolis). Pot-pot ini disusun mengelilingi pusat sarang sebagai tempat larva. Lebah muda yang baru menetas, cenderung berada di dalam sarang, dan ketika cukup umur menjadi lebah pencari makan atau penjaga sarang. Larva lebah ini tidak diberi makan langsung
a
b
Gambar 2 (a) Lebah Trigona spp. (b) Sarang lebah Trigona spp (Pyper, 2007)
Lebah Trigona spp membuat madu dengan mengumpulkan nektar,
kemudian dimatangkan (dengan dehidrasi dan fermentasi) di mulut sampai membentuk madu. Sarang lebah madu biasa dapat menghasilkan 75 kg madu setiap tahun. Sedangkan sarang lebah Trigona spp menghasilkan kurang dari 1 kg setiap tahun. Madu lebah Trigona spp mempunyai aroma khas, campuran manis dan asam seperti aroma lemon. Aroma ini berasal dari resin kuncup tumbuhan yang dikonsumsinya. Menurut Singh (1962), lebah Trigona menghasilkan sedikit madu
yang sulit diekstrak, namun propolis yang dihasilkannya lebih banyak dari jenis lebah lokal yang lain.
Taksonomi lebah Trigona spp:
Kigdom : Animalia
Phylum : Arthropoda
Class : Insecta
Suborder : Apocrita
Superfamily : Apiodae
Famili : Apidae
Subfamily : Apinae
Tribe : Meliponini
Genus : Trigona
Species : T. carbonaria, T. hockingsii, T. iridipennis, T. spinipes
Usus Sapi Sebagai Bagian Sistem Pencernaan Sapi
Sapi merupakan hewan ruminansia dan merupakan salah satu hewan pemakan tumbuhan (herbivora). Bahan makanan sapi adalah rumput dan tumbuh-tumbuhan berserat selulosa yang tinggi. Mikroba-mikroba di dalam rumen berperan mengurai selulosa dan karbohidrat dari rumput yang dimakan oleh sapi, dan mengubahnya menjadi asam lemak volatil. Asam lemak volatil yang terbentuk berperan sebagai bahan bakar utama untuk metabolisme dalam tubuh sapi. Mikroba yang hidup di dalam rumen sapi juga dapat mensintesis asam-asam amino dari bahan nitrogen non protein, seperti urea dan amonia untuk kebutuhan pertumbuhan sapi (Tyler et al. 2006).
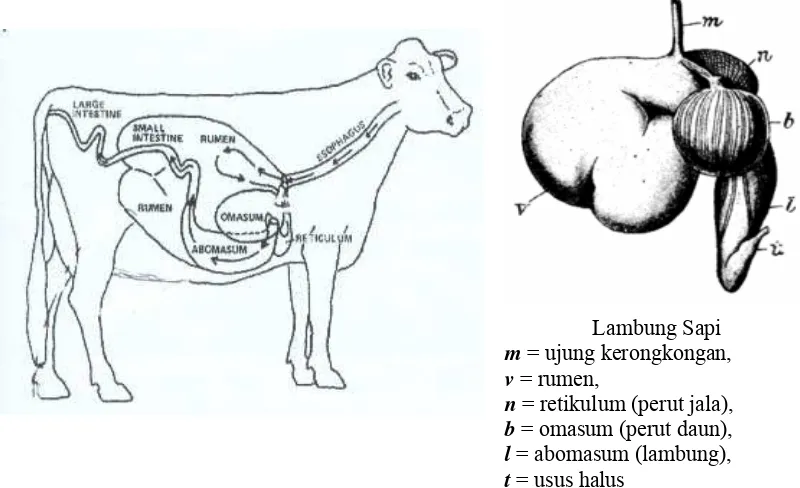
Sapi mempunyai lambung, yang terdiri dari empat bagian yaitu: rumen (bagian paling besar, kapasitas 80%), retikulum (bagian paling kecil, kapasitas 5%), omasum (kapasitas 7 – 8%), dan abomasum (kapasitas 7 – 8%). Lambung mempunyai
Lambung Sapi
m = ujung kerongkongan,
v = rumen,
n = retikulum (perut jala),
b = omasum (perut daun),
l = abomasum (lambung),
t = usus halus
Gambar 3. Anatomi sistem pencernaan sapi (sumber : Wikipedia, 2006a)
Usus halus merupakan tempat berlangsungnya proses pencernaan lebih lanjut. Usus pada sapi sangat panjang, usus halusnya dapat mencapai 40 meter, dengan lebar sekitar 5 cm. Usushalus terdiri atas tiga bagian yaitu duodenum, jejunum, dan ileum. Usus halus menerima sekresi dari pankreas dan gallbladder, yang membantu pencernaan. Proses pencernaan umumnya diselesaikan di sini, dan zat-zat gizi hasil pencernaan terakhir ini diserap melalui fili ke dalam darah dan sistem yang mengandung getah bening, untuk selanjutnya diedarkan ke seluruh bagian tubuh (Tyler et al. 2006). .
menggerakkan penyebarannya ke seluruh jaringan yang diperlukan (Tyler et al. 2006)
Di dalam usus, mikroorganisme yang membantu proses pencernaan makanan adalah Lactobacillus (Lactobacillus salivarius, Lactobacillus plantarum, Lactobacillus casei, L. acidophilus, Lactobacillus rhamnosus , Lactobacillus bulgaricus , Lactobacillus sporogenous dan lain-lain. Jenis bakteri ini disebut sebagai mikroba positif atau probiotik, dan merupakan kelompok mikroba terbesar yang ada di dalam usus sapi. Kelompok bakteri Lactobasillus di dalam usus sapi ini dapat dihambat aktivitasnya bilamana makanan (rumput) yang ditelan sapi terlampau banyak mengandung pestisida, atau dihambat aktivitasnya oleh bakteri jenis patogen (Anonim, 2006b)
Mekanisme kerja Lactobacillus dalam memperbaiki efisiensi pakan untuk meningkatkan produktivitas ternak terjadi melalui perannya memproduksi enzim amilase, baik enzim intraseluler maupun ekstraseluler, dan dapat berkoloni pada ephitel usus. Satu dari beberapa kemungkinan mekanisme dari setiap mikroba probiotik yaitu mencegah pertumbuhan dan perkembangan bakteri patogen, seperti Salmonella dan Escherichia coli, serta menjamin keseimbangan populasi
mikroba saluran pencernaan induk semang. Lactobacilus juga dapat
memproduksi asam laktat dan hidrogen peroksida. Zat-zat yang dihasilkan ini mempunyai kemampuan untuk menghambat perkembangan populasi bakteri terutama Salmonella sp termasuk bakteri-bakteri yang lain. Keberadaan Lactobacillus acidophilus sebagai probiotik, mampu memperbaiki kinerja dan kecernaannya dalam usus halus sehingga absorbsi zat-zat makanan menjadi lebih banyak (Sellars, 1991, diacu dalam Haddadin, 2004).
Cairan tubuh yang keluar membawa serta garam-garam mineral atau elektrolit, yang berdampak pada berubahnya keseimbangan kimiawi tubuh. Pada akhirnya, akan menimbulkan stress dan depresi pada sapi, yang menyebabkan pertumbuhan sapi terganggu, kondisi fisiknya lemah, bahkan menyebabkan kematian. Secara umum, diare dibagi dalam dua kategori, yaitu diare yang disebabkan oleh ketidakseimbangan nutrisi (non-infeksius) dan diare yang disebabkan oleh infeksi mikroorganisme (Manglayang, 2006)
bakteri E. coli bakteri Salmonella sp
Gambar 4, Bakteri E. Coli dan Salmonella sp (Wikipedia, 2006b)
Gambar 5, Bakteri Campylobacter sp. (Sumber : Wikipedia 2008a)
Bakteri Klebsiella merupakan suatu bakteri anaerob yang bersama bakteri patogen lain menyebabkan berbagai infeksi di dalam tubuh. Infeksi-infeksi yang disebabkan itu adalah infeksi saluran pernapasan bagian bawah, infeksi kulit dan jaringan kulit, infeksi saluran kemih, tulang dan sendi, serta infeksi intra abdominal, yakni peranannya mengkontaminasi rongga abdomen (Wikipedia, 2007)
Gambar 6, Bakteri Klebsiella sp (Sumber : Wikipedia, 2007)
Bakteri Bakteroides merupakan salah satu bakteri probiotik pengguna polisakarida dalam proses fermentasi dan metabolisme polisakarida, di samping bakteri sakarolitik lainnya seperti Bifidobacterium, Ruminococcus, Eubacterium, Lactobacillus, dan Clostridium. Proses metabolisme karbohidrat di dalam kolon bergantung pada kerjasama berbagai enzim yang dihasilkan dari bermacam-macam spesies bakteri, termasuk Bakteroides, yang saling bergantung satu sama lain dalam rantai proses fermentasi. Bacteroides adalah genus dari bakteri Gram negatif berbentuk tongkat. Spesies Bacteroides tidak membentuk endospora,
Gambar 7, Bakteri Bakteroides sp (Sumber : Wikipedia.2008b)
Bakteri Bifidum merupakan salah satu anggota kelompok bakteri probiotik, seperti L. casei dan Bakteroides sp. Bakteri ini hidup di dalam usus dan berperan membantu memperlancar proses pencernaan dan mengatasi ancaman terjadinya kanker. Penyebab kanker dapat bermula dari pola makan yang salah yang mengakibatkan terhambatnya sistem pembuangan di dalam usus. Dengan demikian, menimbulkan senyawa karsinogenik dalam tubuh yang berpotensi mengakibatkan kanker. Dari beberapa riset ditemukan bahwa Bifidobacterium tidak hanya mengatasi gangguan pencernaan, akan tetapi dapat juga efektif menurunkan resiko munculnya kanker terutama pada wanita (Anonim, 2007)
Gambar 8, : Bifidobacterium adolescentis Gram.jpg (Sumber : Wikipedia, 2008c)
Senyawa Antibakteri
produk-produk untuk kulit dan kesehatan serta pembersih peralatan rumah tangga. Sedangkan antibiotik adalah zat yang digunakan sebagai obat, baik pada manusia maupun pada hewan, dan mempunyai kemampuan untuk menghambat pertumbuhan maupun membunuh mikroorganisme. Zat ini diperoleh dari hasil metabolisme sekunder mikroorganisme lain, dan juga dapat disintesis secara kimia (Pelczar & Chan, 1988).
Berdasarkan cara kerjanya, antibakteri dibedakan menjadi bakteriostatik dan bakterisida. Antibakteri bakteriostatik bekerja dengan cara menghambat perbanyakan populasi bakteri, namun tidak mematikan bakteri. Sedangkan bakterisida membunuh bakteri. Bakteriostatik dapat bertindak sebagai bakterisida jika dalam konsentrasi yang tinggi. Kadar terendah suatu zat antibakteri yang dapat mampu membunuh bakteri disebut Kadar Bunuh Minimal (KBM), sendangkan kadar terendah yang mampu menghambat pertumbuhan bakteri, dikenal sebagai Kadar Hambat Tumbuh Minimal (KHTM) (Pelczar & Chan, 1988)
Kemampuan antibakteri dari zat-zat dapat berbeda satu sama lain. Menurut Dwijoseputro (1990), antibakteri dibedakan berdasarkan keefektifan kerjanya. Antibakteri berspektrum luas, yakni antibakteri yang efektif menghambat pertumbuhan berbagai jenis bakteri. Sedangkan antibakteri berspektrum sempit, yakni zat antibakteri yang hanya efektif membunuh mikroorganisme tertentu. Kerja antibakteri juga dipengaruhi oleh berbagai faktor seperti konsentrasi zat antibakteri, jenis zat, species bakteri, jumlah bakteri dan pH lingkungan.
Aktivitas Antibakteri
Menurut Jawetz, (1986), kerja aktivitas antibakteri oleh suatu zat terjadi melalui empat cara. Pertama, melalui hambatan sintesis dinding sel. Dengan tidak terbentuknya dinding sel bakteri, maka bakteri tidak dapat hidup.
komponen-komponen seluler. Zat antibakteri akan menyebabkan terjadinya kerusakan pada membran sel. Kerusakan-kerusakan pada membran ini mengakibatkan terganggunya pertumbuhan sel bahkan menyebabkan sel mati.
Ketiga, melalui hambatan sintesis protein. Hidupnya suatu sel bergantung pula pada terpeliharanya molekul-molekul protein dan asam nukleat alamiahnya. Suatu kondisi yang mengubah keadaan ini yakni terjadinya denaturasi protein dan asam-asam nukleat, (koagulasi dan atau timbulnya kondisi ireversible) maka sel pun mengalami kerusakan. Hal ini terjadi melalui kehadiran zat-zat kimia yang bersifat antibakteri atau kondisi suhu dan pH yang ekstrim.
Keempat, hambatan sintesis asam nukleat. Proses kehidupan normal sel sangat ditentukan oleh DNA, RNA dan protein. Dengan demikian, jika terjadi gangguan terhadap sintesis komponen-komponen ini maka mengakibatkan kerusakan total sel.
Pengukuran aktivitas antibakteri dapat dilakukan dengan beberapa metode, yaitu metode difusi dan metode pengenceran. Metode difusi merupakan metode yang lebih umum digunakan (Pelczar et al. 1988). Metode difusi dapat dilakukan melalui tiga cara. Pertama, dengan cara silinder. Silinder steril dengan diameter 8 mm, ditetesi larutan uji (zat antibakteri), dan ditempatkan pada permukaan agar yang telah ditanami bakteri uji. Daerah hambat yang terbentuk, terlihat sebagai daerah bening di sekitar silinder.
Kedua, cara perforasi. Pada cara ini, media agar yang telah ditanam jenis bakteri uji dibuat lubang atau sumur dengan diameter 5 sampai 6 mm. Ke dalam sumur dimasukkan larutan uji (zat antibakteri) sebanyak sekitar 10 l, diinkubasi pada suhu syarat hidup bakteri uji. Daerah hambatan tumbuh bakteri yang terjadi terlihat sebagai daerah bening di sekeliling sumur.
BAB III
METODOLOGI PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilakukan selama 11 bulan, bulan Agustus 2007 sampai bulan Juni 2008. Tempat penelitian di Laboratorium Biokimia Institut Pertanian Bogor (IPB) dan Laboratorium Pemeriksaan Doping dan Kesehatan Masyarakat Daerah Provinsi DKI Jakarta.
Alat dan Bahan
(ESCO, Singapura), inkubator (Memmert, Jerman), pemanas (gerhardt Jerman), neraca analitik (Ohaus Ga200, Jerman), rotavapor, Multi shaker (EYELA, Jepang), freeze-dryer, termometer, plat aluminium Kromatografi Lapis Tipis (KLT) terdiri dari Merck silika gel 60 GF 254, KLT preparatif lempeng kaca silika gel 60 GF 254, rangkaian kolom kromatografi, lampu UV 254 nm, Instrumen GC-MS Agilent Technologies 6890 Gas Chromatograph with Auto Sampler and 5973 Mass Selective Detector and Chemstation data system.
Bahan-bahan yang digunakan adalah sarang lebah Trigona spp asal Pandeglang, isolat bakteri terdiri dari bakteri patogen yaitu E. coli, Salmonella sp, Klebsiella sp. dan Campylobacter sp. bakteri-bakteri non patogen yaitu Bachteriodes sp. Lactobacillus casei, Bifidobacteria bifidum yang diperoleh dari Laboratorium Mikrobiologi Ilmu Pangan FATETA Institut Pertanian Bogor, media tumbuh bakteri yaitu : pepton, bakto agar, yeast ekstrak, glukosa, laktosa, Campylobacter Agar Base (DIFCO), dan suplemen Campylobacter. Pelarut berupa etanol 70%, propilen glikol, n-heksan, kloroform, dan etanol 90%. Pereaksi-pereaksi yakni Dragendrof, Lieberman, Burchard, Wagner, Mayer, daun pepaya, kuning telur, HCl, NH4OH, KMnO4, FeCl3, H2SO4 pekat, Silika gel G60
F254 (Merck) untuk KLT, dan silika gel G60 (0,063 – 0,200 mm) untuk KLT preparatif dan kromatografi kolom (70 – 230 mesh ASTM) (Merck).
Metode Penelitian Pengambilan Sampel
Sarang lebah Trigona spp diambil di beberapa lokasi pembudidayaan di desa Cibaliung kabupaten Pandeglang provinsi Banten, pada bulan Juli tahun 2007 (Lampiran 2). Desa Cibaliung khususnya maupun Kabupaten Pandeglang umumnya terletak pada koordinat : 60 21' - 70 10' LS dan 1040 48'- 1060 11' BT. Topografi sebagian besar wilayah daerah ini berupa dataran rendah dan dataran bergelombang. Kawasan selatan terdapat rangkaian pegunungan. Wilayahnya juga mencakup Pulau Panaitan (di sebelah barat, dipisahkan dengan Selat Panaitan), serta sejumlah pulau-pulau kecil di Samudera Hindia, termasuk Pulau Deli dan
Ekstraksi Propolis Trigona spp
Eskstraksi propolis dari sarang lebah Trigona spp ini dilakukan dengan metode Hasan (2006). Sebanyak 150 gr sarang lebah Trigona spp, dimaserasi dengan 650 ml etanol 70% (direndam sambil digojog dengan menggunakan shaker) selama 7 hari di dalam wadah erlenmeyer 1000 ml. Setelah 7 hari, filtrat didekantasi kemudian residu dimaserasi lagi dengan 50 ml etanol 70% yang baru. Proses ini dilakukan secara berulang setiap hari selama tujuh hari, hingga pelarut etanol pada residu tampak bening. Dengan demikian, total pelarut (etanol) yang digunakan adalah sebanyak 1000 ml, dan total waktu maserasi selama 14 hari. Filtrat yang diperoleh, disatukan di dalam wadah gelap, kemudian dikeringbekukan (freeze-dried) hingga membentuk ekstrak padat yang kemudian digunakan untuk pengujian selanjutnya.
Uji Aktivitas Antibakteri dan Penentuan Konsentrasi Hambat Tumbuh Minimum (KHTM).
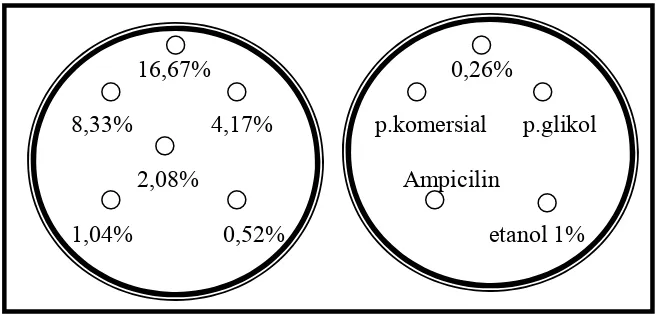
Pengujian aktivitas antibakteri dilakukan dengan metode perforasi atau difusi sumur (Andrews, 2001). Sampel untuk uji aktivitas antibakteri adalah larutan propolis yang dibuat sebanyak enam seri konsentrasi. Untuk kontrol positif digunakan larutan ampicilin 100 ppm, sedangkan kontrol negatif digunakan pelarut propilen glikol dan etanol 1%. Digunakan pula propolis x sebagai pembanding.
Penyiapan larutan propolis. Ekstrak propolis hasil freeze-drying dilarutkan dengan propilen glikol dalam perbandingan 1 : 5 (b/b), sehingga diperoleh larutan propolis dengan kadar 16,67%. Dari larutan dengan kadar 16,67% ini kemudian diencerkan dengan aquadest sehingga dihasilkan tujuh seri konsentrasi, yakni 16,67%, 8,33%, 4,17%, 2,08%, 1,04%, 0,52%, dan 0,26% (Lampiran 4)
Preparasi inokulum. Isolat bakteri dibiakkan dalam media cair PYG (peptone + yeast ekstrak + glukosa ; Lampiran 6), dan diinkubasi pada suhu 37oC selama 24 jam. Biakan segar diukur densitas optik (OD ; optical density)-nya. Jika OD > 0,5, untuk inokulasi diambil 50 l. Jika OD > 0,5, maka diambil 100 l. Larutan inokulum yang sama dengan standar McFarland (Lampiran 8), kerapatan bakterinya sekitar 10o cfu/ml.
Uji KHTM (metode sumur difusi). Sebanyak 50 l bakteri hasil inokulasi pada media cair dimasukkan ke dalam cawan petri steril kemudian ditambahkan dengan 10 ml larutan media agar steril 50oC (yang belum memadat). Campuran di dalam cawan petri dihomogenkan dengan cara menggoyang cawan petri secara perlahan-lahan membentuk angka delapan pada permukaan meja laminar. Campuran didiamkan hingga memadat kemudian dibuat lubang (sumur) berdiameter kira-kira 5 mm dengan menggunakan pipet tetes. Ke dalam setiap sumur dimasukkan 50 l larutan ekstrak propolis untuk tiap konsentrasi dan juga pembanding serta kontrol (positif maupun negatif) pada sumur-sumur yang lain. Dilakukan secara triplo (Gambar 7). Cawan ditutup rapat dan diinkubasi pada suhu 37 oC selama 24 jam. Setelah 24 jam inkubasi, diamati dan diukur daerah bening di sekitar sumur yang menunjukkan kemampuan penghambatan pertumbuhan bakteri (petunjuk aktivitas antibakteri). Pengukuran areal zona bening dilakukan dengan menggunakan jangka sorong.
16,67% 0,26%
8,33% 4,17% p.komersial p.glikol
2,08% Ampicilin
1,04% 0,52% etanol 1%
Gambar 9. Satu seri uji KHTM bakteri
bertahan hidup selama 3 menit di dalam kondisi aerob. Uji KHTM terhadap bakteri ini memiliki dilakukan dengan menggunakan kertas cakram (Lampiran 7). Koloni Campylobacter diambil dengan jarum ose, dicampur dengan larutan fisiologis, dan diencerkan sampai kerapatan bakteri 106 cfu/ml (setara dengan standar McFarland 0,5, Lampiran 8). Inokulum bakteri uji disegarkan sehari sebelum pengujian. Media Campylobacter agar base steril sebelum memadat (55
o
C) dituang ke dalam cawan yang mengandung bakteri uji. Cawan digoyang agar campuran homogen, dan dibiarkan memadat. Kertas cakram steril (diameter 6 mm) diletakkan di atas media padat, kemudian diberi 15 l larutan uji. Cawan dimasukkan ke dalam anaerobic jar dengan penambahan CO2 10% dan nitrogen,
dan diinkubasi pada suhu 42 oC selama 24 jam.
Analisis Fitokimia Propolis (Metode Harborne, 1996).
Analisis fitokimia propolis bertujuan untuk mengetahui secara kualitatif golongan senyawa-senyawa aktif di dalam ekstrak propolis. Identifikasi yang dilakukan meliputi uji terpenoid, uji alkaloid dan uji flavonoid.
Uji terpenoid dan steroid. Sampel ekstrak propolis dilarutkan dalam etanol 70% dengan perbandingan 1 : 10 (b/b) dan dipanaskan pada penangas air. Filtrat diuapkan kemudian ditambahkan eter. Lapisan eter ditambah dengan pereaksi Lieberman Burchard (terbuat dari 3 tetes asam asetat anhidrat + 1 tetes asam sulfat pekat). Terbentuknya warna hijau atau biru menunjukkan adanya steroid, dan warna merah atau ungu menunjukkan adanya senyawa terpenoid. Sebagai pembanding digunakan kuning telur .
Uji Alkaloid.Sampel ekstrak propolis dilarutkan dalam kloroform dengan perbandingan 1 : 2 (b/b) dan ditambah 5 tetes amonia. Fraksi kloroform diasamkan dengan asam sulfat. Bagian asamnya diambil dan ditambahkan masing-masing dengan pereaksi Dragendrof, Mayer, dan Wagner. Adanya alkaloid, ditandai sebagai berikut : dengan pereaksi Dragendrof terbentuk endapan merah. Dengan pereaksi Mayer terbentuk endapan putih. Dengan pereaksi Wagner terbentuk endapan coklat. Sebagai pembanding, digunakan air rebusan daun pepaya.
Disiapkan dua filtrat, yang masing-masing ditambah dengan larutan NaOH dan H2SO4 pekat. Warna jingga yang terbentuk akibat penambahan NaOH,
menunjukkan adanya senyawa fenol hidrokuinon, sedangkan warna merah akibat penambahan H2SO4 pekat menunjukkan adanya flavonoid. Pembanding yang
digunakan adalah ekstrak buah pinang segar.
Penelusuran Senyawa Aktif di Dalam Propolis (Metode KLT).
Identifikasi fraksi senyawa. Analisis fraksi senyawa di dalam sampel propolis Trigona sppdilakukan dengan Kromatografi lapis tipis (KLT) dan juga KLT preparatif. Plat KLT silika gel G60 F254 sebagai fase diam sedangkan fasa
gerak adalah campuran pelarut n-heksan : kloroform : etanol 90% dengan perbandingan 2 :1 : 0,1 (v/v). Jenis-jenis pelarut yang digunakan sebagai campuran eluen, diidentifikasi terlebih dahulu melalui uji eluen tunggal. Hasil KLT diamati dengan lampu uv 254 nm (Lampiran 13 dan Lampiran 14).
Fraksinasi. Pemisahan serta pemurnian tiap fraksi (fraksinasi) dilakukan dengan kromatografi kolom. Kolom kromatografi diisi dengan koloid silika gel GF254. Pelarut yang digunakan, baik untuk melarutkan ekstrak propolis sampel,
pembuatan koloid silika gel G60 F254 untuk pengisian kolom, maupun sebagai
eluen, adalah campuran pelarut n-heksan : kloroform : etanol 90%, 2 :1 : 0,1 (v/v).
Sebanyak 2 gram ekstrak propolis dilarutkan dengan 5 ml pelarut campuran (eluen), kemudian dimasukkan pada permukaan atas kolom. Secara perlahan, eluen ditambahkan dari permukaan atas kolom, sementara fraksi-fraksi ditampung setiap 5 ml pada ujung bawah kolom dengan laju alir 2 ml/menit. Larutan fraksi yang diperoleh, kemudian dianalisis dengan pelat KLT dan diamati dengan lampu uv 254 nm. Spot-spot yang sama, dikelompokkan untuk menghasilkan kelompok-kelompok fraksi.
Uji aktivitas fraksi senyawa terhadap aktivitas bakteri. Masing-masing kelompok fraksi senyawa dari hasil fraksinasi diuji aktivitas antibakterinya terhadap bakteri E. col, dengan metode difusi sumur.
gas chromatography – mass spectrometry (GC-MS). Digunakan instrumen GC-MS Agilen Technologies 6890 Gas Chromatograph dengan auto sample dan detektor selektif massa 5973 dan sistem data Chemstation. Kolom yang digunakan adalah kolom kapiler HP ultra 2, (17 m x 0,25 mm), dan diameter 0,25 l. Sebanyak 5 l sampel (fraksi C) diinjeksikan pada suhu 250 oC. Gas pembawa adalah helium, dengan sistem laju alir konstan, sebesar 0,9 l/menit.
Analisis Data.
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
Hasil ekstraksi propolis
Hasil maserasi sarang lebah Trigona spp adalah filtrat berwarna merah tua (merah kecoklatan). Pada hari-hari pertama maserasi, etanol dari semula bening berubah menjadi merah tua. Intensitas warna larutan semakin menurun dengan semakin bertambahnya waktu maserasi dan penggantian etanol. Pada hari ketujuh, pelarut etanol yang ditambahkan untuk proses maserasi, tetap bening setelah 24 jam. Banyaknya rendemen ekstrak propolis yang diperoleh dari 150 gr sampel sarang lebah madu Trigona spp yang digunakan adalah 25,8417 gr (17,23%). Fisik rendemen berbentuk pasta yang lengket dan berwarna merah kecoklatan (Lampiran 3), serta tidak larut dalam air. Pasta rendemen hanya dapat larut dalam propilen glikol dan beberapa jenis pelarut organik yang lain.
Kondisi fisik rendemen serta banyaknya rendemen yang diperoleh dalam penelitian ini relatif sama dengan yang telah diekstrak oleh Angraini (2006) dan Lasmayanti (2007), dari sarang lebah sejenis yang dikoleksi dari daerah yang sama. Keduanya memperoleh rendemen berwarna coklat tua.
Banyaknya rendemen yang diperoleh, berkaitan erat dengan intensitas warna larutan ekstrak. Woo (2004) dalam Angraini 2006), mengemukakan bahwa larutan ekstrak propolis dengan warna yang lebih gelap, menandakan diperolehnya rendemen yang lebih tinggi dibandingkan dengan warna yang lebih cerah. Gelapnya warna atau tingginya intensitas warna propolis dikarenakan oleh tingginya kandungan flavonoid. Hal ini sesuai dengan yang dikemukakan oleh Harborne (1996), bahwa semua senyawa fenol dalam bahan alam memiliki serapan kuat di daerah ultraviolet, karena memiliki struktur cincin aromatik.
0,1%. Ini menunjukkan bahwa dalam pengeringbekuan larutan ekstrak propolis dalam etanol, tidak terjadi pembebasan etanol secara sempurna. Hal ini dapat terjadi karena propolis merupakan resin, yang dapat dengan kuat menyekap etanol.
Analisis terhadap sisa kandungan etanol di dalam ekstrak propolis, menjadi penting, karena etanol bersifat antiseptik dan dapat mempengaruhi propolis uji untuk menghambat pertumbuhan bakteri. Mekanisme kerja etanol sebagai bahan antimikroba, yaitu dengan cara mendenaturasi protein dan merusak membran sel bakteri (Pelczar et al. 1988)
Hasil Uji Aktivitas Antibakteri dan KHTM
Hasil uji aktivitas antibakteri dan penentuan KHTM dari ekstrak propolis Trigona spp asal Pandeglang terhadap beberapa jenis bakteri usus sapi tercantum dalam Tabel 4. Data uji KHTM setiap bakteri tercantum dalam Lampiran 9.
Komponen bahan uji adalah larutan-larutan ekstrak propolis Trigona spp dengan berbagai tingkat konsentrasi, (0,26% sampai 16,67%), serta larutan kontrol dan pembanding. Larutan ekstrak propolis terbuat dari ekstrak propolis Trigona spp hasil freeze-dryng yang dilarutkan dalam propilen glikol. Propilen glikol merupakan salah satu pelarut yang biasa digunakan untuk melarutkan propolis di dalam dunia farmasi dan industri kosmetik (Tosi et al. 1996). Penggunaan pelarut glikol untuk melarutkan propolis, juga mempengaruhi kekuatan antimikroba propolis, terutama dalam menghambat pertumbuhan fungi (Castaldo et al. 2002).
Uji aktivitas antibakteri dan uji Konsentrasi Hambat Tumbuh Minimum (KHTM) bakteri dengan menggunakan bahan alam propolis Trigona spp asal
Pandeglang terhadap beberapa jenis bakteri telah dilakukan terdahulu oleh
Angraini (2006) dan Lasmayanty (2007). Daya hambat pertumbuhan bakteri uji
ditunjukkan dengan terbentuknya daerah bening (zona bening) di sekitar lubang
penempatan zat uji. Besarnya daya hambat ekstrak propolis terhadap pertumbuhan
bakteri ditentukan melalui pengukuran diameter zona bening (Lampiran 11)
sebagai rata-rata diameter zona bening di sekitar sumur difusi, (Lampiran 9). Dari tiga kali perlakuan pengujian aktivitas antibakteri propolis Trigona spp, hasil rata-rata diameter zona bening terangkum dalam dalam Tabel 4 .
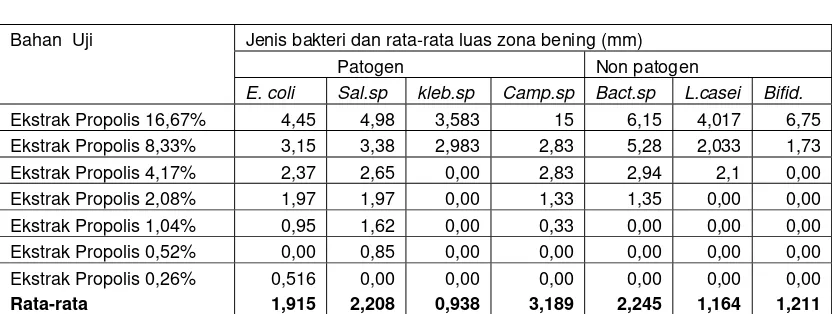
Tabel 4, Hasil Uji aktivitas antibakteri dan penentuan KHTM ekstrak propolis terhadap beberapa bakteri usus sapi.
Bahan Uji Jenis bakteri dan rata-rata luas zona bening (mm)
Keterangan : Sal. sp = bakteri salmonella sp, Kleb.sp = bakteri klebsiella sp. Camp.sp = bakteri Campylobacter sp, Bact.sp = bakteri Bacteroides sp, L. casei = bakteri Lactobacillus casei, Bifid = bakteri Bifidum. Superskrip (a-f) yang berbeda pada kolom yang sama, menunjukkan perbedaan nyata (P<0,05) antar jenis sampel.
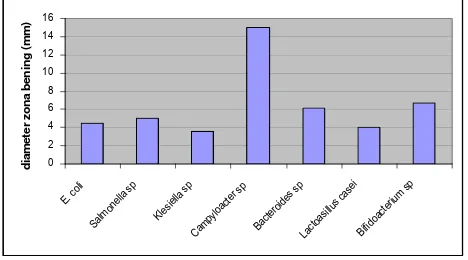
Gambar 10. Grafik daya hambat pertumbuhan bakteri oleh propolis Trigona spp asal Pandeglang pada konsentrasi 16,67%
Pada konsentrasi propolis 0,26% (konsentrasi terendah), daya hambat hanya dialami oleh bakteri E.coli. Pada konsentrasi propolis yang rendah ini, bakteri yang lain tidak mengalami hambatan pertumbuhan (ditunjukkan oleh zona bening 0,00 mm). Dari Tabel 4, terlihat pula bahwa pada konsentrasi propolis 0,26% mampu menghambat pertumbuhan bakteri E. coli, sedangkan pada konsentrasi yang lebih tinggi di atasnya (0,52%) tidak terjadi daya hambat (diameter zona bening 0,00 mm). Hal ini merupakan suatu penyimpangan dan galat pekerjaan, yang diduga disebabkan oleh tiga kemungkinan. Pertama, media agar cair yang ditambahkan ke dalam cawan petridish untuk dicampurkan dengan biakan bakteri, suhunya masih relatif tinggi, sehingga memungkinkan terjadinya kematian pada bakteri uji. Kedua adalah media padat cair yang ditambahkan ke dalam cawan petridish untuk dicampurkan dengan biakan bakteri, suhunya dingin dan menyebabkan media memadat. Dengan demikian, pencampuran dengan biakan bakteri tidak merata, terutama pada daerah sekitar sumur difusi tempat penempatan larutan propolis berkadar 0,52%. Kemungkinan ketiga adalah kurangnya volume larutan propolis 0,52% yang dimasukkan ke dalam sumur difusi. Namun demikian, secara keseluruhan terlihat bahwa kecenderungan daya hambat pertumbuhan bakteri semakin besar dengan naiknya konsentrasi propolis. Hasil analisis statistik untuk data-data pada Tabel 4, menunjukkan bahwa diameter zona bening antar bakteri maupun antar konsentrasi ekstrak propolis Trigona spp asal Pandeglang, berbeda nyata (P<0,05; Lampiran 10) .
Tabel 5., Rata-rata daya hambat Tumbuh Propolis Trigona spp asal Pendeglang terhadap bakteri patogen dan non patogen usus sapi.
Bahan Uji Jenis bakteri dan rata-rata luas zona bening (mm)
Patogen Non patogen
E. coli Sal.sp kleb.sp Camp.sp Bact.sp L.casei Bifid.
Ekstrak Propolis 16,67% 4,45 4,98 3,583 15 6,15 4,017 6,75
Ekstrak Propolis 8,33% 3,15 3,38 2,983 2,83 5,28 2,033 1,73
Ekstrak Propolis 4,17% 2,37 2,65 0,00 2,83 2,94 2,1 0,00
Ekstrak Propolis 2,08% 1,97 1,97 0,00 1,33 1,35 0,00 0,00
Ekstrak Propolis 1,04% 0,95 1,62 0,00 0,33 0,00 0,00 0,00
Ekstrak Propolis 0,52% 0,00 0,85 0,00 0,00 0,00 0,00 0,00
Ekstrak Propolis 0,26% 0,516 0,00 0,00 0,00 0,00 0,00 0,00
Rata-rata 1,915 2,208 0,938 3,189 2,245 1,164 1,211
Keterangan : E. coli = bakteri E. coli., Sal sp = Bakteri salmonella sp., Kleb. Sp = Bakteri Klebsiella sp., Camp. Sp = bakteri Campylobacter sp., Bact. Sp = bakteri Bacteroides sp., L. casei = bakteri Lactobacilus casei., Bifid = bakteri Bifidum sp
Hambat tumbuh yang dialami bakteri E. coli, Salmonella sp dan Campylobakter pada konsentrasi ekstrak propolis yang rendah ini, diduga berkaitan erat dengan sifat khasiat propolis dan perbedaan komposisi struktur dinding sel bakteri. Ketiga jenis bakteri tersebut di atas tergolong bakteri Gram negatif, dan merupakan anggota dari bakteri patogen. Karena merupakan kelompok bakteri Gram negatif, maka struktur dinding sel ketiga bakteri tersebut lebih kompleks dengan beberapa lapisan, yakni peptidoglikan yang relatif tipis, yang dikelilingi oleh lapisan lipoprotein, lipopolisakarida, fosfolipid dan beberapa protein. Lapisan-lapisan ini bersifat impermiable terhadap molekul-molekul kecil seperti nukleosida, oligosakarida dan asam amino (Timotius, 1982). Dengan teori ini, maka seharusnya ketiga bakteri kelompok Gram negatif tersebut lebih bertahan terhadap infiltrasi propolis yang menyebabkan lisis sel, jika dibandingkan dengan bakteri Gram positif.
pada khususnya. Polimiksin berinteraksi kuat dengan fospholipid membran sel, mengakibatkan kehilangan kontrol osmotik, sehingga terjadi kebocoran ion K+ dan komponen vital bakteri lainnya. Penetrasinya ke dalam menjadi mudah dan merusak struktur membran sel. Kerja antibiotik jenis ini adalah merusak membran sel setelah bereaksi dengan fosfat pada fosfolipid membran sel (Simanjuntak 2005).
Propolis Trigona spp asal Pandeglang tampak lebih aktip dan sensitif terhadap beberapa bakteri Gram negatip dalam penelitian ini. Hal ini dapat terjadi karena adanya interaksi komponen-komponen senyawa aktif dalam propolis terhadap fosfat pada fosfolipid membran sel bakteri-bakteri tersebut. Sesuai dengan sifat yang dimiliki oleh antibiotik jenis polimiksin atau streptomiksin, maka penetrasi komponen senyawa aktif dari propolis lebih cepat mencapai membran sel bakteri Gram negatif, sebab lapisan peptidoglikan penyusun dinding sel bakteri kelompok tersebut lebih tipis daripada yang dimiliki bakteri Gram positif.
Dari Tabel 5 diperoleh informasi pula bahwa kemampuan hambat tumbuh minimum dari ekstrak propolis Trigona spp asal Pandeglang, lebih dominan terhadap kelompok bakteri patogen. Rata-rata besarnya daya hambat yang dialami oleh bakteri patogen dalam penelitian ini adalah sebesar 2,75 mm, sedangkan untuk bakteri non patogen adalah sebesar 1,54 mm. Dari segi konsentrasi minimum dosis propolis, kelompok bakteri patogen telah terlebih dahulu dihambat pertumbuhannya. Dengan demikian, dapat dikatakan bahwa untuk menyeimbangkan populasi mikroflora usus sapi, maka dosis propolis Trigona spp asal Pandeglang yang dapat layak diberikan, adalah pada konsentrasi 0,52% sampai 1,04%, dengan konsentrasi optimum adalah 1,04%. Keseimbangan mikroflora di dalam usus sapi, tercapai bilamana populasi bakteri non patogen lebih dominan. Sebab, bakteri-bakteri ini berperan memproduksi enzim-enzim pencernaan, yang membantu proses pencernaan makanan (Lestradet, 1994).
promoters) hewan sapi. Penggunaan propolis sebagai pemacu pertumbuhan hewan, merupakan pilihan yang aman. Sebab propolis tidak bersifat toksik, namun sebaliknya memiliki daya antibakteri, antivirus dan antifungi yang efektif (Nuklin et al. 1979). Selain sebagai bahan antibakteri, propolis juga memiliki sifat dapat merangsang sistem imunitas secara alamiah. Hal ini merupakan suatu hal yang berbeda dari efek yang diberikan oleh obat-obatan sintetik.
Hasil analisis Fitokimia Ekstrak Kasar Propolis.
Analisis fitokimia propolis bertujuan untuk mengetahui secara kualitatif golongan senyawa-senyawa aktif di dalam ekstrak kasar propolis sampel. Identifikasi yang dilakukan adalah uji tanin, uji terpenoid, uji alkaloid dan uji flavonoid (senyawa-senyawa aktif yang ada pada tumbuhan). Langkah ini dilakukan dengan dasar pemahaman bahwa propolis pada sarang lebah merupakan resin yang berasal dari tumbuh-tumbuhan. Hasil uji fitokimia sampel propolis dari sarang lebah madu Trigona spp asal Pandeglang dibandingkan dengan bahan lain adalah seperti pada Lampiran 12 .
Tabel 6. Hasil Analisis Fitokimia
Senyawa Hasil
Sampel propolis Pembanding
Tanin + Air teh +
Flavonoid + Buah pinang +
steroid + Kuning telur +
Alkaloid - Daun papaya +
Analisis fitokimia terhadap bahan propolis yang sama telah dilakukan pada penelitian terdahulu oleh Angraini (2006) dan Lasmayanty (2007). Adapun kesamaan dan perbedaan hasil uji, terangkum dalam Tabel 7.
Tabel 7. Persamaan dan perbedaan hasil analisis fitokimia propolis Trigona spp asal Pandeglang.
Peneliti (tahun) Tanin Flavonoid Steroid Alkaloid
Angraini (2006)
Koleksi propolis; Maret 2006 √ √ √ -
Lasmayanty (2007)