GAMMA TERHADAP CEKAMAN KEKERINGAN
MELALUI SIMULASI POLY-ETHYLENE GLYCOL
(PEG)
TENDY WIJIASTUTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul Toleransi Beberapa Klon Jeruk Keprok Garut (Citrus reticulata L.) Hasil Iradiasi Sinar Gamma terhadap Cekaman Kekeringan Melalui Simulasi Poly-ethylene Glycol (PEG) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2016
Tendy Wijiastuti
TENDY WIJIASTUTI. Toleransi Beberapa Klon Jeruk Keprok Garut (Citrus reticulata L.) Hasil Iradiasi Sinar Gamma terhadap Cekaman Kekeringan Melalui Simulasi Polyethylene Glycol (PEG). Dibimbing oleh AGUS PURWITO, ALI HUSNI dan KIKIN HAMZAH MUTAQIN
Jeruk keprok Garut merupakan salah satu komoditas pertanian unggulan nasional yang perlu terus dipertahankan dan ditingkatkan kualitas maupun kuantitas produksinya. Jeruk keprok Garut memiliki daging buah yang lunak, lembut dan banyak mengandung air. Rasanya manis agak masam yang segar, dan beraroma khas, karena bijinya sedikit, jeruk ini banyak dinikmati oleh masyarakat sebagai buah segar. Produksi jeruk keprok Garut setelah tahun 1992 mengalami penurunan drastis akibat serangan penyakit CVPD dan ditambah perubahan iklim yang tidak menentu seperti anomali iklim El-Nino yang menyebabkan kemarau yang lebih panjang sehingga tidak selamanya lahan pertanaman ideal untuk pertumbuhan. Cekaman abiotik seperti cekaman kekeringan yang berkepanjangan akibat gejala alam El-Nino turut menjadi faktor pembatas dalam produksi jeruk keprok Garut. Perakitan varietas pengembangan jeruk keprok varietas Garut yang memiliki karakter toleran terhadap cekaman kekeringan dapat dilakukan secara non konvensional melalui induksi mutasi dengan teknik pemaparan radiasi sinar gamma. Karakterisasi secara molekuler menggunakan marka RAPD dilakukan untuk melihat keragaman genetik yang terbentuk.
Klon-klon tersebut diharapkan merupakan mutan putatif dan memiliki karakter morfologi dan fisiologi (toleransi cekaman kekeringan) yang lebih baik dibandingkan tetuanya. Pengujian toleransi cekaman kekeringan dilakukan melalui media simulasi polyethylene glycol (PEG). Setelah diperoleh klon-klon mutan yang memiliki karakter toleran terhadap cekaman kekeringan makan klon-klon tersebut perlu diperbanyak secara klon-klonal in vitro sehingga diperoleh duplikat dari masing-masing mutan. Klonal in vitro biasanya dilakukan dengan cara menggandakan tunas baik melalui jalur embriogenesis somatik maupun organogenesis. Penambahan zat pengatur tumbuh jenis sitokinin thidiazuron (TDZ) pada level konsentrasi tertentu mampu menginduksi multiplikasi tunas. Induksi akar pada tunas-tunas klon mutan putatif hasil multiplikasi tunas dilakukan untuk mempersiapkan kondisi klon-klon mutan putatif toleran terhadap cekaman kekeringan saat proses aklimatisasi.
Penelitian ini bertujuan untuk memperoleh klon-klon jeruk keprok Garut mutan putative yang toleran terhadap cekaman kekeringan. Bahan tanaman yang digunakan adalah klon-klon jeruk keprok Garut hasil iradiasi sinar gamma dan tetuanya. Penelitian ini terdiri dari karakterisasi secara molekuler keragaman genetik menggunakan penanda RAPD, evaluasi toleransi klon-klon jeruk keprok Garut terhadap cekaman kekeringan, multiplikasi tunas menggunakan TDZ kombinasi BAP, dan induksi perakaran menggunakan NAA kombinasi IBA.
memberikan respon cekaman kekeringan yang lebih baik dengan penurunan karakter jumlah daun, tinggi tanaman, kandungan klorofil, dan ukuran stomata (panjang dan lebar stomata, jumlah serta kerapatan stomata) lebih rendah dibandingkan dengan klon lainnya. Multiplikasi tunas menggunakan kombinasi zat pengatur tumbuh jenis sitokinin BAP dan TDZ pada konsentrasi BAP 0.1 mg L-1 dan TDZ 0.2 mg L-1 merupakan konsentrasi yang paling optimum dalam menginduksi tunas klon jeruk keprok Garut mutan. Klon-klon eksplan jeruk keprok Garut mutan hasil radiasi sinar gamma pada dua dosis 50 Gray dan 150 Gray memberikan respon yang berbeda pada setiap konsentrasi TDZ yang ditambahkan ke media kultur. Multiplikasi tunas dengan pemarapan eksplan dalam media kultur yang mengandung TDZ dalam jangka panjang menyebabkan tunas yang muncul menjadi abnormal. Induksi perakaran dipengaruhi oleh interaksi antara klon jeruk keprok Garut mutan dengan empat taraf konsentrasi NAA yang dikombinasikan dengan IBA konsentrasi 3 mg L-1 yang terlihat dari peubah pengamatan (waktu inisiasi akar, panjang akar, tinggi tanaman, dan jumlah tunas). Perlakuan NAA 0.5 mg L-1 kombinasi IBA 3 mg L-1 merupakan konsentrasi yang optimum terhadap induksi perakaran. Hal ini terlihat dari penampilan terbaik untuk peubah pengamatan waktu inisiasi akar dan jumlah akar yang merupakan faktor penting dalam induksi perakaran secara in vitro.
TENDY WIJIASTUTI. Clones Tolerance Tangerines Garut Citrus (Citrus reticulata L.) Mutations Induced by Gamma-Ray against Drought Stress Through Simulation of Polyethylene Glycol (PEG). Supervised by AGUS PURWITO, ALI HUSNI and KIKIN HAMZAH MUTAQIN
Tangerines Garut citrus is one of national main commodity that need to be developed and improved to increase quality and quantity of production. Tangerines Garut citrus characteristic is fleshy, soft and high water content. It slightly sour sweet with fresh taste, flavorful typical, and less seed. Many fruit consumer is prefer this citrus because of those good tangerine Garut citrus characteristics. Garut tangerine production was decreasing dramatically after 1992 due to disease (CVPD or Huanglobngbing/HLB) and abiotic stresses (drought) as an impact of natural phenomenon El Nino. Those also become a limiting factor in tangerines Garut citrus production. Developing of Garut tangerine varieties with drought tolerant characteristics can possibly be achieved by gamma irradiation. Molecular characterization using RAPD markers was conducted to analyzed the genetic diversity formed.
Those of irradiated clones that expected to be putative mutant and has morphological characters and physiological (drought stress tolerant) better than its wild type. Drought stress tolerance was conducted by simulation in in vitro
condition by using polyethylene glycol (PEG) on the medium. The irradiated clones which belonging characters of drought stress tolerant were propagated clonally by in vitro for increasing the planlet number. In vitro micropropagation was conducted through somatic embryogenesis and organogenesis for producing shoot multiplication. Thidiazuron (TDZ) on the medium was effective in inducing shoot multiplication. Root induction of putative mutant clones were conducted to provide drought stress during acclimatization process.
The objective of this study was to obtain clones with drought tolerant which resulted from gamma ray irradiation. Bot of irradiated tangerines Garut citrus clones and the wild type were used separately for molecular characterization to analyze genetic diversity by using RAPD, evaluation of tangerines Garut citrus to drought stress, shoot multiplication and root induction by using TDZ + BAP and NAA + IBA, respectively.
interaction between tangerine Garut citrus mutant clones and four level concentrations of NAA combined with 3 mg L-1 IBA, as showed from observation variables (time of initiation root, root length, plant height, and number of buds). Treatment of 0.5 mg L-1 NAA with combination of 3 mg L-1 IBA was the optimum concentration for root induction. That combination resulted in high performances for root initiation time and number of roots which is an important factor in in vitro
root induction.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tidak merugikan kepentingan IPB
GAMMA TERHADAP CEKAMAN KEKERINGAN
MELALUI SIMULASI POLY-ETHYLENE GLYCOL
(PEG)
TENDY WIJIASTUTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nya sehingga penelitian dan karya tulis ilmiah ini dapat diselesaikan.Penelitian dengan judul Toleransi Beberapa Klon Jeruk Keprok Garut (Citrus reticulata L.) Hasil Iradiasi Sinar Gamma terhadap Cekaman Kekeringan melalui Simulasi
Poly-Ethylene Glycol (PEG) telah terlaksana dengan baik atas dukungan dari banyak pihak.
Ucapan terima kasih dan penghargaan yang sebesar-besarnya penulis sampaikan kepada:
1. Dr. Ir. Agus Purwito MSc. Agr, Dr. Ir. Ali Husni, MSi, dan Dr. Ir. Kikin Hamzah Mutaqin, MSi yang telah banyak memberikan pengarahan serta bimbingan sejak awal penelitian hingga penulisan tesis.
2. Badan Penyuluhan dan Pengembangan SDM Pertanian, Kementerian Pertanian RI selaku penyelenggara beasiswa Kementan TA. 2012 yang telah membiayai selama masa tugas belajar dan membiayai sebagian dana penelitian.
3. Kepala Balai Besar Pengembangan Pengujian Mutu Benih Tanaman Pangan dan Hortikultura yang telah memberikan izin tugas belajar dan dukungan selama penelitian.
4. Kepada pihak-pihak yang telah banyak membantu penelitian: Ibu Juariah selaku teknisi Laboratorium Kultur Jaringan Tanaman 1, Bapak Joko selaku teknisi Laboratorium Mikro Teknik, Ibu Sri Budiarti selaku penyelia Laboratorium Verifikasi Keaslian Varietas Balai Besar Pengembangan Pengujian Mutu Benih Tanaman Pangan dan Hortikultura, serta rekan-rekan di laboratorium yaitu Atika, Kawakibi, dan Bu Indriati.
5. Keluarga suami tercinta Trio Witarko dan kedua malaikat kecilku (Ayesha dan Farrasah) atas pengertian dan dukungannya serta sumber inspirasi bagi penulis, serta oang tua tercinta Mama Sudarsinah yang selalu mendukung dan mendoakan penulis.
6. Seluruh teman-teman mahasiswa pascasarjana program studi Pemuliaan dan Bioteknologi Tanaman tahun 2012 yang telah membantu baik secara langsung maupun tidak langsung melalui diskusi-diskusi dan masukannya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2016
Latar Belakang 1
Tujuan 2
Hipotesis 3
Kerangka Pemikiran 3
2 TINJAUAN PUSTAKA 4
3 KARAKTERISASI MOLEKULER KERAGAMAN GENETIK KLON-KLON JERUK KEPROK GARUT (Citrus reticulata L.) HASIL IRADIASI SINAR GAMMA MENGGUNAKAN PENANDA RAPD (RANDOM AMPLIFIED POLYMORPHIC DNA)
Abstrak 12
Pendahuluan 13
Bahan dan Metode 14
Hasil dan Pembahasan 16
Simpulan 22
4 TOLERANSI KLON JERUK KEPROK (Citrus reticulata L.) MUTAN PUTATIF TOLERAN TERHADAP CEKAMAN KEKERINGAN MELALUI SIMULASI POLY-ETHYLENE GLYCOL (PEG)
Abstrak 23
Pendahuluan 24
Bahan dan Metode 25
Hasil dan Pembahasan 27
Simpulan 36
5 MULTIPLIKASI TUNAS JERUK KEPROK GARUT (Citrus reticulata L.) MUTAN PUTATIF MENGGUNAKAN SITOKININ THIDIAZURON (TDZ)
Abstrak 37
Pendahuluan 38
Bahan dan Metode 39
Hasil dan Pembahasan 40
Simpulan 47
6 INDUKSI AKAR JERUK KEPROK GARUT (Citrus reticulata L.)
MUTAN PUTATIF MENGGUNAKAN AUKSIN α-NAPHTALENAACETIC ACID (NAA), INDOLE-3-BUTYRIC ACID (IBA)
Abstrak 48
Pendahuluan 49
Bahan dan Metode 49
Hasil dan Pembahasan 50
Simpulan 57
PEMBAHASAN UMUM 58
KESIMPULAN UMUM 62
DAFTAR PUSTAKA 63
LAMPIRAN 70
2. Kode dan sekuen 15 primer acak (10-mer) Operon yang digunakan dalam studi keragaman genetik klon-klon jeruk keprok Garut mutan
putatif hasil iradiasi sinar gamma 16
3. Penampilan PCR 15 primer pada 19 klon jeruk keprok Garut mutan
putatif 17 4. Hasil penghitungan jumlah produk amplifikasi 18 klon jeruk keprok
Garut mutan putatif dan wild type menggunakan penanda RAPD 18 5. Rekapitulasi sidik ragam pengaruh klon jeruk keprok Garut mutan
putatif dan konsentrasi PEG terhadap toleransi cekaman kekeringan
pada akhir pengamatan (8 MST) 27
6. Pengaruh konsentrasi PEG terhadap pertambahan jumlah daun lima klon jeruk keprok Garut mutan putatif pada akhir pengamatan
(8 MST) 29
7. Pengaruh konsentrasi PEG terhadap pertambahan tinggi tunas pada
akhir pengamatan (8 MST) jeruk keprok Garut mutan putatif 30 8. Kandungan klorofil kelima klon jeruk keprok Garut mutan putatif
pada empat taraf konsentrasi PEG pada media cair 32 9. Ukuran stomata kelima klon jeruk keprok Garut mutan putatif pada
empat taraf konsentrasi PEG 35
10. Persentase efisiensi pertunasan tiga klon jeruk keprok Garut mutan
putatif pada empat taraf konsentrasi TDZ 40
11. Respon tiga klon jeruk keprok Garut mutan putatif terhadap empat
taraf konsentrasi TDZ kombinasi BAP pada umur 10 MSSK 42 12. Rata-rata tinggi tanaman dari setiap klon jeruk keprok Garut mutan
putatif dan konsentrasi TDZ yang diujikan 46
13. Pengaruh auksin tunggal (IBA) dan kombinasi (IBA dan NAA)
terhadap persentase perakaran jeruk keprok Garut mutan putatif 51 14. Respon interaksi antara tiga klon jeruk keprok Garut mutan putatif
dengan empat taraf konsentrasi NAA kombinasi IBA pada umur 8
MST terhadap waktu inisiasi akar (hari) 52
15. Respon interaksi antara tiga klon jeruk keprok Garut mutan putatif dengan empat taraf konsentrasi NAA kombinasi IBA pada umur 8
MST terhadap panjang akar (cm) 53
16. Respon interaksi antara tiga klon jeruk keprok Garut mutan putatif dengan empat taraf konsentrasi NAA kombinasi IBA pada umur 8
MST terhadap tinggi tunas (cm) 54
17. Respon interaksi antara tiga klon jeruk keprok Garut mutan putatif dengan empat taraf konsentrasi NAA kombinasi IBA pada umur 8
MST terhadap jumlah tunas 55
18. Respon tiga klon jeruk keprok Garut mutan putatif terhadap empat taraf konsentrasi NAA kombinasi IBA pada umur 8 MST terhadap
jumlah akar dan jumlah daun 55
19. Nilai korelasi pertumbuhan akar dengan pertumbuhan tunas klon
keprok Garut mutan putatif (Citrus reticulata L.) hasil iradiasi sinar
gamma dan toleransi terhadap cekaman kekeringan 3 2. Pola pita DNA klon jeruk keprok Garut mutan putatif hasil amplifikasi
DNA menggunakan penanda RAPD primer OPA 02 (A), OPA 13 (B)
dan OPN 14 (C) 19
3. Pola pita DNA klon jeruk keprok Garut mutan putatif hasil amplifikasi DNA menggunakan penanda RAPD OPN 15 (A), OPN 16 (B), OPF 14
(C) dan OPZ 10 (D) 20
4. Keragaman genetik 18 klon jeruk keprok Garut mutan putatif dan klon
wild type berdasarkan data gabungan penanda RAPD dengan primer
OPA 13, OPN 14, OPN 15 dan OPZ 10 21
5. Kondisi kultur in vitro tunas klon KG 0 perlakuan cekaman kekeringan
empat konsentrasi PEG pada 2 MST 27
6. Pertambahan jumlah daun klon jeruk keprok Garut mutan putatif pada
empat konsentrasi PEG pada akhir pengamatan (8 MST) 29 7. Kandungan klorofil klon jeruk keprok Garut KG 0 dan KG 13 pada
empat taraf konsentrasi PEG 31
8. Anatomi stomata klon jeruk keprok Garut mutan putatif pada empat
taraf konsentrasi PEG 34
9. Pertumbuhan keempat klon jeruk keprok Garut mutan putatif dan tetua
pada kondisi cekaman kekeringan simulasi PEG 6000 (20% dan 30%) 36 10. Multiplikasi tunas klon jeruk keprok Garut mutan putatif pada media
MW perlakuan TDZ kombinasi BAP 0.1 mg L-1, a) tanpa TDZ atau
kontrol, b) TDZ 0.1 mg L-1, c) TDZ 0.2 mg L-1, d) TDZ 0.3 mg L-1 41 11. Pertumbuhan tunas klon jeruk keprok Garut mutan putatif pada media
MW perlakuan TDZ kombinasi BAP 0.1 mg L-1, a) tanpa TDZ atau
kontrol,b) TDZ 0.1 mg L-1, c) TDZ 0.2 mg L-1,d) TDZ 0.3 mg L-1 44 12. Penampakan irisan melintang tunas hasil multiplikasi tunas dengan
empat konsentrasi TDZ yang dikombinasikan dengan BAP 0.1 mg L-1 a) tanpa TDZ atau kontrol, b) TDZ 0.1 mg L-1, c) TDZ 0.2 mg L-1, d) TDZ 0.3 mg L-1 pada tiga klon jeruk keprok Garut mutan putatif 45 13. Pembentukan perakaran eksplan jeruk keprok Garut mutan putatif pada
beberapa media yang ditambahkan IBA 3 mg L-1 dan beberapa
konsentrasi NAA 51
14. Morfologi pertumbuhan akar dan pertumbuhan tunas klon jeruk keprok Garut mutan putatif pada beberapa taraf konsentrasi NAA kombinasi
IBA 3 mg L-1 57
DAFTAR LAMPIRAN
1. Media Dasar Murashige dan Skoog (MS) dengan Vitamin Morel dan
Wetmore (MW) 70
1
PENDAHULUAN
Latar Belakang
Jeruk keprok (Citrus reticulata L.) di Indonesia merupakan jeruk yang paling popular dan banyak dikonsumsi sebagai buah segar dengan rasa manis asam segar. Indonesia memiliki beragam jeruk keprok varietas unggul lokal yang berkualitas. Jenis jeruk keprok tersebut antara lain jeruk keprok Batu 55 (Kab. Malang Jawa Timur), Brastepu (Kab.Karo Sumatera Utara), Soe (NTT), Madura (Kab. Pamengkasan Madura), Gayo (NAD), Terigas (Kab. Sambas Kalimantan Barat), Borneo prima (Kalimantan Timur), Selayar (Pulau Selayar Sulawesi Selatan), Garut (Kab. Garut Jawa Barat), Kacang Solok (Kab. Solok Sumatera Barat), Siompu (Pulau Buton Sulawesi Tenggara), Tejakula (Kab. Buleleng Bali), dan Gergo lebong (Kab. Lebong) (Balitbangtan 2012).
Jeruk keprok Garut merupakan salah satu komoditas pertanian unggulan nasional yang perlu terus dipertahankan dan ditingkatkan kualitas maupun kuantitas produksinya. Jeruk keprok Garut memiliki daging buah yang lunak, lembut dan banyak mengandung air. Rasanya manis agak masam yang segar, dan beraroma khas, karena bijinya sedikit, jeruk ini banyak dinikmati oleh masyarakat sebagai buah segar (Balitbangtan 2012). Produksi jeruk keprok pada tahun 2014 adalah 1 785 264 ton dan lebih rendah dibandingkan tahun 2010 yaitu 1 937 773 ton atau mengalami penurunan sebanyak 8.54% (BPS 2015). Salah satu penyebab penurunan adalah kekeringan yang disebabkan oleh perubahan iklim atau El Nino yang menyebabkan terjadinya kemarau panjang sehingga tidak selamanya lahan pertanaman ideal untuk pertumbuhan. Di Indonesia tanaman ini sangat memerlukan air yang cukup terutama di bulan Juli-Agustus, dimana pada bulan tersebut pada umumnya merupakan periode terjadinya perkembangan bunga dan buah (Balitbangtan 2012). Kekeringan menyebabkan buah jeruk yang telah terbentuk menjadi keriput, tanaman mati, dan serangan hama penyakit sehingga menurunkan produksi pertanaman jeruk.
Perakitan varietas pengembangan klon jeruk keprok varietas Garut toleran terhadap cekaman kekeringan dan dapat dilakukan secara konvensional melalui persilangan, dan secara non konvensional melalui induksi mutasi dengan teknik pemaparan radiasi sinar gamma. Pada tahun 2013 telah dilakukan induksi mutasi dengan teknik iradiasi sinar gamma dengan beberapa dosis yaitu 20-200 Gray (Karyanti et al. 2015) dan menghasilkan klon-klon yang tetap tumbuh hingga generasi M1V4 sehingga diperlukan karakterisasi secara molekuler untuk melihat keragaman genetik yang terbentuk. Penanda molekuler Random Amplified Polymorphic DNA (RAPD) dapat diandalkan untuk mendeteksi sekuen nukleotida yang polimorfis dengan bantuan mesin PCR (polymerase chain reaction) menggunakan sebuah primer tunggal (10-mer) RAPD.
klon-klon tersebut perlu diperbanyak secara klon-klonal in vitro sehingga diperoleh duplikat dari masing-masing mutan. Klonal in vitro biasanya dilakukan dengan cara menggandakan tunas baik melalui jalur embriogenesis somatik maupun organogenesis. Penambahan zat pengatur tumbuh jenis sitokinin thidiazuron (TDZ) pada level konsentrasi tertentu mampu menginduksi multiplikasi tunas.
Induksi akar pada tunas-tunas klon mutan putatif hasil multiplikasi tunas dilakukan untuk mempersiapkan kondisi klon-klon mutan putatif toleran terhadap cekaman kekeringan saat proses aklimatisasi. Penambahan IBA atau NAA ke dalam media MS berpengaruh terhadap waktu inisiasi, jumlah, panjang dan karakteristik akar piretum klon Prau 6 (Rostiana dan Seswita 2007). Penambahan IBA dengan konsentrasi 3 mgL-1 mampu meningkatkan persentasi pembentukan akar sekunder sebesar 86% dan tingkat keberhasilan aklimatisasi planlet terbaik pada eksplan jeruk keprok Batu 55 (Merigo 2011).
Tujuan
Tujuan penelitian ini adalah sebagai berikut:
1. Mendapatkan informasi keragaman genetik klon-klon hasil induksi mutasi melalui sinar gamma yang dapat dimanfaatkan untuk evaluasi toleransi kekeringan berdasarkan analisis RAPD.
2. Mendapatkan mutan jeruk keprok Garut yang memiliki karakter toleran terhadap cekaman kekeringan.
3. Mendapatkan konsentrasi TDZ yang dikombinasikan dengan BAP 0.1 mg L-1 dalam media pertumbuhan in vitro optimal untuk multiplikasi tunas mutan jeruk keprok Garut.
4. Mendapatkan konsentrasi NAA dikombinasikan dengan IBA yang optimal dalam media pertumbuhan in vitro untuk menginduksi akar mutan jeruk keprok Garut.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah sebagai berikut:
1. Terdapat keragaman genetik klon-klon hasil induksi mutasi melalui sinar gamma yang dapat dimanfaatkan untuk evaluasi toleransi kekeringan berdasarkan analisis penanda RAPD.
2. Terdapat mutan jeruk keprok Garut yang memiliki karakter toleran terhadap cekaman kekeringan
3. Terdapat satu konsentrasi TDZ yang dikombinasikan dengan BAP 0.1 mg L-1 dalam media pertumbuhan in vitro optimal untuk multiplikasi tunas mutan jeruk keprok Garut.
4. Terdapat satu konsentrasi NAA dikombinasikan dengan IBA yang optimal dalam media pertumbuhan in vitro untuk menginduksi akar mutan jeruk keprok Garut.
Kerangka Pemikiran
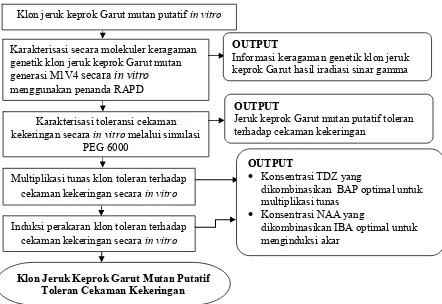
hutan secara tidak terkendali menyebabkan ketersediaan air tanah mengalami penurunan secara drastik dan tanaman jeruk menghadapi cekaman kekeringan terutama saat musim kemarau menjadi salah satu faktor pembatas terhadap peningkatan produktivitas jeruk keprok Garut. Penggunaan bibit varietas yang toleran terhadap cekaman kekeringan merupakan teknik yang efisien dan efektif dalam mengatasi keterbatasan tersebut. Perakitan varietas jeruk toleran terhadap cekaman kekeringan dapat dilakukan dengan induksi mutasi melalui pemaparan radiasi sinar gamma pada populasi kalus embriogenik sehingga diperoleh mutan-mutan putatif.
Karakterisasi secara molekuler keragaman genetik klon jeruk keprok Garut hasil iradiasi sinar gamma diperlukan untuk melihat keragaman genetik yang terbentuk. Karakterisasi toleransi terhadap cekaman kekeringan dilakukan secara
in vitro melalui simulasi poly-ethylene glycol (PEG) 6000 pada beberapa taraf konsentrasi. Mutan-mutan putatif jeruk keprok Garut yang diperbanyak dengan teknik kultur jaringan atau secara in vitro melalui embriogenesis somatik menghasilkan mutan solid. Media perbanyakan secara kultur jaringan dengan menambahkan zat pengatur tumbuh jenis sitokinin dan auksin dapat meningkatkan aktivitas multiplikasi tunas dan induksi perakaran. Skema kerangka pemikiran tersaji pada Gambar 1.
Gambar 1. Skema kerangka pemikiran penelitian karakterisasi genetik jeruk keprok Garut mutan putatif (Citrus reticulata L.) hasil iradiasi sinar gamma dan toleransi terhadap cekaman kekeringan
Klon Jeruk Keprok Garut Mutan Putatif Toleran Cekaman Kekeringan
Klon jeruk keprok Garut mutan putatifin vitro
Karakterisasi toleransi cekaman kekeringan secara in vitro melalui simulasi
PEG 6000
OUTPUT
Jeruk keprok Garut mutan putatif toleran terhadap cekaman kekeringan
Multiplikasi tunas klon toleran terhadap cekaman kekeringan secara in vitro
Induksi perakaran klon toleran terhadap cekaman kekeringan secara in vitro
OUTPUT
Konsentrasi TDZ yang
dikombinasikan BAP optimal untuk multiplikasi tunas
Konsentrasi NAA yang
dikombinasikan IBA optimal untuk menginduksi akar
Karakterisasi secara molekuler keragaman genetik klon jeruk keprok Garut mutan generasi M1V4 secara in vitro
menggunakan penanda RAPD
OUTPUT
2 TINJAUAN PUSTAKA
Jeruk Keprok
Buah jeruk menjadi salah satu buah yang sangat diminati oleh masyarakat Indonesia. Diantaranya yang paling popular adalah jeruk keprok (mandarin) yang dikonsumsi sebagai buah segar. Jeruk keprok rasanya manis asam, segar, kandungan vitamin C dan A yang cukup tinggi, harga relatif murah, dan mudah didapat dimana dan kapan saja diseluruh pelosok negeri.
Menurut Hodgson (1967) tanaman jeruk yang penting secara komersial dapat dikelompokkan menjadi empat kelompok yaitu orange (jeruk manis),
mandarin (jeruk keprok), pummel (jeruk besar), dan grapefruit, serta kelompok
common acid yang terdiri dari citron, lemon dan lime. Taksonomi tanaman jeruk keprok menurut Swingle dan Reece (1967) dalam Oritz (2002) adalah sebagai berikut:
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledonae
Ordo : Rutales
Famili : Rutaceae
Subfamili : Aurantiodeae
Genus : Citrus
Spesies : Citrus reticulata/nobilis L.
Jeruk keprok (Citrus reticulata L.) di Indonesia merupakan jeruk yang paling popular dan banyak dikonsumsi sebagai buah segar dengan rasa manis. Indonesia memiliki beragam jeruk keprok varietas unggul lokal yang berkualitas. Jenis jeruk keprok tersebut antara lain jeruk keprok Batu 55 (Kab.Malang Jawa Timur), Brastepu (Kab.Karo Sumatera Utara), Soe (NTT), Madura (Kab. Pamengkasan Madura), Gayo (NAD), Terigas (Kab. Sambas Kalimantan Barat), Borneo prima (Kalimantan Timur), Selayar (Pulau Selayar Sulawesi Selatan), Garut (Kab. Garut Jawa Barat), Kacang Solok (Kab. Solok Sumatera Barat), Siompu (Pulau Buton Sulawesi Tenggara), Tejakula (Kab. Buleleng Bali), dan Gergo lebong (Kab. Lebong) (Balitbangtan 2012).
hijau muda, dan kuning orange. Tekstur kulitnya mengkilat, licin, penuh pori-pori dan sedikit berbau harum. Daging buahnya berwarna orange, banyak mengandung air dengan rasa manis sedikit asam. Tiap ruang atau septa buah mengandung banyak biji, dan mudah dipisah-pisahkan (Sarwono 1994).
Pemuliaan Mutasi Tanaman Jeruk
Pemuliaan tanaman (plant breeding) adalah perpaduan antara seni (art) dan ilmu (science) dalam merakit keragaman genetik suatu populasi tanaman tertentu menjadi lebih baik atau unggul dari sebelumnya (Chahal dan Gosal 2003). Tujuan dari kegiatan pemuliaan tanaman yaitu menghasilkan varietas tanaman dengan sifat-sifat yang sesuai dengan sistem budidaya yang ada dan tujuan ekonomi yang diinginkan. Teknik pemuliaan tanaman dalam rangka meningkatkan keragaman genetik dapat dilakukan melalui beberapa cara yaitu introduksi tanaman dari luar wilayah, persilangan atau hibridisasi dua spesies, rekayasa genetika dengan memasukkan gen yang diinginkan ke dalam sel tanaman, dan melalui teknik mutasi dengan menggunakan mutagen (Syukur et al. 2012). Pemuliaan tanaman dengan teknik mutasi merupakan salah
satu cara untuk meningkatkan keragaman genetik karakter tertentu pada tanaman dengan mempertahankan suatu sifat yang kompleks seperti halnya kualitas good eating dalam suatu varietas yang memerlukan perbaikan hanya pada satu karakter saja yang diturunkan dan untuk mengembangkan suatu metode dalam mendapatkan tunas-tunas atau tanaman yang dihasilkan dari hanya satu sel (Suminar et al. 2009). Pemuliaan mutasi secara nyata dapat meningkatkan keragaman genetik pada tanaman yang diperbanyak secara vegetatif atau apomiksis (Sleper dan Poehlman 2006).
Mutasi adalah perubahan pada struktur dan atau komposisi genetik yang terjadi secara tiba-tiba, tidak terarah atau secara acak, dan terwariskan (heritable) ke generasi berikutnya. Mutasi dapat terjadi pada setiap fase pertumbuhan tanaman dan pada setiap bagian tanaman, namun lebih banyak terjadi pada fase dan bagian yang sedang aktif melakukan pembelahan seperti tunas dan biji (Soeranto 2012). Beberapa faktor yang mempengaruhi keberhasilan program pemuliaan mutasi antara lain pemilihan mutagen, metode aplikasi, dosis yang digunakan, regenerasi atau pertumbuhan tanaman tersebut, bagian tanaman yang digunakan dan teknik seleksi pada generasi berikutnya (Van Harten 1998). Aplikasi pemuliaan mutasi menggunakan teknik iradiasi sinar gamma saat ini telah banyak digunakan dengan tujuan untuk meningkatkan kualitas buah jeruk. Pemberian iradiasi sinar gamma dosis 20-40 Gray pada tunas aksilar dan jeruk besar asli Indonesia menghasilkan buah tanpa biji (Sutarto et al. 2009). Pemberian iradiasi sinar gamma dosis 2o Gray telah menghasilkan tanaman keprok SoE tanpa biji yang telah berumur 3 tahun (Martasari et al. 2005).
Mekanisme Adaptasi terhadap Cekaman Kekeringan
ketika akar tidak mampu menyerap air dalam jumlah yang cukup untuk proses metabolismenya. Tanaman mengalami kekeringan bila laju penyerapan air tanah oleh perakaran tidak dapat mengimbangi laju evaptranspirasi (Levitt 1980). Ketersediaan air dalam tanah bagi tanaman umumnya pada kapasitas lapang dengan potensial air tanah -0.03 MPa hingga layu permanen -1.5 MPa. Ketersediaan air tanah yang dapat diserap tanaman adalah pada potensial air -0.03 sampai -0.5 MPa dan pada kondisi tersebut tanaman mengabsorbsi air sekitar 55 – 65% dari yang tersedia. Pada kondisi potensial air tanah sekitar -0.5 sampai -1.5 MPa tanaman menunjukkan gejala kelayuan walaupun tanaman dapat mengabsorbsi air.
Gejala kekeringan ditandai oleh adanya gangguan pertumbuhan dan perkembangan tanaman diantaranya hambatan dalam penyerapan hara, pengurangan laju transpirasi dan nilai relative luas daun. . Gangguan pertumbuhan dan perkembangan juga dipengaruhi oleh penurunan laju fotosintesis, fiksasi CO2, dan daya hantar stomata seiring dengan peningkatan intensitas cekaman yang mempengaruhi produksi asimilat untuk pertumbuhan dan produksi tanaman (Purwanto 2003). Pengaruh kekeringan terhadap mekanisme fisiologi antara lain cenderung merusak sistem transport electron sehingga mendorong terbentuknya radikal oksigen bebas (reactive oxygen species atau ROS) pada organela tempat terjadinya metabolism yang melibatkan transport electron atau yang melakukan oksidasi, yaitu kloroplas, mitokondria, dan mikrobodi. ROS pada umumnya merusak komponen penting dalam sel seperti DNA, protein, dan lipid, serta mengakibatkan gangguan pada integritas membrane, aktivitas enzim dan struktur intra seluler (Mundree et al. 2002).
Pengukuran karakter fisiologi seperti kandungan klorofil, merupakan salah satu pendekatan untuk mempelajari pengaruh kekurangan air terhadap pertumbuhan dan hasil produksi, karena parameter ini berkaitan erat dengan laju fotosintesis (Li et al. 2006). Kekurangan air dari tingkat paling ringan sampai paling berat mempengaruhi proses-proses biokimia yang berlangsung dalam sel. Kekurangan air mempengaruhi reaksi-reaksi biokimia fotosintesis, sehingga laju fotosintesis menurun (Fitter dan Hay 1994). Salah satu aspek fotosintesis yang sangat sensitif terhadap kekurangan air adalah biosintesis klorofil dan pembentukan protoklorofil terhambat pada potensial air sedikit dibawah 0 atm (Salisbury dan Ross 1992). Kurangnya ketersediaan air akan menghambat sintesis klorofil pada daun akibat laju fotosintesis yang menurun dan terjadinya peningkatan temperatur dan transpirasi yang menyebabkan disentegrasi klorofil (Hendriyani dan Setiari, 2009). Klorofil merupakan komponen kloroplas yang utama dan kandungan klorofil relatif berkorelasi positif dengan laju fotosintesis (Li et al. 2006).
Menurut Fitter dan Hay (1981), sangat penting bagi tanaman dari seluruh spesies untuk menghindarkan diri dari cekaman kekeringan atau untuk mengembangkan adaptasi secara anatomi, morfologi dan fisiologi agar dapat mentolerir cekaman kekeringan. Tiap varietas tanaman memiliki reaksi yang sangat kompleks dalam menghadapi cekaman kekeringan yang ditunjukkan oleh perubahan morfologi dan fisiologi tanaman yang berbeda.
Menurut Fukai dan Cooper (1995) berdasarkan kemampuan genetik tanaman, terdapat empat mekanisme adaptasi pada kondisi cekaman kekeringan, yaitu: (1) melepaskan diri dari cekaman kekeringan (drought escape) yaitu tanaman menyelesaikan siklus hidupnya sebelum mengalami stres berat, dengan berbunga lebih awal atau daun menggulung, namun mekanisme adaptasi tersebut memiliki kelemahan yaitu genotipe genjah dengan umur pendek umumnya berdaya hasil rendah dibandingkan dengan yang berumur panjang; (2) toleransi dengan potensial air jaringan yang tinggi (dehydration avoidance), yaitu kemampuan tanaman tetap menjaga potensial jaringan dengan meningkatkan penyerapan air atau menekan kehilangan air melalui meningkatkan sistem perakaran, menurunkan hantaran epidermis untuk regulasi stomata, pengurangan absorbsi radiasi dengan pembentukan lapisan lilin, bulu yang tebal, dan penurunan permukaan evapotranspirasi melalui penyempitan luas daun serta pengguguran daun tua; (3) toleransi dengan potensial air jaringan yang rendah (dehydration tolerance), yaitu kemampuan tanaman untuk menjaga tekanan turgor sel dengan menurunkan potensial airnya melalui akumulasi solut seperti gula, asam amino dan prolin; (4) mekanisme penyembuhan (drought recovery), dimana proses metabolisme berjalan normal kembali setelah mengalami cekaman kekeringan.
Mekanisme ketahanan tanaman terhadap cekaman kekeringan bergantung pada genetik tanaman, dimana perbedaan morfologi, anatomi dan metabolisme akan menghasilkan respon yang berbeda terhadap cekaman kekeringan (Hamim 2004). Pada umumnya tanaman yang mengalami cekaman kekeringan akan menggunakan lebih dari satu mekanisme tersebut untuk menjaga kelangsungan hidupnya (Mitra 2001). Tanaman yang tidak mampu beradaptasi pada kondisi cekaman kekeringan akan mati apabila mengalami cekaman lebih lanjut.
Mekanisme toleransi memiliki kontribusi yang tinggi dalam mempertahankan hasil dibawah kondisi cekaman. Toleransi terhadap cekaman kekeringan meliputi aktivitas-aktivitas yanng bertujuan untuk mencegah atau mengurangi kerusakan, menjaga kondisi homeostatik, dan mempertahankan agar pertumbuhan dapat tetap berlangsung meskipun dengan kecepatan yang lebih rendah. Untuk mencapai tujuan tersebut, aktivitas dalam mekanisme toleransi dapat digolongkan menjadi tiga, yaitu: (1) detoksifikasi khususnya terhadap ROS melalui pembentukan protein stress dan osmolit yang kompatibel, (2) menjaga keseimbangan osmotic, dan (3) proses pertumbuhan dengan menurunkan kecepatan fotosintesis, pembelahan dan pembesaran sel (Mundree et al. 2002).
Simulasi Cekaman Kekeringan Menggunakan Polyethilene Glycol (PEG) 6000
Terdapat tiga jenis bahan osmotikum yang sering digunakan yaitu melibiose, mannitol dan polietilenaglikol (polyethilene glycol, PEG). Menurut Verslues et al. 2006 diantara ketiga bahan osmotikum tersebut ternyata PEG merupakan bahan yang terbaik untuk mengontrol potensial air dan tidak dapat diserap tanaman. Asay dan Johnson (1983) menyatakan bahwa simulasi cekaman kekeringan dengan menggunakan larutan PEG dapat mendeteksi dan membedakan respon tanaman terhadap cekaman kekeringan serta tidak bersifat racun bagi tanaman. Menurut Chazen dan Neuman (1994) penggunaan PEG 6000 dalam jangka panjang pada tanaman relatif aman, karena PEG 6000 tidak dapat masuk ke dalam jaringan akar tanaman atau dinding selulosa hanya dapat dilewati oleh PEG dengan berat molekul maksimum 3500. Senyawa PEG merupakan senyawa yang dapat menurunkan potensial osmotik larutan melalui aktivitas matriks sub-unit etilena oksida yang mampu mengikat molekul air dengan ikatan hidrogen (Rahayu et al. 2005). Penurunan potensial air tergantung pada konsentrasi dan bobot molekul PEG yang terlarut. Total massa -CH2-O-CH2- atau kekuatan matriks subunit-etilen dalam mata rantai polimer PEG merupakan faktor penting yang mengontrol besarnya penurunan potensial air. Bila PEG dilarutkan dalam air maka molekul air (H2O) akan tertarik ke atom oksigen pada subunit etlien oksida melalui ikatan hidrogen sehingga menyebabkan potensial air menurun. Semakin pekat kosentrasi PEG semakin banyak zat terlarut yang menahan masuknya air ke dalam jaringan tanaman akibatnya akar tanaman semakin sulit untuk menyerap air (Chazen dan Neuman 1994).
PEG merupakan agen penyeleksi yang bersifat osmotikum (menurunkan potensial air). Potensial air (Ψ) adalah potensial kimia air dalam suatu sistem atau bagian sistem yang dinyatakan dalam satuan tekanan dan dibandingkan dengan potensial kimia air murni (pada tekanan atmosfer dan suhu yang sama), potensial kimia air murni bernilai nol (Salisbury dan Ross 1995). Jika potensial kimia air tertentu kurang dari potensial kimia air murni, maka potensial airnya akan bernilai negatif. Cekaman air pada tanaman terjadi saat potensial air bernilai negatif. Air dapat menjadi faktor pembatas bagi pertumbuhan dan perkembangan tanaman. Pertumbuhan sel merupakan respon awal ditunjukkan terhadap cekaman air. Penambahan PEG ke dalam media kultur diharapkan dapat menciptakan kondisi cekaman karena ketersediaan air bagi tanaman menjadi berkurang. Menurut Short
et al. (1987) menyatakan bahwa kultur in vitro PEG dapat menginduksi cekaman kekeringan dan berkorelasi positif dengan yang terjadi di lapang atau rumah kaca. Konsentrasi PEG 10, 20 dan 30% merupakan konsentrasi yang biasa digunakan untuk simulasi cekaman kekeringan dilapang (Salisbury dan Ross 1995).
Zat Pengatur Tumbuh
Zat pengatur tumbuh tanaman (plant growth substances) atau hormon di
definisikan sebagai senyawa organik yang aktif dalam jumlah kecil yaitu antara 10-6–10-5 mM yang disintesiskan pada bagian tertentu dari tanaman dan pada
Zat pengatur tumbuh tanaman berperan penting dalam mengontrol proses biologi dalam jaringan tanaman. Perannya antara lain mengatur kecepatan pertumbuhan dari masing-masing jaringan dan mengintegrasikan bagian-bagian tersebut guna menghasilkan bentuk atau jaringan tanaman. Aktivitas zat pengatur tumbuh di dalam pertumbuhan tergantung dari jenis, struktur kimia, konsentrasi, genotipe tanaman serta fase fisiologis tanaman. Dalam proses pembentukan organ seperti tunas atau akar terdapat interaksi zat pengatur tumbuh eksogen yang ditambahkan ke dalam media dengan zat pengatur tumbuh endogen yang diproduksi oleh jaringan tanaman (Winata 1992). Menurut Wattimena 1988, bahwa terdapat dua golongan zat pengatur tumbuh yang sangat penting dalam teknik kultur jaringan yaitu auksin dan sitokinin. Peranan auksin dan sitokinin sangat nyata dalam pengaturan pembelahan sel,pemanjangan sel, diferensiasi sel, dan pembentukan organ.
Auksin adalah salah satu hormon tumbuh yang tidak terlepas dari proses pertumbuhan dan perkembangan suatu tanaman. Auksin adalah sekelompok senyawa yang fungsinya merangsang pemanjangan sel-sel pucuk yang spectrum aktivitasnya menyerupai IAA (indole-3-acetic acid). Menurut Davies (2004), auksin pada umumnya meningkatkan pemanjangan sel, pembelahan sel, diferensiasi jaringan pembuluh vaskular, inisiasi akar, merangsang respon (kelenturan) tunas dan akar terhadap gaya gravitasi dan cahaya, penundaan penuaan daun, menghambat atau merangsang (melalui etilen) daun dan pematangan buah, menunda pematangan buah, menstimulasi pertumbuhan bunga. Zulkarnain (2011) menyatakan bahwa auksin berpengaruh pula untuk menghambat pembentukan tunas adventif dan tunas aksilar, namun kehadirannya dalam media kultur dibutuhkan untuk meningkatkan embriogenesis somatik pada kultur suspensi sel.
Sitokinin adalah senyawa yang dapat meningkatkan pembelahan sel pada tanaman serta mengatur pertumbuhan dan perkembangan tanaman. Pemberian sitokinin ke dalam media kultur jaringan penting untuk menginduksi perkembangan dan pertumbuhan eksplan yang mencakup meningkatkan pembelahan sel, proliferasi pucuk, morfogenesis pucuk (inisiasi pembentukan tunas dan mendorong inisiasi tunas), pertumbuhan tunas lateral, dan menunda penuaan daun (Davies 2004) . Sitokinin yang paling banyak digunakan pada kultur in vitro adalah kinetin, benziladenin (BA atau BAP), zeatin, serta 6-[γ,γ
-dimethylallylamino]purine atau 2iP. Zeatin adalah sitokinin yang disintesis secara alamiah, sedangkan kinetin dan BA adalah sitokinin sintetik (Zulkarnain 2011).
Multiplikasi Tunas
majemuk) yang terbentuk secara langsung lebih stabil secara genetik dibandingkan dengan tunas tidak langsung (Lestari 2011).
Zat pengatur tumbuh sitokinin merupakan senyawa pengganti adenine yang meningkatkan pembelahan sel dan fungsi pengaturan pertumbuhan. Sitokinin ditemukan paling banyak didaerah meristem dan area dengan potensi tumbuh berkesinambungan termasuk akar, daun muda, buah yang berkembang, dan biji. Sitokinin diduga diproduksi dalam akar dan ditranslokasikan ke pucuk, karena zat tersebut ditemukan dalam larutan xylem. Peran sitokinin dalam tumbuhan yaitu mengatur pembelahan sel, pembentukan organ, pembesaran sel dan organ, pencegahan kerusakan klorofil, pembentukan kloroplas, penundaan senescens, pembukaan dan penutupan stomata, serta perkembangan mata tunas dan pucuk (Harjadi 2009).
Zat pengatur tumbuh BA (benzyl adenin) paling banyak digunakan untuk memacu penggandaan tunas karena mempunyai aktivitas yang kuat dibandingkan dengan kinetin. BA mempunyai struktur dasar yang sama dengan kinetin tetapi lebih efektif karena BA mempunyai gugus benzil (George dan Sherington, l984).
Benzil adenine purine (BAP) merupakan sitokinin yang paling banyak digunakan dalam kultur jaringan karena lebih stabil dan memiliki efektifitas yang lebih tinggi dibanding dengan sitokinin jenis lain. Penambahan BAP pada konsentrasi rendah 2.5-5 µM memungkinkan tumbuhnya tunas-tunas adventif pada jeruk manis (Agisimanto et al. 2005). Menurut Lestari (2011), disamping BA atau kinetin penggunaan thidiazuron (TDZ) dapat pula meningkatkan kemampuan multiplikasi tunas baik pembentukan tunas adventif maupun proliferasi tunas aksilar. Di duga TDZ mendorong terjadinya perubahan sitokinin ribonukleotida menjadi ribonukleosida yang secara biologi lebih aktif. Kombinasi BA atau BAP dengan TDZ bermanfaat meningkatkan kemampuan proliferasi tunas.
Induksi Perakaran
Perakaran dengan kualitas yang baik dalam perbanyakan tanaman secara
in vitro sangat menentukan keberhasilan dalam tahap aklimatisasi. Formulasi media yang tepat sangat menentukan kualitas akar.. Konsentrasi auksin yang rendah akan meningkatkan pembentukan akar adventif, sedangkan auksin konsentrasi tinggi akan merangsang pembentukan kalus dan menekan morfogenesis (Smith 1992). Sintesis auksin terjadi di daun, diangkut melalui sel, pergerakannya sampai ke batang. Pengangkutan dari batang ke akar mungkin juga melalui jaringan floem (Zong, et al. 2008). Kegunaan dari hormon pengakaran yaitu secara keseluruhan meningkatkan persentase pengakaran, mempercepat inisiasi pengakaran, meningkatkan jumlah dan kualitas dari akar, dan mendorong pengakaran yang seragam (Macdonald2002).
Auksin yang banyak digunakan dalam kultur in vitro adalah indole 3-acetic acid (IAA), α-naphtalena acetic acid (α-NAA), indole-3-butyric acid
(IBA), 2,4-dichlorophenoxyacetic acid (2,4-D), 2,4,5-trichlorophenoxyacetic acid
biasanya IAA diberikan pada konsentrasi yang relatif tinggi (1-30 mgL-1). Sementara NAA merupakan auksin sintetik, tidak mengalami oksidasi enzimatik seperti halnya IAA. Senyawa tersebut dapat diberikan ke media kultur pada konsentrasi yang lebih rendah yaitu berkisar antara 0,1-2,0 mgL-1.
3
KARAKTERISASI MOLEKULER KERAGAMAN
GENETIK KLON-KLON JERUK KEPROK GARUT
(
Citrus reticulata
L.) HASIL IRADIASI SINAR GAMMA
MENGGUNAKAN PENANDA RAPD (
RANDOM AMPLIFIED
POLYMORPHIC DNA)
Abstrak
Teknik RAPD telah banyak digunakan untuk mengkarakterisasi keragaman genetik yang sangat bermanfaat dalam kegiatan pemuliaan tanaman. Tujuan dari percobaan ini adalah untuk mengetahui keragaman genetik klon-klon hasil induksi mutasi melalui sinar gamma yang dapat dimanfaatkan untuk karakterisasi toleransi cekaman kekeringan berdasarkan analisis penanda RAPD. Bahan yang digunakan adalah 18 klon jeruk keprok Garut hasil iradiasi sinar gamma pada beberapa dosis dan satu genotipe jeruk keprok Garut sebagai wild type dan 15 primer penanda RAPD. Hasil penelitian yang diperoleh menunjukkan bahwa tujuh primer RAPD yang digunakan(OPA 02, OPA 13, OPF 14, OPN 14, OPN 15, OPN 16 dan OPZ 10) mampu mengindikasikan adanya keragaman genetik pada 19 klon jeruk kerpok Garut hasil iradiasi sinar gamma. Keragaman genetik yang terjadi memiliki koefisien jarak genetik berkisar antara 0-38.5% antar klon. Penanda RAPD dapat dijadikan sebagai salah satu metode penanda molekuler untuk mengetahui variasi genetik klon-klon jeruk keprok Garut hasil iradiasi sinar gamma.
Kata kunci : keprok Garut, mutasi, keragaman genetik
Abstract
RAPD technique has been widely used to characterize the genetic diversity that is very useful in plant breeding activities. The purpose of this experiment was to determine the genetic diversity of clones result of mutations induced by gamma rays that can be used for the characterization of drought stress tolerance is based on the analysis of RAPD. The materials used are 18 clones tangerines Garut results irradiation of gamma rays at multiple doses and one genotype tangerines Garut as wild type and 15 RAPD primer. The results obtained showed that seven RAPD primers were used (OPA 02, OPA 13, OPF 14, 14 OPN, OPN 15, 16 and OPZ OPN 10) able to indicate there are 19 clones of genetic diversity in orange kerpok Garut results of gamma ray irradiation. The genetic diversity that happens to have the genetic similarity coefficient ranged between 0-38.5% between clones. RAPD markers can be used to determine the genetic variation clones tangerines Garut result gamma ray irradiation.
Pendahuluan
Jeruk termasuk 10 komoditas utama hortikultura yang telah ditetapkan Kementan sejak tahun 2000. Salah satu jenis jeruk lokal yang sangat digemari konsumen adalah jeruk siam. Jeruk siam mendominasi 75% dari total perkebunan jeruk di Indonesia. Produksi jeruk nasional sekitar 2071.08 juta ton dengan luas areal 73306 Ha pada tahun 2010 (Kementan 2012). Indonesia memiliki tiga jenis jeruk lokal yang komersial, yaitu jeruk siam, jeruk keprok dan jeruk besar atau pamelo. Ketiga jenis jeruk tersebut memiliki potensi tinggi karena kemampuan adaptasinya yang baik terhadap beberapa kondisi iklim di Indonesia (Ashari dan Hanif 2012).
Produksi jeruk keprok pada tahun 2014 adalah 1 785 264 ton dan lebih rendah dibandingkan tahun 2010 yaitu 1937 773 ton atau mengalami penurunan sebanyak 8.54% (BPS 2015). Salah satu penyebab penurunan adalah adanya cekaman biotik seperti serangan penyakit Huanglongbing (HLB) (BPTP 2002) dan abiotik (kekeringan). Perakitan varietas pengembangan klon jeruk keprok varietas Garut toleran terhadap cekaman biotik dan abiotik dapat dilakukan secara konvensional melalui persilangan, dan secara non konvensional melalui induksi mutasi dengan teknik pemaparan radiasi sinar gamma.
Karyanti et al. (2015) telah melakukan induksi mutasi melalui radiasi sinar gamma dosis 20-200 Gray dan menghasilkan klon-klon yang tetap bertahan hidup hingga generasi M1V4 secara in vitro. Klon-klon tersebut diharapkan adalah mutan putatif yang belum diketahuikeragaman genetiksehingga diperlukan pengujian secara molekuler untuk mengidentifikasi keragaman genetiknya secara keseluruhan. Dalam percobaan ini karakterisasikeragaman genetik secara molekuler dilakukan menggunakan penanda RAPD. Penanda molekuler Random Amplified Polymorphic DNA (RAPD) dapat diandalkan untuk mendeteksi sekuen nukleotida yang polimorfik dengan bantuan mesin PCR (polymerase chain reaction) dengan sebuah primer tunggal (10-mer) RAPD. Teknik RAPD telah banyak digunakan dalam kegiatan pemuliaan tanaman antara lain analisis keragaman genetik jeruk mandarin (Filho et al.1980), analisis keragaman genetik plasma nutfah tanaman jeruk (Karsinah et al. 2002), kekerabatan genetik jeruk siam(Agisimanto et al. 2007), analisis keragaman genetik jeruk keprok Indonesia (Hardiyanto et al. 2007), analisis genotipe pohon induk jeruk bebas penyakit (Supriyanto et al. 2006), keragaman genetik kultivar jeruk manis (Malik et al. 2012), keragaman genetik jeruk pamelo (Prasetyaningrum et al. 2012).
Bahan dan Metode
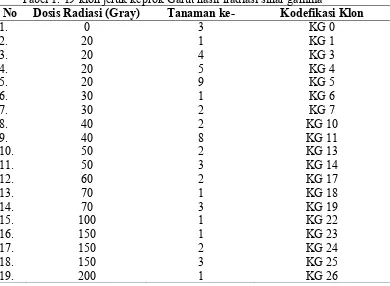
Karakterisasi molekuler keragaman genetik klon-klon jeruk keprok Garut hasil iradiasi sinar gamma dilaksanakan pada bulan April sampai dengan September 2013 di Laboratorium Elektroforesis Balai Besar Pengembangan Pengujian Mutu Benih Tanaman Pangan dan Hortikultura. Bahan yang digunakan dalam percobaan ini adalah daun 19 klon jeruk keprok Garut yang terdiri dari 18 klon hasil iradiasi sinar gammadosis 20 hingga 200 Graygenerasi in vitro M1V4 dan varietas jeruk keprok Garut (wild type atau KG 0) (Tabel 1). Percobaan karakterisasi keragaman genetik analisis penanda RAPD ini dilaksanakan dengan menggunakan 15primer acak (10-mer basa).
Tabel 1. 19 klon jeruk keprok Garut hasil iradiasi sinar gamma
No Dosis Radiasi (Gray) Tanaman ke- Kodefikasi Klon
1. 0 3 KG 0
2. 20 1 KG 1
3. 20 4 KG 3
4. 20 5 KG 4
5. 20 9 KG 5
6. 30 1 KG 6
7. 30 2 KG 7
8. 40 2 KG 10
9. 40 8 KG 11
10. 50 2 KG 13
11. 50 3 KG 14
12. 60 2 KG 17
13. 70 1 KG 18
14. 70 3 KG 19
15. 100 1 KG 22
16. 150 1 KG 23
17. 150 2 KG 24
18. 150 3 KG 25
19. 200 1 KG 26
Isolasi DNA
Protokol yang digunakan untuk ekstraksi DNA adalah prosedur ekstraksi DNA yang dikembangkan oleh Deng et al. (1995) berbasis CTAB yang telah dimodifikasi. Modifikasi tersebut adalah pada saat penggerusan daun eksplan tidak ditambahkan nitrogen cair. Daun klon-klon jeruk keprok Garut mutan dan
satu menit agar tercampur sempurna, kemudian disentrifugasi dengan kecepatan 13.000 rpm selama 10 menit. Fase cair yang terpisah dipindahkan ke dalam tabung mikro tube baru dan dimurnikan kembali dengan menambahkan 1 ml kloroform:isoamil alkohol (24:1) dengan cara yang sama seperti sebelumnya. Fase cair yang diperoleh dari pemurnian kedua dimasukkan ke dalam tabung mikro tube baru, ditambahkan dengan 1 ml isopropanol dingin dan 50 µl Na-asetat 3 M, kemudian dikocok secara perlahan-lahan sampai terlihat benang-benang putih dan diinkubasi dalam freezer suhu -200C selama 30 menit. Larutan DNA yang diperoleh dipisahkan dengan sentrifugasi dengan kecepatan 13 000 rpm selama 10 menit. Endapan DNA dicuci dengan 500 µl buffer pencuci (76% ethanol, 10 mM ammonium asetat) dan dikeringkan dengan cara membalikkan tabung mikro diatas kertas tisu. Selanjutnya, endapan DNA diresuspensikan atau dilarutkan dengan menambahkan buffer 500 µl buffer TE (10 mM Tris HCl pH 7.4; 1 mM EDTA pH 8.0) dan disimpan pada suhu -200C.
Kuantitas dan kualitas larutan DNA dari masing-masing sampel diukuir dengan menggunakan spektrofotometer pada panjang gelombang 260 nm dan 280 nm. Hasil pembacaan nilai absorbansi pada panjang gelombang 260 nm atau A260
= 1 mengindikasikan konsentrasi DNA adalah 50 µg/ml dan dianggap sebagai faktor konversi. Kemurnian DNA dihitung berdasarkan nilai rasio A260/A280.
Larutan DNA yang murni memiliki nilai rasio A260/A280berkisar antara 1.8-2.0,
dan bila nilai rasio tersebut lebih kecil dari 1.8 mengindikasikan terdapat kontaminasi protein atau fenol, sedangkan bila lebih besar dari 2.0 mengindikasikan terdapat kontaminasi RNA (Sulandri dan Zein 2003) .
Amplifikasi DNA dengan mesin PCR
Reaksi amplifikasi atau penggandaan DNA dilaksanakan menggunakan total volume campuran larutan 25 µl yang terdiri atas 12.5 µl buffer PCR GoTaq® Master Mix (buffer reaksi 2x Green GoTaq®, 400 µM dATP, 400 µM dGTP, 400 µM dCTP, 400 µM dTTP dan 3 mM MgCl2), 50 ng DNA cetakan, dan 5 pmol
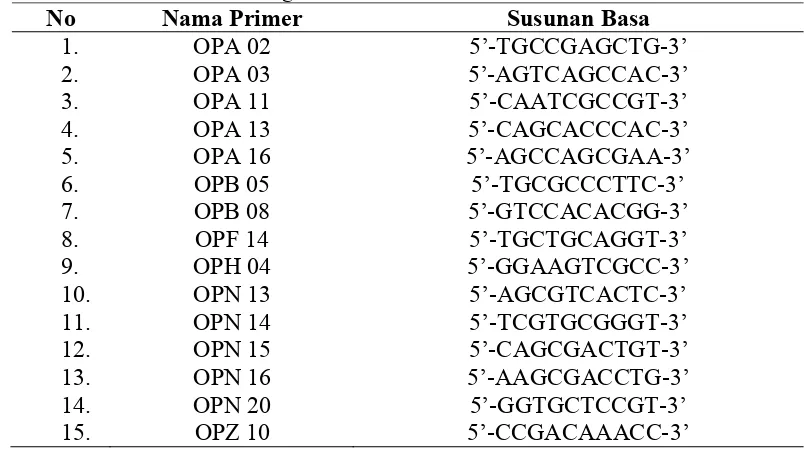
primer (10-mer kit Operon) dengan menggunakan alat Thermo Hybaid PxE 0.2 PCR. PCR dilakukan dengan program sebagai berikut yaitu denaturasi awal pada suhu 940C selama 2 menit sebanyak 1 siklus; amplifikasi sebanyak 45 siklus yang terdiri dari denaturasi pada suhu 940C selama 30 detik, annealing pada suhu 360C selama 30 detik, dan extention pada suhu 720C selama 80 detik; dan perpanjangan akhir pada suhu 720C selama 10 menit sebanyak 1 siklus. Jenis primer dan susunan basa primer yang digunakan ditunjukkan pada Tabel 2.
Tabel 2. Kode dan sekuen 15 primer acak (10-mer) Operon yang digunakan dalam studi keragaman genetik klon-klon jeruk keprok Garut mutan putatif hasil iradiasi sinar gamma
No Nama Primer Susunan Basa
1. OPA 02 5’-TGCCGAGCTG-3’
2. OPA 03 5’-AGTCAGCCAC-3’
3. OPA 11 5’-CAATCGCCGT-3’
4. OPA 13 5’-CAGCACCCAC-3’
5. OPA 16 5’-AGCCAGCGAA-3’
6. OPB 05 5’-TGCGCCCTTC-3’
7. OPB 08 5’-GTCCACACGG-3’
8. OPF 14 5’-TGCTGCAGGT-3’
9. OPH 04 5’-GGAAGTCGCC-3’
10. OPN 13 5’-AGCGTCACTC-3’
11. OPN 14 5’-TCGTGCGGGT-3’
12. OPN 15 5’-CAGCGACTGT-3’
13. OPN 16 5’-AAGCGACCTG-3’
14. OPN 20 5’-GGTGCTCCGT-3’
15. OPZ 10 5’-CCGACAAACC-3’
Analisis Data
Data yang diperoleh dari visualisasi DNA produk PCR teknik RAPD berupa pita-pita diskrit dengan ukuran tertentu dari masing-masing klon jeruk keprok Garut hasil iradiasi. Jarak pita diukur dari batas atas well atau sumur pada gel agarose sampai batas bawah pita yang masih terlihat lalu diurutkan dari jarak pita terbawah sampai batas sumur. Pengukuran pita genom DNA berdasarkan dengan membandingkannya dengan berat molekul standar 100 bp marker DNA ladder. Perbedaan antar klon-klon jeruk keprok Garut mutan putatif hasil iradiasi sinar gamma ditunjukkan oleh jumlah pita dan jarak migrasinya kemudian dibandingkan dengan wild type. Apabila terdapat perbedaan fragmen pita DNA antara 18 klon dengan wild type baik penambahan maupun pengurangan fragmen pita DNA maka diasumsikan telah terjadi perbedaan genetik atau terjadi mutasi akibat iradiasi sinar gamma.
Analisis data dilakukan dengan menterjemahkan atau scoring profil fragmen DNA ke dalam data biner dengan mengkonversikan setiap pita DNA yang muncul diberi nilai 1 dan nilai 0 diberikan untuk yang tidak muncul pada setiap posisi ukuran yang sama dari setiap individu klon-klon hasil iradiasi sinar gamma yang dibandingkan dengan individu kontrol. Data biner tersebut dianalisis lebih lanjut dengan melakukan pengelompokkan data matrix (cluster analysis) dan pembuatan diagram hubungan kekerabatan dilakukan dengan metode Unweighted Pair-Group Method Arithmetic (UPGMA) menggunakan program Numerical Taxonomy and Multivariate System (NTSYS versi 2.02).
Hasil dan Pembahasan
konsentrasi DNA berkisar antara 115-2,585 µg/ml. Larutan DNA dikatakan murni apabila memiliki nilai antara 1.8-2.0. Pada pengujian ini varietas wild type (KG 0) memiliki nilai kemurnian sebesar 1.44. Sampel dengan nilai kemurnian DNA < 1.8 mengindikasikan masih terdapat kontaminasi protein atau phenol di dalam larutan (Sulandri dan Zein 2003), namun pada sampel KG 0 ini tidak dilakukan pemurnian DNA karena setelah dilakukan konfirmasi kemurnian menggunakan elektroforesis horisontal tidak terlihat adanya kontaminan yang cukup tebal. Sedangkan konsentrasi larutan DNA sampel-sampel klon jeruk keprok Garut mutan putatif telah memenuhi syarat minimal yang dibutuhkan dalam analisa DNA penanda RAPD yaitu hanya sebesar 50 ng.
Hasil percobaan menunjukkan bahwa 15 primer acak RAPD yang digunakan memberikan kualitas hasil (penampilan) produk PCR yang berbeda-beda, sehingga diperlukan seleksi primer untuk menentukan primer-primer yang visualisasi produk PCR-nya diuji lanjut untuk mengetahui keragaman genetik yang terbentuk dari hasil iradiasi sinar gamma. Visualisasi produk amplifikasi PCR 15 primer tersebut dapat dilihat pada Tabel 3. Berdasarkan Tabel 3 tersebut diketahui bahwa terdapat empat primer yang tidak meghasilkan fragmen pita DNA, lima primer yang menghasilkan fragmen pita DNA polimorfik, dua primer yang menghasilkan fragmen pita DNA tidak polimorfik (monomorfik), dan terdapat empat primer yang yang menghasilkan fragmen pita DNA namun pada
[image:32.595.107.514.486.723.2]wild type tidak muncul fragmen pita DNA. Primer-primer yang menghasilkan fragmen pita DNA baik polimorfik dan monomorfik akan dilakukan analisis lanjut. Analisis tersebut dilakukan untuk melihat keragaman genetik hasil iradiasi sinar gamma yang terbentuk dengan melihat visualisasi fragmen pita DNA dan mengubah data fragmen pita DNA menjadi data biner kemudian analisis lanjut menggunakan software NTSYs pc.2.02.
Tabel 3. Penampilan PCR 15 primer RAPD pada 19 klon jeruk keprok Garut mutan putatif
No Primer Kualitas hasil produk PCR
1. OPA 02 Polimorfik
2. OPA 03 Wild type tidak muncul pita DNA
3. OPA 11 Tidak muncul pita DNA
4. OPA 13 Tidak Polimorfik
5. OPA 16 Tidak muncul pita DNA
6. OPB 05 Wild type tidak muncul pita DNA 7. OPB 08 Wild type tidak muncul pita DNA
8. OPF 14 Polimorfik
9. OPH 04 Tidak muncul pita DNA
10. OPN 13 Tidak muncul pita DNA
11. OPN 14 Polimorfik
12. OPN 15 Polimorfik
13. OPN 16 Tidak Polimorfik
14. OPN 20 Wild type tidak muncul pita DNA
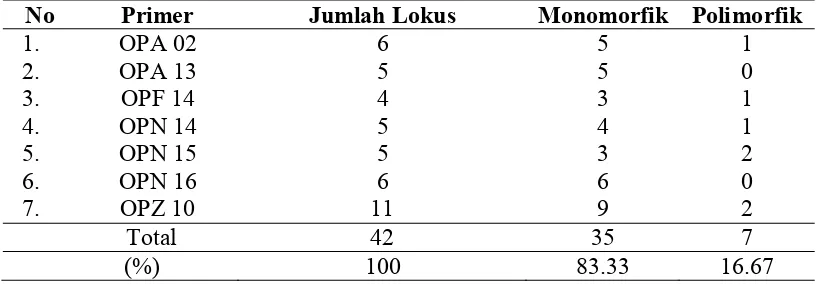
Fragmen pita DNA 18 klon hasil iradiasi sinar gamma dan wild type baik monomorfik dan polimorfik dihitung dan hasil penghitungan dari masing-masing primer dapat dilihat pada Tabel 4.
Tabel 4. Hasil penghitungan jumlah produk amplifikasi 18 klon jeruk keprok Garut mutan putatif dan wild type menggunakan penanda RAPD
No Primer Jumlah Lokus Monomorfik Polimorfik
1. OPA 02 6 5 1
2. OPA 13 5 5 0
3. OPF 14 4 3 1
4. OPN 14 5 4 1
5. OPN 15 5 3 2
6. OPN 16 6 6 0
7. OPZ 10 11 9 2
Total 42 35 7
(%) 100 83.33 16.67
Jumlah fragmen DNA hasil amplifikasi menggunakan mesin PCR berkisar antara 4 sampai 11 pita tergantung pada primer dan klon jeruk keprok Garut mutan putatif yang dianalisis, dengan rata-rata 6 pita per primer (Tabel 3). Ukuran fragmen yang diperoleh berkisar antara 150 sampai 1700 bp dengan total fragmen adalah 42 fragmen DNA yang diproduksi oleh 7 primer. Total fragmen DNA yang diperoleh terdapat 7fragmen DNA yang polimorfik atau sekitar 16.67%, dan terdapat 35 fragmen DNA monomorfik atau sekitar 83.33%.
Jumlah fragmen pita DNA polimorfis yang dihasilkan rendah yaitu hanya 16.67%kemungkinan disebabkan oleh kesamaan varietas asal atau wild type klon-klon mutan putatif, radiasi sinar gamma yang bersifat acak dan sekuen DNA tanaman yang mengalami mutasi masih relatif rendah, jumlah primer yang digunakan masih relatif sedikit serta belum optimal pada proses amplifikasi PCR sehingga belum semua pita DNA muncul pada proses amplifikasi DNA. Perbedaan jumlah dan polimorfisme pita DNA yang dihasilkan dari setiap primer menggambarkan kompleksitas genom tanaman yang diamati. Pita fragmen DNA RAPD merupakan hasil berpasangannya nukleotida primer dengan nukelotida genom tanaman, semakin banyak primer yang digunakan akan semakin mewakili bagian genom tanaman sehingga semakin menggambarkan keadaan genom tanaman sesungguhnya (Syarafuddin dan Nasution 2012).
sehingga daerah tersebut tidak dapat diamplifikasi (Van Harten 1998).Beberapa penyebab bertambahnya pita adalah (1) terjadi delesi antara dua situs tempat primer menempel, (2) terjadi subsitusi pada potongan DNA tertentu akan menyebabkan terdapat situs baru yang cocok untuk primer tertentu (Harahap 2005,Sahasrabudhe dan Deodhar 2010).
M K KG 1
KG 3
KG 4
KG 5 KG 6 KG 7 KG 10 KG 11 KG 13 KG 14 KG 17 KG 18 KG 19 KG 22 M KG 23 KG 24 KG 25 KG 26
M K KG 1 KG 3 KG 4 KG 5 KG 6 KG 7 KG 10 KG 11 KG 13 KG 14 M KG 17 KG 18 KG 19 KG 22 KG 23 KG 24 KG 25 KG 26
M K KG
[image:34.595.74.545.162.697.2]1 KG 3 KG 4 KG 5 KG 6 KG 7 KG 10 KG 11 KG 13 KG 14 KG 17 KG 18 KG 19 KG 22 M KG 23 KG 24 KG 25 KG 26
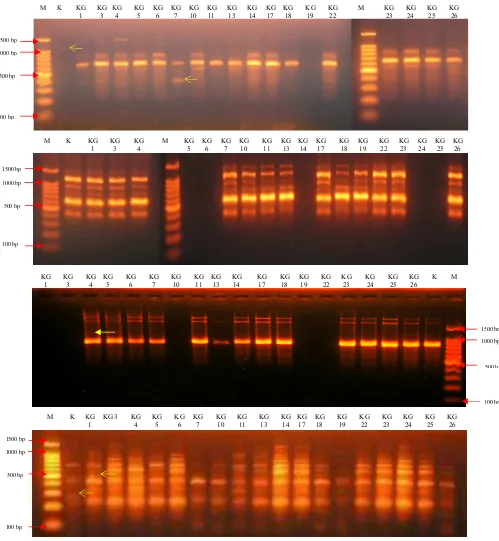
Gambar 2. Pola pita DNA klon jeruk keprok Garut mutan putatif hasil amplifikasi DNA menggunakan penanda RAPD primer OPA 02 (A), OPA 13 (B) dan OPN 14 (C)
Ket : M = Marker Ukuran Basa DNA baku, K= Kontrol atau KG 0 Tanda Panah kuning menunjukkan fragmen DNA polimorfik
M K KG 1 KG 3 KG 4 KG 5 KG 6 KG 7 KG 10 KG 11 KG 13 KG 14 KG 17 KG 18 KG 19 KG 22 M KG 23 KG 24 KG 25 KG 26
M K KG 1
KG 3
KG 4
M KG
5 KG 6 KG 7 KG 10 KG 11 KG 13 KG 14 KG 17 KG 18 KG 19 KG 22 KG 23 KG 24 KG 25 KG 26 KG 1 KG 3 KG 4 KG 5 KG 6 KG 7 KG 10 KG 11 KG 13 KG 14 KG 17 KG 18 KG 19 KG 22 KG 23 KG 24 KG 25 KG 26 K M
M K KG
1
KG 3 KG
[image:35.595.46.545.95.636.2]4 KG 5 KG 6 KG 7 KG 10 KG 11 KG 13 KG 14 KG 17 KG 18 KG 19 KG 22 KG 23 KG 24 KG 25 KG 26
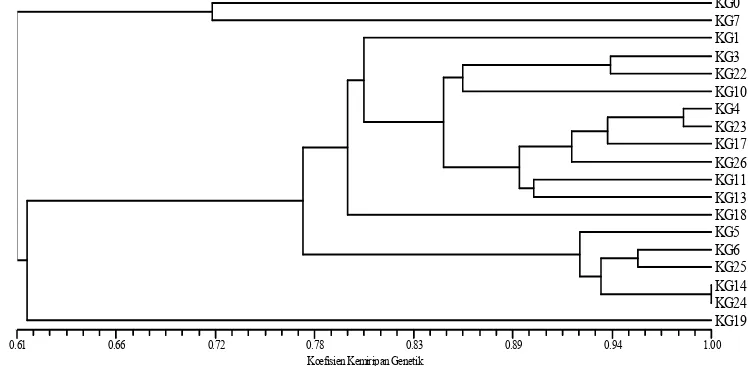
Gambar 3. Pola pita DNA klon jeruk keprok Garut mutan putatif hasil amplifikasi DNA menggunakan penanda RAPD OPN 15 (A), OPN 16 (B), OPF 14 (C) dan OPZ 10 (D)
Ket : M = Marker Ukuran Basa DNA baku, K= Kontrol atau KG 0 Tanda Panah kuning menunjukkan fragmen DNA polimorfik
Profil fragmen DNA hasil amplifikasi dengan menggunakan tujuh primer, dianalisis pengelompokkan data matrix (cluster analysis) dan pembuatan diagram hubungan kemiripan genetik dilakukan dengan metode Unweighted Pair-Group
Method Arithmetic (UPGMA) menggunakan programNumerical Taxonomy and Multivariate System (NTSYS versi 2.02)untuk menentukan hubungan kesamaan atau kemiripan genetik antar individu klon-klon jeruk keprok Garut mutan putatif atau untuk melihat keragaman genetik yang terbentuk dari hasil induksi mutasi menggunakan iradiasi sinar gamma pada beberapa dosis.
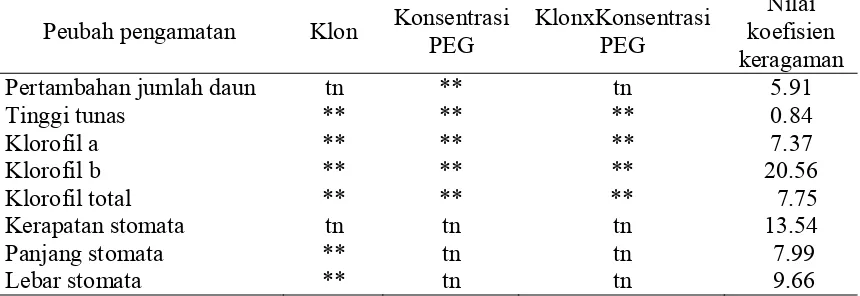
Gambar 4. Keragaman genetik 18 klon jeruk keprok Garut mutan putatif dan klon
wild type berdasarkan data gabungan penanda RAPD dengan primer OPA 02, OPA 13, OPF 14, OPN 14, OPN 15, OPN 16, dan OPZ 10
Hubungan kemiripan genetik hasil analisa data fragmen DNA 19 klon jeruk keprok Garut mutan putatif hasil iradiasi sinar gamma ditunjukkan melalui Gambar 4. Secara umum koefisien kemiripan genetik 19 klon jeruk keprok Garut mutan putatif berkisar antara 61.0 sampai 100%. Terdapat satu kelompok besar yang berisi 16 klon jeruk keprok Garut mutan putatif yang memiliki koefisien kemiripan genetik sebesar 77% dengan klon KG 19. Klon KG 14 dan KG 24 memiliki kemiripan genetik 100% atau tidak berbeda secara genetik, namun tidak identik dengan wild type klon tersebut (KG 0). Hal ini mengindikasikan bahwa iradiasi sinar gamma bersifat acak dalam menginduksi mutasi sel. Klon KG 14 merupakan klon hasil iradasi dosis 50 Gray dan KG 24 adalah klon hasil iradiasi dosis 150 Gray. Perbedaan dosis menyebabkan kedua klon tersebut identik namun berbeda dengan wild typenya. Hal ini dimungkinkan oleh sifat radiasi sinar gamma sangat bersifat individual dan bagian sel yang terkena radiasi yang mengalami mutasi yang berbeda antar tanaman (Yulianti et al. 2010), sehingga memungkinkan terjadinya kerusakan pada susunan DNA yang sama walaupun dosis radiasi sinar gamma yang diberikan berbeda. Klon KG 7 memiliki kemiripan genetik sebesar 72% atau terdapat jarak genetik dengan wild type sebesar 28%, dan hal ini menunjukkan bahwa klon KG 7 adalah klon yang berbeda secara genetik dengan wild type dan klon-klon hasil iradiasi lainnya. Klon KG 19 memiliki kemiripan genetik dengan 16 klon lainnya sebesar 61.5% atau berjarak genetik sebesar 38.5%. KG 7 dan KG 19 merupakan klon hasil iradiasi dosis 30 Gray dan 70 Gray dimana kedua dosis tersebut berada dibawah nilai dosis LD50
yang sebesar 73.5 Gray (Karyanti et al. 2015). Iradiasi sinar gamma bersifat acak sehingga walaupun dosis radiasi yang digunakan rendah namun apabila radiasi pengion tersebut merubah susunan basa DNA maka akan terjadi mutasi gen (Van
Koefisien Kemiripan Genetik
0.61 0.66 0.72 0.78 0.83 0.89 0.94 1.00
Harten 1998). Secara umum dari 18 klon-klon jeruk keprok Garut hasil iradiasi sinar gamma dosis 20 sampai 200 Gray berbeda dengan kontrolnya atau terjadi keragaman genetik dengan jarak genetik berkisar antara 0-38.5%.
Pengujian karakterisasi keragaman genetik menggunakan penanda RAPD ini menunjukkan bahwa tidak seluruh primer yang diujikan menghasilkan fragmen pita DNA. Hal ini menunjukkan bahwa primer-primer tersebut terdiri atas basa-basa nukleotida yang tidak homolog dengan DNA cetakan, karena terbentuknya fragmen pita DNA tergantung dari penempelan sekuen nukleotida primer pada DNA cetakan dari genotipe (klon-klon sampel). Hal ini kemungkinan disebabkan oleh terjadi kesalahan teknis dimana DNA wild typetidak terambil pada saat persiapan PCR, sehingga pada saat proses PCR tidak terdapat cetakan DNA yang akan digandakan atau diamplifikasi. Selain itu larutan DNA beberapa klon memiliki nilai kemurnian <1.8 yang mengindikasikan terdapat kontaminasi protein atau phenol yang mengganggu proses amplifikasi DNA menggunakan mesin PCR. Penanda RAPD merupakan salah satu penanda molekuler yang memiliki menggunakan primer yang bersifat acak, dan memiliki kelemahan yaitu tingkat keterulangan dengan hasil yang sama atau reproducible yang rendah, sehingga diharapkan dapat dilakukan pengujian karakterisasi keragaman genetik yang terbentuk menggunakan penanda lain yang tingkat reproducible tinggi terhadap seluruh klon jeruk keprok Garut hasil iradiasi sinar gamma. Iradiasi sinar gamma sering diaplikasikan karena memiliki kemampuan penetrasi yang jauh ke dalam jaringan tanaman. Induksi mutasi diarahkan untuk mengubah satu atau beberapa karakter penting yang menguntungkan tanaman. Teknik mutasi buatan umumnya ditujukan untuk mengubah karakter tertentu dengan tetap mempertahankan sebagian besar karakter aslinya (Wardiyati et al. 2002). Keragaman genetik yang terbentuk pada jeruk keprok varietas Garut melalui induksi mutasi dengan iradiasi sinar gamma diharapkan dapat menjadi sumber plasma nutfah pada kegiatan seleksi selanjutnya sesuai dengan karakter yang diinginkan. Salah satu karakter yang diharapkan dimiliki oleh klon-klon jeruk keprok Garut mutan putatif adalah karakter toleran terhadap cekaman kekeringan, dan terdapat klon yang memiliki karakter toleran terhadap cekaman kekeringan.
Tahap kegiatan selanjutnya digunakan empat klon jeruk keprok Garut mutan putatif yaitu KG 3, KG 13, KG 23, dan KG 24 untuk dievaluasi karakter toleransi terhadap cekaman kekeringan melalui simulasi PEG secara in vitro. Pemilihan empat klon tersebut selain secara genetik berbeda dengan wild typenya atau KG 0 juga didasarkan pada pertumbuhan tunas-tunas keempat klon tersebut yang lebih baik dan ketersediaan yang cukup banyak dibandingkan dengan klon-klon lainnya.
Simpulan
4 TOLERANSI KLON JERUK KEPROK (
Citrus reticulata
L.)
MUTAN PUTATIF TOLERAN TERHADAP CEKAMAN
KEKERINGAN MELALUI SIMULASI POLY-ETHYLENE
GLIKOL
(PEG)
Abstrak
Cekaman kekeringan yang relatif lama pada fase vegetatif maupun pada fase generatif (proses perkembangan bunga dan buah) dapat menyebabkan penurunan produksi buah jeruk keprok Garut. Tujuan dari penelitian adalah untuk mendapatkan klon-klon jeruk keprok Garut mutan toleran terhadap cekaman kekeringan melalui simulasi menggunakan PEG pada media tanam cair dan memperoleh konsentrasi PEG yang optimum sebagai agen seleksi cekaman kekeringan. Penelitian dilaksanakan mulai November 2013 sampai dengan April 2014 di Laboratorium Kultur Jaringan Departemen Agronomi dan Hortikultura IPB dan Laboratorium Elektroforesis Balai Besar Pengembangan Pengujian Mutu Benih Tanaman Pangan dan Hortikultura. Bahan yang digunakan adalah lima klon jeruk keprok Garut mutan (KG 3, KG 13, KG 23, dan KG 24) dan jeruk kerprok Garut (wild type) sebagai pembanding. Penelitian ini menggunakan Rancangan Acak Lengkap dua faktor dengan faktor pertama adalah lima klon jeruk keprok Garut mutan, dan faktor kedua adalah empat taraf konsentrasi PEG (0%, 10%, 20% dan 30%) pada media tanam MS+vitamin MW yang diulang delapan kali. Hasil penelitian menunjukkan bahwa PEG konsentrasi 20% dapat dijadikan agen seleksi cekaman kekeringan klon-klon jeruk keprok Garut mutan, hal ini diindikasi dengan terjadinya penurunan pertumbuhan vegetatif. Klon KG 13 dan KG 23 merupakan klon yang memberikan respon cekaman kekeringan yang lebih baik dengan penurunan karakter jumlah daun, tinggi tanaman, kandungan klorofil, dan ukuran stomata (panjang dan lebar stomata, jumlah serta kerapatan stomata) lebih rendah dibandingkan dengan klon lainnya.
Kata kunci: jeruk keprok Garut mutan, respon kekeringan, PEG
Abstract
Garut mutant clones, and the second factors is a four-level concentrations of PEG (0%, 10%, 20% and 30%) in the planting medium MS + vitamin MW which is repeated eight times. The results showed that PEG concentration of 20% can be used as agents of selection of drought stress clones of keprok Garut mutant, it is indicated by the decline in vegetative growth. Clones KG 13 and KG 23 is a clone who responded drought stress better with a decrease in the number of characters of leaves, plant height, chlorophyll, and morphology of the stomata (stomata length and width, the number and density of stomata) is lower compared to other clones.
Keywords: keprok Garut mutants, drought response, PEG
Pendahuluan
Setiap tanaman termasuk jeruk keprok Garut memerlukan kondisi lingkungan yang sesuai untuk pertumbuhan dan perkembangannya. Kondisi lingkungan tempat tanaman berada selalu mengalami perubahan. Perubahan yang terjadi mungkin masih berada dalam batas toleransi tanaman tersebut, namun seringkali tanaman mengalami perubahan lingkungan yang dapat menurunkan produktivitas bahkan kematian tanaman. Hal ini menunjukkan bahwa setiap tanaman memiliki faktor pembatas dan daya toleransi terhadap lingkungan (Purwadi 2011).
Perubahan lingkungan yang ekstrim ialah lingkungan yang dapat menimbulkan cekaman pada tumbuhan. Penyebab cekaman dapat berupa berbagai bahan kimia dan faktor-faktor fisik yang bersifat permanen maupun dapat balik kembali. Cekaman kekeringan merupakan hambatan utama dalam peningkatan produksi tanaman budidaya, termasuk jeruk keprok. Pengaruh stress kekeringan terhadap pertumbuhan tanaman sangat ditentukan oleh besarnya tingkat stress yang dialami dan fase pertumbuhan tanaman tersebut saat mendapat stress kekeringan.
Cekaman kekeringan merupakan istilah untuk menyatakan bahwa tanaman mengalami kekurangan air akibat keterbatasan air dari lingkungannya yaitu media tanam. Cekaman kekeringan pada tanaman dapat disebabkan oleh kekurangan suplai air di daerah perakaran dan permintaan air yang berlebihan oleh daun akibat laju evapotranspirasi yang melebihi laju absorpsi air walaupun keadaan air tanah tersedia dengan cukup (Harjadi dan Yahya 1988). Cekaman kekeringan dapat mengakibatkan perubahan-perubahan pada morfologi, fisiologi dan biokimia tanaman, yang pada akhirnya akan memberikan pengaruh buruk terhadap pertumbuhan serta produktivitas tanaman (Levit 1980).
maka tanah di sekitar tanaman digemburkan atau ditutupi mulsa (Balitbangtan 2012).
Cekaman kekeringan yang relatif lama pada fase vegetatif maupun pada pada proses perkembangan bunga dan buah dapat menyebabkan penurunan produksi buah jeruk keprok Garut. Oleh karena itu pengembangan galur-galur jeruk keprok Garut yang toleran terhadap cekaman kekeringan merupakan salah satu program pemuliaan tanaman yang sangat penting baik secara konvensional maupun non konvensional. Induksi mutasi jeruk keprok Garut menggunakan metode iradiasi sinar gamma pada beberapa dosis telah menghasilkan bebera