ANALISIS GENETIK ISOLAT Corynespora cassiicola DAN
PLASMA NUTFAH KARET SERTA IDENTIFIKASI
QUANTITATIVE TRAIT LOCI (QTL) YANG TERPAUT
KETAHANAN PENYAKIT GUGUR DAUN CORYNESPORA
FETRINA OKTAVIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK
CIPTA
Dengan ini saya menyatakan bahwa disertasi yang berjudul Analisis Genetik Isolat Corynespora cassiicola dan Plasma Nutfah Karet serta Identifikasi Quantitative Trait Loci (QTL) yang Terpaut Ketahanan Penyakit Gugur Daun Corynespora adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2016 Fetrina Oktavia
RINGKASAN
FETRINA OKTAVIA. Analisis Genetik Isolat Corynespora cassiicola dan Plasma Nutfah Karet serta Identifikasi Quantitative Trait Loci (QTL) yang Terpaut Ketahanan Penyakit Gugur Daun Corynespora. Dibimbing oleh SUDARSONO, DINY DINARTI, KUSWANHADI dan WIDODO.
Pengembangan budi daya tanaman karet di Indonesia dan negara-negara utama penghasil karet alam di dunia menghadapi kendala serangan penyakit gugur daun Corynespora (PGDC) yang secara signifikan menurunkan produksi lateks tanaman karet. Penyakit gugur daun yang disebabkan oleh cendawan Corynespora cassiicola merupakan salah satu penyakit penting yang sudah tersebar di hampir seluruh sentra perkebunan karet di dunia dan penyebarannya sangat sulit dikendalikan. Penggunaan klon-klon karet tahan sebagai bahan tanam merupakan salah satu solusi pengendalian PGDC secara efektif dan ekonomis. Program pemuliaan tanaman karet untuk menghasilkan klon-klon unggul yang tahan terhadap PGDC seringkali terkendala dengan lamanya waktu yang diperlukan untuk proses seleksi, sehingga kemajuan dibidang biologi molekuler melupakan peluang untuk mengatasi hal tersebut. Serangkaian kegiatan penelitian dilakukan bertujuan untuk : 1) mengidentifikasi keragaman tingkat patogenisitas, sekuen ITS-rDNA dan gen penyandi cassiicolline pada isolat C. cassiicola asal perkebunan karet di Indonesia, 2) mengevaluasi tingkat ketahanan plasma nutfah karet terhadap penyakit gugur daun Corynespora, 3) menganalisis keragaman genetik dan struktur populasi plasma nutfah karet berdasarkan marka EST-SSR, serta 4) menyusun peta pautan genetik dan mengidentifikasi marka SSR yang terkait dengan PGDC pada tanaman karet.
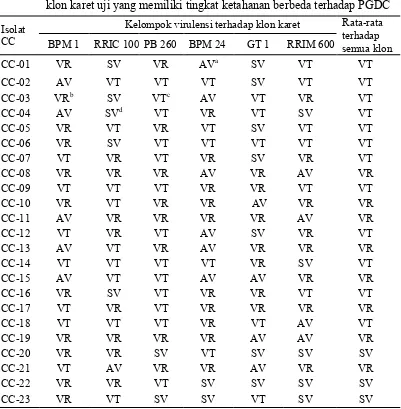
Penelitian diawali dengan uji virulensi 23 isolat C. cassiicola yang terdiri dari dua kelompok. Kelompok pertama adalah 6 isolat yang diisolasi dari klon yang sama (GT 1) pada 6 perkebunan karet berbeda yaitu dari Provinsi Sumatera Utara, Bengkulu, Jambi, Jawa Barat, Jawa Tengah, Kalimantan Barat dan Sumatera Selatan, sedangkan kelompok kedua adalah 17 isolat yang diisolasi dari 17 klon karet berbeda di lokasi yang sama. Uji virulensi dilakukan berdasarkan aktivitas toksin isolat pada daun 6 klon karet yaitu BPM 1, RRIC 100, BPM 24, PB 260, GT 1 dan RRIM 600 yang memiliki tingkat ketahanan berbeda terhadap PGDC. Hasil analisis virulensi menunjukkan bahwa terdapat interaksi antara isolat dengan klon karet yang menghasilkan perbedaan tingkat virulensi masing-masing isolat terhadap enam klon karet uji. Daerah dan jenis klon inang asal isolat diisolasi berpengaruh terhadap kemampuan virulensi dan keragaman sekuen ITS-rDNA isolat C.cassiicola yang dianalisis. Analisis keragaman sekuen ITS-rDNA 23 isolat C. cassiicola menggunakan kombinasi primer ITS1F/ITS4 menunjukkan bahwa terdapat tiga titik SNP yang membagi isolat menjadi 5 haplotipe berbeda dan sebagian besar isolat tergolong ke dalam haplotipe 1. Analisis menunjukkan bahwa terdapat keterkaitan antara sekuen ITS-rDNA dengan kemampuan virulensi, dimana perubahan basa pada titik SNP mengakibatkan terjadinya perubahan tingkat virulensi isolat. Identifikasi gen cas menunjukkan bahwa isolat
iv
Percobaan selanjutnya adalah uji ketahanan 56 plasma nutfah karet yang terdiri dari 50 aksesi populasi IRRDB 1981 dan 6 klon karet populasi Wickham terhadap empat isolat C. cassiicola (CC-01, CC-20, CC-22, dan CC-23) yang tergolong sangat virulen. Hasil penelitian menunjukkan bahwa 12 aksesi tergolong sangat tahan, 13 aksesi tahan, 23 aksesi rentan dan 8 aksesi tergolong sangat rentan terhadap PGDC. Terdapat tiga aksesi dari populasi IRRDB 1981 yang memiliki tingkat ketahanan lebih baik dari populasi Wickham yaitu PN 451, PN 494 dan PN 604.
Analisis keragaman genetik plasma nutfah karet menggunakan 15 primer EST-SSR menunjukkan bahwa terdapat keragaman genetik yang cukup tinggi pada populasi yang dianalisis. Analisis filogenetik menunjukkan terdapat tiga kelompok plasma nutfah karet, dimana populasi Wickham berada terpisah dari populasi IRRDB 1981 yang menandakan bahwa terdapat jarak genetik yang cukup jauh antara populasi Wickham dengan IRRDB 1981, serta populasi IRRDB 1981 terpisah lagi menjadi dua kelompok berdasarkan asal geografis dari masing-masing subpopulasi dengan sedikit pencampuran antar subpopulasi. Analisis struktur populasi menggunakan program STRUCTURE menunjukkan bahwa pencampuran yang terjadi kemungkinan disebabkan oleh adanya aliran gen melalui hibridisasi antar populasi.
Berdasarkan informasi yang diperoleh pada percobaan diatas telah dilakukan pemilihan klon-klon yang memiliki sifat ketahanan yang sangat kontras sebagai tetua persilangan. Sebagai tetua betina dipilih klon tahan BPM 1 dan tetua jantan dipilih klon rentan RRIM 600 untuk menghasilkan populasi pemetaan. Dari persilangan kedua klon tetua diperoleh 30 tanaman dan 74 embrio F1. Tanaman F1 yang diperoleh selanjutnya di uji tingkat ketahanannya terhadap PGDC menggunakan dua isolat C. cassiicola yaitu CC-06 yang berasal dari klon GT 1 dan CC-22 yang berasal dari klon RRIM 600. Uji ketahanan menunjukkan bahwa tingkat ketahanan tanaman F1 terhadap kedua isolat bervariasi dengan kisaran 5.2 – 33.4% pada isolat CC-06 dan 3.5–36.4% pada isolat CC-22. Untuk menyusun peta pautan genetik maka telah dilakukan seleksi 135 lokus SSR pada kedua klon tetua untuk memilih lokus-lokus yang polimorfik. 30 lokus terseleksi selanjutnya digunakan untuk mengamplifikasi 104 individu populasi pemetaan dan hanya primer yang bersegregasi 1:1 yang digunakan dalam penyusunan peta pautan genetik. Analisis pautan menggunakan program MAPMAKER/EXP menunjukkan bahwa pada LOD 3 terbentuk 4 kelompok dengan total 8 lokus terpaut, sedangkan pada LOD 2 terbentuk 2 kelompok pautan dengan total 11 lokus terpaut. QTL yang terkait PGDC belum berhasil diidentifikasi pada peta pautan tersebut, namun berdasarkan analisis marka tunggal diketahui bahwa empat lokus (EHB 70, EHB 081, EHBp 18 dan SSRH 548) berasosiasi dengan kedua isolat (06 dan CC-22). Selain itu juga diperoleh satu lokus (HB 68) yang hanya berasosiasi dengan isolat CC-06 dan lima lokus lainnya (gSSR 165, HBE 329, SSRH 103, HB 78 dan gSSR 212) berasosiasi hanya dengan isolat CC-22. Informasi yang diperoleh dalam penelitian ini merupakan langkah awal dalam pengembangan Marker Assisted Selection (MAS) ketahanan terhadap PGDC pada tanaman karet.
SUMMARY
FETRINA OKTAVIA. Genetic Analysis of Corynespora cassiicola isolates and Rubber Germplasm and Identification of Quantitative Trait Loci (QTL) Linked with Resistance to Corynespora Leaf Fall Disease. Supervised by SUDARSONO, DINY DINARTI, KUSWANHADI and WIDODO.
Improvement of rubber cultivation in Indonesia and other major natural rubber producer countries in the world faced constraint the Corynespora leaf fall (CLF) disease attack that significantly reduce the production of the latex. Leaf fall disease caused by the fungus Corynespora cassiicola is one of the important disease which widespread in almost all of the centers of rubber plantations in the world and the spreading is very difficult to control. Using the resistant rubber clones as a planting material is one of the CLF disease control solutions effectively and economically. The rubber breeding program to obtain the superior clones which resistant to CLF disease is often constrained by the length of time required for the selection process, so that the progress of the molecular biology is a chance to solve this case. a series of experiments were carried out aims to: 1) identify the diversity of the C. cassiicola pathogenicity, rDNA- ITS sequences and the cassiicolline-coded genes of C. cassiicola isolates from rubber plantations in Indonesia, 2) evaluate the resistance level of the rubber germplasm to CLF disease, 3) analyzing the genetic diversity and population structure of the rubber germplasm based on EST-SSR markers, and 4) construct the genetic linkage map and to identify the SSR markers associated with CLF disease on rubber tree.
The study was started by evaluation of the virulence of the 23 C. cassiicola
isolates that consist of two groups. The first group was six C. cassiicola isolates collected from the same rubber clones (GT 1) on the six different rubber plantations i.e province of North Sumatra, Bengkulu, Jambi, West Java, Central Java, West Kalimantan and South Sumatra, while the second group was 17 isolates collected from 17 different rubber clones in the same location. The virulence test have been done based on the toxin activity of isolates on the leaf of six rubber clones i.e BPM 1, RRIC 100, 24 BPM, PB 260, GT 1 and RRIM 600 which have the different resistance levels to CLF disease. Virulence analysis showed that there were an interaction between isolates and rubber clones which indicated the differences of the virulence level of each isolates to six rubber clones tested. Geographical and host clones origin of isolates collected affect the virulence ability and diversity of the rDNA-ITS sequences of C. cassiicola
vi
The further experiment was resistance test of 56 rubber germplasm rubber which consist of 50 accessions of IRRDB 1981 population and 6 clones of Wickham population to four of C. cassiicola isolates (CC-01, CC-20, CC-22 and CC-23) that classified as very virulent isolates. The results showed that 12 accessions classified as very resistant, 13 of resistant accessions, 23 of susceptible accessions and 8 accessions classified as very susceptible to CLF disease. There were three accessions of IRRDB 1981 population have better resistance levels from Wickham population namely PN 451, PN 494 and PN 604.
Genetic diversity analysis of the rubber germplasm using 15 of EST-SSR primers showed that there was a high genetic diversity on the populations analyzed. Phylogenetic analysis showed that there were three groups of rubber germplasm, which of the Wickham population was separated from IRRDB 1981 population indicated that there was a high genetic distance between Wickham and IRRDB 1981 populations, as well as the IRRDB 1981 population separated into two groups based on the geographical origin with a few admixing of these subpopulations. The population structure analysis using the STRUCTURE program indicated that the genetic admixing due to the gene flow through hybridization between populations.
Acording to the previous studies the clones selection which have a contrastly resistance to CLF disease as a parent tree on pollination. As a female parent was elected a clones resistant of BPM 1 and susceptible clone of RRIM 600 as a male parent to obtain a mapping population. The crossing of both parent clones were obtained 30 of F1 plants and 74 of embryonic F1. Furthermore the F1 plants have been tested resistance to CLF disease using two C. cassiicola isolates namely CC-06 and CC-22 were collected from GT 1 and RRIM 600 rubber clones respectively. The resistance test indicated that there were a variation on the F1 plant resistance levels to both of isolates with range of 5.2 to 33.4% on the CC-06 and 3.5 to 36.4% on the CC-22 isolate. Furthermore to construct a genetic linkage map has been selected 135 of SSR loci on the both of parent clones to choose the polymorphic loci. Furthermore 30 of selected loci were used to amplify all of 104 individuals of mapping population and only SSR loci that 1:1 segregate were used on the construction of genetic linkage maps. Linkage analysis using the MapMaker program demonstrated that there were four linkage groups on the LOD 3 with total 8 loci, while in the LOD 2 formed two linked groups with total 11 of linked loci. QTLs linked CLF disease have not been identified on the linkage map, but based on the single marker analysis showed that four of loci (EHB70, EHB081, EHBp18 and SSRH548) associated with two isolates (06 and CC-22). Moreover single marker anlaysis showed that HB68 locus associated only with CC-06 isolate and five of other loci (gSSR165, HBE 329, SSRH103, HB78 and gSSR212) associated only with CC-22 isolate. The informations obtained in this study were the first step on the development of Marker Assisted Selection (MAS) of rubber resistance to CLF disease.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
ANALISIS GENETIK ISOLAT Corynespora cassiicola DAN
PLASMA NUTFAH KARET SERTA IDENTIFIKASI
QUANTITATIVE TRAIT LOCI (QTL) YANG TERPAUT
KETAHANAN PENYAKIT GUGUR DAUN CORYNESPORA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
FETRINA OKTAVIA
ii
Penguji pada Ujian Tertutup: Dr Ir Asep Setiawan, MS Dr Dra Sekar Woelan, MP
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulis berhasil menyelesaikan disertasi yang berjudul Analisis Genetik Isolat Corynespora cassiicola dan Plasma Nutfah Karet serta Identifikasi
Quantitative Trait Loci (QTL) yang Terpaut Ketahanan Penyakit Gugur Daun Corynespora.
Terima kasih penulis ucapkan kepada Bapak Prof Dr. Ir. Sudarsono, MSc. Sebagai ketua komisi pembimbing, dan kepada Ibu Dr. Diny Dinarti, MSi, Bapak Dr. Widodo, MS dan Bapak Dr. Kuswanhadi, DEA sebagai anggota komisi pembimbing yang telah banyak memberikan saran dan masukan sejak persiapan, pelaksanaan penelitian sampai penyusunan disertasi ini. Penulis juga mengucapkan terima kasih kepada Dr. Yudiwanti Wahyu EK, MS sebagai ketua Program Studi Pemuliaan Bioteknologi Tanaman serta Dr. Hajrial Aswidinoor MSc, Dr. Dewi Sukma MSi, Dr. Asep Setiawan MS, Dr Sekar Woelan MP dan Dr. Thomas Wijaya, MSc yang telah bersedia menjadi penguji luar komisi pada ujian pra kualifikasi, ujian tertutup dan sidang terbuka Program Doktor. Ucapan terima kasih juga penulis ucapkan kepada Kepala Balai Penelitian Sembawa, Direktur Pusat Penelitian Karet dan Direktur PT. Riset Perkebunan Nusantara, yang telah memberikan kesempatan dan dukungan biaya kepada penulis untuk melangsungkan studi S3 di Institut Pertanian Bogor.
Tidak lupa penulis mengucapkan terimakasih kepada teman-teman peneliti, teknisi pemuliaan dan penyakit di Balai Penelitian Sembawa, teman-teman di Laboratorium Biologi Molekuler Tanaman AGH IPB dan teman-teman PBT angkatan 2012 yang telah membantu baik secara fisik maupun psikologis selama berlangsungnya penelitian dan dukungan dalam penulisan disertasi ini.
Ucapan terima kasih yang tidak terhingga penulis sampaikan kepada Ayahanda Damunir dan Ibunda Rosmeinar (Alm), sanak saudara, suami Siad Agung Dermawan dan anak tercinta Aurelia Martalita Siad, atas semua doa, kasih sayang, pengertian, dukungan dan kesabaran yang tidak terbatas selama penulis menempuh pendidikan S3 di IPB. Akhir kata, semoga disertasi ini bermanfaat bagi kemajuan ilmu pemuliaan dan biologi molekuler tanaman, khususnya tanaman karet di Indonesia.
Bogor, 2016
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR ix
DAFTAR LAMPIRAN x
1 PENDAHULUAN
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 4
Manfaat Penelitian 4
Kebaruan Penelitian 5
Ruang Lingkup Penelitian 6 Kerangka Berfikir dan Garis Besar Disertasi 6 aftar Pustaka 9
2 TINJAUAN PUSTAKA
Tanaman Karet (Hevea brasiliensis Muell Arg.) 11
Plasma Nutfah Karet IRRDB 1981 12
Penyakit Gugur Daun Corynespora 12
Keragaman Genetik Isolat C. Cassiicola 13
Gejala Serangan PGDC 15
Mekanisme Interaksi C. cassiicola dan Tanaman Karet 15 Mekanisme Pertahanan Tanaman Karet Terhadap Serangan PGDC 16
Peta Pautan Genetik 18
Pemetaan QTL 19
Daftar Pustaka 19
3 ANALISIS KERAGAMAN PATOGENISITAS, SEKUEN ITS-rDNA DAN GEN PENYANDI CASSIICOLLINE PADA ISOLAT Corynespora cassiicola ASAL PERKEBUNAN KARET DI INDONESIA
Abstrak 23
Abstract 24
Pendahuluan 25
Bahan dan Metode 26
Hasil 32
Pembahasan 39
Simpulan 43
viii
4 IDENTIFIKASI KETAHANAN PLASMA NUTFAH KARET IRRDB 1981 TERPILIH TERHADAP PENYAKIT GUGUR DAUN CORYNESPORA BERDASARKAN AKTIVITAS TOKSIN CASSIICOLLINE
Abstrak 49
Abstract 50
Pendahuluan 51
Bahan dan Metode 52
Hasil dan Pembahasan 53
Simpulan 61
Daftar Pustaka 62
5 KERAGAMAN GENETIK DAN STRUKTUR POPULASI PLASMA NUTFAH KARET BERDASARKAN EST-SSR
Abstrak 65
Abstract 66
Pendahuluan 67
Bahan dan Metode 68
Hasil dan Pembahasan 70
Simpulan 77
Daftar Pustaka 78
6 KONSTRUKSI PETA KETERPAUTAN GENETIK DAN IDENTIFIKASI MARKA SSR YANG BERASOSIASI DENGAN PENYAKIT GUGUR DAUN CORYNESPORA PADA TANAMAN KARET
Abstrak 81
Abstract 82
Pendahuluan 83
Bahan dan Metode 84
Hasil dan Pembahasan 86
Simpulan 98
Daftar Pustaka 98
7 PEMBAHASAN UMUM 101
8 SIMPULAN UMUM 104
LAMPIRAN 106
DAFTAR TABEL
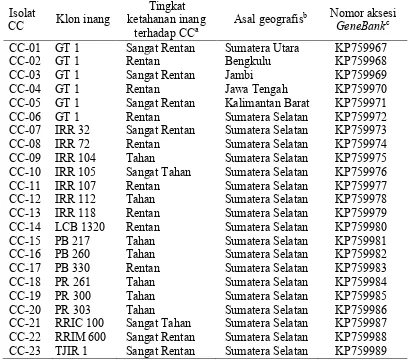
1. Klon karet inang, tingkat ketahanan inang terhadap C. cassiicola, daerah asal dan nomor aksesi Genebank 23 isolat C.cassiicola yang diisolasi
dari perkebunan karet di Indonesia 28
2. Nomor aksesi, spesies inang dan negara asal isolat C. cassiicola yang digunakan dalam analisis filogenetik pada sekuen rDNA-ITS dan gen
cas 31
3. Daftar primer gen cas, suhu anealing dan isoform target yang digunakan
dalam penelitian 32
4. Pengelompokan tingkat virulensi 23 isolat C. cassiicola berdasarkan intensitas kelayuan daun terhadap masing-masing dan rata-rata enam klon karet uji yang memiliki tingkat ketahanan berbeda terhadap PGDC 33 5. Sekuen dan frekuensi haplotipe 23 isolat C. cassiicola dari Indonesia
berdasarkan sekuen ITS-rDNA 37
6.Rata-rata Intensitas kelayuan daun dan pengelompokan tingkat resistensi
plasma nutfah karet terhadap PGDC 56
7. Persentase aksesi tahan dari masing-masing daerah asal plasma
nutfah karet 61
8. Daftar material tanaman, populasi dan asal populasi plasma nutfah karet dari lembah Amazon yang digunakan dalam analisis keragaman genetik
dan struktur populasi 71
9. Ukuran alel, jumlah alel per primer (N), persentase primer polimorfik (PIC), heterozigositas teramati (Ho) dan harapan (He) 15 primer
EST-SSR pada plasma nutfah karet 74
10.Pendugaan jumlah rata-rata alel per primer (Na), rata-rata alel efektif (Ne), heterozigositas teramati (Ho) dan harapan (He), nilai indeks fiksasi (F), rata-rata jumlah alel umum dan spesifik pada
masing-masing populasi plasma nutfah karet 75
11.Analisis khi kuadrat 30 primer SSR segregasi 1:1 pada populasi F1 hasil persilangan klon karet BPM 1 dan RRIM 600 90 12.Hasil analisis asosiasi marker tunggal primer SSR dengan ketahanan
populasi pemetaan tanaman karet terhadap 2 isolat C.cassiicola 93 13.Daftar progeni F1 hasil persilangan klon karet BPM 1 dan RRIM 600,
intensitas kelayuan daun, jumlah lokus yang membawa alel terseleksi
x
DAFTAR GAMBAR
1. Diagram alir penelitian 7
2. Posisi primer ITS pada ribosomal DNA 14
3.Mekanisme aktivasi gen-gen pertahanan pada interaksi patogen-tanaman 17
4. Peta lokasi asal isolat C. cassiicola 29
5. Pengelompokan 23 isolat C. cassiicola berdasarkan intensitas kelayuan
daun 34
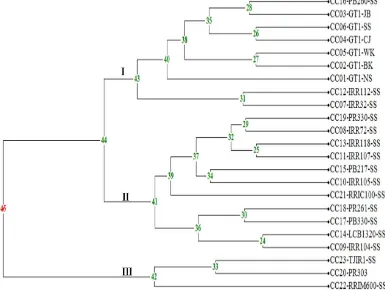
6. Analisis filogenetik 23 isolat C. cassiicola yang berasal dari klon karet
dan daerah berbeda 35
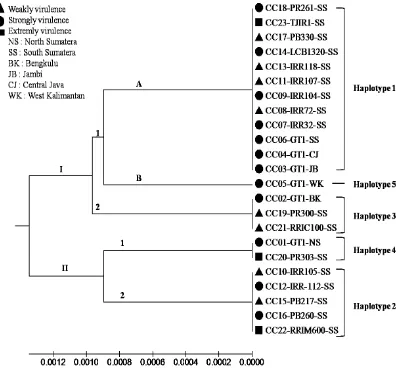
7. Jejaring haplotipe berdasarkan Reduced Median dari sekuen ITS-rDNA
23 isolat C. cassiicola 36
8.Pohon filogenetik 23 isolat C. cassiicola berdasarkan sekuen ITS-rDNA 38 9. Pohon filogenetik 23 isolat C. cassiicola berdasarkan gen cas 39 10.Intensitas kelayuan daun berbagai aksesi karet terhadap 4 isolat C.
cassiicola 55
11.Rata-rata intensitas kelayuan daun plasma nutfah karet PN 1981 pada 4
isolat C. cassicola 56
12.Perbedaan pengaruh toksin terhadap kelayuan dan penggulungan daun pada aksesi tanaman karet sangat tahan (PN 451) dan sangat rentan (PN
22) 58
13.Dendogram pengelompokan plasma nutfah karet berdasarkan tingkat ketahanan terhadap PGDC dengan metode hierarki Euclidean 60
14.Lokasi asal pengumpulan plasma nutfah karet 71
15.Visualisasi pola pita DNA 56 aksesi plasma nutfah karet menggunakan
primer gSSR 268 73
16.Pengelompokan 56 aksesi plasma nutfah karet dengan metode
Neighbour-Joining 74
17.Principal Coordinate Analysis sebaran 56 aksesi plasma nutfah karet 75 18.Estimasi struktur populasi 56 aksesi karet berdasarkan analisis
Structure 76
19.Intensitas Kelayuan Daun 30 progeni F1 hasil persilangan klon karet BPM 1 dan RRIM 600 terhadap filtrat toksin dua isolat C.cassiicola 87 20.Sebaran intensitas kelayuan daun populasi F1 hasil persilangan klon
karet BPM 1 dan RRIM 600 terhadap dua isolat C. cassiicola 88 21.Hasil analisis SSR dan genotyping sebagian populasi pemetaan
tanaman karet 89
22.Peta pautan genetik populasi F1 hasil persilangan klon BPM 1 dan
RRIM 600 91
23.Variasi alel dan rataan tingkat ketahanan populasi pemetaan tanaman karet terhadap isolat C. cassiicola CC-06 pada 5 lokus yang berasosiasi
dengan PGDC 94
24.Variasi alel dan rataan tingkat ketahanan populasi pemetaan tanaman karet terhadap isolat C. cassiicola CC-22 pada 9 lokus yang berasosiasi
25.Variasi alel dan rataan tingkat ketahanan populasi pemetaan tanaman karet terhadap 2 isolat C.cassiicola pada 10 lokus yang berasosiasi
dengan PGDC 98
DAFTAR LAMPIRAN
1. Tahapan isolasi isolat C. cassiicola dari daun karet 107 2. Tahapan persiapan isolat C. cassiicola untuk isolasi DNA 107 3. Tahapan produksi filtrat toksin cassiicolline dan uji virulensi isolat C.
cassiicola dari daun karet 108
4. Tahapan uji ketahanan daun karet berdasarkan aktivitas toksin 108 5. Nomor aksesi dan basa nukleotida sekuen ITS-rDNA 109
6. Basa nukleotida sekuen gen cas 116
7. Tahapan persilangan buatan tanaman karet untuk menghasilkan populasi
F1 117
8. Tahapan isolasi embrio tanaman karet dari buah hasil persilangan 117
1
1 PENDAHULUAN
Latar Belakang
Karet (Hevea brasiliensis) merupakan salah satu tanaman perkebunan yang memiliki peranan penting bagi perekonomian Indonesia, baik sebagai sumber lapangan kerja dan pendapatan petani maupun sebagai sumber devisa negara. Sampai tahun 2014, total areal perkebunan karet di Indonesia tercatat 3,61 juta hektar yang terdiri dari perkebunan rakyat, negara dan swasta dengan total produksi mencapai 3,15 juta ton (BPS 2015). Hal ini menjadikan Indonesia sebagai negara penghasil karet alam terbesar nomor dua di dunia setelah Thailand. Dalam budidaya tanaman karet sering kali dihadapkan pada kondisi yang tidak optimal bagi pertumbuhan dan produksi baik yang disebabkan oleh faktor biotik seperti penyakit maupun abiotik seperti kering alur sadap dan kekeringan. Saat ini terdapat 3 penyakit utama yang paling berpengaruh dalam budidaya tanaman karet yaitu penyakit gugur daun South American Leaf Blight (SALB) yang disebabkan oleh Microcyclus ulei, Penyakit Gugur Daun Corynespora
(PGDC) yang disebabkan cendawan Corynespora cassiicola dan Cendawan Akar Putih (JAP). Di daerah asal tanaman karet seperti Brazil dan negara-negara Amerika Selatan, SALB merupakan penyakit utama yang menyerang hampir semua klon sehingga budidaya karet tidak terlalu berkembang di daerah tersebut. Di Asia Tenggara yang merupakan sentra produksi karet alam yang menyumbang lebih dari 90% produksi karet alam dunia, SALB tidak berkembang, namun PGDC menjadi ancaman utama terhadap penurunan produksi.
PGDC menyerang tanaman karet pada berbagai tingkat perkembangan daun dan umur tanaman. Apabila kondisi lingkungan mendukung, serangan dapat terjadi sepanjang tahun yang mengakibatkan pengguguran daun secara terus menerus sehingga produksi tanaman terhambat. Pada kondisi terserang berat dapat mengakibatkan kematian tanaman sehingga perlu dilakukan pembongkaran dan pemusnahan. Di Indonesia, hampir seluruh daerah sentra karet terserang PGDC yang mengakibatkan kerugian besar secara ekonomis karena penurunan produksi yang mencapai 60% (Situmorang et al. 2007).
2
Ageratum conyzoides dan Centrosema pubescent (Ogbebor & Adenkule 2005) maupun cendawan yang bersifat antagonis (Evueh et al. 2011).
Pengaturan pola penanaman klon dimana dalam suatu areal ditanam berbagai jenis klon merupakan alternatif lain pencegahan PGDC yang sudah banyak diterapkan pada perkebunan-perkebunan besar. Namun sejauh ini semua metode tersebut dirasakan masih belum efektif dalam menanggulangi permasalahan PGDC, sehingga penggunaan klon-klon tahan sebagai bahan tanam menjadi solusi terbaik. Untuk perakitan klon-klon karet yang tahan PGDC tersebut sangat diperlukan informasi yang berkaitan dengan genetik baik patogen maupun tanaman serta mekanisme interaksi keduanya.
Perumusan Masalah
Penggunaan klon-klon unggul sebagai bahan tanam merupakan salah satu komponen penting dalam budidaya tanaman karet. Sesuai dengan arah dan tujuan program pemuliaan tanaman karet, bahan tanam unggul merupakan klon-klon yang memiliki produksi lateks tinggi dan pertumbuhan yang jagur serta karakter agronomis yang baik seperti ketahanan terhadap penyakit, kekeringan, angin, temperatur rendah dan kering alur sadap.
Program pemuliaan tanaman karet untuk menghasilkan klon-klon unggul terdiri dari beberapa tahapan yang meliputi persilangan buatan, seleksi progeni hasil persilangan di lapangan, uji pendahuluan progeni terpilih, uji lanjutan dan uji adaptasi. Dalam proses tersebut terdapat berbagai kendala yang dihadapi terutama yang terkait dengan keterbatasan ketersediaan plasma nutfah sebagai sumber gen-gen karakter agronomis yang diinginkan, keterbatasan areal pengujian dan lamanya waktu yang diperlukan sampai suatu klon dapat dilepas sebagai klon unggul baru.
Persilangan buatan pada tanaman karet secara umum masih menggunakan klon-klon yang sudah dibudidayakan secara luas yang disebut juga dengan populasi Wickham, dimana berdasarkan analisis genetik diketahui bahwa klon-klon tersebut memiliki dasar genetik yang sempit (Besse et al. 1994; Lekawipat et al. 2003; Oktavia et al. 2011). Hal ini diduga karena klon-klon tersebut memiliki asal yang sama. Permasalahan ini dapat diatasi dengan penggunaan plasma nutfah baru hasil eksplorasi IRRDB (International Rubber Research Development Board) di lembah Amazon tepatnya pada tiga negara bagian di Brazil yaitu Rondonia, Acre dan Matto Grosso pada tahun 1981. Aksesi hasil eksplorasi tersebut dinamakan dengan plasma nutfah IRRDB 1981 (PN’81). Berdasarkan pengujian pertumbuhan dan produksi diketahui bahwa plasma nutfah tersebut memiliki pertumbuhan yang jagur namun potensi produksinya dibawah rata-rata klon-klon populasi Wickham. Hal ini menjadi pembatas untuk menjadikan plasma nutfah tersebut langsung sebagai klon produksi, namun berpotensi sebagai sumber materi genetik karakter-karakter agronomis yang bagus salah satunya adalah sumber ketahanan terhadap PGDC, sehingga informasi tingkat ketahanannya perlu diketahui.
3
C. cassiicola penyebab PGDC memiliki keragaman genetik yang luas dan tingkat patogenisitas yang berbeda. Perbedaan ini terjadi karena adanya proses mutasi dan evolusi yang dapat menyebabkan terjadinya perubahan genetik pada isolat. Variasi genetik yang dihasilkan tersebut akan berpengaruh terhadap tingkat ketahanan suatu klon, dimana terdapat interaksi spesifik antara isolat C. cassiicola
dengan suatu klon. Informasi keragaman genetik dan tingkat patogenisitas dari isolat-isolat tersebut sangat diperlukan untuk mengembangkan strategi pemuliaan yang tepat.
Keterbatasan areal dan lamanya waktu seleksi merupakan masalah serius yang dihadapi dalam program pemuliaan tanaman karet secara konvensional, dimana satu siklus pemuliaan yang dimulai dari persilangan buatan sampai dihasilkannya suatu klon unggul anjuran memerlukan waktu 25 - 30 tahun. Salah satu alternatif untuk mengatasi permasalahan tersebut adalah dengan cara memanfaatkan kemajuan di bidang biologi molekuler, yaitu Marker Asissted Selection (MAS).
Pemanfaatan teknik marka molekuler dalam program pemuliaan tanaman diharapkan dapat membantu mempersingkat waktu seleksi, mengurangi areal seleksi dan menghemat biaya. Tersedianya peta pautan genetik merupakan salah satu hal yang diperlukan dalam proses seleksi yang dibantu oleh marka (Lee 1995). Proses seleksi yang dibantu marka dapat dilakukan apabila telah dilokalisir lokus sifat kuantitatif (QTL) atau kualitatif yang terpaut dengan marka molekuler. Pemetaan QTL melibatkan konstruksi peta genomik dan mencari hubungan antara sifat dan marka polimorfik.
Pada dasarnya peta pautan genetik dibangun dengan menggunakan segregasi populasi backcross atau F2. Namun pada tanaman tahunan seperti karet sulit dilakukan backcross atau pembentukan F2 murni. Pada tanaman tahunan yang menyerbuk bebas kemungkinan gen-gen atau marka DNA yang terdapat pada satu individu tanaman mempunyai genotipe yang berbeda, sebagian bersifat heterozigot dan sebagiannya lagi bersifat homozigot dominan atau homozigot resesif. Oleh sebab itu persilangan antara dua tanaman tetua yang demikian akan ditemukan pada tanaman turunan pertama menyerupai konfigurasi backcross pada sebagian marka dan pada sebagian marka yang lain menyerupai konfigurasi F1 dan F2 (Novalina & Sagala 2013).
Menurut Grattapaglia dan Sederoff (1994), salah satu strategi yang dapat dilakukan untuk mengkonstruksi peta pautan genetik pada tanaman tahunan yang menyerbuk bebas seperti tanaman karet adalah melalui strategi pseudotestcross, dimana satu tetua berlaku sebagai tetua uji bagi tetua yang lainnya sehingga nantinya akan diperoleh dua peta pautan yaitu peta tautan tetua betina dan peta pautan tetua jantan. Pada strategi ini marka heterozigot pada satu tetua dan homozigot resesif pada tetua yang lain dipilih melalui skrining rasio segregasi 1:1 pada tanaman turunan. Sekarang ini, populasi turunan pertama hasil suatu persilangan sudah banyak digunakan sebagai populasi pemetaan dalam mengkonstruksi peta pautan seperti yang dilakukan pada tanaman Eucaliptus
(Grattapaglia & Sederoff 1994), leci (Liu & Mei 2003) dan karet (Lespinasse et al. 2000; Le-Guen et al. 2007; Rattanawong et al. 2009; Novalina & Sagala 2013).
4
arrays dari 2-5 pasangan basa nukleotida berulang yang ditemukan secara luas pada organisme eukariota. Marka ini bersifat kodominan dan dapat mendeteksi variasi alel yang tinggi (Panaud et al. 1996). SSR merupakan salah satu marka molekuler yang dapat menganalisis lokus spesifik, bersifat multi alel dan menghasilkan tingkat polimorfisme yang tinggi dalam populasi (Seguin et al.
2001). SSR sudah digunakan untuk pemetaan genetik pada tanaman karet yang terpaut dengan penyakit SALB (Le-Guen et al. 2007), produksi (Rattanawong et al. 2009; Novalina & Sagala 2013) dan pertumbuhan (Souza et al. 2013).
Ketersediaan peta pautan genetik, informasi tentang sifat-sifat yang berasosiasi dengan PGDC, dan informasi tentang marka-marka yang terpaut dengan lokus-lokus pengendali ketahanan terhadap PGDC pada tanaman karet sangat membantu dalam proses seleksi tanaman karet pada masa yang akan datang.
Tujuan Penelitian
Tujuan umum penelitian adalah mengidentifikasi QTL yang terkait dengan penyakit gugur daun Corynespora pada tanaman karet, sedangkan tujuan khusus penelitian adalah :
1. Menerangkan keragaman isolat C. cassiicola asal tanaman karet berdasarkan kemampuan virulensi, basa nukleotida sekuen ITS-rDNA dan sekuen gen penyandi toksin cassiicolline.
2. Mengevaluasi ketahanan terhadap PGDC dan keragaman genetik plasma nutfah karet IRRDB 1981 sehingga dapat dijadikan sebagai dasar pemilihan tetua dalam program pemuliaan tanaman karet.
3. Memperoleh informasi peta keterpautan genetik dan mengidentifikasi keberadaan QTL dan marka-marka yang berasosiasi dengan ketahanan terhadap PGDC pada tanaman karet.
Manfaat Penelitian
Informasi keragaman genetik dan tingkat virulensi isolat C. cassiicola dapat digunakan sebagai dasar dalam menyusun strategi pemuliaan tanaman karet untuk menghasilkan klon-klon karet unggul yang tahan PGDC yaitu dengan memilih isolat paling virulen dalam pengujian klon-klon karet terhadap PGDC. Selain itu informasi tersebut juga berguna untuk menyiapkan metode terbaik dalam mencegah dan mengatasi PGDC.
5 Adanya informasi peta pautan genetik merupakan dasar dalam pengembangan studi identifikasi QTL yang terkait dengan PGDC. QTL dan marka molekuler yang memiliki keterpautan kuat dengan PGDC dapat dijadikan sebagai alat bantu seleksi ketahanan tanaman karet terhadap PGDC sehingga proses seleksi dapat dilakukan dengan cepat dan akurat.
Kebaruan Penelitian
Hasil penelitian yang disajikan dalam disertasi ini merupakan kajian genetika, patologi, pemuliaan dan molekuler yang terkait dengan ketahanan tanaman karet terhadap PGDC yang meliputi virulensi dan genetika isolat C. cassiicola penyebab PGDC, genetika dan pemuliaan tanaman karet terhadap PGDC dan interaksi keduanya ditinjau dari lokus-lokus yang terkait dengan sistem ketahanan tanaman karet terhadap PGDC. Adapun poin-poin kebaruan yang berhasil diperoleh dari penelitian ini adalah:
1. Diperolehnya 23 sekuen nukleotida penyusun gen ITS-rDNA isolat C. cassiicola asal perkebunan karet Indonesia. Sekuen nukleotida yang diperoleh telah di submit di GeneBank NCBI (National Centre for Biotechnology Institute) dan telah dipublikasi secara on line pada http://www.NCBI.nlm.nih.gov/genebank yang dapat diakses secara gratis. 2. Informasi keragaman tingkat virulensi 23 isolat C. cassiicola asal
perkebunan karet Indonesia dan keterkaitannya dengan keragaman genetik berdasarkan sekuen ITS-rDNA. Informasi yang diperoleh sangat bermanfaat dalam program pemuliaan tanaman untuk menghasilkan klon-klon tahan dan penyusunan strategi pengendalian PGDC.
3. Teridentifikasinya keberadaan gen penyandi toksin cassiicolline yang merupakan efektor utama penyebab PGDC pada isolat C. cassiicola asal perkebunan karet Indonesia.
4. Teridentifikasinya tingkat ketahanan plasma nutfah karet IRRDB 1981 terhadap PGDC sehingga aksesi yang memiliki tingkat ketahanan tinggi dapat dijadikan sebagai sumber gen ketahanan dalam program persilangan buatan untuk menghasilkan klon-klon karet unggul tahan terhadap PGDC. 5. Informasi keragaman genetik dan struktur populasi plasma nutfah karet
berdasarkan marka EST-SSR. Informasi yang diperoleh dapat dijadikan sebagai dasar pemilihan tetua dalam program persilangan tanaman karet dan manajemen konservasi plasma nutfah karet.
6. Diperolehnya peta pautan genetik tanaman karet pada populasi F1 menggunakan marka SSR. Peta pautan tersebut merupakan dasar dalam studi genetik untuk memperoleh Marka Asissted Selection (MAS) pada tanaman karet.
6
Ruang Lingkup Penelitian
Kegiatan penelitian ini mempunyai tiga ruang lingkup yang berbeda tetapi saling berkaitan untuk mencapai tujuan yang telah ditetapkan. Ruang lingkup pertama adalah terkait dengan isolat C. cassiicola yang meliputi analisis tingkat virulensi, keragaman genetik berdasarkan sekuen ITS-rDNA dan identifikasi gen penyandi toksin cassiicolline pada 23 isolat C. cassiicola asal tanaman karet Indonesia. Informasi yang diperoleh pada percobaan ini digunakan sebagai dasar pemilihan isolat untuk uji ketahanan pada percobaan selanjutnya. Ruang lingkup kedua adalah terkait dengan plasma nutfah tanaman karet yang meliputi uji ketahanan plasma nutfah terhadap PGDC menggunakan isolat terpilih pada percobaan sebelumnya, serta analisis keragaman genetik dan struktur populasi plasma nutfah tersebut berdasarkan marka EST-SSR. Informasi dari percobaan ini digunakan sebagai dasar dalam pemilihan klon-klon tetua dalam persilangan buatan untuk menghasilkan populasi pemetaan genetik. Ruang lingkup ketiga adalah terkait dengan analisis QTL yang meliputi persilangan buatan untuk menghasilkan populasi F1 yang akan digunakan sebagai populasi pemetaan, uji ketahanan populasi F1 terhadap PGDC (phenotyping) dan analisis SSR populasi pemetaan (genotyping) untuk menyusun peta keterpautan genetik. Berdasarkan data phenotyping dan genotyping dilakukan identifikasi keberadaan QTL dan marka-marka molekuler yang berasosiasi dengan PGDC. Ruang lingkup dan tahapan penelitian ditampilkan pada diagram alir penelitian (Gambar 1).
Kerangka Berfikir dan Garis Besar Disertasi
Serangan PGDC merupakan ancaman dalam budi daya tanaman karet. Hampir semua sentra perkebunan karet di Asia dan Afrika terserang penyakit tersebut sehingga menyebabkan terjadinya penurunan produksi yang cukup tajam. Berbagai cara sudah dilakukan dalam pengendalian PGDC, dimana penggunaan pestisida kimia merupakan cara umum yang banyak dipilih. Sejauh ini metode tersebut belum efektif dalam mengendalikan PGDC, dimana selain mahal dan menghasilkan residu yang berakibat negatif terhadap lingkungan, aplikasi pada tanaman produksi juga sulit dilakukan karena tinggi tanaman karet yang bisa mencapai 10 m. Selain itu penggunaan pestisida secara terus menerus juga dapat mengakibatkan terjadinya tekanan terhadap patogen sehingga patogen menjadi resisten terhadap pestisida tersebut. Pada perkebunan besar pengendalian dengan sistem penanaman secara poliklonal, dimana beberapa jenis klon dengan berbagai tingkat ketahanan ditanam secara bersamaan dalam suatu luas areal tertentu. Hal ini untuk menciptakan kondisi interaksi yang seimbang antara klon dan patogen untuk mencegah timbulnya ras-ras patogen spesifik yang lebih virulen sehingga dapat mematahkan ketahanan penyakit pada tanaman karet. Namun sejauh ini semua cara tersebut dirasakan masih belum efektif dalam mengendalikan serangan PGDC.
7
Gambar 1 Diagram alir penelitian
menghasilkan klon-klon unggul yang tahan terhadap PGDC sudah dilakukan secara rutin dan berbagai klon tahan sudah dihasilkan. Namun sering kali klon tersebut hanya bertahan beberapa tahun, dimana kemudian ketahanan klon-klon tersebut terpatahkan oleh munculnya ras-ras baru patogen yang lebih virulen seperti yang terjadi pada klon GT 1 dan PB 260. Oleh karena itu diperlukan studi genetik yang lebih mendalam terkait dengan patogen maupun klon karet.
Perkembangan program pemuliaan tanaman karet tidak secepat tanaman hortikultura karena siklus hidupnya yang panjang dan latar genetik yang sempit. Seleksi dalam program pemuliaan tanaman karet merupakan salah satu tahapan penting dalam menghasilkan klon-klon tahan. Namun tahapan ini menghadapi kendala yang terkait dengan lamanya waktu yang diperlukan sampai tanaman
Penelitian I
Analisis virulensi isolat
C. casiicola
Analisis genetik isolat C. casiicola berdasarkan sekuen gen ITS-rDNA
Identifikasi gen cassiicolline
isolat C. casiicola
Penelitian II
Uji ketahanan plasma nutfah tanaman karet terhadap PGDC
Penelitian III
Analisis keragaman genetik plasma nutfah karet berdasarkan EST-SSR
Penelitian IV
Persilangan buatan untuk menghasilkan populasi F1
pseudotestcross
Pemilihan tetua untuk persilangan berdasarkan informasi ketahanan dan keragaman genetik plasma nutfah karet
Pemilihan isolat untuk uji ketahanan berdasarkan informasi tingkat virulensi dan keragaman genetik
Uji ketahanan populasi F1 terhadap PGDC (phenotyping)
Analisis SSR populasi F1 (genotyping)
8
tumbuh dan siap untuk diseleksi. Karena itu perlu dicari solusi untuk mengatasi perasalahan tersebut sehingga program pemuliaan tanaman karet untuk menghasilkan klon-klon unggul baru dapat dipercepat.
Berdasarkan permasalahan-permasalahan tersebut dan adanya informasi hasil-hasil penelitian yang terkait dengan serangan dan pengendalian PGDC pada tanaman karet yang telah dipublikasikan sebelumnya yang dijadikan acuan, maka disusun rencana dan dilakukan serangkaian kegiatan penelitian terkait aspek genetika dan molekuler patogen, serta genetika, pemuliaan dan molekuler tanaman karet untuk menjawab permasalahan tersebut seperti yang disajikan dalam disertasi ini. Masing-masing bab menyajikan hasil penelitian dengan topik yang berkesinambungan dan berisi dasar pemikiran, tujuan, metode serta hasil penelitian. Pada Bab I disertasi ini diuraikan tentang latar belakang, tujuan, manfaat, kebaruan penelitian, ruang lingkup penelitian dan kerangka berfikir serta garis besar isi disertasi. Bab II berisi kajian literatur tentang tanaman karet dan pengendalian terhadap serangan PGDC. Pada bab ini diuraikan juga hasil penelitian yang terkait dengan semua aspek yang diteliti pada disertasi ini.
Terjadinya perubahan tingkat ketahanan suatu klon karet terhadap PGDC diduga karena adanya keragaman genetik pada isolat C. cassiicola. Berbagai faktor seperti perubahan iklim dan lingkungan akibat pemanasan global, penggunaan pestisida kimia secara terus menerus maupun tekanan penggunaan klon-klon inang tahan dapat menjadi pemicu terjadinya perubahan dalam genom patogen. Sering kali perubahan ditingkat genetik akan mempengaruhi tingkat virulensi dari isolat tersebut. Berbagai penelitian melaporkan bahwa efektor utama yang mempengaruhi kemampuan virulensi isolat C. cassiicola adalah toksin
cassiicolline yang dihasilkan oleh gen cas. Identifikasi terhadap keberadaan gen cas menunjukkan bahwa terdapat 6 kelas gen dimana terdapat keterkaitan masing-masing kelas dengan tingkat virulensi isolat. Sejauh mana keragaman genetik isolat C. cassiicola asal perkebunan karet Indonesia dan kaitannya dengan kemampuan virulensi isolat tersebut serta jenis gen cas yang terdapat pada masing-masing isolat disajikan pada Bab III disertasi ini.
Berdasarkan informasi yang diperoleh pada Bab III maka dilakukan pemilihan isolat-isolat yang bersifat sangat virulen untuk digunakan dalam pengujian ketahanan plasma nutfah karet terhadap PGDC. Informasi tingkat ketahanan plasma nutfah tersebut sangat penting sebagai dasar pemilihan aksesi-aksesi yang akan dijadikan sebagai tetua sumber gen-gen ketahanan dalam perakitan klon-klon karet unggul yang tahan PGDC. Topik penelitian yang terkait dengan pengujian tersebut disajikan dalam Bab IV.
Selanjutnya dalam Bab V disampaikan informasi keragaman genetik dan struktur populasi plasma nutfah karet yang dianalisis menggunakan marka EST-SSR. Adanya keragaman genetik yang luas merupakan dasar utama dalam pengembangan klon-klon baru.
9 data ketahanan populasi dilakukan identifikasi keberadaan QTL dan analisis asosiasi marka SSR dengan sifat ketahanan terhadap PGDC. Pada Bab VII disampaikan pembahasan umum yang berkaitan dengan hasil-hasil penelitian secara keseluruhan. Sebagai penutup, pada Bab VIII dicantumkan kesimpulan umum dari semua topik yang telah dibahas pada masing-masing bagian disertasi ini.
Daftar Pustaka
Besse P, Seguin M, Lebrun P, Chevallier M, Nicolas D, Lanaud C. 1994. Genetic diversity among wild and cultivated populations of Hevea brasiliensis
assessed by nuclear RFLP analysis. Theor Appl Genet. 88:199-207.
Badan Pusat Statistik. 2015. Statistik Karet Indonesia 2014. Jakarta (ID): BPS Pr. Evueh A, Okhuoya J, Osemwegie O, Attitalla I, Ogbebor O. 2011. Evaluation of
phylloplane fungi as biocontrol agent of corynespora leaf fall disease of rubber (Hevea brasiliensis Muell. Arg.). World J fungal plant Biol. 2(1):1-5. Grattapaglia D, Sederoff R. 1994. Genetic linkage maps of Eucaliptus grandis
and Eucaliptus urophylla using pseudotestcross mapping strategy and RAPD markers. Genetics. 137:1121-1137.
Le-Guen V, Garcia D, Mattos C, Doare F, Lespinasse D, Seguin M. 2007. Bypassing of a phyllogenic Microcyclus ulei resistance in rubber tree, analyzed by QTL detection. New Phytol. 173:335-345.
Lee M. 1995. DNA markers and plant breeding programs. Adv Agron. 55:265-344.
Lekawipat N, Teerawatanasuk K, Rodier-Goud M, Seguin M, Vanavichit A, Toojinda T, Tragoonrung S. 2003. Genetic diversity analysis of wild germplasm and cultivated clones of Hevea brasiliensis Muell. Arg. by using microsatellite markers. J Rub Res. 6(1):36-47.
Lespinasse D, Rodier-Goud M, Grivet L, Leconte A, Legnate H, Seguin M. 2000. A saturated genetic linkage map of rubber tree (Hevea spp.) based on RFLP, AFLP, microsatellite and isozyme markers. Theor Appl Genet. 100:127-138. Liu C, Mei M. 2003. Construction of a lychee genetic linkage map based on RAPD markers. Di dalam: Hammerschlag F. A, Saxena P, editor. XXVI International Horticultural Congress: Biotechnology in horticultural crop improvement; Achievements, opportunities and limitations; 2002 Aug 11-17; Toronto, Kanada. Toronto (CD): Univ Guelph Pr. hlm 131-136.
Manju M, Idikula S, Jacob C, Vinod K, Prem E. 2002. Management of corynespora leff fall (CLF) disease of rubber with based fungiside formulations. Plantation Crops Res Dev In the New Mill :527-530.
Novalina, Sagala AD. 2013. Construction of Hevea brasiliensis genetic linkage map and Identification of quantitative trait loci using RAPD markers. Inter J Adv Sci Eng Inform Tech. 3(1):71-75.
Ogbebor N, Adenkule A. 2005. Inhibition of conidial germination and mycelial growth of Corynespora cassiicola (Berk and Curt) of rubber (Hevea brasiliensis muell. Arg.) using extracts of some plants. African J. Biotech.
10
Oktavia F, Lasminingsih M, Kuswanhadi. 2011. Genetic diversity of wild germplasm and cultivated clones of Hevea brasiliensis muell. Arg.detected by RAPD analysis. J Rubb Res. 14(4):241-251.
Panaud O, Chen X, McCouch S. 1996. Development of microsatellite markers and characterization of simple sequence length polymorphism (SSLP) in rice (Oryza sativa L.). Mol Gen Genet. 252:597-607.
Rattanawong R, Prapan K, Lekawipat N, Seguin M, Clement-Demange A. 2009. Detection of QTLs assotiation with growth, latex production and rubber quality for the development of Marker Asissted Selection (Hevea brasiliensis). IRRDB workshop on genome and transcriptome; 2009 Jun 3-5; Montpellier, Perancis. Montpellier (FR): IRRDB-CIRAD.
Seguin M, Gay C, Xiong TC, Rodier-Goud M. 2001. Microsatellite markers for genome analysis or rubber tree (Hevea spp). Proceedings of IRRDB symposium, 2001 Sept 25-28; Montpellier, Perancis. Montpellier (FR): IRRDB-CIRAD.
Situmorang A, Sinaga M, Suseno R, Hidayat S, Siswanto, Darussamin A. 2007. Penyebaran penyakit gugur daun corynespora pada perkebunan karet di Indonesia. Indon J Rub Res. 25(1):76-82.
11
2 TINJAUAN PUSTAKA
Tanaman Karet (Hevea brasiliensis Muell Arg.)
Karet (H. Brasiliensis) merupakan tanaman tahunan yang berasal dari lembah Amazon, Brazil yang dibawa oleh Henry Wickham masuk ke Indonesia pada tahun 1876 (Dijkman 1951). Cikal bakal tanaman karet yang dibudidayakan saat ini berasal dari 22 biji yang dibawa oleh Henry Wickham tersebut yang tumbuh dan akhirnya berkembang luas.
H. brasiliensis merupakan tanaman dikotil yang menyerbuk silang dengan jumlah kromosom 2n=36. Selain H. Brasiliensis, secara umum tanaman yang termasuk ke dalam kelompok famili Euphorbiaceae mampu menghasilkan getah seperti Ficus elastica Roxb., Castiloa elastica Cerv., Funtumia elastica Stapf.,
Willughbeia spp., Landolphia spp., Palaquium gutta Burck., Payena spp,
Mimosops balata (Aubl.) Gaertn., Achras zapota L., Manihot glaziovii Muell Arg., Cryptostegia spp, Parthenium argentatum Gray dan Solidago spp (Dijkman 1951). Selain H. brasiliensis, terdapat 9 spesies lainnya dalam Genus Hevea yang juga menghasilkan lateks yaitu H. Benthamiana Mull Arg., H. Camargoana Pires,
H camporum Ducke, H. Guianensis Aubl, H. Microphylla Ule, H. Nitida Muell
Arg, H. Pauciflora Muell Arg. H. Rigidofolia Muell Arg. dan H. Spuceana Muell Arg. Namun lateks yang dihasilkan spesies-spesies tersebut kurang layak diusahakan secara ekonomis karena potensi produksinya yang rendah (Webster & Paardekooper 1989).
Pemuliaan tanaman karet diawali dengan penggunaan bahan tanam yang berasal dari biji (seedling) dari keturunan populasi Wickham. Penggunaan bahan tanam tersebut masih memberikan produktivitas yang rendah berkisar antara 330-648 kg/ha/tahun. Seleksi individu yang dilakukan terhadap populasi bersegregasi yang kemudian diperbanyak secara vegetatif telah menghasilkan klon-klon primer dengan potensi produksi lebih dari dua kali lipat dibanding produktivitas sebelumnya. Klon-klon primer yang masih sering dijumpai di lapangan sampai saat ini antara lain GT 1, LCB 1320 dan PR 107. Tahap selanjutnya pemuliaan tanaman karet berkembang melalui persilangan klon-klon tetua yang mempunyai sifat-sifat tertentu. Persilangan antar klon-klon primer menghasilkan klon-klon sekunder seperti PR 255, PR 303, BPM 1 dan RRIM 600, sedangkan persilangan antar klon sekunder atau klon primer dengan klon sekunder menghasilkan klon-klon tersier seperti BPM 24, RRIM 725 dan PB 260. Produktivitas dan sifat pertumbuhan klon sekunder dan tersier lebih baik dibanding dengan klon-klon primer. Pada lingkungan yang sesuai, produktivitas klon-klon-klon-klon karet tersebut mencapai lebih dari 2000 kg/ha/tahun dan tanaman sudah dapat disadap pada umur kurang dari empat tahun (Suhendry et al. 2001).
12
Vijayakumar 1992). Kondisi lingkungan demikian pada umumnya merupakan tipologi agroekosistem daerah tropika basah. Elevasi kebun yang optimal untuk budidaya tanaman karet terletak antara 0-200 m di atas permukaan laut (Darmandono 1996).
Perkebunan karet di Indonesia tersebar pada berbagai kisaran tipe agroklimat yang mempunyai curah hujan antara 1500-4000 mm/tahun. Pada daerah yang kering pertumbuhan tanaman karet lambat dengan produktivitas yang rendah. Sebaliknya pada kondisi curah hujan terlalu tinggi juga kurang baik, karena mempunyai resiko lebih tinggi terhadap serangan penyakit daun dan bidang sadap. Disamping itu jumlah hari hujan juga berkorelasi negatif dengan jumlah hari sadap, sehingga pada daerah yang terlalu basah akumulasi hasil karet dalam setahun akan lebih rendah.
Plasma Nutfah Karet IRRDB 1981
Secara umum plasma nutfah tanaman karet dapat dibedakan atas dua kelompok yaitu populasi Wickham yang masuk ke Indonesia pada tahun 1876 dan populasi Plasma Nutfah IRRDB 1981 (PN’81) hasil eksplorasi IRRDB pada tahun 1981 di lembah Amazon. Populasi Wickham merupakan klon-klon yang sudah dibudidayakan secara umum oleh masyarakat, sedangkan PN’81 masih dalam tahap pengujian di Pusat Penelitian Karet. Pengujian menunjukkan bahwa PN’81 memiliki potensi produksi lateks dibawah rata-rata klon populasi Wickham, sehingga tidak dilepas langsung sebagai klon produksi lateks (Aidi-Daslin, 2009). Namun aksesi-aksesi PN’81 tersebut berpotensi sebagai sumber genetik kar akter-karakter agronomis bagus salah satunya adalah ketahanan terhadap PGDC.
Selama ini program kegiatan pemuliaan tanaman karet masih banyak menggunakan sumber genetik dari klon-klon populasi Wickham. Analisis keragaman genetik menunjukkan bahwa klon-klon tersebut memiliki keragaman genetik yang rendah (Besse et al., 1994; Lekawipat et al., 2003; Oktavia et al., 2011). Keterbatasan dalam keragaman genetik dapat mempengaruhi upaya peningkatan produktivitas klon karet. Ketersediaan plasma nutfah baru merupakan salah satu peluang untuk upaya tersebut.
Penyakit Gugur Daun Corynespora
Pada saat ini terdapat empat jenis penyakit gugur daun yang menyerang tanaman karet yaitu penyakit gugur daun South American Leaf Blight (SALB) yang disebabkan oleh Microcyclus ulei, penyakit gugur daun Colletotricum yang disebabkan oleh Colletotrichum gloeosporioides, penyakit gugur daun Oidium
yang disebabkan oleh Oidium heveae dan penyakit gugur daun Corynespora
13 produksi. Di Amerika Selatan, C. cassiicola ditemukan bukan sebagai cendawan patogen tanaman karet, tapi cendawan endofit yang hidup sebagai saprofit. Sejauh ini belum ditemukan gejala PGDC, namun berdasarkan analisis toksin yang dilakukan isolat tersebut berpotensi menjadi patogen (Déon et al. 2012b).
Keragaman Genetik Isolat C. cassiicola
C. cassicola yang dapat menyerang daun, batang, bunga dan akar tanaman memiliki kisaran inang yang cukup luas, yaitu lebih dari 530 spesies dari 320 genus tanaman (Dixon et al. 2009). Cendawan patogen yang memiliki miselium berwarna coklat kegelapan tersebut termasuk kedalam Kingdom Thallophyta, Kelas Deuteromycetes, Ordo Hyphomycetes, Famili Dentiacea dan Genus
Corynespora.
C. cassiicola memiliki keragaman yang cukup luas, yang dapat ditentukan dengan melihat perbedaan morfologi koloninya, bentuk dan ukuran konidia, tingkat patogenisitas dan perbedaan ditingkat genetik (Darmono et al., 1996; Nghia et al., 2008; Shimomoto et al., 2011). Perbedaan ditingkat morfologi memiliki kelemahan karena adanya faktor pengaruh lingkungan yang dapat menyebabkan perubahan morfologi, sedangkan perbedaan ditingkat genetik bebas dari pengaruh lingkungan dan adanya perbedaan dapat terjadi karena adanya mutasi, substitusi, insersi dan delesi pada materi genetik suatu isolat.
Keragaman genetik isolat C. cassiicola tergantung pada berbagai faktor seperti tanaman inang (Dixon et al. 2009) dan asal geografis (Nghia et al. 2010). Keragaman genetik tersebut dapat dianalisis dengan menggunakan berbagai teknik molekuler seperti RAPD (Random Amplified Polymorphic DNA) (Romruensukharom et al. 2005; Shimomoto et al. 2011), ISSR (Inter Simple Sequence Repeat) (Nghia et al. 2008; Qi et al. 2009b) dan ITS rDNA (Internal Transcribed Spacer ribosomal DNA) (Silva et al. 1998; Atan & Hamid 2003; Qi
et al. 2009; Nghia et al. 2010; Hieu et al. 2014).
Gen rRNA cendawan memiliki sistron yang terdiri dari 18S SSU (Small Sub Unit), 5,8S dan 28S LSU (Large Sub Unit) yang akan ditranskripsikan sebagai suatu unit oleh RNA polymerase I. Diantara ketiga sistron tersebut terdapat suatu sekuen yang disebut dengan ITS, dimana sekuen tersebut terletak diantara 18S dan 28S serta mengapit 5,8S pada gen yang menyandikan rRNA (Gambar 2). ITS merupakan sekuen yang tidak memiliki fungsi dalam unit rRNA, namun berperan dalam menjaga kestabilan proses transkripsi gen-gen penyandi unit rRNA lainnya sehingga pada waktu proses pematangan rRNA sekuen tersebut akan dipotong dan didegradasi dengan cepat. Gen-gen yang mengkode rRNA merupakan sekuen berulang yang terdiri dari ribuan copy. Sekuen-sekuen yang mengkode rRNA tersebut banyak digunakan dalam studi filogenetik cendawan (Glass et al. 2013).
14
Gambar 2 Posisi primer ITS pada ribosomal DNA (White et al. 1990) menunjukan bahwa ITS rDNA merupakan marker universal terbaik dalam identifikasi organisme cendawan dibanding marker universal lainnya seperti 18S, 28S dan gen penyandi protein RPB1.
Sekuen ITS dapat dibedakan menjadi dua bagian yaitu ITS-1 yang terletak diantara 18S dan 5,8S serta ITS-2 yang terletak antara 5,8S dan 28S. Secara umum istilah ITS merujuk pada dua ITS tersebut termasuk 5,8S (Schoch et al.
2012). ITS-1 lebih banyak digunakan sebagai marker yang ideal pada cendawan karena memiliki variasi genetik yang lebih tinggi dibanding ITS-2 sehingga mampu membedakan spesies yang memiliki hubungan kekerabatan yang lebih dekat (Hinrikson et al. 2005). Sekuen ITS-2 memiliki variasi genetik yang tergolong sedang, namun juga dapat membedakan spesies berkerabat dekat dengan baik, dan kadangkala lebih baik dari ITS-1 (Nilsson et al. 2008).
Berdasarkan posisi sekuen ITS-1 dan ITS-2 tersebut sudah dirancang beberapa primer yang dapat mengamplifikasi sekuen ITS yaitu primer ITS1, ITS2, ITS3 dan ITS4 (Gambar 2) (White et al. 1990). Dalam amplifikasi sekuen ITS-1 sering digunakan primer ITS1F. Target utama dari primer ITS1 adalah suatu intron yang terletak pada ujung 3’ dari SSU berbagai organisme cendawan, dan intron tersebut seringkali teramplifikasi ketika digunakan primer ITS1F (Vralstad
et al. 2002).
Gejala Serangan PGDC
Pada tanaman karet, serangan PGDC pertama kali ditemukan di India pada tahun 1958, yang kemudian mulai menyebar ke berbagai negara penghasil karet lainnya. Di Indonesia serangan PGDC mulai ditemukan pada awal tahun 1980 yang diduga penyebaran sporanya dibawa melalui klon KRS 21 yang masuk ke Indonesia melalui program Pertukaran Klon Internasional pada tahun 1974. Serangan patogen tersebut menyebabkan seluruh klon KRS 21 terserang parah dan beberapa klon pertukaran lainnya seperti RRIC 103 dan RRIM 725 juga terinfeksi. Selanjutnya penyebaran patogen ke klon-klon lain hasil seleksi lokal terjadi dengan cepat sehingga beberapa klon seperti PPN 2058, PPN 2444, dan PPN 2447 tercatat sebagai klon yang sangat rentan.
15 berwarna coklat. Gejala awal berupa bercak hitam terutama pada urat atau tulang daun yang baru terlihat setelah daun berwarna hijau muda atau tua. Selanjutnya bercak berkembang mengikuti tulang atau urat daun dan meluas ke urat-urat daun yang kecil didekatnya sehingga bercak terlihat menyirip seperti tulang-tulang ikan. Saat serangan berlanjut bercak akan semakin meluas dimana bagian tepi bercak terlihat berwarna cokelat dan terdapat sirip-sirip berwarna cokelat atau hitam. Lambat laun daun yang terserang akan mengkerut, menguning dan gugur. Tingkat kecepatan penyebaran gejala serangan tersebut sangat tergantung pada kondisi iklim disekitarnya, dimana pada kondisi curah hujan dan kelembaban tinggi serangan akan semakin meningkat (Situmorang et al. 2007).
Mekanisme Interaksi C. cassiicola dan Tanaman Karet
Tingkat ketahanan suatu klon dipengaruhi oleh genetik klon inang, genetik patogen yang menyerang dan faktor lingkungan. Setiap klon sudah memiliki gen-gen ketahanan di dalam gen-genomnya, namun ekspresi dari gen-gen-gen-gen tersebut berbeda pada setiap klon. Demikian juga dengan isolat-isolat patogen yang memiliki gen-gen virulensi, namun ekspresinya berbeda satu sama lain. Analisis terhadap isolat
C. cassiicola yang berasal dari berbagai klon karet menunjukkan bahwa terdapat variasi genetik pada isolat-isolat tersebut dan diduga variasi genetik tersebut berperan penting dalam menentukan tingkat patogenisitasnya (Silva et al. 2003; Nghia et al. 2008; Fernando et al. 2009; Qi et al. 2009).
Interaksi patogen dan tanaman inang diawali dengan menempelnya spora pada permukaan tanaman yang selanjutnya akan membentuk kapak infeksi. Pada tanaman karet, interaksi C. cassiicola diawali dengan terjadinya penetrasi pada permukaan daun tanaman yang terjadi dalam waktu 12 jam setelah inokulasi dan tidak terdapat perbedaan kecepatan penetrasi antara klon resisten dan rentan. Hal ini berarti bahwa patogen mampu menembus lapisan epidermis daun, baik pada klon resisten maupun klon rentan, namun respon selanjutnya berbeda antara kedua jenis klon tersebut. Serangan pada klon rentan menyebabkan kerusakan pada sel epidermis, nukleus dan organel lain sehingga menimbulkan kerusakan parah pada daun. Pada klon resisten kolonisasi cendawan terbatas hanya pada beberapa sel di sekitar hifa cendawan dan tidak menyebar ke jaringan sehat (Breton et al. 2000). Pada waktu proses penembusan lapisan epidermis daun tersebut, C. cassiicola
menghasilkan enzim-enzim yang dapat mendegradasi dinding sel daun seperti
pectin lyase dan selulase (Jayasimghe et al. 1998). Diduga ketahanan yang ditunjukkan oleh klon karet resisten bersifat genetik dan diatur pada tingkat DNA. Studi yang dilakukan oleh (Tan & Tan 1996) menunjukkan bahwa sifat ketahanan tanaman karet terhadap PGDC kemungkinan dikendalikan secara poligenik, namun studi lain yang dilakukan oleh (Hadi et al. 2004) menunjukkan bahwa sifat ketahanan tersebut dikendalikan oleh dua pasang gen utama yang berinteraksi secara epistasis.
16
cassiicolline termasuk tipe Small Secreted Protein (SSP), yaitu suatu senyawa
glycoprotein yang memiliki berat molekul rendah dan kaya dengan residu sistein. Meskipun setiap ras C. cassiicola memiliki struktur SSP homolog, namun memiliki sekuen dan fungsi yang berbeda sehingga tingkat toksisitas cassiicolline
akan berbeda pada setiap ras. Karakterisasi yang dilakukan pada 3 isolat C. cassiicola yang memiliki tingkat virulensi berbeda menunjukkan bahwa setiap ras memiliki jenis cassiicollinee yang berbeda yaitu ras paling virulen memiliki tipe CCP, medium virulen tipe CCAM3 dan avirulen memiliki tipe CCAM1 (Déon et al. 2012a).
Cassiicollinee juga merupakan host-selective toxins (HST), hanya toksik terhadap tanaman tertentu namun tidak toksik terhadap tanaman lain. Seperti kebanyakan HST lainnya, cassiicolline diduga merupakan faktor penentu utama patogenisitas C. cassiicola. Hal ini didukung oleh fakta bahwa kerentanan terhadap toksin sejalan dengan kerentanan terhadap cendawan penghasil toksin, dan sebaliknya, resistensi terhadap toksin sejalan dengan resistensi terhadap cendawannya (Breton et al. 2000; Déon et al. 2012a).
Mekanisme Pertahanan Tanaman Karet Terhadap Serangan PGDC
Pertahanan Secara Struktural
Secara umum mekanisme pertahanan tanaman dari serangan patogen dilakukan melalui proses penguatan struktur permukaan epidermis dengan berbagai cara seperti penebalan lapisan kutikula dan penguatan dinding sel melalui proses lignifikasi. Salah satu penyusun dinding sel tanaman adalah lignin yang merupakan suatu senyawa phenylpropanoid hydroxycinnamyl alcohol.
Proses perlindungan melalui lignifikasi dapat terjadi melalui beberapa cara yaitu peningkatan ketahanan dinding sel, mencegah terjadinya degradasi oleh enzim yang dihasilkan cendawan, menghentikan difusi enzim dan toksin dari cendawan ke tanaman serta nutrisi dan air dari tanaman ke cendawan. Selama polimerisasi akan dihasilkan prekursor fenolik dan radikal bebas yang akan menginaktifasi toksin, serta membran dan ujung hifa cendawan juga dapat terlignifikasi sehingga akan menghilangkan plastisitas hifa untuk tumbuh. Pada tanaman karet yang terserang PGDC, akan ditemukan akumulasi lignin disekitar ujung hifa (Breton et al. 1997a).
Pertahanan Secara Biokimiawi
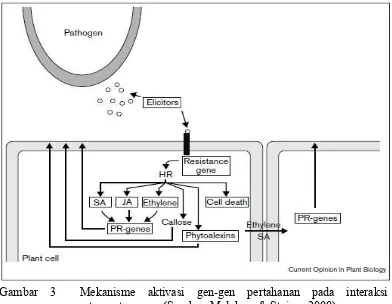
Pada interaksi patogen dengan tanaman terjadi mekanisme kesesuaian genetik, dimana pada saat menyerang tanaman, patogen akan melepaskan elisitor yang ditangkap oleh reseptor yang dihasilkan oleh tanaman. Mekanisme pengenalan elisitor patogen oleh tanaman terdiri dari dua, yang pertama adalah pengenalan protein efektor spesifik yang dihasilkan oleh gen avr yang ditangkap oleh protein reseptor yang dihasilkan oleh gen R. Apabila terdapat kesesuaian antara efektor dan reseptor, terjadi induksi hypersensitive respon (HR) yang akan menginduksi kematian sel dengan cepat (program cell death / PCD), pembentukan kallose, senyawa fitoaleksin serta ekspresi hormon tanaman seperti
17
shynthase dan phenol oxydase (Gambar 3) (Melchers dan Stuiver 2000). Pada dasarnya enzim-enzim tersebut sudah diekspresikan dalam konsentrasi rendah, namun meningkat dengan cepat karena adanya infeksi PGDC. Tingkat aktivitas enzim tersebut juga berbeda antar klon karet, tergantung pada tingkat ketahanan terhadap PGDC dimana aktivitas enzim lebih tinggi pada klon yang tahan dibanding klon yang peka (Philip et al. 2001). Mekanisme interaksi protein efektor dan protein reseptor tersebut dikenal dengan konsep gene for gene yang menghasilkan sistem pertahanan yang disebut dengan ketahanan vertikal yang dapat memberikan perlindungan yang penuh pada tanaman.
Mekanisme kedua adalah deteksi efektor yang tidak spesifik berupa molekul
pathogen-associated molecular patterns (PAMP) seperti lipoplisakarida, enzim, toksin, glikoprotein dan asam lemak yang dihasilkan pada saat patogen menyerang tanaman dan selanjutnya PAMP akan menginduksi ekspresi gen-gen ketahanan. Mekanisme ini memberikan perlindungan yang lebih lemah dibanding mekanisme pertama dan disebut juga dengan ketahanan horizontal (Agrios 2005; Gururani et al. 2011; Robert-Seilaniantz et al. 2011).
Salah satu mekanisme pertahanan utama tanaman karet terhadap PGDC adalah produksi senyawa fitoaleksin yang pada tanaman karet dinamakan dengan
scopoletin. Scopoletin adalah suatu metabolit sekunder yang merupakan senyawa
hydrocaumarin (7-hydroxy-6-methoxy coumaryn) dengan berat molekul rendah dan aktivitas antimikrobial (Breton et al.1997b). Efisiensi scopoletin sebagai antimikroba tergantung kepada kecepatan dan intensitas akumulasi senyawa tersebut pada jaringan yang terserang. Semakin tinggi intensitas dan semakin cepat proses akumulasi yang terjadi maka semakin efisien kerja scopoletin dalam melawan serangan parasit. Namun efisiensi kerja senyawa tersebut dapat dihalangi oleh patogen dengan cara mendegradasinya. Scopoletin dihasilkan
[image:39.595.117.509.448.752.2]18
segera setelah tanaman terserang patogen dengan puncak produksi 48 jam setelah infeksi. Produksi scopoletin tanaman tahan 5 kali lebih tinggi dari tanaman rentan. Hasil ini menunjukkan bahwa intensitas produksinya cukup tinggi dan proses akumulasi terjadi dengan cepat, namun daya toksisitasnya tidak terlalu tinggi. Hal ini kemungkinan disebabkan oleh 2 hal yaitu tingginya efisiensi degradasi
scopoletin oleh C. cassiicola sehingga scopoletin belum dapat bekerja dengan efektif dan meningkatnya aktivitas peroksidase yang menjadikan scopoletin
sebagai substrat. Namun demikian produk hasil oksidasi scopotein oleh peroksidase tersebut memiliki tingkat toksisitas yang lebih tinggi dibanding
scopoletin itu sendiri (Breton et al. 1997b).
Peta Pautan Genetik
Peta genetik dari suatu spesies tanaman merupakan model abstrak pengaturan linier dari suatu ke