STUDI PERBANYAKAN JARAK PAGAR UNGGUL
(Jatropha curcas L.) SECARA IN VITRO MELALUI
LINTASAN ORGANOGENESIS DAN
EMBRIOGENESIS
ANGGI NINDITA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis “Studi Perbanyakan Jarak Pagar Unggul (Jatropha curcas L.) secara in Vitro Melalui Lintasan Organogenesis dan Embriogenesis” adalah karya saya sendiri dengan arahan Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2010
Anggi Nindita
through Organogenesis and Embryogenesis. Under supervision of Bambang S. Puwoko as chairman; Darda Efendi, and Iswari Saraswati Dewi as members of the advisory committee.
Plant species with rich secondary metabolites such as Jatropha curcas L. is difficult to propagate through tissue culture. Once established, tissue culture propagation supports uniform propagules supply. The objectives of the research were to obtain in vitro culture media for shoot induction through organogenesis and embryogenesis pathway. Three experiments were conducted. Plant materials used in the first experiment were cotyledon and hypocotyl from seed cultured in vitro, while in the second experiment were stem segments excised from young shoots of two month cuttings and leaves from cuttings grown in the greenhouse. In the third experiment embryo axis and cotyledon were used to obtain somatic embryo. The results of the first experiment showed that shoot induction can be obtained from both cotyledons and hypocotyls.However hypocotyls gave more shoots and leaves than cotyledons when cultured in MS + IAA 0.1 mg/l + BAP 3.0 mg/l. In second experiment, based on number of shoots and time of shoots initiation, MS+BAP 4.0 mg/l gave the highest number of shoots and earlier time of shoot initiation. However the highest number of leaves was given by MS+ NAA 0.5 mg/l + BAP 4.0 mg/l. In the third experiment, somatic embryos were obtained only from MS medium supplemented with picloram 1.0 mg/l for both embryo axis and cotyledon explants.
Anggi Nindita. Studi Perbanyakan Jarak Pagar Unggul (Jatropha curcas L.) secara in
Vitro Melalui Lintasan Organogenesis dan Embriogenesis. Dibawah bimbingan
Bambang S. Purwoko sebagai ketua Komisi Pembimbing, Darda Efendi dan Iswari Saraswati Dewi sebagai anggota Komisi Pembimbing.
Penelitian ini bertujuan untuk memperoleh konsentrasi zat pengatur tumbuh dan jenis eksplan yang tepat, yang berpotensi untuk menginduksi organogenesis dan embriogenesis jarak pagar in vitro. Kegiatan penelitian secara keseluruhan terdiri atas tiga percobaan yaitu : (1) organogenesis in vitro pada kotiledon dan hipokotil tanaman jarak pagar; (2) Induksi organogenesis dari stek batang dan daun tanaman jarak pagar, dan (3) Studi perbanyakan masal jarak pagar secara in vitro melalui lintasan embriogenesis somatik.
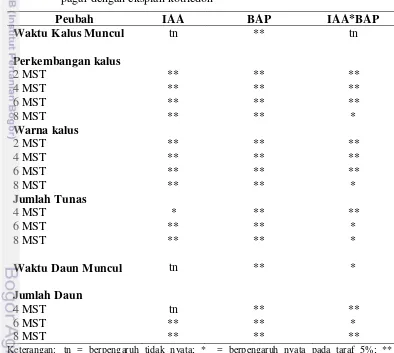
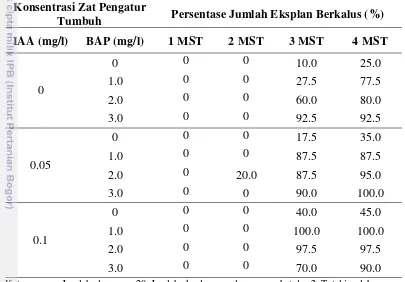
Percobaan pertama yaitu organogenesis in vitro pada kotiledon dan hipokotil tanaman jarak pagar. Percobaan pertama terdiri dari dua percobaan yaitu percobaan 1a adalah pengaruh taraf IAA dan BAP terhadap induksi tunas jarak pagar dengan menggunakan eksplan hipokotil. Percobaan kedua yaitu percobaan 1b adalah pengaruh taraf IAA dan BAP terhadap induksi tunas jarak pagar dengan eksplan kotiledon. Pada kedua percobaan ini digunakan rancangan faktorial yang disusun secara acak kelompok (RAK) dengan dua faktor. Faktor pertama adalah taraf kombinasi zat pengatur tumbuh IAA ( 0; 0.05 dan 0.1 mg/l). Faktor kedua adalah BAP (0; 1.0; 2.0; 3.0 mg/l). Setiap kombinasi perlakuan diulang 20 kali, sehingga setiap percobaan terdapat 12 x 20 = 240 botol satuan percobaan, satuan percobaan adalah dua eksplan per botol. Pengamatan dilakukan dengan mengamati pertumbuhan dan perkembangan eksplan setiap minggu selama delapan minggu. Peubah yang diamati adalah skor perkembangan kalus, skor warna kalus, waktu kalus muncul, jumlah daun, waktu daun muncul, jumlah tunas, dan waktu daun muncul.
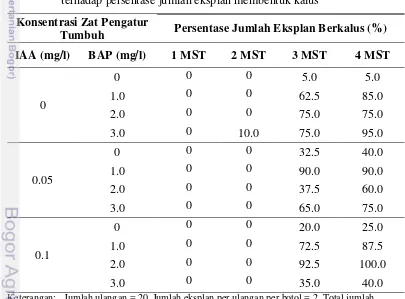
Percobaan kedua adalah Induksi organogenesis dari stek batang dengan jumlah buku lebih dari satu dan daun tanaman jarak pagar. Pada percobaan ini eksplan yang digunakan adalah eksplan yang berasal dari IP-1P yang sudah distek selama ± 2 bulan. Percobaan kedua terdiri dari dua percobaan, yaitu percobaan 2a adalah pengaruh konsentrasi NAA dan BAP terhadap induksi tunas jarak pagar dengan menggunakan eksplan stek batang dan Percobaan 2b adalah pengaruh konsentrasi NAA dan BAP terhadap induksi tunas jarak pagar dengan menggunakan eksplan daun. Pada kedua percobaan ini digunakan rancangan faktorial yang disusun secara acak kelompok (RAK) dengan dua faktor. Faktor pertama adalah taraf kombinasi zat pengatur tumbuh yaitu NAA (0; 0.5; 1.0 mg/l). Faktor kedua adalah taraf kombinasi zat pengatur tumbuh BAP (0; 2.0; 3.0; 4.0 mg/l). Setiap kombinasi perlakuan diulang 10 kali, sehingga terdapat 12 x 10 = 120 satuan percobaan pada setiap percobaan, masing-masing 1 botol dengan 2 eksplan per botol. Pengamatan dilakukan dengan mengamati pertumbuhan dan perkembangan eksplan setiap minggu, selama delapan minggu. Peubah yang diamati adalah jumlah eksplan yang berkalus, waktu pembentukan kalus (HST), jumlah daun dan waktu pembentukan daun.
Pada percobaan tiga yaitu studi perbanyakan masal jarak pagar secara in vitro
kali, sehingga terdapat 14 x 10 = 140 satuan percobaan. Pengamatan dilakukan dengan mengamati pertumbuhan dan perkembangan eksplan setiap minggu. Peubah yang diamati adalah skor perkembangan kalus, skor warna kalus, jumlah embrio somatik, waktu munculnya embrio somatik.
Hasil penelitian pada percobaan pertama menunjukkan bahwa induksi tunas dapat diperoleh dari eksplan yang berasal dari hipokotil dan kotiledon. Percobaan dengan menggunakan eksplan hipokotil manghasilkan jumlah tunas lebih banyak dibandingkan eksplan kotiledon pada kombinasi zat pengatur tumbuh IAA 0.1 mg/l+ BAP 3.0 mg/l. Pada percobaan kedua, eksplan daun tidak berhasil menginduksi tunas, sedangkan eksplan dengan stek batang mampu menginduksi tunas. Berdasarkan jumlah tunas dan waktu muncul tunas kombinasi zat pengatur tumbuh MS+NAA 0 mg/l + BAP 4.0 mg/l menghasilkan jumlah tunas yang terbanyak dan waktu muncul kalus yang tercepat. Jumlah daun yang terbanyak pada percobaan kedua adalah pada media MS+NAA 0.05 mg/l + BAP 4.0 mg/l. Pada percobaan ketiga, embrio somatik dapat terbentuk pada media yang mengandung picloram 1.0 mg/l saja untuk jenis eksplan aksis embrio dan kotiledon.
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
STUDI PERBANYAKAN JARAK PAGAR UNGGUL
(Jatropha curcas L.) SECARA IN VITRO MELALUI
LINTASAN ORGANOGENESIS DAN
EMBRIOGENESIS
ANGGI NINDITA
Tesis
Sebagi salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Pemuliaan Tanaman dan Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Anggi Nindita NIM : A253074011
Disetujui,
Komisi Pembimbing
Ketua
Prof.Dr.Ir. Bambang Sapta Purwoko, MSc.
Anggota
Dr.Ir. Darda Efendi, MSi.
Anggota
Dr.Ir. Iswari Saraswati Dewi
Diketahui,
Ketua Mayor
Pemuliaan Tanaman dan Bioteknologi
Dr. Ir. Trikoesoemaningtyas, MSc.
Dekan Sekolah Pascasarjana
Prof.Dr.Ir. Khairil A. Notodiputro, MS.
karunia dan rahmat-Nya sehingga karya ilmiah ini dapat diselesaikan dengan baik.
Penelitian berjudul ‘Studi Perbanyakan Jarak Pagar Unggul (Jatropha curcas L)
Secara In Vitro Melalui Lintasan Organogenesis dan Embriogenesis’ dilaksanakan
sejak bulan Agustus 2009 - Juni 2010.
Terima kasih penulis ucapkan khusus kepada ketua komisi pembimbing
Bapak Prof.Dr.Ir. Bambang Sapta Purwoko, M.Sc. Beliau tidak hanya sebagai
pembimbing tetapi juga sebagai orangtua yang selalu memberikan bimbingan
yang terarah kepada penulis tentang cara berpikir yang sistematis, disiplin, dan
selalu memberikan motivasi sehingga penulis dapat menyelesaikan studi dan
penulisan thesis. Terima kasih kepada Bapak Dr.Ir. Darda Efendi, M.Si. atas
bimbingannya yang analitis dan sistematik, dan terimakasih kepada Ibu Dr.Ir.
Iswari Saraswati Dewi selaku pembimbing yang intensif memberikan masukan
yang berharga dan menjadikan penulis semangat untuk menjadi seorang peneliti,
serta Ibu Dr. Ir. Dewi Sukma M.Si sebagai dosen penguji yang telah banyak
memberi saran. Selanjutnya penghargaan dan ucapan terima kasih penulis
ucapkan kepada Ecoscience bekerjasama dengan SBRC LPPM-IPB atas beasiswa
pendidikan yang diberikan kepada penulis, serta kepada Direktorat Jenderal
Pendidikan Tinggi melalui Hibah Kompetitif Penelitian sesuai Prioritas Nasional
Nomor: 343/SP2H/PP/DP2M/VI/2009, yang diberikan kepada Prof.Dr.Ir.
Bambang Sapta Purwoko, M.Sc dan Dr.Ir. Darda Efendi, M.Si. atas bantuan dana
penelitian yang diberikan.
Ungkapan terima kasih juga disampaikan kepada Orang Tua, Suami,
keluarga dan seluruh sahabat. Semoga bimbingan dan segala bentuk bantuan yang
telah diberikan dari semua pihak mendapatkan nilai ibadah yang diterima oleh
Allah SWT. Semoga thesis ini dapat memberikan manfaat bagi para pembaca dan
pengembangan ilmu pengetahuan. Terimakasih.
Bogor, Agustus 2010
Penulis dilahirkan di Depok pada tanggal 9 Maret 1983 sebagai anak
pertama dari pasangan Bapak Djumar Hanifa Hutagalung dan B. Shinta
Dharmapadni. Penulis menikah dengan Ardianto Mufaadi SP. M.Si.
Penulis menyelesaikan pendidikan formal di SDN Anyelir II Depok pada
tahun 1994, SLTPN II Depok pada tahun 1997, dan SMU Negeri 109 Jakarta
Selatan pada tahun 2000. Penulis mendapatkan gelar Sarjana Pertanian di Program
studi Pemuliaan Tanaman dan Teknologi Benih, Jurusan Budi Daya Pertanian,
Fakultas Pertanian, Institut Pertanian Bogor pada tahun 2004.
Penulis bekerja sebagai staf di Pusat Penelitian Surfaktan dan Bioenergi
(SBRC LPPM-IPB) untuk penelitian tanaman jarak pagar dari tahun 2007 sampai
dengan tahun 2010. Tahun 2008 penulis melanjutkan pendidikan program
Magister, Program Studi Pemuliaan Tanaman dan Bioteknologi pada Sekolah
ix
Pelaksanaan Penelitian ... 16
Metode Penelitian ... 19
Percobaan I. Organogenesis In vitro pada Kotiledon dan Hipokotil . 20 Percobaan II. Induksi Organogenesis dari Stek tunas dan Daun ... 22
Percobaan III. Studi Perbanyakan Masal Jarak Pagar secara In vitro Melalui Lintasan Embriogenesis Somatik ... 23
Model Statistik untuk Semua Percobaan ... 26
HASIL DAN PEMBAHASAN ... 27
Percobaan I. Organogenesis In vitro pada Kotiledon dan Hipokotil ... 27
Kondisi Umum ... 27
Kondisi Umum pada Percobaan 1a ... 28
Kondisi Umum pada Percobaan 1b ... 29
Waktu Muncul Kalus ... 30
Waktu Muncul Kalus pada Percobaan 1a ... 30
Waktu Muncul Kalus pada Percobaan 1b ... 31
Jumlah Eksplan Membentuk Kalus ... 32
Jumlah Eksplan Membentuk Kalus pada Percobaan 1a ... 32
Jumlah Eksplan Membentuk Kalus pada Percobaan 1b ... 33
Perkembangan Kalus ... 34
Perkembangan Kalus pada Percobaan 1a ... 34
Perkembangan Kalus pada Percobaan 1b ... 35
x
Jumlah Tunas pada Percobaan 1a... 39
Jumlah Tunas pada Percobaan 1b ... 40
Waktu Muncul Daun ... 41
Waktu Daun Kalus pada Percobaan 1a... 41
Waktu Daun Kalus pada Percobaan 1b ... 42
Jumlah Daun ... 43
Jumlah Daun pada Percobaan 1a ... 43
Jumlah Daun pada Percobaan 1b ... 43
Percobaan II. Induksi Organogenesis dari Stek in vtro dan Daun ... 45
Kondisi Umum ... 45
Waktu Muncul Tunas ... 46
Jumlah Eksplan Membentuk Tunas ... 48
Jumlah Tunas ... 49
Jumlah Daun ... 50
Percobaan III. Perbanyakan Masal Jarak Pagar Secara In Vitro Melalui . Lintasan Embriogenesis Somatik... 52
Kondisi Umum ... 52
Jumlah Eksplan Berkalus dan Jumlah Eksplan Membentuk Embrio Somatik ... 52
Perkembangan Kalus dan Warna Kalus ... 53
Jumlah Embrio Somatik ... 55
Waktu Muncul Embrio Somatik ... 57
KESIMPULAN DAN SARAN ... 59
Kesimpulan ... 59
Saran ... 59
DAFTAR PUSTAKA ... 60
xi
No Halaman
1 Kombinasi perlakuan konsentrasi zat pengatur tumbuh IAA dan BAP
dengan eksplan hipokotil ... 20
2 Kombinasi perlakuan konsentrasi zat pengatur tumbuh IAA dan BAP
dengan eksplan kotiledon ... 21
3 Kombinasi perlakuan konsentrasi zat pengatur tumbuh NAA dan BAP dengan eksplan stek batang ... 22
4 Kombinasi perlakuan konsentrasi zat pengatur tumbuh NAA dan BAP dengan eksplan daun ... 23
5 Kombinasi perlakuan konsentrasi zat pengatur tumbuh 2,4-D dan
picloram dengan jenis eksplan ... 24
6 Rekapitulasi uji F pengaruh IAA dan BAP terhadap induksi tunas jarak pagar dengan eksplan hipokotil ... 28
7 Rekapitulasi uji F pengaruh IAA dan BAP terhadap induksi tunas jarak pagar dengan eksplan kotiledon ... 29
8 Pengaruh konsentrasi zat pengatur tumbuh IAA dan BAP pada eksplan hipokotil terhadap waktu muncul kalus ... 30
9 Pengaruh konsentrasi zat pengatur tumbuh IAA dan BAP pada eksplan kotiledon terhadap waktu muncul kalus ... 31
10 Pengaruh konsentrasi zat pengatur tumbuh dari eksplan hipokotil terhadap persentase jumlah eksplan membentuk kalus ... 32
11 Pengaruh konsentrasi zat pengatur tumbuh dari eksplan kotiledon terhadap persentase jumlah eksplan membentuk kalus ... 34
12 Pengaruh konsentrasi zat pengatur tumbuh IAA dan BAP pada eksplan hipokotil terhadap perkembangan kalus ... 35
13 Pengaruh konsentrasi zat pengatur tumbuh IAA dan BAP pada eksplan kotiledon terhadap perkembangan kalus ... 36
14 Pengaruh konsentrasi zat pengatur tumbuh IAA dan BAP pada eksplan hipokotil terhadap warna kalus ... 37
15 Pengaruh konsentrasi zat pengatur tumbuh IAA dan BAP pada eksplan kotiledon terhadap warna kalus ... 38
16 Pengaruh konsentrasi zat pengatur tumbuh IAA dan BAP pada eksplan hipokotil terhadap jumlah tunas ... 39
17 Pengaruh konsentrasi zat pengatur tumbuh IAA dan BAP pada eksplan kotiledon terhadap jumlah tunas ... 40
xii
20 Pengaruh konsentrasi zat pengatur tumbuh IAA dan BAP pada eksplan hipokotil terhadap jumlah daun ... 44
21 Pengaruh konsentrasi zat pengatur tumbuh IAA dan BAP pada eksplan kotiledon terhadap jumlah daun ... 44
22 Rekapitulasi uji F pengaruh NAA dan BAP terhadap induksi tunas jarak pagar dengan eksplan stek batang dan daun... 45
23 Pengaruh konsentrasi zat pengatur tumbuh terhadap waktu terbentuknya tunas pada stek batang pada 12 MST (Minggu Setelah Tanam) ... 46
24 Pengaruh konsentrasi zat pengatur tumbuh dari eksplan stek batang terhadap persentase jumlah eksplan bertunas (%) pada 12 MST (Minggu Setelah Tanam) ... 48
25 Pengaruh konsentrasi zat pengatur tumbuh terhadap jumlah tunas pada eksplan stek tunas pada 12 MST (Minggu Setelah Tanam) ... 50
26 Pengaruh konsentrasi zat pengatur tumbuh terhadap jumlah daun pada eksplan stek batang pada 12 MST (Minggu Setelah Tanam)... 51
27 Rekapitulasi sidik ragam pada induksi embrio somatik ... 52
28 Pengaruh konsentrasi zat pengatur tumbuh dan jenis eksplan terhadap persentase jumlah eksplan berkalus dan jumlah eksplan membentuk
embrio somatik pada 12 MST (Minggu Setelah Tanam) ... 53
29 Pengaruh jenis eksplan terhadap perkembangan kalus ... 53
30 Pengaruh konsentrasi zat pengatur tumbuh pada jenis eksplan aksis embrio dan kotiledon terhadap perkembangan kalus pada 12 MST
(Minggu Setelah Tanam) ... 54
31 Pengaruh konsentrasi zat pengatur tumbuh terhadap warna kalus pada 12 MST (Minggu Setelah Tanam) ... 55
32 Pengaruh jenis eksplan dan konsentrasi zat pengatur tumbuh terhadap
jumlah eksplan membentuk embrio somatik ... 56
xiii
No Halaman
1 Tahapan perbanyakan jarak pagar dari stek batang dan daun ... 18
2 Alur penelitian studi perbanyakan masal jarak pagar secara in vitro melalui lintas organogenesis dan embriogenesis ... 19
3 Skoring perkembangan kalus ... 25
4 Skoring warna kalus... 25
5 Sumber eksplan dan tahapan perkecambahan secara in vitro. ... 27
6 Perkembangan kalus pada eksplan yang berasal dari hipokotil (A) dan kotiledon (B) pada 8 MST... 36
7 Warna kalus putih bening (A) dan hijau bening (B)... 39
8 Organogenesis dari eksplan hipokotil (A) dan eksplan kotiledon (B) ... 41
9 Tahapan perkembangan organogenesis lapang dari eksplan stek batang .. 47
10 Kalus embriogenik yang diduga membentuk tahapan globular ... 55
11 Eksplan yang membentuk embrio somatik pada tahapan (A) globular, (B) torpedo, dan (C) kotiledon ... 57
xiv
No Halaman
1 Komposisi larutan stok media Murashige dan Skoog (MS) ... 66
2 Pembuatan larutan stok untuk zat pengatur tumbuh ... 66
3 Hasil optimasi cara sterilisasi jarak pagar serta persentase keberhasilan sterilisasi eksplan ... 67
4 Deskripsi jarak pagar IP-1P... 70
5 Sidik ragam perkembangan kalus pada eksplan hipokotil (Percobaan I) . 71 6 Sidik ragam perkembangan kalus pada eksplan kotiledon (Percobaan I) .. 73
7 Sidik ragam warna kalus pada eksplan hipokotil (Percobaan I)... 75
8 Sidik Ragam Warna Kalus pada Eksplan Kotiledon (Percobaan I) ... 77
9 Sidik ragam jumlah daun pada eksplan hipokotil (Percobaan I) ... 79
10 Sidik ragam jumlah daun pada eksplan kotiledon (Percobaan I) ... 81
11 Sidik ragam jumlah tunas pada eksplan hipokotil (Percobaan I) ... 83
12 Sidik ragam jumlah tunas pada eksplan kotiledon (Percobaan I)... 85
13 Sidik ragam waktu muncul kalus pada eksplan hipokotil (Percobaan I) ... 86
14 Sidik ragam waktu muncul kalus pada eksplan kotiledon (Percobaan I) .. 86
15 Sidik ragam waktu muncul daun eksplan hipokotil (Percobaan I) ... 87
16 Sidik ragam waktu muncul daun pada eksplan kotiledon (Percobaan I) ... 87
17 Sidik ragam jumlah tunas (Percobaan II) ... 87
18 Sidik ragam jumlah daun (Percobaan II) ... 88
19 Sidik ragam perkembangan kalus (Percobaan III) ... 88
20 Sidik ragam warna kalus (Percobaan III) ... 88
Latar Belakang
Cadangan minyak mentah dunia semakin hari semakin berkurang
sedangkan kebutuhannya semakin meningkat seiring dengan pertambahan
penduduk dunia. Menghadapi kenaikan harga minyak pada tahun 2005,
pemerintah Indonesia melakukan kebijakan pengembangan Bahan Bakar Nabati
(BBN) yang merupakan sumber energi yang dapat diperbaharui dan ramah
lingkungan (Krisnamurthi 2006). Diharapkan dengan adanya kebijakan tersebut
kebutuhan Indonesia terhadap minyak bumi dapat dipenuhi dengan sumber energi
nabati hingga 2% kebutuhan saat ini (Ditjen Migas 2009). Penggunaan minyak
nabati menarik bagi investor dan pekerja lingkungan dalam konteks clean
development mechanism (Achten et al. 2008). Beberapa tanaman yang
mempunyai potensi sebagai bahan bakar nabati antara lain kelapa sawit, kelapa,
ubi kayu, ubi jalar, tebu, kedelai, jagung, dan jarak pagar.
Jarak pagar (Jatropha curcas L.) merupakan tanaman yang diunggulkan
di Indonesia sebagai penghasil minyak untuk biodiesel. Jarak pagar merupakan
species dari famili Euphorbiaceae yang tumbuh di daerah tropis. Tanaman jarak
pagar juga dapat digunakan untuk reklamasi lahan karena dapat tumbuh di lahan
bekas tambang (Aderibigbe et al. 1997). Namun demikian, produktivitas jarak
pagar masih relatif rendah, sehingga upaya untuk meningkatkan produktivitas
menjadi prioritas. Salah satu permasalahan yang menyebabkan petani kurang
tertarik untuk mengembangkan jarak pagar adalah belum tersedianya jarak pagar
yang berproduksi tinggi sehingga mampu memberikan keuntungan bagi petani
yang membudidayakan tanaman jarak pagar.
Hasil penelitian menunjukkan bahwa produktivitas jarak pagar pada tahun
pertama cukup bervariasi, yaitu 0.3 kg/pohon (Heller 1996), 400 kg/ha/tahun
(Jones and Miller 1992), 200 kapsul/tanaman atau 0.36 kg/pohon (Hasnam et al.
2007). Pada tanaman dewasa dengan input yang rendah produksi biji hanya
sekitar 0.5 ton/tahun/hektar namun dengan input yang tinggi produksi biji dapat
mencapai sekitar 4-5 ton/tahun/hektar (Feike et al. 2007). Potensi produksi biji
880.78 kg/ha (352.31 gram/tanaman) dari tanaman asal stek, dan 749.81 kg/ha
(299.92 gram/tanaman) dari tanaman asal biji, serta 484.11 kg/ha (193.64
g/tanaman) dari tanaman asal biji yang kemudian dipangkas (Santoso et al. 2008).
Saat ini tanaman jarak pagar mulai dikembangkan sebagai komoditas
penting sumber penghasil energi alternatif yang dapat diperbaharui. Sebelumnya
tanaman jarak pagar tidak memiliki nilai ekonomi selain sebagai pagar atau
tanaman obat sehingga tidak menjadi prioritas objek penelitian. Namun saat ini
akibat peningkatan budidaya jarak pagar di Indonesia maka timbul beberapa
permasalahan dalam pengembangan tanaman jarak pagar yaitu belum adanya
varietas yang unggul, jumlah ketersediaan bibit yang terbatas, teknik budidaya
yang belum memadai dan sistem pemasaran dan harga yang belum ada standar
(Hariyadi 2006).
Upaya pengembangan tanaman jarak pagar memerlukan penyediaan bibit
atau benih sebagai bahan tanam. Perbanyakan jarak pagar dapat ditempuh dengan
cara konvensional dan non konvensional. Secara konvensional jarak pagar
biasanya diperbanyak dengan stek batang dan biji. Perbanyakan dengan stek
batang membutuhkan syarat-syarat tertentu antara lain stek diambil dari tanaman
yang telah berumur 4 tahun, berdiameter 1.5 – 2.5 cm dan panjang 25 – 40 cm dan
berbentuk lurus (Hasnam dan Zainal 2006), sedangkan perbanyakan non
konvensional adalah pemakaian teknologi kultur jaringan. Perbanyakan dengan
teknik ini memiliki kelebihan yaitu tanaman dapat diperbanyak setiap saat tanpa
tergantung musim karena dilakukan di ruang tertutup, tidak memerlukan bahan
tanam yang banyak, dapat memperbanyak tanaman dalam jumlah besar dalam
waktu yang relatif singkat dan tanaman yang dihasilkan seragam bebas dari
penyakit.
Selain beberapa kelebihan yang dimiliki oleh teknik kultur jaringan
terdapat beberapa syarat lain yang harus dipenuhi oleh suatu tanaman. Syarat awal
untuk menetapkan metode kultur jaringan sebagai suatu cara perbanyakan pada
suatu tanaman yaitu : (1) kecepatan organogenesis atau embriogenesis untuk
pembentukan planlet tinggi, (2) planlet yang dihasilkan secara in vitro harus
mampu bertahan di lapangan dan penampakan di lapangan seperti yang
keuntungan lebih dibandingkan sistem perbanyakan secara konvensional, dan (4)
sifat-sifat atau karakteristik yang diinginkan harus dapat dipertahankan (Gunawan
1992).
Pengembangan tanaman jarak pagar menghadapi kendala penyediaan
bahan tanaman berupa varietas unggul. Produksi jarak pagar dapat ditingkatkan
dengan pengembangan kultivar yang resisten hama dan penyakit, toleran
kekeringan dan produktivitas tinggi, antara lain adalah dengan metode rekayasa
genetika. Penerapan metode rekayasa genetika memerlukan eksplan yang mampu
membentuk tunas atau embrio somatik secara efisien sebagai targetnya. Kedua
teknik ini perlu dikembangkan sehingga diperoleh informasi sistem regenerasi in
vitro yang baik. Regenerasi tanaman sifatnya spesifik untuk tiap-tiap genotipe
tanaman, alternatif teknik regenerasi tunas (organogenesis) atau embrio somatik
(embriogenesis) perlu dibakukan untuk masing–masing genotipe.
Penentu keberhasilan dalam pembentukan tunas adventif atau embrio
somatik adalah tersedianya zat pengatur tumbuh. Oleh karena itu perlu adanya
penelitian regenerasi tanaman secara in vitro melalui organogenesis dan
embriogenesis dengan informasi yang tepat mengenai jenis dan konsentrasi zat
pengatur tumbuh dalam media induksi.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk memperoleh : (1) jenis eksplan, dan
kombinasi konsentrasi zat pengatur tumbuh yang optimum untuk menginduksi
organogenesis pada jarak pagar; (2) jenis eksplan, dan kombinasi konsentrasi zat
pengatur tumbuh yang optimum untuk menginduksi embriogenesis somatik pada
jarak pagar.
Hipotesis Penelitian
1. Terdapat jenis eksplan dan kombinasi konsentrasi zat pengatur tumbuh yang
optimum untuk menginduksi organogenesis pada jarak pagar.
2. Terdapat jenis eksplan dan kombinasi konsentrasi zat pengatur tumbuh yang
Botani dan Ciri Morfologi Jatropha curcas L.
Jarak pagar (Jatropha curcas Linn.) adalah tanaman perdu (semak) famili
Euphorbiaceae yang berasal dari Amerika Selatan. Dari berbagai pustaka
disebutkan bahwa jarak pagar berasal dari Amerika Tengah dan Meksiko,
kemudian menyebar ke Afrika dan Asia. Di Meksiko, tanaman tumbuh secara
alami di kawasan hutan pinggiran pantai. Di Afrika dan Asia, jarak pagar hanya
ditemukan sebagai tanaman pagar atau pembatas lahan pertanian. Jarak pagar
menyebar di Malaka setelah tahun 1700-an dan di Filipina sebelum tahun 1750
(Heller 1996). Di Indonesia, tanaman ini diperkenalkan oleh Jepang pada tahun
1942 sebagai tanaman pekarangan. Beberapa nama daerah jarak pagar yaitu jarak
kosta atau jarak budeg (Sunda), jarak gundul atau jarak pager (Jawa), kelekhe
paghar (Madura), jarak pager (Bali), lulu mau, paku kase, dan jarak pageh (Nusa
Tenggara), kuman nema (Alor), jarak kosta, jarak wolanda, bindalo, bintalo, dan
tondo utomene (Sulawesi), serta ai huwa kamala, balacai dan kadoto (Maluku)
(Hambali et al. 2006).
Jarak pagar termasuk dalam divisi Spermatophyta, sub-divisi
Angiospermae, kelas Dicotyledonae, ordo Euphorbiales, famili Euphorbiaceae,
genus Jatropha, dan species Jatropha curcas L. (Nurcholis dan Sumarsih 2007).
Genus Jatropha memiliki 175 spesies (Liu et al. 2007); dari jumlah ini lima
spesies terdapat di Indonesia, yaitu J. Curcas L dan J. gossypiifolia yang sudah
digunakan sebagai tanaman obat sedangkan J. integerrima Jacq, J. multifida dan
J. podagrica Hook digunakan sebagai tanaman hias (Hasnam 2006). Diantara
jenis tanaman jarak tersebut yang memiliki potensi sebagai penghasil minyak
bakar (biofuel) adalah jarak pagar (Hariyadi 2006).
Tanaman jarak pagar merupakan tanaman multiguna yang pemanfaatannya
sangat luas. Menurut Heller (1996), manfaat lain tanaman jarak pagar dibedakan
berdasarkan bagian-bagian dari tanaman jarak pagar antara lain:
a. Bagian Tanaman. Jarak pagar dibudidayakan sebagai tanaman pagar untuk memagari kebun dan lahan, menjaga tanaman kebun dari hewan yang
Verde, jarak pagar ditanam di daerah gersang (kering) untuk mengontrol erosi
tanah akibat air atau angin, dan kayunya digunakan sebagai bahan bakar. Di
daerah Madagaskar, Pulau Comore, Papua Nugini, dan Uganda jarak pagar
digunakan sebagai tanaman penunjang untuk vanila.
b. Buah. Bagian buah terdiri atas kulit buah, kulit biji dan biji. Kulit buah maupun kulit biji digunakan untuk kayu bakar dan bahan baku pupuk organik.
c. Biji. Biji jarak pagar dapat dipres sampai mengeluarkan minyak jarak dan menyisakan bungkil. Minyak jarak terutama sebagai salah satu sumber bahan
baku biodiesel. Hasil samping pembuatan biodiesel berupa gliserin dapat
digunakan sebagai bahan baku pembuatan sabun. Bungkil jarak pagar dapat
diolah menjadi arang briket yang merupakan salah satu sumber energi alternatif
yang dapat digunakan untuk bahan bakar rumah tangga.
Manfaat lain jarak pagar adalah ekstrak biji, daun dan kulit pohon jarak
pagar dapat digunakan sebagai obat tradisional. Ekstrak metanol dari daun jarak
pagar dapat melindungi sel limfoblastoid pada manusia melawan efek cytopathic
dari virus human immunodeficiency virus (HIV). Daun yang masih muda aman
dimakan jika dikukus atau direbus. Air rebusannya dapat digunakan untuk
mengobati batuk dan sebagai antiseptik setelah melahirkan. Daunnya digunakan
juga sebagai teh untuk obat malaria (Henning 2007). Di beberapa wilayah tertentu
di Meksiko jarak pagar dapat dimakan karena tidak mengandung phorbol ester
sehingga tidak beracun. Minyak jarak pagar berguna sebagai obat pencuci perut,
penyakit kulit dan rematik. Phorbol ester dari minyaknya digunakan untuk
mengontrol berbagai hama. Di Nigeria jarak pagar digunakan untuk stik permen
karet. Getah dari batang digunakan untuk menghentikan pendarahan pada luka
(Heller 1996, Henning 2007). Getah mengandung agen antimikroba
Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae, Streptococcus
pyogenes dan Candida albicans.
Tanaman jarak pagar adalah tanaman perdu dengan tinggi 1 -7 meter
dengan sistem perakaran berupa akar tunggang berwarna putih kecoklatan. Batang
berwarna putih kotor, berkayu, silindris, dan bergetah (Hariyadi 2006) dengan
percabangan tidak teratur yang terdiri atas cabang primer, cabang sekunder, dan
pertama kali terbentuk. Cabang yang terbentuk pada cabang primer disebut
sebagai cabang sekunder yang merupakan tempat tumbuh dari cabang terminal.
Cabang terminal adalah cabang tempat tumbuhnya daun, bunga, dan buah. Oleh
karena itu, jumlah cabang terminal ditentukan oleh jumlah cabang primer dan
sekunder. Dalam budidaya, jumlah cabang primer dibatasi 3 – 5 cabang/tanaman,
dan tiap cabang primer dibatasi tiga cabang sekunder. Jumlah cabang terminal
dalam satu tanaman lebih dari 40 – 45 cabang akan menyebabkan produksi
menurun, sehingga setiap cabang sekunder hanya dibatasi tiga cabang terminal
(Ferry 2006).
Daun berwarna hijau lebar daun 6 – 16 cm dan panjang tangkai daun 4 –
15 cm. Struktur daun berupa daun tunggal, berbentuk bulat telur (elips), berlekuk,
bersudut tiga atau lima, dan tulang daun menjari dengan 5 – 7 tulang utama
(Hariyadi 2006).
Jarak pagar adalah tanaman monosius dengan bunga berkelamin satu
(uniseksual) dan jarang yang hermaphrodite. Bunga tersusun dalam malai
(inflorescence) dengan lima kelopak bunga (sepal) dan lima mahkota bunga
(petal) yang berwarna hijau–kekuningan atau coklat–kekuningan. Bunga jantan
mempunyai 10 benang sari (stamen) dengan pola tersusun dalam dua lingkaran
(whorl) masing-masing terdiri atas lima benang sari yang menyatu membentuk
tabung. Bunga betina berukuran lebih besar dibanding bunga jantan terdiri atas
bakal buah (ovarium) dengan lima lokus (ruang) yang masing–masing berisi satu
bakal biji (ovulum). Tangkai putik (stilus) melekat pada pangkal bunga dengan
kepala putik (stigma) terpecah tiga (Hasnam 2006). Hariyadi (2006) menyatakan
bahwa dalam satu bunga umumnya terdapat tiga ovul/ovarium.
Jarak pagar tumbuh di dataran rendah sampai ketinggian sekitar 1000 m di
atas permukaan laut. Curah hujan berkisar antara 300-2380 mm/tahun. Suhu yang
sesuai untuk pertumbuhan tanaman jarak adalah 20-26oC. Tanaman jarak
memiliki sistem perakaran yang mampu menyerap air sehingga toleran terhadap
kekeringan. Tanaman ini dapat tumbuh pada tanah berpasir, tanah berbatu, tanah
lempung, atau tanah liat. Tanaman ini dapat beradaptasi pada tanah yang kurang
subur, memiliki drainase baik, tidak tergenang dan pH tanah 5.0-6.5 (Hariyadi
Perbanyakan jarak pagar dapat dilakukan secara generatif dengan biji
(secara langsung atau melalui pembibitan sebelum penanaman) (Achten et al.
2008), secara vegetatif dengan stek (Swamy dan Singh 2006; Fieke et al. 2007)
atau melalui kultur jaringan (Datta et al. 2007). Eksplan yang dapat digunakan
dalam perbanyakan kultur jaringan jarak pagar yaitu bagian hipokotil, epikotil,
pucuk, daun, dan tangkai daun (Sujatha dan Mukta 1996; Wei Qin et al. 2004).
Perbanyakan vegetatif dapat berasal dari stek cabang maupun stek pucuk.
Penggunaan stek cabang sebagai bahan tanaman perlu memperhatikan diameter,
umur yang dicirikan dengan berkayu dan belum berkayu dan panjang stek. Stek
cabang yang cukup baik pertumbuhannya adalah stek yang berdiameter 2 cm,
berkayu berwarna hijau keabuabuan (Ferry 2006). Menurut Santoso dan Purwoko
(2008) pertumbuhan dan perkembangan tanaman jarak pagar yang berasal dari biji
dan stek batang memiliki pertumbuhan vegetatif (tinggi tanaman, jumlah daun dan
jumlah cabang skunder) yang sama. Tanaman berasal dari stek lebih cepat
berbunga dibandingkan tanaman dari biji. Namun menurut Heller (1996),
perbanyakan tanaman dari stek menunjukkan umur yang lebih pendek dan
ketahanan kekeringan dan penyakit yang lebih rendah dibanding yang
diperbanyak dari biji. Hal ini menurut Kumar dan Sharma (2008) mungkin
disebabkan tanaman yang dihasilkan dari stek tidak menghasilkan akar tunggang
(karena itu kurang toleran terhadap kekeringan). Tanaman dari stek menghasilkan
akar-tunggang palsu yang dapat menembus hanya 1/2 atau 2/3 kedalaman tanah
dibandingkan akar tunggang yang dihasilkan tanaman yang tumbuh dari biji. Akar
tunggang tanaman yang berasal dari biji langsung, diyakini dapat mencapai
lapisan tanah yang lebih dalam.
Sebagai tanaman menyerbuk silang, tanaman jarak pagar membutuhkan
agensia polinator (biasanya serangga) untuk memfasilitasi terjadinya penyerbukan
silang. Aktivitas polinator yang tinggi akan mendukung terjadinya persilangan
antar individu tanaman (Heliyanto 2007). Adikadarsih dan Hartono (2007)
mengemukakan bahwa penggunaan biji jarak pagar untuk benih harus berasal dari
buah yang berwarna kuning hingga kuning kehitaman karena memiliki daya
Biji jarak pagar merupakan biji berkeping dua (dikotil). Secara umum biji
jarak tersusun atas kulit (shell) dan isi biji (kernel) yang di dalamnya terdapat
embrio. Kulit menempel sekitar 28.82% dari biji, dan isi sekitar 71.19%. Isi biji
terdiri atas embrio, kotiledon atau daun biji (Santoso et al. 2007).
Kultur Jaringan Tanaman
Menurut Zulkarnain (2009), kultur jaringan adalah istilah umum yang
ditujukan pada budidaya secara in vitro terhadap berbagai tanaman yang meliputi
batang, daun, akar, bunga, kalus, sel, protoplas, dan embrio. Bagian-bagian
tersebut disebut eksplan, diisolasi dari kondisi in vivo dan dikulturkan pada
medium buatan yang steril sehingga dapat beregenerasi dan berdiferensiasi
menjadi tanaman lengkap.
Gunawan (1992) menyebutkan kultur jaringan atau teknik kultur jaringan
in vitro adalah suatu metode pembiakan vegetatif yang dilakukan dengan cara
menumbuhkan sel, jaringan atau organ, dalam media aseptik yang kaya nutrisi dan
zat pengatur tumbuh dalam wadah tertutup yang tembus cahaya dengan tujuan
agar bagian-bagian tersebut memperbanyak diri dan beregenerasi kembali menjadi
tanaman lengkap. Hartmann et al. (1990), menggunakan istilah yang lebih
spesifik, yaitu mikropropagasi terhadap pemanfaatan teknik kultur jaringan dalam
upaya perbanyakan tanaman.
Hartmann dan Kester (1983) menyatakan bahwa proses yang menginduksi
pembentukan jaringan dari sel atau kalus menjadi tunas, tunas adventif atau akar
hingga akhirnya menjadi tanaman lengkap yang sempurna disebut organogenesis.
Menurut Zhang dan Lemaux (2005) pada kultur in vitro organogenesis tunas
berasal dari differensiasi sel somatik bukan dari sel embrio. Organogenesis
tersebut dikendalikan oleh keberadaan gen pada eksplan yang berespon terhadap
pemberian zat pengatur tumbuh sehingga mempengaruhi pembelahan sel dan
proses diferensiasinya.
Metode perbanyakan tanaman secara in vitro dapat ditempuh dengan dua
cara yaitu (1) melalui multiplikasi tunas dari mata tunas aksilar, dan (2) melalui
pembentukan tunas adventif dan embrio somatik secara langsung maupun tidak
pertama yaitu perbanyakan tunas dari mata tunas aksilar lebih banyak digunakan
dalam usaha perbanyakan tanaman. Telah banyak penelitian yang dilakukan
membuktikan bahwa metode tersebut lebih cepat dan sedikit atau tidak terjadi
penyimpangan genetik, sedangkan morfogenesis tidak langsung melalui
pembentukan kalus dapat menyebabkan tingkat penyimpangan genetik yang lebih
tinggi dan waktu perbanyakan yang lebih lama.
Keberhasilan teknik kultur jaringan ditunjukkan dengan adanya
pertumbuhan dan perubahan bentuk jaringan yang dikulturkan yang dipengaruhi
oleh faktor genotipe dari bakal tanaman yang dikulturkan, media dan zat pengatur
tumbuh, faktor lingkungan dan faktor fisiologi jaringan yang digunakan sebagai
eksplan (George dan Sherrington 1984).
Kultur Jaringan Tanaman Jarak Pagar
Perbanyakan jarak pagar dapat dilakukan secara generatif dengan biji (biji
secara langsung atau pembibitan sebelum penanaman) (Achten et al. 2008), secara
vegetatif dengan stek (Swamy dan Singh 2006; Fieke et al. 2007) dan melalui
kultur in vitro atau kultur jaringan (Datta et al. 2007).
Dalam pelaksanaan kultur in vitro dengan tujuan untuk perbanyakan
vegetatif tanaman diperlukan beberapa langkah umum seperti penyiapan eksplan,
sterilisasi baik alat–alat yang digunakan maupun eksplan, pembuatan media,
penanaman dan regenerasi tanaman menjadi planlet dan aklimatisasi (Gunawan
1992).
Sebelum melakukan kultur in vitro untuk suatu tanaman kegiatan pertama
yang perlu dilakukan adalah memilih tanaman induk yang hendak diperbanyak.
Tanaman tersebut harus jelas jenis, spesies dan varietas serta harus sehat dan
bebas dari hama dan penyakit. Hampir semua bagian tanaman yang masih muda
yang keadaan sel-selnya masih aktif membelah merupakan bagian tanaman yang
paling baik untuk eksplan (Wattimena et al. 1992).
Pada tanaman jarak pagar (Jatropha curcas L.) eksplan yang dapat
digunakan berupa hipokotil, epikotil, pucuk, daun dan tangkai daun (Sujatha et
al. 2008; Wei Qin et al. 2004). Salah satu faktor pembatas dalam keberhasilan
kultur. Inisiasi eksplan yang bebas kontaminan merupakan langkah yang sangat
penting. Bahan tanam dari lapangan mengandung debu, kotoran dan berbagai
kontaminan hidup pada permukaannya. Kontaminan hidup dapat berupa
cendawan, bakteri, serangga, tungau serta spora (Gunawan 1992).
Pemilihan metode sterilisasi harus tepat karena sterilisasi hanya
mengeliminasi kontaminan dan tidak mematikan jaringan eksplan. Sterilisasi
eksplan biasa dilakukan dengan menggunakan bahan-bahan kimia berupa sabun,
bakterisida dan fungisida seperti deterjen, benlate, dithane 45, agrimicyn, HgCl2,
dan Na hipoklorit. Sterilisasi tanaman jarak pagar (Jatropha curcas L.) dapat
dilakukan dengan merendam biji jarak yang telah dikupas dalam larutan 0.15%
HgCl2 selama 25 menit dan dibilas dengan air steril (Wei Qin et al. 2004).
Kondisi fisik media ada dua macam yaitu media padat dan media cair.
Media cair tidak menggunakan bahan pemadat berupa agar. Media padat terdiri
atas unsur hara, hormon, vitamin, gula dan sukrosa, dan dalam media harus ada
pelarut yang berupa air dan atau pemadat (agar, gelrite). Keuntungan penggunaan
media padat (agar) adalah : (1) agar membeku pada suhu <450 C dan mencair
pada suhu 1000
µ
C, sehingga dalam kisaran suhu kultur, media dalam keadaan
stabil, (2) tidak dicerna oleh enzim, (3) tidak bereaksi dengan
persenyawaan-persenyawaan penyusun media.
Zat pengatur tumbuh merupakan salah satu komponen media yang sangat
berpengaruh dalam keberhasilan teknik kultur jaringan tanaman jarak pagar,
terutama keseimbangan antara auksin dan sitokinin karena merupakan agen yang
mengatur pertumbuhan. Kombinasi penggunaan auksin dan sitokinin dapat
meningkatkan pertumbuhan tanaman jarak pagar. Penggunaan IBA 0.1 mg/l dan
BA 0.5 mg/l dapat menginduksi pembentukan tunas dari epikotil (Wei Qin et al.
2004). Penelitian Sujatha dan Mukta (1996) menyimpulkan bahwa penggunaan
IBA 4.9 M dan BA 2.22 µM merupakan kombinasi terbaik untuk menginduksi
tunas adventif.
Sujatha et al. (2008) menggunakan eksplan stek batang (stem segment)
yang ditanam pada media MS dan BAP 2 mg/l untuk menginduksi tunas,
sedangkan dengan penambahan IAA 0.5 mg/l, adenin sulphat 25 mg/l, glutamine
penggunaan sitokinin dan auksin disamping dapat menginduksi tunas juga dapat
menginduksi kalus. Pada percobaan Lu Wei et al. (2003) penggunaan media MS
dengan 1 mg/l IBA dan 0.5 BA mg/l dapat menginduksi pembentukan kalus pada
daun.
Pemberian GA3 dapat dilakukan untuk mempercepat pemanjangan tunas
(Deore dan Johnson 2008), sedangkan adenin sulfat dapat membantu proses
pertumbuhan embrio somatik (Jha et al. 2007) dan meningkatkan vigoritas planlet
(Shrivastava dan Banerjee 2008). Untuk menginduksi perakaran dapat digunakan
media tanpa zat pengatur tumbuh (Sujatha dan Mukta 1996; Jha et al. 2007),
diberi NAA 1,0 mg/l (Sujatha et al. 2008), IBA 0.1-0.3 mg/l (Deore dan Johnson
2008) atau pada media ½ MS dikombinasikan dengan IBA 3.0 mg/l (Shrivastava
dan Banerjee 2008). Keberhasilan dalam aklimatisasi planlet yang telah berakar
berkisar 80-100% (Sujatha dan Mukta 1996; Jha et al. 2007; Deore dan Jhonson
2008; Shrivastava dan Banerjee 2008). Saat ini Karyanti et al. (2008) telah
berhasil menginduksi tunas dari eksplan daun yang berasal dari bibit asal biji yang
dikecambahkan dengan menggunkan BAP (4.0 ppm dan 5.0 ppm) atau kinetin
(15.0 ppm dan 20.0 ppm).
Selain itu, Kalimuthu et al. (2007) menggunakan varietas lokal di
Coimbatore, India untuk menghasilkan 30-40 tunas adventif per eksplan dalam
waktu 30-40 hari dengan menggunakan BAP 1.5 mg/l, Kinetin 0.5 mg/l, dan IAA
0.1 mg/l, sedangkan Datta et al. (2007) menumbuhkan eksplan tunas aksilar pada
media yang mengandung BA 5 mg/l dan adenin sulfat 22.5 mg/l untuk
menghasilkan tunas adventif dengan produksi 6.2 + 0.6 tunas per eksplan. Biji
jarak diambil dari Ramakhrishna Mission, Narendrapur, West Bengal, India.
Multiplikasi tunas terbaik dari tunas aksilar ditemukan pada media dengan BA 0.5
mg/l dan IBA 0.1 mg/l yang menghasilkan 5.9 tunas pada minggu ke-6. Akar
dihasilkan setelah 5 minggu pada media dengan IBA 0.5 mg/l yang disubkultur ke
media tanpa ZPT. Shrivastava dan Banerjee (2008) menggunakan bahan tanaman
dari Bhopal, India untuk menginisiasi tunas dengan BA 3 mg/l, IBA 1 mg/l,
adenin sulfat 25 mg/l, glutamin 50 mg/l, L-Arginin 15 mg/l, dan asam sitrat 25
mg/l. Perakaran dipacu pada media ½ MS yang ditambah IBA 1-4 mg/l dan
Rajore dan Batra (2005) melaporkan regenerasi tanaman jarak pagar yang
efisien dengan menggunakan eksplan tunas apikal dari varitetas lokal di Jaipur,
India. Multiplikasi tunas terbaik diperoleh pada media MS dengan BAP 2 mg/l
dan IAA 0.5 mg/l dengan tambahan adenin sulfat, glutamin, dan arang aktif.
Penelitian yang dilakukan oleh Kaewpoo dan Te-chato (2009)
mengemukakan bahwa semua jenis eksplan (tunas aksilar, tunas apikal, dan
batang) yang dikulturkan dengan BA 0.5 mg/l dan IBA 0.25 mg/l memberikan
hasil terbaik pada pembentukan tunas. Tunas aksilar mampu diinduksi sampai 5.3
tunas baru per eksplan, sedangkan eksplan tunas apikal menghasilkan 5.3 tunas
per eksplan dan eksplan batang menghasilkan 5.1 tunas per eksplan.
Organogenesis dengan menggunakan eksplan daun muda dari hasil
perkecambahan in vitro telah berhasil didapatkan oleh Deore dan Johnson (2008).
Biji yang digunakan asal klon elit dari Kakinada, South of Andhra Pradesh, India.
Induksi kalus terbaik terjadi pada media MS ditambah TDZ 0.5 mg/l, BA 0.5 mg/l
dan IBA 0.1 mg/l. Perbanyakan dan perpanjangan tunas dilakukan pada media
yang mengandung BA 1 mg/l ditambah kinetin 0.5 mg/l, IAA 0.25 mg/l, dan GA3
µ
0.25 mg/l. Kemudian planlet dipindahkan ke media perakaran terbaik yaitu IBA
0.1 mg/l selama 30 hari. Induksi tunas pada daun jarak pagar juga didapatkan oleh
Karyanti et al. (2008) dalam media MS yang mengandung BAP 4 atau 5 mg/l dan
kinetin 15 atau 20 mg/l, yang mampu memproduksi pembentukan tunas tertinggi.
Zat Pengatur Tumbuh dalam Kultur Jaringan
Zat pengatur tumbuh (ZPT) adalah senyawa organik bukan nutrisi yang dalam
konsentrasi rendah (<1 M) bersifat mendorong, menghambat atau secara
kualitatif mengubah pertumbuhan dan perkembangan tanaman (Wattimena 1988),
sedangkan menurut Beyl (2005) zat pengatur tumbuh akan memberikan pengaruh
pada selang konsentrasi 0.001-101µM.
Zat pengatur tumbuh juga menstimulasi pembelahan dan perkembangan
sel, kadang-kadang jaringan atau eksplan dapat memproduksi zat pengatur
tumbuh sendiri (endogen), tetapi biasanya zat pengatur tumbuh harus
ditambahkan dari luar ke medium kultur jaringan untuk pertumbuhan dan
pengatur tumbuh dari luar adalah untuk mengubah nisbah zat pengatur tumbuh
yang ada pada tanaman. Perubahan nisbah selanjutnya mengubah laju
pertumbuhan dan perkembangan tanaman. Menurut Zulkarnain (2009) untuk
mendapatkan hasil yang maksimum dari perlakuan zat pengatur tumbuh maka
komponen medium lainnya harus berada pada kadar yang optimum.
Menurut Wattimena (1988), zat pengatur tumbuh dikelompokkan menjadi
lima golongan yaitu auksin, sitokinin, asam absisik (ABA), etilen dan retardan.
Jenis zat pengatur tumbuh yang sering digunakan dalam kultur jaringan adalah
auksin dan sitokinin. Efek perbandingan auksin dan sitokinin terhadap
morfogenesis dari kultur jaringan yang dijelaskan oleh Skoog dan Miller (1957)
masih digunakan sebagai dasar untuk manipulasi tanaman sampai sekarang. Efek
dari zat pengatur tumbuh sangat tergantung pada jenis dan konsentrasi yang
digunakan dan jaringan target (Beyl 2005).
Menurut Gunawan (1992), sitokinin yang sering digunakan pada kultur
jaringan adalah kinetin, zeatin, BA, BAP, 2iP, dan PBA. Auksin terdiri atas IAA,
2,4-D, IBA, NAA dan 2,4,5 T. Zat pengatur tumbuh sitokinin dapat merangsang
berbagai tanggap biologi bila diberikan secara eksogen terhadap seluruh tanaman
atau organ tanaman yang mempengaruhi pembelahan sel, morfogenesis, memacu
perkembangan kuncup samping tanaman dikotil, menghambat gugurnya daun dan
mempunyai kemampuan menunda penuaan (Salisbury dan Ross 1995). Pengaruh
dominansi meristem apikal dapat dihilangkan dengan penambahan zat pengatur
tumbuh terutama sitokinin ke dalam medium (Wattimena et al. 1992). Auksin
berperan pada proses perkembangan tanaman, merangsang pemanjangan dan
pembesaran sel, dominansi apikal, induksi akar dan embrio somatik (Beyl 2005).
Embriogenesis Somatik
Menurut Zulkarnain (2009) embriogenesis somatik adalah proses
perkembangan embrio lengkap dari sel-sel vegetatif atau sel-sel somatik yang
diperoleh dari berbagai sumber eksplan. Inisiasi dan diferensiasi embrio somatik
tidak melibatkan proses seksual.
Embriogenesis somatik adalah proses terbentuknya embrio somatik.
tanaman tanpa melalui fusi gamet, artinya bukan zigot, tetapi berasal dari tubuh
tanaman (Gunawan 1992). Embriogenesis somatik memiliki dua pola
perkembangan yaitu 1) embriogenesis langsung (direct embryogenesis), dimana
embrio langsung terbentuk pada eksplan tanpa melalui proses pengkalusan, 2)
embriogenesis tak langsung (indirect embryogenesis) dimana sebelum terbentuk
embrio, eksplan membentuk kalus terlebih dahulu. Embriogenesis langsung secara
in vitro umumnya terjadi pada sel-sel eksplan yang masih muda (juvenil)
sedangkan embriogenesis tak langsung terjadi pada sel-sel yang telah mengalami
diferensiasi, pembelahan sel, dan transformasi menjadi sel embriogenik. Sel-sel
embriogenik yang akan menjadi embrio adalah sel-sel yang berukuran kecil,
dengan isi sitoplasma yang penuh atau tanpa vakuola. Pada embriogenesis tak
langsung, kalus yang diperoleh dari inisiasi awal akan memiliki kemampuan
beregenerasi membentuk embrio somatik yang tinggi dibandingkan dengan kalus
hasil subkultur. Embriogenesis somatik telah dipelajari pada 200 spesies yang
tergolong Gymnospermae maupun Angiospermae (Evans et al. 1981).
Menurut Evans et al. (1981), bahwa terdapat dua macam kalus yang dapat
terbentuk dalam kultur in vitro suatu tanaman, yaitu: (1) kalus embriogenik dan
(2) kalus non embriogenik. Kalus embriogenik adalah kalus yang mempunyai
potensi untuk beregenerasi menjadi tanaman, baik melalui organogenesis
(langsung membentuk organ) maupun embriogenesis (melalui pembentukan
embrio somatik). Kalus non embriogenik adalah kalus yang sedikit atau tidak
mempunyai kemampuan untuk beregenerasi membentuk tanaman. Embriogenesis
somatik merupakan jalur regenerasi tanaman yang lebih disukai untuk tujuan
rekayasa genetika, karena tanaman yang dihasilkan dapat berasal dari satu sel.
Secara genetik, tanaman regeneran yang berasal dari satu sel lebih stabil
dibandingkan dengan jalur regenerasi lainnya.
Penggunaan auksin yang tinggi akan mempercepat dan memperbanyak
jumlah embrio somatik yang terbentuk. Jenis auksin yang biasa digunakan untuk
induksi embriogenesis adalah 2,4 – dichlorophenoxyacetic acid (2,4–D) dan
napthalene acetic acid (NAA). Hormon 2,4–D cenderung menginduksi embrio
somatik secara tidak langsung melalui fase kalus, sehingga jumlah embrio yang
sehingga lebih sulit dikecambahkan menjadi planlet/tanaman. Hormon NAA
cenderung menginduksi embrio somatik secara langsung tanpa pembentukan
kalus. Embrio somatik yang dihasilkan lebih normal dan mudah dikecambahkan
menjadi planlet/tanaman, tetapi jumlahnya lebih sedikit (Bhojwani dan Razdan
1989).
Penggunaan jenis eksplan yang bersifat meristematik umumnya
memberikan keberhasilan pembentukan embrio somatik yang lebih tinggi.
Eksplan yang digunakan dapat berupa aksis embrio zigotik muda dan dewasa,
kotiledon, mata tunas, epikotil maupun hipokotil (Vesco dan Guerra 2001).
Kalimuthu et al. (2007) menyatakan bahwa embrio somatik pada tanaman jarak
pagar didapatkan dari jenis eksplan kotiledon dan diinduksi dari media yang
Waktu dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Agustus 2009 – Juni 2010, di
Laboratorium Kultur Jaringan dan Laboratorium Umum, Departemen Agronomi
dan Hortikultura, Fakultas Pertanian – IPB, Dramaga, Bogor.
Bahan dan Alat
Bahan tanaman yang digunakan adalah benih jarak pagar genotipe IP-1P.
Bahan eksplan yang digunakan berupa kotiledon dan hipokotil yang telah
ditanam dalam kondisi in vitro, stek tunas dan daun tanaman jarak pagar dewasa
hasil stek. Media yang digunakan adalah media MS (Murashige dan Skoog
1962). Zat pengatur tumbuh meliputi 1-napthalene acetic acid (NAA), indole
acetic acid (IAA), benzyl amino purin (BAP), kinetin, dan picloram. Bahan lain
yang digunakan adalah agar–agar, gula, alkohol 96%, bahan kimia komponen
media MS, Betadine, aquadest dan spirtus. Bahan untuk sterilisasi tanaman
adalah deterjen, Bayclin (sodium hipoklorit), agrept (bakterisida), dithane
(fungisida), dan air steril. Alat yang digunakan diantaranya adalah peralatan
gelas, timbangan analitik, autoklaf, laminar air flow cabinet, peralatan diseksi,
mikroskop stereo kamera, dan rak kultur.
Pelaksanaan Penelitian
Pelaksanaan penelitian meliputi beberapa tahap pekerjaan yang saling
berkesinambungan : a) sterilisasi alat–alat gelas, alat–alat tanam dan aquadest,
(b) pembuatan larutan stok dan media, dan (c) sterilisasi sumber eksplan.
Percobaan pendahuluan dilakukan untuk sterilisasi, optimasi media dan
penyediaan eksplan.
a. Sterilisasi Alat dan Lingkungan Kerja
Alat tanam (pinset, scalpel), cawan petri dan pipet yang sudah dicuci
dibungkus dengan kertas. Botol kultur disterilkan dengan autoklaf selama 1 jam
pinset juga disterilkan dengan perendaman dalam alkohol 95% dan nyala api
lampu spirtus. Permukaan tempat kerja (ruang laminar air flow cabinet) sebelum
digunakan disterilkan dengan menyemprot alkohol 70% dan dilap dengan kertas
tissue.
b. Pembuatan Larutan Stok dan Pembuatan Media
Percobaan ini menggunakan media Murashige dan Skoog (1962). Untuk
memudahkan pembuatan media dibuat larutan stok unsur–unsur penyusun
media. Larutan stok digunakan untuk mempermudah kelarutan unsur yang
digunakan dan untuk mendapatkan ketelitian yang tinggi. Pembuatan larutan
stok media MS dikelompokkan dalam larutan stok makro, Ca, mikro A, mikro B,
Fe, Myoinositol, vitamin dan stok zat pengatur tumbuh (Lampiran 1 dan 2).
Pembuatan media dilakukan dengan cara larutan stok dipipet, larutan
untuk media dasar terdiri atas larutan stok makro, Ca, mikro A, mikro B, Fe,
vitamin, dan myo-inositol. Larutan stok tersebut dimasukkan ke dalam gelas
tabung dan ditambahkan gula sebanyak 30 gram/l, kemudian ditambahkan
aquades sampai mencapai 1 liter, lalu diaduk secara merata. Selanjutnya larutan
media tersebut diukur keasamannya dengan menggunakan kertas pH. Keasaman
larutan media yang direkomendasikan sampai batas 5.8. Apabila belum
mencapai pH 5.8, maka diteteskan larutan KOH, sebaliknya apabila di atas pH
5.8 diteteskan larutan HCl 0.1 N. Setelah mencapai pH 5.8, dimasukan agar
phytagel dimasukkan sebanyak 2 gram/l, lalu diaduk secara merata. Tahap
selanjutnya adalah larutan media tersebut direbus sampai mendidih. Selanjutnya
dimasukkan ke dalam botol kultur lalu ditutup dengan plastik dan diikat dengan
tali karet. Setiap botol diisi 15-20 ml larutan media. Setelah itu media
disterilkan ke dalam autoklaf pada suhu 1210
Sterilisasi eksplan yang berasal dari benih jarak dilakukan di luar dan di
dalam laminar (Lampiran 3). Tahap pertama benih jarak IP-1P (Lampiran 4)
dipisahkan antara kernel dan kulitnya dengan cara cangkang biji diretakkan
dengan tang hingga kulitnya pecah. Kernel dicuci dengan detergen dan dibilas
dengan air mengalir sampai bersih. Setelah itu kernel disterilkan dengan Dithane C tekanan 17.5-20 psi selama 30
menit.
dan Agrept (2 gram/l) dan diaduk selama 1 jam. Selanjutnya, kernel dibilas
dengan air steril 3 kali (sterilisasi di luar laminar). Kemudian sterilisasi kernel
dilanjutkan di dalam laminar dengan air steril dan Bayclin 20% dan diaduk
selama 20 menit sebelum dicuci dengan air steril 3 kali. Pada sterilisasi yang
terakhir Bayclin 5% diberikan selama 5 menit kemudian dicuci dengan air steril.
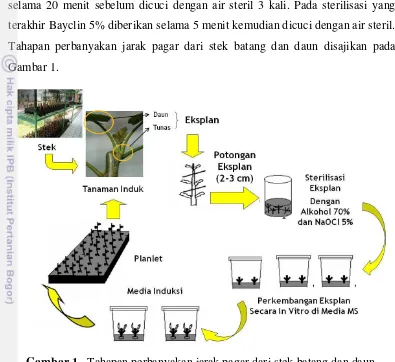
Tahapan perbanyakan jarak pagar dari stek batang dan daun disajikan pada
Gambar 1.
Gambar 1. Tahapan perbanyakan jarak pagar dari stek batang dan daun
Sterilisasi eksplan yang berasal dari lapangan dilakukan pada tanaman
jarak pagar yang berasal dari stek umur ±2 bulan. Bagian tanaman yang
digunakan dicuci dengan Tween 20 dan dibilas dengan air aquadest steril.
Eksplan yang sudah bersih direndam dalam bakterisida dan fungisida selama 1
jam, sebelum dibilas dengan air steril (sterilisasi di luar laminar). Kemudian
sterilisasi dilanjutkan di dalam laminar dengan cara eksplan direndam di dalam
Bayclin 5% selama 30 menit sebelum dicuci dengan air steril 3 kali. Eksplan
kembali direndam di dalam Betadine selama 20 menit sebelum dibilas dengan
aquadest steril sebanyak 8 kali. Bagian eksplan yang berwarna putih dipotong,
Metode Penelitian
Kegiatan penelitian secara keseluruhan terdiri atas tiga percobaan yaitu :
(1) In vitro organogenesis pada kotiledon dan hipokotil tanaman jarak pagar; (2)
Induksi organogenesis dari stek tunas dan daun tanaman jarak pagar, dan (3)
Studi perbanyakan masal jarak pagar secara in vitro melalui lintasan
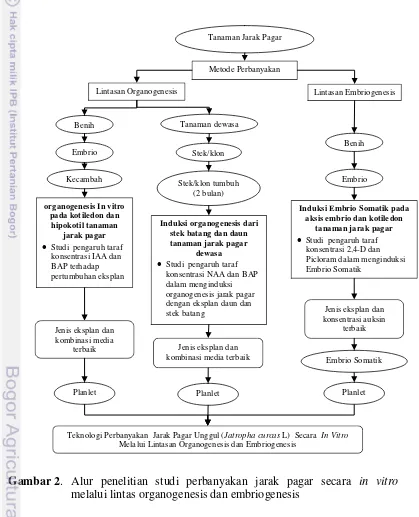
embriogenesis somatik. Gambar alur penelitian disajikan pada Gambar 2.
Gambar 2. Alur penelitian studi perbanyakan jarak pagar secara in vitro
melalui lintas organogenesis dan embriogenesis
Lintasan Organogenesis Lintasan Embriogenesis
organogenesis In vitro pada kotiledon dan
hipokotil tanaman jarak pagar
• Studi pengaruh taraf konsentrasi IAA dan BAP terhadap pertumbuhan eksplan
Induksi organogenesis dari stek batang dan daun tanaman jarak pagar
dewasa
• Studi pengaruh taraf konsentrasi NAA dan BAP dalam menginduksi organogenesis jarak pagar dengan eksplan daun dan stekbatang
Induksi Embrio Somatik pada aksis embrio dan kotiledon
tanaman jarak pagar
• Studi pengaruh taraf konsentrasi 2,4-D dan Picloram dalam menginduksi Embrio Somatik
terbaik Jenis eksplan dan kombinasi media terbaik
Planlet Planlet
Teknologi Perbanyakan Jarak Pagar Unggul (Jatropha curcas L) Secara In Vitro
Melalui Lintasan Organogenesis dan Embriogenesis
Jenis eksplan dan konsentrasi auksin
terbaik
Percobaan I. Organogenesis In vitro pada Kotiledon dan Hipokotil
Percobaan satu terdiri atas dua percobaan, yaitu: a) percobaan pengaruh
konsentrasi IAA dan BAP dengan menggunakan eksplan hipokotil dan b)
percobaan pengaruh konsentrasi IAA dan BAP dengan menggunakan eksplan
kotiledon
Percobaan 1a. Pengaruh Konsentrasi IAA dan BAP terhadap Induksi Tunas Jarak Pagar dengan Menggunakan Eksplan Hipokotil.
Pada percobaan ini digunakan rancangan faktorial yang disusun secara
acak kelompok (RAK) dengan dua faktor. Faktor pertama adalah konsentrasi zat
pengatur tumbuh IAA yang terdiri atas 3 taraf yaitu 0; 0.05 dan 0.1 mg/l. Faktor
kedua adalah konsentrasi zat pengatur tumbuh BAP yang terdiri dari 4 taraf yaitu
0; 1.0; 2.0; dan 3.0 mg/l. Setiap kombinasi perlakuan diulang 20 kali, sehingga
terdapat 12 x 20 = 240 satuan percobaan. Kombinasi perlakuan konsentrasi zat
pengatur tumbuh IAA dan BAP pada berbagai taraf dengan eksplan hipokotil
disajikan pada Tabel 1.
Tabel 1. Kombinasi perlakuan konsentrasi zat pengatur tumbuh IAA dan BAP dengan eksplan hipokotil
Percobaan 1b. Pengaruh Konsentrasi IAA dan BAP terhadap Induksi Tunas Jarak Pagar dengan Menggunakan Eksplan Kotiledon.
Pada percobaan ini digunakan rancangan faktorial yang disusun secara
acak kelompok (RAK) dengan dua faktor. Faktor pertama adalah konsentrasi zat
pengatur tumbuh IAA yang terdiri atas 3 taraf yaitu 0; 0.05 dan 0.1 mg/l. Faktor
kedua adalah konsentrasi zat pengatur tumbuh BAP yang terdiri dari 4 taraf yaitu
0; 1.0; 2.0; dan 3.0 mg/l. Setiap kombinasi perlakuan diulang 20 kali, sehingga
terdapat 12 x 20 = 240 satuan percobaan. Kombinasi perlakuan konsentrasi zat
pengatur tumbuh IAA dan BAP pada berbagai taraf dengan eksplan kotiledon
disajikan pada Tabel 2.
Tabel 2. Kombinasi perlakuan konsentrasi zat pengatur tumbuh IAA dan BAP dengan eksplan kotiledon
Pengamatan pada Percobaan 1a dan 1b meliputi pertumbuhan dan
perkembangan eksplan setiap minggu selama delapan minggu. Peubah yang
diamati adalah :
1. Persentase jumlah eksplan membentuk kalus
∑
Eksplan∑
yang digunakan berkalus EksplanX 100%
2. Skoring perkembangan kalus (Gambar 3)
3. Skoring warna kalus (Gambar 4)
4. Waktu muncul kalus (hari setelah tanam/HST), diamati setiap hari sekali
pada setiap unit percobaan.
5. Jumlah tunas, dilakukan pada setiap minggu setelah tanam (MST) pada
setiap unit percobaan.
6. Jumlah daun, dilakukan pada setiap minggu setelah tanam (MST) pada
setiap unit percobaan.
7. Waktu muncul daun (hari setelah tanam/HST), diamati setiap hari pada
Percobaan II. Induksi Organogenesis dari Stek Batang dan Daun
Percobaan kedua menggunakan eksplan yang berasal dari tanaman
komposit IP-1P yang sudah distek selama ± 2 bulan. Percobaan kedua terdiri atas
dua percobaan, yaitu: a) percobaan pengaruh NAA dan BAP dengan
menggunakan eksplan stek batang dan b) percobaan pengaruh NAA dan BAP
dengan menggunakan eksplan daun.
Percobaan 2a. Pengaruh Konsentrasi NAA dan BAP terhadap Induksi Tunas Jarak Pagar dengan Menggunakan Eksplan Stek Batang
Pada percobaan ini digunakan rancangan faktorial yang disusun secara
acak kelompok (RAK) dengan dua faktor. Faktor pertama adalah perlakuan
konsentrasi zat pengatur tumbuh yaitu NAA (0; 0.1; 0.5 mg/l). Faktor kedua
adalah perlakuan konsentrasi zat pengatur tumbuh BAP (0; 2.0; 3.0; 4.0 mg/l).
Setiap kombinasi perlakuan diulang 10 kali, sehingga terdapat 12 x 10 = 120
satuan percobaan, masing-masing 1 botol dengan 2 eksplan per botol. Kombinasi
perlakuan konsentrasi zat pengatur tumbuh NAA dan BAP dengan eksplan stek
batang disajikan pada Tabel 3.
Tabel 3. Kombinasi perlakuan konsentrasi zat pengatur tumbuh NAA dan BAP dengan eksplan stek batang
Percobaan 2b. Pengaruh Konsentrasi NAA dan BAP terhadap Induksi Tunas Jarak Pagar dengan Menggunakan Eksplan Daun
Percobaan ini menggunakan eksplan daun dari tanaman hasil stek. Pada
percobaan ini digunakan rancangan faktorial yang disusun secara acak kelompok
(RAK) dengan dua faktor. Faktor pertama adalah perlakuan konsentrasi zat
pengatur tumbuh yaitu NAA (0; 0.1; 0.5 mg/l). Faktor kedua adalah perlakuan
konsentrasi zat pengatur tumbuh BAP (0; 2.0; 3.0; 4.0 mg/l). Setiap kombinasi
perlakuan diulang 10 kali, sehingga terdapat 12 x 10 = 120 satuan percobaan,
masing-masing 1 botol dengan 2 eksplan per botol. Kombinasi perlakuan
konsentrasi zat pengatur tumbuh NAA dan BAP dengan eksplan daun disajikan
pada Tabel 4.
Tabel 4. Kombinasi perlakuan konsentrasi zat pengatur tumbuh NAA dan BAP dengan eksplan daun
Pengamatan meliputi pertumbuhan dan perkembangan eksplan setiap
minggu, selama delapan minggu. Peubah yang diamati adalah :
1. Persentase jumlah eksplan membentuk tunas
∑
Eksplan∑
yang digunakan bertunas EksplanX 100%
2. Waktu tunas muncul (hari setelah tanam/HST), diamati setiap hari sekali
pada setiap unit percobaan.
3. Jumlah tunas, dilakukan pada setiap minggu setelah tanam (MST) pada
setiap unit percobaan.
4. Jumlah daun, dilakukan pada setiap minggu setelah tanam (MST) pada
setiap unit percobaan.
Percobaan III. Studi Perbanyakan Jarak Pagar secara In vitro Melalui Lintasan Embriogenesis Somatik
Percobaan ini bertujuan untuk menginduksi kalus embriogenik dan
mendapatkan embrio somatik melalui perlakuan zat pengatur tumbuh. Pada
percobaan ini digunakan rancangan faktorial yang disusun secara acak kelompok
(RAK) dengan dua faktor. Faktor pertama adalah jenis eksplan yang terdiri atas
dua taraf yaitu aksis embrio dan kotiledon. Faktor kedua adalah jenis media yang
terdiri atas 2,4-D (1.0; 2.0; dan 3.0 mg/l), picloram (1.0; 3.0; dan 5.0 mg/l), dan
sebagai kontrol tanpa auksin. Setiap kombinasi perlakuan diulang 10 kali,
sehingga terdapat 14 x 10 = 140 satuan percobaan. Setiap satuan percobaan
terdiri dari satu botol dengan jumlah dua eksplan per botol. Kombinasi perlakuan
konsentrasi auksin dengan jenis eksplan disajikan pada Tabel 5.
Tabel 5. Kombinasi perlakuan konsentrasi zat pengatur tumbuh 2,4-D dan picloram dengan jenis eksplan
Pengamatan meliputi pertumbuhan dan perkembangan eksplan setiap
minggu. Peubah yang diamati adalah :
1. Persentase jumlah eksplan membentuk kalus
∑
Eksplan∑
yang digunakan berkalus EksplanX 100%
2. Perkembangan kalus
Pengamatan dilakukan setiap minggu dan dimulai pada saat 2 minggu setelah
tanam (2 MST) sampai 16 MST. Pengamatan dilakukan dengan sistem
skoring. Skoring perkembangan kalus mengacu pada Gambar 3.
3. Warna kalus eksplan
Pengamatan dilakukan setiap minggu dan dimulai pada saat 2 minggu setelah
tanam (2 MST) sampai 16 MST. Pengamatan dilakukan dengan cara melihat
warna kalus berdsarkan sistem skoring (Gambar 4).
4. Persentase jumlah kalus membentuk embrio somatik
Kontrol 2,4-D (mg/l) Picloram (mg/l)
1.0 2.0 3.0 5.0 3.0 1.0
Embrio axis M1 M2 M3 M4 M5 M6 M7
5. Jumlah embrio somatik
Pengamatan dilakukan setiap minggu dengan cara menghitung jumlah
embrio somatik (Fase globular, hati, torpedo dan kotiledon) pada eksplan.
6. Waktu munculnya embrio somatik
Pengamatan dilakukan setiap hari dengan cara menghitung munculnya
Gambar 3. Skoring perkembangan kalus: (A) 1 – 25 % kalus (skor 2), (B) 26 – 50% kalus menutupi eksplan (skor 3), (C) 51 – 75 %
kalus menutupi eksplan (skor 4), (D) 76 – 100 % kalus menutupi eksplan (skor 5)
Gambar 4. Skoring warna kalus: (A) 76 – 100 % kalus berwarna coklat (skor 1), (B) 21 – 75 % kalus berwarna coklat (skor 2), (C) Kalus tidak berwarna atau bening (skor 3), (D) Kalus berwarna hijau bening (skor 4)
A
C
B
D
A
C
B
Model Statistik untuk Semua Percobaan
Rancangan penelitian akan menggunakan rancangan acak kelompok.
Data analisis dengan sidik ragam dan apabila hasilnya berbeda nyata, dilakukan
uji lanjut Duncan Multiple Range Test pada taraf 5%. Model statistik yang
digunakan dalam rancangan menurut Mattjik dan Sumertajaya (2002), yaitu : Υijk = μ + αi + βj + (αβ)ij + εijk
dimana,
i = 1, 2, …, r; j = 1, 2, …, r; k = 1, 2, ...r
Υiik = Nilai Pengamatan pada faktor Pertama taraf 1 faktor Kedua taraf ke-j dan ulangan ke-k
μ = Rataan umum
αi = Pengaruh utama Faktor Pertama
βj = Pengaruh utama Faktor Kedua
(αβ)ij = Pengaruh interaksi faktor Pertama ke-i dan faktor Kedua ke-j
Percobaan I. In vitro Organogenesis pada Kotiledon dan Hipokotil
Kondisi Umum
Percobaan pendahuluan dilaksanakan untuk mendapatkan metode
sterilisasi yang tepat pada eksplan yang akan digunakan pada percobaan
selanjutnya. Terdapat dua percobaan yang akan dilakukan pada percobaan
pertama, yaitu :
Percobaan 1a: pengaruh konsentrasi IAA dan BAP terhadap induksi tunas dengan
menggunakan eksplan hipokotil.
Percobaan 1b: pengaruh konsentrasi IAA dan BAP terhadap induksi tunas dengan
menggunakan eksplan kotiledon.
Eksplan yang digunakan pada kedua percobaan ini adalah hipokotil dan kotiledon
yang didapat dari kecambah in vitro (Gambar 5). Salah satu faktor yang
mempengaruhi ketidakberhasilan perbanyakan secara in vitro adalah kontaminasi
dari eksplan yang ditanam.
Gambar 5. Sumber eksplan dan tahapan perkecambahan secara in vitro. (A) Biji utuh, (B) Biji dikupas, (C) Embrio 0 HST, (D) Kecambah 3 HST, (E) Kecambah 7-14 HST, dan (F) Kecambah 30 HST
Tingkat keberhasilan sterilisasi eksplan yang berasal dari benih jarak pagar
ini berkisar antara 0 – 80% berdasarkan lampiran 3. Pada minggu pertama kondisi
A B C