STUDI MOLEKULER UNTUK MENENTUKAN
KEKERABATAN GENUS
Zingiber
VARIETAS Z
erumbet
YUDITH PRADIPTA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
YUDITH PRADIPTA. Studi Molekuler untuk Menentukan Kekerabatan Genus
Zingiber
Varietas
Zerumbet
. Dibimbing oleh I MADE ARTIKA dan MARLINA
ARDIYANI.
Perbedaan pendapat untuk pengelompokan tanaman obat dapat menimbulkan
permasalahan kekacauan penggunaan nama ilmiah tanaman. Pengelompokan
tanaman secara morfologi pada kasus tertentu kurang efektif sehingga perlu
dilakukan studi molekuler agar hasilnya lebih akurat menggunakan marka
molekuler. Marka molekuler yang digunakan adalah
maturase
K (
mat
K) dan
Internal Transcribe Spacer
(ITS). Tujuan penelitian adalah mengelompokan
anggota genus
Zingiber
varietas
Zerumbet
yaitu
Zingiber zerumbet
,
Zingiber
aromaticum
, dan
Zingiber amaricans
berdasarkan marka molekuler. Tahapan
penelitian dimulai dengan isolasi DNA, amplifikasi DNA,
sequencing
DNA,
penyejajaran hasil
sequencing
, dan pembuatan pohon filogeni. Hasil isolasi DNA
menunjukkan bahwa kualitas DNA baik. Ukuran DNA hasil amplifikasi dengan
marka molekuler
mat
K untuk genus
Zingiber
varietas
Zerumbet
adalah sekitar
2000–3000 bp, sedangkan ukuran DNA hasil amplifikasi dengan marka molekuler
ITS adalah sekitar 900 bp. Sekuens ITS tidak bagus sehingga hanya sekuens dari
mat
K yang dapat digunakan untuk penarikan kesimpulan. Hasil penyejajaran
sekuens dibandingkan dengan data yang didapatkan dari GenBank, perbedaan
basa antara anggota genus
Zingiber
varietas
Zerumbet
dengan jenis
Zingiber
lainnya sangat kecil yaitu 1 bp sampai 11 bp. Hasil pohon filogeni yang memiliki
nilai indeks konsistensi (CI)= 0.897 dan indeks retensi (RI)= 0.833
memperlihatkan kekerabatan yang sangat dekat antara ketiga anggota genus
Zingiber
varietas
Zerumbet
dengan nilai
bootstrap
(BS)= 59. Ketiga anggota
genus
Zingiber
varietas
Zerumbet
yang diteliti merupakan suatu spesies kompleks
yang berada di bawah jenis
Zingiber zerumbet
.
ABSTRACT
YUDITH PRADIPTA. Molecular Studies to Determine Genetic Relationship of
The
Zingiber
Genus
Zerumbet
Subsection. Under the direction of I MADE
ARTIKA and MARLINA ARDIYANI.
Problems due to opinion differences in medicinal plants classification cause
confusion on the use of scientific name of plants. The grouping of plants which
based on morphology in some cases is less effective and it is necessary to perform
molecular studies used maturase (matK) and Internal Transcribe Spacer (ITS) as
molecular markers. The study was aimed to classify members of the
Zingiber
genus
Zerumbet
subsection that is
Zingiber zerumbet
,
Zingiber aromaticum
, and
Zingiber amaricans
.
Stages of research were isolation of DNA, DNA
amplification, DNA sequencing, alignment of DNA sequences, and construction
of phylogenetic tree. Results showed that the isolated DNA was of good
quality. The size of the amplified DNA with the matK was 2000–3000 bp, while
the size of the amplified DNA with the ITS was 900 bp. ITS sequences were of
low quality, so that only the matK sequences were used for inference. Based on
the results of sequence alignment with data obtained from GenBank differences
between members of the genus
Zingiber
subsection
Zerumbet
with other types of
Zingiber
was 1–11 bp and the phylogenetic tree with consistency index (CI)=
0.897 and retention index (RI)= 0.833 shows a very close genetic relationship
between the three members of the
Zingiber
genus
Zerumbet
subsection with
bootstrap (BS)= 59. The third member of the
Zingiber
genus
Zerumbet
subsection
is spesies kompleks which is under the type of
Zingiber zerumbet
.
STUDI MOLEKULER UNTUK MENENTUKAN
KEKERABATAN GENUS
Zingiber
VARIETAS Z
erumbet
YUDITH PRADIPTA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Studi Molekuler untuk Menentukan Kekerabatan Genus
Zingiber
Varietas
Zerumbet
Nama : Yudith Pradipta
NIM :
G84080059
Disetujui
Komisi Pembimbing
Diketahui
Tanggal Lulus :
Dr. Ir. I Made Artika, M.App.Sc
Ketua Departemen Biokimia
Dr. Ir. I Made Artika, M.App.Sc
Ketua
PRAKATA
Puji dan syukur dipanjatkan atas kehadirat Allah SWT untuk segala rahmat
dan karunia-Nya serta salawat dan salam tercurahkan pada Rasulallah SAW
sehingga penulisan hasil penelitian ini dapat diselesaikan. Hasil penelitian yang
berjudul Studi Molekuler untuk Menentukan Kekerabatan Marga
Zingiber
Varietas
Zerumbet
ini ditujukan sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada Departemen Biokimia.
Rasa terima kasih diberikan kepada semua pihak yang telah membantu
dalam penyusunan hasil penelitian ini, baik secara langsung maupun tidak
langsung. Ucapan terima kasih disampaikan kepada Dr. Ir. I Made Artika,
M.App.Sc sebagai pembimbing skripsi dan Dr. Marlina Ardiyani, M.Sc sebagai
pembimbing penelitian yang dilaksanakan di Laboratorium Sistematika Molekuler
Tumbuhan, Pusat Penelitian Biologi, LIPI, Cibinong-Bogor. Terima kasih pula
kepada Ibu Nita dan Ibu Susi yang telah mendampingi selama penelitian. Tidak
lupa pula rasa terima kasih pun diucapkan kepada kedua orang tua, nenek, adik,
Jihad, dan seluruh keluarga besar atas segala doa dan dukungan yang sangat
berarti bagi penulis. Adapula rasa terima kasih kepada para sahabat Ririn, Mimi,
Ica, Melda, Lela, Mamat, Dea, Riris, Sari, Azizah, Tati, Thya, Rena, Putri,
Kenyar, Aina, Iqbal, dan Andi atas segala dukungan dan bantuannya selama
penulisan hasil penelitian ini.
Penulisan hasil penelitian ini masih banyak kekurangannya. Oleh karena itu,
diharapkan saran dan kritik membangun yang dapat berguna dalam memperbaiki
penulisan hasil penelitian ini. Besar harapan agar hasil penelitian ini bermanfaat
bagi semua pihak yang membutuhkan.
Bogor, September 2012
RIWAYAT HIDUP
Penulis dilahirkan di Kota Bogor pada tanggal 16 Januari 1990 dari ayah
yang bernama Yadi Adriadi dan ibu yang bernama Yuniarti. Penulis adalah anak
pertama dari dua bersaudara. Adik laki-laki penulis bernama Yunasz Praditya.
Pendidikan penulis dimulai dari Play Group Edelweis pada tahun 1992–
1993, kemudian melanjutkan pendidikan ke TK Pertiwi III Bogor pada tahun
1994–1996, setelah itu penulis melanjutkan pendidikan ke jenjang Sekolah Dasar
di SD Negeri Polisi IV Bogor pada tahun 1996–2002. Tahun 2002 penulis
memulai pendidikan di Sekolah Menengah Pertama di SMP Negeri 6 Bogor yang
sempat mendapatkan predikat juara umum pada tahun kedua dan lulus pada tahun
2005, pada tahun yang sama penulis meneruskan pendidikan ke jenjang Sekolah
Menengah Atas di SMA Negeri 5 Bogor dan lulus pada tahun 2008, pada tahun
2008 penulis lolos seleksi masuk perguruan tinggi negeri di Institut Pertanian
Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI). Pilihan mayor yang
penulis ambil adalah Biokimia yang berada di bawah Fakultas Matematika dan
Ilmu Pengetahuan Alam.
Selama penulis mengikuti perkuliahan di IPB, penulis pernah mengikuti
beberapa kegiatan kepanitian. Kepanitian yang pernah penulis ikuti adalah
Sport
Competition and Art Festival on
MIPA
Faculty
(SPIRIT) sebagai anggota divisi
humas tahun 2010, Masa Perkenalan Kampus Mahasiswa Biokimia pada tahun
2009 sebagai bendahara, Biokimia Expo pada tahun 2010 sebagai sekretaris,
Seminar Kesehatan dan Keselamatan Kerja (K3) pada tahun 2010 sebagai anggota
divisi humas, dan Siang Keakraban Biokimia pada tahun 2012 sebagai anggota
divisi publikasi dan dokumentasi (PDD). Selain itu penulis pernah menjabat
sebagai sekretaris Himpunan Keluarga SMA Negeri 5 Bogor pada tahun 2010.
Penulis dalam bidang karya ilmiah pernah mendapatkan dana bersaing dari
Direktorat Jenderal Pendidikan Tinggi (DIKTI) dalam Pekan Kreativitas
Mahasiswa (PKM) dalam bidang Penelitian pada tahun 2012 dengan judul
Identifikasi Bakteri Resisten terhadap Merkuri sebagai Alternatif Agen
Bioremediasi pada Pencemaran Tanah Pertambangan.
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 1
Genus
Zingiber
Varietas
Zerumbet
... 1
Metode Isolasi DNA ... 4
Polymerase Chain Reaction
(PCR) ... 5
Marka Molekuler ... 5
Hubungan Kekerabatan (Filogenetik) ... 7
BAHAN DAN METODE ... 8
Bahan dan Alat ... 8
Metode ... 8
HASIL DAN PEMBAHASAN ... 9
Identifikasi Tiga Anggota Genus
Zingiber
Varietas
Zerumbet
... 9
Hasil Isolasi DNA Marga
Zingiber
Varietas
Zerumbet
... 11
Hasil Amplifikasi dan
Sequencing
mat
K ... 12
Hasil Amplifikasi dan
Sequencing
ITS ... 14
Analisis Filogenetik ... 15
SIMPULAN DAN SARAN ... 19
Simpulan ... 19
Saran ... 19
DAFTAR PUSTAKA ... 19
DAFTAR GAMBAR
Halaman
1
Zingiber zerumbet.
... 2
2
Zingiber aromaticum
………. 3
3
Zingiber amaricans
……….... 3
4 Tahapan reaksi PCR………... 5
5 Daerah sekuens
mat
K dan intron
trn
K……….. 6
6 Unit transkripsi
Internal Transcribe Spacer
(ITS)………... 7
7 Elektroforesis hasil isolasi DNA………... 12
8 Elektroforesis hasil PCR
trn
K………... 12
9 Kromatogram
hasil
sequencing
DNA
Z. zerumbet
dengan primer
trn
K2R… 13
10 Elektroforesis hasil PCR ITS……….. 14
11 Kromatogram hasil
sequencing
DNA
Z. aromaticum
dengan primer ITS5P.. 14
12 Hasil penyejajaran sekuens
mat
K varietas
Zerumbet
dan data GenBank…… 15
13 Pohon filogeni………. 18
DAFTAR LAMPIRAN
Halaman
1 Strategi Penelitian ... 23
2 Tahapan amplifikasi DNA dengan marka molekuler
mat
K ... 24
3 Tahapan amplifikasi DNA dengan marka molekuler ITS... 25
4 Tabel sekuens primer yang digunakan... 26
5 Tabel perbedaan morfologi genus
Zingiber
varietas
Zerumbet
... . 27
6 Sekuens
hasil
sequencing
DNA
Zingiber zerumbet ...
`28
PENDAHULUAN
Gen merupakan input penting yang dibutuhkan untuk studi molekuler. Gen merupakan bagian dari genom yang membawa sifat suatu organisme. Identifikasi dan karakterisasi gen seringkali diperlukan dalam beberapa percobaan molekuler seperti isolasi, kloning, ataupun mempelajari ekspresi gennya. Pendekatan yang dapat digunakan untuk mengidentifikasi keberadaan gen maupun ekspresinya adalah memanfaatkan kemajuan bioinformatika dan teknik
Polymerase Chain Reaction (PCR) menggunakan marka molekuler. Marka molekuler yang berbasis DNA merupakan komponen yang penting dalam penelitian menggunakan pendekatan molekuler. Marka molekuler yang digunakan dalam penelitian ini adalah matK yang didapatkan dari DNA kloroplas dan ITS yang didapatkan dari DNA inti yang sudah umum digunakan untuk riset genus Zingiberaceae. Metode yang digunakan adalah PCR yang merupakan teknologi dalam biologi molekuler yang sudah diterapkan secara meluas untuk berbagai macam jenis analisis biologi molekuler. Pemanfaatan ilmu bioinformatika pada penelitian ini pada umumnya ditujukan untuk analisis hasil dari proses sequencing dengan program ChromasPro versi Trial, penyejajaran sekuens DNA dengan program MEGA 5.0 (molecular evolutionary genetics analysis), dan analisis kekerabatan (filogenetik) dengan program PAUP 4.0 (phylogeni analysis using parsimony) serta TreeView.
Pendekatan molekuler dalam penelitian ini dipilih karena belum pernah ada yang melakukannya, selain itu hasilnya pun akan lebih akurat. Studi morfologi untuk menentukan kekerabatan varietas Zerumbet
ini dilakukan oleh Valeton (1918) serta Backer dan Bakhuizen (1968). Studi lanjutan dengan pendekatan morfologi dilakukan oleh Nasution dan Richard (1980) menggunakan karakter morfologi, polen, dan kandungan senyawa kimia serta Husin dan Elizabeth (1987) melakukan studi lanjutan dengan mengamati anatominya. Hasil kedua studi lanjutan tersebut mendukung pengelompokan yang diusulkan Valeton (1918). Sumber lain mencantumkan bahwa jenis Z. amaricans, Z. aromaticum, dan Z. littorale merupakan varietas dari jenis Z. zerumbet yang ditulis oleh Guzman dan Siemonsma (1999) pada salah satu volume Plant Resources of South East Asia (PROSEA). Varietas merupakan tingkatan taksa yang berada di bawah jenis
dalam hierarki taksonomi (Jeffrey 1978; Stuessy 1994).
Penelitian terbaru dilakukan oleh Laili (2010) dengan menggunakan perbandingan morfologi kromosom. Hasil dari penelitian tersebut menunjukkan bahwa Zingiber zerumbet, Zingiber amaricans, dan Zingiber aromaticum merupakan jenis yang berbeda.
Zingiber littorale tidak diteliti karena sampel dari tanaman tersebut tidak dapat ditemukan. Studi kromosom yang dilakukan Laili (2010) dilatarbelakangi oleh rekomendasi dari Nasution dan Richard (1980) yang mengatakan bahwa sitotaksonomi penting dilakukan agar dapat diperoleh kesimpulan penempatan taksa yang lebih akurat. Melalui data kromosom, dapat diperkirakan kemungkinan terjadinya isolasi genetik (Stace 1989).
Tujuan dari penelitian ini adalah menentukan kekerabatan dari anggota genus
Zingiber varietas Zerumbet yaitu Z. amaricans, Z. aromaticum, dan Z. zerumbet
dengan pendekatan molekuler. Hal ini dilakukan karena adanya perbedaan pendapat dalam pengelompokan genus Zingiber
varietas Zerumbet antara Valeton (1918) serta Backer dan Bakhuizen (1968). Valeton (1918) menyatakan Z. amaricans, Z. aromaticum, Z. littorale, dan Z. zerumbet merupakan empat jenis yang tidak sama, sedangkan menurut Backer dan Bakhuizen (1968) empat jenis tersebut berada dalam satu spesies kompleks di bawah jenis Z. zerumbet. Spesies kompleks merupakan suatu istilah yang mengacu pada tingkatan taksa varietas (Stuessy 1994).
Hipotesis yang dapat diambil dari penelitian ini yang pertama adalah Z. amaricans, Z. aromaticum, dan Z. zerumbet
merupakan tiga jenis yang tidak sama. Z. amaricans, Z. aromaticum, dan Z. zerumbet
merupakan spesies kompleks di bawah Z. zerumbet. Z. littorale tidak diteliti dikarenakan belum ditemukannya sampel daun tanaman tersebut sampai tulisan ini dibuat. Manfaat yang diharapkan dari penelitian ini adalah dapat menentukan kekerabatan yang akurat antara Z. amaricans,
Z. aromaticum, dan Z. zerumbet.
TINJAUAN PUSTAKA
Genus Zingiber Varietas Zerumbet
1996; Guzman & Siemonsma 1999). Menurut Kress et al. (2002) genus Zingiber ini memiliki 53 genus dan lebih dari 1200 jenis. Sejauh ini daerah yang diketahui kaya akan Zingiberaceae adalah wilayah Malaysia, Indonesia, Brunei, Philipina, dan Papua (Larsen et al. 1999). Zingiberaceae secara umum dikenal oleh masyarakat Indonesia sebagai tumbuhan jahe-jahean. Tumbuhan ini banyak dimanfaatkan oleh masyarakat di Indonesia sebagai bumbu masak, obat-obatan, bahan untuk membuat jamu, bahan rempah-rempah, tanaman hias, bahan kosmetik, bahan minuman, dan bahan tonik rambut (Lawrence 1964).
Contoh jenis dari genus Zingiber yang menjadi komoditi penting di 5 negara Asia Tenggara termasuk Indonesia, yaitu jahe (Zingiber officinale Rosc.) dan lempuyang (Zingiber zerumbet (L.) Sm.) (Guzman & Siemonsma 1999). Sebagian besar jenis tumbuhan dari suku Zingiberaceae pun telah lama dikultivasi karena dikenal masyarakat luas sebagai bahan baku obat-obatan dan bumbu masakan (Heyne 1987; Ravindran & Babu 2005). Lempuyang dimanfaatkan secara tradisional sebagai obat herbal oleh masyarakat, seperti sebagai penambah nafsu makan, cacingan, kolik, memar, beri-beri, kurap, alergi, rematik, batuk, dan ambeien (Hariana 2008). Jika dilihat dari manfaat dari tanaman tersebut, maka perlu dilakukan pengelompokan yang akurat dengan menggunakan pendekatan molekuler ini.
Z. zerumbet pertama kali dideskripsikan oleh Linnaeus (1753) sebagai jenis Amomum zerumbet dan direvisi oleh Smith pada tahun 1804 menjadi genus Zingiber. Jenis tersebut dinamakan lempuyang gajah oleh masyarakat yang membudidayakannya (Valeton 1918; Sastrapradja et al. 1981; Tjitrosoepomo 1993). Lempuyang berasal dari bahasa jawa, yaitu kata empu atau empon-empon yang berarti rimpang yang dapat digunakan sebagai bahan baku obat-obatan (Heyne 1987).
Lempuyang gajah (Z. zerumbet) merupakan salah satu tanaman yang banyak digunakan dalam campuran obat tradisional atau jamu. Rimpang dari lempuyang gajah ini mempunyai rasa yang cukup pahit dan mempunyai bau yang spesifik. Z. zerumbet
diketahui memiliki kandungan senyawa kimia yang khas, yaitu zerumbon (CL15H22O) yang berpotensi sebagai anti radikal bebas, anti inflamasi, anti kanker, serta dapat mengurangi aktivitas virus HIV (Sakinah et al. 2007). Lempuyang gajah secara tradisional dapat dimanfaatkan sebagai obat sakit perut, asma,
disentri, obat cacing, obat mencret, dan bersifat karninatif (Depkes 1989; Hanafi et al.
2001).
Lempuyang gajah merupakan terna perennial yaitu tanaman obat yang dapat tumbuh sepanjang tahun dengan tinggi hingga 200 cm, memiliki ukuran rimpang yang besar berwarna kuning gading hingga kuning pucat, dan memiliki aroma yang tidak terlalu tajam. Daun berbentuk bulat telur terbalik (obovate) dengan pangkal daun membulat dan ujung daunnya agak meruncing (subacuminate) hingga runcing (acute). Daun bertrikom halus (subglabrous) serta memiliki tangkai (petiole) bermembran, ligula bermembran, dan pelepah (sheath) (Valeton 1918). Bulir berbentuk bulat telur berujung tumpul (Linnaeus 1753). Gambar 1 menunjukkan bagian-bagian tanaman Z. zerumbet yang telah dipaparkan sebelumnya.
Gambar 1 Zingiber zerumbet: A. perawakan; B. bunga; C. bulir muda; D. bulir tua, buah, dan biji; E. spesimen Herbarium Bogoriense (BO) (Laili
F. 2010).
Lempuyang wangi memiliki wangi yang lebih harum dibandingkan dengan jenis lempuyang lainnya. Metabolit sekunder merupakan faktor yang berperan dalam memberikan aroma, bau, dan kualitas khasiat yang spesifik bagi setiap tanaman (Robinson 1988). Nama lempuyang wangi ini dikenal di Sumatera dan Jawa Tengah, sedangkan di Madura tanaman ini dikenal dengan nama lempuyang ruum.
Lempuyang wangi merupakan tanaman obat berbatang semu dengan waktu
C
D
E
3
berbunga Januari–April (Sudarsono et al.
2002). Kandungan lempuyang wangi yang bermanfaat adalah saponin dan flavonoid. Saponin dapat menurunkan tingkat plasma kolesterol dan meningkatkan ekskresi kolesterol melalui feses, sedangkan flavonoid dapat menurunkan kolesterol dalam serum dengan cara menghambat pembentukan misel dalam usus halus sehingga akan mengurangi penyerapan kolesterol (Cheeke 1989).
Daun berbentuk lanset, berlidah panjang dengan posisi tegak dan berselaput, bagian pangkal daun berbentuk bundar atau lancip, serta bagian permukaan daun berbulu. Bunga tanaman berbentuk mayang tersembul di atas tanah dengan posisi gagang bunga tegak, berbulu, ramping dan sangat kuat, memiliki sisik yang berwarna merah, serta berbentuk lanset. Mahkota bunga berwarna kuning terang, kuning gelap, atau putih kekuningan. Rimpang menyerupai jahe, memiliki ukuran paling kecil dibandingkan dengan jenis lempuyang lainnya, dan berwarna kuning pucat dengan rasa yang pahit (Tim Penulis Martha Tilaar Inovation Center 2002). Buah lempuyang wangi berbentuk kotak, bulat telur, dan berwarna merah dengan biji bulat panjang. Gambar 2 menunjukkan bagian-bagian tanaman Z. aromaticum yang telah dipaparkan pada kalimat-kalimat sebelumnya.
Gambar 2 Zingiber aromaticum: A. perawakan; B. bulir muda; C. bulir tua; D. bunga; E. spesimen tipe Herbarium Kebun Raya Bogor (KRB)
(Laili F. 2010).
Z. amaricans memiliki nama lokal lempuyang pahit (Valeton 1918) atau lempuyang emprit (Tjitrosoepomo 1993) dan banyak dibudidayakan masyarakat di Pulau Jawa (Backer & Bakhuizen 1968). Tanaman ini tumbuh tidak terlalu tinggi dibandingkan dengan jenis lempuyang lainnya. Rimpang lempuyang pahit berukuran kecil, berserat keras, berwarna kuning, memiliki rasa yang pahit, dan memiliki bau yang menyengat. Ukuran daun tidak begitu lebar, bulir berbentuk bulat lonjong dengan ujung yang runcing.
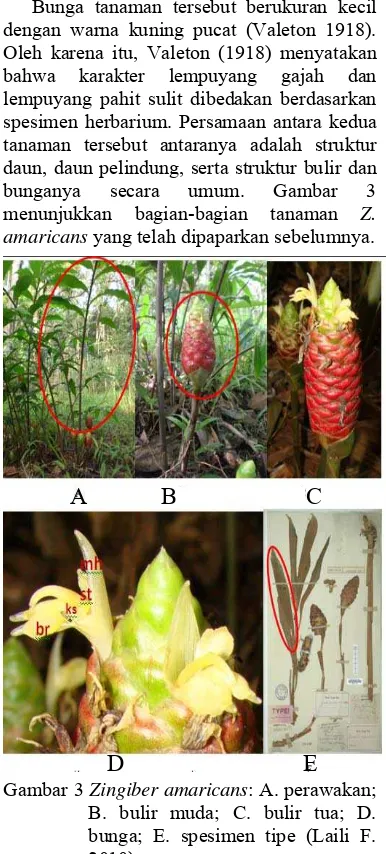
Bunga tanaman tersebut berukuran kecil dengan warna kuning pucat (Valeton 1918). Oleh karena itu, Valeton (1918) menyatakan bahwa karakter lempuyang gajah dan lempuyang pahit sulit dibedakan berdasarkan spesimen herbarium. Persamaan antara kedua tanaman tersebut antaranya adalah struktur daun, daun pelindung, serta struktur bulir dan bunganya secara umum. Gambar 3 menunjukkan bagian-bagian tanaman Z. amaricans yang telah dipaparkan sebelumnya.
Gambar 3 Zingiber amaricans: A. perawakan; B. bulir muda; C. bulir tua; D. bunga; E. spesimen tipe (Laili F. 2010).
Bagian bunga pada ketiga anggota varietas
Z. zerumbet ini memiliki bagian mahkota (mh), bibir (br), stamminodia (st), dan kepala sari (ks). Jika dilihat pada gambar dapat dibedakan posisi bunga pada perbungaan, warna bunga, dan bentuk bunga dari ketiga angota varietas Z. zerumbet ini. Z. zerumbet
C
D
E
A
B
C
D
E
memiliki bunga berwarna hijau dan Z. aromaticum serta Z. amaricans memiliki bungan berwarna kuning.
Zingiber littorale adalah herba perennial jenis liar yang tidak dibudidayakan oleh masyarakat dan diduga sebagai varietas dari
Zerumbet. Tanaman jenis ini pernah ditemukan di daerah Sibolangit, Pulau Merak, Pulau Babi, dan daerah Jawa Timur. Jenis lempuyang ini belum memiliki nama daerah. Tinggi tanaman ini dapat mencapai 100 cm dengan daun yang tidak begitu lebar. Bulir dari Zingiber littorale ini berbentuk fusiform
dengan bunga berukuran relatif besar dan memiliki warna yang pucat (Valeton 1918; Backer & Bakhuizen 1968). Jenis lempuyang ini tidak dapat diteliti dikarenakan tidak ditemukannya sampel tanaman sampai tulisan ini dibuat.
Tahapan penelitian yang telah dilakukan untuk menentukan kekerabatan anggota genus
Zingiber varietas Zerumbet ini dapat dilihat pada Lampiran 1. Strategi penelitian diawali dengan metode isolasi DNA yang dilakukan dengan pendekatan Doyle dan Doyle (1987), kemudian dilanjutkan dengan amplifikasi DNA dengan metode PCR menggunakan marka molekuler matK dan ITS, setelah itu dilanjutkan dengan sequencing yang kemudian akan dianalisis kekerabatannya dengan metode bioinformatika.
Metode Isolasi DNA
Sel makhluk hidup memiliki dinding sel pada bagian luarnya sehingga untuk mengeluarkan materi DNA dari nukleus, dinding sel harus dipecah terlebih dahulu dengan cara mekanik ataupun enzimatik yang biasa disebut sebagai proses isolasi DNA. DNA merupakan makromolekul beruntai ganda berbentuk heliks yang berfungsi sebagai pewarisan sifat yang menyimpan beragam materi genetik dan mengandung basa purin dan pirimidin. Basa purin meliputi adenin dan guanin, sedangkan basa pirimidin meliputi timin dan sitosin (Manz et al. 2004).
Isolasi DNA sampel dapat dilakukan menggunakan metode CTAB yang mengacu pada Doyle dan Doyle (1987). Metode ini merupakan protokol isolasi DNA yang paling umum digunakan karena konsentrasi DNA yang diperoleh pada umumnya lebih banyak dibandingkan dengan metode lainnya. Tahapan dari metode isolasi DNA tersebut mudah dan cepat sehingga tidak membutuhkan waktu lama untuk isolasi. Penelitian yang dilakukan oleh Williams et al.
(2004) dan Kress et al. (2002)
mengelompokkan beberapa jenis tanaman Zingiberaceae menggunakan metode isolasi berbasis CTAB yang dikembangkan oleh Doyle dan Doyle (1987).
Metode isolasi berbasis CTAB ini tidak hanya digunakan untuk genus Zingiber, ada pula penelitian dari Ardiana (2009) yang menggunakan metode berbasis CTAB yang dikembangkan oleh Doyle dan Doyle (1987) ini dengan sampel daun pepaya dan daun jeruk. Tidak hanya penelitian Ardiana (2009) yang menggunakan metode berbasis CTAB ini, ada pula penelitian yang dilakukan oleh Maftuchah dan Agus (2006) yang menggunakan metode ini untuk meneliti tanaman jarak pagar.
Metode isolasi DNA berbasis CTAB yang dikembangkan oleh Doyle dan Doyle (1987) pun dapat dimodifikasi dengan nitrogen cair (Utami et al. 2012) yang juga menghasilkan pita DNA yang baik saat dilakukan uji kualitatif dengan sampel temulawak. Metode lain yang dapat digunakan untuk isolasi DNA tanaman adalah dengan metode berbasis SDS (sodium dodecyl sulphate), namun pada umumnya penggunaan detergen non ionik seperti CTAB akan menghasilkan kuantitas DNA yang lebih tinggi dibandingkan SDS (Maftuchah & Agus 2006). Metode lain yang dapat digunakan adalah dengan menggunakan Qiagen Kit untuk isolasi DNA, namun penggunaan metode ini memerlukan biaya yang mahal, selain itu ada pula metode Castillo (1994) yang digunakan oleh Safitri (2012) untuk isolasi DNA dari tanaman kelapa sawit.
Bagian organ tanaman yang diambil adalah daun, daun dipilih karena merupakan organ yang mudah dihancurkan dibandingkan dengan bagian organ lainnya dan merupakan organ penting dalam kehidupan tanaman. Daun yang digunakan dalam penelitian ini adalah daun muda dan sehat yang diambil pada tahun 2010 dari hasil koleksi Fajriah Laili yang disimpan dalam silika gel. Pemilihan daun muda ini dikarenakan daun sedang aktif melakukan pembelahan dan pertumbuhan sel sehingga mengandung banyak DNA.
5
genus Zingiber varietas Zerumbet tersebut. Primer yang digunakan akan menyeleksi DNA saat proses amplifikasi. Penelitian ini menggunakan DNA kloroplas dan DNA inti.
Polymerase Chain Reaction (PCR)
Metode PCR merupakan metode yang dikembangkan oleh Kary B. Mulis pada tahun 1985 untuk melipatgandakan secara eksponensial suatu sekuens nukleotida tertentu dengan cara in vitro (Yuwono 2006). Reaksi polimerasi DNA merupakan teknik kunci dalam molekuler genetik dengan menggunakan sedikit potongan kecil dari DNA atau RNA untuk analisis, sehingga memiliki efisiensi yang tinggi dalam menggandakan potongan DNA tertentu dalam jumlah besar (Bintang 2010).
Metode PCR menggunakan komponen-komponen replikasi DNA untuk mereplikasi suatu fragmen DNA yang spesifik di dalam tabung reaksi dan dikembangkan untuk mempercepat isolasi DNA spesifik tanpa membuat dan melakukan pustaka genom (Barnum & Susan 2005). Beberapa komponen yang penting dalam reaksi PCR adalah DNA target, enzim Taq DNA polimerase, deoksiribonukleotida trifosfat (dNTP), primer, dan larutan penyangga (bufer) (Muladno 2002).
Primer merupakan rantai DNA yang umumnya terdiri atas 10 atau lebih nukleotida (oligonukleotida) yang berfungsi sebagai pemula pada proses sintesis DNA dengan PCR. Enzim Taq DNA polimerase diisolasi pertama kali oleh Kary Mullis pada tahun 1983 dari bakteri Thermus aquaticus YT1
yang hidup di sumber air panas Yellowstone National Park California yang mampu mempertahankan aktivitasnya pada suhu tinggi (sampai 950C) walaupun dilakukan pemanasan berkali-kali dan mampu menambahkan satu nukleotida, terutama dATP pada ujung DNA hasil polimerisasi tanpa cetakan (Yuwono 2006). Deoksiribonukleotida trifosfat (dNTP) sebagai sumber nukleotida pada proses PCR yang mengandung deoksiadenosin trifosfat (dATP), deoksisitidin trifosfat (dCTP), deoksiguanosin trifosfat (dGTP), dan deoksitimin trifosfat (dTTP). Bufer berfungsi sebagai kofaktor bagi enzim Taq DNA polimerase (Bintang 2010).
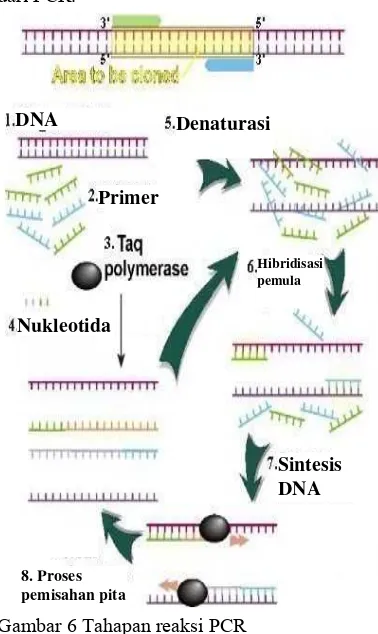
Tahapan PCR terdiri atas empat tahap, yaitu (1) Denaturasi dengan memisahkan DNA untai ganda menjadi untai tunggal yang dilakukan dengan pemanasan pada suhu 90– 950C (Edel 1998; Saiki 1990). (2) Hibridisasi
pemula (annealing) yang dilakukan dengan menurunkan suhu reaksi sehingga primer dapat menempel pada DNA target sesuai dengan sekuens komplemennya (Tobin & Morel 1997) dengan suhu sekitar 50–600C (Muladno 2002). (3) Sintesis DNA (extension) dengan menaikkan kembali suhu sekitar 720C sehingga memungkinkan enzim polimerase bekerja lebih aktif (Becker et al.
2000). (4) Pemisahan pita, pengikatan primer, dan pemanjangan yang diulang sampai 40 kali (Bintang 2010). Gambar 6 merupakan tahapan dari PCR.
Gambar 6 Tahapan reaksi PCR (http://universe-review.ca).
Metode PCR ini telah banyak dikembangkan, salah satunya adalah reverse transcription PCR (RT-PCR) yang memerlukan enzim transkriptase balik dalam proses pengerjaannya. Enzim tersebut adalah enzim DNA polimerase yang menggunakan molekul RNA sebagai cetakan untuk sintesis molekul DNA (cDNA) yang komplementer dengan molekul RNA tersebut (Yuwono 2006).
Marka Molekuler
Marka molekuler adalah suatu metode penunjuk keberadaan rangkaian nukleotida (DNA) yang dapat menyandikan suatu sifat atau memberikan informasi tentang keberadaan posisi suatu sekuens konservasi di
dalam genom atau non fungsional (Marta 2010). Brown et al. (1996) menyatakan bahwa penanda DNA dapat digunakan untuk identifikasi suatu individu atau genotip, derajat kekerabatan antar genotip, dan adanya variasi genetika suatu populasi tanaman. Penanda DNA juga dapat menentukan determinasi gen atau kompleks gen yang diinginkan dalam suatu genotip spesifik, dan pengembangan varietas tanaman baru melalui transformasi. Pemilihan marka yang akan digunakan dalam analisis genetik perlu mempertimbangkan tujuan yang diinginkan, sumber dana yang dimiliki, fasilitas yang tersedia, serta kelebihan dan kekurangan masing-masing tipe marka (Azrai 2006).
Maturase K (matK)
Marka molekuler matk ini pernah digunakan pula oleh Kress et al. (2002) untuk klasifikasi beberapa jenis tanaman dari genus Zingiberaceae. Menurut Soltis et al. (1998) genom kloroplas berupa molekul sirkular dengan dua segmen inverted berulang yang dipisahkan oleh bagian besar dan kecil single-copy serta dianggap konservatif dalam evolusinya. Keuntungan genom kloroplas pada rekonstruksi filogenetik termasuk fakta bahwa genom kloroplas memberi kemudahan memeriksa seluruh genom melalui analisis situs restriksi. Daerah sekuens matK dan intron trnK dapat dilihat pada Gambar 4. Sekuens matK dapat menghasilkan panjang 1500 bp dan daerah matK ini berada di dalam daerah trnK, oleh karena itu untuk mendapatkan daerah matK yang diinginkan, maka digunakanlah primer trnK dalam penelitian ini.
Gambar 4 Daerah sekuens matK dan intron
trnK (Soltis et al. 1998).
Marka molekuler matK dibuat berdasarkan DNA kloroplas (cpDNA). Menurut Clegg et al. (1986) cpDNA sangat cocok untuk mempelajari evolusi dan filogenetik suatu tumbuhan. Hal ini dikarenakan cpDNA merupakan komponen yang cukup melimpah pada keseluruhan DNA pada tumbuhan sehingga sangat mendukung dalam ekstraksi DNA beserta analisisnya. Kelebihan lain dari cpDNA dibandingkan dengan marka
molekuler lainnya adalah jika sekuens cpDNA diketahui dapat ditelusuri mengenai perubahan gen, perubahan struktur genom, dan tingkat kecepatan evolusi gen. Selain itu, perubahan sekuens cpDNA dapat digunakan untuk memecahkan hubungan filogenetik tumbuhan pada tingkat evolusi yang paling dalam (Soltis et al. 1998).
Primer yang digunakan adalah primer yang universal, yaitu trnk1F yang berperan sebagai forward dengan nilai melting temperature (Tm) sebesar 530C dan trnk2R yang berperan sebagai reverse dengan nilai
melting point (Tm) sebesar 550C yang berfungsi sebagai pemula pada proses sintesis DNA. Terdapat empat pasang primer lainnya yang berada diantara trnK1F dan trnK2R yang digunakan untuk proses sequencing, empat pasang primer tersebut adalah m1R— m1F, m5R—m5Fa, m8R—m8F, dan mSP2R—mSP2F yang sekuensnya dapat dilihat pada Lampiran 4. Sampel pertama yang disequencing di perusahaan 1st Base Singapura untuk PCR dengan primer trnK adalah Z. zerumbet yang menggunakan kesepuluh primer yang telah disebutkan sebelumnya. Hasil dari sequencing sampel tersebut kemudian akan dikirim oleh perusahaan 1st Base Singapura berupa kromatogram dari sepuluh primer yang digunakan, setelah itu dilakukan proses contig
menggunakan perangkat lunak ChromasPro untuk menghasilkan sebuah sekuens yang utuh dengan menggabungkan kromatogram dari kesepuluh primer yang digunakan. Proses
contig ini selain dapat menghasilkan sekuens yang utuh dari suatu sampel, maka dapat dilihat pula jika ada primer yang perlu dihilangkan. Sampel Z. zerumbet
menunjukkan bahwa ada tiga primer yang perlu dihilangkan untuk proses sequencing
sampel berikutnya, ketiga primer tersebut adalah m1R, mSP2R, dan trnK1F. Primer yang digunakan untuk proses sequencing
sampel Z. amaricans dan Z. aromaticum yang
dikirimkan ke perusahaan 1st Base Singapura adalah trnK2R, m1F, m5R, m5F, m8R, m8F, dan mSP2F. Tujuan dari dihilangkannya primer yang tidak diperlukan tersebut adalah agar dapat menghemat waktu dan biaya.
Internal Transcribed Spacer (ITS)
Marka molekuler ITS sendiri menggunakan primer yang universal. Marka molekuler ini pun digunakan oleh Kress et al.
7
menyimpulkan suatu filogenetik adalah DNA ribosomal yang disebut rDNA dan memiliki 3 jenis yang berukuran besar, yaitu 26S, 18S, dan 5.8S yang disandi oleh satu unit transkripsi tunggal. Sekuens yang menyandi ketiga rDNA tersebut dipisahkan dalam unit-unit transkripsi yang disebut transcribed spacer atau sering pula disebut Internal Transcribed Spacer (ITS). Setiap unit rDNA dalam satu rangkaian kromosom memiliki daerah pengode 26S, 18S, dan 5.8S seperti yang telah dijelaskan sebelumnya mengapit ITS1 dan ITS2 (Soltis et al. 1998) dapat dilihat pada Gambar 5. Primer yang digunakan dalam penelitian ini adalah ITS 5P dan ITS 8P yang merupakan modifikasi dari ITS4 dan ITS5. Nilai Tm primer ITS 5P dan ITS 8P masing-masing adalah 570C.
Analisis filogenetik dengan penanda ITS dapat digunakan untuk mengevaluasi hubungan antar jenis. Sekuens daerah ITS pada umumnya tetap atau dapat mengalami sedikit perubahan dalam suatu jenis, namun masih memperlihatkan adanya perbedaan di antara jenis dalam suatu genus (Edel 1998). Kelebihan dari ITS diantaranya adalah memiliki laju evolusi yang tinggi dan terdapat pada semua gen rRNA eukariot, sensitivitas cukup tinggi karena berukuran kecil (kurang lebih 700 bp), serta memiliki salinan yang banyak di dalam genom inti (Baldwin et al. 1995).
Gambar 5 Unit transkripsi Internal Transcribed Spacer (ITS)
(Mansfield & Kang 2008).
Hubungan Kekerabatan (Filogenetik)
Karakter morfologi telah lama digunakan dalam banyak penelitian filogenetika. Seiring dengan kemajuan molekuler seperti perkembangan teknik PCR dan sequencing
DNA, data DNA saat ini telah digunakan dalam banyak penelitian filogenetika untuk menghasilkan informasi yang lebih akurat. Filogenetik merupakan salah satu metode yang paling sering digunakan dalam sistematika untuk memahami keanekaragaman makhluk hidup melalui rekonstruksi hubungan kekerabatan. Konsep filogenetika menyatakan bahwa sebuah
kelompok organisme yang anggota-anggotanya memiliki banyak kesamaan karakter atau ciri dianggap memiliki hubungan yang sangat dekat dan diperkirakan diturunkan dari satu nenek moyang. Sumber karakter DNA dapat diperoleh dari inti (nDNA), kloroplas (cpDNA), dan mitokondria (mtDNA).
Nenek moyang dan semua turunannya akan membentuk sebuah kelompok monofiletik di mana setiap anggotanya diasumsikan membawa sifat atau pola genetik dan biokimia yang sama (Topik 2005). Filogenetik molekuler ini mengombinasikan teknik biologi molekuler dengan statistik untuk merekonstruksi hubungan filogenetika.
Analisis filogenetika molekuler merupakan proses bertahap untuk mengolah data sekuens DNA atau protein sehingga diperoleh suatu hasil yang menggambarkan evolusi suatu kelompok organisme. Menurut Hershkovitz dan Leipe (1998), ada sejumlah asumsi yang harus diperhatikan sebelum menggunakan data sekuens DNA atau protein dalam analisis filogenetika, di antaranya adalah sekuens berasal dari sumber yang spesifik seperti inti, kloroplas, dan mitokondria; sekuens bersifat homolog (diturunkan dari satu nenek moyang); sekuens memiliki sejarah evolusi yang sama seperti bukan dari campuran DNA inti dan mitokondria; serta setiap sekuan berkembang secara bebas. Ilmu bioinformatika dapat digunakan untuk analisis filogenetika dalam penelitian ini.
Bioinformatika itu sendiri merupakan bidang ilmu baru yang lahir dari diperlukannya kemampuan komputer berdaya tinggi untuk mengorganisir, menganalisis, dan menyimpan informasi biologis. Tipe-tpe informasi biologis primer yang terlibat dalam bioinformatika adalah data sekuens DNA dan protein. Data sekuens dari seluruh jenis mahkluk hidup yang sudah diteliti akan disimpan dalam sebuah database yang diciptakan untuk menampung seluruh informasi dan dapat diakses oleh semua orang. Penyimpanan database yang tetap di Amerika disebut GenBank yang ditangani oleh National Center for Biotechnology Information (NCBI). Jepang pun memiliki database tambahan pada DataBank of Japan
diklon dan di-sequencing, maka sekuens itu dapat digunakan dalam penulurusan yang disebut BLAST terhadap semua sekuens yang diketahui. Hal tersebut dilakukan untuk menentukan gen tersebut sudah pernah diklon atau belum dan apakah gen tersebut memiliki keterkaitan dengan gen lain yang sudah dikatahui. Jika sekuens tersebut baru, maka kekerabatannya dengan sekuens-sekuens lain dapat membantu untuk menentukan kemungkinan fungsi biologisnya (Elord & William 2006).
Beberapa perangkat lunak yang dapat digunakan dalam peneltiian untuk analisis filogenetika ini adalah MEGA 5.0 yang berfungsi untuk penyejajaran sekuens yang dihasilkan dari proses sequencing, ChromasPro untuk melakukan contig pada hasil penyejajaran sekuens, PAUP 4.0 untuk membuat pohon filogeni serta analisis kekerabatan dari varietas Zerumbet, dan TreeView untuk melihat pohon filogeni yang dihasilkan.
BAHAN DAN METODE
Bahan dan Alat
Bahan yang digunakan adalah sampel daun Zingiber zerumbet, Zingiber amaricans,
dan Zingiber aromaticum. Daun Z. zerumbet
diambil dari daerah lereng merapi Kaliurang, daun Z. amaricans diambil dari daerah hutan kota UI Depok, dan daun Z. aromaticum
diambil dari Kebun Raya Bogor yang dikoleksi oleh Laili (2010). Bahan lain yang digunakan adalah protolog, rimpang, PVP (polivinil pirolidin), pasir kuarsa, larutan 2x CTAB (setil trimetil amonium bromida), larutan merkaptoetanol, larutan kloroform-isoamilalkohol, isopropanol dingin, bufer TE (tris-EDTA), bufer TBE (tris boric acid), agarosa, dan DNA ladder. Bahan lainnya adalah bufer PCR, enhancer bufer, Taq
polymerase, MgCl, primer trnK 1F, primer trnK 2R, primer ITS 5P, primer ITS 8P, dNTPs, DNA hasil isolasi, dan larutan dH2O.
Alat-alat yang digunakan dalam penelitian yaitu neraca analitik LIBROR AEX-200G,
water bath shaker TAITEC PERSONAL-11, gelas kimia (250 mL dan 500 mL), gelas ukur (100 mL dan 500 mL), dan labu Erlenmeyer (100 mL dan 250). Alat lainnya adalah, oven,
microwave, vortex genie-2, tabung Eppendorf
(0.2 mL dan 1.5 mL), pipet mikro, mortar, penangas air, elektroforesis mupid-exu, gel – documentation (perangkat dokumentasi gel), TaKaRa PCR Thermal Cycle Dice TP600, autoklaf, dan sentrifus mikro KUBOTA-6800.
Metode
Identifikasi Tiga Anggota Genus Zingiber
Varietas Zerumbet
Identifikasi ketiga anggota genus Zingiber
varietas Zerumbet yang diteliti yaitu Z. zerumbet, Z. aromaticum, dan Z. amaricans
dilakukan dengan mencari literatur mengenai ciri organ ketiga tanaman tersebut yang mengacu pada pustaka yang ditulis oleh Valeton (1918). Ciri dari setiap organ yang telah didapatkan kemudian dicocokan dengan spesimen yang ada di LIPI Cibinong dan pada tanaman hidupnya.
Isolasi DNA (Doyle & Doyle 1987)
Proses pertama adalah isolasi DNA yang dilakukan menggunakan metode modifikasi Doyle & Doyle (1987). DNA diisolasi dari tumbuhan Z. zerumbet, Z. amaricans, dan Z. aromaticum. Isolasi diawali dengan memanaskan 500 µL CTAB pada suhu 60oC selama 15 menit untuk setiap sampel. Sebanyak 20 mg daun, pasir kuarsa satu ujung sudip, dan PVP satu ujung sudip digerus halus menggunakan mortar. Bubuk yang terbentuk dimasukkan ke dalam tabung Effendorf yang berisi CTAB hangat, kemudian ditambahkan dengan 2% merkaptoetanol. Larutan diinkubasi dalam penangas air 65oC selama 1 jam. Selanjutnya larutan sampel disimpan pada suhu ruang selama 15 menit, kemudian disentrifus dengan kecepatan 13000 g selama 15 menit.
Supernatan diambil 400 µL, kemudian ditambahkan dengan 400 µL kloroform-isoamilalkohol dengan perbandingan 1:1 dan dihomogenkan. Sampel disentrifus kembali dengan kecepatan 13000 g selama 10 menit. Supernatan diambil sebanyak 250 µL, kemudian ditambahkan dengan 250 µL
kloroform-isoamilalkohol dengan perbandingan 1:1 dan dihomogenkan.
9
Amplifikasi dengan PCR
Primer trnK. Untuk mengamplifikasi daerah matKkloroplas, PCR dilakukan pada sampel DNA hasil ekstraksi menggunakan
primer trnK 1F sebagai primer forward
(CTC AAC GGT AGA GTA CTC G) dan
trnK 2R sebagai primer reserve (AAC TAG TGG GAT GGA GTA G). Diantara kedua primer ini terdapat empat pasang primer lainnya yang masih berada dalam daerah
matK. Volume untuk 1x reaksi PCR adalah 25µL dengan komposisi larutan yaitu, 5 µL bufer dengan MgCl, 5 µL enhancer, 0.25 µL primer 1F, 0.25 µL primer 2R, 0.5 µL dNTP mix, 1 µL DNA hasil isolasi sebagai cetakan, 0.1 µL Taq polymerase, dan 12.9 µL dH2O. Selanjutnya, setiap campuran larutan dihomogenisasi hingga tercampur rata. Amplifikasi DNA dilakukan menggunakan alat PCR thermal cycle
dengan kondisi PCR yaitu 35 siklus dengan kondisi tiap siklus yaitu 5 menit tahap pradenaturasi pada suhu 95oC, 30 detik tahap denaturasi, 30 detik tahap annealing
pada suhu 57oC, 3 menit tahap sintesis pada suhu 72oC, 10 menit tahap pemanjangan berikutnya pada suhu 72oC, dan tahap penyimpanan pada suhu 10oC. Tahapan untuk analisis dengan marka molekuler
matK ini dapat dilihat pada Lampiran 2 yang berupa diagram alir.
Primer ITS. Sampel DNA hasil
ekstraksi dilakukan proses PCR menggunakan primer ITS 5P sebagai primer forward (GGA AGG AGA AGT CGT AAC AAG) dan ITS 8P sebagai primer reserve
(CAC GCT TCT CCA GAC TAC A). Volume untuk 1x reaksi PCR adalah 25µL dengan komposisi larutan yaitu, 2.5 µL 5x bufer, 1.5 µL MgCl, 1.5 µL primer 5P, 1.5 µL primer 8P, 0.5 µL dNTP mix, 0.5 µL DNA hasil isolasi sebagai cetakan, 0.2 µL
Taq polymerase, dan 16.8 µL dH2O. Selanjutnya, setiap campuran larutan dihomogenisasi hingga tercampur rata. Amplifikasi DNA dilakukan menggunakan alat PCR thermal cycle dengan kondisi PCR yaitu 30 siklus dengan kondisi tiap siklus yaitu 3 menit tahap pradenaturasi pada suhu 94oC, 1 menit tahap denaturasi, 1 menit tahap annealing pada suhu 55oC, 90 detik tahap sintesis pada suhu 72oC, 5 menit tahap pemanjangan berikutnya pada suhu 72oC, dan tahap penyimpanan pada suhu 4oC. Tahapan untuk analisis dengan marka molekuler ITS ini dapat dilihat pada Lampiran 3 yang berupa diagram alir.
Uji Kualitatif DNA
Gel agarosa 1% dibuat dengan mencampurkan serbuk agarosa dan bufer TBE. Pembuatan gel untuk gel doc 8 sumur dibuat dengan 0.2 gram agarosa yang ditambahka dengan 20 mL TBE, sedangkan untuk 12 sampel dibuat dengan 0.4 gram agarosa ditambahkan dengan 40 mL TBE yang kemudian dipanaskan dan dicetak. Jika sudah menjadi gel, maka dapat dimasukkan ke dalam alat elektroforesis untuk dimasukkan sampel yang akan dianalisis.
Sebanyak 2 µL sampel dicampurkan dengan 1 µL loading dye, kemudian dimasukkan ke dalam sumur gel. Gel dijalankan dalam mesin elektroforesis selama 25 menit pada 100 volt dan suhu ruang. Selanjutnya, gel hasil elektroforesis direndam dalam larutan EtBr (etidium bromide) selama 15 menit, kemudian dibilas di air bersih. Gel hasil pewarnaan diamati di bawah sinar ultraviolet.
Analisis Kekerabatan
Pemurnian dan sequencing DNA dilakukan di perusahaan 1st Base Singapura yang bertempat di Malaysia. Data sekuens daerah matK dan ITS yang dihasilkan dari proses sequencing diolah menggunakan perangkat lunak MEGA. Hasil dari penyejajaran sekuens kemudian akan dibuat pohon filogeninya dan dianalisis kekerabatannya yang sebelumnya dibandingkan pula perbedaan basanya.
Sekuens dari daerah matK dan ITS dikontig dengan menggunakan program ChromasPro versi Trial. Sekuens DNA dianalisis menggunakan perangkat lunak MEGA dan PAUP. Data untuk sekuens DNA kelompok Zingiber varietas Zerumbet yang didapatkan dan jenis Zingiber lainnya yang datanya diambil dari GenBank saling disejajarkan. Setelah itu dibuat pohon filogeninya dengan menggunakan program PAUP. Pohon filogeni yang terbentuk dibuka dengan program TreeView kemudian dianalisis kekerabatannya.
HASIL DAN PEMBAHASAN
Identifikasi Tiga Anggota Genus Zingiber
Varietas Zerumbet
oleh Husin & Elizabeth (1987) dalam penelitian mengenai bukti anatomi taksonomi kerabat-kerabat Z. zerumbet. Menurut Husin & Elizabeth (1987), bentuk dan jumlah sel epidermis bagian abaksial (permukaan bawah) daun per satuan bidang pandangan mikroskop dengan perbesaran 400 kali, dapat membedakan ketiga anggota varietas
Zerumbet. Bentuk dan ukuran sel epidermis yang tidak beraturan merupakan ciri khas Z. aromaticum, sel epidermis yang pada umunya berukuran kecil dan memiliki jumlah rata-rata 120–172 sel per satuan bidang merupakan ciri khas Z. zerumbet, sedangkan sel epidermis yang umumnya berukuran lebih kecil dibandingkan Z. aromaticum dan Z. zerumbet
memiliki jumlah rata-rata sel per satuan bidang pandangan kurang dari 130 sel merupakan ciri khas dari Z. amaricans. Namun, pengamatan ini tidak dilakukan karena tidak terfokus pada morfologi, tetapi molekuler dan dapat dibedakan langsung dengan melihat rimpang yang telah didapat dan pengamatan dengan melihat spesimen serta literatur.
Karakter yang digunakan untuk membedakan Z. zerumbet, Z. amaricans, dan
Z. aromaticum dapat dilihat pada Tabel 1 dengan melihat perbedaan rimpang, bulir, daun, dan bunga yang ditulis sesuai dengan hasil pengamatan yang telah dilakukan, serta dapat melihat Lampiran 5 untuk mengetahui bentuk serta warna organ tanaman yang diamati. Hal ini dilakukan agar memudahkan pembaca untuk membedakan ketiga anggota varietas Zerumbet tersebut. Hal yang paling mudah diamati adalah tinggi tanaman, bunga, ukuran bulir, serta bentuk bulir perbungaan. Pengamatan ini dilihat dari protolog yang mengacu pada tulisan Valeton (1918) dan juga melakukan pengamatan pada spesimen ketiga anggota genus Zingiber varietas
Zerumbet tersebut dengan mengukur daun dan bulirnya yang terdapat di ruang spesimen LIPI, serta pengamatan pada tanaman hidup yang berada di Kebun Raya Bogor. Namun, untuk mengamati perbungaan dilihat dari literatur, karena sampai saat tulisan ini dibuat tidak ditemukan tanaman yang sedang mengalami perbungaan. Cara lain yang dilakukan untuk mengamati dan melengkapi data morfologi tanaman ini selain hal-hal tersebut adalah dengan dengan mengamati rimpangnya yang dapat ditemukan di pasar tradisional. Lempuyang gajah atau Zingiber zerumbet memiliki tinggi tanaman hingga 200 cm dengan bulir perbungaan berbentuk bulat telur berujung tumpul dan jarang ditemukan
berbentuk runcing dengan ukuran panjang 7.5–12 cm dan lebar 2–5 cm. Bunganya berwarna hijau dan cukup besar dibandingkan dua anggota genus Zingiber varietas Zerumbet
lainnya. Rimpang dari Z. zerumbet memiliki ukuran yang lebih besar dibandingkan dengan anggota genus Zingiber varietas Zerumbet
lainnya. Warna dagingnya kuning gading, aroma tidak menyengat, dan rasanya sepat. Ukuran panjang rimpang yang ditemukan di pasar tradisional adalah 10–20 cm dengan diameter 1.5–3.5 cm. Daunnya bertrikom halus (subglabrousi) dengan bentuk bulat telur terbalik (obovate), pangkal daun membulat, sedangkan ujung daunnya agak meruncing (subacuminate) hingga runcing (acute). Ukuran daun Z. zerumbet ini lebih besar dibandingkan yang lainnya dengan memiliki panjang 13.5–39 cm dan lebar 2.5–8 cm yang diukur dengan menggunakan daun yang ada di ruang spesimen.
Lempuyang pahit atau Z. amaricans dapat memiliki tinggi sampai 100 cm dengan bulir perbungaan berbentuk bulat-lonjong (ellipse) berujung runcing (acutus). Ukuran bulir perbungaan lempuyang pahit ini memiliki panjang 3.5–10 cm dan lebar 2–4 cm. Rimpang dari Z. amaricans ini memiliki warna rimpang kuning-kuning tua dengan aroma yang menyengat dan rasa yang pahit. Ukuran rimpangnya kecil dengan diameter 1.5–2 cm dan memiliki panjang 8–9 cm, rimpang Z. amaricans ini dibeli di Pasar Anyar. Bentuk daun dari Z. amaricans hampir sama dengan Z. zerumbet sehingga sulit dibedakan dengan kasat mata. Yang dapat diamati dari daun Z. amaricans ini hanyalah ukuran daunnya dengan panjang 5–30 cm dan lebar 1–7.5 cm. Sesuai dengan pengamatan yang telah dilakukan, Z. amaricans ini lebih mudah ditemukan di daerah Bogor dibandingkan dua anggota varietas Zerumbet
yang lain. Hal ini dapat terjadi dikarenakan Z. amaricans ini lebih banyak dimanfaatkan sebagai bahan pembuat jamu atau lainnya.
Lempuyang wangi atau Z. aromaticum
11
telur dengan ujung sangat tumpul, ukuran daun yang dihasilkan dengan mengamati spesimen memiliki panjang 14–30 cm dan lebar 3.5–8 cm. Jika dibandingkan dengan dua anggota varietas Zerumbet yang lain, Z. aromaticum lebih sulit ditemukan di pasar tradisional.
Hasil Isolasi DNA Marga Zingiber Varietas
Zerumbet
Hasil uji kualitatif isolasi DNA ketiga anggota genus Zingiber varietas Zerumbet
yaitu Z. zerumbet (28), Z. amaricans (03),dan
Z. aromaticum (23) dapat dilihat pada Gambar 7 dan tidak dilakukan uji kuantitatif untuk menentukan konsentrasi DNA dengan spektrofotometer, namun jika ingin menghitung ukurannya saja dapat dilihat dengan cara membandingkan jarak pita DNA dengan jarak ladder yang telah diketahui ukurannya. Hasil isolasi berupa elektroforegram tersebut menunjukkan bahwa DNA yang dihasilkan dari hasil isolasi DNA
sudah baik karena ketiga anggota sampel genus Zingiber varietas Zerumbet yang diisolasi rata-rata menghasilkan pita yang cukup jelas dan hanya sedikit berbeda pada intensitas terangnya dan sampel Z. amaricans
memiliki pita yang paling baik dibandingkan dengan sampel lainnya. Sampel tersebut memiliki pita yang cukup jelas dan cukup terang dengan smear yang lebih sedikit dari sampel lainnya. Hasil pita pada elektroforegram memang terlihat smear
terutama pada sampel Z. zerumbet, namun karena DNA ini digunakan untuk PCR maka hal ini tidak menjadi masalah karena pada proses PCR itu sendiri akan diseleksi secara spesifik. Hasil DNA yang smear akan menjadi masalah jika DNA yang dihasilkan dari isolasi ini digunakan untuk kloning gen.Oleh karena itu, hasil elektroforegram dari isolasi DNA tersebut menunjukkan bahwa hasil isolasi baik dan terdapat DNA yang diinginkan sehingga stok DNA yang dibuat tersebut dapat dipakai untuk proses amplifikasi DNA dengan marka
Tabel 1 Perbedaan karakter anggota genus Zingiber varietas Zerumbet
No. Karakter Z. zerumbet Z. amaricans Z. aromaticum
1. Rimpang
● Ukuran (cm) p= 10–20, d= 1.5–3.5 p= 8–9, d= 1.5–2 p= 4–7.5, d= 1.5–2.5
● Warna kulit Coklat agak tua Coklat tua Coklat muda
● Warna
daging Kuning gading Kuning tua Kuning muda
● Rasa Sepat Pahit Pahit
● Aroma Tidak menyengat Menyengat Agak menyengat 2. Daun
● Ukuran teruk berdaun (cm)
± 200 ± 100 ± 150
● Ukuran helaian daun (cm)
p= 13.5–39, l= 2.5–8 p= 5–30, l= 1–7.5 p= 14–30, l= 3.5–8
3. Perbungaan
● Bentuk bulir Bulat telur Bulat telur Bulat telur
● Bentuk ujung bulir
Tumpul dan jarang
runcing Tumpul
Runcing dan terkadang tumpul
● Ukuran bulir
(cm) p= 3.5–10, l= 2–4 p= 3.5–10, l= 2–4 p= 6–12, l= 2.5–5 4. Bunga
● Warna Putih–Kuning gading Kuning muda Kuning–Kuning tua
● Bentuk bibir Jorong (rounded-ovate) Memanjang (oblong)
molekuler ITS dan matK. Ukuran dari masing-masing sampel varietas Zerumbet ini dapat dihitung dengan membandingkan ukuran jarak sampel dan jarak ladder yang telah diketahui ukurannya. Hasil elektroforesis isolasi DNA ini berada di atas
ladder sehingga tidak dapat ditentukan ukurannya, namun hal tersebut tidak menjadi masalah karena yang dilakukan pada penelitian ini hanyalah uji kualitatif untuk mengetahui keberadaan DNA tanpa uji kuantitatif untuk menghitung jumlah konsentrasi DNA yang dihasilkan dari proses isolasi DNA sampel tersebut.
Gambar 7 Elektroforegram hasil isolasi DNA
Zingiber amaricans (03),
Zingiber aromaticum (23), dan
Zingiber zerumbet (28).
Uji kualitatif ini dilakukan dengan metode elektroforesis gel agarosa dengan konsentrasi 1%, pemilihan konsentrasi gel agarosa 1% ini agar gel yang akan dipakai elektroforesis struktur seratnya baik, ukuran porinya besar, serta tahan terhadap gesekan. Selain itu konsentrasi gel agarosa yang baik untuk elektroforesis adalah 0.8–1.5%, sedangkan konsentrasi gel yang sangat encer (0.1–0.2%) dapat meningkatkan daya pisah elektroforesis, tetapi hal tersebut sulit dilakukan karena gel yang encer sangat mudah pecah (Bintang 2010). Uji kualitatif dengan metode elektroforesis gel agarosa ini pun dilakukan untuk uji hasil dari amplifikasi DNA dari marka molekuler ITS dan matK yang menggunakan agarosa dan ditambahkan TBE yang berfungsi sebagai bufer. Agarosa ini terbuat dari ekstrak rumput laut yang sudah dimurnikan. Pemilihan elektroforesis dengan gel agarosa pada penelitian ini dikarenakan metode elektroforesis ini lebih aman dibandingkan dengan elektroforesis lainnya, seperti akrilamid yang langsung mencampurkan EtBr (etidium bromide) yang bersifat toksik untuk elektroforesis. EtBr ini merupakan pewarna gel, sehingga pada saat diberikan paparan sinar UV pita DNA dapat terlihat.
Hasil Amplifikasi dan SequencingmatK
Amplifikasi DNA pada tahap ini bertujuan untuk mendapatkan sekuens dari marka molekuler matK pada sampel DNA yang diuji. Primer yang digunakan untuk amplifikasi ini adalah trnK1F sebagai forward
dan trnK2R sebagai reverse, sehingga penamaan PCR dari proses ini adalah PCR
trnK. Larutan sampel yang dihasilkan dari proses amplifikasi ini berwarna bening, maka perlu ditambahkan loading dye agar sampel menjadi berwarna dan mudah dimasukkan ke dalam sumur saat uji kualitatif menggunakan elektroforesis gel. Hasil elektroforesis dari PCR dengan primer trnK ini dapat dilihat pada Gambar 8. Pita yang dihasilkan terang dan jelas sehingga hasil PCR ini dapat dilanjutkan untuk proses sequencing. Kendala yang dihadapi pada proses ini yaitu sempat terjadi kesalahan dari perusahaan tersebut yang menyebabkan harus dilakukan PCR ulang sebanyak 2 sampel yang cukup menunda penyelesaian penulisan. DNA yang dihasilkan dari sampel hasil PCR Z. zerumbet, Z. aromaticum, dan Z. amaricans jika dibandingkan dengan ladder adalah diantara 2000–3000 bp.
Gambar 8 Elektroforesis hasil PCR trnK
Zingiber amaricans (03),
Zingiber aromaticum (23), dan
Zingiber zerumbet (28).
Tahapan yang paling kritis pada proses PCR adalah annealing karena pada saat tahap tersebut terjadi penempelan primer pada DNA
template. Jika pemilihan suhu annealing tidak tepat, maka dapat mengakibatkan primer tidak dapat mengamplifikasi DNA dengan baik. Hasil pita DNA pada saat uji kualitatif tidak akan terbentuk atau pita hanya terlihat tipis dan dapat terlihat smear. Optimasi suhu
annealing pada penelitian ini dicoba dengan empat suhu yang berbeda yaitu 52°C, 54°C, 56°C, dan 57°C. Hasil pita pada suhu 52°C tidak terlihat, pada suhu 54°C pun pita masih 03 23 28
3000 bp 2500 bp 2000 bp 1500 bp 1200 bp 1000 bp 900 bp 800 bp 700 bp 500 bp 400 bp 300 bp 200 bp
13
tidak terlihat, pada suhu 56°C terlihat pita DNA namun masih smear, dan pada suhu 57°C pita terlihat jelas tanpa smear seperti yang terlihat pada Gambar 8. Hal ini sesuai dengan teori yang menyatakan bahwa semakin tinggi suhu annealing maka pita DNA yang dihasilkan akan semakin terlihat spesifik, namun hal tersebut pun tetap bergantung pada kualitas hasil PCR.
Kit yang digunakan dalam amplifikasi DNA dengan marka molekuler matK ini adalah Kapa2GTM Robust PCR Kit. Bufer yang digunakan adalah 5x kappa 2G bufer A yang mengandung MgCl2 1.5 mM yang berfungsi sebagai kofaktor bagi enzim Taq
DNA polimerase, bufer A ini digunakan untuk
template yang memiliki komposisi GC kurang dari 65%, dapat memberikan hasil yang baik, spesifik, dan sensitif. Selain itu, ada pula pilihan dengan menambahkan 5x kappa enhancer yang berfungsi untuk meningkatkan keefisienan reaksi dan lebih spesifik lagi, dNTP yang berfungsi sebagai sumber nukleotida, dan MgCl2 sebagai sumber ion Mg2+ yang berfungsi sebagai kofaktor bagi enzim Taq DNA polymerase yang digunakan saat proses amplifikasi. Primer yang digunakan berfungsi sebagai pemula dalam proses PCR.
Komponen lain yang digunakan dalam proses PCR adalah enzim Taq DNA polimerase. Konsentrasi Enzim Taq DNA polimerase tidak boleh terlalu tinggi karena akan mengakibatkan munculnya produk non-spesifik dan jika konsentrasi Enzim Taq DNA polimerase terlalu rendah, maka proses amplifikasi berlangsung secara inefisien dan produk amplifikasi yang diperoleh akan mempunyai konsentrasi yang relatif rendah. Komponen penting lainnya adalah DNA yang berfungsi sebagai template dan dH2O yang berfungsi sebagai bahan untuk mengencerkan larutan untuk diberi perlakuan PCR.
Hasil sequencing DNA dari marka
molekuler matK pada semua sampel adalah baik dan dapat dilakukan contig pada program ChromasPro yang dapat digunakan secara gratis selama 60 hari. Primer yang digunakan untuk proses sequencing ini adalah m1F, m8Fa, m8R, m5Fa, m5R, mSP2R, dan
trnK2R. Hasil sequencing primer trnK2Rdari salah satu sampel yang diteliti yaitu sampel Z. zerumbet dapat dilihat pada Gambar 9 yang berupa kromatogram. Kromatogram yang dihasilkan pada sebagian primer trnK2R ini memiliki hasil yang dapat dilihat dengan jelas titik puncak setiap basanya, dapat dengan mudah membedakan posisi setiap basa, dan tidak ada noise yang dapat mengganggu penentuan posisi basa dari DNA sampel Z. zerumbet. Hasil kromatogram dari sequencing
marka molekuler matK ini dapat dikatakan sudah bagus, sehingga dapat diteruskan untuk menghasilkan sekuens yang utuh dengan menggunakan program contig yang terdapat di ChromasPro. Sekuen utuh yang dihasilkan dari proses contig pada sampel Z. zerumbet ini dapat dilihat pada Lampiran 6. Sekuens yang utuh tersebut dapat digunakan untuk proses penyejajaran, sehingga dapat dilihat seberapa banyak perbedaan dari setiap sampel yang dapat menunjukkan bagaimana hubungan kekerabatan dari setiap sampel yang diuji.
Proses contig perlu diperiksa kembali dan diperbaiki susunan basanya karena ada beberapa basa yang diberi warna hitam atau akan muncul huruf selain A,T,G, dan C dikarenakan ada gangguan atau noise yang dapat dilihat dari kromatogram hasil
sequencing marka molekuler ITS. Jika hasil
contig sudah diperbaiki, maka akan dihasilkan sekuens yang utuh yang dapat digunakan untuk dilakukan penyejajaran sekuens dengan program Muscle yang terdapat di perangkat lunakMEGA 5.0. Panjang sekuens utuh yang dihasilkan dari ketiga anggota genus Zingiber
varietas Zerumbet ini lebih dari 2000 bp. Marka molekuler lain yang digunakan pada
penelitian ini adalah ITS, hasil amplifikasi dan sequencing dari ITS dapat dilihat pada bab selanjutnya untuk menunjukkan bahwa hasil sekuens matK memiliki hasil yang lebih baik untuk analisis filogenetik.
Hasil Amplifikasi dan Sequencing ITS
Amplifikasi pada penelitian ini tidak hanya dilakukan dengan satu marka molekuler yaitu matK, tapi dilakukan pula amplifikasi dengan marka molekuler lainnya yaitu ITS dengan tujuan untuk membandingkan hasilnya agar data yang dihasilkan dapat lebih akurat.
Kit yang digunakan dalam amplifikasi DNA dengan marka molekuler ITS ini adalah promega. Komponen yang digunakan adalah
green buffer sebagai penyangga dan tanpa penambahan enhancer. Karena bufer yang digunakan sudah berwarna, saat analisis kualitatif dengan elektroforesis tidak diperlukan penambahan loading dye untuk pewarnaan. Bahan lain yang digunakan adalah DNA sampel sebagai template,dH2O sebagai bahan pengencer, primer ITS5P dan ITS8P sebagai pemula yang sekuensnya dapat dilihat pada Lampiran 4, Enzim Taq DNA polimerase, dan dNTP yang fungsinya sama seperti yang telah dijelaskan sebelumnya.
Sama halnya dengan amplifikasi dengan marka molekuler matK, tahapan annealing
pada PCR dengan marka molekuler ITS ini pun merupakan tahapan yang paling kritis. Optimasi suhu annealing dengan primer ITS5 dan ITS8 ini menggunakan suhu 55°C. Suhu ini dapat menghasilkan pita DNA yang baik dan jelas terlihat tanpa smear pada saat uji kualitatif. Hasil PCR menggunakan marka molekuler ITS dapat dilihat pada Gambar 10. Gambar tersebut menunjukkan bahwa pita yang dihasilkan dari proses elektroforesis dari sampel yang diberikan perlakuan PCR dengan primer ITS terang dan jelas sehingga dapat
diteruskan untuk proses sequencing yang dilakukan di perusahaan 1st Base Singapura. Ukuran DNA yang dihasilkan dari sampel hasil PCR Z. zerumbet, Z. aromaticum, dan Z. amaricans adalah sekitar 900 bp.
Gambar 10 Elektroforesis Hasil PCR ITS
Zingiber amaricans (03),
Zingiber aromaticum (23), dan
Zingiber zerumbet (28).
Hasil sequencing dari salah satu sampel anggota Zingiber varietas Zerumbet yang ditampilkan pada Gambar 11 berupa kromatogram adalah hasil dari Z. aromaticum
dengan primer ITS5P. Amplifikasi dan
sequencing dari marka molekuler ini sudah dilakukan pengulangan sebanyak tiga kali ulangan dikarenakan hasil yang tidak bagus. Hasil kromatogram tersebut menunjukkan sekuens yang bertumpuk-tumpuk dan tidak menghasilkan sekuens yang baik. Hal ini dapat dilihat dari adanya noise yang menyulitkan untuk penentuan basa. Hasil
sequencing tersebut tidak dapat dilakukan
contig ataupun perbaikan susunan sekuens. Oleh karena itu, hasil tersebut tidak dapat menghasilkan sekuens yang utuh dari Z. aromaticum karena hasil sequencing dari primer ITS8P dan ITS5P tidak dapat disatukan dengan program contig yang ada di ChromasPro, sehingga data dari hasil
sequencing dengan marka molekuler ITS ini
Gambar 11 Kromatogram hasil sequencing DNA Z. aromaticum dengan primer ITS5P. 3000 bp
2500 bp 2000 bp 1500 bp 1200 bp 1000 bp 900 bp 600 bp 500 bp 400 bp 300 bp
15
tidak dapat dipakai untuk melakukan analisis filogenetik anggota varietas Zerumbet. Analisis lanjutan untuk menentukan kekerabatan dari anggota genus Zingiber
varietas Zerumbet hanya dilakukan dengan menggunakan hasil data sekuens dari marka molekuler matK karena tidak memungkinkan untuk menggunakan marka molekuler ITS. Hasil sequencing seperti marka molekuler ITS ini dapat disebabkan adanya sifat polimorfisme dari DNA genus Zingiber
varietas Zerumbet itu sendiri, sehingga perlu dilakukan penelitian lanjutan menggunakan proses transformasi untuk mendapatkan hasilnya. Namun, penelitian lanjutan dengan transformasi ini tidak dilakukan karena keterbatasan waktu.
Analisis Filogenetik
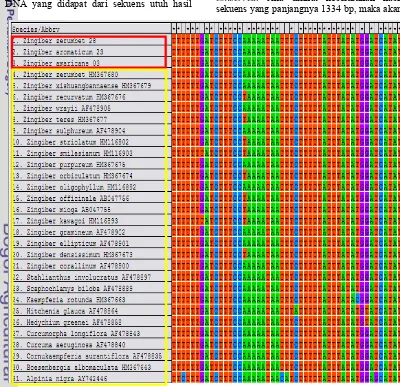
Analisis filogenetik yang dilakukan dalam penelitian ini menggunakan terapan ilmu bioinformatika dengan bantuan perangkat lunak MEGA 5.0 untuk penyejajaran sekuens DNA yang didapat dari sekuens utuh hasil
sequencing dengan marka molekuler matK, sampel yang diteliti adalah anggota varietas
Zerumbet yaitu Z. zerumbet, Z. amaricans, dan Z. aromaticum dimasukan ke dalam perangkat lunak MEGA 5.0 yang kemudian ditambahkan denga 28 sekuens dari GenBank yang dapat dilihat pada Gambar 12. Gambar tersebut menunjukkan bahwa data sekuens sampel yang diteliti berada di dalam kotak merah dan data sekuens yang didapatkan dari GenBank berada dalam kotak kuning. Penyejajaran sekuens dilakukan menggunakan program Muscle yang terdapat pada MEGA 5.0 untuk menentukan apakah satu sekuens DNA homolog dengan yang lainnya. Tahap ini akan menampilkan setiap basa nukleotida yang terdapat pada setiap sampel DNA yang digunakan seperti yang terlihat pada Gambar 12. Sekuens yang ditampilkan bukan merupakan sekuens utuh, namun pada penelitian ini dengan melihat hasil penyejajaran sekuens tersebut maka dapat dilihat bahwa banyak sekuens yang cukup
conserved. Jika dilihat keseluruhan hasil sekuens yang panjangnya 1334 bp, maka akan
terlihat pula gap berupa garis putus-putus yang dapat disebabkan karena adanya insersi atau delesi.
Sekuens dengan primer trnK pada umumnya akan menghasilkan panjang sekuens sekitar 2600 bp, sedangkan matK menghasilkan panjang sekuens sekitar 1500 bp. Dilihat dari salah satu sekuens yang didapatkan dari GenBank, Z. officinale
menjadi acuan penentuan posisi gen matK yang akan diambil. Z. officinale memiliki panjang trnK 2633 bp dan gen matK terdapat pada situs 787 bp di dalam trnK yang memiliki panjang sekuens 1548 bp. Penyejajaran dilakukan dengan mengambil gen matK yang dipotong sebanyak 214 bp dikarenakan terdapat beberapa data sekuens dari GenBank yang panjangnya tidak sama sehingga panjang sekuens total yang dianalisis adalah 1334 bp agar hasil lebih akurat. Sekuens yang dimiliki anggota varietas
Zerumbet pada gen matK dapat dilihat pada Lampiran 7 yang jika dibandingkan dengan sekuens utuh hasil sequencing dengan primer yang telah disebutkan sebelumnya, maka hasil sekuens pada gen matK terlihat lebih pendek. Analisis yang dilakukan setelah penyejajaran sekuens adalah penghitungan perbedaan basa antara ketiga anggota genus
Zingiber varietas Zerumbet dengan tiga jenis
Zingiber lainnya yang didapatkan dari GenBank. Data sekuens yang diambil dari GenBank untuk perbandingan ditentukan berdasarkan letaknya pada pohon filogeni yang dihasilkan dari program MEGA 5.0. Ketiga data sekuens yang digunakan merupakan genus Zingiber karena akan lebih mudah untuk menentukan ketiga sampel yang digunakan dalam penelitian yaitu Z. zerumbet,
Z. amaricans, dan Z. aromaticum merupakan jenis yang berbeda atau varietas. Hasil yang didapatkan untuk perhitungan perbedaan basa antara anggota genus Zingiber varietas
zerumbet yang dibandingkan dengan Z. recurvatum, Z. xishuangbannaense, dan Z. zerumbet yang didapatkan dari data GenBank dapat dilihat pada Tabel 2.
Jika dilihat dari hasil penyejajaran sekuens dan dihitung perbedaan basanya dapat disimpulkan bahwa ketiga anggota genus
Zingiber varietas Zerumbet yang diteliti merupakan varietas dari jenis Zingiber zerumbet atau merupakan spesies kompleksdi bawah jenis Zingiber zerumbet yang sesuai dengan pernyataan Backer dan Bakhuizen (1968).
Tahap selanjutnya setelah penyejajaran sekuens selesai adalah melakukan analisis filogenetik dengan program PAUP 4.0 yang berfungsi sebagai pembuat pohon filogeni. Rekonstruksi pohon filogeni dilakukan menggunakan metode parsimony yang merupakan metode analisis untuk memilih pohon filogeni yang akan menentukan kekerabatan suatu organisme yang mendekati keadaan sebenarnya di alam dengan bootstrap
(BS) 1000 ulangan agar hasil lebih akurat. Nilai ulangan BS ini dapat ditingkatkan agar mendapatkan hasil yang lebih akurat. Metode
parsimony menghasilkan 250 pohon filogeni dengan nilai indeks konsistensi (CI)= 0.897 dan nilai indeks retensi (RI)= 0.833, nilai tersebut menandakan bahwa hasil konsistensi dan resolusi dari pohon filogeni yang dihasilkan cukup tinggi karena mendekati nilai 1.0.
Rekonstruksi pohon filogeni ini diawali dengan menentukan kelompok outgroup yang sangat penting untuk polarisasi karakter apomorfik dan plesiomorfik. Kelompok
outgroup yang dipilih dalam penelitian ini adalah Alpinia nigra yang didapatkan dari data GenBank. Pemilihan jenis ini dikarenakan memiliki posisi yang paling jauh dengan jenis Zingiber yang diteliti. Karakter apomorfik adalah karakter yang berubah dan diturunkan yang terdapat pada ingroup, sedangkan karakter plesiomorfik adalah karakter primitf yang ada pada outgroup itu sendiri. Karakter lainnya adalah karakter sinapomorfik yang diturunkan dan terdapat pada kelompok monofiletik. Kelompok monofiletik merupakan kelompok yang terbentuk jika nenek moyang tunggalnya hanya menghasilkan semua jenis turunan dalam genus tersebut.
Jika dilihat dari Gambar 13 yang menunjukkan hasil pohon filogeni sampel dan data GenBank dengan bantuan program PAUP 4.0, maka dapat dilihat bahwa ketiga
Tabel 2 Perbedaan basa varietas Zerumbet dengan genus Zingiber data GenBank
GenBank
Sampel Z. zerumbet Z. xishuangbannaense Z. recurvatum
Z. zerumbet 1 8 10
Z. amaricans 2 9 11
17
sampel genus Zingiber varietas Zerumbet
yang d