i
Efikasi Vaksin DNA Penyandi Glikoprotein
Koi Herpesvirus pada Ikan Mas Stadia Benih
melalui Perendaman
SOKO NUSWANTORO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
ii
Efikasi Vaksin DNA Penyandi Glikoprotein
Koi Herpesvirus pada Ikan Mas Stadia Benih
melalui Perendaman
SOKO NUSWANTORO
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
iii Judul Tesis : Efikasi Vaksin DNA Penyandi Glikoprotein Koi Herpesvirus
pada Ikan Mas Stadia Benih melalui Perendaman Nama : Soko Nuswantoro
NIM : C151080321
Disetujui
Komisi Pembimbing
Dr. Alimuddin, S.Pi. M.Sc. Ketua
Dr. Munti Yuhana, S.Pi. M.Si. Anggota
Diketahui Ketua Program Studi
Ilmu Akuakultur
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Enang Harris, M.S. Dr. Ir. Dahrul Syah, M.Sc.Agr.
ii © Hak Cipta milik IPB, tahun 2012
Hak Cipta Dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
iii
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyampaikan bahwa tesis yang berjudul:
EFIKASI VAKSIN DNA PENYANDI GLIKOPROTEIN KOI
HERPESVIRUS PADA IKAN MAS STADIA BENIH MELALUI PERENDAMAN
adalah benar merupakan hasil karya yang belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2012
i SOKO NUSWANTORO. Efficacy of DNA Vaccine Encoding Koi Herpesvirus Glycoprotein on Common Carp Fingerling by Immersion. Under direction of Dr. Alimuddin and Dr. Munti Yuhana.
Abstract
Koi herpesvirus (KHV) is a herpesvirus which especially infects and causes mass mortality to koi and common carp. Therefore the protection of carp from KHV infection is urgently needed. In this study, we developed an application of DNA vaccine containing gene encoding KHV glycoprotein by immersion method to increase survival of common carp against KHV infection. As many as 400 of 30-day-old common carp juveniles were immersed in the water containing 1.3 x 108 CFU/ml of the killed Escherichia coli cells carrying DNA vaccine. Treatments performed were variation of duration and frequency of DNA vaccine immersion; as follows: 1x 30 minutes, 1x 60 minutes, 1x 90 minutes, 2x 90 minutes, and 3x 90 minutes of immersion treatments. Reverse transcription polymerase chain reaction (RT-PCR) analysis showed that DNA vaccine was successfully expressed among the vaccinated fish. Twenty eight days post vaccination, the fish were challenged by injecting 10-4 ml/fish of KHV. The result demonstrated that vaccination by 30 minutes immersion; allowed the 61% of fish survived, this was significantly different (P<0.05) compared to control (without vaccination), but insignificantly different (P>0.05) compared to those of other treatments. The relative percent survival of vaccinated fish were also similar among different treatments (P>0.05). Vaccination by immersion have increased the survival rate about 2 fold compared to unvaccinated fish control (26.67%). Thus, DNA vaccine was effective delivered by immersion for 1x 30 minutes, and this technique can be useful to level up the resistance to KHV infection in common carp juveniles.
ii
RINGKASAN
SOKO NUSWANTORO. Efikasi Vaksin DNA Penyandi Glikoprotein Koi Herpesvirus pada Ikan Mas Stadia Benih melalui Perendaman. Di bawah bimbingan Dr. Alimuddin dan Dr. Munti Yuhana.
Penyakit KHV sangat menular, dapat menyebabkan serangan massal, dan kematian mencapai 85-100% (Sunarto dan Cameron, 2006). Beberapa metode pernah dicoba untuk menanggulangi serangan dari KHV ini, antara lain: dengan menjaga suhu agar tetap hangat di atas 86°F (30°C) (Ronen et al., 2003), karena pada umumnya serangan KHV terjadi pada saat suhu perairan berkisar antara 72°-81°F (22°-27°C) (Gilad et al., 2003). Cara ini dinilai kurang efektif dan efisien, karena sulit menjaga suhu perairan untuk tetap hangat bila budidaya di perairan terbuka, dan juga hanya bersifat sementara, sehingga KHV kembali menyerang bila suhu menjadi hangat (Hartman et al., 2008).
Dengan vaksinasi, ikan dirangsang untuk memproduksi antibodi yang berfungsi sebagai pertahanan terhadap benda asing yang masuk ke dalam tubuh ikan. Hanya saja penggunaan vaksin dari virus yang diinaktivasi selama ini selalu menemui kegagalan (Illouze et al., 2006). Jenis vaksin lainnya adalah vaksin DNA. Vaksin DNA bersifat sederhana, aman, dapat mengaktifkan sistem kekebalan sesaat ataupun yang bersifat seluler, dapat mengkombinasikan beberapa gen penyandi untuk menanggulangi beberapa patogen, dapat diberikan pada stadia awal (Lorenzen dan LaPatra, 2005).
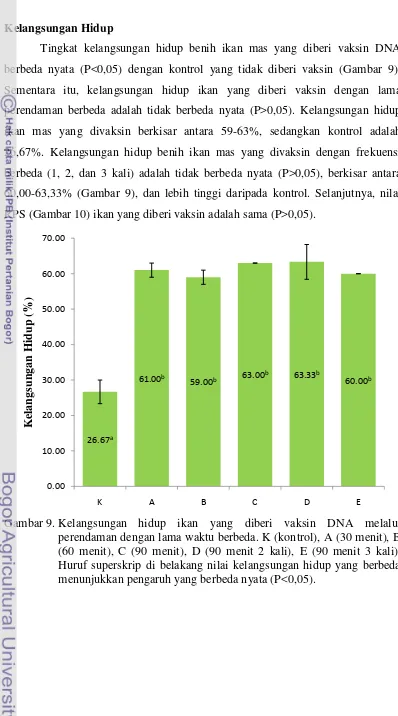
Dalam penelitian ini, kami mengembangkan suatu aplikasi dari vaksin DNA mengandung gen penyandi glikoprotein KHV melalui metode perendaman untuk meningkatkan kelangsungan hidup ikan mas terhadap infeksi KHV. Sebanyak 400 ekor benih ikan mas berusia 30 hari direndam dalam air yang mengandung 1,3 x 108 CFU/ml sel bakteri Eschericia coli mati membawa vaksin DNA. Perlakuan yang diberikan merupakan variasi dari durasi dan frekuensi perendaman vaksin DNA; yaitu: perlakuan perendaman selama 1x 30 menit, 1x 60 menit, 1x 90 menit, 2x 90 menit, dan 3x 90 menit. Analisis reverse transcription polimerase chain reaction (RT-PCR) menunjukkan bahwa vaksin DNA berhasil terekspresi pada ikan yang divaksin. Setelah 28 hari vaksinasi, ikan diuji tantang dengan menginjeksikan KHV 10-4 ml/ikan. Hasilnya menunjukkan bahwa Vaksinasi benih ikan mas usia 30 hari melalui perendaman bakteri E. coli mengandung vaksin DNA GP-25 yang telah diinaktivasi terbukti dapat memberikan kekebalan terhadap infeksi virus KHV. Hal ini dibuktikan dengan nilai kelangsungan hidup berkisar 59-63%; 2,2-2,4 kali lebih tinggi dibandingkan dengan ikan kontrol tanpa divaksin (26,67%). Kelangsungan hidup ikan divaksin melalui perendaman 30 menit tidak berbeda (P>0,05) dengan 60 dan 90 menit. Dengan demikian vaksinasi DNA melalui perendaman untuk meningkatkan daya tahan ikan mas terhadap infeksi KHV cukup dilakukan selama 30 menit. Nilai kelangsungan hidup ikan yang divaksin 2 dan 3 kali adalah sama dengan yang divaksin sekali.
iii imunogenik ini akan direspons oleh ikan mas untuk menghasilkan antibodi untuk meningkatkan daya tahannya terhadap infeksi KHV. Dengan demikian, vaksinasi DNA besar kemungkinannya tidak memerlukan booster seperti halnya vaksinasi konvensional. Hal ini menjadi kelebihan praktis dari vaksin DNA.
iv
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas karunia-Nya penelitian ini dapat diselesaikan. Penelitian ini mengangkat tema genetika penyakit, dengan judul: Efikasi vaksin DNA penyandi glikoprotein KHV (koi herpesvirus) pada ikan mas stadia benih melalui perendaman. Penelitian ini dilaksanakan selama 12 bulan (Februari 2011-Januari 2012) di Laboratorium Karantina Ikan dan Laboratorium Kesehatan Ikan Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi Jawa Barat.
Terima kasih penulis ucapkan kepada Bapak Dr. Alimuddin S.Pi. M.Sc. dan Ibu Dr. Munti Yuhana S.Pi. M.Si. selaku pembimbing; Bapak Prof. Dr. Ir. Enang Harris M.S. selaku Ketua Program Studi Ilmu Akuakultur, yang telah banyak memberi saran.
Terima kasih penulis ucapkan kepada Bapak Ir. Moh. Abduh Nurhidajat M.Si. selaku Direktur Produksi Kementrian Kelautan dan Perikanan (sebelumnya Kepala Balai Besar Pengembangan Budidaya Ikan Tawar Sukabumi) dan Bapak Ir. Maskur M.Si. selaku Direktur Kesehatan Ikan dan Lingkungan Kementerian Kelautan dan Perikanan (sebelumnya Kepala Balai Besar Pengembangan Budidaya Air Tawar Sukabumi) yang telah memberikan ijin penggunaan fasilitas untuk penelitian.
Terima kasih juga penulis ucapkan kepada Bapak Ayi Santika S.Pi. M.Si., Bapak Ade Sunarma S.Pi. M.Si., Bapak Adi Sucipto S.Pi. M.Si., Ibu Zakki Zainun A.Md. PP., Ibu Mira Mawardi S.Pi., Bapak Dasep Hasbulloh M.Si. dan Ibu Dr. Sri Nuryati S.Pi. M.Si. yang banyak memberi saran dan membantu dalam kelancaran penelitian; Anna Octavera S.Pi. atas bantuannya dalam persiapan primer untuk PCR.
v Cahyadi S.Pi., dan beberapa sahabat lain yang terus memotivasi hingga selesainya karya tulis ini.
Terima kasih teristimewa saya persembahkan untuk ibunda tercinta Dr. dr. Hj. Asih Tri Rachmi Nuswantari M.M., juga istri tercinta Nurry Setyowati S.Pi., kedua mertuaku Bapak H. Soeradji dan Ibu Hj. Soeratmi, kakekku Drs. H. Widomoko ST. MSi., kedua nenekku Soewarti dan Noerwati, dan juga ananda Mudzafar Khalifah Setyonuswantoro yang dengan sabar menanti bagian akhir dari karya tulis ini.
vi
Vaksin DNA Penyandi Glikoprotein ... 6
PCR/RT-PCR ... 8
Pengadaan Isolat KHV (Koi Herpesvirus) ... 14
Uji Tantang ... 14
Parameter Uji ... 15
Analisis Data ... 15
HASIL DAN PEMBAHASAN Kelangsungan Hidup ... 17
Verifikasi DNA dan Ekspresi mRNA ... 18
vii 3. Bercak pendarahan pada kulit ataupun pangkal sirip (Grimmett
et al., 2006) ... 5 4. (A, B, C) histologi dari penapis insang ikan terinfeksi; (D, E, F)
histologi dari gill arch ikan terinfeksi (Illouze et al., 2006) ... 5 5. Konstruksi vaksin DNA. (a) Bagian dari DNA glikoprotein yang
digunakan dalam vaksin DNA. (b) Hasil konstruksi vaksin DNA yang mampu berekspresi di dalam tubuh inang (Lorenzen dan
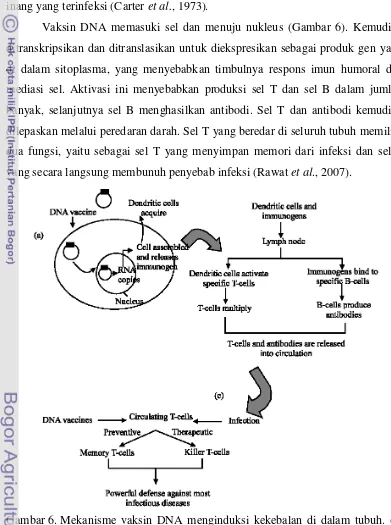
LaPatra, 2005) ... 6 6. Mekanisme vaksin DNA menginduksi kekebalan tubuh. (a)
Penyerapan selular vaksin DNA. (b) Penginduksian respons humoral. (c) Penginduksian respons kuat selular (Rawat et al., hidup yang berbeda menunjukkan pengaruh yang berbeda nyata
(P<0,05) ... 17 10. Kelangsungan hidup relatif ikan yang divaksin dengan lama dan
frekuensi berbeda terhadap kontrol, A (30 menit 1 kali), B (60 menit 1 kali), C (90 menit 1 kali), D (90 menit 2 kali), E (90 menit 3 kali). Huruf superskrip di belakang nilai kelangsungan hidup yang sama menunjukkan tidak ada pengaruh yang berbeda
nyata (P>0,05) ... 18 11. Deteksi DNA GP25 menggunakan metode PCR dengan cetakan
DNA dari insang ikan mas dan primer spesifik GP25 (A), verifikasi status ikan mas terhadap infeksi virus KHV menggunakan primer spesifik KHV (B), produk PCR
viii DNA, vaksinasi 1x 30 menit (1), vaksinasi 1x 60 menit (2),
vaksinasi 1x 90 menit (3), vaksinasi 2x 90 menit (4), vaksinasi 3x 90 menit (5), ikan kontrol tanpa perlakuan vaksinasi (K), kontrol positif PCR (K+), kontrol negatif PCR tanpa cetakan DNA (K-). Angka di sebelah kiri gambar adalah ukuran fragmen DNA marker. Tanda kepala panah di sebelah kanan gambar
adalah target produk amplifikasi PCR ... 19 12. Gambaran histopatologi insang ikan kontrol terinfeksi KHV hari
ke-14 (kiri). Terdapat beberapa gejala insang ikan terserang KHV, antara lain: hiperplasia (a); fusi lamella (b); badan inklusi (c). Gambaran histologi insang ikan sehat tanpa infeksi KHV
(kanan); bar = 8,γγμm ... 20 13. Gambaran histopatologi insang ikan perlakuan terinfeksi KHV
ringan hari ke-14 (kiri). Terdapat beberapa gejala insang ikan terserang KHV ringan, yaitu hiperplasia ringan (a). Gambaran histologi insang ikan sehat tanpa infeksi KHV (kanan); bar =
ix
DAFTAR LAMPIRAN
halaman
1. Konstruksi plasmid pAct-GP25 (Nuryati, 2010) ... 35
2. Denah posisi akuarium uji tantang ... 36
3. Prosedur pembuatan preparat histologi ... 37
4. Data kematian harian ikan mas ... 39
5. Data suhu air harian ... 40
6. Hasil uji statistik lama perendaman ... 41
1
PENDAHULUAN
Latar Belakang
Ikan mas (Cyprinus carpio) adalah ikan yang banyak dibudidayakan untuk konsumsi terutama di negara-negara Asia dan Eropa (Bercovier et al., 2005). Semenjak 1998, kematian masal ikan mas meluas hampir di seluruh dunia (Bercovier et al., 2005), seperti di Amerika, Israel (Hedrick et al., 2000), Jerman (Bretzinger et al., 1999), Inggris, Italia, Belanda, Korea (Choi et al., 2004), Indonesia (Rukyani, 2002), Jepang (Sano et al., 2004; Haramoto et al., 2007) dan Thailand (Pikulkaew et al., 2009). Wabah ini dikarenakan infeksi dari koi herpesvirus (KHV). Budidaya ikan intensif, perdagangan ikan domestik, dan internasional tanpa pengawasan ketat menyebabkan penyebaran virus ini secara global, dan cepat. Penyakit KHV sangat menular, dapat menyebabkan serangan massal, dan kematian mencapai 85-100% (Sunarto dan Cameron, 2006).
Beberapa metode pernah dicoba untuk menanggulangi serangan dari KHV ini, antara lain: dengan menjaga suhu agar tetap hangat di atas 86°F (30°C) (Ronen et al., 2003), karena pada umumnya serangan KHV terjadi pada saat suhu perairan berkisar antara 72°-81°F (22°-27°C) (Gilad et al., 2003). Cara ini dinilai kurang efektif dan efisien, karena sulit menjaga suhu perairan untuk tetap hangat bila budidaya di perairan terbuka, dan juga hanya bersifat sementara, sehingga KHV kembali menyerang bila suhu menjadi hangat (Hartman et al., 2008).
Salah satu teknik yang dapat digunakan yakni vaksinasi. Vaksinasi adalah metode yang paling menjanjikan untuk mengendalikan penyakit ikan dengan memacu respons kebal spesifik dari ikan (Press dan Lillehaug, 1995; Ardo et al., 2008). Dengan vaksinasi, ikan dirangsang untuk memproduksi antibodi yang berfungsi sebagai pertahanan terhadap benda asing yang masuk ke dalam tubuh ikan. Hanya saja penggunaan vaksin dari virus yang diinaktivasi selama ini selalu menemui kegagalan (Illouze et al., 2006).
2 penelitian ini digunakan vaksin DNA penyandi glikoprotein dari KHV (GP-25) melalui perendaman. Perendaman sering kali digunakan dalam kegiatan vaksinasi (Corbeil et al., 2000a; Arijo et al., 2005; Osman et al., 2009; Costa et al., 2011), teknik perendaman dipilih karena memungkinkan untuk ikan berukuran kecil; jumlah banyak; dan tidak menyebabkan stres pada ikan (Ellis, 1989). Seperti yang dilakukan oleh Corbeil et al. (2000a) dalam menguji vaksin DNA infectious hematopoieticnecrosis virus ( IHNV) salah satunya melalui teknik perendaman. Karena yang digunakan hanya gen penyandinya saja, vaksin ini tidak membahayakan organisme yang divaksinasi (Toranzo et al., 2009; Nuryati, 2010).
Rumusan Masalah
Serangan penyakit KHV dapat menyebabkan kematian masal. Salah satu cara untuk mencegah serangan penyakit adalah dengan meningkatkan ketahanan organisme. Ketahanan tersebut dapat ditingkatkan dengan cara memasukkan DNA imunogenik dari virus ke dalam tubuh organisme tersebut, sehingga tubuh organisme dapat mengenali DNA asing tersebut sebagai bagian dari virus dan merangsang tubuh untuk meningkatkan ketahanan tubuh organisme untuk melawan serangan KHV. Terdapat beberapa teknik yang biasa digunakan dalam vaksinasi, yaitu: penyuntikan ke dalam otot daging, melalui oral dan perendaman. Perendaman dipilih karena sangat cocok untuk benih dalam jumlah banyak dan tidak terlalu menimbulkan stres pada ikan.
Tujuan dan Manfaat Penelitian
Penelitian ini bertujuan untuk menguji efektivitas lama perendaman dan frekuensi pemberian vaksin DNA GP-25 melalui perendaman benih ikan mas terhadap infeksi KHV. Manfaat penelitian ini dalam kegiatan budidaya ikan mas dapat meningkatkan kelangsungan hidup terhadap infeksi KHV.
Hipotesis
3
TINJAUAN PUSTAKA
KHV (Koi Herpesvirus)
KHV adalah penyakit virus berbahaya yang dapat menyebabkan ikan sakit dan mati secara mendadak pada ikan mas (Grimmett et al., 2006; Siwicki et al., 2006). Penyakit KHV ini hanya ditemukan pada ikan koi dan ikan mas (Crane et al., 2004; Pikarsky et al., 2004; Illouze et al., 2006). Penyakit KHV ini dapat menyebabkan kematian 85-100% dari total populasi (Gunimaladevi et al., 2004;
Pikarsky et al., 2004), penyakit ini biasanya timbul ketika suhu air berkisar antara 72°-81°F (22°-27 °C) (Gilad et al., 2003). Dengan masa inkubasi 7-21 hari (Gunimaladevi et al., 2004; Pikarsky et al., 2004; Dishon et al., 2005). Penyakit virus ini menjangkiti ikan di berbagai usia, tapi studi kohabitasi menunjukkan bahwa benih lebih memiliki kerentanan dibandingkan ikan dewasa (Perelberg et al., 2003).
Kasus pertama yang mencuat adalah di Inggris pada tahun 1996 (Hartman et al., 2008). Semenjak itu kasus lain dipastikan hampir di seluruh negara yang membudidayakan ikan koi ataupun ikan mas dengan pengecualian Australia (Pokorova et al., 2005), dan Republik Ceko (Pokorova et al., 2007)
KHV (yang juga dikenal sebagai cyprinid herpes virus-3 atau CyHV-3) digolongkan sebagai virus DNA dalam keluarga virus Herpesviridae (Ronen et al., 2003). KHV adalah virus herpes, berdasarkan morfologi dan genetik, dan sangat erat kekerabatannya terhadap carp pox virus (cyprinid herpesvirus-1 atau CyHV-1) and hematopoietic necrosis herpesvirus of goldfish (cyprinid herpesvirus-2 atau CyHV-2) (Waltzek et al., 2005).
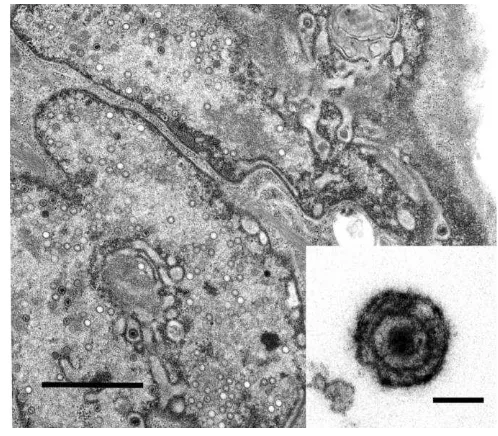
4 Gambar 1. Virion dari koi herpesvirus (KHV) yang tumbuh di sel KF-1 terinfeksi. Bar = 500 nm. Gambar insersi adalah virion KHV komplit dengan jaringan virus. Bar = 100 nm (Hedrick et al., 2005).
Infeksi KHV mungkin menyebabkan terjadinya luka pada insang, terlihat bercak-bercak merah dan putih. Bercak putih (Gambar 2) menunjukkan adanya nekrosis pada jaringan insang (Choi et al., 2004). Kerusakan insang yang disebabkan penyakit KHV adalah gejala klinis yang paling sering terjadi. Gejala luar lain dari KHV dapat juga seperti pendarahan pada insang, mata cekung, bercak pucat pada kulit (Perelberg et al., 2003; Sunarto dan Cameron, 2006; Hartman et al., 2008) seperti pada Gambar 3, dan juga produksi lendir yang berlebihan (Grimmett et al., 2006).
5 Gambar 3. Bercak pendarahan pada kulit ataupun pangkal sirip (ditunjukan oleh
anak panah) (Grimmett et al., 2006).
Perubahan patologi terlihat pada insang paling cepat 2 hari setelah infeksi, terbukti dengan hilangnya lamela yang diikuti dengan bercampurnya infiltrasi sel inflamatori (Gambar 4). Dari hari keenam hingga hari selanjutnya, perubahan pada insang menjadi semakin jelas, dengan makin terhapusnya gambaran insang yang diikuti beberapa inflamasi di dekat semua filamen. Kongesti pada saluran pembuluh vena pusat pada insang juga terjadi pada tahapan ini. Perubahan yang sama juga terjadi pada hari kedelapan dan seterusnya (Illouze et al., 2006).
Gambar 4. (A, B, C) histologi dari penapis insang ikan terinfeksi; (D, E, F) histologi dari gill arch ikan terinfeksi (Illouze et al., 2006).
Hari ke-0
Hari ke-0
Hari ke-2
Hari ke-2
Hari ke-6
6 Metode penyebaran dari KHV salah satunya adalah kontak langsung dengan ikan terinfeksi, cairan dari ikan terinfeksi dan air, lumpur atau pembawa lain yang telah terkontaminasi oleh KHV. Virus yang menginfeksi masuk ke ikan melalui insang dan mungkin juga melalui usus (Dishon et al., 2005). Penelitian terbaru menyebutkan kulit yang melapisi sirip dan tubuh juga menjadi pintu masuk utama bagi KHV (Costes et al., 2009). Selanjutnya menyebar dari kulit dan insang menuju organ dalam (Pikarsky et al., 2004; Dishon et al., 2005). Hingga saat ini belum ada laporan kejadian zoonosis untuk KHV terhadap manusia. Akibat serangan virus herpes pada ikan tidak akan menyebabkan penyakit pada manusia (Hartman et al., 2008).
Vaksin DNA Penyandi Glikoprotein
Vaksin DNA adalah vaksin yang dihasilkan dari proses pengkonstruksian sebuah vektor yang disisipi gen penyandi protein tertentu untuk menjadi suatu protein antigen protektif dari patogen yang diinginkan (Gambar 5). Plasmid mengandung elemen yang mampu teramplifikasi ke dalam jumlah besar dalam sel bakteri, dan gen patogen tersebut diapit oleh elemen promoter, dan elemen terminasi yang memfasilitasi ekspresinya dalam sel eukariot (Kurath, 2008).
7 Sitolisis kekebalan yang dimediasi oleh antibodi dan komplemennya dapat langsung menyerang komponen dari sebagian besar glikoprotein herpes simplex virus (HSV), di antaranya gA, gB, dan gC, dan menyerang glikoprotein gD yang terdapat pada permukaan sel terinfeksi (Machtiger et al., 1980). Glikoprotein virus telah terbukti sebagai antigen yang menstimulasi respons kekebalan sesaat dalam inang yang terinfeksi (Carter et al., 1973).
Vaksin DNA memasuki sel dan menuju nukleus (Gambar 6). Kemudian ditranskripsikan dan ditranslasikan untuk diekspresikan sebagai produk gen yang di dalam sitoplasma, yang menyebabkan timbulnya respons imun humoral dan mediasi sel. Aktivasi ini menyebabkan produksi sel T dan sel B dalam jumlah banyak, selanjutnya sel B menghasilkan antibodi. Sel T dan antibodi kemudian dilepaskan melalui peredaran darah. Sel T yang beredar di seluruh tubuh memiliki dua fungsi, yaitu sebagai sel T yang menyimpan memori dari infeksi dan sel T yang secara langsung membunuh penyebab infeksi (Rawat et al., 2007).
8 Vaksin DNA antivirus untuk ikan kini terus dalam pengembangan lebih lanjut karena beberapa alasan; vaksin DNA dapat menginduksi sel B dan respons kuat sel T; DNA lebih stabil terhadap perubahan suhu dibanding dengan protein; vaksin DNA dapat diproduksi dengan murah dan menghindari resiko yang tidak diinginkan seperti pada vaksin tradisional (Kanellos et al., 2006).
Vaksin DNA penyandi glikoprotein telah beberapa kali terbukti dapat berhasil dan aman digunakan untuk menanggulangi beberapa penyakit, seperti penggunaan DNA penyandi glikoprotein dari virus Infectious Hematopoietic Necrosis (IHNV) untuk ikan Oncorhynchus mykiss (Corbeil et al., 2000a; Kim et al., 2000; LaPatra et al., 2001); penggunaan DNA penyandi glikoprotein dari virus Lymphocystis Disease (LCDV) untuk ikan Paralichthys olivaceus (Zheng et al., 2006); penggunaan DNA penyandi glikoprotein dari virus Hirame Rhabdovirus (HIRRV) untuk ikan Paralichthys olivaceus (Takano et al., 2004; Seo et al., 2006); penggunaan DNA penyandi glikoprotein dari virus Spring Viremia of Carp (SVCV) untuk ikan Cyprinus carpio (Kanellos et al., 2006) dan Cyprinus carpio koi (Emmenegger dan Kurath, 2008); bahkan Boudinot et al.
(1998) menggabungkan dua DNA penyandi glikoprotein virus Infectious Hematopoietic Necrosis (IHNV) dan virus Viral Hemorrhagic Septicemia (VHSV) untuk ikan Oncorhynchus mykiss; penggunaan DNA penyandi glikoprotein dari koi herpesvirus (KHV) untuk ikan Cyprinus carpio (Nuryati, 2010); penggunaan DNA penyandi glikoprotein dari bakteri Cryptobia salmositica untuk ikan Oncorhynchus mykiss (Woo, 2010).
PCR/RT-PCR
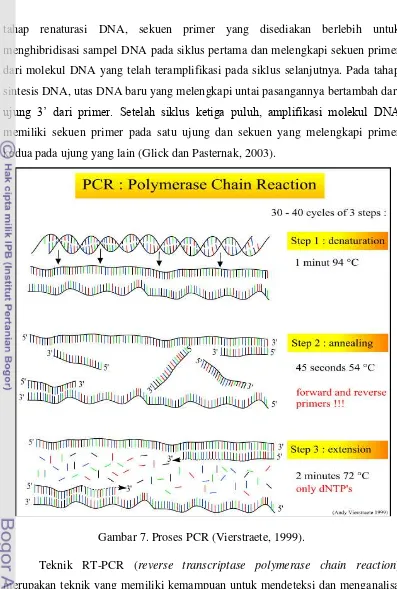
9 tahap renaturasi DNA, sekuen primer yang disediakan berlebih untuk menghibridisasi sampel DNA pada siklus pertama dan melengkapi sekuen primer dari molekul DNA yang telah teramplifikasi pada siklus selanjutnya. Pada tahap sintesis DNA, utas DNA baru yang melengkapi untai pasangannya bertambah dari
ujung γ’ dari primer. Setelah siklus ketiga puluh, amplifikasi molekul DNA
memiliki sekuen primer pada satu ujung dan sekuen yang melengkapi primer kedua pada ujung yang lain (Glick dan Pasternak, 2003).
Gambar 7. Proses PCR (Vierstraete, 1999).
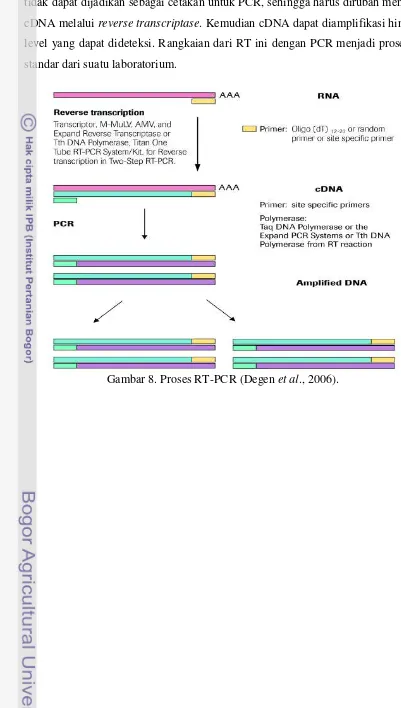
10 tidak dapat dijadikan sebagai cetakan untuk PCR, sehingga harus dirubah menjadi cDNA melalui reverse transcriptase. Kemudian cDNA dapat diamplifikasi hingga level yang dapat dideteksi. Rangkaian dari RT ini dengan PCR menjadi prosedur standar dari suatu laboratorium.
11
BAHAN DAN METODE
Perbanyakan Vaksin DNA
Escherichia coli yang telah disisipi plasmid gen pAct-GP25 (Nuryati, 2010; Lampiran 1) diperbanyak di Laboratorium Kesehatan Ikan Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi. Isolat murni E. coli dipindahkan ke dalam media 2xYT padat dan diinkubasi pada suhu 37oC selama sekitar 20 jam. E. coli yang tumbuh dipindahkan ke dalam 1000 ml media 2xYT cair dan diinkubasi pada inkubator shaker (Heidolph unimax 1010 dan inkubator 1000, Germany) dengan suhu 37oC selama 16-20 jam dengan kecepatan 240 rpm. Sel E. coli dipanen dengan cara dibagi ke dalam beberapa tabung 50 ml, disentrifugasi 5000 rpm selama 10 menit. Supernatan dibuang, sedangkan pelet bakteri disimpan pada suhu -20oC.
E. coli sebelum digunakan dalam vaksinasi terlebih dahulu diinaktivasi. Inaktivasi dilakukan dengan memasukkan tabung berisi bakteri ke dalam air bersuhu 85oC selama 15 menit, kemudian didinginkan kembali pada suhu ruang. Kepadatan E. coli diukur menggunakan spektrofotometer dengan absorbansi 1-1,5 pada 600 nm (A600) untuk mendapatkan E. coli dengan kepadatan 109 sel/ml
(Anonymous, 2007). E. coli kemudian digunakan sebagai vaksin melalui perendaman dengan kepadatan 108 sel/ml.
Pengadaan Ikan Uji
Ikan yang digunakan dalam penelitian ini berasal dari Sub Unit Kolam Air Deras (SUKAD) Cisaat, BBPBAT Sukabumi yang berumur 5 hari, dipindahkan ke Laboratorium Karantina Ikan BBPBAT Sukabumi. Ikan dipelihara selama 25 hari. Benih ikan berumur 30 hari sebanyak 400 ekor untuk masing-masing perlakuan direndam ke dalam wadah berisi air 1 liter dengan kepadatan bakteri 1,3 x 108 sel/ml dengan perlakuan vaksinasi selama 1x 30 menit, 1x 60 menit, 1x 90 menit, 2x 90 menit dan 3x 90 menit dengan aerasi kuat. Hal ini untuk membandingkan lama perendaman vaksinasi dan frekuensi perendaman vaksin.
12 ekstraksi diambil sebanyak 25-50 mg, ditambahkan DNAzol sebanyak 1 ml, dihomogenisasi menggunakan pestle, kemudian diinkubasi pada suhu ruang selama 5-10 menit. Tabung disentrifugasi menggunakan Micromax RF (Thermo IEC, USA) pada 10.000 rpm selama 10 menit suhu ruang. Supernatan dipindahkan ke dalam tabung baru, ditambahkan 0,5 ml etanol absolut, dihomogenisasi dengan dibolak-balik. Tabung disimpan secara vertikal selama 1 menit, agar DNA mengendap di dasar tabung, tabung disentrifugasi lagi pada 10.000 rpm selama 1-2 menit suhu ruang. Pelet DNA dicuci sebanyak 2 kali dengan menambahkan 1 ml ethanol 75%, dibolak-balik, disimpan secara vertikal selama 1 menit, disentrifugasi pada 10.000 rpm selama 1-2 menit suhu ruang. Etanol dibuang, kemudian tabung dikering-udarakan selama 1 menit.
Amplifikasi DNA hasil ekstraksi DNA dilakukan dengan menggunakan PCR. Primer yang digunakan merupakan primer yang konstruksinya didesain oleh Octavera (komunikasi pribadi) dengan forward F-GP25 5’ -TTGTCGACATG-ACGGGTTGTGGGGTTTG-γ’ dan reverse R-GP25 5’ -CCTCAGCAAGGCG-GCCTTCAC-γ’. Reaksi PCR yang digunakan, yaitu dengan tabung Pure Taq Ready-To-Go-PCR Beads (GE Healthcare, UK) berisi PCR Beads ditambahkan 1 µl primer forward; 1 µl primer reverse; 1 µl DNA genomik dan sisanya adalah air steril hasil destilasi (SDW) hingga volume akhir menjadi 25 µl. Amplifikasi PCR dilakukan dengan program: pre-denaturasi pada suhu 94oC selama 7 menit; 45 siklus pada suhu 94oC selama 30 detik, 64oC selama 30 detik dan 72oC selama 30 detik; serta suhu 72oC selama 7 menit. Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarosa 0,7%. Sebagai kontrol internal digunakan primer KHV (Yuasa et al., β005) dan -aktin ikan mas (Liu et al., 1990). Pengambilan sampel untuk verifikasi DNA dilakukan kembali setelah 14 hari dan 28 hari pasca vaksinasi.
Ekspresi mRNA
Analisis ekspresi mRNA dilakukan 24 jam setelah vaksinasi. Isolasi RNA menggunakan reagen RNeasy Mini Kit (Qiagen, USA). Sampel untuk ekstraksi diambil sekitar 30 mg, ditambahkan 600 μl bufer RLT yang sebelumnya telah
13 dilakukan di atas es. Tabung disentrifugasi selama 3 menit dengan kecepatan penuh. Dengan hati-hati supernatan dipindahkan dengan pipeting ke dalam tabung mikrosetrifugasi baru. Etanol ditambahkan 600 μl 70% untuk membersihkan larutan, dan dihomogenkan secepatnya menggunakan pipeting. Larutan dipindahkan sebanyak 700 μl ke dalam RNeasy spin column, tabung koleksi 2 ml dipasang untuk menampung larutan yang terbuang. Tabung ditutup rapat dan disentrifugasi selama 15 detik pada 10.000 rpm. Larutan yang menembus filter spin column dibuang. Buffer RW1 ditambahkan sebanyak 700 μl. Tabung ditutup rapat dan disentrifugasi selama 15 detik pada 10.000 rpm. Larutan yang menembus filter spin column dibuang kembali. Bufer RPE ditambahkan sebanyak
500 μl. Tabung ditutup rapat dan disentrifugasi selama 15 detik pada 10.000 rpm. Larutan yang menembus filter spin column dibuang kembali. Buffer RPE ditambahkan sebanyak 500 μl. Tabung ditutup rapat dan disentrifugasi selama 2 menit pada 10.000 rpm. Larutan yang menembus filter spin column dibuang kembali. RNeasy spin column dipindahkan ke dalam tabung koleksi baru, ditambahkan 50 μl air bebas RNase. Tabung ditutup rapat, dan disentrifugasi selama 1 menit pada 10.000 rpm untuk melarutkan RNA.
14 menggunakan gel agarosa 1%. Pengambilan sampel untuk uji ekspresi mRNA dilakukan kembali setelah 14 hari dan 28 hari setelah vaksinasi.
Pemeliharaan Ikan Uji
Ikan mas yang telah divaksin dipelihara di dalam akuarium (60x50x40 cm) dengan suhu air 29 ± 1oC, dilengkapi dengan aerasi dan air diganti sebanyak ¾ bagian dilakukan tiga kali seminggu. Pemberian pakan pada ikan dilakukan tiga kali sehari hingga ikan kenyang dengan menggunakan cacing sutra hingga berumur 30 hari, kemudian dilanjutkan menggunakan pakan komersial hingga ikan berumur 60 hari.
Pengadaan Isolat KHV (Koi Herpesvirus)
Filtrat virus diperoleh dari isolasi pada beberapa ikan mas yang berasal dari Waduk Cirata, Kabupaten Cianjur, yang terserang KHV. Sampel isolat diambil dari insang ikan yang positif terserang KHV. Sebelum insang digunakan, terlebih dahulu ikan diverifikasi positif terserang KHV. Metode verifikasi seperti yang sudah ditulis sebelumnya dengan perbedaan pada penggunaan primer (Yuasa et al., 2005) dan program PCR yang disesuaikan dengan panjang dan komposisi primernya.
Insang sebanyak 1 g digerus menggunakan mortar, diencerkan dengan PBS hingga 10 ml, disentrifugasi pada 5000 rpm selama 15 menit suhu 5oC. Hasil gerusan disaring dengan milipore filter 0,4 µm. Hasil dari penyaringan ini yang dijadikan stok (10-1), untuk penggunaan infeksi ke ikan filtrat diencerkan hingga 10-3.
Uji Tantang
Dalam uji tantang digunakan ikan sebanyak 30 ekor untuk masing-masing perlakuan dengan tiga ulangan, yaitu perlakuan ikan dengan lama perendaman selama 1x 30 menit, 1x 60 menit, 1x 90 menit, 2 x90 menit, 3x 90 menit, ikan kontrol perlakuan tanpa diberikan vaksin. Ikan diuji tantang dengan menginjeksikan filtrat KHV sebanyak 0,1 ml dari stok filtrat 10-3.
15 dilakukan setiap 2 hari sekali. Ikan uji diberi pakan komersial sebanyak 2 kali sehari yaitu pada pagi dan sore hari. Ikan mati setiap hari disisihkan dan dicatat untuk membandingkan kelangsungan hidupnya. Denah posisi akuarium uji tantang tersaji pada Lampiran 2.
Pada akhir periode pemeliharaan uji tantang, sampel ikan diambil untuk memastikan terserang KHV. Metode ekstraksi DNA seperti dijelaskan sebelumnya. Sebagai data pendukung, dilakukan juga pembuatan preparat histologi dari ikan yang diuji tantang dengan prosedur pembuatan preparat histologi modifikasi dari Mumford (2004). Sebagai sampel histologi organ insang diambil dari ikan yang mati selama uji tantang dan dibandingkan dengan kontrol.
Parameter Uji
Parameter yang diuji pada penelitian ini adalah kelangsungan hidup dan tingkat kelangsungan hidup relatif. Tingkat kelangsungan hidup dihitung berdasarkan persamaan (Zonneveld et al., 1991):
%
Tingkat kelangsungan hidup relatif dihitung berdasarkan persamaan (Ellis, 1988): � = 1−��
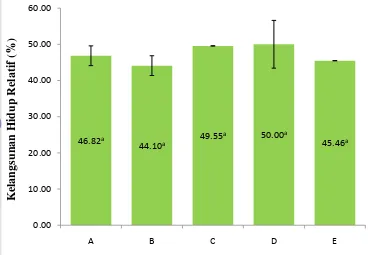
17 perendaman berbeda adalah tidak berbeda nyata (P>0,05). Kelangsungan hidup ikan mas yang divaksin berkisar antara 59-63%, sedangkan kontrol adalah 26,67%. Kelangsungan hidup benih ikan mas yang divaksin dengan frekuensi berbeda (1, 2, dan 3 kali) adalah tidak berbeda nyata (P>0,05), berkisar antara 60,00-63,33% (Gambar 9), dan lebih tinggi daripada kontrol. Selanjutnya, nilai RPS (Gambar 10) ikan yang diberi vaksin adalah sama (P>0,05).
Gambar 9. Kelangsungan hidup ikan yang diberi vaksin DNA melalui perendaman dengan lama waktu berbeda. K (kontrol), A (30 menit), B (60 menit), C (90 menit), D (90 menit 2 kali), E (90 menit 3 kali). Huruf superskrip di belakang nilai kelangsungan hidup yang berbeda menunjukkan pengaruh yang berbeda nyata (P<0,05).
18 Gambar 10. Kelangsungan hidup relatif ikan yang divaksin dengan lama dan frekuensi berbeda terhadap kontrol, A (30 menit 1 kali), B (60 menit 1 kali), C (90 menit 1 kali), D (90 menit 2 kali), E (90 menit 3 kali). Huruf superskrip di belakang nilai kelangsungan hidup yang sama menunjukkan tidak ada pengaruh yang berbeda nyata (P>0,05).
Verifikasi DNA dan Uji Ekspresi mRNA
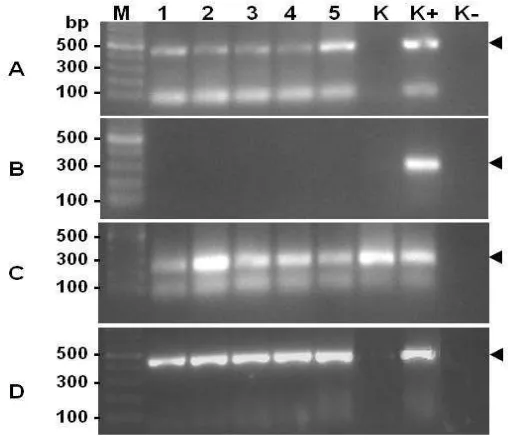
Verifikasi DNA GP25 dilakukan untuk memastikan bahwa vaksin DNA masuk dan diserap oleh organ target. Seperti ditunjukkan pada Gambar 11A, bukan karena ikan mas terinfeksi oleh KHV.
Uji ekspresi mRNA GP25 dilakukan untuk memastikan bahwa GP25 diekspresikan di dalam tubuh ikan mas. Ekspresi mRNA GP25 terdeteksi pada semua perlakuan vaksinasi hingga hari ke-28 (Gambar 11D).
19 Gambar 11. Deteksi DNA GP25 menggunakan metode PCR dengan cetakan DNA dari insang ikan mas dan primer spesifik GP25 (A), verifikasi status ikan mas terhadap infeksi virus KHV menggunakan primer spesifik
KHV (B), produk PCR menggunakan primer -aktin ikan mas (C), dan ekspresi mRNA GP25 pada ikan mas yang telah divaksin dengan lama waktu, dan frekuensi berbeda (D). DNA dan RNA total diekstraksi dari insang ikan mas pada hari ke-28 pasca vaksinasi. M: marker DNA, vaksinasi 1x 30 menit (1), vaksinasi 1x 60 menit (2), vaksinasi 1x 90 menit (3), vaksinasi 2x 90 menit (4), vaksinasi 3x 90 menit (5), ikan kontrol tanpa perlakuan vaksinasi (K), kontrol positif PCR (K+), kontrol negatif PCR tanpa cetakan DNA (K-). Angka di sebelah kiri gambar adalah ukuran fragmen DNA marker. Tanda kepala panah di sebelah kanan gambar adalah target produk amplifikasi PCR.
Histologi
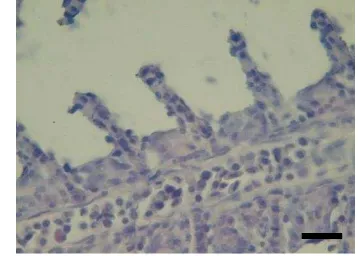
Histologi merupakan salah satu teknik untuk mengidentifikasi kerusakan terhadap jaringan organ atau tubuh yang diakibatkan oleh bakteri, parasit maupun serangan virus. Jenis kerusakan pun tergantung dari seberapa parah serangan dari penyakit tersebut. Gejala yang umum terjadi pada serangan virus terhadap insang, beberapa di antaranya adalah hiperplasia, fusi lamella, dan badan inklusi.
20 lamela, dan terdapat beberapa badan inklusi sebagai ciri khas kerusakan jaringan yang disebabkan oleh serangan virus (Gambar 12). Sedangkan pada ikan yang divaksin memiliki kerusakan yang relatif lebih ringan, hanya mengalami hiperplasia ringan (Gambar 13). Pada ikan sehat tidak terlihat adanya kerusakan-kerusakan yang disebabkan oleh serangan dari KHV.
Gambar 12. Gambaran histopatologi insang ikan kontrol terinfeksi KHV hari ke-14 (kiri). Terdapat beberapa gejala insang ikan terserang KHV, antara lain: hiperplasia (a); fusi lamella (b); badan inklusi (c). Gambaran histologi insang ikan sehat tanpa infeksi KHV (kanan); bar = 8,33 μm.
Gambar 13. Gambaran histopatologi insang ikan perlakuan terinfeksi KHV ringan hari ke-14 (kiri). Terdapat beberapa gejala insang ikan terserang KHV ringan, yaitu hiperplasia ringan (a). Gambaran histologi insang ikan sehat tanpa infeksi KHV (kanan); bar = 8,33
μm.
Pembahasan
Vaksinasi benih ikan mas usia 30 hari melalui perendaman bakteri E. coli mengandung vaksin DNA GP-25 yang telah diinaktivasi terbukti dapat memberikan kekebalan terhadap infeksi virus KHV. Hal ini dibuktikan dengan
a b
c
21 nilai kelangsungan hidup berkisar 59-63%; 2,2-2,4 kali lebih tinggi dibandingkan dengan ikan kontrol tanpa divaksin (26,67%). Kelangsungan hidup ikan divaksin melalui perendaman 30 menit tidak berbeda (P>0,05) dengan 60 dan 90 menit. Dengan demikian vaksinasi DNA melalui perendaman untuk meningkatkan daya tahan ikan mas terhadap infeksi KHV cukup dilakukan selama 30 menit. Nilai kelangsungan hidup ikan yang divaksin 2 dan 3 kali adalah sama dengan yang divaksin sekali. Hal ini menunjukkan bahwa vaksinasi DNA cukup dilakukan sekali saja dengan perendaman selama 30 menit. Lama perendaman selama 30 menit relatif sama dengan vaksinasi benih ikan salmon selama 40 menit perendaman (Corbeil et al., 2000a).
Jumlah bakteri yang mengandung vaksin pada penelitian ini adalah 1,3 x108 CFU/mL. Dosis ini lebih besar bila dibandingkan dengan dosis yang digunakan oleh Corbeil et al. (2000a) yang menggunakan dosis bakteri sebesar 3,4 x106 CFU/mL. Penurunan dosis vaksin DNA KHV memungkinkan untuk dilakukan, seperti yang digunakan oleh Corbeil et al. (2000b) yang menggunakan vaksin DNA ipIHNw-G dengan dosis rendah sebesar 1-10 ng/ikan mampu memberikan perlindungan pada benih ikan trout terhadap IHNV WRAC strain heterolog.
22 merespons serangan penyakit dan memproduksi antibodi. Semakin besar ukuran ikan, maka akan semakin besar kemampuan ikan tersebut dalam melawan serangan penyakit, walaupun ikan tersebut memiliki umur yang sama. Hal tersebut sejalan dengan pernyataan Ellis (1989) bahwa respons imun dari ikan dapat lebih dipengaruhi oleh ukuran ikan, bukan umur. Pada spesies salmonid tingkat kekebalan tinggi hanya diperoleh pada larva dengan berat minimal 1 gram. Selanjutnya, perbedaan metode vaksinasi diduga juga mempengaruhi efikasi vaksin. Nuryati (2010) menggunakan metode injeksi, sementara Khodijah (2012) menggunakan metode oral melalui pakan.
Hasil verifikasi vaksin DNA dan hasil uji ekspresi (Gambar 11) di dalam tubuh ikan, membuktikan bahwa pemberian vaksin DNA melalui perendaman ikan dalam air mengandung bakteri utuh inaktif dapat terekspresi hingga hari ke-28. Ini berarti bahwa protein GP-25 secara terus-menerus diproduksi hingga hari ke-28 (Kanellos et al., 1999). Protein imunogenik ini akan direspons oleh ikan mas untuk menghasilkan antibodi untuk meningkatkan daya tahannya terhadap infeksi KHV. Sejalan dengan hasil yang didapat oleh Boudinot et al. (1998) yang mengkombinasikan vaksin DNA gen glikoprotein viral hemorrhagic septicemia virus (VHSV) dan infectious hematopoietic necrosis virus (IHNV) terhadap ikan Onchorhynchus mykiss yang dapat mendeteksi ekspresi vaksin DNA hingga hari ke-45. Bahkan Garver et al. (2005) masih mendeteksi ekspresi vaksin DNA pIHNw-G yang diinjeksikan ke ikan Onchorhynchus mykiss pada hari ke-90.
23 dengan Edwardsiella ictaluri. Sedangkan Altun et al. (2010) melakukan booster vaksinasi melalui oral pada ikan Onchorhynchus mykiss 60 hari setelah vaksinasi pertama melalui injeksi peritonial. Dengan demikian, vaksinasi DNA besar kemungkinannya tidak memerlukan booster seperti halnya vaksinasi konvensional. Hal ini menjadi kelebihan praktis dari vaksin DNA.
Dari hasil histologi jaringan insang pada saat puncak masa inkubasi KHV, menunjukkan bahwa perlakuan pemberian vaksin DNA memberikan kekebalan terhadap tubuh ikan yang terserang KHV. Seperti yang terlihat pada Gambar 12 dan Gambar 13 di atas, terdapat perbedaan yang cukup nyata. Pada ikan kontrol tanpa vaksinasi terdapat banyak kerusakan struktur jaringan organ bila dibandingkan dengan ikan dengan perlakuan vaksinasi. Seperti adanya tanda hiperplasia yang lebih banyak pada ikan kontrol bila dibandingkan dengan ikan dengan perlakuan vaksinasi, lamela yang menyatu hingga dari pangkal hingga ke ujung lamela pada ikan kontrol sedangkan pada ikan perlakuan vaksinasi belum terlihat adanya lamela yang menyatu, dan juga adanya badan inklusi pada jaringan insang ikan kontrol. Menurut Sano et al. (2004) lamela sekunder menyatu dengan adanya hiperlasia pada branchial epithelium dan nekrosis sel terjadi cukup jelas. Kerusakan-kerusakan tersebut sudah mulai terjadi paling cepat 2 hari setelah penginfeksian, yang terlihat jelas dengan mulai hilangnya beberapa bagian lamela (Ilouze et al., 2006). Kerusakan akan semakin parah terjadi ketika memasuki hari keenam hingga hari kesebelas setelah penginfeksian, dimana biasanya kerusakan pada lamela terjadi menyeluruh (El-Din, 2011).
25
KESIMPULAN DAN SARAN
Kesimpulan
Vaksinasi benih ikan mas usia 30 hari melalui perendaman bakteri E. coli mengandung vaksin GP-25 efektif memberikan kekebalan terhadap infeksi virus KHV. Perendaman dapat dilakukan selama 30 menit dengan frekuensi sekali. Vaksinasi DNA melalui bakteri inaktif dapat diserap oleh tubuh ikan dan mRNA terekspresi hingga hari ke-28.
Saran
27
DAFTAR PUSTAKA
Altun S, Kubilay A, Ekici S, Didinen B, Diler O. 2010. Oral vaccination lactococcosis in rainbow trout (Oncorhynchus mykiss) using sodium alginate and poly (lactide-co-glycolide) carrier. Kafkas Univ. Vet. Fak. Derg. 16 (Suppl-B): S211-S217.
Amend DF. 1981. Potency testing of fish vaccines. Dev. Biol.Stand. 49: 447-454. Anonymous. 2007. PurelinkTM hipure plasmid filter purification kits; for midi and
maxi preparation of plasmid DNA. USA. Invitrogen: hlm 6.
Ardo L, Yin G, Xu P, Varadi L, Szigeti G, Jeney Z, Jeney G. 2008. Chinese herbs (Astragalus membranaceus and Lonicera japonica) and boron enhance the non-specific immune response of Nile tilapia (Oreochromis niloticus) and resistance against Aeromonas hydrophila. Aquaculture 275: 26-33.
Arijo S, Rico R, Chabrillon M, Diaz-Rosales P, Martinez-Manzanares E, Balebona MC, Magarinos B, Toranzo AE, Morinigo MA. 2005. Effectiveness of a divalent vaccine for sole Solea senegalensis (Kaup), against Vibrio harveyi and Photobacterium damselae subsp. Piscida. J. Fish Dis. 28: 33-38.
Bercovier H, Fishman Y, Nahary R, Sinai S, Zlotkin A, Eyngor M, Gilad O, Eldar A, Hedrick RP. 2005. Cloning of the koi herpesvirus (KHV) gene encoding thymidine kinase dan its use for a highly sensitive PCR based diagnosis. BMC Microbiol. 5: 13.
Boudinot P, Bernard D, Boubekeur S, Thoulouze M, Bremont M, Benmansour A. 1998. The glycoprotein of a fish rhabdovirus profiles the virus-specific T-cell repertoire in rainbow trout. J. Gen. Virol. 85: 3099-3108.
Bretzinger A, Fischer-Scheri T, Oumouna M, Hoffman R, Truyen U. 1999. Mass mortalities in koi carp, Cyprinus carpio, associated with gill and skin disease. Bull. Eur. Assoc. Fish Pathol. 19:182-185.
Carter MF, Biswal N, Rawls WE. 1973. Characterization of nucleic acid of Pichinde virus. J. Virol. 11(1): 61-68.
Choi DL, Sohn SG, Bang JD, Do JW, Park MS. 2004. Ultrastructural identification of a herpes-like virus infection in common carp Cyprinus carpio in Korea. Dis. Aquat. Org. 61: 165-168
28 Corbeil S, LaPatra S.E, Anderson E.D, Kurath G. 2000b. Nanogram quantities of a DNA vaccine protect rainbow trout fry against heterologous strains of infectious hematopoietic necrosis virus. Vaccine 18: 2817-2824.
Costa AA, Leef MJ, Bridle AR, Carson J, Novak BF. 2011. Effect of vaccination against yersiniosis on the relative percent survival, bactericidal and lysozyme response of Atlantic salmon, Salmo salar. Aquaculture 315: 201-206
Costes B, Raj VS, Michel B, Fournier G, Thirion M, Gillet L, Mast J, Lieffrig F, Bremont M, Vanderplasschen. 2009. The major portal of entry of koi herpesvirus in Cyprinus carpio is the skin. J. Virol. 83(7): 2819-2830. Crane M, Sano M, Komar C. 2004. Infection with koi herpes virus-disease carp.
Developed to support the NACA/FAO/OIE regional quarterly aquatic animal disease (QAAD) reporting system in the Asia-Pacific. NACA, Bangkok. 11 hal.
Degen H-J, Deufel A, Eisel D, Grunewald-Janho S, Keesey J. 2006. PCR Applications Manual. Edisi ke-3. Germany. www.roche-applied-science.com.
Dishon A. Perelberg A. Bishara-Shieban J. Ilouze M, Davidovich M, Werker S, Kotler M. 2005. Detection of carp interstitial nephritis and gill necrosis virus in fish droppings. Appl. Environ. Microbiol. 71: 7285-7291.
El-Din MMM. 2011. Histopathological studies in experimentally infected koi carp (Cyprinus carpio koi) with koi herpesvirus in Japan. World J. Fish Sci. 3(3): 252-259.
Ellis AE. 1988. Fish vaccination. England: Academic Press. hlm 17. Ellis AE. 1989. Fish vaccination. Aqua. Info. Series 4: 1-5
Emmenegger EJ, Kurath G. 2008. DNA vaccine protects ornamental koi (Cyprinus carpio koi) against North American spring viremia of carp virus. Vaccine 26: 6415-6421.
Garver KA, Conway CM, Elliot DG, Kurath G. 2005. Analysis of DNA-vaccinated fish reveals viral antigen in muscle, kidney and thymus, and transient histopathologic changes. Mar. Bio. 7: 540-553.
29 Glick BR, Pasternak JJ. 2003. Molecular biotechnology: principles and applications of recombinant DNA. Edisi ke-3. ASM Pr.. Washington. 110-111.
Grimmett SG, Warg JV, Getchell RG, Johnson DJ, Bowser PR. 2006. An unusual koi herpesvirus associated with a mortality event of common carp Cyprinus carpio in New York State, USA. J. Wildl. Dis. 42(3): 658-662.
Gunimaladevi I, Kono T, Venugopal MN, Sakai M. 2004. Detection of koi herpesvirus in common carp, Cyprinus carpio L, by loop-mediated isothermal amplification. J. Fish Dis. 27: 583-589.
Haramoto E, Kitajima M, Katayama H, Ohgaki S. 2007. Detection of koi herpesvirus DNA in river water in Japan. J. Fish Dis. 30: 59-61.
Hartman KH, Yanong RPE, Pouder DB, Petty BD, Francis-Floyd R, Riggs AC. 2008. Koi herpesvirus (KHV) disease. Fact Sheet VM-149 The Institute of Food and Agricultural Sciences (IFAS) University of Florida (UF).
Hedrick RP, Gilad O, Yun S, Spangenberg JV. 2000. A herpesvirus associated with mass mortality of juvenile and adult koi, a strain of common carp. J. Aquat. Animal Health 12: 44-57.
Hedrick RP, Gilad O, Yun SC, McDowell TS, Waltzek TB, Kelley GO, Adkison A. 2005. Initial isolation and characterization of a herpes-like virus (KHV from koi and common carp. Bull. Fish. Res. Agen. 2: 1-7
Hutoran M, Ronen A, Perelberg A, Ilouze M, Dishon A, bejerano I, Chen N, Kotler M. 2005. Description of an as yet unclasified DNA virus from diseased Cyprinus carpio species. J. Virol. 79(4): 1983-1991.
Illouze M, Dishon A, Kotler M. 2006. Characterization of a novel virus causing a lethal disease in carp and koi. Microbiol. Mol. Biol. Rev. 70 (1): 147-156. Ispir U, Dorucu M. 2010. Effect of immersion booster vaccination with Yersinia
ruckeri extracellular products (ECP) on rainbow trout Oncorhynchus mykiss. Int. Aquat. Res. 2: 127-130.
Jeney Z, Racz T, Thompson KD, Poobalane S, Ardo L, Adams A, Jeney G. 2009. Differences in the antibody response and survival of genetically diferent varieties of common carp (Cyprinus carpio L.) vaccinated with a commercial Aeromonas salmonicida/ Aeromonas hydrophila vaccine and challenged with Aeromonas hydrophila. Fish Physiol. Biochem. 35: 677-682.
30
Kanellos T, Sylvester ID, D’Mello F, Howard CR, Mackle A, Dixon PF, Chang
K, Ramstad A, Midtlyng PJ, Russel PH. 2006. DNA vaccination can protect Cyprinus carpio against spring viraemia of carp virus. Vaccine 24: 4927-4933.
Khodijah S. 2012. Efektifivitas frekuensi pemberian vaksin DNA melalui pakan terhadap kelangsungan hidup relatif ikan mas yang diinfeksi koi herpesvirus. Skripsi. Departemen Budidaya Perairan. Fakultas Perikanan dan Ilmu Kelautan Institut Pertanian Bogor, Bogor.
Kim CH, Johnson MC, Drennan JD, Simon BE, Thomann E, Leong CJ. 2000. DNA vaccines encoding viral glycoproteins induce nonspecific immunity and mx protein synthesis in fish. J. Virol. 74(15): 7048-7054.
Kresno SB. 2001. Imunologi: Diagnosis dan prosedur laboratorium. Edisi ke-4. Balai Penerbit Fakultas Kedokteran Universitas Indonesia. Jakarta. 81-83. Kurath G. 2008. Biotechnology and DNA vaccines for aquatic animals. Rev. Sci.
Tech. Off. Int. Epiz. 27(1): 175-196.
LaPatra SE, Serge C, Gerald RJ, William DS, Niels L, Eric DA, Gael K. 2001. Protection of rainbow trout against hematopoietic necrosis virus four days after specific or semi specific DNA vaccination. Vaccine 19: 4011-4019. Liu ZJ, Zhu ZY, Roberg K, Faras A, Guise K, Kapuscinski AR, Hackett PB.
1990. Isolation and characterization of beta-actin gene of carp (Cyprinus carpio). DNA Seq. 1(2): 125-36.
Lorenzen N dan LaPatra SE. 2005. DNA vaccines for aquacultured fish. Rev. Sci. Tech. Off. Int. Epiz. 24(1): 201-213.
Machtiger NA, Pancake BA, Eberle R, Courtney RJ, Tevethia SS, Schaffer PA. 1980. Herpes simplex virus glycoproteins: isolation of mutants resistant to immune cytolysis. J. Virol. 34(2): 336-346.
Mullis KB, Faloona FA, Scharf SJ, Saiki RK, Horn GT, Erlich HA. 1986. Specific enzimatic amplification of DNA in vitro: the polymerase chain reaction. Cold Spring Harb. Symp. Quant. Biol. 51: 263-273.
Mumford SL. 2004. National Wild Fish Health Survey-Laboratory Procedures Manual. Second Edition. U.S. Fish and Wildlife Service, Warm Spring, GA.
31 Osman KM, Mohamed LA, Rahman EHA, Soliman WS. 2009. Trials for vaccination of Tilapia fish against Aeromonas and Pseudomonas infections using monovalent, bivalent dan polyvalent vaccines. World J. Fish Mar. Sci. 1(4): 297-304.
Perelberg A, Smirnov M, Hutoran M, Diaman A, Bejerano Y, Kotler M. 2003. Epidemiological description of a new viral disease afflicting cultured Cyprinus carpio in Israel. IJA-Bamidgeh 55(1): 5-12.
Pikarsky E, Ronen A, Abramowitz J, Levavi-Sivan B, Hutoran M, Shapira Y, Steinitz M, Perelberg A, Soffer D, Kotler M. 2004. Pathogenesis of acute viral disease induced in fish by carp interstitial nephritis and gill necrosis virus. J. Virol. 78: 9544-9551.
Pikulkaew S, Meeyam T, Banlunara W. 2009. The outbreak of koi herpesvirus (KHV) in koi (Cyprinus carpio koi) from Chiang Mai Province, Thailand. Thai. J. Vet. Med. 39(1): 53-58.
Pokorova D, Vesely T, Piackova V, Reschova S , Hulova J. 2005. Current knowledge on koi herpesvirus (KHV): A review. Vet. Med. Czech 50: 139-147.
Pokorova D, Piackova V, Cizek A, Reschova S, Hulova J, Vicenova M, Vesely T. 2007. Tests for the presence of koi herpesvirus (KHV) in common carp (Cyprinus carpio carpio) and koi carp (Cyprinus carpio koi) in the Czech Republic. Vet. Med. 52(12): 562-568.
Press CM, Lillehaug A. 1995. Vaccination in European salmonid aquaculture: A review of practices and prospects. Br. Vet. J. 151: 45-69.
Rawat M, Singh S, Saraf S, Saraf S. 2007. An overview of biochemical aspects of DNA vaccines. Asian J. Biochem. 2 (4): 208-223.
Ronen A, Perelberg A, Abramowitz J, Hutoran M, Tinman S, Bejerano I, Steinitz M, Kotler M. 2003. Efficient vaccine against the virus causing a lethal disease in cultured Cyprinus carpio. Vaccine 21: 4677-4684.
32 Seo JY, Ki-Hong K, Sung-Gu K, Myung-Joo O, Soo-Wan N, Young-Tae K,
Tae-Jin C. 2006. Protection of flounder against hirame rhabdovirus (HIRRV) with a DNA vaccine containing the glycoprotein gene. Vaccine 24(7): 1009-1015.
Shoemaker CA, Klesius PH, Evans JJ. Immunization of eyed channel catfish Ictalurus punctatus eggs with monovalent Flavobacterium columnare vaccine and bivalent F. columnare and Edwardsiella ictaluri vaccine. Vaccine (25): 1126-1131.
Siwicki AK, Lepa A, Mataczewska J, Kazun B, Kazun K, Terech-Majewska E. 2006. Isolation and identification of carp interstitial nephritis and gill necrosis virus (CNGV) in fingerling common carp (Cyprinus carpio L.). Arch. Pol. Fish. 14(2): 157-167.
Soltani M, Kalbassi MR. 2001. Protection of Persian sturgeon (Acipenser persicus) fingerling aganst Aeromonas hydrophila septicemia using three different antigens. Bull. Eur. Ass. Fish Pathol. 21(6): 235-240.
Sunarto A, Cameron A. 2006. Epidemiology and control of koi herpesvirus in Indonesia. Proceedings of the 11th International Symposium on Veterinary Epidemiology and Economics, 2006.
Takano T, Iwahori A, Hirono I, Aoki T. 2004. Development of a DNA vaccine against hirame rhabdovirus and analysis of the expression of immune-related genes after vaccination. Fish Shellfish Immunol. 17(4): 367-374. Tonheim TC, Jarl B, Roy AD. 2008. What happens to the DNA vaccine in fish? A
review of current knowledge. Fish Shellfish Immunol. 25: 1-18.
Toranzo AE, Romalde JL, Magarinos B, Barja JL. 2009. Present and future of aquaculture vaccines against fish bacterial diseases. Opt. Med. A(86): 155-176.
Vierstraete A. 1999. Principle of the PCR. http://users.ugent.be/~avierstr/ principles/pcr.html (17 Mei 2010).
Waltzek TB, Kelley GO, Stone DM, Way K, Hanson L, Fukuda H, Hirono I, Aoki T, Davison AJ, Hedrick RP. 2005. Koi herpesvirus represents a third cyprinid herpesvirus (CyHV-3) in the family Herpesviridae. J. Gen. Virol. 86: 1659-1667.
Woo PTK. 2010. Immunologigal and therapeutic strategies against Salmonid cryptobiosis. J. Biomed. Biotech. 2010: 1-9.
33 Zheng F, Sun X, Liu H, Zhang J. 2006. Study on the distribution and expression of DNA vaccine against lymphocytis disease virus in Japanese flounder (Paralichthys olivaceus). Aquaculture 261: 1128-1134.
35 Lampiran 1. Konstruksi plasmid pAct-GP25 (Nuryati, 2010)
Keterangan:
Act : Promoter -aktin ikan medaka GP25 : Glikoprotein ORF 25
BGH : poly-A dari bovine growth hormone
E : Eco RI
S : Sal I
X : Xho I
E E S S X X
Act GP25 BGH
36 Lampiran 2. Denah posisi akuarium uji tantang
Keterangan:
A : Perlakuan perendaman 30 menit 1 kali B : Perlakuan perendaman 60 menit 1 kali C : Perlakuan perendaman 90 menit 1 kali D : Perlakuan perendaman 90 menit 2 kali E : Perlakuan perendaman 90 menit 3 kali K : Kontrol tanpa perendaman
1,2,3 : Ulangan
K3 A2 B1 C3 D2 E1
D1 E3 K2 A1 B3 C2
37 Lampiran 3. Prosedur pembuatan preparat histologi (modifikasi Mumford, 2004)
- Jaringan difiksasi dengan menggunakan formalin 5 %,
- Direndam dalam ethanol 70 % selama 24 jam sampai dengan tidak terbatas, - Direndam dalam ethanol 80 % selama 1-12 jam,
- Direndam dalam ethanol 90 % selama 30 menit, - Direndam dalam ethanol 95 % selama 30 menit, - Direndam dalam ethanol absolut 1 selama 30 menit, - Direndam dalam ethanol absolut 2 selama 30 menit, - Direndam dalam ethanol absolut 3 selama 30 menit, - Direndam dalam xylol 1 selama 30 menit,
- Direndam dalam xylol 2 selama 30 menit,
- Direndam dalam xylol 3 (pada suhu 60oC) selama 30 menit, - Direndam dalam parafin 1 selama 30 menit,
- Direndam dalam parafin 2 selama 30 menit, - Direndam dalam parafin 3 selama 30 menit,
- Blok jaringan dipotong melintang dengan menggunakan mikrotom (5 μm), - Diletakkan di atas permukaan air hangat,
- Dilekatkan pada permukaan objek glass,
- Direndam dalam xylol 1 selama 3 menit, - Direndam dalam xylol 2 selama 3 menit, - Direndam dalam xylol 3 selama 3 menit,
38 Lampiran 3. Prosedur pembuatan preparat histologi (lanjutan)
- Ditetesi hematoksilin selama 2-3 detik, - Dibilas dengan menggunakan air mengalir, - Dicelupkan ke dalam aquades,
- Ditetesi eosin selama 1 menit,
- Dibilas dengan menggunakan air mengalir, - Dicelupkan ke dalam aquades,
- Dicelupkan beberapa saat ke dalam ethanol 80 %, - Dicelupkan beberapa saat ke dalam ethanol 90 %, - Dicelupkan beberapa saat ke dalam ethanol 95 %, - Dicelupkan beberapa saat ke dalam ethanol absolut 1, - Dicelupkan beberapa saat ke dalam ethanol absolut 2, - Dicelupkan beberapa saat ke dalam ethanol absolut 3,
- Dicelupkan beberapa saat ke dalam xylol 1, - Dicelupkan beberapa saat ke dalam xylol 2, - Dicelupkan beberapa saat ke dalam xylol 3, - Dikering udarakan.
39 Lampiran 4. Data kematian harian ikan mas
T
A : Perlakuan perendaman 30 menit 1 kali B : Perlakuan perendaman 60 menit 1 kali C : Perlakuan perendaman 90 menit 1 kali D : Perlakuan perendaman 90 menit 2 kali E : Perlakuan perendaman 90 menit 3 kali K : Kontrol tanpa perendaman
40 Lampiran 5. Data suhu air harian (oC)
Hari Tanggal Min. Maks.
1 20/11/2011 23,0 24,5 2 21/11/2011 23,0 24,0 3 22/11/2011 23,5 24,5 4 23/11/2011 23,5 25,0 5 24/11/2011 23,0 25,0
6 25/11/2011 23, 25,0
7 26/11/2011 23,5 24,5 8 27/11/2011 23,0 24,5 9 28/11/2011 22,5 25,0 10 29/11/2011 23,0 24,0 11 30/11/2011 23,0 24,5 12 01/12/2011 23,0 25,0 13 02/12/2011 22,5 24,0 14 03/12/2011 23,0 24,5 15 04/12/2011 23,0 24,0 16 05/12/2011 23,0 24,5 17 06/12/2011 22,5 24,0 18 07/12/2011 23,0 24,0 19 08/12/2011 23,0 24,5 20 09/12/2011 23, 24,5 21 10/12/2011 23,5 25,0
41 Lampiran 6. Hasil uji statistik lama perendaman
Test of Homogeneity of Variances
42 Lampiran 7. Hasil uji statistik kelangsungan hidup relatif
Test of Homogeneity of Variances Kelangsungan Hidup Relatif
Levene Statistic df1 df2 Sig.
8.270 4 10 .003
ANOVA
Kelangsungan Hidup Relatif
Source of Variation Sum of Squares df Mean Square F Sig.
Between Groups 78.60 4 19.65 .55 .70
Within Groups 358.28 10 35.83
Total 436.88 14
Homogeneous Subsets Kelangsungan Hidup Relatif
Lama dan Frekuensi
Perendaman N
Subset for alpha = 0.05 1
Duncana 60 menit (1) 3 44.10
90 menit (3) 3 45.46
30 menit (1) 3 46.82
90 menit (1) 3 49.55
90 menit (2) 3 50.01
Sig. .29