IDENTIFIKASI DAN UJI PATOGENISITAS
PENYEBAB BUSUK PANGKAL BATANG PADA JERUK
(
Citrus
spp.) DARI BEBERAPA SENTRA PRODUKSI JERUK
DI INDONESIA
JULINDA BENDALINA DENGGA HENUK
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Identifikasi dan Uji Patogenisitas Penyebab Busuk Pangkal Batang pada Jeruk (Citrus spp.) dari Beberapa Sentra Produksi Jeruk di Indonesia adalah karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Nopember 2010
ABSTRACT
JULINDA BENDALINA DENGGA HENUK. Identification and Patogenicity Test of Basal Stem Rot Disease on Citrus spp. from Citrus Central Production
Area in Indonesia. Under the direction of MEITY SURADJI SINAGA and SRI HENDRASTUTI HIDAYAT
Basal stem rot (gummosis) is one of the important diseases in citrus. This disease can be caused by several species of Phytophthora, such as Phytophthora nicotianae Dast., P. palmivora and P. citrophthora, Lasiodiplodia theobromae (synonyms Botryodiplodia theobromae and Diplodia natalensis; teleomorph Botryosphaeria rhodina). The objectives of the study are to identify the species of pathogenic fungi causing basal stem rot from several citrus central production in Indonesia based on morphological and molecular characteristics and to evaluate the pathogenicity differences between species of pathogenic fungi in citrus basal stem rot from Indonesia. This study includes four activities: (1) collection, isolation and identification of pathogenic fungi from basal stem rot, (2) extraction
of DNA genomic and amplification DNA fragment using PCR technique, (3) analysis of genetic diversity, (4) pathogenicity test of pathogenic fungi of basal
stem rot. Based on morphological characteristics and confirmation with DNA sequence data from the internal transcribed spacer regions (ITS4 and ITS5), basal stem rot was caused by Botryodiplodia theobromae Pat. (teleomorph Botryosphaeria rhodina (Cooke) Arx.)) and P. citrophthora. Nine isolates of Botryosphaeriaceae from citrus and other hosts from different location further genetic analysis showed that those isolates can be differentiated into two clusters, showing the possible genetic differences among them. Pathogenicity test showed positive result on citrus seedlings and citrus explant in vitro.
RINGKASAN
JULINDA BENDALINA DENGGA HENUK. Identifikasi dan Uji Patogenisitas Penyebab Busuk Pangkal Batang Jeruk (Citrus sp.) dari Beberapa Sentra Produksi
Jeruk di Indonesia. Dibimbing oleh MEITY SURADJI SINAGA dan SRI HENDRASTUTI HIDAYAT.
Penyakit busuk pangkal batang (BPB) merupakan salah satu penyakit penting karena dapat mematikan tanaman dan saat ini telah berkembang luas di beberapa sentra produksi jeruk di Indonesia. Penyakit disebabkan oleh beberapa spesies seperti Phytophthora nicotianae Dast., P. palmivora dan P. citrophthora, Botryodiplodia theobromae dan atau Diplodia natalensis. Sampai saat ini belum ada identifikasi yang tepat mengenai patogen utamanya. Oleh karena itu, perlu dilakukan identifikasi yang akurat dalam identifikasi awal patogen tanaman sebagai dasar untuk menentukan strategi pengendalian penyakit yang efektif dan efisien. Penelitian bertujuan untuk mengidentifikasi spesies patogen BPB jeruk dari 11 sentra produksi jeruk di Indonesia berdasarkan karakteristik morfologi dan molekulernya, dan mengevaluasi patogenisitas tiap spesies patogen BPB jeruk dari beberapa sentra produksi jeruk di Indonesia.
Peubah yang diamati secara makroskopis yaitu warna dan bentuk koloni, lama tumbuh patogen. Secara mikroskopis, karakter morfologis Phytophthora yang diamati yaitu bentuk dan ukuran sporangium, papilla, ada tidaknya sekat dan klamidospora; sedangkan karakter morfologis Diplodia atau Botryodiplodia yang diamati yaitu hifa, stroma, piknidia, konidiofor, klamidospora, bentuk dan ukuran konidia. Identifikasi spesies Phytophthora menggunakan kunci identifikasi Erwin & Ribeiro 1996 sedangkan Diplodia dan atau Botryodiplodia menurut Barnett & Hunter (1998). Identifikasi secara molekuler menggunakan PCR dengan pasangan primer ITS4 dan ITS5. Karakteristik molekuler yang diamati yaitu ukuran fragmen pasangan basa (pb) atau sekuen DNA hasil amplifikasi. Peubah yang diamati pada uji patogenisitas yaitu kejadian penyakit berdasarkan gejala yang terbentuk setelah inokulasi patogen.
Hasil isolasi diperoleh 12 isolat yang terdiri dari 1 isolat Phytophthora sp.
dari Desa Oehala, Kabupaten Timor Tengah Selatan (TTS), Propinsi Nusa Tenggara Timur (NTT); 11 isolat Botryodiplodia sp. dan atau Diplodia sp.
dari Berastagi (Sumatera Utara), Kampar (Riau), Muaro Jambi (Jambi), Tulang Bawang Barat (Lampung), Garut (Jawa Barat), Jember dan Batu-Malang
(Jawa Timur), Bangli (Bali), TTS (NTT), Banjarmasin dan Banjarbaru (Kalimantan Selatan).
(1996), isolat Phytophthora sp. yang berasal dari Desa Oehala, TTS (NTT) adalah Phytophthora citrophthora (RE Smith & EH Smith) Leonian (1925).
Isolat Diplodia sp. dan atau Botryodiplodia sp. dapat memenuhi cawan petri 3–7 HSI jika dikulturkan pada media PDA. Miseliumnya aerial, awalnya putih, menjadi hitam kehijauan sampai abu-abu akhirnya menjadi hitam. Hifa bersekat, hialin kemudian menjadi coklat. Klamidospora terbentuk secara interkalar. Piknidia lebih cepat tumbuh jika ditanam pada WA yang diberi potongan jerami padi steril, yaitu ± 2 minggu setelah isolasi, sedangkan isolat yang diisolasi pada PDA, piknidia tumbuh sangat lambat yaitu ± 1 bulan setelah isolasi. Piknidia terbentuk secara berkelompok dalam stroma, konidiofor tunggal, konidia dihasilkan di dalam piknidia. Konidia terdiri dari konidia muda dan konidia matang. Keduanya berbentuk ovoid dan ellipsoid. Konidia muda hialin, dindingnya terdiri dari 2 lapisan, granular dan tidak bersekat sedangkan konidia matang berwarna coklat, dinding selnya 1 lapisan dan memiliki satu sekat. Ukuran konidia bervariasi dengan rerata 25.31 µm x 15.00 µm. Hasil identifikasi menggunakan sistem klasifikasi Saccardo menurut Barnett & Hunter (1998), 11 isolat dari lokasi berbeda memiliki karakter yang merupakan ciri khas Botryodiplodiatheobromae Pat.
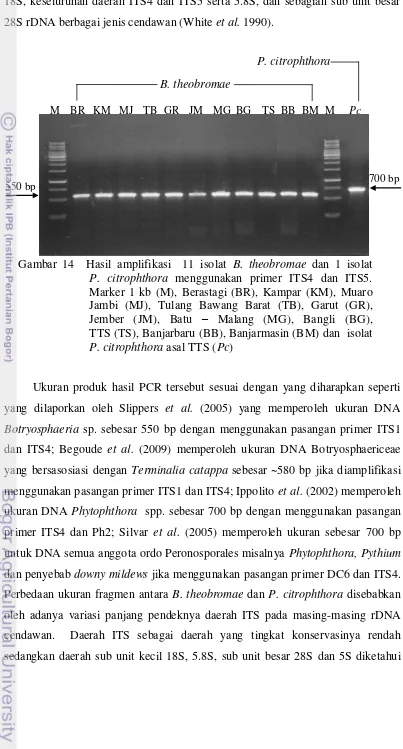
Identifikasi molekuler dengan PCR menggunakan primer ITS4 dan ITS5 mampu mengamplifikasi fragmen DNA B. theobromae dan P. citrophthora. Produk hasil amplifikasi isolat B. theobromae berukuran ± 550 bp, sementara isolat P. citrophthora berukuran ± 700 bp. Ukuran produk hasil PCR sesuai yang diharapkan. Hasil BLAST menunjukkan kesepuluh isolat target mempunyai kemiripan yang tinggi (lebih dari 90%, e-value 0.0) dengan B. theobromae (sinonimnya Lasiodiplodia theobromae; teleomorp Botryosphaeria rhodina). Artinya hasil identifikasi yang telah dilakukan secara konvensional sudah tepat.
Hasil analisis kekerabatan menunjukkan hubungan kekerabatan isolat-isolat B. theobromae dari 10 lokasi sentra produksi jeruk di Indonesia berbeda atau terpisah dengan isolat dari GenBank sehingga terbagi menjadi dua kelompok utama. Isolat Indonesia sendiri terbagi menjadi 2 kelompok yaitu kelompok pertama terdiri dari Muaro Jambi, Jember dan Kampar, sedangkan kelompok kedua terdiri dari Bangli, TTS, Malang, Banjarbaru, Berastagi, Garut dan Tulang Bawang Barat. Hasil analisis identitas matriks menunjukkan sesama isolat Indonesia sendiri mempunyai kesamaan yang tinggi ditunjukkan dengan nilai kesamaannya >90%, sedangkan jika dibandingkan dengan isolat-isolat dari GeneBank, ternyata isolat Indonesia mempunyai nilai kesamaan yang sangat rendah (<50%).
Uji patogenisitas pada tanaman eksplan secara in vitro yang dilakukan oleh peneliti lain dengan menggunakan isolat B. theobromae dan P. citrophthora yang sama, secara berturut-turut menunjukkan gejala klorosis, berkembang menjadi nekrosis, membentuk gum sampai mengakibatkan kematian (8 HSI jika
diinokulasi dengan P. citrophthora, dan 12 HSI jika diinokulasi dengan B. theobromae). Sedangkan Uji patogenisitas yang dilakukan di rumah kasa
memperlihatkan gejala yang positif meskipun perkembangan gejalanya sangat lambat.
© Hak Cipta milik IPB, tahun 2010
Hak Cipta dilindungi Undang-undang1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah.
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB. 2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya
IDENTIFIKASI DAN UJI PATOGENISITAS
PENYEBAB BUSUK PANGKAL BATANG PADA JERUK
(
Citrus
spp.) DARI BEBERAPA SENTRA PRODUKSI JERUK
DI INDONESIA
JULINDA BENDALINA DENGGA HENUK
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Fitopatologi, Departemen Proteksi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Identifikasi dan Uji Patogenisitas Penyebab Busuk Pangkal Batang pada Jeruk (Citrus spp.) dari Beberapa Sentra Produksi Jeruk di Indonesia
Nama : Julinda Bendalina Dengga Henuk
NRP : A352080011
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc Dr. Ir. Sri Hendrastuti Hidayat, M.Sc
Ketua Anggota
Diketahui
Ketua Mayor Fitopatologi Dekan Sekolah Pascasarjana
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc Prof. Dr. Ir. Khairil A. Notodiputro, M.S
PRAKATA
Puji Tuhan karena atas pertolongan dan kasih karunia-Nya, tesis dengan judul Identifikasi dan Uji Patogenisitas penyebab Busuk Pangkal Batang pada Jeruk (Citrus spp.) dari Beberapa Sentra Produksi Jeruk di Indonesia dapat diselesaikan dengan baik.
Penulis mempersembahkan rasa terima kasih dan penghargaan yang tak terhingga kepada Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc. dan Dr. Ir. Sri Hendrastuti Hidayat, M.Sc. atas kesempatan dan kepercayaan yang
diberikan kepada penulis serta segala bimbingan yang diberikan dengan setulus
hati kepada penulis demi terelesaikannya tesis ini. Penelitian ini dapat terlaksana dengan adanya bantuan sebagian dana penelitian melalui program KKP3T Kementrian Pertanian RI, Tahun Anggaran 2009 atas nama
Prof. Dr. Ir. Meity Suradji Sinaga, M.Sc. dan dukungan bahan-bahan untuk identifikasi molekuler dari Laboratorium Virologi Tumbuhan IPB atas ijin dari Dr. Ir. Sri Hendrastuti Hidayat, M.Sc.
Terima kasih penulis sampaikan kepada Pak Dadang selaku laboran dan teknisi Laboratorium Mikologi Tumbuhan yang telah membantu kelancaran pelaksanaan penelitian di laboratorium; saudari Tuti S. Legiastuti, yang dengan sabar telah memberikan pengarahan kepada penulis selama bekerja di Laboratorium Virologi Tumbuhan IPB, saudari Rut Normasari, Pak Irwan Lakani dan saudari Devi Agustina yang telah membantu menganalisis hasil sekuensing, serta Pak Sodik yang membantu pelaksanaan penelitian di rumah kasa Departemen Proteksi Tanaman IPB.
Terima kasih juga penulis sampaikan untuk semua anggota Laboratorium Mikologi Tumbuhan dan Virologi Tumbuhan Departemen Proteksi Tanaman IPB serta teman-teman Fitopatologi khususnya angkatan 2008 (Nilda, Pipit, Tri dan Wawan), Keluarga Besar Persekutuan Oikumene Kampus IPB, dan Keluarga Besar Mahasiswa Nusa Tenggara Timur (Gamanusratim) untuk semua kebersamaan kita dan dengan tulus telah memberikan kontribusi dengan caranya masing-masing terutama doa, kasih sayang dan semangat. Semoga Bapa Sorgawi senantiasa melimpahi berkat terutama kesuksesan dan kebahagiaan bagi kita semua.
Rasa terima kasih dan penghargaan yang tak terhingga penulis peruntukkan bagi papa Yesaya Yunus Pandie Henuk, S.H. (Alm), mama Yane Baceba Pandie Henuk Manafe, adik Novi dan Ai; kakak sekaligus kekasihku Arie serta keluarga besar Laukapitang atas limpahan doa, cinta, kasih sayang, fasilitas, pengorbanan, serta semangat yang tiada henti dan tulus demi terselesaikannya tesis ini.
Akhirnya penulis berharap semoga tesis ini dapat bermanfaat bagi kemajuan dan pengembangan ilmu pengetahuan di masa yang akan datang.
Bogor, Nopember 2010
RIWAYAT HIDUP
Penulis dilahirkan di Kupang pada tanggal 7 Juli 1979 dari ayah Yesaya Yunus Pandie Henuk, S.H. (Alm) dan ibu Yane Baceba Pandie Henuk
Manafe. Penulis merupakan anak sulung dari tiga bersaudara. Penulis menyelesaikan pendidikan Sekolah Menengah Umum pada SMU Negeri 1 Kupang pada tahun 1997. Pada tahun yang sama penulis diterima sebagai mahasiswa Program Studi Ilmu Hama dan penyakit Tumbuhan, Fakultas Pertanian, Universitas Nusa Cendana (Undana) melalui jalur Penelusuran Minat dan Kemampuan (PMDK). Gelar Sarjana diperoleh pada tahun 2002. Sejak tahun 2005, penulis menjadi staf dosen di Program Studi Ilmu Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Undana, Kupang. Tahun 2008 penulis terdaftar sebagai mahasiswa program Magister Sains pada Program Studi Fitopatologi, Sekolah Pascasarjana, Institut Pertanian Bogor dengan Beasiswa Pendidikan Pascasarjana (BPPS) dari Direktorat Jendral Pendidikan Tinggi, Departemen Pendidikan Nasional Republik Indonesia.
DAFTAR ISI
Gejala, Penyebab dan Pengendalian ... 5Sifat-sifat Umum Phytophthora spp. ... 7
Sifat-sifat Umum Diplodia sp. dan atau Botryodiplodia sp. ... 10
Identifikasi Cendawan Berdasarkan Karakter Morfologi ... 12
Identifikasi Cendawan Berdasarkan Karakter Molekuler ... 15
BAHAN DAN METODE Waktu dan Tempat Penelitian ... 17
Metode Pelaksanaan ... 17
Pengumulan Sampel Tanaman Sakit ... 17
Isolasi Phytophthora, Diplodia dan atau Botryodiplodia dari Jaringan Tanaman Sakit ... 18
Isolasi spora Tunggal Phytophthora, Diplodia dan atau Botryodiplodia ... 19
Identifikasi Phytophthora, Diplodia dan atau Botryodiplodia Berdasarkan Karakter Morfologi ... 20
Identifikasi Phytophthora, Diplodia dan atau Botryodiplodia Menggunakan Teknik PCR ... 22
Ekstraksi DNA Genomik Cendawan ... 22
Amplifikasi DNA ... 23
Visualisasi ... 23
Perunutan Nukleotida dan Analisis Filogenetik ... 23
Uji Patogenisitas ... 24
HASIL DAN PEMBAHASAN Identifikasi Cendawan Patogen BPB Berdasarkan Karakter Morfologi ... 25
Identifikasi Cendawan Patogen BPB Jeruk Menggunakan Teknik PCR ... 34
Perunutan Nukleotida (Sekuensing) ... 36
SIMPULAN DAN SARAN
Simpulan ... 44
Saran ... 44
DAFTAR PUSTAKA ... 45
DAFTAR TABEL
Halaman
1 Daftar Lokasi Pengambilan Sampel Tanaman Sakit ... 18
2 Isolat Patogen yang diperoleh dari Bagian Pangkal Batang Jeruk Sakit dan dari tanah (rizosfer) ... 27
3 Ukuran Sporangia P. citrophthora (panjang x lebar) ... 29
4 Ukuran Konidia Diplodia sp. dan atau Botryodiplodia sp. ... 33
5 Daftar Hasil Runutan Nukleotida Isolat penelitian dari ... 37
6 Hasil Analisis BLAST Sekuen Sepuluh Isolat Penelitian ... 37
7 Daftar Runutan Nukleotida yang Digunakan untuk Analisis Kekerabatan ... 38
DAFTAR GAMBAR
Halaman
1 Morfologi Sporangium P. nicotianae (A), P. palmivora (B), dan
P. citrophthora (C) menurut Erwin & Ribeiro (1996)... 21
2 Morfologi Piknidia Diplodia spp. (A) dan Botryodiplodia spp. (B) Menurut Barnett & Hunter (1998) ... 21
3 Gejala BPB di Pembibitan Jeruk di KP Punten (Loka Penelitian Tanaman Jeruk dan Hortikultura Subtropik, Batu–Malang) ... 26
4 Gejala BPB di Lapangan (Kabupaten TTS–NTT) ... 26
5 Tipe koloni P. citrophthora ... 28
6 Morfologi Hifa, Miselium, dan Klamidospora P. citrophthora ... 28
7 Bentuk dan Papilla Sporangia P. citrophthora Asal Desa Oehala (TTS) ... 29
8 Perkembangan Warna Koloni Miselium Diplodia dan atau Botryodiplodia dalam PDA pada Suhu Ruang (25–30 oC) ... 30
9 Pembentukan Hifa dan Klamidospora B. theobromae... 30
10 Morfologi Stroma, Piknidia, Konidia dan Konidiofor B. theobromae... 31
11 Konidia B. theobromae (Perbesaran 400x pada mikroskop cahaya) ... 32
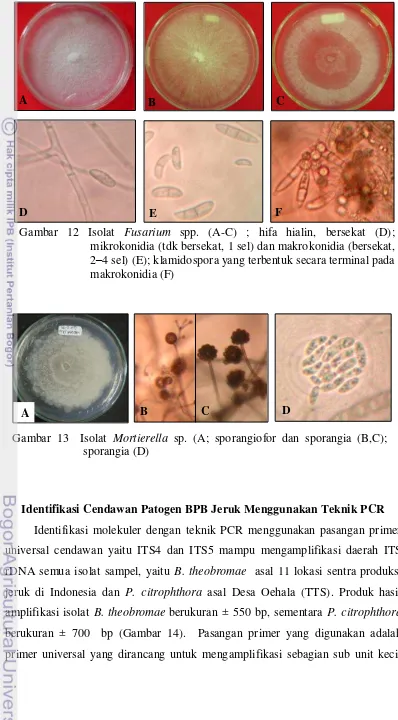
12 Isolat Fusarium spp. ... 34
13 Isolat Mortierella sp. ... 34
14 Hasil Amplifikasi 11 Isolat B. theobromae dan 1 Isolat P. citrophthora Menggunakan Primer ITS4 dan ITS5 ... 35
DAFTAR LAMPIRAN
Halaman
1 Komposisi Medium PDA (1 liter) ... 49 2 Komposisi Medium V8 Agar (1 liter) ... 49 3 Protokol Penyiapan Inokulum Phytophthora (AVRDC Mycology
2000) ... 50 4 Cara Kalibrasi Mikrometer Okuler dan Objektif pada Mikroskop
Binokuler ... 51 5 Sistem Klasifikasi Saccardo (Barnett & Hunter 1998) ... 51 6 Pertumbuhan Koloni Diplodia dan atau Botryodiplodia dalam
PDA pada Suhu Kamar (25 – 30 oC) ... 52 7 Konidia Botryodiplodia theobromae (Perbesaran 100x dan 400x
pada Mikroskop Binokuler) ... 54 8 Hasil Perunutan Nukleotida Sepuluh Isolat B. theobromae
(Format Contiq) ... 56 9 Hasil Penjajaran Nukleotida Isolat penelitian dan Isolat dari
PENDAHULUAN
Latar Belakang
Jeruk merupakan salah satu tanaman hortikultura yang memiliki arti penting sebagai sumber pendapatan karena merupakan komoditas perdagangan nasional dan internasional. Saat ini jeruk nasional cenderung kalah bersaing dengan jeruk impor dan luas panen pun cenderung menurun. Produksi jeruk nasional tahun 2007 sebesar 2.60 juta ton dengan luas panen 67,592 ha, jika dibandingkan dengan data 2 tahun sebelumnya yaitu tahun 2006 (72,390 ha, 2.78 juta ton) dan 2005 (67,883 ha, 2.62 juta ton), maka produksi dan luas panen jeruk tahun 2007 cenderung menurun (Basisdata Deptan 2009). Salah satu kendala utama yang menyebabkan penurunan produksi dan luas panen jeruk di Indonesia adalah penyakit busuk pangkal batang (BPB) atau disebut juga penyakit “blendok” atau
“gummosis” yang merupakan salah satu penyakit penting pada jeruk setelah penyakit citrus vein phloem degeneration (CVPD). Penyakit BPB menjadi sangat penting karena dapat mematikan tanaman di lapang maupun saat masih di pembibitan. Saat ini, penyakit BPB telah berkembang luas di beberapa sentra produksi jeruk di Indonesia.
Selama ini penyebab penyakit BPB pada jeruk diidentifikasi sebagai Phytophthora spp., tetapi ternyata cendawan patogen lain yang berbeda juga dapat menimbulkan penyakit BPB, yaitu Diplodia natalensis dan atau Botryodiplodia theobromae. Namun sampai saat ini belum ada laporan dan identifikasi yang tepat mengenai patogen utama yang menyebabkan penyakit BPB di Indonesia. Siviero et al. (2006) melaporkan Phytophthora spp. sebagai penyebab penyakit BPB telah menyebar di seluruh dunia dan bertanggung jawab terhadap kerugian pada budidaya jeruk. Menurut Erwin & Ribeiro (1996), penyakit BPB jeruk disebabkan Phytophthora spp. yaitu P. parasitica dan atau P. citrophthora; menurut Leoni &
Ghini (2006) penyakit ini disebabkan oleh P. nicotianae (P. parasitica) dan P. citrophthora. Demikian pula Vial et al. (2006) melaporkan bahwa P. citrophthora (Smith & Smith) Leonian dan P. parasitica Dastur (sin. P. nicotianae Breda de Haan) telah diidentifikasi sebagai spesies yang paling
Ashari (1995), Phytophthora spp. yang penting dalam menyebabkan penyakit ini adalah P. nicotianae (dulu: P. parasitica Dast), P. citrophthora (dulu: Pythiacytic citrophthora R.E. Sm. Et E.H. Sm), P. palmivora (Butl), dan diantara ketiga spesies tersebut, spesies yang utama adalah P. nicotianae var. parasitica. Sedangkan menurut Timmer et al. (2000), penyakit ini disebabkan oleh Lasiodiplodia theobromae (Pat.) Griffon dan Maubl. (Sinonimnya Diplodia natalensis Pole-Evans dan Botryodiplodia theobromae Pat.; teleomorph Botryosphaeria rhodina (Cooke) Arx). Identifikasi Diplodia dan Botryodiplodia hingga spesies juga belum dilaporkan.
Pada dasarnya Phytophthora maupun Diplodia dan atau Botryodiplodia mempunyai sebaran inang yang relatif luas. Spesies Phytophthora dapat menginfeksi beberapa ratus spesies tanaman di seluruh dunia, termasuk sayuran, buah-buahan, tanaman hias dan tanaman hutan (Erwin & Ribeiro 1996; Camele 2005). P. nicotianae (P. parasitica) diketahui merupakan spesies penting penyebab penyakit lebih dari 40 tanaman, bahkan P. cinnamomi Rands dilaporkan menginfeksi lebih dari 1000 spesies tanaman (Ho & Lu 1997), meskipun beberapa
spesies dilaporkan mempunyai sebaran inang yang sangat terbatas, seperti P. colocasiae dan P. fragariae Hickman (Erwin dan Ribeiro 1997; Drenth & Guest
2004). Demikian pula dengan beberapa spesies Botryosphaeriaceae diketahui merupakan patogen penting lebih dari 50 spesies tanaman (Begoude et al. 2009; Wet et al. 2008; Slippers et al. 2005; Phillips et al. 2005); B. theobromae adalah cendawan polifag yang dapat menyerang bermacam-macam tumbuhan termasuk jeruk (Semangun 2000). Oleh karena itu, dalam satu spesies tanaman yang menunjukkan gejala dan tanda yang sama, ada kemungkinan ditemukan lebih dari satu spesies patogen. Dalam hal ini penyakit BPB kemungkinan dapat disebabkan oleh Phytophthora, Diplodia dan atau Botryodiplodia secara tunggal atau pun secara bersama-sama.
morfologi dan identifikasi secara molekuler menggunakan teknologi polymerase chain reaction (PCR).
Identifikasi spesies secara morfologi relatif lebih murah dibandingkan dengan identifikasi secara molekuler dan sudah bisa memberikan informasi yang jelas, tetapi memiliki kelemahan karena isolasi dan penetapan karakter morfologis dan fisiologis sulit dilakukan karena memerlukan waktu yang cukup lama; memerlukan keahlian khusus; sering bersifat subjektif dan sangat ditentukan oleh pengetahuan dan pengalaman karena beberapa karakter fenotipik taksonomi bisa saling tumpang tindih di antara spesies dan variasi yang sangat nyata dapat terjadi antara isolat dari spesies yang sama dapat dipengaruhi oleh lingkungan (Watanabe 2002). Sebaliknya identifikasi secara molekuler akan menghasilkan informasi genetik dengan ketepatan yang lebih akurat, relatif lebih cepat, spesifik, sensitif, dan hasilnya tidak dipengaruhi oleh lingkungan tetapi kelemahannya memerlukan bahan dan alat yang sangat mahal dan sebagian bahan berbahaya bagi kesehatan manusia (Ma & Themis 2007).
Perkembangan teknik molekuler yang sedemikian pesat pada tiga dasawarsa terakhir memberikan peluang yang besar bagi dikembangkannya perangkat deteksi yang sensitif dan spesifik dan dapat dilakukan dalam jangka waktu yang relatif singkat. Pendekatan molekuler pada berbagai bidang penelitian semakin dipermudah dengan ditemukannya metode PCR untuk mengamplifikasi DNA secara in vitro. Perbedaan profil fragmen DNA hasil amplifikasi dengan PCR dapat digunakan sebagai alat untuk membedakan mikroba pada tingkat genus, spesies bahkan genotipe spesifik dari patogen (Edel 1998).
Tujuan Penelitian
Penelitian bertujuan untuk mengidentifikasi spesies cendawan patogen BPB jeruk dari beberapa sentra produksi jeruk di Indonesia berdasarkan karakteristik morfologi dan molekulernya; mengevaluasi perbedaan patogenisitas antar spesies cendawan patogen BPB jeruk dari beberapa sentra produksi jeruk di Indonesia.
Manfaat Penelitian
TINJAUAN PUSTAKA
Penyakit Busuk Pangkal Batang: Gejala, Penyebab dan Pengendalian
Penyakit BPB umumnya terjadi pada bagian pangkal batang, atau bagian sambungan antara batang atas dan bawah untuk bibit jeruk okulasi. Gejala awal tampak berupa bercak basah yang berwarna gelap pada kulit batang. Pembusukan dimulai dari pangkal batang dekat permukaan tanah sampai titik okulasi (40 cm). Jaringan kulit kayu bahkan permukaan kulit, kambium, kayu yang terinfeksi mengalami perubahan warna, lama-kelamaan akan mengelupas kulitnya dan jatuh sehingga menyebabkan luka lebar terutama pada serangan lanjut. Kulit batang yang terserang, permukaannya cekung dan mengeluarkan gum, dan pada tanaman terserang sering berbentuk kalus (Ploetz 2003). Kematian tanaman akibat serangan penyebab penyakit ini terjadi apabila bercak pada kulit melingkari batang. Perkembangan bercak ke bagian atas, umumnya terbatas hingga 60 cm di atas permukaan tanah, sedangkan perkembangan ke bagian bawah dapat meluas ke bagian akar tanaman (Lutz & Menge 1986) .
Gejala yang timbul pada pembibitan adalah menguningnya daun, kelayuan dan diikuti dengan kematian atau apabila pada pembibitan yang disiram dengan air
tercemar patogen dapat menyebabkan kematian serentak. Pada kasus ini akar-akar tanaman menjadi busuk (Graham et al. 1992).
Penyakit BPB jeruk dapat disebabkan oleh Phytophthora spp., Diplodia dan atau Botryodiplodia spp.. Erwin & Ribeiro (1996) melaporkan terdapat 11 spesies Phytophthora yang dapat diisolasi dari pohon jeruk sakit, yaitu P. boehmeriae,
P. cactorum, P. cinnamomi, P. citricola, P. citropthora, P. drecshleri, P. hibernalis, P. megasperma, P. palmivora, P. parasitica (P. nicotianae), dan
P. syringae namun di Indonesia dilaporkan terdapat tiga spesies Phytophthora
yang penting yaitu P. parasitica Dast. (P. nicotianae), P. palmivora dan P. citraphthora, dan diantara ketiga spesies tersebut, spesies yang utama adalah
P. nicotianae var parasitica (Ashari 1995).
Penyakit lebih banyak terjadi pada kebun dengan ketinggian lebih dari 400 m dari permukaan laut. Tingkat ketahanan varietas sangat berpengaruh
lemon (RL) sangat rentan terhadap penyakit ini, sedangkan japanese citrun (JC) dan sour orange relatif lebih tahan. Tanah basah, adanya kabut, dan fluktuasi suhu yang kecil, pH tanah yang agak masam yaitu 6.0 sampai 6.5 merupakan kondisi yang cocok untuk perkembangan patogen (Ploetz 2003).
Pengendalian terpadu lebih diutamakan untuk memperoleh hasil maksimal yaitu penerapan pengendalian secara kultur teknis, mekanis atau fisik, biologi, genetika, dan kimia (Agrios 2005). Menurut Feichtenberger (2001) dalam Siviero et al. (2006), strategi utama untuk mengendalikan penyakit ini antara lain dengan menggunakan bibit tanaman yang sehat, menghindari terjadinya kontaminasi pada area yang kelembabannya tinggi, menghindari luka pada tanaman, meningkatkan kandungan bahan organik dalam tanah, dan pengendalian kimiawi dengan produk yang sistemik. Meskipun demikian, penggunaan kultivar resisten merupakan metode yang paling ekonomis dan efisien untuk mengendalikan penyakit ini.
Secara kultur teknis, pengendalian penyakit yang dianjurkan adalah menanam jeruk di atas gundukan-gundukan setinggi 20–25 cm, tetapi tanaman tidak dibumbun agar batang atas tidak berhubungan dengan tanah; menggunakan benih dengan mata tempel setinggi 35–50 cm dari permukaan tanah, untuk mengurangi kemungkinan batang atas yang rentan terinfeksi cendawan dari tanah; menghindari air pengairan terkena langsung pangkal batang dengan membuat selokan melingkari batang; mengurangi kelembaban kebun dengan mengatur drainase, jarak tanam, pemangkasan, dan sanitasi lingkungan atau kebun; menghindari terjadinya pelukaan pada akar maupun pangkal batang pada waktu pemeliharaan atau penyiangan; pemupukan; pengamatan pangkal batang jeruk secara teliti dan teratur, terutama pada musim hujan, agar gejala penyakit dapat diketahui secara dini; pH tanah diupayakan lebih dari 6.5 dengan pemberian dolomit (Mehrotra & Ashok 2003).
tanaman yang akan ditolong untuk membantu fungsi akar dan pohon yang rusak (Khan 2007).
Secara biologi, mengunakan agens antagonis cendawan Trichoderma spp., Gliocladium spp. yang dicampur dengan pupuk kandang atau kompos (Ashari 1995). Secara genetika atau dengan varietas tahan, menggunakan batang bawah yang tahan terhadap Phytophthora spp., misalnya Poncirus trifoliata dan Cleopatra mandarin; varietas tahan terhadap Phytophthora dan salinitas, yaitu taiwanica dan citromello 4475 (Ploetz 2003).
Secara kimia, mengolesi pangkal batang dan akar-akar yang tampak dari luar dengan ter (Carbolineum plantarum 50%) sampai setinggi 50 cm. Perlakuan tersebut dimulai tahun ketiga setelah penanaman dan setiap awal musim hujan. Agar batang yang berwarna hitam tidak banyak menyerap panas sehingga kulitnya rusak (untuk mencegah infeksi setelah diberi ter), maka bagian yang diberi ter ditutup dengan larutan kapur yang ditambah dengan garam dapur (25 kg kapur mati, 2 kg garam dapur, dan 25–35 L air); mengoles luka (bekas tanaman yang terinfeksi yang dibuang) dengan bubur california, bubur bordeux, Carbolineum:parafin (8 : 92), mankozeb, atau tembaga oksiklorida. Kemudian luka ditutup dengan obat penutup luka, seperti ter, setelah kulit mengalami regenerasi; dan membersihkan alat-alat pertanian yang akan digunakan, misal dengan klorok (Mehrotra & Ashok 2003).
Sifat-sifat Umum Phytophthora spp.
P. citrophthora sporangiumnya berbentuk jorong atau berbentuk buah jeruk sitrun dan terbentuk pada bagian tengah atau ujung sporangiofor. Sporangiofor bercabang tidak teratur. Spora mempunyai 2 bulu cambuk. Patogen juga dapat membentuk klamidospora yang hialin. Pada PDA, koloni petalatte, sedangkan pada cornmeal agar, tipe koloninya stellate, lanose, indeterminate antara rosette dan lanose (Erwin & Ribeiro 1996). Selanjutnya menurut Timmer et al. (2000), P. citrophthora mempunyai sporangia dengan papilla yang di bawah kondisi sesuai
akan melepaskan sejumlah zoospora yang memiliki dua flagella. Sporangia P. citrophthora, biasanya lebih panjang dibandingkan sporangia P. palmivora
tetapi memiliki bentuk sporangia yang sangat bervariasi. P. citrophthora tidak menghasilkan oospora, temperatur optimum untuk pertumbuhan miselia yaitu 24–28 oC.
P. palmivora mempunyai sporangium jorong, dan dapat membentuk klamidospora berbentuk bulat dengan diameter 30–60 µ m. Sporangia sporocysts kadang-kadang tidak mempunyai papilla. Sporangia dapat berkecambah secara langsung dengan membentuk pembuluh kecambah, atau tidak langsung dengan membentuk zoospora atau spora kembara yang dapat berenang. Membentuk miselium bercabang dan tidak bersekat ketika muda, tetapi membentuk sekat pada hifa yang sudah tua, yaitu pada saat pembentukan organ reproduktif. Karakter koloni pada umumnya memounyai pinggiran yang tidak rata dan berwarna putih, tipe rosaceous, stelate dan cottony (Erwin & Ribeiro 1996). Sporangia lonjong, bentuknya seperti pir dengan ukuran 25–35 x 40–60 µ m. Menghasilkan klamidospora yang melimpah, oospora berukuran 22–29 µ m, dan temperatur optimum untuk pertumbuhan miselia yaitu 27–30 oC (Timmer et al. 2000).
srikaya, aren, pepaya, kelapa, terung belanda, durian, pala, sirih, dan lada (Graham et al. 1998).
Penyakit ini berkembang pada kebun-kebun yang mempunyai temperatur tanah cukup tinggi. Suhu cardinal antara 10 oC, 30–32 oC, dan 37 oC membantu perkembangan P. nicotianae. Penularan Phytophthora dalam tanah melalui spora yang aktif dalam air. Karena itu perkembangannya sangat cepat pada keadaan lembab dan umumnya kerusakan akar terjadi pada musim hujan. Jenis jeruk yang peka adalah batang bawah RL, sedangkan sour orange dan JC relatif lebih tahan. Varietas keprok dan manis sangat peka terhadap Phytophthora spp. Sambungan yang sangat dekat dengan tanah atau tanah tergenang di bedengan merupakan kondisi yang memudahkan terjadinya infeksi (Ploetz 2003).
Di antara spesies Phytophthora yang menyerang jeruk, P. citropthora aktif tropik dan kadang-kadang di daerah subtropik dan bagian mediteranian selama musim panas dan lembab (Timmer et al. 2000).
(2003), P. citrophthora terdapat dalam tanah yang kedalamannya satu meter atau lebih dan dapat disebarkan ke buah dan daun oleh percikan air hujan. Infeksi terjadi pada kulit batang yang basah dan hanya terjadi melalui jaringan dimana terdapat propagul yang berkecambah. Spesies Phytophthora yang lain dapat bertahan dalam tanah untuk sementara waktu. Bagian testa benih dari benih jeruk yang terinfeksi akan membawa patogen ke kebun benih yang baru dan melalui transplantasi pada kebun bibit.
Infeksi dapat terjadi melalui luka alami, luka karena alat pertanian atau luka karena serangga. Infeksi terjadi terutama pada musim hujan dan dibantu oleh pH tanah agak asam (6,0–6.5). Infeksi patogen juga dibantu oleh kabut dan fluktuasi suhu yang kecil yang akan memperlambat penguapan. Penyakit ini mampu menyerang banyak tanaman perkebunan yang lain (Ploetz 2003).
Sifat-sifat Umum Diplodia sp. atau Botryodiplodia sp.
Botryosphaeriaceae merupakan kelompok cendawan yang memuat sejumlah spesies yang tersebar pada beberapa genus anamorp, diantaranya yang paling dikenal adalah Diplodia, Lasiodiplodia, Neofusicoccum, Pseudofusicoccum, Dothiorella, dan Sphaeropsis (Crous et al. 2006). Anggota Botryosphaeriaceae mempunyai distribusi yang sangat luas dan terjadi dalam varietas yang luas pada berbagai tanaman inang termasuk monokotiledon, dikotiledon, gymnospermae dan angiospermae, dimana anggota-anggota Botryosphaeriaceae ini dapat berperan sebagai saprofit, parasit, dan endofit (Begoude et al. 2009). Von Arx (1987) dalam Begoude et al. 2009, melaporkan bahwa spesies-spesies pada Botryosphaeriaceae telah lama dikenal sebagai patogen penting pada beberapa tanaman. Tanaman yang terinfeksi menunjukkan gejala yang beragam misalnya die-back, kanker, hawar, dan busuk pada seluruh organ tanaman bagian atas.
tanaman akan mati. Pada tahap awal patogen masuk pada kulit di daerah ketiak cabang terutama kulit yang luka, serangan di antara kulit dan kayu mengakibatkan tanaman mengeluarkan gum sebagai reaksi tanaman atas serangan patogen. Gum yang dikeluarkan tidak selalu mengandung patogen (Naqvi 2004).
Pada Diplodia kering, gejala awal lebih sulit diamati karena kulit batang atau cabang tanaman yang terserang tidak mengeluarkan gum tetapi akan mengelupas dan langsung mengering. Pada permukaan kulit terdapat celah-celah kecil yang mengandung massa spora cendawan berwarna putih atau hitam, selanjutnya kulit yang terserang akan mengering dan mengelupas. Serangan pada batang utama akan lebih berbahaya dibanding pada cabang atau ranting. Serangan yang melingkar pada batang atau cabang mengakibatkan bagian tanaman di atas serangan akan kering atau mati dan berwarna hitam.
D. nataliensis memiliki piknidium berwarna hitam dan letaknya tersebar, tidak berstroma dibedakan dengan B. theobromae Pat. yang memiliki piknidium berkumpul dan berstroma. Penetrasi menyebabkan tanaman bereaksi dengan mengeluarkan substansi pertahanan berupa gum berwarna kuning. Gum dikeluarkan oleh tanaman sebagai bentuk reaksi setelah adanya serangan patogen dalam jaringan, gum diproduksi untuk melokalisasi patogen agar tidak berkembang lebih luas. Gum yang keluar dari permukaan kulit jaringan tanaman menunjukkan tingkat serangan yang sudah lanjut.
Patogen ini tumbuh sangat cepat pada medium PDA pada kisaran suhu 25–30 oC, membentuk miselium aerial berwarna putih sampai abu-abu terang atau
abu-abu tua. Piknidia lebih cepat terbentuk jika dibiakkan pada potongan ranting jeruk yang steril. Piknidia berbentuk subglobose sampai globose, diameternya 300–700 µm, terbentuk secara tunggal atau berkelompok di dalam stroma, dapat menghasilkan spora berukuran 10–18 µ m x 17–43 µ m. Konidium muda hialin, nonsepta dan granular, sedangkan konidium dewasa tampak striated, berwarna gelap, tidak mempunyai lapisan lendir di luarnya dan memiliki satu sekat, (Timmer et al. 2000).
berbeda sangat tinggi antara siang dan malam terutama musim kemarau merupakan lingkungan yang mempermudah perkembangan cendawan ini. Kondisi tanaman yang lemah didukung oleh kelembaban yang tinggi akan mendukung terjadinya penetrasi pada jaringan tanaman inang baru. Penetrasi pada pamelo (C. maxima Merr.) terutama terjadi pada pertengahan musim hujan karena kelembaban memenuhi syarat bagi pertumbuhan cendawan atau pada musim kemarau dimana kondisi tanaman kurang optimal sehingga pertahanan tanaman kurang. Penetrasi yang sudah berhasil selanjutnya akan terjadi kolonisasi dan cendawan akan tumbuh dan memperbanyak pada jaringan tanaman inang. Fase-fase kritis patogen adalah pada saat sebelum terjadi penetrasi, pada fase ini pengendalian akan lebih efektif dibanding apabila sudah lanjut.
Umumnya pengendalian yang dilakukan untuk patogen ini yaitu :
1. Menjaga kebersihan kebun; memangkas ranting kering, memotong bagian cabang yang terinfeksi dan bekas potongannya diolesi parafin atau bahkan membongkar tanaman terinfeksi berat. Bekas pemangkasan, pemotongan dan pembongkaran dibakar atau ditimbun. Drainase kebun perlu diperbaiki.
2. Menjaga kebersihan alat pertanian; pisau, gunting pangkas maupun gergaji atau alat lainnya, sebelum dan setelah digunakan dicuci bersih dan kemudian sebaiknya diolesi kapas yang dibasahi alkohol 70% atau 10% pemutih atau kloroks.
3. Menyaput batang utama, cabang primer dan sekunder dengan fungisida yang ada (bahan aktif benomil atau Cu) atau dengan bubur california yang dapat dibuat sendiri. Penyaputan batang dilakukan paling sedikit dua kali setahun, yaitu pada awal dan akhir musim hujan. Bagian tanaman yang akan disaput, dibersihkan dari gumosis dan kulit kering yang mengelupas dengan cara disikat.
Identifikasi Cendawan Berdasarkan Karakter Morfologi
laboratorium untuk diagnosis dan identifikasi. Prosedur laboratorium yang dikerjakan mungkin memerlukan waktu beberapa hari atau minggu untuk menyelesaikan diagnosis dan identifikasi tersebut, untuk beberapa kasus relatif insensitif (Flynn 1994).
Pengamatan dapat dilakukan dalam berbagai tingkatan, mulai dari pengamatan dengan mata telanjang atau secara visual melalui mikroskop stereo atau mikroskop compound sampai menggunakan mikroskop elektron. Akan tetapi dengan mikroskop compound saja, identifikasi sudah dapat dilakukan dan cendawan dapat diberi nama dengan jelas dalam kaitannya dengan kemampuan individual pada pengamatan morfologi, atau kemampuan teknikal untuk menginduksi sporulasi pada media kultur (Watanabe 2002).
Spora merupakan salah satu karakteristik morfologi yang paling penting untuk identifikasi. Terdapat berbagai tipe spora yang dimiliki oleh cendawan. Berdasarkan morfologi spora maka cendawan dengan mudah dapat diklasifikasikan, tetapi beberapa cendawan mungkin diidentifikasi berdasarkan karakteristik morfologi yang lain selain spora, misalnya hifa, miselia, tubuh buah, kebiasaan tumbuh dan berbagai organ morfologi yang secara alami dapat diamati dalam kultur (Barnett & Hunter 1987).
Pengamatan di bawah mikroskop compound merupakan cara pengamatan yang konvensional. Tanpa menggunakan cover slip, cara sporulasi, rangkaian spora, atau kepala spora dapat diamati di bawah mikroskop. Penting juga dengan menggunakan minyak imersi untuk pengamatan mikroskopis pada perbesaran kuat. Akan tetapi identifikasi secara konvensional harus dilakukan oleh orang yang ahli dan berpengalaman, bahkan pengamatan harus diulang beberapa kali untuk mengetahui karakteristik morfologis secara detail dan untuk akses takson yang sesuai sehingga diperlukan cukup banyak waktu (Watanabe 2002). Selanjutnya dinyatakan bahwa kunci identifikasi juga harus dipersiapkan pada berbagai level, termasuk pada level divisi, klas, ordo, famili, genus dan spesies.
kisaran inang dimasukkan dalam kunci identifikasi dan dapat dipelajari bersama-sama dengan karakteristik morfologisnya. Setelah disesuaikan dengan
literatur untuk mencocokkan kembali morfologinya, barulah identifikasi selesai (Domsch et al. 1980).
Watanabe (2002) mengemukakan beberapa karakteristik kultur, morfologi
dan fisiologi yang dapat digunakan sebagai acuan untuk identifikasi, yaitu antara lain :
1. Karakteristik kultur :
Warna pada permukaan dan dasar koloni, bau, kuantitas hifa aerial, tekstur koloni permukaan (cottony, shrunken, sloppy, resupinate, velvety, powdery atau floury, crustaceous, water soaked, embedded, yeast-like, sticky, homogenous atau heterogenous, ada atau tidaknya elevasi), tepi koloni (halus, tidak beraturan, terbatas, menyebar), pola (zonate, radiate, flowery, arachnoid), pigmen eksudat (berwarna, transparan), organ yang dibentuk (struktur tubuh buah, sklerotia, rhizomorf, synnema, sporodochia, stroma, setae).
2. Karakteristik morfologi :
Ukuran (panjang, lebar, ketebalan, dan lain-lain), warna (mengacu pada warna standar yang dipetakan), bentuk hifa (septa, aseptat, lokasi septa, clamp connection, hyphopodia), appresoria, klamidospora, dan berbagai struktur yang berbeda pada masing-masing klas, bentuk perkecambahan (secara langsung melalui tabung kecambah, tidak langsung melalui zoospora), pola formasi struktur tubuh buah (discrete, aggregate, caespitose).
3. Karakteristik fisiologi :
Identifikasi Cendawan Berdasarkan Karakter Molekuler
Identifikasi secara molekuler dilakukan dengan amplifikasi daerah internal transcribed spacer (ITS) dari DNA ribosom (rDNA) menggunakan polymerase chain reaction (PCR) dengan pasangan primer oligonukleotida tertentu, baik yang general maupun yang spesifik. PCR merupakan teknik yang mulai berkembang pesat sekitar tahun 1987. Teknik PCR merupakan teknik untuk keperluan amplifikasi DNA secara in vitro yang seringkali mempunyai sensitivitas dan spesifitas yang tinggi (Mullis et al. 1986). Pada dasarnya, PCR mampu mengenali dan memperbanyak (amplifikasi) segmen DNA sasaran walaupun dalam konsentrasi yang sangat rendah. Reaksi amplifikasi sangat bergantung dari keberadaan enzim polymerase sebagai katalisator, terutama yang tahan panas. Enzim yang paling terkenal dan paling banyak digunakan adalah polimerase DNA Taq (Taq polymerase) yang diisolasi dari bakteri tahan panas thermus aquaticus (Bartlett and David. 2003). Bahan lain yang diperlukan adalah deoxynucleotide triphosphates (dNTPs), yang terdiri dari deoxyguanidine triphosphates (dGTP), deoxycytidine triphosphates (dCTP), dan deoxythymidine triphosphates (dTTP), serta buffer PCR yang mengandung MgCl2 (Taylor 1991).
Salah satu faktor yang penting yang mempengaruhi kualitas PCR adalah pemilihan primer yang tepat (Ryclik 1995). Primer merupakan oligonukleotida yang berfungsi sebagai pemancing amplifikasi molekul DNA. Primer terdiri dari dua macam yaitu forward dan reverse. Primer forward mengawali amplifikasi
cetakan DNA ke arah kanan dengan arah sintesis dari ujung 5’P ke 3’OH.
Sebaliknya primer reverse mengawali amplifikasi cetakan DNA ke arah kiri. Dengan adanya kedua primer tersebut, maka gen target akan teramplifikasi sepanjang PCR berlangsung.
Amplikasi DNA secara in vitro dengan PCR terdiri atas beberapa siklus, yang setiap siklusnya terdiri dari 3 tahap reaksi dengan kondisi suhu yang berbeda secara berulang yaitu denaturasi, pelekatan primer (annealing) dan pemanjangan (elongation). Dengan reaksi amplifikasi DNA secara simultan, maka jumlah DNA sasaran akhir telah dilipatgandakan secara eksponensial (McPherson et al. 1992).
Tahap denaturasi adalah pembentukan DNA utas tunggal dari DNA utas ganda (putusnya ikatan hydrogen dari kedua utas tunggal DNA komplementer)
yang umumnya terjadi pada suhu ˃95 o
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian telah dilaksanakan dari bulan Oktober 2009 sampai Agustus 2010. Kegiatan isolasi dan identifikasi cendawan patogen BPB berdasarkan karakter morfologi dilakukan di laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Insitut Pertanian Bogor (IPB). Ekstraksi DNA genomik dan amplifikasi fragmen DNA dengan teknik PCR dilakukan di laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, IPB. Purifikasi dan perunutan nukleotida dilakukan dengan mengirimkan sampel ke Macrogen Incorporation (Seoul – Korea Selatan). Uji patogenisitas dilakukan di rumah kasa Departemen Proteksi Tanaman, IPB.
Metode Pelaksanaan
Pengumpulan Sampel Tanaman Sakit
Sampel tanaman sakit diambil dari 11 lokasi sentra produksi jeruk di Indonesia (Tabel 1). Penentuan sampel dilakukan secara terarah (purposive) yaitu hanya pada tanaman jeruk yang menunjukkan gejala dan tanda terserang cendawan patogen BPB, yaitu gejala awal tampak berupa bercak basah yang berwarna gelap pada bagian kulit batang. Pembusukan dimulai dari pangkal batang dekat permukaan tanah sampai ke titik okulasi (40 cm). Jaringan kulit kayu bahkan permukaan kulit, kambium, dan kayu yang terserang mengalami perubahan warna, lama-kelamaan kulitnya akan mengelupas dan jatuh ke tanah sehingga menyebabkan luka lebar terutama pada serangan lanjut. Bagian kulit batang yang terserang, permukaannya cekung dan mengeluarkan blendok atau gum.
Tabel 1 Daftar lokasi pengambilan sampel tanaman sakit
Isolasi Phytophthora, Diplodia dan atau Botryodiplodia dari Jaringan Tanaman Sakit
Sampel tanah diambil pada kedalaman 15 sampai 25 cm dari permukaan tanah dan dari bagian rizosfer. Isolasipatogen dari sampel tanah dilakukan dengan cara pengumpanan pada buah apel dan jeruk. Pengumpanan dilakukan dengan cara melubangi buah apel dengan cork borer sedalam ± 1 cm, kemudian tanah dimasukkan ke dalam lubang tersebut, lalu diinkubasi selama 3 hari atau jika telah terlihat bercak berwarna coklat maka buah apel tersebut dibelah dan diambil bagian bercak yang agak jauh dari tanah yang menempel pada buah tersebut, kemudian dikulturkan pada media PDA dan V8. Cara isolasi lainnya adalah dengan menggenangi sampel tanah dengan air steril, kemudian buah jeruk sehat yang dilubangi diletakkan di atas genangan tanah tersebut dan diinkubasi sampai buah menunjukkan bercak coklat. Selanjutnya jaringan sakit diisolasi dan ditumbuhkan pada media PDA atau V8 untuk merangsang sporulasinya.
Isolasi Spora Tunggal Phytophthora, Diplodia dan atau Botryodiplodia
Isolasi spora tunggal dilakukan menurut Choi et al. (1999) yang telah dimodifikasi. Masing-masing isolat cendawan ditumbuhkan pada media yang sesuai selama 5 sampai 7 hari pada suhu kamar (± 25–30 oC), kemudian air steril dimasukkan ke dalam biakan tersebut dan disiapkan sebagai suspensi yang diencerkan sampai konsentrasi tertentu. Suspensi diteteskan ke water agar (WA) dan diinkubasi pada 25 oC selama 12–24 jam. Cawan petri tidak dibungkus agar tetesan suspensi mengering dan mengurangi kontaminasi. Spora diperiksa setelah 12 jam, selanjutnya setiap 24 jam untuk melihat perkecambahannya. Saat spora telah berkecambah, digunakan jarum steril untuk mengambil bagian agar yang mengandung spora. Bagian agar yang diambil harus setipis mungkin. Untuk memastikan bahwa spora yang diambil hanya satu maka slide tersebut disiapkan
preparat inokulum untuk pengamatan karakter secara mikroskopis digunakan protokol menurut AVRDC Mycology 2000 (Lampiran 3).
Identifikasi Phytophthora, Diplodia dan atau Botryodiplodia Berdasarkan Karakter Morfologi
Identifikasi spesies Phytophtora dilakukan berdasarkan kriteria morfologi sporangium dan papilla menurut Erwin & Ribeiro (1996) (Gambar 1), sedangkan
untuk spesies Diplodia dan atau Botryodiplodia dilakukan menggunakan kunci identifikasi morfologi piknidia dan konidia Diplodia sp.; piknidia,
pembentukan konidiofor dan konidia Botryodiplodia sp. menurut Barnett & Hunter (1998) (Gambar 2). Untuk keperluan ini, sporangium tunggal Phytophtora sp.
ditumbuhkan pada media PDA dan V8, sedangkan spora tunggal Diplodia sp. atau Botryodiplodia sp. ditumbuhkan pada PDA. Masing-masing biakan
ditumbuhkan pada suhu kamar selama beberapa hari atau sampai koloni memenuhi cawan petri diameter 9 cm.
Pengamatan dilakukan secara makroskopis dan mikroskopis. Pengamatan makroskopis dilakukan secara visual, sedangkan pengamatan mikroskopis
menggunakan mikroskop binokuler yang dilengkapi dengan mikrometer okuler dan mikrometer objektif. Pengamatan secara makroskopis yaitu warna
koloni, bentuk atau tipe koloni dan waktu atau lama tumbuh patogen yang diamati setiap hari dimulai sejak 1 HSI (Hari Setelah Isolasi) sampai koloni tumbuh memenuhi cawan petri diameter 9 cm. Pengamatan secara mikroskopis, terhadap karakter morfologis Phytophthora sp. meliputi bentuk dan ukuran (panjang dan
lebar) sporangium, sporangiofor, papilla, warna sporagiosfor, ada tidaknya sekat dan klamidospora; sedangkan karakter morfologis Diplodia sp. atau
Botryodiplodia sp. yang diamati yaitu pembentukan hifa, stroma, piknidia, konidiofor, klamidospora, bentuk dan ukuran konidium.
\ \
Gambar 2 Morfologi piknidia dan konidia Diplodia sp. (A) dan piknidia, pembentukan konidiofor dan konidia Botryodiplodia sp. (B) menurut Barnett & Hunter (1998), pembentukan konidia dan konidia Lasiodiplodia spp. (C) (Burgess et al. 2006)
Gambar 1 Morfologi sporangium dan papilla P. nicotianae (A), P. palmivora (B), dan P. citrophthora (C) menurut Erwin & Ribeiro (1996)
A
C
B
A B
Identifikasi Phytophthora spp., Diplodia spp. dan atau Botryodiplodia spp. Menggunakan Teknik PCR
Identifikasi secara molekuler dilakukan dengan amplifikasi daerah internal transcribed spacer (ITS) DNA ribosom (rDNA) dengan teknik PCR,
menggunakan pasangan primer universal cendawan yaitu primer forward
ITS4 (5’-TCCTCCGCTTATTGATATGC-3’) dan primer reverse ITS5
(5’-GGAAGTAAAAGTCGTAACAAGG-3’) (White et al. 1990).
Ekstraksi DNA Genomik Cendawan
Isolat cendawan ditumbuhkan pada medium potato dextrose broth (PDB) dalam tabung erlenmeyer sebanyak 100 ml, digoyang dengan kecepatan 125 rpm pada suhu kamar selama 7 hari. Miselia disaring dengan kertas Whatman nomor 1, dicuci dengan phosphate buffer saline (PBS) sebanyak 3 kali, dan siap digunakan untuk ekstraksi DNA.
Ekstraksi DNA cendawan patogen dilakukan menurut metode Abd-Elsalam et al. (2003) yang telah dimodifikasi. Miselium cendawan diinokulasi pada PDB selama 3 hari, kemudian dipanen dan digerus bersama nitrogen cair sampai halus. Selanjutnya ditambahkan bufer ekstraksi (200 mM Tris-HCl pH 8.5; 250 mM NaCl, 25 mM EDTA, 0.5% SDS) sebanyak 1 ml dan 10 µ l merkaptoetanol
kemudan dihomogenkan dengan cara divorteks. Setelah itu dipanaskan pada penangas air 65 oC selama 30 menit dan didinginkan pada suhu ruang.
Sebanyak 750 µ l chloroform isoamil (24:1) ditambahkan ke dalam tabung tersebut dan divorteks lagi kemudian dipresipitasi dengan sentrifugasi pada 11000 rpm selama 10 menit. Supernatan dipindahkan ke tabung yang baru dan ditambahkan dengan 1/10 volume Natrium asetat dan 2.5 x volume etanol
absolut, dihomogenkan, diinkubasi pada -20 oC selama 30 menit, dipresipitasi lagi pada 14000 rpm selama 10 menit. Pelet dicuci dengan dengan 500 µ l etanol 70%
Amplifikasi DNA
Amplifikasi DNA menggunakan pasangan primer universal cendawan ITS4 dan ITS5. Komponen dan komposisi bahan PCR disiapkan yaitu terdiri dari 15.3 µ l ddH2O; 2.5 µ l buffer 10x + Mg2+ ; 2.5 µl sucrose cresol 10x; 0.5 µ l dNTP 10 mM; masing-masing 1 µ l primer forward dan reverse; 0.2 µ l enzim Taq DNA polimerase rekombinan 5U/µ l; 2 µ l DNA sampel konsentrasi 25 – 50 ng/µ l. Volume campuran reaksi 25 µ l. Amplifikasi dilakukan dengan thermocycler
GeneAmp PCR System 9700 sebanyak 35 siklus melalui tiga tahapan, yaitu denaturasi awal suhu 94 oC selama 5 menit, denaturasi pada suhu 94 oC
selama 1 menit; penempelan primer (annealing) pada suhu 52 oC selama 1 menit;
dan pemanjangan (extension) pada suhu 72 oC selama 2 menit. Setelah 35 siklus, PCR dibiarkan pada suhu 72 oC selama 10 menit kemudian suhunya
diturunkan sampai 4 oC.
Visualisasi
Visualisasi hasil amplifikasi DNA dilakukan secara elektroforesis pada 1% gel agarosa TBE. Sebanyak 0.2 g agarosa, 20 ml 0.5x TBE dipanaskan pada microwave selama 1 menit, diaduk rata dan dibiarkan sampai hangat. Selanjutnya ditambahkan 1 µ l etidium bromida (0.5 µ l/10 ml agarosa) kemudian diaduk rata. Gel tersebut dimasukkan ke dalam cetakan, dibiarkan dingin dan mengeras (˃30 menit). Disiapkan 1 µ l loading buffer (6x), ditambahkan produk PCR 5 µ l, dimasukkan ke dalam sumuran. Ladder DNA diletakkan sesuai kebutuhan,
dielektroforesis dengan arus listrik 70 V selama 30 menit atau 130 volt selama 15 menit. Gel hasil elektroforesis diletakkan di atas transluminator ultra violet dan
difoto untuk dokumentasi.
Perunutan Nukleotida dan Analisis Filogenetik
dilakukan penjajaran menggunakan Clustal X (Thompson et al. 1997) dan Mega versi 4.0 (Tamura et al. 2007). Analisis homologi nukleotida dilakukan melalui basic local alignment search tool (BLAST). Untuk analisis filogenetik, masing-masing runutan isolat yang ditemukan pada penelitian ini dan runutan homologinya yang dipilih dari GeneBank (http://www.ncbi.nlm.nih.gov) disejajarkan menggunakan software ClustalW (http://www.ebi.ac.uk) kemudian hasil penjajaran nukleotida ditransfer ke Mega versi 4.0 (Tamura et al. 2007) untuk menghasilkan penjajaran final yang akan dipakai untuk membuat pohon filogenetik. Rekonstruksi filogeni menggunakan metode maximum parsimony (MP) dengan bootstrap 1000 kali. Perhitungan identitas matriks dilakukan untuk mengetahui kedekatan isolat cendawan asal Indonesia dengan isolat lainnya yang diambil dari GeneBank.
Uji Patogenisitas
HASIL DAN PEMBAHASAN
Identifikasi Cendawan Patogen BPB Berdasarkan Karakter Morfologi
Identifikasi berdasarkan karakter morfologi dilakukan untuk mengamati setiap isolat cendawan patogen BPB secara makroskopis dan mikroskopis. Untuk keperluan tersebut diawali dengan survai dan pengambilan sampel ke 11 lokasi sentra produksi jeruk di Indonesia (Tabel 1). Di antara kesebelas
lokasi tersebut, peneliti hanya berkesempatan untuk melakukan survai ke dua lokasi saja yaitu ke lokasi pembibitan jeruk di kebun percobaan (KP) Desa Punten (loka penelitian tanaman jeruk dan hortikultura subtropik, Kota Batu – Malang) dan lokasi penanaman jeruk di Kabupaten Timor Tengah Selatan (TTS), Propinsi
NTT. Di TTS (NTT), peneliti melakukan survai dan pengambilan sampel di 8 lokasi (desa dan kecamatan) yang diketahui mempunyai populasi jeruk cukup
banyak, yaitu Ajobaki dan Sikam (Mollo Utara), Oelbubuk dan Oelekam (Mollo Tengah), Oehala (Mollo Selatan), Fatumnasi (Fatumnasi), Kakan dan
Kuanfatu (Kuanfatu). Ketinggian tempat di TTS secara keseluruhan berkisar antara 750 – 1799 meter di atas permukaan laut (dpl), dengan rerata suhu 24 oC (NTT dalam Angka 2009).
Gambar 3 Gejala BPB di pembibitan jeruk di KP Punten (loka penelitian tanaman jeruk dan hortikultura subtropik, Batu–Malang). Batang yang terserang menjadi cekung dan mengeluarkan gum (A), bercak nekrosis mengelilingi batang (B), gum yang masih basah (C)
Gejala penyakit BPB pada tanaman jeruk dewasa hampir sama dengan gejala di pembibitan dan mudah dikenali. Namun pada tanaman dewasa yaitu pada kulit batangnya, terdapat banyak luka-luka yang meluas tapi dangkal yang lama-kelamaan akan mengelupas dan terlepas dengan sendirinya. Di bagian luka juga terlihat gum yang telah mengering sehingga kelihatan mengkilap sekalipun dilihat dari jarak yang cukup jauh. Pada serangan lanjut dapat menyebabkan kematian tanaman secara keseluruhan (Gambar 4).
Gambar 4 Gejala BPB di lapangan (Kabupaten TTS – NTT). Gum pada kulit batang (A); kulit batang yang mengelupas (B); bercak melingkari batang, berkembang ke bagian bawah dan meluas ke bagian akar tanaman yang menyebabkan kematian tanaman (C)
Gum yang telah mengering diambil dari pembibitan maupun dari lapangan dan diisolasi dalam medium PDA, namun tidak ditemui adanya patogen. Hal ini
A B C
sesuai dengan Naqvi (2004) yang menyatakan bahwa tanaman mengeluarkan gum sebagai reaksi tanaman atas serangan patogen, namun gum yang dikeluarkan tidak selalu mengandung patogen. Gum dihasilkan untuk melokalisasi patogen agar tidak berkembang lebih luas. Gum yang keluar dari permukaan kulit jaringan tanaman menunjukkan tingkat serangan yang sudah lanjut (Agrios 2005).
Diperoleh 12 isolat dari bagian pangkal batang sakit dan dari tanah (rizosfer) yang terdiri atas satu isolat Phytophthora sp. berasal dari Desa Oehala, TTS (NTT) dan 11 isolat Botryodiplodia sp. dan atau Diplodia sp. yang masing-masing berasal dari Berastagi (Sumatera Utara), Kampar (Riau), Muaro Jambi (Jambi), Tulang Bawang Barat (Lampung), Garut (Jawa Barat), Jember dan Batu – Malang (Jawa Timur), Bangli (Bali), TTS (NTT), Banjarmasin dan Banjarbaru (Kalimantan Selatan) (Tabel 2).
Tabel 2 Isolat patogen yang diperoleh dari bagian pangkal batang jeruk sakit dan dari tanah (rizosfer)
No Asal isolat Hasil isolasi
1 Oehala (TTS – NTT) Phytophthora sp.
2 Berastagi (Sumatera Utara) Botryodiplodia sp. dan atau Diplodia sp. 3 Kampar (Riau) Botryodiplodia sp. dan atau Diplodia sp. 4 Muaro Jambi (Jambi) Botryodiplodia sp. dan atau Diplodia sp. 5 Tulang Bawang Barat
(Lampung)
Botryodiplodia sp. dan atau Diplodia sp. 6 Garut (Jawa Barat) Botryodiplodia sp. dan atau Diplodia sp. 7 Jember (Jawa Timur) Botryodiplodia sp. dan atau Diplodia sp. 8 Batu – Malang (Jawa Timur) Botryodiplodia sp. dan atau Diplodia sp. 9 Bangli (Bali) Botryodiplodia sp. dan atau Diplodia sp. 10 TTS (NTT) Botryodiplodia sp. dan atau Diplodia sp. 11 Banjarbaru (Kalimantan
Selatan)
Botryodiplodia sp. dan atau Diplodia sp. 12 Banjarmasin (Kalimantan
Selatan)
Botryodiplodia sp. dan atau Diplodia sp.
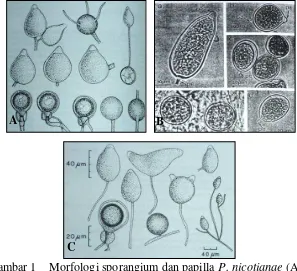
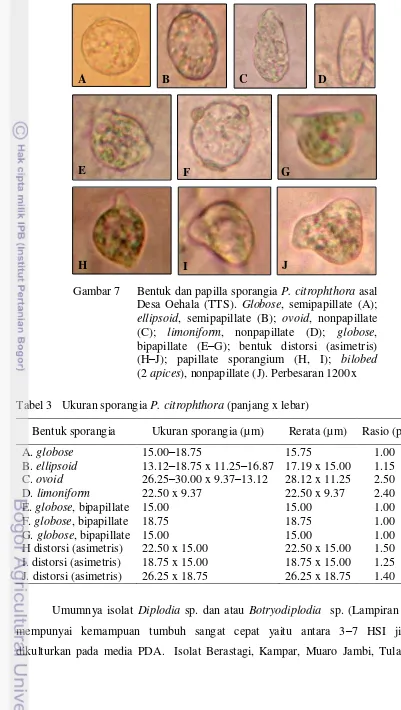
corraloid, hialin, halus sampai kasar, membengkak, bulat sampai lonjong (ovoid) dan tidak beraturan (Gambar 6 A–C). Klamidospora globose terbentuk secara interkalar (Gambar 6D). Terdapat beberapa bentuk sporangia (Gambar 7), yaitu globose (A, E–G), ellipsoid (B), ovoid (C), limoniform (D), dan beberapa bentuk distorsi atau asimetris (H–J). Masing-masing tipe sporangia mempunyai ukuran yang berbeda, dengan rerata 15.00–28.12 µm x 9.37–15.75 µm (Tabel 3).
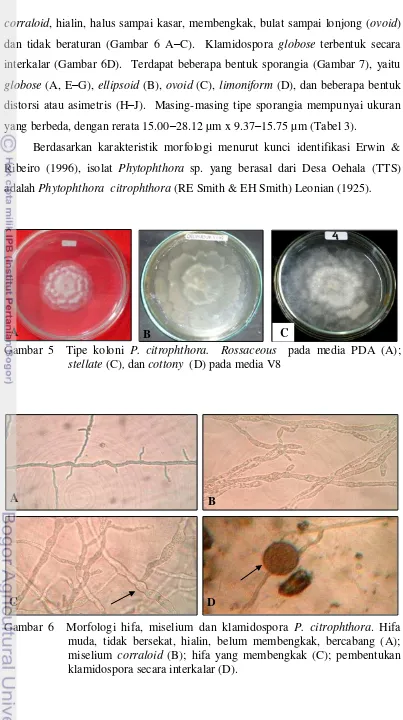
Berdasarkan karakteristik morfologi menurut kunci identifikasi Erwin & Ribeiro (1996), isolat Phytophthora sp. yang berasal dari Desa Oehala (TTS) adalah Phytophthora citrophthora (RE Smith & EH Smith) Leonian (1925).
Gambar 5 Tipe koloni P. citrophthora. Rossaceous pada media PDA (A); stellate (C), dan cottony (D)pada media V8
Gambar 6 Morfologi hifa, miselium dan klamidospora P. citrophthora. Hifa muda, tidak bersekat, hialin, belum membengkak, bercabang (A); miselium corraloid (B); hifa yang membengkak (C); pembentukan klamidospora secara interkalar (D).
A B C
C
A B
Gambar 7 Bentuk dan papilla sporangia P. citrophthora asal Desa Oehala (TTS). Globose, semipapillate (A); ellipsoid, semipapillate (B); ovoid, nonpapillate (C); limoniform, nonpapillate (D); globose, bipapillate (E–G); bentuk distorsi (asimetris) (H–J); papillate sporangium (H, I); bilobed (2 apices), nonpapillate (J). Perbesaran 1200x
Tabel 3 Ukuran sporangia P. citrophthora (panjang x lebar)
Bentuk sporangia Ukuran sporangia (µ m) Rerata (µm) Rasio (p/l) A. globose 15.00–18.75 15.75 1.00 B. ellipsoid 13.12–18.75 x 11.25–16.87 17.19 x 15.00 1.15 C. ovoid 26.25–30.00 x 9.37–13.12 28.12 x 11.25 2.50 D. limoniform 22.50 x 9.37 22.50 x 9.37 2.40 E. globose, bipapillate 15.00 15.00 1.00 F. globose, bipapillate 18.75 18.75 1.00 G. globose, bipapillate 15.00 15.00 1.00 H distorsi (asimetris) 22.50 x 15.00 22.50 x 15.00 1.50 I. distorsi (asimetris) 18.75 x 15.00 18.75 x 15.00 1.25 J. distorsi (asimetris) 26.25 x 18.75 26.25 x 18.75 1.40
Umumnya isolat Diplodia sp. dan atau Botryodiplodia sp. (Lampiran 6) mempunyai kemampuan tumbuh sangat cepat yaitu antara 3–7 HSI jika dikulturkan pada media PDA. Isolat Berastagi, Kampar, Muaro Jambi, Tulang
A B C D
G
J E
H
F
Bawang Barat, Garut, Batu – Malang, TTS, Banjarmasin dan Banjarbaru mampu memenuhi cawan petri pada 3 HSI, Jember pada 4 HSI dan Bangli pada 7 HSI. Koloni miseliumnya aerial, awalnya putih, setelah 4–5 hari menjadi hitam kehijauan sampai abu-abu, kemudian setelah 10 hari miselium menjadi hitam (Gambar 8).
Gambar 8 Perkembangan warna koloni miselium Diplodia sp. dan atau Botryodiplodia sp. dalam PDA pada suhu ruang (25–30 oC). Miselium aerial berwarna putih (A); permukaan atas berwarna abu-abu, permukaan bawah berwarna hitam kehijauan (B); miselium menjadi hitam (C).
Secara mikroskopis, hifa awalnya hialin kemudian menjadi coklat dan bersekat. Saat akan membentuk sekat, hifa awalnya berbentuk lonjong kemudian akan memanjang dan mengelembung (pear shape) pada ujung sekat (Gambar 9 A–D). Klamidospora terbentuk secara interkalar (Gambar 9 E, F).
Gambar 9 Pembentukan hifa dan klamidospora B. theobromae. Pembentukan hifa (A–D); pembentukan klamidospora secara interkalar (E, F)
A B C
D E F
Piknidia akan terbentuk jika kondisi lingkungan tidak menguntungkan, oleh karena itu piknidia akan lebih cepat tumbuh yaitu ± 2 minggu setelah isolasi jika isolat ditanam pada media yang miskin nutrisi yaitu WA yang diberi potongan jerami padi steril (Gambar 10D). Isolat yang diisolasi pada media PDA (Gambar 10 A, B), piknidia tumbuh sangat lambat yaitu ± 1 bulan setelah isolasi. Piknidia terbentuk secara berkelompok dalam stroma (Gambar 10B), sedangkan konidiofor tunggal (Gambar 10 H).
Gambar 10 Morfologi stroma, piknidia, konidia dan konidiofor B. theobromae. Piknidia pada PDA (A); piknidia terbentuk dalam stroma (B); stroma pada PDB (C); piknidia ditumbuhkan pada potongan jerami
padi dalam WA (D); piknidia pada potongan jerami padi (E); piknidia terbentuk secara berkelompok pada E diamati secara mikroskopis (300x) (F); massa konidia muda yang keluar dari dalam piknidia (100x) (G); konidiofor tunggal (400x) (H)
Konidia dihasilkan di dalam piknidia. Konidia terdiri dari konidia muda dan konidia matang. Keduanya berbentuk ovoid, dan ellipsoid, bedanya konidia muda hialin, dindingnya terdiri dari dua lapisan, granular dan tidak bersekat, sedangkan
C
D E
G
A B
F
konidia matang berwarna coklat, dinding selnya hanya satu lapisan, berwarna coklat tua dan memiliki satu sekat sehingga membentuk dua sel (Gambar 11).
Konidia yang dihasilkan masing-masing isolat dari setiap lokasi terlihat pada Lampiran 7. Konidia matang akan berwarna gelap (coklat) dan bersekat
hanya setelah keluar dari piknidia. Ukuran konidia bervariasi yaitu panjangnya 18.75–31.87 µ m dan lebarnya 11.25–18.75 µm, atau rerata panjang x lebar = 25.31 x 15.00 µm (Tabel 4).
Gambar 11 Konidia B. theobromae (perbesaran 400x pada mikroskop cahaya). Konidia muda yang tidak bersekat, transparan, dinding yang tebal (2 lapisan) dan granular (A); konidia matang yang bersekat, coklat dan bersekat (B); konidia muda dan konidia matang (C)
Berdasarkan hasil identifikasi menggunakan sistem klasifikasi Saccardo (Lampiran 5) menurut Barnett & Hunter (1998), 11 isolat dari setiap lokasi yang berbeda diketahui memiliki karakter antara lain konidia terbentuk dalam badan buah aseksual (piknidia); konidia berbentuk globose dan atau ellipsoid; umumnya konidia terdiri dari 2 sel; konidia berpigmen gelap; dan piknidia terbentuk secara berkelompok di dalam stroma. Dari beberapa karakter di atas diketahui bahwa isolat-isolat tersebut memiliki karakter yang merupakan ciri khas Botryodiplodia theobromae Pat.. Menurut Timmer et al (2000), B. theobromae Pat. merupakan sinonim dari Lasiodiplodia theobromae (Pat.) Griffon dan Maubl. dan Diplodia natalensis Pole-Evans; sedangkan teleomorphnya yaitu Botryosphaeria rhodina (Cooke) Arx). Jika dibandingkan dengan beberapa sumber pustaka, antara lain menurut Phillips (2002) konidia Lasiodiplodiaspp. pada awalnya hialin kemudian menjadi berwarna dan memiliki satu sekat. Melanin tersimpan dalam bantuk garis yang teratur dan tetap pada bagian sebelah dalam dinding konidia, sehingga