PENAPISAN HEPADNAVIRUS SECARA SEROLOGIK DAN
MOLEKULER PADA MONYET EKOR PANJANG
(
Macaca fascicularis
) DI HABITAT
EX-SITU
INTAN CITRANINGPUTRI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Penapisan Hepadnavirus secara Serologik dan Molekuler pada Monyet Ekor Panjang (Macaca fascicularis) di Habitat Ex-situ adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
INTAN CITRANINGPUTRI. Penapisan Hepadnavirus secara Serologik dan Molekuler pada Monyet Ekor Panjang (Macaca fascicularis) di Habitat Ex-situ. Dibimbing oleh JOKO PAMUNGKAS, DIAH ISKANDRIATI dan RADEN PUTRATAMA AGUS LELANA.
Penemuan infeksi virus hepatitis B (VHB) monyet ekor panjang (Macaca fascicularis) di Pulau Mauritius pada tahun 2013 merupakan temuan baru yang menunjukan bahwa penyakit ini dapat menginfeksi jenis satwa primata dari famili Cercopithecidae. Temuan tersebut hanya dilaporkan pada M. fascicularis yang berada di benua Afrika, sehingga menjadi alasan dilakukannya investigasi pada M. fascicularis asal Indonesia. Untuk mendapatkan gambaran keadaan tersebut, sampel darah M. fascicularis diambil dari berbagai lokasi habitat ex-situ.
Uji penapisan terhadap antigen permukaan virus hepatitis B (Hepatitis B surface antigen, HBsAg) dilakukan pada 95 sampel plasma dan serum M. fascicularis yang berasal dari penangkaran, pusat penyelamatan satwa, dan topeng monyet. Upaya pemeriksaan DNA VHB dilakukan pada sampel yang menunjukan hasil seropositif terhadap HBsAg. Uji penapisan menunjukan bahwa sebanyak 11 dari 95 (11.6%) sampel reaktif terhadap HBsAg. Antigen permukaan virus hepatitis B lebih banyak ditemukan pada monyet di pusat penyelamatan satwa dan topeng monyet (55%) dibandingkan dengan satwa penangkaran (45%).
Hasil seropositif HBsAg pada sampel M. fascicularis yang diperiksa dengan teknik ELISA menggunakan kit HBsAg manusia mengindikasikan adanya kemiripan protein antigen permukaan VHB manusia dengan yang ditemukan pada M. fascicularis, karena antibodi monoklonal yang digunakan dalam uji ELISA pada penelitian ini bersifat spesifik mengikat HBsAg manusia. Meskipun uji PCR terhadap sampel tersebut tidak menunjukkan adanya DNA VHB, hasil seropositif HBsAg mengindikasikan bahwa M. fascicularis dapat terinfeksi VHB atau virus yang mirip VHB secara alami.
Kata kunci: virus hepatitis B, monyet ekor panjang, habitat ex-situ
SUMMARY
INTAN CITRANINGPUTRI. Serologic and Molecular Screening for Hepadnavirus among Long-Tailed Macaques (Macaca fascicularis) In Ex-Situ Habitats. Supervised by JOKO PAMUNGKAS, DIAH ISKANDRIATI and RADEN PUTRATAMA AGUS LELANA.
The report the hepatitis B virus (HBV) infection in long-tailed macaque (Macaca fascicularis) from the Mauritius Island in 2013 is a new finding shows that the virus can infect primate species of the family Cercopithecidae. The findings were only reported in M. fascicularis located as part of African continent, generating the rationale for an investigation on the virus from M. fascicularis in Indonesia. To obtain general situation about HBV in M. fascicularis in Indonesia, blood samples were taken from M. fascicularis several ex-situ habitat locations.
Screening test against hepatitis B virus surface antigen (HBsAg) was performed on 95 plasma and serum samples of M. fascicularis obtained from breeding facilities, wildlife rehabilitation centers, and performance monkeys. Efforts to do HBV DNA examination were carried out on samples that showed seropositive for HBsAg. The results showed that 11 of 95 (11.6%) samples were reactive to HBsAg. Hepatitis B virus surface antigen is more prevalent in monkeys from wildlife rescue center and performance monkeys (55%) compared with M. fascicularis from breeding facilities (45%).
Seropositive results to HBsAg in samples from M. fascicularis tested by ELISA kit of human HBsAg indicates similarities of HBsAg found in humans, based on the fact that monoclonal antibodies used in ELISA assay in this study are specific for human HBsAg. Although the PCR testing on these samples did not indicate the presence of HBV DNA, HBsAg seropositivity results are strong indication that M. fascicularis can be naturally infected by HBV or HBV-like virus.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Primatologi
PENAPISAN HEPADNAVIRUS SECARA SEROLOGIK DAN
MOLEKULER PADA MONYET EKOR PANJANG
(
Macaca fascicularis
) DI HABITAT EX-SITU
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Penapisan Hepadnavirus Secara Serologik dan Molekuler pada Monyet Ekor Panjang (Macaca fascicularis) di Habitat Ex-Situ Nama : Intan Citraningputri
NIM : P053120031
Disetujui oleh Komisi Pembimbing
Dr drh Joko Pamungkas, MSc Ketua
Dr drh Diah Iskandriati Anggota
Dr drh R P Agus Lelana, SpMP MSi Anggota
Diketahui oleh
Ketua Program Studi Primatologi
Prof drh Dondin Sajuthi, MST, PhD
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan penyusunan tesis yang berjudul Penapisan Hepadnavirus secara Serologik dan Molekuler pada Macaca fascicularis di Habitat Ex-situ. Tesis ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains Sekolah Pascasarjana Institut Pertanian Bogor.
Proses penulisan tesis ini tidak terlepas dari dukungan berbagai pihak. Oleh karena itu, dengan rasa tulus dan hormat, Penulis mengucapkan banyak terima kasih kepada Dr drh Joko Pamungkas, MSc sebagai ketua komisi pembimbing, Dr drh Diah Iskandriati dan Dr drh R P Agus Lelana, SpMP MSi sebagai anggota komisi pembimbing yang telah dengan sabar meluangkan banyak waktu dalam memberikan arahan dan masukan kepada penulis. Ucapan terima kasih penulis haturkan kepada Dr Uus Saepuloh, SSi MBiomed sebagai penguji luar komisi atas masukan dan saran yang diberikan. Terima kasih kepada Prof drh Dondin Sajuthi, MST PhD sebagai Ketua Program Studi serta seluruh dosen maupun tenaga kependidikan program studi Primatologi SPS IPB yang telah turut medukung studi penulis.
Ucapan terima kasih penulis haturkan kepada Dr Ir Entang Iskandar, MSi sebagai pihak program studi Primatologi SPS IPB; Karmele Llano Sanchez, drh Wendi Prameswari, dan drh Nur Purba Priambada sebagai pihak International Animal Rescue Indonesia; Dr Uus Saepuloh, SSi MBiomed, Rachmitasari Noviana, SSi MSi, rekan-rekan Laboratorium Mikrobiologi & Imunologi, dan Laboratorium Bioteknologi PSSP LPPM-IPB yang telah memfasilitasi dan mendukung penelitian yang penulis lakukan.
Terima kasih kepada ibu, bapak, suami, dan anak yang dengan tulus dan sabar memberikan doa, motivasi maupun semangat dalam setiap aktivitas yang penulis lakukan. Terima kasih juga penulis ucapkan kepada keluarga besar yang turut memotivasi dan menginspirasi penulis selama menjalani perkuliahan. Terima kasih kepada teman-teman Primatologi (2012/2013) (Ibu Yanti, Mas Yana, M Faisal RK, SHut MSi, Indri Hapsari, SSi, Agus Pambudi Dharma, SSi MSi), dan kakak Pangudi Citraningputra, SKomp MKomp yang selalu semangat dalam menempuh pendidikan magister bersama-sama.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 3
Virus Hepatitis B 3
Monyet Ekor Panjang (Macaca fascicularis) 10
Uji Serologi ELISA 14
Identifikasi Langsung Asam Nukleat Virus 15
Survei Cross sectional 16
3 METODE 17
Tempat dan Waktu Penelitian 17
Bahan 17
Alat 17
Tahapan Pemeriksaan Sampel 18
Pengumpulan dam Pemrosesan Sampel 18
Uji Serologi terhadap HBsAg 18
Isolasi DNA dan Amplifikasi 19
Prosedur Polymerase Chain Reaction (PCR) dan Elektroforesis 19
Analisis Data 20
4 HASIL DAN PEMBAHASAN 21
Deteksi Antigen Hepatitis B secara Serologis dengan ELISA 21
Deteksi Hepatitis B dengan PCR 23
5 SIMPULAN DAN SARAN 255
Simpulan 255
Saran 255
DAFTAR PUSTAKA 26
LAMPIRAN 31
DAFTAR TABEL
1 Pasangan primer untuk mendeteksi gen core dan surface HBV pada
satwa primata 15
2 Campuran reaksi PCR 20
3 Primer oligonukleotida yang digunakan untuk mengamplifikasi daerah
gen pre-S1 20
4 Prevalensi infeksi Hepatitis B pada sampel yang dikoleksi dari Pusat Studi Satwa Primata (PSSP) LPPM-IPB dan Pusat Penyelamatan Satwa
pada Juni 2014 hingga Februari 2015 21
5 Hasil pengujian ELISA antigen Hepatitis B (HBsAg) yang reaktif 22
DAFTAR GAMBAR
1. Gambaran skematik organisasi genom VHB (Zhang 2011) 4 2. Siklus hidup virus Hepatitis B (Lu dan Block 2004) 8 3. Pola penanda serologik pada infeksi akut dan kronis (Dienstag dan
Isselbacher 1998) 9
4. Kedekatan antara monyet ekor panjang dengan pemiliknya (a), kontak langsung dengan mukosa tubuh (b), saling berbagi makanan (c). 12
5. Desain Penelitian 18
6. Hasil amplifikasi PCR virus hepatitis B Regio Pre-S1 pada sampel
seropositif HBsAg. (1) individu T3336, (2) T3199, (3) T3331, (4) J190111B, (5) J300511C, (6) Nala, (7) Matu, (8) Pandu, (9) Brahma, (10) Awi, (11) TM SL3, (12) kontol postitif VHBHu, (13) kontrol positif VHBGi, (14) kontrol positif VHBOu, (15) kontrol negatif. 23
DAFTAR LAMPIRAN
1
PENDAHULUAN
Latar Belakang
Hepatitis merupakan penyakit peradangan pada organ hati yang umumnya disebabkan oleh infeksi virus (WHO 2002). Penyakit viral hepatitis merupakan penyebab utama sirosis dan kanker hati (CDC 2010). Salah satu virus penyebab hepatitis pada manusia yang menimbulkan dampak global yang besar ialah virus hepatitis B (VHB) (WHO 2002). Virus hepatitis B yang berasal dari keluarga hepadnavirus. Hepadnavirus dapat ditemukan pada unggas (avihepadnavirus) dan mamalia (orthohepadnavirus) terutama primata (Glebe 2007). Infeksi hepatitis B memiliki tingkat endemisitas yang tinggi di Indonesia, dengan prevalensi HBsAg positif 9.4% dari 10391 sampel serum, menunjukan bahwa diantara 10 penduduk di Indonesia terdapat seorang penderita Hepatitis B virus (Dirjen PP & PL Kemenkes RI 2012). Diantara negara-negara anggota WHO SEAR (World Health Organization South East Asian Region) Indonesia merupakan negara dengan kasus Hepatitis B nomor 2 terbesar setelah Myanmar (Dirjen PP & PL Kemenkes RI 2012).
Walaupun umumnya VHB diketahui sebagai penyakit pada populasi manusia, namun beberapa penelitian telah mempublikasikan prevalensi VHB pada satwa primata, terutama yang berada di penangkaran dan satwa primata yang tertular VHB dari manusia (Heckel et al. 2001; Bancroft et al. 1977). Di habitat alam, infeksi VHB satwa primata telah diidentifikasi pada jenis owa (GiHBV), orangutan (OuHV), simpanse (ChHBV), gorilla (GoHBV), dan woolly monkey (WMHBV) (Warren et al.1999; Mason et al. 2006). Berbagai studi menyebutkan bahwa hepadnavirus pada satwa primata secara genetik berbeda dari VHB manusia (Warren et al. 1999; Hu et al. 2000).
Diantara tingginya prevalensi infeksi hepatitis B pada jenis kera dan Atelidae (woolly monkey), belum ada infeksi VHB yang dilaporkan terjadi pada jenis primata kecil Cercopithecidae. Hingga pada tahun 2013, dilaporkan adanya temuan baru hepadnavirus yang secara genetik dekat dengan VHB manusia pada monyet ekor panjang (Macaca fascicularis) dari Pulau Mauritius (Dupinay et al. 2013). Baru-baru ini, Lelana et al. (2014) melakukan penelitian dan survei berbagai agen penyakit patogen, salah satunya penyakit Hepatitis B pada topeng monyet di daerah DKI Jakarta, Jawa Barat, dan Jawa Tengah. Hasil penelitian menunjukan bahwa antibodi terhadap Hepatitis B terdeteksi sebanyak 8.9% (4/45), namun dari semua sampel seropositif, DNA virus hepatitis B tidak terdeteksi.
2
Deteksi infeksi VHB dapat dilakukan melalui pemeriksaan secara serologis terhadap antigen permukaan dan antibodi terhadap VHB dengan ELISA, selain itu DNA viral VHB dapat dideteksi melalui uji polimerase chain reaction (PCR) (Heckel et al. 2001, Dupinay et al. 2013). Penanganan penyakit kronik Hepatitis B umumnya lama, mahal, hanya efektif sebagian dan sering menyebabkan munculnya varian resisten (Tillmann 2007). Saat ini pendekatan imunoterapi diharapkan mampu mengembalikan respon imun humoral dan spesifik untuk kasus ini, namun dari segi penelitian biomedis, belum ditemukan satwa primata kecil yang cocok sebagai hewan model virus Hepatitis B (Gheit et al. 2002; Dupinay et al. 2013).
Perumusan Masalah
Dalam penelitian Dupinay et al. (2013) dan Lelana et al. (2014) telah dilaporkan infeksi VHB pada monyet ekor panjang. Namun, masih diperlukan banyak data dan informasi untuk mengidentifikasi dan membuktikan bahwa monyet ekor panjang di Indonesia dapat terinfeksi VHB. Mengingat monyet ekor panjang terdistribusi di dalam habitat in-situ maupun di lingkungan sekitar masyarakat, maka penelitian mengenai keberadaan VHB pada monyet ekor panjang sangat diperlukan. Dengan alasan tersebut, sampel pada penelitian ini diambil dari berbagai lembaga ex-situ yang menangani monyet ekor panjang, baik di fasilitas penangkaran dan pusat penyelamatan satwa.
Tujuan Penelitian
Tujuan penelitian ini ialah untuk melakukan investigasi dan mengetahui angka prevalensi Hepadnavirus pada Macaca fascicularis.
Manfaat Penelitian
Hasil penelitian ini diharapkan menjadi sumbangan pemikiran untuk:
1. Bidang biomedis: penemuan Hepadnavirus pada Macaca fascicularis dapat mempresentasikan hewan model baru untuk pendekatan pengembangan terapi anti-VHB.
2. Bidang biosafety: informasi hasil penelitian dapat menjadi pertimbangan biosafety, program vaksinasi personel yang menangani satwa atau sampel asal M.fascicularis.
3
2
TINJAUAN PUSTAKA
Virus Hepatitis B
Klasifikasi Taksonomi
Berdasarkan ICTV (International Committee on Taxonomy of Viruses), virus Hepatitis B (VHB) merupakan spesies virus prototype dari famili Hepadnaviridae. Famili virus ini terdiri dari dua genus, yaitu Avihepadnavirus yang menyebabkan Hepatitis B pada unggas, dan Orthohepadnavirus yang menyebabkan Hepatitis B pada mamalia, khususnya primata. Dalam genus Orthohepadnavirus, terdapat virus penyebab hepatitis untuk spesies lain, seperti Ground squirrel hepatitis virus, Woodchuck hepatitis virus, dan Woolly monkey hepatitis B virus (Mason et al. 2006).
Virus hepatitis B bersifat hepatotrofik, bereplikasi di dalam organ hati namun dapat juga bertahan diluar hati, dan hal ini berkaitan dengan derajat penyakit hepatitis akut dan kronis. VHB berupa virus dengan material genetik DNA untai ganda sebagian, memiliki strategi replikasi yang unik sebagai virus DNA pada hewan (Seeger 1991). Virus ini menggunakan RNA intermediet dan cara reverse transcription, sehingga dalam klasifikasi Baltimore, virus Hepatitis B digolongkan pada grup VII, dimana Hepadnaviridae memiliki DNA untai ganda dengan RNA Intermediate (dsDNA-RT).
Virologi Virus Hepatitis B
Virus Hepatitis B ditemukan oleh Blumberg pada tahun 1965 sebagai antigen Australia, karena antigen ini didapatkan dari bangsa Aborigin Australia. Dane et al. melakukan pemeriksaan dengan miskroskop imunoelektron dan menemukan partikel virus yang memiliki antigen di permukaannya. Bentuk partikel VHB antara lain bulat dan berupa filamen panjang. Partikel VHB bulat berdiameter 42 nm dengan nukleocapsid (inti) yang dikelilingi lapisan luar berupa lipid bilayer dengan kompleks glikoprotein (Seeger dan Mason 2000).
Lapisan pertama permukaan VHB merupakan lapisan selubung luar (envelope) dengan ketebalan 7 nm, berisi antigen surface Hepatitis B (HBsAg). Selubung luar virion terdiri atas 3 jenis protein yang disebut protein major, sedang, dan besar yang ketiganya disandi oleh gen yang berbeda. Sintesis major protein diatur oleh regio gen-S, protein sedang diatur oleh pre-S2 + S, dan protein besar diatur oleh pre-S1 + pre-S2 + S. Dalam rantai asam amino yang sintesisnya diatur oleh gen pre-S, terdapat reseptor dari polimer albumin serum manusia pHSA (polymerized Human serum albumin) reseptor, dimana pada hepatosit inang juga memiliki reseptor sejenis. Sehingga, diperkirakan bahwa partikel VHB berinteraksi dengan hepatosit inang melalui anti-reseptor di permukaan VHB dengan perantara pHSA (Hendrarahardja 1990).
4
Organisasi Genom Virus Hepatitis B
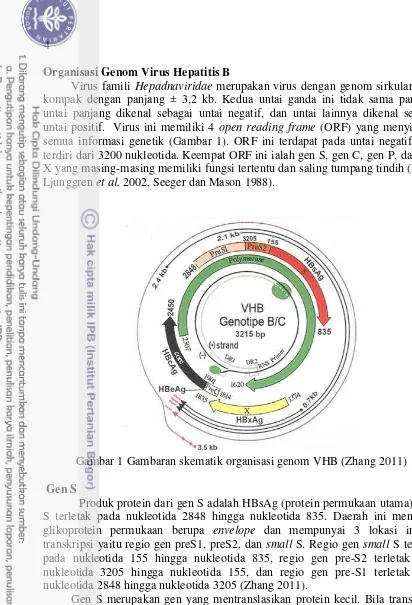
Virus famili Hepadnaviridae merupakan virus dengan genom sirkular yang kompak dengan panjang ± 3,2 kb. Kedua untai ganda ini tidak sama panjang, untai panjang dikenal sebagai untai negatif, dan untai lainnya dikenal sebagai untai positif. Virus ini memiliki 4 open reading frame (ORF) yang menyimpan semua informasi genetik (Gambar 1). ORF ini terdapat pada untai negatif yang terdiri dari 3200 nukleotida. Keempat ORF ini ialah gen S, gen C, gen P, dan gen X yang masing-masing memiliki fungsi tertentu dan saling tumpang tindih (Kidd-Ljunggren et al. 2002, Seeger dan Mason 1988).
Gambar 1 Gambaran skematik organisasi genom VHB (Zhang 2011) Gen S
Produk protein dari gen S adalah HBsAg (protein permukaan utama). Gen S terletak pada nukleotida 2848 hingga nukleotida 835. Daerah ini menyandi glikoprotein permukaan berupa envelope dan mempunyai 3 lokasi inisiasi transkripsi yaitu regio gen preS1, preS2, dan small S. Regio gen small S terletak pada nukleotida 155 hingga nukleotida 835, regio gen pre-S2 terletak pada nukleotida 3205 hingga nukleotida 155, dan regio gen pre-S1 terletak pada nukleotida 2848 hingga nukleotida 3205 (Zhang 2011).
5 determinan ‘a’ merupakan target diagnostik (Weinberger et al. 2000, Chiou et al. 1997). Sifat conserved dan struktur lengkung ganda dipertahankan dengan ikatan disulfida yang terletak pada posisi asam amino 121, 124, 137, 138, 139, 147, dan 149. Lengkung pertama terletak pada asam amino 124 hingga 137, sedangkan lengkung kedua terletak pada asam amino 139 hingga 147. Lengkung kedua merupakan struktur yang paling conserved diantara daerah lainnya (Tedja 2002).
Apabila inisiasi transkripsi dimulai pada regio gen pre-S2 hingga S maka dibentuk protein sedang dengan panjang 281 asam amino. Protein ini bersifat hidrofilik dan berisi satu epitop. Pada lokasi ini juga terdapat tempat pengikatan pHSA yang mempermudah virus masuk ke dalam hepatosit (Tedja 2002).
Apabila inisiasi transkripsi dimulai dari gen pre-S1 hingga S, maka akan dibentuk protein besar dengan panjang asam amino yang bervariasi, yaitu antara 389 hingga 400. Chisari et al. (1989) melaporkan bahwa protein besar dapat menghambat sekresi HBsAg. Selain itu, apabila produksi protein besar berlebihan akan menyebabkan nekrosis hepatoseluler yang mengarah pada karsinoma hepatoseluler. Pada daerah pre-S1 terdapat daerah pengikatan virus ke hepatosit pada asam amino 21-47 sehingga diperkirakan daerah pre-S1 dan Pre-S2 memegang peranan penting pada replikasi virus dan patogenesis penyakit hepatitis B (Lok et al. 2001).
Gen Core
Gen Core terletak pada posisi nukleotida 1814-2450 (Zhang 2011). Gen ini menyandi antigen Core Hepatitis B (HBcAg) yang merpakan polipeptida komponen utama nukleokapsid. Apabila inisiasi transkripsi dimulai dari kodon pre-C hingga C, maka akan dibentuk molekul peptida besar dengan panjang 214 asam amino dengan berat molekul 19 kD, yang dikenal dengan antigen e Hepatitis B (HBeAg). Antigen ini disekresikan saat inang dalam keadaan infeksius (Tedja 2002).
Apabila inisiasi transkripsi dimulai dari daerah C, tanpa melibatkan pre-C, yaitu pada nukleotida 1901-2450, maka akan dibentuk protein HBcAg dengan panjang 183 asam amino. Partikel HBcAg ini merupakan target penting dalam pengenalan respon imun terhadap infeksi VHB. Antibodi terhadap HBcAg (anti-HBc) merupakan satu-satunya indikasi bahwa inang pernah atau sedang terinfeksi VHB (Tedja 2002, Feitelson 1994).
Gen P
Gen P (polymerase) terletak pada nukleotida 2307-1620 dan merupakan daerah ORF yang terbesar. Gen P berfungsi dalam menyandi DNA polimerase. Enzim ini memiliki 2 aktivitas, yaitu sebagai DNA-dependent DNA polymerase dan RNA-dependent reverse transcriptase (Zhang 2011, Dienstag dan Isselbacher 1998).
Gen X
6
produknya tidak terdapat pada non-mamalia hepadnavirus (Dienstag dan Isselbacher 1998).
Epidemiologi Hepatitis B
Pada Manusia
Hepatitis B merupakan salah satu penyakit menular yang paling umum dan serius di dunia. Diperkirakan lebih dari sepertiga penduduk dunia terinfeksi virus Hepatitis B. Infeksi ini menyebar pada individu lain serta dapat menyebabkan adanya reservoir yaitu penderita hepatitis B kronik (kronik karier). Sekitar lebih dari 200 juta orang ialah kronik karier VHB. Hampir 25% penderita karier mengalami penyakit hati yang serius seperti kronik hepatitis, sirosis, dan hepatocellular carcinoma. Infeksi VHB menyebabkan kematian pada lebih dari 1 juta orang per tahun (Soemohardjo 1990, Dienstag dan Isselbacher 1998, Hollinger dan Liang 2001).
Hingga saat ini belum ditemukan vektor yang berpotensi sebagai pembawa virus hepatitis B. Berdasarkan penelitian yang dilakukan oleh Tahitoe (1995), HBsAg dapat bertahan dalam tubuh nyamuk A.aegypti selama 3 hari, dan kemudian levelnya menurun, sehingga belum dapat dikatakan nyamuk A.aegypti sebagai vektor penyakit hepatitis B.
Subtipe dari strain VHB digunakan untuk tujuan epidemiologi, pelacakan rantai infeksi nosokomial, dan untuk menemukan hubungan antara penyakit dan subtipe tertentu. Ada 4 subtipe utama HBsAg yaitu adw, adr, ayw, dan ayr. Subtipe juga berhubungan dengan faktor etnik dan genetik, terutama pada kasus hepatitis kronik. Namun, pada dekade terakhir, pembagian subtipe secara bertahap telah digantikan dengan genotipe (Kidd-Ljunggren 2002).
Genotipe VHB A dapat ditemukan di Baratlaut Eropa, Amerika Utara, Filipina, Hongkong, Afrika Selatan, dan Afrika Timur. Genotipe VHB B dan C merupakan indigenous pada populasi penduduk di Asia tenggara. Genotipe C juga ditemukan di Jepang dan kepulauan selatan di Lautan Pasifik. Genotipe D merupakan yang paling banyak tersebar di dunia, prevalensi tertinggi terdapat pada Eropa Selatan dan Afrika Utara. Genotipe E ditemukan di Afrika Barat dan Selatan. Genotipe F ditemukan di Amerika selatan dan Tengah. Genotipe G ditemukan di Perancis dan Amerika Serikat. Epidemiologi infeksi VHB di Indonesia bedasarkan prevalensi HBs antigenemia berkisar antara 3 - 20%. Subtipe HBsAg utama di Indonesia adalah adw, adr, dan ayw. (Soemohardjo 1990).
Pada Satwa Primata
Infeksi virus Hepatitis B selain strain yang berbeda dari genotipe VHB manusia, telah teridentifikasi terdapat pada owa (Hylobates sp., Nomascus sp.) (GiHBV), orangutan (Pongo pygmaeus) (OuHBV), simpanse (Pan troglodytes) (ChHBV) gorila (Gorilla gorilla) (GoHBV), dan woolly monkey (Lagothrix lagotricha) (WMHBV) (Warren et al.1999, Mason et al. 2006).
7 Berdasarkan analisis filogenetik menunjukan bahwa terdapat perbedaan cabang filogenetik antara VHB manusia genotype A-E, VHB kera, VHB manusia genotype F, dan VHB monyet dunia baru Woolly monkey (WMVHB). Dupinay et al. (2013) melaporkan bahwa di alam, ditemukan infeksi virus hepatitis B pada monyet ekor panjang yang berada di Pulau Mauritius. Temuan ini merupakan laporan pertama adanya infeksi kronik virus hepatitis B pada cercopithecine yang secara imunologi dekat dengan manusia.
Patogenesis Virus Hepatitis B
Penyakit hepatitis B pada manusia memiliki masa inkubasi infeksi sekitar 45-120 hari, dengan rata-rata 60-90 hari. Variasi tersebut tergantung jumlah virus yang menginfeksi, cara penularan, dan faktor host (WHO 2002). Patogenesa penyakit hepatitis B dimulai saat dimulainya replikasi virus di dalam tubuh inang. Replikasi virus sebagian besar terjadi di sel hati. Proses replikasi virus secara umum terjadi dalam beberapa tahap, yaitu perlekatan (attachment), penetrasi, uncoating, ekspresi gen, replikasi genom, perakitan (assembling), dan pelepasan (release).
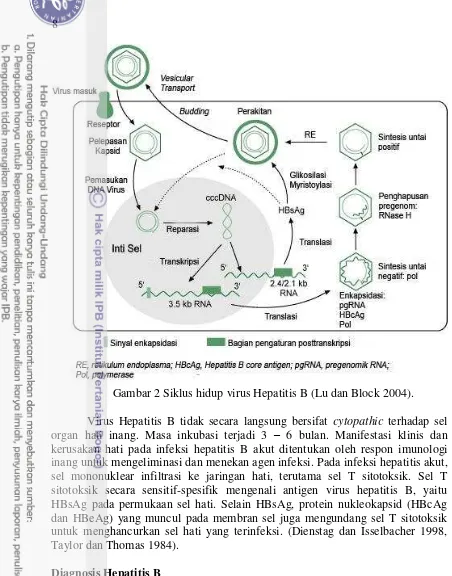
Mekanisme replikasi VHB pada manusia, dimulai dengan perlekatan protein permukaan virion pada reseptor spesifik di membran sel hati inang yang dapat terjadi melalui beberapa cara. Pertama, melalui reseptor spesifik pada permukaan hepatosit yang mengenali dan mengikat daerah pre-S1 LHBs. Cara kedua, melalui reseptor p-HSA (polymerized human serum albumin) yang terdapat pada daerah gen pre-S2 (Tedja 2002). Setelah terjadinya fusi membran, partikel core kemudian ditransfer ke sitoplasma dan selanjutnya dilepaskan ke dalam nukleus (genom release), selanjutnya DNA VHB yang masuk ke dalam nukleus mula-mula berupa untai DNA yang tidak sama panjang yang kemudian akan terjadi proses DNA repair berupa pemanjangan rantai DNA yang pendek sehingga menjadi dua untai DNA yang sama panjang atau covalently closed circle DNA (cccDNA) (Hardjoeno 2007).
Covalently closed circle DNA (cccDNA) merupakan cetakan (template) untuk propagasi RNA pre-genom selanjutnya (tahap transkripsi). RNA pre-genom mempunyai peranan penting sebagai cetakan pada translasi protein core dan polymerase virus, dan sebagai cetakan untuk sintesis DNA untai negatif melalui proses transkripsi balik yang terjadi di dalam nukleus. Setelah untai negatif di bentuk, maka untai positif akan dibentuk dari DR2 (Direct Repeat 2) pada ujung 5’ untai negatif. Pada proses ini terjadi template transfer yang menyebabkan terbentuknya genom VHB yang sirkuler/rc DNA. Bentuk RNA yang lain akan mengalami proses translasi menjadi protein masing-masing sesuai mRNA nya di ribosom (Lu dan Block 2004, Lok et al. 2001).
8
Gambar 2 Siklus hidup virus Hepatitis B (Lu dan Block 2004). Virus Hepatitis B tidak secara langsung bersifat cytopathic terhadap sel organ hati inang. Masa inkubasi terjadi 3 – 6 bulan. Manifestasi klinis dan kerusakan hati pada infeksi hepatitis B akut ditentukan oleh respon imunologi inang untuk mengeliminasi dan menekan agen infeksi. Pada infeksi hepatitis akut, sel mononuklear infiltrasi ke jaringan hati, terutama sel T sitotoksik. Sel T sitotoksik secara sensitif-spesifik mengenali antigen virus hepatitis B, yaitu HBsAg pada permukaan sel hati. Selain HBsAg, protein nukleokapsid (HBcAg dan HBeAg) yang muncul pada membran sel juga mengundang sel T sitotoksik untuk menghancurkan sel hati yang terinfeksi. (Dienstag dan Isselbacher 1998, Taylor dan Thomas 1984).
Diagnosis Hepatitis B
9 status infeksi kronis pada spesies owa dan simpanse (Noppornpanth et al. 2003, Payne 2004).
Penelusuran VHB DNA dilakukan dengan metode PCR, dan dilakukan sekuens pada regio pre-S, regio envelope dan core telah dilakukan oleh banyak peneliti pada isolat asal woolly monkey, owa, simpanse, gorila, dan orangutan. Analisis filogenetik dilakukan pada hasil sekuens untuk menentukan hubungan genetik virus antara isolat tersebut dengan spesies lain maupun VHB manusia (Grethe et al. 2000, Sa-nguanmoo et al. 2008, Payne 2004).
Diagnosis infeksi virus hepatitis B pada manusia mengacu pada deteksi penanda serologik dan dilihat juga gejala klinis yang muncul. Pada beberapa kasus infeksi asimptomatik, diagnosis hanya dapat diketahui oleh penanda serologik. Pada Gambar 3 digambarkan hubungan antara munculnya penanda serologik dan gelaja klinis selama infeksi hepatitis B akut.
Gambar 3 Pola penanda serologik pada infeksi akut dan kronis (Dienstag dan Isselbacher 1998)
Status hepatitis B individual dapat ditentukan dengan pemeriksaan penanda serologik sebagai berikut (Adams et al. 1995) :
HBsAg: antigen permukaan virus hepatitis B yang hanya muncul pada infeksi akut atau kronis.
Anti-HBs: antibodi terhadap HBsAg yang ditemukan pada pasien yang telah pulih dari hepatitis B atau yang telah diimunisasi hepatitis B. Vaksin hanya mentriger anti-HBs karena tidak terjadi replikasi virus pada individu yang diberi vaksin hepatitis B.
anti-10
HBc muncul tanpa HBsAg atau anti-HBs, individu pasien dikategorikan sebagai karier.
Manifestasi Klinis Hepatitis B Pada Satwa Primata
Manifestasi klinis penyakit hepatitis B pada satwa primata berbeda dengan manusia. Penyakit hepatitis B akut pada manusia dapat terlihat dari beberapa gejala seperti mual, muntah, diare, anoreksia, sakit kepala, kekuningan, demam ringan, dan hilang nafsu makan. Terkadang infeksi VHB tidak memunculkan gejala kekuningan (jaundice). Gejala yang nyata yang dapat diidentifikasi dengan deteksi biokimia atau serologi virus spesifik pada darah penderita (WHO, 2002). Pada manusia dewasa, infeksi VHB dapat pulih secara komplit, namun 5-10% tidak dapat tereliminasi total dari virus akibat kegagalan tanggapan imun yang adekuat sehingga terjadi infeksi hepatitis B perisiten, jika hal ini terus berlangsung dapat bersifat karier inaktif atau hepatitis kronis yang tidak menunjukkan gejala, tapi infeksi ini tetap menjadi sangat serius dan dapat mengakibatkan kerusakan hati atau sirosis, kanker hati dan kematian (WHO 2002).
Pada beberapa penelitian yang mendeteksi keberadaan hepatitis B pada satwa primata seperti simpase, McDonald et al. (2000) melaporkan bahwa gejala klinis hepatitis tidak ditemukan pada simpanse. Penelitian hepatitis B pada gorilla, orangutan, owa dan woolly monkey juga tidak melaporkan adanya gejala klinis yang timbul pada satwa yang terinfeksi VHB. Temuan profil kimia darah untuk kasus hepatitis B pada satwa primata telah dilaporkan Gheit et al. (2002) pada Macaca sylvanus di Morocco yang menginokulasikan virus hepatitis B manusia pada hati M. sylvanus. HBsAg dapat terdeteksi bersamaan dengan kenaikan ALT (Alanine Transferase), namun anti-HBs dan anti-HBc tidak terdeteksi dalam serum. Lanford et al. (2003) yang menginfeksilkan sipder-monkey (Ateles geoffroyi) dengan VHB dari
clone infeksius VHB Woolly-monkey (WMHBV) melaporkan bahwa spider-monkey hanya dapat bertahan hidup selama 6 minggu, namun infeksi tidak mentriger gejala klinis atau kenaikan enzim hati.
Monyet Ekor Panjang (Macaca fascicularis)
Taksonomi
Macaca fascicularis atau yang dikenal sebagai monyet ekor panjang, cynomolgus monkey, atau crab-eating macaques terdistribusi secara luas pada daratan tropis dan habitatnya berdampingan dengan manusia di kepulauan Asia Tenggara (Eudey 2008, Gumert et al. 2011). Secara taksonomi, monyet ekor panjang diklasifikasikan dalam (Brandon-Jones et al. 2004):
Kingdom : Animalia
11
Morfologi
Monyet ekor panjang merupakan satwa primata yang menggunakan keempat tungkai nya untuk berjalan (quadrupedalism), memiliki ekor yang lebih panjang dari kepala dan badan, dan memiliki bantalan duduk (ischial callosity) yang melekat pada tulang duduk (ischium) (Napier & Napier 1985). Satwa primata ini memiliki variasi warna rambut coklat kekuningan atau abu-abu sampai coklat gelap. Warna rambut di bagian ventral tubuh lebih pucat. Rambut di atas mahkota kepala tumbuh kearah belakang yang sering berbentuk mahkota (crest) yang runcing (Groves 2001). Kulit wajah berwarna abu-abu gelap dengan kulit kelopak mata bagian medial lebih pucat (Rowe 1996).
Monyet ekor panjang menunjukkan perbedaan ukuran antara jantan dan betina (sexual dimorphism). Bobot tubuh monyet ekor panjang jantan 4.7-8.3 kg dan betina 2.5-5.7 kg. Panjang kepala dan badan jantan berkisar antara 412 – 648 mm dan betina 385 - 503 mm. Panjang ekor monyet jantan 435 – 655 mm dan betina 400 – 550 mm. Jumlah gigi jenis ini berjumlah 32 buah dengan rumus gigi (2I- 1C- 2PM-3M/2I-1C-2PM-3M) (Rowe 1996).
Kematangan seksual individu jantan untuk bereproduksi secara baik dimulai pada umur 51,6 bulan, sedangkan monyet betina mengalami pubertas pada umur 2-3 tahun. Pubertas ditandai oleh kejadian menstruasi pertama (menarche). Siklus menstruasi berkisar antara 28-32 hari dan ovulasi terjadi pada hari ke 12 sampai hari ke 15. Kematangan seksual monyet ekor panjang betina pada umur 50,4 bulan, dan lama kebuntingan berkisar antara 160-170 hari. Umur melahirkan pertama umumnya 46 bulan, dan interval kelahiran antara 12-24 bulan. Secara umum, monyet ini melahirkan satu anak. Penyapihan anak dilakukan pada umur 12-18 bulan (Hendrickx & Dukelow 1995).
Status Konservasi
Monyet ekor panjang termasuk satwa liar yang statusnya diatur oleh undang-undang Nomor 5 Tahun 1990 tentang Konservasi Sumber Daya Alam hayati dan Ekosistemnya, dan PP No. 7 Tahun 1999 menyatakan bahwa Macaca fascicularis merupakan jenis satwa yang tidak dilindungi, serta masuk kategori satwa dalam Apendiks II CITES. lembaga dunia yang mengurus perlindungan alam IUCN (International Union for Conservation of Nature and Natural Resources) memasukkan beberapa spesies ini dalam kategori beresiko rendah (Least concern).
Monyet ekor panjang dapat hidup di berbagai pulau dan habitat di Indonesia. Satwa ini ditemukan di Pulau Sumatera, kepulauan Lingga, Riau, Bangka, Belitung, kepulauan Tambelan, kepulauan Natuna, Nias, Jawa, Bali, Mantasari, Bawean, Maratua, Lombok, Sumba, dan Sumbawa (Santosa 1996, Suaryana et al. 2000). Kemampuan monyet ekor panjang dapat hidup di habitat asli dan habitat-habitat lainnya terkait dengan sifat adaptasi yang tinggi terhadap lingkungan dan iklim yang berbeda (Napier & Napier 1985).
12
dilakukan survei, ditemukan adanya konflik antara manusia dengan monyet ekor panjang, umumnya terjadi pada daerah pertanian, lokasi wisata, dan situs religius. Pada budaya asia telah lama monyet ekor panjang digunakan dalam hiburan masyarakat, salah satunya topeng monyet di negara Indonesia, dimana monyet dihabituasi dan dilatih untuk dapat melakukan pertunjukan diiringi musik dengan menggunakan kostum selayaknya manusia (Schillaci et al. 2005). Monyet ekor panjang juga banyak dipelihara oleh masyarakat selayaknya hewan domestik, satwa dapat dibeli dari pasar hewan, seperti Pasar Pramuka Jakarta. Satwa yang berada di pasar hewan umumnya ditempatkan dalam populasi yang padat dan kondisi yang buruk, dimana kondisi tersebut dapat menekan sistem imunitas dan memfasilitasi penularan berbagai penyakit (Karesh et al 2005, Malone et al. 2002).
Dalam lingkungan pemeliharaan, kontak antara manusia dengan monyet ekor panjang sangat dekat, mereka tinggal dengan keluarga pemilik, saling berbagi makanan dan sumber air (Schillaci et al. 2005). Berbagai bentuk kedekatan monyet ekor panjang dengan pemiliknya tanpa alat pelinding diri digambarkan pada Gambar 4.
Selain itu, monyet ekor panjang telah dimanfaatkan secara luas oleh manusia antara lain dalam bidang ekowisata, dan ilmu biomedis. Kemiripan anatomi dan fisiologi, serta filogenetik antara monyet ekor panjang dengan manusia menyebabkan satwa ini suseptibel atau peka terhadap berbagai penyakit manusia, sehingga monyet ekor panjang dapat dimanfaatkan dalam penelitian biomedis (Sajuhti dan Lelana 1993, Bennett 1995).
Gambar 4. Kedekatan antara monyet ekor panjang dengan pemiliknya (a), kontak langsung dengan mukosa tubuh (b), saling berbagi makanan (c). (dok.Citraningputri)
Penyakit Hepatitis B pada Monyet Ekor Panjang
Beberapa penelitian untuk menguji keberadaan hepatitis B pada jenis monyet Cercopithecidae telah banyak dilakukan. Heckel et al. (2001) telah melakukan uji penapisan terhadap anti-HBc, HBsAg, anti-HBs, HBeAg, anti-HBe, anti-HBc IgM dengan menggunakan ELISA komersial untuk mendeteksi hepatitis
a) c)
b) b)
a)
(a)
(b)
13 B manusia, dan nested PCR pada 386 ekor jenis Cercopithecidae. Namun, hanya 1 sampel Cercopithecus aethiops terdeteksi positif anti-HBc dan DNA VHB dalam serum.
Makuwa et al (2003) melakukan survei hepatitis B pada jenis monyet Cercopithecidae di pusat primata CIRMF Gabon-Afrika Tengah. Penanda serologi anti-HBc, HbsAg, anti-HBs digunakan untuk mendeteksi VHB dengan ELISA komersial, dan nested PCR. Primer yang digunakan dipilih dari regio genom yang conserved yang mengkode antigen S-surface dan C-core. Jenis Cercopithecidae yang dilakukan survei diantaranya 143 ekor Macaca sp., 125 ekor Cercopithecus sp., dan 72 ekor Macaca fascicularis. Namun, tidak ada satupun Cercopithecidae yang menunjukan hasil positif penanda serologi hepatitis B maupun nested PCR.
Starkman et al. (2003) melakukan investigasi terhadap distribusi infeksi alami hepatitis B pada 93 ekor Cercopithecidae asal Afrika, diantaranya Papio spp., Cercopithecus sp., Cebus sp., dan Mandrillus sp. Pada uji penapisan, semua sampel diuji terhadap keberadaan HBsAg dengan menggunakan ELISA komersial, namun tidak ada sampel yang menunjukan hasil positif. Untuk menelaah kemungkinan bahwa varian VHB pada Cercopithecidae yang secara evolusi merupakan spesies yang jauh berbeda dari spesies primata lainnya, sehingga kemungkinan VHB yang juga sangat berbeda untuk dapat terdeteksi dengan primer VHB konvensional, maka Starkman et al. mengembangkan pasangan primer yang berbeda. Primer ini dikembangkan dari regio gen yang sangat conserved dari gen permukaan, yang tidak hanya dapat mengamplifikasi VHB semua genotipe manusia dan satwa primata, namun juga VHB dari rodensia. Namun, primer ini tetap tidak dapat mendeteksi adanya infeksi VHB pada sampel Cercopithecidae tersebut.
Makuwa et al. (2006) melakukan studi epidemiologi kembali pada 405 ekor Cercopithecidae, 72 diantaranya Macaca fascicularis di Gabon-Afrika Tengah. Uji serologi dilakukan terhadap anti-HBc, HBsAg, anti-HBs, HBeAg, dan anti-HBe. Uji PCR dilakukan dengan primer yang sama pada penelitian Makuwa et al. (2003). Hasil menunjukan VHB tidak terdeteksi pada 405 sampel Cercopithecidae baik secara serologi maupun molekular.
Dupinay et al. (2013) melakukan investigasi pada 260 ekor Macaca fascicularis yang berasal dari Morocco, Pulau Mauritius, dan Asia. Uji penanpisan dilakukan untuk mendeteksi HBsAg (VIDAS HBsAg Ultradetection) dan anti-HBs dengan ELISA komersial. Hasil menunjukan 4 sampel positif HBsAg. Pengujian dilanjutkan dengan kuantifikasi viral-load dengan real-time PCR, kuantifikasi cccDNA pada organ hati dengan real-time PCR, dan Immunofluorescence pada organ hati untuk mendeteksi HBsAg dan HBcAg. VHB DNA terdeteksi pada 31 dari 120 sampel serum, dan 21 dari 50 sampel hati. Semua sampel positif hanya berasal dari M.fascicularis yang berasal dari Pulau Mauritius. Hasil sekuens genom menunjukan bahwa VHB yang menginfeksi ialah VHB genotipe D subtype ayw3. VHB ini berelasi dekat dengan VHB manusia, dan dimungkinkan ditransmisikan dari manusia, karena koloni M.fascicularis di Pulau Mauritius berasal dari 300 tahun yang lalu dibawa oleh bangsa Portugis dari Jawa ke Pulau Mauritius.
14
penyakit hepatitis B. Uji penapisan dilakukan terhadap anti-HBs dengan ELISA komersial (HBsAg™, Human®, Human Gesellschaft fȕr Biochemica und Diagnostica mbH). Uji PCR dilakukan dengan menggunakan primer yang mengamplifikasi hepatitis B pada orangutan, owa, dan manusia. Hasil menunjukkan bahwa 4 dari 45 ekor M. fascicularis terdeteksi memiliki anti-HBs, namun DNA VHB tidak ditemukan dengan pasangan primer tersebut. Hal ini merupakan temuan pertama yang menunjukan hasil serologi positif terhadap anti-HBs pada M. fascicularis di Indonesia.
Uji Serologi ELISA
Uji serologis ELISA (Enzym-linked immunosorbent assay) diperkenalkan oleh Peter Perlmann dan Eva Engvall pada tahun 1971 untuk menganalisis adanya interaksi antigen dengan antibodi di dalam sampel dengan menggunakan enzim sebagai pengenal (Leguin 2005). Prinsip enzim immunoassay menggunakan enzim yang melekat pada salah satu reagen untuk menunjukan kuantifikasi melalui pengembangan warna setelah penambahan substrat atau kromogen yang cocok (Crowther 2001). ELISA terdiri dari 3 tipe metode utama, yaitu ELISA tipe langsung, ELISA tipe tidak langsung, dan Sandwich ELISA. Masing-masing metode digunakan tergantung dari tujuan uji yang dilakukan. Untuk mendeteksi antibodi, tipe yang biasa digunakan ialah ELISA tidak langsung.
Protokol ELISA langsung ialah (i) antigen dilarutkan dalam larutan penyangga, umumnya penyangga yang digunakan ialah larutan karbonat/bikarbonat pH tinggi (9,6) atau netral phosphate-buffered saline (PBS). Tujuannya agar larutan penyangga tidak mengandung protein yang dapat berkompetisi dengan target antigen untuk melekat pada sumur plate polystirene. Antigen akan melekat pada sumur plate selama inkubasi. Suhu optimum yang digunakan untuk masa inkubasi ialah 37oC. Tahap (ii) dilakukan pencucian untuk menghilangkan antigen yang tidak melekat menggunakan larutan penyangga netral (seperti PBS). Tahap (iii) antibodi yang telah dikonjugasikan dengan enzim ditambahkan ke dalam sumur, dan jika sampel mengandung antigen maka terjadi ikatan antigen-antibodi. Tahap (iv) diikuti inkubasi dan pencucian. Tahap (v) konjugat ditambahkan dan dilakukan inkubasi. Umumnya, konjugat merupakan antibodi yang di label dengan enzim, fluorochrome, atau reagen lainnya yang jika bereaksi akan menghasilkan warna. Antibodi pada konjugat berupa antibodi antispesies tertentu, dan enzim yang umum digunakan ialah Alkaline phosphatase + p-Nitrophenylphosphate atau Horseradish peroxidase + hydrogen peroxide substrate. (vi) Dilakukan pencucian. (vii) Substrat/chromophore kemudian ditambahkan untuk mengikat konjugat. Substrat bersifat peka terhadap cahaya, sehingga inkubasi dilakukan pada kondisi gelap dalam suhu ruang. Apabila konjugat bereaksi dengan ikatan antigen-antibodi, enzim dalam konjugat membuat kromogen pada substrat menghasilkan warna. (viii) Langkah terakhir, larutan stop ditambahkan dalam sumur. Kemudian dilakukan pembacaan (Crowther 2001).
15
Identifikasi Langsung Asam Nukleat Virus
Reaksi berantai polymerase (Polymerase Chain Reaction) merupakan suatu metode enzimatis untuk melipatgandakan secara eksponensial suatu sekuen nukleotida tertentu dengan cara in vitro (Yuwono 2006). Prinsip teknik ini ialah penggandaan satu molekul DNA yang dilakukan oleh protein spesifik yang dikenal sebagai polymerase. Polyerase merupakan enzim yang dapat menyusun untaian basa nukleotida menjadi bentuk untaian molekul panjang. Basa nukleotida tersebut ialah Adenine (A), Thymine (T), Cytosine (C), dan Guanine (G) (Joshi et al. 2011)
Tabel 1 Pasangan primer untuk mendeteksi gen core dan surface HBV pada satwa primata
Target Primer Urutan basa (5’ ke 3’) Orangutan (Warren et al. 1999, Verschoor et al. 2001)
Gen Pre-S SF1 TGYGGGTCACCWTATTCTTGGG
SRout CACTGTTCCTGAACTGGAGC Macaca sylvanus (Gheit et al. 2002)
Gen S Forward GGAGTGGGCCTCAGCCCGTTTCTC Reverse GCCCCCAATACCACATCATCCATA Gen Core Forward TCGGAGTGTGGATTCGCACTCCTC
Reverse GATTGAGACCTTCCTCCTCTGCGAGGA Cercopithecidae Afrika, kera, dan Monyet Dunia Baru (Starkman et al. 2003) Gen S Set Primer S3:
Primer 21 GACTTCTCTCARTTTTCYAGGGG Primer 22 GATGTRTCTGCGGCGTTTTATCAT Primer 23 GATACCCTCACCCGGARTCRGGCA Primer 24 GGCAAAGAGRACCGAGTYAAATGA Macaca fascicularis (Dupinay et al. 2013)
Kuantitatif real-time PCR
Forward GCTGACGCAACCCCCACT Reverse AGGAGTTCCGCAGTATGG
16
polymerase. Pada akhir reaksi, sekuens spesifik akan terakumulasi dalam jutaan salinan, yang disebut amplikon. Amplikon divisualisasikan sebagai pita DNA pada agar agarose melalui teknik elektroforesis. Fragmen DNA dipisahkan oleh gel elektroforesis, di mana potongan DNA akan turun melalui matriks polimer yang ditempatkan di bawah medan listrik (NCBI 2014).
Pada umumnya, deteksi hepatitis B dengan menggunakan PCR memiliki target regio yang conserved (lestari) diantara beberapa genotipe virus hepatitis B, seperti regio Gen S (surface) dan region inti (core). Berbagai primer untuk mendeteksi hepatitis B pada satwa primata telah dikembangkan, termasuk pada jenis Macaca sp. seperti Macaca sylvanus dan Macaca fascicularis (Gheit et al. 2002, Dupinay et al. 2013). Pasangan primer yang digunakan untuk mengamplifikasi virus hepatitis B pada berbagai spesies satwa primata disajikan dalam Tabel 1.
Survei Cross sectional
Survey cross-sectional adalah studi yang bertujuan untuk menentukan frekuensi (atau tingkat prevalensi) kejadian tertentu, seperti paparan, penyakit, atau suatu kejadian yang berkaitan dengan kondisi kesehatan masyarakat dalam populasi yang telah ditentukan pada suatu titik waktu tertentu (IARC 2015). Umumnya subjek atau sampel dipilih dari populasi yang ditetapkan dan dihubungkan pada satu waktu tertentu. Berbagai metode dapat digunakan untuk memilih sampel yang representatif, contohnya metode pengambilan contoh secara acak, karena dapat mengurangi kemungkinan pemilihan yang bias (Casley dan Lury 1987).
17
3
METODE
Tempat dan Waktu Penelitian
Pengumpulan sampel dilaksanakan di dua lokasi pemeliharaan monyet ekor panjang di luar habitat ex-situ, yaitu fasilitas penangkaran, dan pusat penyelamatan satwa. Sampel yang dimanfaatkan dalam penelitian ini adalah serum atau plasma monyet ekor panjang yang merupakan sampel koleksi dari kedua lembaga tersebut sebagai sampel pemeriksaan kesehatan rutin. Penggunaan sampel dalam penelitian ini telah mendapatkan izin dari fasilitas tersebut.
Sampel yang berasal dari fasilitas penangkaran merupakan sampel koleksi Laboratorium Mikrobiologi dan Imunologi PSSP LPPM IPB yang diperoleh dari berbagai lokasi penangkaran. Selain penangkaran, termasuk juga sampel asal topeng monyet yang diambil di Kota Solo-Jawa Tengah. Sedangkan sampel asal pusat penyelamatan satwa (PPS) berupa sampel serum atau plasma M. fascicularis yang merupakan hasil sitaan atau serahan secara sukarela dari masyarakat yang kemudian direhabilitasi pada fasilitas ini.
Sampel diambil secara cross-sectional dimulai bulan Juni 2014 sampai dengan Februari 2015. Pemrosesan dan pengujian sampel dilaksanakan di Laboratorium Bioteknologi dan Laboratorium Mikrobiologi dan Imunologi PSSP LPPM-IPB.
Bahan
Bahan yang digunakan ialah koleksi sampel serum dan plasma dari Laboratorium Mikrobiolgi dan Imunologi PSSP LPPM-IPB dan beberapa sampel serum atau plasma dari pusat penyelamatan satwa. Bahan-bahan lain yang digunakan ialah : (i) Prosedur ELISA: HBsAg ELISA kit komersial (HBsAg™, Human®, Human Gesellschaft fȕr Biochemica und Diagnostica mbH) berupa enzim konjugat anti-HBsAg (Guinea pig) horesradish peroksidase, substrat hidrogen peroksidase, substrat TMB (3,3’,5,5’-tetramethylbenzidine), DMSO, kontrol negatif berupa serum manusia negatif hepatitis B, kontrol positif berupa serum manusia yang positif hepatitis B, dan larutan pencucian PBS (phosphate buffered saline), Tween-20, dan larutan stop berupa asam sulfur.
Prosedur PCR (ii): QiaAmp DNA blood mini kit (Qiagen), proteinase K, larutan penyangga pelisis (lisis buffer), PCR kit KAPA Hifi HotStart ReadyMix® (yang terdiri dari MgCl2, dNTPs, KAPA HiFi HotStart DNA Polymerase, PCR
buffer 10X, KCl, Tris-HCl), sampel DNA (10 µl), ddH2O, kontrol positif VHB,
dan kontrol negatif VHB.
Alat
18
Tahapan Pemeriksaan Sampel Pengumpulan dam Pemrosesan Sampel
Pengumpulan sampel dilakukan secara cross-sectional dari berbagai kondisi habitat ex-situ monyet ekor panjang. Sampel dipilih secara acak. Pengambilan sampel dilakukan satu kali tanpa pengulangan. Sampel serum/plasma diambil menggunakan tip steril berbahan polyester dan disimpan di dalam tabung mikro, kemudian disimpan dalam suhu ± 4oC selama proses transportasi. Setelah tiba di laboratorium, dilakukan inaktivasi sampel, yaitu melaui tahapan: serum diambil sebanyak 200 µl kemudian dimasukan masing-masing kedalam tiga buah tabung eppendof, dimasukkan kedalam penangas air bersuhu 56oC selama 30 menit. Sampel yang telah dibagi pada tiga tabung dibekukan dan disimpan dalam suhu -80oC hingga saatnya dilakukan pengujian.
Gambar 5 Desain Penelitian
Uji Serologi terhadap HBsAg
Uji serologi yang dilakukan pada penelitian ini ialah uji ELISA tipe langsung yang mendeteksi adanya antigen permukaan hepatitis B (HBsAg) dengan menggunakan sumur mikro yang telah dilapis dengan antibodi monoklonal (mab, tikus) terhadap HBsAg. Uji ini menggunakan HBsAg ELISA kit komersial (HBsAg™, Human®, Human Gesellschaft fȕr Biochemica und
Diagnostica mbH, Germany).
Tahap pertama prosedur ini dimulai dengan memasukan kontrol positif, kontrol negatif yang telah tersedia, dan sampel serum M. fascicularis masing-masing sebanyak 50 µl ke dalam sumur. Satu sumur pertama tidak diberi kontrol atau sampel karena optical density (OD) yang dihasilkan digunakan sebagai kontrol konjugat dalam interpretasi hasil. Konjugat anti-HBsAg (Guinea pig) horseradish peroksidase sebanyak 50 µl dimasukan ke dalam setiap sumur, kecuali sumur pertama (sumur kontrol konjugat). Setelah itu, sampel diinkubasi
Pusat Studi Satwa Primata – LPPM IPB :
Uji serologi terhadap HBsAg VHB DNA
Tidak terinfeksi VHB Terinfeksi VHB
19 dalam suhu 37oC selama 80 menit dan diikuti dengan 8 kali pencucian menggunakan larutan PBS-Tween20 sebanyak 350 µl.
Tahap kedua adalah penambahan substrat berupa hidrogen peroksida sebanyak 50 µl dan substrat TMB 50 µl pada semua sumur, kemudian diinkubasikan pada suhu ruang selama 30 menit dalam kondisi gelap. Substrat akan bereaksi dengan enzim peroksidase sehingga kromogen akan teroksidasi menghasilkan warna. Reaksi dihentikan dengan pemberian larutan Asam sulfur sebanyak 100 µl. Warna yang dihasilkan dibaca melalui alat ELISA microplate reader dengan panjang gelombang 450 nm. Hasil berupa densitas optik (OD) merupakan data numerik yang diinterpretasikan sebagai proporsional jumlah HBsAg pada setiap sampel. Nilai densitas optik (OD) diperoleh dari formulasi perhitungan yang digunakan sesuai ELISA kit komersial ini, yaitu:
Cut-off value (COV) = Rataan nilai kontrol negatif + 0.025.
Sampel dapat diinterpretasikan sebagai hasil non reaktif apabila nilai absorbansi (OD) sampel kurang dari COV. Hasil reaktif apabila nilai absorbansinya sama dengan atau lebih besar dari COV.
Isolasi DNA dan Amplifikasi
Isolasi DNA dilakukan dengan ekstraksi DNA kit yaitu QIAamp DNA blood minikit™ (Qiagen®). Sebanyak 200 µl serum dimasukkan ke dalam 20 µl Proteinase K. Selanjutnya ditambahkan larutan lisis buffer sebanyak 200 µl ke dalam masing-masing tabung mikro, dihomogenkan dengan vortex, di inkubasi dalam penangas air 56oC selama 10 menit, disentrifugasi selama 1 menit, diberi Ethanol 100% sebanyak 200 µl, kemudian dihomogenkan. Selanjutnya campuran dimasukkan ke dalam QIAamp spin column, pada proses ini diharapkan DNA akan terserap pada membran silica-gel pada spin column. Untuk menghilangkan residu kontaminan DNA, dilakukan pencucian dengan larutan penyangga AW1 500 µl, disentrifugasi 6800 x g selama 1 menit, setelah itu filtrat dibuang. Proses pencucian dilanjutkan dengan peangga AW2 500 µl, disentrifugasi 20815 x g selama 2 menit. Kemudian spin column dimasukkan ke tabung baru. DNA dielusi menggunakan penyangga AE sebanyak 200 µl, di inkubasi pada suhu ruang selama 1 menit dan disentrifugasi 6800 x g. DNA tersebut digunakan sebagai cetakan (template) PCR.
Prosedur Polymerase Chain Reaction (PCR) dan Elektroforesis
Penyiapan campuran PCR dilakukan di dalam Laminar air flow (ESCO AHC-4A1). Secara berurutan reagen PCR seperti yang tertera pada Tabel 2 dicampur pada tabung berukuran 1,5 ml. Primer yang digunakan didesain untuk mengamplifikasi daerah Pre-S1 yang merupakan daerah conserved dan karakteristik untuk VHB yang berasal dari spesies yang berbeda. Primer ini telah digunakan untuk mendeteksi VHB pada spesies orangutan dan owa jawa (Warren et al. 1999; Verschoor et al. 2001; Noviana 2012). Primer yang digunakan tertera pada Tabel 3. Runutan oligonukleotida primer forward HepB-SF1 berada di posisi 912 – 932, dan primer reverse HepB-SRout berada di posisi 1348–1367 pada gen S. Target produk pasangan primer ini 455 pasang basa (pb).
20
tabung PCR dimasukan ke dalam mesin PCR dengan program sebagai berikut: pre start pada suhu 94oC selama 5 menit, denaturasi 94oC selama 30 detik, anneling 52oC selama 30 detik, ekstension 72oC selama 30 detik, dan post-ekstension pada suhu 72oC selama 7 menit yang diamplifikasi sebanyak 45 siklus. Tabel 2 Campuran reaksi PCR
Reagen Volume/reaksi (µ l)
KAPA HiFi HotStart ReadyMix™ 12.5
Primer forward 10 pmol/µ l 1.0
Primer reverse 10 pmol/µ l 1.0
ddH2O 5.5
Template 5.0
Volume Total 25
Tabel 3 Primer oligonukleotida yang digunakan untuk mengamplifikasi daerah gen pre-S1
Primer Urutan basa (5’ ke 3’) Referensi
Forward hepB-SF1 TGYGGGTCACCWTATTCTTGGG Warren et al. (1999)
Reverse hepB-SRout CACTGTTCCTGAACTGGAGC
Produk PCR kemudian dilalukan pada gel elektroforesis 1.8% agarose yang mengandung ethidium bromida 0.1 µg/ml dalam larutan penyangga TAE menggunakan elektroforesis horizontal dengan tegangan 100 volt selama 45 menit. Sebagai penanda, diberikan penanda DNA 100-1000 pb DNA ladder ke dalam sumur gel. Hasil elektroforesis divisualisasikan dengan menggunakan Gel Doc (BioRad®).
Analisis Data
21
4
HASIL DAN PEMBAHASAN
Pengumpulan sampel telah dilakukan di dua lokasi studi yaitu di Pusat Studi Satwa Primata-Lembaga Penelitian dan Pengabdian Masyarakat Institut Pertanian Bogor (PSSP-LPPM IPB) dan Pusat Penyelamatan Satwa (PPS) di Ciapus-Bogor. Sebanyak 95 sampel serum dan plasma telah berhasil dikoleksi dari dua lokasi studi dengan distribusi sampel, 78 sampel dari PSSP-LPPM IPB dan 17 sampel dari pusat penyelamatan satwa. Jumlah dan jenis sampel ini disesuaikan dengan ketersedian koleksi sampel yang ada di lembaga konservasi ex-situ tersebut. Dari keseluruhan sampel yang diperoleh, asal sampel dikategorikan menjadi 3 yaitu, 1) sampel asal penangkaran koleksi PSSP (Bogor 1, Bogor 2, Bogor 3, Tangerang), 2) sampel topeng monyet (koleksi PSSP), dan 3) sampel monyet koleksi pusat penyelamatan satwa. Hasil uji serologi dan PCR DNA VHB disajikan pada Tabel 4.
Tabel 4 Prevalensi infeksi hepatitis B pada sampel yang dikoleksi dari Pusat Studi Satwa Primata (PSSP) LPPM-IPB dan Pusat Penyelamatan Satwa pada Juni 2014 hingga Februari 2015
Asal Sampel Jenis Sampel Jumlah Sampel Pemeriksaan viral hepatitis B HBsAg VHB DNA
Deteksi Antigen Hepatitis B secara Serologis dengan ELISA
Berdasarkan uji ELISA terhadap HBsAg, sebanyak 11 dari 95 ekor monyet ekor panjang (11.6%) terdeteksi antigen hepatitis B pada serum/plasma (Tabel 4). Uji HBsAg dilakukan dengan teknik ELISA tipe langsung kit komersial (HBsAg™, Human®, Human Gesellschaft fȕr Biochemica und Diagnostica mbH, Germany) dengan menggunakan sumur mikro yang telah dilapisi dengan antibodi monoklonal (mab, tikus) terhadap HBsAg. Antibodi monoklonal ialah antibodi monospesifik yang identik karena diproduksi oleh satu tipe sel imun yang semua dikloning dari single parent cell. Antibodi monoklonal memiliki daya afinitas monovalen yang hanya mengikat epitop yang sama, dan hanya memiliki satu epitop (Tansey et al. 1994). Dari definisi tersebut dapat dikatakan uji ELISA yang digunakan dalam penelitian ini bersifat spesifik mengikat protein antigen permukaan virus hepatitis B manusia, sehingga virus hepatitis B yang terdeteksi pada M. fascicularis memiliki protein antigen permukaan (gen S) yang sama dengan manusia.
22
beberapa epitop yang memiliki struktur tiga dimensi yang sama. Antibodi monoklonal juga dapat bereaksi dengan dua antigen multiepitop yang berbeda jika epitop utama bersama-sama dikenali oleh antibodi monoklonal.
Deteksi HBsAg dengan metode ELISA pada M. fascicularis dilaporkan telah dilakukan, namun HBsAg belum dapat terdeteksi pada M. fascicularis asal Asia (Makuwa et al. 2006), dan telah terdeteksi pada 4 dari 21 M. fascicularis dengan VHB DNA positif asal Pulau Mauritius (Dupinay et al. 2013).
Tabel 5 Hasil pengujian ELISA antigen Hepatitis B (HBsAg) yang reaktif
No. Tatoo / Nama Jenis COV = rataan kontrol negatif + 0,025 = 0,034 + 0,025
Ket: PPS: Pusat Penyelamatan Satwa; TOPMON: topeng monyet.
Berdasarkan data riwayat asal satwa, dapat diketahui bahwa satwa dengan HBsAg positif lebih banyak dari asal sampel dari satwa hasil p dan topeng monyet (peliharaan), yaitu sebanyak 55% (6/11) dibandingkan sampel asal penangkaran, sebanyak 45% (5/11) (Tabel 5). Dari hasil tersebut, ada kemungkinan bahwa monyet ekor panjang yang telah dipelihara oleh manusia beresiko lebih tinggi terinfeksi hepatitis B. Kontak langsung tanpa alat pelindung diri antara manusia dengan monyet ekor panjang memungkinkan terjadinya transmisi infeksi virus hepatitis B. Virus hepatitis B termasuk dalam bloodborne pathogen atau agen patogen yang terdapat di dalam darah atau cairan tubuh, sehingga virus ini ditransmisikan melalui kontak dengan produk darah/cairan tubuh/mukosa. Dalam lingkungan pemeliharaan, kontak antara manusia dengan monyet ekor panjang sangat dekat, mereka tinggal dengan keluarga pemilik, saling berbagi makanan dan sumber air (Schillaci et al. 2005). Kondisi imunitas satwa juga sangat berpengaruh terhadap transmisi penyakit, apabila kondisi lingkungan penuh tekanan dan tingkat stress meningkat maka satwa retan terinfeksi penyakit (Malone et al. 2002).
23 kemungkinan infeksi alami VHB yang bersifat indigenous pada M. fascicularis. Salah satu indigenous hepatitis B telah dilaporkan pada simpanse, dimana pada 11 dari 13 simpanse dengan infeksi VHB kronis terlihat secara genetik berbeda dengan genotipe VHB manusia. Kemudian apabila dibandingkan dengan isolat VHB satwa primata lainnya, VHB simpanse memiliki nukleotida khas dan asam amino yang berbeda pada seluruh genom dan gen S yang dapat secara cepat dan tepat mengidentifikasi strain ini (Hu et al. 2000).
Walaupun VHB pada satwa primata dapat bersifat indigenous, namun penularan dengan manusia tetap menjadi perhatian. Beberapa publikasi menyatakan pula bahwa strain VHB owa, monyet woolly, dan VHB manusia dapat menyebabkan infeksi hepatitis B pada simpanse. Transmisi yang paling berpotensi dalam penularan penyakit zoonotik ini ialah melalui darah atau paparan cairan tubuh, seperti kondisi satwa primata dengan infeksi VHB kronis dijadikan hewan peliharaan, kontak yang dekat dengan perawat satwa, dan apabila satwa primata dipotong untuk dikonsumsi (Hu et al. 2000).
Deteksi Hepatitis B dengan PCR
Pemeriksaan PCR dilakukan terhadap 11 sampel darah plasma atau serum yang telah berstatus serologis positif terhadap antigen virus hepatitis B. Hasil PCR memperlihatkan bahwa pada semua sampel tidak teramplifikasi dengan pasangan primer untuk regio Pre-S1 VHB dimana regio ini merupakan regio yang conserved dari bagian virus hepatitis B (Gambar 6).
Gambar 6 Hasil amplifikasi PCR virus hepatitis B Regio Pre-S1 pada sampel seropositif HBsAg. (1) individu T3336, (2) T3199, (3) T3331, (4) J190111B, (5) J300511C, (6) Nala, (7) Matu, (8) Pandu, (9) Brahma, (10) Awi, (11) TM SL3, (12) kontol postitif VHBHu, (13) kontrol positif VHBGi, (14) kontrol positif VHBOu, (15) kontrol negatif. Kesebelas sampel monyet ekor panjang yang positif terhadap HBsAg ternyata menunjukan hasil yang negatif pada uji PCR (Tabel 4). Tidak terdeteksinya viral DNA VHB dapat juga disebabkan oleh pasangan primer hepSF-1 dan hepSR-out yang digunakan dalam penelitian ini tidak dapat mengamplifikasi viral DNA sampel dengan baik. Dalam studi yang dilakukan oleh Dupinay et al. (2013), yang dapat mendeteksi VHB pada M. fascicularis asal Pulau Mauritius dari sampel serum, digunakan primer dari daerah yang saling
500 pb 400 pb 300 pb 200 pb 100 pb
24
tumpang tindih dari daerah gen surface dan gen core, yang sangat conserved diantara semua genotipe VHB manusia. Primer ini menyandi daerah gen permukaan (gen S) sebesar 118 bp dengan urutan basa forward (5’ GGAGTGGGCCTCAGCCCGTTTCTC’3) pada posisi 489-512 dan reverse (5’GCCCCCAATACCACATCATCCATA’3) (Gheit et al. 2002). Apabila dibandingkan dengan primer yang digunakan pada penelitian ini, primer forward hepB-SF1 menyandi daerah gen PreS1 pada posisi 912-932 dan primer reverse menyandi daerah gen PreS1 pada posisi 1348-1367. Sementara, apabila dibandingkan dengan primer yang digunakan Dupinay et al. (2013) yang menggunakan metode real time-PCR, dengan primer dari urutan DNA yang tumpang tindih antara gen core pada posisi 1186 – 1203 dan posisi 1266 – 1283. Sehingga kemungkinan perbedaan daerah yang disandi inilah yang menyebabkan DNA VHB tidak teramplifikasi dari sampel M. fascicularis pada penelitian ini. Berdasarkan analisis filogenetik yang dilakukan oleh Dupinay et al. (2013), menunjukan bahwa genom VHB monyet ekor panjang Pulau Mauritius terkelompok pada VHB manusia, dibandingkan dengan VHB satwa primata lainnya.
Selain itu, kondisi positif HBsAg dan negatif DNA VHB dapat diinterpretasikan sebagai dua kemungkinan, yaitu: 1) jumlah virus dalam sampel sangat rendah dan 2) infeksi kronis. Menurut Terrault & Wright (1998) dan Hollinger & Liang (2001), dikatakan bahwa pada fase infeksi akut, DNA VHB dapat terdeteksi di dalam darah dengan pemeriksaan PCR pada 3-5 minggu setelah paparan, dan HBsAg akan terdeteksi didalam darah 7-9 minggu setelah paparan. Konsentrasi DNA VHB akan meningkat perlahan seiring dengan meningkatnya HBsAg, kemudian mencapai puncaknya selama infeksi akut. Kemudian konsentrasi HBsAg dalam serum akan menurun hingga level tak terdeteksi antara 4-6 bulan, jika level HBsAg tetap persisten lebih dari 6 bulan, maka dikategorikan mengalami infeksi kronis.
25
SIMPULAN DAN SARAN
Simpulan
1. Sebelas dari 95 monyet ekor panjang (11.6%) di habitat ex-situ menunjukkan keberadaan antigen permukaan virus hepatitis B (HBsAg), namun tidak teramplifikasi dengan teknik PCR menggunakan primer virus hepatitis B orangutan.
2. Antigen hepatitis B lebih banyak dideteksi pada monyet di pusat penyelamatan satwa dan topeng monyet (55%) dibandingkan dengan satwa penangkaran (45%).
3. Penelitian ini menguatkan dugaan adanya infeksi Hepatitis B pada monyet ekor panjang di Indonesia untuk pertama kalinya.
Saran
1. Diperlukan penelitian lebih lanjut untuk mengidentifikasi secara molekuler virus hepatitis B pada monyet ekor panjang Indonesia yang telah terdeteksi secara serologis dengan metode yang berbeda.
2. Diperlukan pengembangan primer PCR yang didesain untuk mendeteksi secara general Famili Hepadnaviridae pada satwa primata.
26
DAFTAR PUSTAKA
Adams SR, Muchmore E, Richardson JH. 1995. Biosafety: Zoonoses, Biohazards, and Other Health Risks. Didalam: Bennett BT, Abee CR, Henrickson R. 1995. Nonhuman Primates in Biomedical Research. New York (US): Academic Pr. hlm 391-400.
Bancroft WH, Snitbhan R, Scott RMN, Tingpalapong M, Watson WT, Tanticharoenyos P, Karwacki JJ, Srimarut S. 1977. Transmission of hepatitis B virus to gibbons by exposure to human saliva containing hepatitis B surface antigen. J Infect Dis 135: 79-85.
Bennett BT, Abee CR, Henrickson R. 1995. Nonhuman Primates in Biomedical Research. New York (US): Academic Pr.
Brandon-Jones D, Eudey AA, Geissmann T, Groves CP, Melnick DJ, Morales JC, Shekelle M, Sewart CB. Asian primate classification. Int J Primatol 25(1): 112-121. doi: 10.1023/B:IJOP.0000014647.18720.32
Casley, Lury. 1987. Didalam: [IARC] International Agency for Research on Cancer. 2015 .Cross-sectional surveys. http://www.iarc.fr/en/publications/ pdfs-online/epi/cancerepi/CancerEpi-10.pdf [12 Januari 2015].
[CDC] Centers for Disease Control and Prevention. 2010. Viral Hepatitis. Hepatitis B General Fact Sheet [Internet]. [diunduh 2014 Des 11]; 21(1073): 1-2. Tersedia pada: http://www.cdc.gov/hepatitis/HBV/PDFsHepBGeneralFact Sheet.pdf.
[CDPH]. California Department of Public Health. 2009. What is a cross sectional study? http://www.ehib.org/faq.jsp?faq_key=41. [4 Februari 2015].
Chiou HL, Lee TS, Kuo J, Mau YC, Ho MS. 1997. Altered antigenicity of ‘a’ determinant variants of hepatitis B virus. J Gen Virol 78: 2639–2645.
Chisari FV, Klopchin K, Moriyama T, Pasquinelli C, Dunsford HA, Sell S, Pinkert CA, Brinster RL, Palmiter RD. 1989. Molecular pathogenesis of hepatocellular carninoma in Hepatitis B transgenic mice. Cell 59: 1145-1156. Crowther JR. 2001. The ELISA Guidebook. New Jersey (US): Humana Press. Dienstag JL, Isselbacher KJ. 1998. Acute viral hepatitis. Di dalam: Fauci AS et al.,
editor. Harrison’s Principles of Internal Medicine. Volume 2. Ed ke-14. New York (US): McGraw-Hill. hlm 1677-1701.
[Dirjen PP & PL Kemenkes] Direktorat Jenderal PP & PL Kementerian Kesehatan RI. 2012. Pedoman Pengendalian Hepatitis Virus. Jakarta: Kemenkes RI.
Dupinay T, Gheit T, Roques P, Cova L, Chevallier-Queyron P, Tasahsu SI, Le Grand R, Simon F, Cordier G, Wakrim L et al. 2013. Discovery of naturally occurring transmissible chronic hepatitis B virus infection among Macaca fascicularis from Mauritius Island. Hepatology. 58(5):1610-1620. doi: 10.1002/hep.26428.
Eudey AA. 2008. The crab-eating macaque (Macaca fascicularis): widespread and rapidly declining. Prim Conserv (23): 129–132.