UJI TOKSISITAS AKUT EKSTRAK ETANOL KULIT
AKAR GINSENG KUNING (Rennellia elliptica Korth.)
TERHADAP MENCIT (Mus musculus)
SKRIPSI
FARICHAH MANSUROH
NIM. 109102000050
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UJI TOKSISITAS AKUT EKSTRAK ETANOL KULIT
AKAR GINSENG KUNING (Rennellia elliptica Korth.)
TERHADAP MENCIT (Mus musculus)
SKRIPSI
Diajukan sebagai salah satu syarat memperoleh gelar Sarjana Farmasi
FARICHAH MANSUROH
NIM. 109102000050
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
JAKARTA
OKTOBER 2013
Skripsi ini adalah hasil karya sendiri,
dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar
Nama : Farichah Mansuroh
NIM : 109102000050
Tanda tangan :
iv
Nama : Farichah Mansuroh
NIM : 109102000050
Program Studi : Farmasi
Judul Skripsi : Uji Toksisitas Akut Ekstrak Etanol Kulit Akar Ginseng
Kuning (Rennellia elliptica Korth.) Terhadap Mencit (Mus
musculus)
Menyetujui :
Pembimbing I
Dr. Andria Agusta
NIP. 196908161994031003
Pembimbing II
Drs. Umar Mansur, M.Sc., Apt.
Mengetahui,
Ketua Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan
UIN Syarif Hidayatullah Jakarta
Skripsi ini diajukan oleh :
Nama : Farichah Mansuroh
NIM : 109102000050
Program Studi : Farmasi
Judul Skripsi : Uji Toksisitas Akut Ekstrak Etanol Kulit Akar Ginseng
Kuning (Rennellia elliptica Korth.) Terhadap Mencit (Mus
musculus)
Telah berhasil dipertahankan dihadapan Dewan Penguji dan diterima sebagai persyaratan yang diperlukan untuk memperoleh gelar Sarjana Farmasi pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
DEWAN PENGUJI
Pembimbing I : Dr. Andria Agusta ( )
Pembimbing II : Drs. Umar Mansur, M.Sc., Apt. ( )
Penguji I : Yardi, Ph.D., Apt. ( )
Penguji II : Puteri Amelia, M.Farm., Apt. ( )
Ditetapkan di : Jakarta
vi ABSTRAK
Nama : Farichah Mansuroh
Program Studi : Farmasi
Judul : Uji Toksisitas Akut Ekstrak Etanol Kulit Akar Ginseng Kuning (Rennellia elliptica Korth.) Terhadap Mencit (Mus musculus)
Akar Ginseng Kuning (Rennellia elliptica Korth.) secara empiris telah digunakan sebagai zat afrodisiak, obat pegal linu dan tonik setelah melahirkan. Tujuan dari penelitian ini adalah untuk menentukan nilai LD50 dan tingkat keamanan dari
ekstrak etanol akar tersebut dengan uji toksisitas akut terhadap mencit betina menggunakan metode dari OECD 425 (Up and Down Procedure), serta pengaruhnya terhadap histopatologi organ hati, ginjal, dan limpa mencit. Pada penelitian ini mencit diberikan ekstrak secara oral dengan dosis tunggal 2000 mg/kgbb. Mencit diamati secara individu meliputi, tanda-tanda toksisitas dan berat badan selama 14 hari. Hasil menunjukkan bahwa tidak terdapat mencit yang mati ataupun mengalami tanda-tanda toksisitas, dan tidak terjadi perubahan yang bermakna pada bobot mencit pada dosis 2000 mg/kgbb (p≥0,05). Pada pengamatan histopatologi, tidak terdapat kerusakan pada organ hati dan limpa mencit akibat pemerian ekstrak etanol kulit akar Ginseng Kuning (Rennellia elliptica Korth.), tetapi dapat mengakibatkan kerusakan pada jaringan ginjal yaitu mengkerutnya glomerulus (atrofi).
ABSTRACT
Name : Farichah Mansuroh
Program Study : Pharmacy
Tittle : Acute Toxicity Study of Ethanolic Extract of Ginseng Kuning (Rennellia elliptica Korth.) roots peel to Mice (Mus musculus)
Ginseng Kuning (Rennellia elliptica Korth.) roots extract was used empirically as an aphrodisiac, as for body aches and as a post natal tonic. The present study was aimed to determine LD50, to establish the safety of ethanolic extract of Ginseng
Kuning (Rennellia elliptica Korth.) roots peel by acute oral toxicity study in female mices as per OECD guideline 425 (Up and Down Procedure) and to know the histopathological effect on liver, kidney, and spleen of mice. Mices were administered the extracts per-oral in single dose of 2000 mg/kg of body weight. All the animals were individually studied for mortality, wellness parameters and body weight for 14 days. No mortality and no significant changes were observed in body weight (p≥0,05) and wellness parameters at 2000 mg/kg body weight doses, which reveal the safety of these extracts in the doses up to 2000 mg/kg body weight. Ethanolic extract of Ginseng Kuning roots peel did not caused histopathological effect on liver and spleen of mices. But, it caused shrinkage of glomerulus (atrophy) on kidney’s tissue.
viii
Alhamdulillahi Rabbi al-‘Aalamiin, puji syukur kehadirat Allah, Tuhan
semesta alam atas karunia, hidayah, dan rahmat-Nya sehingga penulis dapat
menyelesaikan skripsi yang berjudul “Uji Toksisitas Akut Ekstrak Etanol Kulit
Akar Ginseng Kuning (Rennellia elliptica Korth.) Terhadap Mencit (Mus
musculus)”. Penulisan skripsi ini disusun sebagai salah satu syarat kelulusan
tingkat sarjana pada Program Studi Farmasi Fakultas Kedokteran dan Ilmu
Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Kami menyadari bahwa selama masa perkuliahan sampai penyelesaian
penulisan skripsi ini tidaklah mudah, sehingga untuk menyelesaikan semua ini
tidak terlepas dari doa, bantuan, bimbingan, dan dukungan dari berbagai pihak.
Untuk itu kami mengucapkan terima kasih yang tak terhingga kepada:
1. Bapak Dr. Andria Agusta selaku Pembimbing I atas izin yang diberikan
pada penulis untuk melakukan penelitian di Lab. Fitokimia LIPI, atas
nasehat, bimbingan, dan arahan selama penelitian dan penulisan skripsi.
2. Bapak Drs. Umar Mansur, M.Sc., Apt. selaku Pembimbing II sekaligus
Ketua Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan
Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta, atas nasehat,
bimbingan, dan arahan yang telah diberikan pada penulis.
3. Ibu Dr. Ir. Praptiwi, M.Agr., Teh Dewi Wulansari, M.Sc., Apt., Ibu Dra.
Yuliasri Jamal, M.Sc., Mas Toni, Mbak Dewi, Pak Lukman, Kang Asep
yang telah membantu penulis selama penelitian di Botani LIPI.
4. Ibu dr. Dyah Ayu Woro S. yang telah membantu penulis dalam membaca
preparat histopatologi.
5. Kementrian Agama Republik Indonesia yang telah memberikan
bimbingan, arahan, dan “Beasiswa Santri Berprestasi” selama menempuh
pendidikan di Program Studi Farmasi Fakultas Kedokteran dan Ilmu
Kesehatan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta.
6. Bapak Prof. Dr. dr. (hc). MK. Tadjudin, Sp. And., selaku Dekan Fakultas
Kedokteran dan Ilmu Kesehatan Universitas Islam Negeri (UIN) Syarif
8. Bapak/Ibu Jajaran Dosen dan Staf Akademika Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta
yang telah memberikan ilmu, bimbingan, dan arahan kepada penulis
selama masa perkuliahan.
9. Ibunda tercinta Ny. Nasriyah (Almh.) yang penulis yakin doanya masih
mengalir untuk penulis, serta Ayahanda Kasman Sutikno atas kesabaran,
doa yang tak pernah putus, dukungan, nasehat, dan kasih sayangnya, yang
mengajarkan penulis untuk selalu berada dalam jalan-Nya
10.Mbak, mas, mas ipar dan mbak ipar (mbak Titin dan mas As, mbak Ana
dan mas Khadafi, mbak Sofi dan mas Bin, mas Arif dan mbak Lia).
Terimakasih atas doa dan support panjenengan semua, atas apa yang telah
diberikan kepada penulis. Kehadiran para jagoan kecil kalian memberikan
keceriaan dan semangat pada penulis.
11.Teman-teman penulis : Dyah, ning Indah, Leli, Nuyung, Neneng, Ema,
Fina, Ainul, Nurul, Fery, Zaky, Umam, Fahmi, Farid, Seil, ka Alvin, ning
Zuwi, Udin, sodara Fitri, Hanik, CSS MoRA 2009, Wafa, teman
seperjuangan di LIPI (Dimas dan Lina), dan lainnya.
12.Teman-teman EDTA-C beserta keluarga besar Farmasi 09 atas semangat
dan kebersamaan selama perkuliahan.
13.Semua pihak yang telah membantu penulis dalam menyelesaikan
penelitian ini, yang penulis tidak bisa sebutkan satu persatu.
Semoga semua bantuan yang telah diberikan mendapatkan balasan dari Allah swt.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna, untuk
itu saran dan kritik yang membangun sangat penulis nantikan. Semoga skripsi ini
dapat memberikan sumbangan yang berharga, bagi kepentingan keilmuan maupun
aplikasi di dunia kesehatan.
Jakarta, 2 Oktober 2013
x
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah
Jakarta, saya yang bertanda tangan di bawah ini :
Nama : Farichah Mansuroh
NIM : 109102000050
Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan
Jenis Karya : Skripsi
Demi perkembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah
saya, dengan judul :
UJI TOKSISITAS AKUT EKSTRAK ETANOL KULIT AKAR GINSENG
KUNING (Rennellia elliptica Korth.) TERHADAP MENCIT (Mus musculus)
Untuk ditampilkan di Digital Library Perpustakaan Universitas Islam Negeri
(UIN) Syarif Hidayatullah Jakarta untuk kepentingan akademik sebatas sesuai
dengan Undang-Undang Hak Cipta.
Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan
sebenarnya.
Dibuat di : Jakarta
Pada tanggal : 2 Oktober 2013
Yang menyatakan,
Halaman
HALAMAN JUDUL ... ii
HALAMAN PERNYATAAN ORISINILITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING. ... iv
HALAMAN PENGESAHAN ... v
ABSTRAK ... vi
ABSTRACT ... vii
KATA PENGANTAR ... viii
HALAMAN PERSETUJUAN PUBLIKASI KARYA ILMIAH ... x
DAFTAR ISI ... xi
2.1 Ginseng Kuning (Rennellia elliptica Korth.) ... 4
2.2 Hewan Percobaan... 5
2.6.1 Penentuan LD50 berdasarkan OECD ... 12
2.6 Efek Toksik Teerhadap Organ Sasaran ... 16
xii
3.3.1 Uji Kadar Air Simplisia ... 19
3.3.2 Ekstraksi Kulit Akar Ginseng Kuning ... 19
3.3.3 Hewan Percobaan ... 20
3.3.4 Uji Toksisitas Akut ... 20
3.3.5 Pengamatan Histopatologi Organ Mencit ... 21
BAB 4. HASIL DAN PEMBAHASAN . ... 24
4.1 Hasil penelitian ... 24
4.1.1 Kadar Air Simplisia dan Ekstrak Etanol Kulit Akar Ginseng Kuning ... 24
4.1.2 Pengamatan Tanda-tanda Toksisitas ... 24
4.1.3 Hasil Bobot Mencit ... 24
4.1.4 Hasil Uji Toksisitas ... 25
4.1.5 Hasil Pengamatan Organ Secara Makroskopis ... 25
4.1.6 Hasil Pengamatan Histopatologi ... 25
4.2Pembahasan ... 27
BAB 5. KESIMPULAN DAN SARAN ... 33
5.1 Kesimpulan ... 33
5.2 Saran ... 33
Tabel Halaman
Tabel 2.1 Klasifikasi toksisitas akut ... 10
Tabel 2.2 Perbandingan metode yang berbeda dalam penentuan nilai LD50 ... 11
Tabel 2.3 Prinsip penentuan LD50 pada tiga metode ... 15
Tabel 3.1 Perlakuan terhadap mencit ... 21
Tabel 4.1 Bobot Mencit... 24
xiv
Halaman
Lampiran 1. Alur Kerja. ... 38
Lampiran 2. Penghitungan Kadar Air Simplisia, Rendemen Ekstrak, dan Pembuatan Larutan Uji ... 40
Lampiran 3. Hasil Pengamatan Tanda-tanda Toksisitas ... 42
Lampiran 4. Analisa Data Bobot Mencit ... 44
Lampiran 5. Hasil Uji Toksisitas Akut ... 47
Lampiran 6. Histopatologi Organ Hati... 48
Lampiran 7. Histopatologi Organ Ginjal ... 51
Lampiran 8. Histopatologi Organ Limpa ... 54
1 UIN Syarif Hidayatullah Jakarta
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Penggunaan obat tradisional memiliki sejarah yang sangat panjang. Hal ini
merupakan suatu kekayaan pengetahuan, keterampilan dan praktik berdasarkan
keyakinan dan pengalaman adat yang setiap daerah memiliki budaya yang
berbeda. Praktik pengobatan tradisional sangat bervariasi dari satu negara ke
negara, dan dari daerah ke daerah, karena hal tersebut dipengaruhi oleh
faktor-faktor seperti budaya, sejarah, sikap personal dan filsafat. Menurut WHO, 80%
penduduk dunia masih bergantung pada pengobatan tradisional. Sejarah panjang
menunjukkan bahwa terdapat banyak praktik pengobatan tradisional berdasarkan
pengalaman, kemudian diteruskan dari generasi ke generasi, telah menunjukkan
keamanan dan kemanjuran obat tradisional. Namun, diperlukan penelitian ilmiah
untuk memberikan bukti keamanan dan kemanjuran dari obat tradisional tersebut
(WHO, 2000).
Indonesia merupakan negara tropis dengan sumber tanaman obat yang
berlimpah dan juga merupakan negara dengan keanekaragaman hayati terbesar
kedua di dunia setelah Brazil, bahkan dapat menjadi posisi pertama jika
keanekaragaman hayati laut juga dipertimbangkan. Sekitar 80% sumber tanaman
obat di dunia terdapat di hutan tropis Indonesia (Handa, et al., 2006). Salah satu
tanaman yang terdapat di hutan di Indonesia adalah Ginseng Kuning (Rennellia
elliptica Korth.), tanaman ini merupakan tanaman dari genus Rennellia dan
termasuk dalam Famili Rubiaceae. Tanaman tersebut tumbuh di daerah Sumatera
dan Kalimantan (Suratman, 2008). Akar dari tanaman ini telah dimanfaatkan
secara tradisional untuk mengobati nyeri badan, tonik setelah melahirkan, serta
digunakan sebagai zat afrodisiak. Secara ilmiah, telah dilaporkan bahwa akar
tumbuhan tersebut mengandung antrakuinon yang berfungsi sebagai
antiplasmodial dengan nilai IC50 4,04 µg/mL (Osman, et al., 2010) dan juga
UIN Syarif Hidayatullah Jakarta Hakekatnya maksud obat tradisional ditelitikembangkan adalah untuk
dimanfaatkan sebagai obat untuk manusia, karenanya uji toksisitas obat
tradisional perlu dilakukan untuk menilai keamanan obat tradisional yang di uji.
Uji toksisitas terdiri atas 2 jenis, yaitu: uji toksisitas umum (akut,
subakut/subkronis, kronis) dan uji toksisitas khusus (teratogenik, mutagenic, dan
karsinogenik) (Derkes RI, 2000).
Dalam rangka pengembangan pemanfaatan akar Ginseng Kuning sebagai
bahan obat, perlu dilakukan penelitian mengenai efikasi dan keamanannya. Uji
toksisitas ini merupakan salah satu bagian dari rangkaian studi terhadap akar
Ginseng Kuning yang juga meliputi evaluasi senyawa bioaktif dan studi preklinik
sebagai afrodisiak guna mendukung penggunaan bahan tumbuhan ini sebagai
bahan afrodisiak. Uji toksisitas bahan obat pada tahap preklinik meliputi uji
toksisitas umum dengan dosis tunggal (akut) dan dosis berulang. Saat ini belum
terdapat laporan tentang tingkat keamanan dalam penggunaan akar tumbuhan
Ginseng Kuning. Oleh karena itu, pada penelitian ini akan dipelajari derajat
efisiensi, keamanan dan efek-efek yang ditimbulkan pada penggunaan ekstrak
akar Ginseng Kuning (Rennellia elliptica Korth.) sebagai obat tradisional seperti
yang telah digunakan, dengan menentukan dosis toksisitas akut (LD50) serta
melihat histopatologi yang terjadi pada organ hati, ginjal, dan limpa pada mencit.
1.2 Rumusan Masalah
1. Apakah pemberian dosis tunggal ekstrak etanol kulit akar Ginseng
Kuning (Rennellia elliptica Korth.) memiliki efek toksik terhadap
mencit?
2. Berapa nilai LD50 ekstrak etanol kulit akar Ginseng Kuning (Rennellia
elliptica Korth.) yang diberikan per oral pada mencit?
3. Bagaimana pengaruh pemberian dosis tunggal ekstrak etanol kulit akar
Ginseng Kuning (Rennellia elliptica Korth.) terhadap histopatologi
UIN Syarif Hidayatullah Jakarta 1.3 Tujuan Penelitian
Menentukan toksisitas akut ekstrak etanol kulit akar Ginseng Kuning
(Rennellia elliptica Korth.) yang diberikan per oral pada mencit dengan
menentukan LD50 serta pengaruhnya terhadap histopatologi organ hati, ginjal, dan
limpa mencit.
1.4 Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi penelitian lebih
lanjut mengenai toksisitas akut pemberian ekstrak etanol kulit akar Ginseng
Kuning (Rennellia elliptica Korth.) terhadap mencit dan memperkirakan resiko
penggunaan ekstrak kulit akar Ginseng Kuning pada manusia, sehingga nantinya
penggunaan ekstrak tersebut dapat dilakukan secara aman. Selain itu juga sebagai
landasan bagi pengembangan lebih lanjut kulit akar Ginseng Kuning sebagai
BAB 2
TINJAUAN PUSTAKA
2.1 Ginseng Kuning (Rennellia elliptica Korth.)
Ginseng Kuning (Rennellia elliptica Korth.) merupakan tumbuhan dari
famili Rubiaceae yang tumbuh di sepanjang tepi sungai dan hutan di dataran
rendah, pada ketinggian 40-650 m di atas permukaan laut. Tumbuhan ini tersebar
di bagian selatan Myanmar sampai Malaysia Barat, serta daerah Sumatera,
Kalimantan, dan Semenanjung Melayu. Di Sumatera, spesies ini terdapat di
Sumatera Utara, Sumatera Barat, dan Sumatera Selatan. Nama daerah dari
tumbuhan ini dikenal dengan nama Jarum-Jarum Betina, Kayu Kuni, Kayu Kemik
(Minangkabau). Di Malaysia dikenal dengan sebutan Segemuk atau Mengkudu
Rimba, dan juga disebut dengan sebutan Ginseng Kuning karena berupa akar
dengan warna kuning (Suratman, 2008; Osman, et al., 2010; Ismail, et al., 2012).
Gambar 2.1 Akar, buah, dan daun Ginseng Kuning (Rennellia elliptica Korth.)
(Ismail et al, 2012)
Ginseng Kuning (Rennellia elliptica Korth.) memiliki bentuk pohon kecil
atau semak belukar dengan tinggi 1,5-2 m, dengan batang lignosus. Daun
berbentuk bulat panjang dengan panjang 8-23 cm, berwarna hijau tua atau hijau
pucat, dengan tangkai yang panjang. Bunga berwarna putih atau ungu gelap dan
beraroma sangat harum. Buah berbentuk bulat dan berwarna hijau (Suratman,
UIN Syarif Hidayatullah Jakarta
Kingdom : Plantae
Sub Kingdom : Tracheobionta
Super Divisi : Spermatophyta
Divisi : Magnoliophyta
(Sumber:NCBI,http://www.ncbi.nlm.nih.gov/Taxonomy/Browser)
Ekstrak akar Ginseng Kuning (Rennellia elliptica Korth.) secara
tradisional telah digunakan untuk berbagai tujuan, diantaranya sebagai zat
afrodisiak, untuk mengobati nyeri badan dan untuk mengatasi sakit setelah
melahirkan. Akar Ginseng Kuning (Rennellia elliptica Korth.) mengandung
antrakuinon yang berfungsi sebagai antiplasmodial dengan nilai IC50 4,04 µg/mL
(Osman, et al., 2010) dan juga sebagai antioksidan (Ahmad, et al., 2010).
Senyawa yang terkandung dalam akar Ginseng Kuning (Rennellia elliptica
Korth.) adalah 1,2-dimetoksi-6-metil-9,10-antrakuinon, rubiadin,
1-hidroksi-2-metoksi-6-metil-9,10-antrakuinon, nordamnacanthal, damnacanthal,
3-formil-2-hidroksi-9,10-antrakuinon, lucidin-ω-metil eter,
3-hiodroksi-2-metil-9,10-antrakuinon, 2-hidroksi-3-metoksi-6-metil-9,10-3-hiodroksi-2-metil-9,10-antrakuinon, rubiadin-l-metil eter,
3-hidroksi-2-hidroksimetil-9,10-antrakuinon (Ismail, et al., 2012).
2.2 Hewan Percobaan
Pada dasarnya tidak ada satu hewan pun yang sempurna untuk uji toksisitas
akut yang nantinya akan digunakan oleh manusia. Walaupun tidak ada aturan
tetap yang mengatur pemilihan spesies hewan coba, yang lazim digunakan pada
uji toksisitas akut adalah tikus, mencit, marmut, kelinci, babi, anjing, monyet.
Tikus dan mencit merupakan hewan yang paling umum digunakan dalam
penelitian ilmiah, tikus dan mencit merupakan spesies hewan yang hampir 14 kali
lebih banyak digunakan dibanding dengan spesies lainnya (Porter, 2000).
Pada awalnya, pertimbangan dalam memilih hewan coba hanya berdasarkan
avaibilitas, harga, dan kemudahan dalam perawatan. Namun seiring
perkembangan zaman tipe metabolisme, farmakokinetik, dan perbandingan
catatan atau sejarah avaibilitas juga ikut dipertimbangkan. Hewan yang paling
sering dipakai adalah mencit dengan mempertimbangkan faktor ukuran,
kemudahan perawatan, harga, dan hasil yang cukup konsisten dan relevan
(Jacobson, et al., 2004). Taksonomi dari mencit yaitu :
Kingdom : Animalia
Filum : Chordata
Sub filum : Vertebrata
Kelas : Mamalia
Ordo : Rodentia
Familia : Muridae
Sub family : Murinae
Genus : Mus
Species : Mus musculus (Sumber :Schwiebert, 2007 )
2.3 Metode Ekstraksi (Depkes RI, 2000)
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Berikut
adalah beberapa cara ekstraksi dengan menggunakan pelarut:
2.3.1 Cara dingin
a. Maserasi
Maserasi merupakan cara ekstraksi yang dilakukan dengan merendam
serbuk simplisia dalam cairan penyari (pelarut) dengan beberapa kali pengocokan
atau pengadukan pada temperatur ruang (kamar). Secara teknologi termasuk
ekstraksi dengan prinsip metode pencapaian konsentrasi pada keseimbangan.
Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan
UIN Syarif Hidayatullah Jakarta b. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna (exhaustive extraction) yang umumnya dilakukan pada temperatur
ruangan. Prinsip perkolasi adalah serbuk simplisisa ditempatkan dalam suatu
bejana silinder yang bagian bawahnya diberi sekat berpori. Cairan penyari
dialirkan dari atas ke bawah melalui serbuk tersebut, kemudian melarutkan zat
aktif dari sel-sel yang dilalui sampai mencapai keadaan jenuh.
2.3.2 Cara panas
a. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan
adanya pendingin balik. Umumnya dilakukan pengulangan proses pada residu
pertama sampai 3-5 kali sehingga dapat termasuk proses ekstraksi sempurna.
b. Sokhlet
Sokhlet merupakan ekstraksi menggunakan pelarut yang selalu baru
umumnya dilakukan alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah
pelarut relatif konstan dengan adanya pendingin balik.
c. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara umum
dilakukan pada temperatur 40-500C.
d. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur terukur 96-980C)
selama waktu tertentu (15-20 menit). Infus pada umumnya digunakan untuk
menarik atau mengekstraksi zat aktif yang larut dalam air dan bahan-bahan nabati.
oleh kuman dan kapang, sehingga ekstrak yang diperoleh dengan infus tidak boleh
disimpan lebih dari 4 jam.
e. Dekok
Dekok adalah infus pada waktu yang lebih lama (> 30 menit) dan
temperatur sampai titik didih air.
2.4 Toksisitas
Suatu zat kimia dikatakan toksik (beracun) diartikan sebagai zat yang
berpotensi memberikan efek berbahaya terhadap mekanisme biologi tertentu pada
suatu organisme. Sifat toksik suatu senyawa ditentukan oleh: dosis, konsentrasi
racun pada reseptor, sifat zat tersebut, kondisi bioorganisme, dan bentuk efek
yang ditimbulkan. Toksisitas merupakan istilah relatif dari suatu zat kimia, dalam
kemampuannya menimbulkan efek berbahaya atau penyimpangan mekanisme
biologi pada suatu organisme (Wirasuta, et al., 2007).
Pada umumnya pajanan zat kimia tidak dapat dihindari (pada kasus tertentu
bahkan dikehendaki), seharusnya dilakukan evaluasi toksikologi terhadap
kebanyakan zat kimia untuk menentukan tingkat pajanan yang kiranya tidak
menimbulkan resiko. Umumnya uji toksisitas bertujuan untuk menilai resiko yang
mungkin ditimbulkan dari suatu zat kimia toksikan pada manusia. Untuk
mengenali suatu zat kimia maka perlu dikenali bahaya yang mungkin ditimbulkan.
Hal ini dilakukan dengan mengumpulkan serta menyusun data toksisitas yang
relevan dan data yang berkaitan (Lu, 1995).
Tujuan akhir dari uji toksikologi dan penelitian lainnya yang berkaitan
dalam menilai keamanan/resiko toksikan pada manusia, idealnya data
dikumpulkan dari manusia. Tetapi karena hambatan etik tidak memungkinkan
langsung melakukan uji toksisitas pada manusia. Oleh karena itu uji toksikologi
umumnya dilakukan pada binatang, hewan sel tunggal, atau sel kultur. Dari
data-data tersebut dilakukan ekstrapolasi ke manusia, sehingga diperoleh
batasan-batasan nilai yang dapat diterapkan pada manusia guna memenuhi tujuan akhir
UIN Syarif Hidayatullah Jakarta 2.5 Uji Toksisitas
Pengujian toksisitas diperlukan untuk mengetahui dosis yang dapat
menyebabkan keracunan. Pengujian toksisitas biasanya dibagi menjadi tiga
kategori: (1) Uji toksisitas akut dilakukan dengan memberikan zat kimia yang
sedang diuji sebanyak satu kali, atau beberapa kali dalam waktu 24 jam; (2) Uji
toksisitas jangka pendek (subakut atau subkronik) dilakukan dengan memberikan
bahan tersebut berulang-ulang, biasanya setiap hari atau lima kali seminggu
selama jangka waktu kurang lebih 10% dari masa hidup hewan; (3) Uji toksisitas
jangka panjang (kronik) dilakukan dengan memberikan zat kimia berulang-ulang
selama masa hidup hewan coba atau sekurang-kurangnya sebagian besar dari
hidupnya (Lu, 1995).
Menurut Gupta, et al. (2012), Uji toksisitas akut merupakan uji di mana
dosis tunggal zat kimia yang diberikan pada hewan percobaan untuk menentukan
LD50 (dosis yang menyebabkan kematian 50% dari kelompok hewan percobaan).
Hal ini merupakan langkah awal dalam penilaian dan evaluasi sifat toksik dari
suatu zat kimia serta merupakan salah satu pemeriksaan awal yang dilakukan pada
semua senyawa.
Beberapa faktor yang perlu diperhatikan dalam penentuan nilai LD50
diantaranya yaitu, pengacakan hewan percobaan, selisih bobot antar hewan,
pengosongan lambung (puasa), dan ketersediaan air. Selain itu juga dipengaruhi
oleh penentuan dosis awal percobaan untuk meminimalkan hewan yang mati,
sehingga mengurangi jumlah hewan yang digunakan dalam percobaan. Metode ini
juga meningkatkan presisi dari nilai LD50 (Gupta, et al., 2012 ). Kategori dan
kriteria nilai toksisitas akut dinyatakan sebagai nilai LD50 atau sebagai estimasi
Tabel 2.1 Klasifikasi Toksisitas Akut
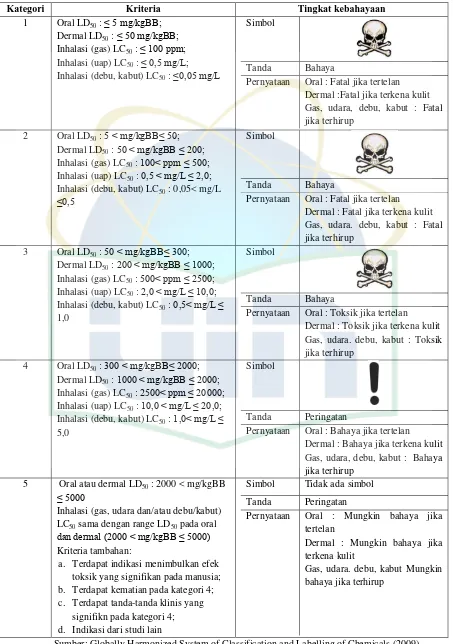
Kategori Kriteria Tingkat kebahayaan
1 Oral LD50: ≤ 5 mg/kgBB;
Dermal LD50: ≤ 50 mg/kgBB;
Inhalasi (gas) LC50: ≤ 100 ppm;
Inhalasi (uap) LC50: ≤ 0,5 mg/L;
Inhalasi (debu, kabut) LC50: ≤0,05 mg/L
Simbol
Tanda Bahaya
Pernyataan Oral : Fatal jika tertelan Dermal :Fatal jika terkena kulit Gas, udara, debu, kabut : Fatal
Pernyataan Oral : Fatal jika tertelan Dermal : Fatal jika terkena kulit Gas, udara. debu, kabut : Fatal jika terhirup
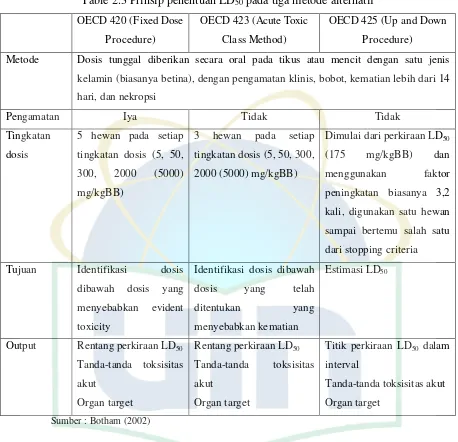
3 Oral LD50: 50 < mg/kgBB≤ 300;
Dermal LD50: 200 < mg/kgBB ≤ 1000;
Inhalasi (gas) LC50: 500< ppm ≤ 2500;
Inhalasi (uap) LC50: 2,0 < mg/L ≤ 10,0;
Inhalasi (debu, kabut) LC50: 0,5< mg/L ≤
1,0
Simbol
Tanda Bahaya
Pernyataan Oral : Toksik jika tertelan Dermal : Toksik jika terkena kulit Gas, udara. debu, kabut : Toksik jika terhirup
4 Oral LD50: 300 < mg/kgBB≤ 2000;
Dermal LD50: 1000 < mg/kgBB ≤ 2000;
Inhalasi (gas) LC50: 2500< ppm ≤ 20000;
Inhalasi (uap) LC50: 10,0 < mg/L ≤ 20,0;
Inhalasi (debu, kabut) LC50: 1,0< mg/L ≤
5,0
Simbol
Tanda Peringatan
Pernyataan Oral : Bahaya jika tertelan Dermal : Bahaya jika terkena kulit Gas, udara, debu, kabut : Bahaya jika terhirup
5 Oral atau dermal LD50 : 2000 < mg/kgBB
≤ 5000
Inhalasi (gas, udara dan/atau debu/kabut) LC50 sama dengan range LD50 pada oral
dan dermal (2000 < mg/kgBB ≤ 5000)
Kriteria tambahan:
a. Terdapat indikasi menimbulkan efek toksik yang signifikan pada manusia; b. Terdapat kematian pada kategori 4; c. Terdapat tanda-tanda klinis yang
signifikn pada kategori 4; d. Indikasi dari studi lain
UIN Syarif Hidayatullah Jakarta 2.6 Penentuan LD50
Dalam menentukan nilai LD50 terdapat beberapa metode yang digunakan,
seperti metode grafik (Miller-Tainter), metode aritmatika (Karber), dan
pendekatan statistik. Metode lain yang juga sering digunakan diantaranya adalah
metode Litchfield dan Wilcoxson, serta metode Reed-Muench. Dari beberapa
metode tersebut Paramveer. S, et al. (2010), menyimpulkan perbandingan dari
metode-metode tersebut seperti pada tabel dibawah ini.
Table.2.2 Perbandingan metode yang berbeda dalam penentuan nilai LD50
Metode Karber Metode Miller – Tainter Metode Lorke
Jumlah hewan Melebihi kebutuhan Melebihi kebutuhan Tepat
Pengeluaran Tinggi Tinggi Rata-rata (biasa)
Keakuratan hasil Tidak akurat Tidak akurat Meragukan
Sumber : Paramveer, S (2010)
Selain dari metode yang telah banyak digunakan, terdapat tiga metode
alternatif yang diadopsi dimana menggunakan perlakuan yang lebih manusiawi
terhadap hewan dan menggunakan lebih sedikit hewan. Metode tersebut merekam
tanda-tanda toksisitas sampai menunjukkan kematian pada hewan percobaan.
Menurut Paramveer. S, et al. (2010), tiga metode alternatif tersebut adalah metode
dari OECD (The Organisation for Economic Co-operation and Development)
yaitu:
1. Prosedur Penetapan Dosis (Fixed Dose Procedure )- OECD 420
2. Metode Tingkat Toksik Akut (Acute Toxic Class method)-OECD 423
3. Prosedur peningkatan dan penurunan (Up-and-Down Procedure)-OECD
425
Ketiga metode uji toksisitas akut dari OECD tersebut merupakan pilihan yang
dapat digunakan dalam penentuan nilai LD50. Seperti metode uji toksisitas akut
lainnya, Up and Down Procedure (UDP) merupakan metode yang dapat dipercaya
dalam uji toksisitas akut. UDP adalah metode yang efisien dalam menentukan
nilai LD50. Metode ini dapat memperkirakan klasifikasi tingkat bahaya dengan
Sehingga dalam hal ini penggunaan metode UDP dapat dipertimbangkan secara
ekonomi, sains, dan etik (WHO, 2002).
2.6.1 Penentuan LD50 berdasarkan OECD
Panduan dari OECD (The Organisation for Economic Co-operation and
Development) yang membahas tentang uji toksisitas menjelaskan bahwa semua
panduan dari OECD melibatkan pemberian dosis tunggal dari sampel uji untuk
hewan dewasa muda yang sehat secara oral, pemgamatan dilakukan sampai 14
hari setelah pemberian dosis, dengan pencatatan berat badan dan nekropsi dari
semua hewan. Dosis dapat diberikan berdasarkan pada volume konstan atau
konsentrasi konstan tergantung pada kebutuhan toksikologi. Setiap hewan dipilih
secara acak. Pada saat pemberian sampel uji, setiap hewan harus berumur antara
8-12 minggu dan beratnya harus dalam interval ± 20% dari berat rata-rata semua
hewan. Titik akhir untuk Panduan 423 dan 425 adalah angka kematian, tetapi
untuk Pedoman 420 itu adalah pengamatan tanda-tanda jelas yang menunjukkan
toksisitas (evident toxicity) (OECD,2001).
Panduan 420 (Fixed Dose Procedure): Studi pengamatan untuk memilih
dosis awal yang tepat dan meminimalkan jumlah hewan yang digunakan. Dosis
yang digunakan adalah 5, 50, 300 atau 2000 mg/kgbb. Kelompok hewan
dilakukan pemberian setiap tingkat dosis sampel secara bertahap, dengan dosis
awal yang terpilih diharapkan menghasilkan beberapa tanda-tanda toksisitas.
Kelompok hewan selajutnya diberikan dosis yang lebih tinggi atau lebih rendah,
tergantung pada tanda-tanda toksisitas, sampai tujuan dicapai, yaitu, klasifikasi zat
uji berdasarkan identifikasi dosis menyebabkan evident toxicity. Setiap kelompok
dalam satu tingkat dosis terdiri dari lima hewan dewasa muda dari satu jenis
kelamin. Hewan diamati secara individu pada tiap-tiap tingkatan dosis. Jumlah
hewan yang digunakan antara 5-7 hewan, dan 5 hewan yang digunakan dalam uji
limit dose (OECD,2001).
Panduan 423 (Acute Toxic Class): Dosis yang digunakan adalah 5, 50,
300 atau 2000 mg/kgbb. Pemberian sampel uji pada tiap kelompok hewan
dilakukan secara bertahap, dengan dosis awal yang terpilih diharapkan
UIN Syarif Hidayatullah Jakarta diberikan dosis lebih tinggi atau lebih rendah, tergantung pada kematian, sampai
tujuan dicapai, yaitu, klasifikasi zat uji berdasarkan identifikasi dosis yang
menyebabkan kematian, kecuali bila tidak ada efek pada dosis tertinggi. Pengujian
ini menggunakan 3 hewan dari satu jenis kelamin dalam tiap kelompok. Rata-rata
jumlah hewan yang digunakan adalah 7, dan sekitar 6 hewan yang digunakan
dalam uji limit dose (OECD,2001).
Panduan 425 (Up and Down Procedure): Pada metode ini terdapat dua
macam cara pengujian toksisitas akut secara oral, yaitu limit test dan main test.
Limit test digunakan ketika diketahui bahwa zat uji yang akan diujikan memiliki
tingkat toksisitas yang rendah, mempunyai dosis toksik dibawah batas dosis yang
telah ditentukan. Sedangkan ketika terdapat sedikit atau tidak ada informasi
tentang toksisitas zat uji tersebut atau jika diduga toksik, maka digunakan main
test (OECD, 2008).
Pada pengujian dengan limit test, digunakan satu hewan terlebih dahulu
untuk diberikan sampel dengan dosis 2000 mg/kgbb. jika hewan tersebut mati
maka dilakukan main test, tetapi jika hewan tersebut hidup maka digunakan empat
hewan lainnya dan diberikan dosis yang sama. Dari kelima hewan tersebut jika
terdapat tiga atau lebih hewan yang masih bertahan hidup maka dosis toksik
sampel lebih dari 2000 mg/kgbb. tetapi jika terdapat tiga atau lebih hewan yang
mati maka dilakukan pengujian main test (OECD, 2008).
Panduan ini juga merupakan prosedur yang bertahap, tetapi menggunakan
hewan tunggal, dengan hewan pertama diberikan dosis di bawah estimasi dari
LD50. Tergantung pada hasil dari hewan sebelumnya, dosis selanjutnya ditambah
atau dikurangi dengan faktor antilog 1/estimasi kemiringan (slope) pada kurva
dosis respon, biasanya dengan faktor 3,2. Urutan ini berlanjut sampai ada
pembalikan dari hasil awal, kemudian, dosis yang diberikan pada hewan
selanjutnya mengikuti prinsip up-down sampai stopping criteria terpenuhi. Jika
tidak ada pembalikan sebelum mencapai batas dosis yang dipilih (2000 atau 5000
mg/kgbb), maka hewan yang digunakan tidak lebih dari jumlah hewan yang ada
pada limit test. Pilihan untuk menggunakan dosis batas atas 5000 mg/kgbb
digunakan hanya jika dibenarkan oleh kebutuhan regulasi tertentu. Stopping
a. 3 hewan berturut-turut bertahan di atas batas dosis;
b. 5 pembalikan (reverse) terjadi pada setiap 6 hewan yang diuji berturut-turut;
c. Sedikitnya terdapat 4 hewan telah mengalami pembalikan pertama.
Pengujian ini menggunakan satu hewan dari satu jenis kelamin. Pemodelan
statistik menunjukkan bahwa rata-rata jumlah hewan yang digunakan dalam
pengujian ini adalah sekitar 6-9 hewan dan 5 hewan yang digunakan dalam limit
test (OECD, 2001).
Untuk ketiga panduan tersebut, pengamatan klinis yang cermat harus
dilakukan setidaknya dua kali pada hari pemberian dosis atau lebih sering ketika
menunjukkan respon dari hewan, dan setidaknya sekali sehari setelahnya.
Pengamatan tambahan dilakukan jika hewan terus menunjukkan tanda-tanda
toksisitas. Pengamatan meliputi perubahan kulit dan bulu, mata dan selaput lendir,
pernapasan, peredaran darah, sistem saraf pusat dan otonom, aktivitas
somatomotor dan tingkah laku. Pengamatan tambahan dibutuhkan jika terdapat
hewan yang menunjukkan tanda-tanda keracunan, Pengamatan yang dilakukan
meliputi tremor (gemetar), konvulsi (kejang), salivasi, diare, letargi (kelesuan),
sedatif dan koma. Jika terdapat hewan yang dalam keadaan hampir mati dan
menujukkan kesakitan yang hebat atau menunjukkan stress hebat sebaiknya
dibunuh. Hewan yang dibunuh dianggap dalam interpretasi hasil dengan cara yang
sama seperti hewan yang mati pada pengujian (OECD,2001).
Botham (2002), menyimpulkan ketiga alternatif metode tersebut dalam tabel
UIN Syarif Hidayatullah Jakarta Table 2.3 Prinsip penentuan LD50 pada tiga metode alternatif
OECD 420 (Fixed Dose
kelamin (biasanya betina), dengan pengamatan klinis, bobot, kematian lebih dari 14 hari, dan nekropsi
tingkatan dosis (5, 50, 300, 2000 (5000) mg/kgBB)
Dimulai dari perkiraan LD50
(175 mg/kgBB) dan menggunakan faktor
peningkatan biasanya 3,2 kali, digunakan satu hewan
sampai bertemu salah satu dari stopping criteria
Tujuan Identifikasi dosis
dibawah dosis yang menyebabkan evident
toxicity
Identifikasi dosis dibawah
dosis yang telah ditentukan yang
menyebabkan kematian
Estimasi LD50
Output Rentang perkiraan LD50
Tanda-tanda toksisitas
Keterbatasan dari ketiga metode tersebut adalah (OECD,2001) :
1. Metode ini mungkin memiliki hasil klasifikasi yang melebihi atau kurang
tepat terhadap nilai LD50 sesungguhnya dan hasil yang diperoleh cenderung
dipengaruhi oleh pemilihan dosis awal yang digunakan terutama pada zat
yang memiliki dosis yang rendah.
2. Bisa saja zat uji dapat menyebabkan kematian tertunda (5 hari atau lebih
setelah pemberian zat uji). Zat uji yang dapat menyebabkan kematian tertunda
berpengaruh pada penggunaan panduan 425, dimana durasi pengujian lebih
temuan kematian tertunda mungkin memerlukan tambahan dosis dengan
tingkat yang lebih rendah yang dilakukan secara berulang.
2.7 Efek Toksik Terhadap Organ Sasaran
2.7.1 Hati
Hati merupakan organ terbesar dalam tubuh, menempati hampir seluruh
bagian atas rongga abdomen. Dalam hati terdapat 3 jenis jaringan yang penting,
yaitu sel parenkim hati, susunan pembuluh darah, dan susunan saluran empedu.
Ketiga jaringan ini berhubungan erat, sehingga kerusakan satu jenis jaringan dapat
mengakibatkan kerusakan jaringan lain. Histologi hati terdiri atas lobulus.
Lobulus berisi sel epitel khusus yang disebut hepatosit yang tersusun tidak teratur,
bercabang-cabang dan selnya saling berhubungan mengelilingi vena sentralis.
Pada kapiler terdapat celah garis endotel yang disebut sinusoid yang merupakan
tempat perlintasan darah. Pada sinusoid terdapat sel fagositosis yang disebut sel
Kuppfer yang berfungsi menghancurkan leukosit dan sel darah merah yang rusak,
bakteri dan benda asing lain pada aliran pembuluh darah vena dari traktus
gastrointestinalis (Tortora, 2005).
Pemeriksaan histopatologi meliputi perubahan berat organ dan penampilan
warna hewan uji. Warna dan penampilan sering dapat menunjukkan sifat
toksisitas, seperti perlemakan hati atau sirosis. Biasanya berat organ merupakan
penunjuk yang sangat peka dari efek pada hati. Pemeriksaan mikroskopik dapat
menggunakan mikroskop cahaya untuk mendeteksi berbagai jenis kelainan,
seperti perlemakan, sirosis, nekrosis, nodul hiperplastik, dan neoplasia (Lu, 1995).
2.7.2 Ginjal
. Ginjal merupakan organ yang berperan mengatur keseimbangan cairan
tubuh serta mengekskresi kelebihannya sebagai kemih. Nefron merupakan unit
fungsional dan struktural dari ginjal dan ginjal terdiri dari ribuan nefron. Tiap
nefron terdiri dari dua bagian, yaitu korpus renalis dimana plasma darah difiltrasi
dan tubulus renalis yang mengabsorpsi dan mensekresi cairan yang lewat. Korpus
renalis dibagi menjadi dua bagian yaitu glomerulus (kapiler glomerulus) dan
UIN Syarif Hidayatullah Jakarta menjadi tiga bagian, yaitu tubulus proksimal, lengkung henle dan tubulus distalis
(Tortora 2005).
Pemeriksaan patologi makroskopik dilakukan dengan menimbang berat
ginjal hewan uji. Bila terdapat perbedaan dengan hewan pembanding sering
menujukkan terjadinya lesi ginjal. Dan pemeriksaan mikroskopik dapat
mengungkapkan tempat, luas, dan sifat morfologik lesi ginjal (Lu, 1995).
2.7.3 Limpa
Limpa merupakan organ limfoid terbesar dan terletak di antara fundus
lambung dan diafragma. Limpa dibungkus oleh peritoneum dan berhubungan
dengan lambung, diafragma, dan ginjal kiri oleh lipatan peritoneum yang disebut
ligamen gastrolienal, frenikolienal dan lienorenal. Limpa berfungsi sebagai imun
terhadap antigen yang terbawa oleh darah, mengakumulasi limfosit dan makrofag,
dan degradasi eritrosit. Limpa dibungkus oleh kapsula, yang terdiri atas dua
lapisan, yaitu satu lapisan jaringan penyokong yang tebal dan satu lapisan otot
halus. Perpanjangan kapsula ke dalam parenkim limpa disebut trabekula.
Trabekula mengandung arteri, vena, saraf, dan pembuluh limfe. Parenkim limpa
disebut pulpa yang terdiri atas pulpa merah dan pulpa putih. Pulpa merah
berwarna merah gelap pada potongan limpa segar. Pulpa merah terdiri atas
sinusoid limpa .Pulpa putih tersebar dalam pulpa merah, berbentuk oval dan
berwarna putih kelabu. Pulpa putih terdiri atas pariarteriolar limphoid sheats
(PALS), folikel limfoid, dan zona marginal (Fawcett, 2002).
Struktur intern limpa dan keterkaitan antara pulpa putih dan pulpa merah
didasarkan atas penyebaran pembuluh darahnya. Pulpa putih parenkim limpa
disusun sekitar arteri dan pulpa merah mengisi celah-celah diantara sinus-sinus
venosus. Spesies dengan volume darah relatif kecil (kelinci, rodensia percobaan)
memiliki banyak pulpa putih, kerangka jaringan ikat nyata, dan otot-otot polos
BAB 3
METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Penelitian ini di laksanakan di Laboratorium Biosains dan Laboratorium
Reproduksi Pusat Penelitian Biologi LIPI yang berada di Jalan Raya
Jakarta-Bogor Km.46 Cibinong Jakarta-Bogor, serta di Laboratorium Penelitian I FKIK UIN
Syarif Hidayatullah Jakarta Jl. Kertamukti No. 5 Pisangan Ciputat, yang dimulai
dari bulan April sampai September 2013.
3.2 Alat dan Bahan Penelitian
3.2.1 Alat
Alat-alat yang digunakan terdiri dari gunting, gelas beker (pyrex), gelas
ukur (pyrex), pipet tetes, spatula, batang pengaduk, erlenmeyer (pyrex), labu 100
ml (pyrex), kertas saring (whatman no.2), vial, timbangan analitik, rotary
evaporator (heidolph WB 2000), freeze dryer (eyela), sonde, kandang mencit,
masker, sarung tangan, timbangan hewan, papan bedah, alat bedah steril,
mikrotom (yamato), oven, kaca objek, dan mikroskop (Olympus IX71).
3.2.2 Bahan Kimia
Bahan-bahan yang digunakan yaitu; aquadest, etanol 96%, Na CMC
(Sigma), eter, Buffer Neutral Formalin (BNF) 10 %, alkohol, xylen, paraffin, dan
pewarna haematoksilin-eosin.
3.2.3 Bahan Uji
Bahan uji yang digunakan dalam penelitian ini ialah kulit akar Ginseng
Kuning (Rennellia elliptica Korth.) yang berasal dari Pontianak Kalimantan Barat
dan merupakan koleksi Laboratorium Fitokimia Pusat Penelitian Biologi Lembaga
UIN Syarif Hidayatullah Jakarta 3.2.4 Hewan Coba
Hewan percobaan yang digunakan dalam penentuan nilai LD50 merupakan
mencit (Mus musculus) galur Deutsch Denken Yokken (DDY) betina yang dalam
keadaan nulipara (belum pernah melahirkan) dan tidak hamil. Hewan percobaan
berkisar antara umur 2-3 bulan dengan bobot 25-35 gram. Mencit yang digunakan
dalam penelitian ini sebanyak 7 ekor yang diperoleh dari Laboratorium Patologi
FKH IPB.
3.3 Prosedur Penelitian
3.3.1 Uji Kadar Air Simplisia
1 gram kulit akar Ginseng Kuning segar dimasukkan dan ditimbang
seksama dalam wadah yang telah ditara. Simplisia tersebut dikeringkan pada oven
suhu 1050 C selama 30 menit, dibiarkan hingga suhu ruang dalam desikator, dan
ditimbang. Pengeringan dilanjutkan dan ditimbang sampai perbedaan antara 2
penimbangan berturut-turut tidak lebih dari 0,001 g (Depkes, 2000).
3.3.2 Ekstraksi Kulit Akar Ginseng Kuning (Rennellia elliptica Korth.)
Kulit akar Ginseng Kuning (Rennellia elliptica Kort.) segar sebanyak
259,94 gram ditimbang dan kemudian dirajang kecil. Hasil rajangan ini
diekstraksi dengan metode maserasi menggunakan etanol 96% yang telah
didestilasi. Volume pelarut yang digunakan untuk maserasi adalah 600 mL yaitu
sampai seluruh simplisia teremdam oleh pelarut. Simplisia direndam selama
semalam (±24 jam). Proses ekstraksi ini dilakukan sebanyak lima kali dengan
volume pelarut yang sama. Hasil maserasi disaring menggunakan kapas, dan
selanjutnya disaring dengan kertas saring.
Filtrat yang diperoleh, pelarutnya diuapkan menggunakan rotary evaporator
hingga diperoleh ekstrak kental yang kemudian dikeringkan dengan alat freez
dryer selama 1 hari hingga diperoleh ekstrak kering sebanyak 19,7820 gram, dan
selanjutnya dilakukan penghitungan persen rendemen ekstrak, yaitu:
3.3.3 Hewan Percobaan
Hewan percobaan (mencit) diaklimatisasi selama 10 hari terlebih dahulu
sebelum diberikan perlakuan dengan ditempatkan dalam kandang pada suhu 230 C
(±30 C). Hewan diberikan pellet untuk mencit dan air minum (ad libitum).
Aklimatisasi dilakukan agar mencit dapat menyesuaikan diri dengan lingkungan.
Selama proses aklimatisasi dilakukan pengamatan kondisi umum serta
penimbangan bobot mencit.
3.3.4 Uji Toksisitas Akut
3.3.4.1Penentuan Nilai LD50 (OECD, 2008)
Penentuan nilai LD50 ini menggunakan metode Up and Down Procedure
dengan uji batas dosis (limit test), dimana sebelum diberikan perlakuan, tiga
mencit dipuasakan (tidak diberikan makan) terlebih dahulu selama 3-4 jam
dengan tetap diberikan minum (ad libitum). Setelah dipuasakan mencit ditimbang
dan kemudian satu mencit diberikan secara oral dosis tunggal ekstrak etanol kulit
akar Ginseng Kuning dengan dosis 2000 mg/kgbb yang telah disuspensikan dalam
Na CMC 1%. Volume Administrasi Obat (VAO) dihitung sesuai dengan bobot
mencit, volume dosis tunggal yang diberikan pada mencit tidak lebih dari 1
ml/100 gram. Sedangkan 2 mencit yang lain digunakan sebagai kontrol. Untuk
mencit kontrol hanya diberikan suspensi Na CMC 1% dengan volume pemberian
sama dengan volume yang diberikan pada mencit yang diuji. Ketika sampel uji
telah diberikan, mencit tidak diberikan makan (tetap diberikan minum) selama 1-2
jam, dan kemudian mencit diberikan makan kembali secara ad libitum. Mencit
diamati setiap 30 menit selama 4 jam dan selanjutnya diamati setiap hari sampai
14 hari. Tanda-tanda toksisitas yang diamati meliputi, kulit dan bulu, mata, letargi
(kelesuan), konvulsi (kejang), tremor (gemetar), diare, dan mati.
Dua hari berikutnya pengujian toksisitas ekstrak dilanjutkan pada empat
mencit lain dengan perlakuan sebelum dan sesudah pemberian ekstrak sama
seperti mencit sebelumnya. Pengujian ini dilakukan karena pada 48 jam setelah
peberian ekstrak untuk mencit pertama masih hidup dan tidak menunjukkan
tanda-tanda toksisitas ataupun kematian. Pengamatan bobot mencit dilakukan
UIN Syarif Hidayatullah Jakarta Tabel 3.1 Perlakuan terhadap mencit
Mencit Perlakuan Ket
Perhitungan LD50 menggunakan software AOT 425 StatPgm.
b) Penghitungan Perbedaan Bobot Mencit
Data bobot mencit yang diperoleh diolah secara statistik menggunakan
SPSS. Analisis yang dilakukan yaitu uji homogenitas dan uji kenormalan,
selanjutnya dilakukan analisis varian one way ( ANOVA ) untuk melihat
ada atau tidaknya perbedaan bermakna antara mencit yang diberikan
perlakuan terhadap mencit kontrol.
3.3.5 Pengamatan Histopatologi Organ Mencit
3.3.5.1 Pengambilan Organ Mencit
Pemeriksaan histopatologi ini dilakukan untuk melihat pengaruh dari
pemberian ekstrak etanol kulit akar Ginseng Kuning terhadap organ hati, ginjal,
dan limpa mencit. Mencit yang masih bertahan hidup sampai hari ke 14,
dimatikan dengan cara inhalasi menggunakan eter. Setelah mencit mati, kemudian
dilakukan pembedahan untuk mengambil organ mencit. Pengambilan organ
mencit dilakukan sebagai berikut:
a) Mencit yang telah mati ditelentangkan pada papan bedah.
b) Kulit perut bagian bawah diangkat dengan pinset, kemudian pada bagian
tersebut digunting menggunakan gunting bedah untuk memberikan jalan
c) Pengguntingan tersebut dilanjutkan kearah perut atas sisi kanan dan kiri
hingga ke bagian bawah kedua kaki depan mencit sehingga seluruh bagian
rongga perut mencit terlihat.
d) Organ yang diambil adalah hati, ginjal, dan limpa.
3.3.5.2 Pembuatan Preparat Histologi (Talukder, 2007)
a) Fiksasi Organ direndam dalam Buffer Neutral Formalin (BNF) 10% .
b) Dehidrasi Organ yang telah difiksasi dalam BNF 10% di dehidrasi yaitu
dengan memotong organ kira-kira 1 cm kemudian direndam dalam alkohol
bertingkat (alkohol 70%, 80%, 90%, 95%, dan-100%), masing-masing
menit, dan kemudian dimasukkan dalam paraffin 1,2, dan 3 masing-masing
1 jam. Proses ini dilakukan didalam oven dengan suhu 580 C.
e) Embedding Organ dimasukkan dalam cetakan yang sebelumnya telah
diolesi dengan gliserol dan diisi dengan paraffin cair pada dasarnya. Organ
yang akan diamati diletakkan melintang, kemudian paraffin cair dituang
sampai cetakan penuh. Selanjutnya didiamkan pada suhu ruang selama
sehari, sampai paraffin benar-benar mengeras, setelah itu didinginkan dalam
lemari pendingin pada suhu 40 C.
f) Sectioning Hasil cetakan dipotong dengan menggunakan mikrotom
dengan ketebalan 5 µm.
g) Afiksing Irisan yang diperoleh dari pemotongan tersebut diletakkan di
atas gelas objek yang telah ditetesi air. Kemudian dikeringkan di atas
hotplate dengan suhu ± 400 C selama ± 2 hari.
h) Staining Organ yang telah melekat pada gelas objek, direndam dalam
xylen selama 1 jam, kemudian dilakukan rehidrasi dengan direndam dalam
alkohol bertingkat (alkohol 100%, 95%, 90%, 80%, 70%) masing-masing
UIN Syarif Hidayatullah Jakarta direndam dalam pewarna Hematoksilin selama ± 30 detik, selanjutnya
dicuci pada air mengalir selama 15 menit. Setelah itu direndam dalam
aquadest kembali. Dilanjutkan dengan direndam dalam pewarna eosin
selama ± 30 detik dan kemudian direndam dalam alkohol bertingkat
(alkohol 70%, 80%, 90%, 95%, dan 100%) masing-masing selama ± 30
detik. Setelah itu direndam dalam xylen selama 15-30 menit.
i) Mounting Preparat yang telah terwarnai ditetesi dengan entelan ± 1 tetes.
Kemudian ditutp dengan cover glass.
j) Preparat diamati dibawah mikroskop cahaya untuk melihat organ secara
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Kadar Air Simplisia dan Ekstrak Etanol Kulit Akar Ginseng Kuning
Simplisia kulit akar Ginseng Kuning yang digunakan dalam penelitian ini
memiliki kadar air 3,771%. Sebanyak 259,94 gram kulit akar Ginseng Kuning
yang diekstraksi dengan etanol 96% diperoleh ekstrak kering sebanyak 19,7820
gram, sehingga diperoleh nilai rendemen ekstrak sebesar 7,61% (Lampiran 2).
4.1.2 Pengamatan Tanda-Tanda Toksisitas
Pengamatan tanda-tanda toksisitas meliputi keadaan kulit dan bulu, mata,
letargi (kelesuan), konvulsi (kejang), tremor (gemetar), diare, dan mati. Saat
pengamatan tanda-tanda toksisitas, yaitu setelah pemberian dosis tunggal ekstrak
etanol kulit akar Ginseng Kuning 2000 mg/kgbb pada mencit tidak ditemukan
tanda-tanda toksisitas tersebut. Mencit yang diberikan perlakuan mempunyai
aktivitas yang sama dengan mencit kontrol (Lampiran 3).
4.1.3 Hasil Bobot Mencit
Tabel 4.1 Bobot Mencit
Mencit Bobot mencit (gram) pada hari ke-
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
1 29 30 31 31 31 31 32 32 33 33 33 33 34 34 33
2 29 30 29 30 31 31 32 32 33 33 33 33 33 33 33
3 28 29 29 29 30 30 31 31 30 31 31 32 31 31 31
4 29 29 29 30 30 30 31 32 32 32 32 32 31 32 32
5 30 31 32 32 33 33 35 35 37 36 35 35 34 35 36
6 29 30 30 32 33 32 31 33 34 32 33 33 33 33 34
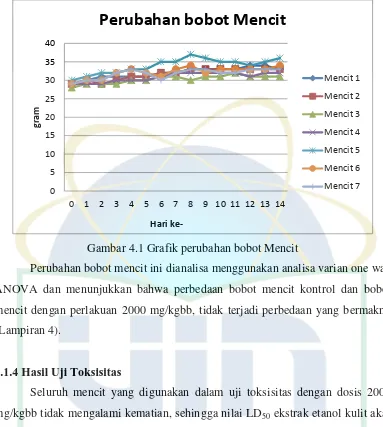
UIN Syarif Hidayatullah Jakarta Gambar 4.1 Grafik perubahan bobot Mencit
Perubahan bobot mencit ini dianalisa menggunakan analisa varian one way
ANOVA dan menunjukkan bahwa perbedaan bobot mencit kontrol dan bobot
mencit dengan perlakuan 2000 mg/kgbb, tidak terjadi perbedaan yang bermakna
(Lampiran 4).
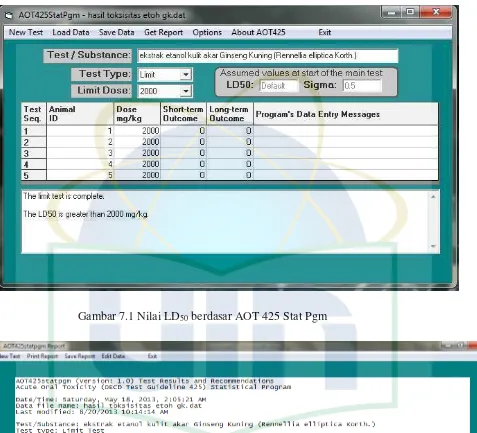
4.1.4 Hasil Uji Toksisitas
Seluruh mencit yang digunakan dalam uji toksisitas dengan dosis 2000
mg/kgbb tidak mengalami kematian, sehingga nilai LD50 ekstrak etanol kulit akar
Ginseng Kuning adalah lebih dari 2000 mg/kgbb. Penentuan ini menggunakan
software AOT 425 StatPgm (Lampiran 5).
4.1.5 Hasil Pengamatan Organ Secara Makroskopis
Dari pengamatan makroskopik yang meliputi bentuk dan warna organ
diketahui bahwa tidak ada perbedaan yang terjadi pada organ hati, ginjal, dan
limpa mencit yang diberikan perlakuan terhadap mencit kontrol.
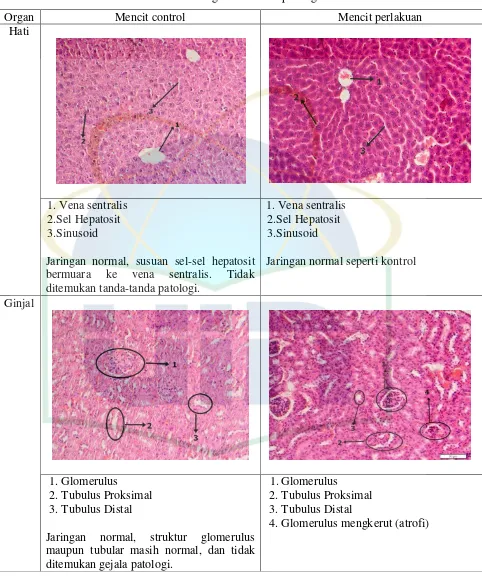
4.1.6 Hasil Pengamatan Histopatologi
Pemeriksaan histopatologi dilakukan pada organ hati, ginjal dan limpa
mencit kontrol dan mencit perlakuan untuk melihat kelainan pada organ tersebut
Tabel. 4.2 Hasil Pengamatan Histopatologi
Organ Mencit control Mencit perlakuan
Hati
1.Vena sentralis 2.Sel Hepatosit 3.Sinusoid
Jaringan normal, susuan sel-sel hepatosit bermuara ke vena sentralis. Tidak ditemukan tanda-tanda patologi.
1.Vena sentralis 2.Sel Hepatosit 3.Sinusoid
Jaringan normal seperti kontrol
Ginjal
1.Glomerulus
2.Tubulus Proksimal 3.Tubulus Distal
Jaringan normal, struktur glomerulus maupun tubular masih normal, dan tidak ditemukan gejala patologi.
1.Glomerulus
2.Tubulus Proksimal 3.Tubulus Distal
UIN Syarif Hidayatullah Jakarta Limpa
1.Pulpa Putih 2.Pulpa Merah 3.Trabekula
Jaringan normal, susunan folikel di
parakorteks dan medula tidak
menunjukkan peningkatan aktivitas dari sel imun.
Pada penelitian ini, sampel uji yang digunakan adalah ekstrak etanol kulit
akar Ginseng Kuning (Rennellia elliptica Korth.), dimana kulit akar tumbuhan
tersebut merupakan koleksi yang ada di Laboratorium Fitokimia Puslit Biologi
LIPI yang berasal dari Pontianak Kalimantan Barat. Kulit akar dari Ginseng
Kuning yang masih segar dilakukan uji kadar air simplisia dan diperoleh kadar air
simplisia kulit akar Ginseng Kuning sebesar 3,771%. Kulit akar tersebut
diekstraksi dengan etanol 96% menggunakan metode maserasi. Etanol digunakan
sebagai pelarut kareana senyawa mayor dari kulit akar Ginseng Kuning adalah
rubiadin, dimana rubiadin ini merupakan polifenol. Etanol merupakan salah satu
pelarut yang baik digunakan dalam ekstraksi senyawa polifenol, selain itu juga
aman jika dikonsumsi (Dai, et al., 2010). Metode maserasi digunakan karena
metode ini cara pengerjaan dan peralatan yang digunakan sederhana dan mudah
diusahakan (Depkes RI, 2000). Dari 259,94 gram kulit akar Ginseng Kuning segar
yang diekstrak, diperoleh 19,7820 gram ekstrak kering. Sehingga diperoleh
rendemen ekstrak sebanyak 7,61%. Ekstrak kering inilah yang digunakan untuk
Uji toksisitas akut ini dilakukan karena pada akar tumbuhan Ginseng
Kuning ini telah digunakan secara tradisional serta telah terbukti memiliki
aktivitas sebagai antiplasmodial dan sebagai antioksidan, dimana semua itu akan
memiliki manfaat yang besar bagi manusia. Sehingga uji toksisitas ini perlu
dilakukan untuk mengetahui tingkat keamanan dari tumbuhan tersebut. Pada uji
toksisitas akut dalam penelitian ini menggunakan metode Up and Down
Procedure (UDP). Metode ini merupakan metode alternatif dalam pengujian
toksisitas akut. Ketika dibandingkan dengan metode penentuan nilai LD50
konvensional, Up and down procedure ini menggunakan hewan yang lebih
sedikit, bahkan sampai sepertiga dari jumlah hewan yang digunakan dalam
metode konvensional (Erkekoglu, et al., 2011). Dalam analisa perbandingan
dengan metode konvensional, UDP merupakan metode yang paling sederhana
untuk digunakan dan menghasilkan nilai LD50 yang sangat bagus dibanding
dengan nilai LD50 dari metode konvensional (Lipnick, et al., 1995). Selain itu,
dalam Hanbook Non-Safety Clinical Testing menyebutkan bahwa WHO
menyarankan untuk menggunakan metode ini dalam pengujian toksisitas akut. Hal
ini dikarenakan bahwa metode tersebut merupakan metode yang fleksibel dan
dapat dipertimbangkan secara ekonomi, sains, dan etik.
Pada penelitian ini penggunaan metode UDP dipilih uji batas dosis (limit
test), dikarenakan ekstrak akar Ginseng Kuning (Rennellia elliptica Korth.)
tersebut telah digunakan oleh masyarakat. Sehingga dapat diasumsikan bahwa
ekstrak tersebut memiliki tingkat toksisitas yang rendah. Dalam penggunaan limit
test ini dipilih dosis 2000 mg/kgbb, karena dalam panduan internasional
menyarankan bahwa untuk uji toksisitas akut dengan dosis tunggal disarankan
untuk menggunakan dosis teratas (limit dose) 2000mg/kgbb (WHO, 2002). Selain
itu juga dalam klasifikasi tingkatan toksik dalam GHS (The Globally Harmonized
System of Classification and Labelling of Chemicals) disebutkan bahwa diatas
dosis 2000 mg/kgbb termasuk dalam kategori toksisitas yang rendah dan sudah
tidak terdapat simbol atau tanda peringatan keamanan dalam pelabelan yang perlu
dicantumkan.
Pada penelitian ini digunakan mencit betina galur Deutsch Denken Yokken
UIN Syarif Hidayatullah Jakarta tersebut ekonomis, mudah didapat, perawatannya mudah (Harmita, 2006). Galur
DDY dipilih karena memiliki reproduksi yang baik dan pertumbuhan yang
unggul, selain itu galur ini sudah banyak digunakan dalam penelitian berbagai
bidang, seperti studi farmakologi, farmakokinetik, dan toksikologi (NIBIO, 2005).
Mencit betina yang digunakan dalam keadaan nulipara (belum pernah
melahirkan) dan tidak hamil. Hewan betina digunakan karena dalam pengujian
toksisitas akut menggunakan hewan jantan dan betina akan diperoleh hasil yang
sama. Ketika terdapat perbedaan respon yang diberikan antara jantan dan betina,
secara umum hewan betina lebih sensitif dibanding dengan jantan (Lipnick, et al.,
1995).
Mencit yang digunakan terlebih dahulu diaklimatisasi selama 10 hari
untuk proses adaptasi dengan kondisi lingkungan baru (kandang mencit). Selama
masa aklimatisasi tersebut, mencit diberi makan pellet dan minum (ad libitum)
dan ditempatkan pada kandang dengan suhu 230 C (±30) (OECD, 2008).
Aklimatisasi ini dilakukan agar mencit dapat menyesuaikan diri dengan
lingkungan yang baru.
Pada pengujian ini mencit diberikan bahan uji secara oral menggunakan
sonde. Rute oral dipilih karena disesuaikan dengan rute yang biasanya digunakan
pada manusia dalam mengonsumsi ekstrak kulit akar Ginseng Kuning. Saat
sampel diujikan pada mencit, ekstrak kering kulit akar Ginseng Kuning
disuspensikan dengan Na CMC 1%, karena ekstrak tersebut tidak larut sempurna
dalam air. Dalam Handbook of Exipience disebutkan bahwa Na CMC merupakan
senyawa yang tidak toksik dan tidak menimbulkan iritan. Sehingga dapat
dikatakan bahwa zat pembawa tersebut tidak berpengaruh pada pengujian
toksisitas ini.
Uji toksisitas akut ini dilakukan terdapat 5 mencit perlakuan dan 2 mencit
kontrol. Dalam metode UDP dengan pengujian limit test, hewan yang diberikan
perlakuan bahan uji adalah maksimal 5 hewan (OECD, 2008), sedangkan
digunakannya 2 mencit sebagai kontrol karena dalam ICCVAM (Interagency
Coordinating Committee on the Validation of Alternative Methods) menyebutkan
tetapi minimal menggunakan dua hewan. Hal ini bertujuan untuk mengurangi
penggunaan hewan yang berlebihan dalam suatu pengujian.
Uji toksisitas ini dilakukan pada satu mencit betina perlakuan yang telah
dipuasakan (tidak diberi makan) selama 3-4 jam dengan tetap diberikan minum.
Dipuasakannya mencit tersebut bertujuan agar nantinya ketika mencit tersebut
diberikan sampel diharapkan sampel tersebut dapat langsung kontak dengan
sistem pencernaan mencit dan tidak terganggu oleh adanya makanan yang ada di
pencernaan mencit. Setelah diberikan ekstrak secara oral, mencit juga tidak diberi
makan selama 1-2 jam, tetapi tetap diberi minum secara ad libitum. Hal ini
dilakukan untuk memaksimalkan penyerapan ekstrak pada pencernaan mencit.
Pemgamatan terhadap tanda-tanda toksisitas dilakukan setiap 30 menit
setelah pemberian ekstrak selama 4 jam. Dalam pengamatan diperoleh bahwa
hewan beraktivitas seperti hewan kontrol yang tidak diberikan ekstrak. Setelah 24
jam dan 48 jam pengujian, satu hewan tersebut tidak mati ataupun menunjukkan
tanda-tanda toksisitas. Kemudian pada hari tersebut dilakukan pemberian ekstrak
pada 4 mencit yang lain dengan perlakuan yang sama pada mencit sebelumnya.
Kelima mencit perlakuan ini sampai 14 hari tidak mati ataupun menunjukkan
tanda-tanda toksisitas. Sehingga dapat dikatakan bahwa ekstrak kulit akar Ginseng
Kuning memiliki nilai LD50 lebih dari 2000 mg/kgbb, dimana menurut kategori
dari GHS (The Globally Harmonized System of Classification and Labelling of
Chemicals) dosis tersebut termasuk dalam kategori 5 yang dapat dikatakan
memiliki tingkat toksisitas yang rendah. Selain itu, perubahan bobot mencit
selama 14 hari tidak terjadi perbedaan yang bermakna jika dibandingkan dengan
mencit kontrol, karena setelah data bobot mencit diolah secara statistik diperoleh p≥0,05.
Pada hari ke-15 dilakukan pembedahan terhadap hewan coba untuk
mengamati organ hewan setelah diberikan ekstrak tersebut. Hal ini dilakukan
untuk mengamati patologi yang muncul pada organ hati, ginjal, dan limpa mencit
ketika di amati secara mikroskopis akibat pemberian ekstrak etanol kulit akar
Ginseng Kuning. Pengamatan pada organ hati, ginjal, dan limpa mencit tersebut
dilakukan karena hati merupakan organ terbesar dan secara metabolisme paling
UIN Syarif Hidayatullah Jakarta sebagian besar obat dan toksikan. Sedangan ginjal mencit diamati karena urin
merupakan jalur utama ekskresi sebagian besar toksikan. Akibatnya ginjal
mempunyai volume aliran darah yang tinggi, mengkonsentrasi toksikan pada
filtrat, membawa toksikan melalui sel tubulus, dan megaktifkan toksikan tertentu.
Selain itu, limpa juga merupakan organ sasaran karena limpa merupakan salah
satu organ sistem imun. Berbagai toksikan diketahui dapat menekan fungsi imun.
Penekanan ini akan mengakibatkan menurunnya resistensi pejamu terhadap
infeksi dan menurunnya kemampuan mengendalikan neoplasma dan zat asing lain
(Lu, 1995).
Hasil pengamatan histopatologi organ hati, ginjal, dan limpa
menunjukkan bahwa organ hati mencit kontrol dan perlakuan tidak ditemukan
kelainan pada jaringan hati tersebut. Pada hati mencit kontrol, susunan sel-sel
hepatosit bermuara ke vena sentralis serta tidak ditemukan tanda-tanda patologi.
Begitu juga pada jaringan hati mencit perlakuan terlihat normal seperti mencit
kontrol. Pada histopatologi organ ginjal mencit kontrol menunjukkan bahwa
struktur glomerulus maupun tubular masih normal, dan tidak ditemukan adanya
tanda-tanda patologi. Dari lima mencit perlakuan, terdapat 2 mencit dengan
jaringan pada ginjal normal seperti pada jaringan ginjal mencit kontrol, dan
terdapat 2 mencit yang mengalami atrofi glomerulus (glomerulus mengkerut),
serta terdapat satu mencit yang mengalami udem (bengkak) yang bersifat
reversibel dan disertai dengan atrofi glomerulus. Dimana hal tersebut dapat
kembali normal bila penyebab kerusakan (paparan toksin) dihentikan.
Munculnya atrofi glomerulus menggambarkan adanya reaksi antara
makromolekul yang terfiltrasi dengan dinding filter glomerulus. Atrofi glomerulus
ditandai dengan mengecilnya glomerulus dalam kapsula Bowman sehingga ruang
diantara glomerulus dan kapsula Bowman makin melebar. Atrofi glomerulus
dapat terjadi akibat masuknya senyawa-senyawa yang bersifat toksik ke dalam
filter glomerulus, yang menyebabkan pengecilan morfologi dan aktivitas sel-sel
tubuli yang menjadi barier dari filter glomerulus (Jones, et al., 2006).
Pada histopatologi organ limpa mencit kontrol menunjukkan bahwa
susunan folikel di parakorteks dan medulla tidak menunjukkan peningkatan
hal ini menunjukkan bahwa tidak terdapat organism asing, neoplasma, dan zat-zat
asing lain yang mengganggu sistem imun pada organ limpa mencit. Sehingga
dapat dikatakan bahwa ekstrak etanol kulit akar Ginseng Kuning dosis 2000
mg/kgbb tidak menyebabkan patologi pada organ hati dan limpa mencit, tetapi