Carnation mottle virus
PADA TANAMAN ANYELIR DI
INDONESIA: ETIOLOGI, EKSPRESI GEN PROTEIN
SELUBUNG, DAN ELIMINASINYA
ERNIAWATI DININGSIH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa disertasi berjudul Carnation mottle virus pada Tanaman Anyelir di Indonesia: Etiologi, Ekspresi Gen Protein Selubung, dan Eliminasinyaadalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2016
Erniawati Diningsih
RINGKASAN
ERNIAWATI DININGSIH. Carnation mottle virus pada Tanaman Anyelir di Indonesia: Etiologi, Ekspresi Gen Protein Selubung, dan Eliminasinya. Dibimbing oleh GEDE SUASTIKA, TRI ASMIRA DAMAYANTI, dan SLAMET SUSANTO.
Anyelir (Dianthus caryophillus L) merupakan salah satu tanaman bunga potong utama dunia karena bunganya cantik dan memiliki berbagai variasi warna dan bentuk. Di Indonesia, produksi bunga potong anyelir masih jauh dari potensi genetiknya, sehingga pendapatan petani dari usaha budidaya tanaman hias juga lebih rendah dari yang seharusnya. Kondisi ini terjadi karena hampir semua tanaman anyelir sudah terinfeksi virus, namun petani tidak mengetahui hal ini. Ada lebih dari 15 virus yang dapat menginfeksi anyelir, akan tetapi Carnation mottle virus (CarMV) dilaporkan merupakan virus utama pada tanaman anyelir. Di beberapa sentra produksi anyelir di Jawa Barat ditemukan gejala tanaman anyelir terinfeksi virus berupa belang-belang hijau tua dan muda (mottle). Gejala ini mirip dengan yang dilaporkan di luar negeri. Penelitian mengenai penyakit
mottle/belang pada tanaman anyelir di Indonesia belum banyak dilakukan. Berdasarkan hal tersebut maka penelitian ini secara umum bertujuan untuk mengidentifikasi dan mendapatkan karakter virus penyebab penyakit belang pada tanaman anyelir di Jawa Barat serta memperoleh metode eliminasi virus untuk mendukung pengadaan benih anyelir secara berkelanjutan.
Deteksi secara serologi menggunakan metode ELISA menunjukkan bahwa semua kultivar tanaman anyelir yang diuji (28 kultivar) terinfeksi oleh CarMV (100%) dan tidak terinfeksi oleh Carnation latent virus (CLV), Carnation ringspot virus (CRSV), dan Carnation vein mottle virus (CVMV). CarMV menginfeksi secara tunggal pada sampel tanaman anyelir yang diuji. Reaksi positif terhadap antiserum CarMV tidak hanya terjadi pada sampel tanaman yang bergejala saja tetapi juga pada sampel yang tidak bergejala. Partikel virus dari sap tanaman sakit berbentuk isometrik dengan diameter berukuran 30 nm teramati melalui pengecatan negatif 2% uranil asetat menggunakan transmission electron microscopy (TEM).
RT-PCR dengan primer spesifik protein selubung (coat protein/CP) CarMV berhasil mengamplifikasi sembilan isolat gen CP CarMV dengan ukuran sekitar ± 1000 pb. Kesembilan CarMV asal Jawa Barat memiliki kesamaan runutan nukleotida berkisar 94.3% sampai 98.1% dan asam amino yang tinggi berkisar 95.5% sampai 99.4% dengan isolat dari negara lain yang. CarMV isolat-isolat Jawa Barat memiliki kesamaan urutan nukleotida tertinggi dengan isolat-isolat CarMV asal China (AF173879) dan Spanyol (AJ309509.1), dan kesamaan asam amino tertinggi dengan isolat CarMV asal China dan Mexico (KC834739.1). Diantara sembilan isolat CarMV asal Jawa Barat, isolat CWB (Ciwangun dengan gejala berat) sudah didaftarkan di GenBank dengan nomor aksesi KP119181 dengan nama isolat Idn-WJ4.
asam amino yang disandi dan motif protein yang dihasilkan. Keragaman genetik gen CP CarMV berkorelasi dengan variasi gejala pada tanaman anyelir terinfeksi. Analisis pohon filogenetik menunjukkan bahwa CarMV isolat-isolat Jawa Barat terpisah dalam tiga kelompok besar bersama-sama dengan isolat-isolat lainnya yang sudah terdaftar di Genbank.
Deteksi virus yang mudah dan cepat, diperlukan untuk memantau sumber induk anyelir bebas virus. Metode simple direct tube (SDT) dan simple extraction method (SEM) berhasil mendapatkan RNA total dari tanaman anyelir baik dari sampel daun maupun batang. Metode ekstraksi RNA total dengan SDT dan SEM yang digabungkan dengan One step RT-PCR menghasilkan intensitas DNA yang sebanding dengan kit komersial. RNA total dari daun sebagai sumber templat one step RT-PCR terbaik dibandingkan batang. Preparasi RNA total dengan metode SDT dan SEM adalah metode cepat, mudah, dan murah dalam menyediakan templat one step RT-PCR. Konsentrasi primer 0.4 µM dan MgCl2 2 mM merupakan konsentrasi optimum untuk menghasilkan hasil amplifikasi terbaik.
Gen CP parsial CarMV berukuran 1020 pb berhasil dikloning ke dalam TA vektor pTZ57R/T dan di subkloning ke vektor ekspresi pET28a, serta diekspresikan dalam bakteri E. coli strain BL21(DE3). Ekspektasi gen CP CarMV dalam vektor ekspresi menghasilkan protein fusi berukuran ± 40.2 kDa. Hasil analisis SDS PAGE menunjukkan adanya pita protein fusi pada ukuran ±40.2 kDa sebagai ekspresi dari gen CP CarMV rekombinan walaupun dengan tingkat ekspresi yang belum optimal. Untuk mendapat protein dalam jumlah melimpah (over expression) perlu dilakukan optimasi terhadap beberapa faktor yang dapat mempengaruhi ekspresi gen.
CarMV dapat dibebaskan dari jaringan tanaman anyelir terinfeksi menggunakan antiviral 2-thiouracil dan amantadin. Kultur meristem terminal dari planlet pada perlakuan 2 thiourasil menghasilkan planlet bebas virus sebesar 0 sampai 57%, sementara perlakuan amantadin menghasilkan 25.0 sampai 54.55% planlet bebas virus. Diantara perlakuan yang diuji, perlakuan antiviral amantadin dengan konsentrasi 5 – 30 ppm lebih optimal menghasilkan planlet anyelir bebas CarMV dan tidak toksik terhadap tanaman. Perlakuan amantadin 5 sampai 20 ppm mampu menghambat virus lebih tinggi dibandingkan perlakuan 2-thiouracil pada konsentrasi yang sama. Amantadin 5 sampai 30 ppm menghasilkan tingkat penghambatan virus sebesar 42.94 – 59.57%, sedangkan 2-thiouracil sebesar -8.18 - 63,03%. Berdasarkan hasil tersebut amantadin lebih efektif diaplikasikan untuk mendapatkan tanaman anyelir bebas virus dibandingkan 2-thiouracil.
Hasil penelitian ini menunjukkan bahwa penyakit belang pada tanaman anyelir di Jawa Barat disebabkan infeksi CarMV. Keberadaan CarMV dalam jaringan tanaman anyelir dapat dideteksi secara cepat menggunakan teknik one step RT-PCR menggunakan templat yang diekstraksi melalui metode SDT dan SEM. Gen CP CarMV dapat dikloning ke dalam TA vektor dan disubkloning ke dalam vektor ekspresi serta diekspresikan dalam bakteri ekspresi untuk menghasilkan antigen yang bermanfaat dalam pembuatan antiserum. CarMV dalam jaringan tanaman anyelir dapat dibebaskan melalui penggunaan senyawa antiviral yang dikombinasikan dengan kultur meristem ujung, dan senyawa antiviral amantadin lebih efektif dibandingkan 2-thiouracil.
SUMMARY
ERNIAWATI DININGSIH. Carnation mottle virus on Carnation Plant In Indonesia: Etiology, Coat Protein Gene Expression, and Its Elimination. Supervised by GEDE SUASTIKA, TRI ASMIRA DAMAYANTI, and SLAMET SUSANTO.
Carnation (Dianthus caryophyllus L) is one of the world's major cut flower plants since the flowers are beautiful and have a wide variety of colors and shapes. In Indonesia, carnation cut flower production is stil so far from its genetic potential, therefore the farmer’s from the cultivation of ornamental plants is lower than it should be. These situation occurs because almost all the carnation plants had been infected by virus, however the farmers did not know and aware with this problem. There are more than 15 known viruses that can infect carnation, among them Carnation mottle virus (CarMV) was reported as a major virus on carnation plants. In some carnation production centers in West Java were found the mottle symptoms which were similar to those reported abroad. Thus, the studies aimed to identify and to characterize the causal virus of mottle disease on carnation plant in West Java.
Serological detection by ELISA method showed that all the tested carnation cultivars (28 cultivars) were infected by CarMV (100%) and did not infected by
Carnation latent virus (CLV), Carnation ringspot virus (CRSV), and Carnation vein mottle virus (CVMV). CarMV singly infects the tested carnation plant samples. The positive reaction against CarMV antiserum is detected either on symptomatic or on a asymptomatic samples. Isometric-shaped virus particles from infected plant with diameter size 30 nm was observed by negative staining using 2% uranyl acetate on transmission electron microscopy (TEM).
RT-PCR using specific primer of CarMV coat protein (CP) gene successfully amplified nine isolates with a size aproximately 1000 bp. Nine CarMV isolates from West Java have high sequences similarities level of either nucleotide (94.3 to 98.1%) or amino acid (95.5 to 99.4%) with corresponding isolates from other countries. CarMV West Java isolates had the highest nucleotide sequences similarity with isolates from China CarMV (AF173879) and Spain (AJ309509.1), and the highest amino acids similarities with CarMV isolate from China and Mexico (KC834739.1). Among the nine CarMV West Java isolates, the CWB isolate (Idn-WJ4) had been deposited in the GenBank data base with accession numbers KP119181.
The nucleotide sequences alignment of nine CP gene isolates of CaMV from West Java with ten nucleotide sequences of CP gene isolate from other countries showed that there were several point mutations. Among those point mutations, caused either amino acid changes or protein motif. Genetic diversity of CarMV CP genes correlated with the symptom variations of carnation infected plants. Phylogenetic tree analysis showed that CarMV West Java isolates are separated into three major groups together with other isolates that have been registered in Genbank.
total RNA either from leaf or stem of carnation plants. Total RNA from leaves showed the best source of one step RT-PCR template in compared with stem. Total RNA preparation by SDT and SEM method were considerate as a rapid, easy, and inexpensive method to provide a one step RT-PCR template. Primer and MgCl2 concentration of 0.4 μM and 2 mM, was optimum concentration to get best CarMV amplification, respectively.
The partial CarMV CP gene (1020 bp) was successfully cloned into TA vector pTZ57R/T and subcloned into expression vector pET28a, and expressed in
E. coli strain BL21 (DE3). The expressed CarMV CP gene will produce fusion protein with sized of ± 40.2 kDa by SDS-PAGE analysis. However, the expression of the protein is not optimum yet. To obtain over expression protein, optimizes some factor that may affect gen expression is necessary to conduct in order to get the abundance protein of CarMV as antigen.
CarMV could be eliminated from infected carnation plant tissues using 2-thiouracil and amantadin antiviral. Meristem tip culture taken from 2-2-thiouracil treatment planlets produced virus-free plantlets ranged from 0 to 57% while by amantadine treatment produced 25.0 to 54.55%. Among tested treatments, antiviral amantadine with concentration at 5-30 ppm is optimum to produce better CarMV-free plantlets and toxic to the plants. Amantadine treatment from 5 to 20 ppm was able to inhibit the virus higher than 2-thiouracil treatment at the same concentration. Amantadine 5 to 30 ppm produced levels of viral inhibition ranging from 42.94 to 59.57%, while the 2-thiouracil ranging from -8.18 - 63.03%. The amantadine showed better potential than 2-thiouracil as an antiviral agent to get CarMV free carnation plants.
The results of this study indicated that the disease mottle on carnation plants in West Java is caused by CarMV infection. The existence of CarMV in carnation plant tissue could be detected rapidly using the technique one step RT-PCR using a template that is extracted through the SDT and SEM methods. CarMV CP gene could be cloned into TA vector and subkloning into the expression vector and expressed in a bacterial expression to produce antigens useful in the manufacture of antiserum. CarMV in carnation plant tissue could be eliminated through the use of antiviral compounds which combined with the meristem tip culture, and amantadine.antiviral compound is more effective than 2-thiouracil.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Fitopatologi
Carnation mottle virus
PADA TANAMAN ANYELIR DI
INDONESIA: ETIOLOGI, EKSPRESI GEN PROTEIN
SELUBUNG, DAN ELIMINASINYA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Penguji pada Ujian Tertutup: Prof (R) Dr Budi Marwoto, MSi (Balai Penelitian Tanaman Hias)
Di Ir Giyanto, MSi (Institut Pertanian Bogor)
Penguji pada Ujian Terbuka: Prof (R) Dr Ir Yusdar Hilman, MS
(Pusat Penelitian dan pengembangan Hortikultura) Dr Ir Giyanto, MSi
PRAKATA
Segala puji dan syukur dilimpahkan ke hadirat Allah SWT karena atas berkat rahmat dan karunia-Nya penulisan disertasi ini dapat diselesaikan. Penelitian ini berjudul Carnation mottle virus pada Tanaman Anyelir di Indonesia: Etiologi, Ekspresi Gen Protein Selubung, dan Eliminasinya. Penelitian ini berjalan dalam kurun waktu sekitar 3.8 tahun (September 2012 – Mei 2016).
Terimakasih yang sedalam-dalam nya penulis sampaikan kepada Badan Litbang Pertanian, Kementerian Pertanian yang telah memberikan kesempatan dan beasiswa kepada penulis untuk melanjutkan studi S3 di Institut Petanian Bogor.
Penghargaan dan ucapan terimakasih penulis sampaikan kepada Dr Ir Gede Suastika, MSc, Dr Ir Tri Asmira Damayanti, MAgr, dan Prof Dr Ir Slamet Susanto, MAgr selaku komisi pembimbing atas segala bimbingan, kritik, dan saran yang diberikan kepada penulis sehingga penulis dapat menyelesaikan disertasi ini. Ucapan terimakasih penulis sampaikan juga kepada Prof (R) Dr Ir Budi Marwoto, MSi, Dr Ir Giyanto, MSi dan Prof (R) Dr Ir Yusdar Hilman selaku penguji luar komisi yang telah memberikan sumbangsih saran dan perbaikan demi penyempurnaan disertasi ini.
Penghormatan yang setinggi-tingginya penulis haturkan kepada Ayahanda Edi Junaedi dan Ibunda Wasilah, serta saudara- saudara yang telah memberikan dukungan material dan spiritual, serta kasih sayang yang sangat mendalam pada penulis. Terimakasih yang tak terhingga penulis sampaikan kepada Suami tercinta Saryono dan anak-anakku Annisa Berliana Yodi, M. Lutfi Bagaskara Yodi, dan M. Faiq Pradipta Yodi atas segala dukungan, kesabaran dan pengertianya selama penulis melaksanakan studi.
Rasa terimakasih juga penulis sampaikan kepada Prof Dr Ir Sri Hendrastuti Hidayat selaku Penanggungjawab Laboratorium Virologi, Departemen Proteksi Tanaman, IPB yang telah memfasilitasi sarana penelitian. Terimakasih juga kepada Dr Ir Ifa Manzila, Dr Ir Tripuji, Ir Wakiah Nuryani, Ir Evi Silvia, Laili Qodriyah, dan EE Saepudin yang telah membantu kelancaran penelitian. Rasa terimakasih juga penulis sampaikan kepada Kepala Balai Penelitian Tanaman Hias, Ketua Kelti Hama dan Penyakit Tumbuhan Balai Penelitian Tanaman Hias serta jajarannya yang telah mendukung terlaksananya penelitian. Terimakasih juga kepada teman-teman di Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, IPB atas dukungan dan kerjasamanya yang luar biasa, serta kepada semua teman-teman yang tidak dapat penulis sebutkan satu persatu. Tidak lupa juga kepada Bapak Ir Yoyo Sulyo, MSi (alm) yang telah memberikan dukungan yang sangat besar terhadap penulis demi kemajuan karier penulis. Semoga Allah mengampuni segala dosa-dosanya. Terimakasih kepada semua pihak yang telah membantu kelancaran penelitian.
Akhirnya penulis persembahkan karya ilmiah ini kepada Bangsa Indonesia, semoga bermanfaat bagi perkembangan pertanian Indonesia.
Bogor, Agustus 2016
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xiii
DAFTAR LAMPIRAN xvi
1 PENDAHULUAN Latar Belakang Perumusan Masalah Tujuan Penelitian Hipotesis
Manfaat Penelitian
Kebaruan dan Keunggulan Penelitian Ruang Lingkup Penelitian
1 3 4 4 4 5 5
2 TINJAUAN PUSTAKA 8
3 IDENTIFIKASI, KARAKTERISASI, DAN KERAGAMAN GENETIK Carnation mottle virus YANG MENGINFEKSI TANAMAN ANYELIR DI JAWA BARAT
Pendahuluan Metode Hasil Pembahasan Simpulan 20 21 25 42 45 4 EVALUASI METODE PREPARASI RNA TOTAL PADA
TANAMAN ANYELIR (Dianthus caryophyllus L.) UNTUK DETEKSI CEPAT Carnation mottle virus
Pendahuluan Metode Hasil Pembahasan Simpulan 49 50 52 57 59 5 EKSPRESI GEN PROTEIN SELUBUNG CarMV DALAM
BAKTERI Escherichia coli
Pendahuluan Metode Hasil Pembahasan Simpulan 62 63 69 76 78 6 ELIMINASI Carnation mottle virus MENGGUNAKAN
SENYAWA ANTIVIRAL PADA KULTUR JARINGAN ANYELIR (Danthus caryophyllus L.)
DAFTAR ISI (lanjutan)
7 PEMBAHASAN UMUM 93
8 SIMPULAN DAN SARAN 98
DAFTAR PUSTAKA 100
LAMPIRAN 107
RIWAYAT HIDUP 119
DAFTAR TABEL
3.1 Sembilan isolat CarMV asal Jawa Barat 23
3.2 Komposisi reaktan untuk reaksi reverse transcription (RT) 24 3.3 Komposisi reaktan untuk reaksi polymerase chain reaction
(PCR)
25 3.4 Pengelompokkan gejala infeksi virus pada tanaman anyelir di
lapangan
27 3.5 Kategori gejala dan hasil ELISA pada beberapa varietas/kultivar
tanaman anyelir yang digunakan dalam penelitian
30 3.6 Kejadian penyakit empat jenis virus anyelir di lima lokasi
pengambilan sampel di Jawa Barat
30 3.7 Uji kisaran inang CarMV dari salah satu isolat Jawa Barat
(Cipanas)
31 3.8 Homologi beberapa isolat CarMV asal Jawa Barat dan negara
yang berbeda berdasarkan sekuen nukleotida gen CP
36 3.9 Homologi beberapa isolat CarMV asal Jawa Barat dan negara
yang berbeda berdasarkan sekuen asam amino gen CP
37 3.10 Mutasi titik pada sekuen asam amino sembilan isolat gen CP
CarMV dari Jawa Barat terhadap isolat asal Spanyol dan Cina
39 4.1 Komposisi reaktan untuk reaksi one step RT-PCR 52 4.2 Rerata nilai kemurnian dan konsentrasi RNA hasil pengukuran
dengan nano drop
53 4.3 Perbandingan tiga metode ekstraksi RNA total berdasarkan
komposisi bufer, waktu pelaksanaan, tingkat kerumitan, dan perkiraan biaya bahan tiap sampel
56
5.1 Perancangan primer gen CP CarMV 63
6.1 Pengaruh perlakuan antiviral terhadap daya tahan hidup dan pertumbuhan planlet, serta persentase planlet bebas virus
85 6.2 Persentase planlet bebas virus pada beberapa konsentrasi
antiviral
89 6.3 Tingkat penghambatan virus (THR) (%) pada perlakuan
beberapa antiviral
DAFTAR GAMBAR
1.1 Alur penelitian Carnation mottle virus pada Tanaman Anyelir di Indonesia: Etiologi, Ekspresi Gen Protein Selubung dan Eliminasinya
7
2.1 Organisasi genom Carnation mottle virus (sumber: Brunt & Martelli 2008). ORF: Open reading frame, RdRp: RNA dependence RNA polymerase, MP: Movement protein
12
2.2 Peta vektor ekspresi pET28a (Novagen) 17
3.1 Pengawetan dan penyimpanan inokulum CarMV. a. Potongan daun anyelir terinfeksi dalam CaCl2, b. penyimpananpada suhu 4 o
C.
22
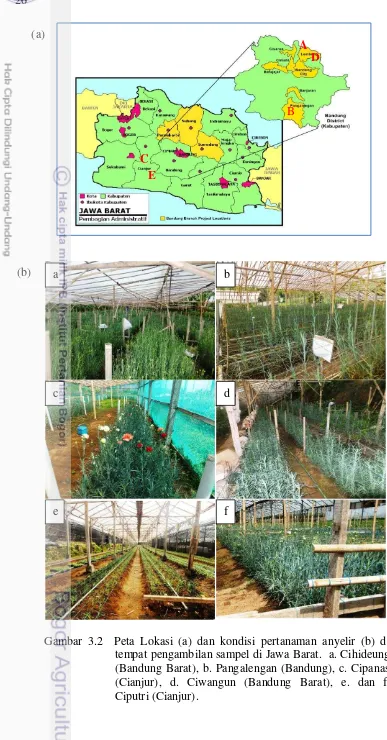
3.2 Peta lokasi (a) dan kondisi pertanaman anyelir (b) di tempat pengambilan sampel di Jawa Barat. a. Cihideung (Bandung Barat), b. Pangalengan (Bandung), c. Cipanas (Cianjur), d. Ciwangun (Bandung Barat), e dan f. Ciputri. (Cianjur)
26
3.3 Gejala infeksi virus pada tanaman anyelir introduksi asal Ciputri dengan kategori gejala berat (a-f), sedang (g), dan ringan (h). ((a) kultivar Castelaro, (b,d & e). Candy, (c) Aicardi, (f) Prado Nova, (g & h) nama kultivar tidak diketahui).
28
3.4 Gejala infeksi virus pada tanaman anyelir asal Cipanas dengan kategori gejala berat (a & b), sedang (c) dan ringan (d).
29 3.5 Gejala infeksi ganda virus dan cendawan pada pertanaman
anyelir. Daun mengalami klorosis/belang yang disertai dengan pengeringan tanaman (tanda panah).
29
3.6 Tipe gejala CarMV asal Jawa Barat pada beberapa tanaman uji. a. Ageratum conyzoides, b. Licopersicon esculentum, c. Cucumis sativus, d. C. quinoa, e. Nicotiana clevelandii, f. Begonia sp, g. C amarantocolor, dan h. Phalaenopsis sp.
33
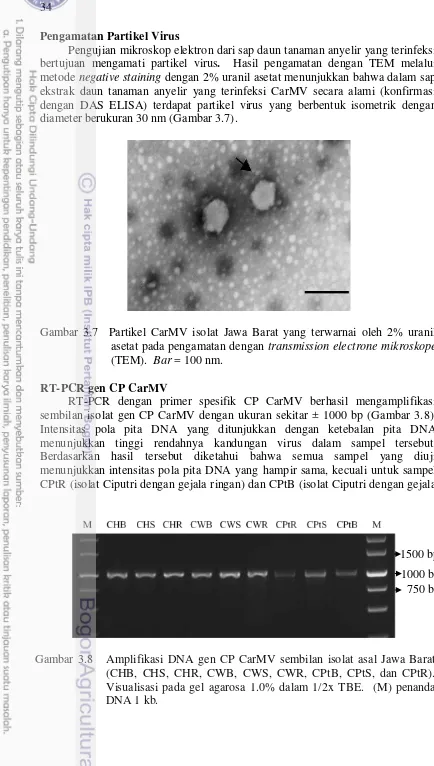
3.7 Partikel CarMV isolat Jawa Barat yang terwarnai oleh 2% uranil asetat pada pengamatan dengan transmission electrone mikroskope (TEM). Bar = 100 nm
34
3.8 Amplifikasi DNA gen CP CarMV sembilan isolat asal Jawa Barat (CHB, CHS, CHR, CWB, CWS, CWR, CPtB, CPtS, dan CPtR). Visualisasi pada gel agarosa 1.0% dalam 1/2x TBE. (M) penanda DNA 1 kb.
34
3.9 Motif protein CP sembilan isolat CarMV asal Jawa Barat berdasarkan analisis protein menggunakan Expasy Myhits. Spain (Spanyol), Belanda, dan Cina digunakan sebagai pembanding. 1. Protein kinase C (PKC) phosphorilation ( ) 2.
Casein kinase II (CK2) phosphorilation ( ), 3. Myristylation ( ), 4.
Icosahedral virus CP ( ) 5. FARP ( ), 6. Carmo coat ( ), 7.
Tyrosin kinase phosphorylation ( ),dan 8. ASN glycosylation ( ).
38
3.10 Pohon filogenetik nukleotida gen CP CarMV isolat-isolat Jawa Barat terhadap 9 isolat CarMV pada Genbank. Cowpea mottle virus (CPMoV) digunakan sebagai pembanding di luar grup.
Isolat yang diberi tanda titik ialah isolat-isolat Jawa Barat.
DAFTAR GAMBAR (lanjutan)
3.11 Pohon filogenetik asam amino gen CP CarMV isolat-isolat Jawa Barat terhadap 9 isolat CarMV pada Genbank. Cowpea mottle virus (CPMoV) digunakan sebagai pembanding di luar grup.
Isolat yang diberi tanda titik ialah isolat-isolat Jawa Barat.
42
4.1 Amplifikasi DNA gen CP CarMV melalui one step RT-PCR pada konsentrasi akhir primer 0.4 µM (a) dan 0.8 µM (b) dan MgCl2 2.0
mM menggunakan templat asal daun dan batang yang diekstraksi dengan metode SDT, SEM, dan kit. M. Penanda DNA 1 kb (Thermo Scientific), K-. Kontrol negatif, K+. Kontrol positif.
54
4.2 Amplifikasi DNA gen CP CarMV melalui one step RT-PCR pada konsentrasi akhir primer 0.4 µM, 0.6 µM, 0.8 µM, dan 1.0 µM, serta konsentrasi MgCl2 2.0 mM (a) dan 1.5 mM (b) menggunakan templat
asal batang yang diekstraksi dengan metode SDT, SEM, dan kit.
55
5.1 Konstruksi gen CP CarMV dalam vektor eskpresi pET28a 67 5.2 Amplifikasi gen CP CarMV dari sampel daun anyelir terinfeksi
CarMV. (M) Penanda DNA 1 kb (Thermo Scientific), (1-5). cDNA CP isolat Ciputri.
69
5.3 Amplifikasi cDNA gen CP CarMV (lajur 1-5) dari koloni bakteri transforman dan visualisasi plasmid yang diisolasi dari bakteri transforman JM107 (lajur 6-10). (M) Penanda DNA I kb (Thermo Scientific)
70
5.4 Pola pita DNA gen CP CarMV dan vektor pTZ57R/T yang terpisah melalui proses restriksi menggunakan enzim endonuklease BamHI dan XhoI. (M) Marker DNA 1 kb (Thermo Scientific), (Line 1&2) hasil restriksi pada vektor rekombinan pTZ57R/T-CP 1020 bp dari dua klon yang berbeda.
71
5.5 Urutan dan posisi nukleotida gen CP CarMV 1020 pb hasil perunutan DNA (cetak merah). Cetak biru menunjukkan posisi enzim restriksi yang digunakan dalam perancangan primer
72
5.6 Restriksi vektor ekspresi pET28a dengan enzim restriksi BamHI dan XhoI. (M) Penanda DNA 1 kb, (1) vektor ekspresi pET28a sebelum dipotong, (2) pET28a setelah dipotong.
72
5.7 Visualisasi hasil restriksi vektor rekombinan pTZ57R/T dengan enzim restriksi BamHI dan XhoI (a) dan hasil purifikasi gel gen CP CarMV yang telah terpotong (E1 & E2) (b)
73
5.8 Koloni bakteri transforman BL21 (DE3) pada medium LB agar yang mengandung 25 µg/ml kanamisin
73 5.9 Amplifikasi gen CP CarMV 1020 pb dari bakteri BL21(DE3)
yang ditransformasi dengan vektor rekombinan pET28a-CP CarMV. (M). Penanda DNA 1 kb, (1-5) lima koloni bakteri transforman
74
5.10 Ekspektasi Gen CP CarMV 1020 pb (cetak warna hijau) dalam vektor ekspresi pET28a (cetak tulisan warna hitam). * Star codon, **Stop codon, huruf dengan blok abu-abu: 6x His tag.
DAFTAR GAMBAR (lanjutana)
5.11 Ekspresi CP CarMV rekombinan dalam bakteri E. coli strain BL21(DE3) pada suhu 25 oC dengan konsentrasi IPTG 0 mM (tanpa induksi/un), 0.25 mM (tidak ditampilkan), 0.5 mM (1), 0.75 mM (2), dan 1.0 mM (3) dengan waktu panen 4, 8, dan 12 jam setelah induksi. (M) Penanda protein low range (Bio Rad).
76
6.1 Persiapan eksplan untuk kultur jaringan. (a) Tanaman sumber eksplan, (b) tunas-tunas pucuk sebagai eksplan, dan (c) 3 - 4 ruas batang eksplan.
82
6.2 Sterilisasi eksplan. a. Pembersihan eksplan dengan air yang mengalir (1 jam), b. Perendaman dalam antibiotik (1 mg/ml) (30 menit), c. Perendaman dalam deterjen (1 mg/ml) (30 menit), d. Perendaman dalam NaOCl 20% (5 menit), 10% (10 menit), alkohol 96% (10 detik), e. Pembilasan dengan aquades, dan f. Pengeringan eksplan.
83
6.3 Pertumbuhan planlet anyelir pada umur 2 bulan setelah perlakuan pada medium MS yang mengandung antiviral 2-thiouracil pada konsentrasi 5 – 30 ppm. a. 0 ppm, b. Ribavirin 5 ppm (pembanding), c. 5 ppm, d. 10 ppm, e. 15 ppm, f. 20 ppm, g. 25 ppm, h. 30 ppm
86
6.4 Pertumbuhan planlet anyelir pada umur 2 bulan setelah perlakuan pada MSZ-amantadin pada konsentrasi 5 - 30 ppm. a. 0 ppm, b. 5 ppm ribavirin (pembanding), c. 5 ppm, d. 10 ppm, e. 15 ppm, f. 20 ppm g. 25 ppm, dan h. 30 ppm
87
6.5 Kultur meristem ujung (± 0.5 mm) planlet anyelir. a. Meristem ujung
(dalam lingkaran) yang masih menyatu dengan bagian planlet lainnya, b. ± 0.5 mm meristem ujung yang sudah dipotong, c. Meristem ujung yang tumbuh (5 hari setelah tanam), dan d. Meristem ujung pada 5 minggu setelah tanam.
88
6.6 Rata-rata titer virus pada perlakuan 2-thiouracil (a) dan amantadin (b) dibandingkan rata-rata titer virus pada kontrol (tanpa perlakuan)
90
DAFTAR LAMPIRAN
1 Alignment nukleotida gen CP sembilan CarMV isolat Jawa Barat dengan isolat CarMV asal Belanda dan Spanyol. * Sekuen yang
concerv (terpelihara).
108
2 Alignment asam amino CP sembilan CarMV isolat Jawa Barat dengan beberapa isolat CarMV yang terdapat di GenBank. Huruf yang diberi warna merah atau berada dalam kotak menunjukkan adanya mutasi pada daerah tersebut.
113
3 Grafik hasil pengukuran kuantitas RNA dengan Nanodrop pada tiga metode ekstraksi RNA total. A. Kit komersial, B. SDT, dan C. SEM.
DAFTAR LAMPIRAN (lanjutan)
4 Ekspresi gen CP CarMV rekombinan dalam bakteri E. coli strain BL21(DE3) pada suhu 30 oC dengan konsentrasi IPTG 0.25 mM (1), 0.5 mM (2), 0.75 mM (3), 1.0 mM (4), dan 0 mM (uninduce)
(5). (M) marker protein low range (Bio Rad), (B) E coli tanpa transformasi, (P) pET28a-BL21, (K2 & K3) klon 2 dan 3.(a) fraksi protein dalam pelet bakteri (insoluble fraction), (b) fraksi protein terlarut dalam supernatant (soluble fraction).
116
5 Ekspresi gen CP CarMV rekombinan dalam bakteri E. coli strain BL21(DE3) pada suhu 25 oC (atas) dan 37 oC (bawah) dengan konsentrasi IPTG 0.25 mM (1), 0.5 mM (2), 0.75 mM (3), 1.0 mM (4), dan 0 mM (tidak diinduksi) (un). (M) Penanda protein
low range (Bio Rad), (P) pET28a-BL21(DE3), (B) E coli tanpa transformasi.
117
6 Ekspresi gen CP CarMV rekombinan dalam bakteri E. coli strain BL21(DE3) pada suhu 25 oC dan 37 oC dengan waktu panen 12 jam setelah induksi dan konsentrasi IPTG 0.25 mM (1), 0.5 mM (2), 0.75 mM (3), 1.0 mM (4), dan 0 mM (tidak diinduksi) (un). (M) Penanda protein low range (Bio Rad), (P) pET28a-BL21.
PENDAHULUAN
Latar Belakang
Anyelir (Dianthus caryophillus L) merupakan salah satu tanaman bunga potong yang populer di dunia karena bunganya cantik dan memiliki berbagai variasi warna dan bentuk. Tanaman ini berasal dari kawasan Mediterania dan sudah tersebar luas di seluruh dunia. Menurut Sing et al. (2005), anyelir termasuk ke dalam kategori bunga potong utama dunia bersama dengan lima bunga potong lainnya. Informasi lain menyebutkan bahwa anyelir merupakan tanaman hias bunga potong terbesar ketiga di dunia setelah mawar dan krisan (Badan Litbang Pertanian 2011 (http: //pustaka.litbang.deptan.go.id/inovasi/kl11341039). Pusat produksi anyelir di dunia meliputi Amerika Serikat (New England, Colorado, California), Argentina, Chili, Colombia, Costa Rica, Republik Dominika, Ecuador, Meksiko, Peru, Italia, Spanyol, Belanda, Prancis, Israel, India, Iran, dan Turki (Whealy 1992; Lisa 1995; Singh et al. 2005; Cevik et al. 2010; Safari 2010) Potensi ekonomi komoditas anyelir di dunia sangat tinggi. Pada tahun 1987 misalnya, sebagai produsen anyelir terbesar di Amerika Latin, Colombia mengekspor 1.27 milyar batang anyelir ke pasar dunia bernilai 71 juta USD. Pada tahun yang sama, Jerman sebagai importir anyelir terbesar di Eropa mengimpor 1 milyar anyelir yang bernilai 272 juta USD dari Belanda (Whealy 1992).
Di Indonesia, produksi bunga potong anyelir belum optimal karena produktivitas dan mutu bunga masih jauh dari potensi genetiknya. Hal ini menyebabkan pendapatan petani dari usaha budidaya anyelir juga lebih rendah dari yang seharusnya. Produksi tanaman anyelir di Indonesia pada tahun 2014 menduduki posisi kedelapan di antara dua belas tanaman hias lainnya mencapai 2.962.777 tangkai dari luas panen sebesar 118.018 m2 dan bernilai sekitar 5.9 milyar (BPS 2014). Hal ini antara lain karena insidensi virus yang tidak disadari oleh petani. Serangan virus pada anyelir menyebabkan gejala belang (mottle) pada daun (Brunt & Martelli 2008), pertumbuhan tanaman terhambat, bunga berukuran kecil, pecah warna bunga, dan daun menyempit (Cevik et al. 2010). Tanaman terinfeksi virus sangat rentan terinfeksi oleh patogen lainnya (Sing et al.
2005).
Anyelir sangat rentan oleh infeksi beberapa virus. Virus-virus yang dapat menginfeksi anyelir di antaranya adalah Carnation mottle virus (CarMV),
Carnation vein mottle virus (CVMV), Carnation etched ring virus (CERV),
Carnation necrotic fleck virus (CNFV), Carnation latent virus (CLV), dan
Carnation ringspot virus (CRSV) (Lisa 1995). Menurut Sanchez-Navaro et al. (2007), Carnation italian ringspot virus (CIRV) juga ditemukan menginfeksi tanaman anyelir. Semua virus-virus tersebut adalah virus dari genom RNA kecuali CERV yang merupakan virus dari genom DNA.
sebagai tanaman induk untuk memproduksi stek berikutnya diduga menjadi penyebab rendahnya kuantitas dan kualitas bunga potong anyelir di Indonesia karena adanya akumulasi patogen seperti virus dalam jaringan tanaman.
Di Indonesia, CarMV (Tombusviridae; Carmovirus) ditemukan menginfeksi tanaman anyelir (Sulyo et al. 2003). Di antara semua anggota Carmovirus,
CarMV dan Cowpea mottle virus merupakan patogen penting secara ekonomi (Raikhy et al. 2006). Menurut Peraturan Menteri Pertanian no. 93 tahun 2011, CarMV merupakan organisme pengganggu tanaman karantina (OPTK) A1 yang penyebarannya ke Indonesia harus dicegah karena keberadaannya di Indonesia belum dilaporkan (www.karantina.deptan. go.id [4 Juni 2013]). Namun, setelah ada laporan dari hasil penelitian ini, CarMV berubah status menjadi OPTK A2 yang penyebarannya dicegah ke wilayah lain di Indonesia (Kementan 2015).
Penyebaran CarMV perlu diawasi lebih ketat di Indonesia agar tidak menginfeksi tanaman-tanaman hias penting lainnya, mengingat CarMV dilaporkan juga menginfeksi anggrek Phalaenopsis di Taiwan dengan gejala klorosis berbentuk cincin pada daun (Zheng et al. 2011). Hal ini mengindikasikan bahwa metode deteksi dini yang cepat pada tanaman anyelir sangat penting, terutama pada tanaman induk yang akan digunakan sebagai sumber perbanyakan vegetatif. Di samping itu perlu dilakukan analisis kekerabatan dengan virus sejenis.
Untuk keperluan deteksi massal, diperlukan adanya antiserum. Antiserum untuk beberapa virus anyelir sudah diproduksi oleh perusahaan luar negeri. Namun, untuk mendapatkan antiserum tersebut membutuhkan biaya yang besar dan kadangkala membutuhkan waktu yang lama karena harus diimpor dari luar negeri. Untuk mengurangi ketergantungan pada produk luar negeri, di Indonesia sudah dilakukan produksi antiserum secara konvensional melalui purifikasi partikel virus dari tanaman sakit yang kemudian diinjeksikan ke kelinci. Namun melalui metode konvensional ini, antiserum yang dihasilkan tidak spesifik terhadap partikel virus saja tetapi juga terhadap protein tanaman yang terbawa pada saat purifikasi dan terinjeksikan ke dalam kelinci.
Untuk mengatasi masalah tersebut, produksi antiserum poliklonal dapat dilakukan melalui teknik kloning dan ekspresi gen selubung protein (coat protein/ (CP) dalam bakteri Escherichia coli. Produksi antiserum melalui kloning dan ekspresi gen selubung protein virus pada sistem ekspresi telah banyak dilakukan pada beberapa virus tanaman (Abdelkader et al. 2004; Cerovska et al. 2010, Soumya et al. 2014). Dengan metode tersebut, antiserum yang dihasilkan lebih spesifik terhadap virus yang ditargetkan. Dengan demikian, pada penelitian ini dilakukan kloning dan ekspresi gen CP CarMV pada sistem ekspresi E. coli.
Penyediaan bibit bebas virus melalui seleksi hampir tidak dapat dilakukan karena sampai saat ini sulit menemukan individu tanaman yang tidak membawa virus tanaman, terutama dari infeksi CarMV. Pada penelitian ini dilakukan upaya membebaskan tanaman anyelir dari CarMV melalui metode eliminasi virus. Metode eliminasi yang dilakukan ialah dengan terapi kimia (chemotherapy) menggunakan antiviral 2-thiouracil dan amantadin yang dikombinasikan dengan kultur ujung meristem (meristem tip culture). Kultur ujung meristem (3 mm) yang dikombinasikan dengan chemotherapy menggunakan ribavirin (5 mg/l) selama 5 minggu dapat menghasilkan tanaman anyelir bebas virus (Wang et al. 1990). Penggunaan antiviral ribavirin pada medium kultur jaringan menyebabkan penggunaan biaya produksi yang cukup besar karena harga ribavirin yang cukup mahal. Oleh karena itu dalam penelitian ini digunakan senyawa kimia yang harganya lebih murah, yaitu 2-thiouracil dan amantadin yang keefektifannya dibandingkan dengan ribavirin.
Perumusan Masalah
Penelitian virus pada tanaman anyelir di Indonesia belum banyak dilakukan sehingga data dan informasi ilmiah mengenai sifat dan karakter virus yang menginfeksi tanaman anyelir di Indonesia masih terbatas. Untuk mengatasi masalah virus pada tanaman anyelir, pengetahuan mengenai bioekologi seperti sifat dan karakter virus perlu diketahui terlebih dahulu. Di samping itu, belum banyak juga dilaporkan cara pengendalian virus yang efektif pada tanaman anyelir di Indonesia. Di dalam industri perbanyakan anyelir, produksi bibit bebas virus membutuhkan metode deteksi dini yang cepat dan murah. Antiserum adalah materi yang sangat dibutuhkan dalam upaya penapisan tanaman anyelir bebas virus melalui metode ELISA sebagai metode alternatif dari RT-PCR. Pertanyaan pertanyaan yang harus dijawab dalam penelitian ini adalah sebagai berikut:
1. Virus-virus apa sajakah yang menginfeksi pada tanaman anyelir di Indonesia, khususnya di Jawa Barat sebagai salah satu sentra produksi tanaman anyelir yang terbesar di Indonesia
2. Apakah CarMV mendominasi infeksi pada pertanaman anyelir di Jawa Barat seperti yang pernah dilaporkan sebelumnya bahwa CarMV mendominasi di beberapa negara produksi anyelir di dunia.
3. Bagaimanakah karakter biologi dan molekuler CarMV pada tanaman anyelir di Jawa Barat.
4. Adakah metode deteksi CarMV yang cepat dan sederhana
5. Apakah gen CP CarMV yang melimpah dapat dihasilkan dari ekspresi pET28a pada E. coli yang dapat dimanfaatkan sebagai sumber antigen bagi pembuatan antiserum.
Tujuan Penelitian
Secara umum penelitian ini bertujuan mengidentifikasi dan mendapatkan karakter virus penyebab penyakit belang pada tanaman anyelir serta memperoleh metode eliminasi virus untuk mendukung pengadaan benih anyelir bebas virus secara berkelanjutan.
Secara khusus penelitian ini telah dilaksanakan dengan beberapa tujuan, yaitu:
1. Mendapatkan data insidensi CarMV di beberapa sentra produksi tanaman anyelir di Jawa Barat dan insidensi virus-virus lain yang kemungkinan menginfeksi anyelir.
2. Mendapatkan karakter biologi (kisaran inang dan tipe gejala), morfologi, dan molekuler CarMV berdasarkan variasi gejala.
3. Mengkaji keragaman genetik CarMV isolat Jawa Barat berdasarkan variasi gejala.
4. Mengevaluasi tiga metode ekstraksi RNA total untuk deteksi cepat Carnation mottle virus pada tanaman anyelir.
5. Mendapatkan antigen CarMV melalui ekspresi gen CP CarMV pada bakteri E. coli.
6. Mendapatkan teknologi eliminasi CarMV yang efektif pada tanaman dan planlet anyelir bebas virus
Hipotesis
1. CarMV mendominasi infeksi virus pada tanaman anyelir dibandingkan beberapa virus lainnya.
2. Karakteristik biologi, morfologi (fisik), maupun molekuler CarMV isolat Jawa Barat (Indonesia) identik dengan isolat-isolat dari negara lain.
3. Salah satu metode ekstraksi RNA total yang dievaluasi akan menjadi metode yang mampu menyediakan RNA total dalam deteksi one step RT-PCR dengan hasil yang sebanding dengan RNA total yang diekstraksi dengan kit. 4. Salah satu senyawa antiviral yang digunakan dalam penelitian ini efektif
mengeliminasi virus.
5. CP CarMV dapat diekspresikan pada E. coli sebagai sumber antigen
Manfaat Penelitian
1. Memberikan informasi mengenai distribusi berbagai jenis virus pada tanaman anyelir dan karakteristik CarMV isolat Jawa Barat, sehingga dapat membantu dalam penentuan strategi pengendalian.
2. Informasi penemuan CarMV pada hampir semua kultivar anyelir di Jawa Barat dapat dijadikan sebagai dasar bagi pemulya tanaman untuk menghasilkan tanaman tahan virus
virus tumbuhan lainnya, terutama bagi karantina tumbuhan dan institusi sertifikasi benih.
4. Antigen yang didapatkan akan digunakan untuk produksi antiserum poliklonal CarMV
5. Teknik eliminasi yang diperoleh dalam penelitian ini dapat diaplikasikan secara rutin untuk menghasilkan tanaman anyelir bebas virus.
6. Planlet anyelir bebas virus yang diperoleh dalam penelitian ini dapat dijadikan sumber eksplan untuk menghasilkan induk-induk tanaman anyelir bebas virus.
Kebaruan dan Keunggulan Penelitian
Penelitian ini memiliki beberapa nilai kebaruan yaitu:
1. Diperolehnya pengetahuan mengenai virus yang mendominasi infeksi pada tanaman anyelir di Jawa Barat, yaitu Carnation mottle virus (CarMV). CarMV masih dianggap sebagai organisme pengganggu tanaman karantina (OPTK) A1 sebelum penelitian ini dilakukan. Saat ini, menurut Permentan No 51 Tahun 2015, CarMV berubah statusnya menjadi OPTK A2 yang keberadaannya di Indonesia sudah diketahui dan dicegah penyebarannya ke daerah lain.
2. Diperolehnya karakter biologi (kisaran inang dan tipe gejala), morfologi dan molekuler CarMV isolat Jawa Barat serta keragaman genetiknya yang dapat dijadikan sebagai pengetahuan dasar untuk mempelajari mekanisme pengendalian penyakit belangpada tanaman anyelir.
3. Penelitian ini terkait kajian biologi dan molekuler, serta upaya pengendalian CarMV, merupakan yang pertama dilakukan di Indonesia
4. Teknik deteksi cepat, teknik eliminasi, dan antigen CarMV yang diperoleh dalam penelitian ini merupakan teknologi yang bermanfaat berkaitan dengan penyediaan bibit bebas virus dan monitoring penyakit.
Ruang Lingkup Penelitian
Penelitian dilakukan mulai dari September 2012 sampai Mei 2016 dengan ruang lingkup penelitian meliputi (Gambar 1.1):
1. Mendeteksi secara serologi beberapa virus pada tanaman anyelir dari Jawa Barat menggunakan antiserum terhadap CarMV, CRSV, CLV dan CVMV untuk mendapatkan spesies virus yang menginfeksi anyelir.
2. Mengkaji karakter CarMV (sebagai virus utama pada anyelir) melalui deteksi secara biologi (uji kisaran inang dan keragaman biologi), morfologi (mikroskop elektron), dan molekuler (perunutan DNA CarMV).
3. Mengkaji keragaman genetik sekuen gen CP carMV melalui analisis asam amino dan motif protein.
4. Mengevaluasi tiga metode preparasi RNA total untuk templat one step RT-PCR CarMV dari tanaman anyelir .
\\\\\\\\\
7
Identifikasi, karakerisasi, dan keragaman genetic CarMV
Survei dan koleksi sampel
Kegiatan penelitian:
Deteksi serologi
RT-PCR
Perunutan asam nukleat
Uji keragaman biologi
Pengamatan
Eliminasi CarMV menggunakan sentawa antiviral pada kultur
jaringan anyelir Ekspresi gen coat protein
CarMV dalam bakteri
Escherichia coli
Evaluasi metode preparasi RNA total untuk deteksi
cepat CarMV
Kegiatan penelitian:
Preparasi sampel
Preparasi asam nukleat
Kuantifikasi RNA
One step RT-PCR
Visualisasi
Kegiatan penelitian:
Desain primer
RT-PCR
TA cloning
Subkloning
Ekspresi gen CP
SDS PAGE
Kegiatan penelitian:
Preparasi sampel dan media tanam
Uji serologi pra perlakuan
Inisiasi dan propagasi eksplan
Perlakuan antivral
Kultur meristem ujung
Uji serologi dan analisis data
Gambar 1.1 Alur penelitian Carnation mottle virus pada Tanaman Anyelir di Indonesia: Etiologi, Ekspresi Gen Protein Selubung, dan Eliminasinya. * Sudah terbit, ** In review, Topik penelitian, Kegiatan penelitian, Luaran
Identitas CarMV
Keragaman genetik CarMV
Morfologi partikel virus
Tipe gejala
Publikasiinter. 1* & 2**
Metode preparasi RNA total dan deteksi cepat
Informasi kuantitas RNA
Publikasi nasional**
Antigen CP CarMV
Publikasi ilmiah
Antigen CP CarMV
Planlet bebas virus
2 TINJAUAN PUSTAKA
Sifat dan Perbanyakan Tanaman Anyelir (Dianthus caryophyllus L.)
Anyelir, dalam bahasa Inggris dikenal sebagai carnation, mempunyai nama ilmiah Dianthus caryophillus L. Nama carnation berasal dari nenek moyangnya orang Yunani yaitu sebagai bunga yang digunakan untuk acara penobatan gelar atau upacara kenaikan tahta di kerajaan-kerajaan (coronation flower). Dalam taksonomi tumbuhan, Dianthus termasuk family Caryophyllaceae Juss. Famili
Caryophyllaceae memiliki 88 genus dan 1750 spesies ( 2011).
Tanaman anyelir dibudidayakan lebih dari 200 tahun yang lalu. Tanaman ini berasal dari kawasan Mediterania dan sudah tersebar luas di seluruh dunia. Varietas-varietas modern pertama kali dikembangkan di Perancis pada tahun 1840 (Badan Litbang Pertanian 2011). Bunga anyelir memiliki warna yang terang dan berwarna warni sehingga sering digunakan sebagai hiasan.
Anyelir termasuk tanaman perennial, yaitu tanaman yang dapat dipanen ulang (Mattjik 2010) dan dapat hidup lebih dari 2 tahun. Tanaman dapat diganti dengan yang baru setelah produksinya menurun. Warna bunga anyelir sangat beragam, kadangkala menampilkan warna yang berbintik-bintik, sehingga menjadikan komoditas ini banyak dicari. Untuk menghasilkan bunga yang bagus, budidaya tanaman anyelir harus dilakukan di daerah yang cocok, yaitu dataran tinggi dan udara serta cahaya yang mendukung.
Karakteristik dan Kegunaan Tanaman Anyelir
tanah yang gembur dan subur. Kondisi yang cocok untuk menanam tanaman anyelir adalah yang bertekstur liat berpasir, subur, gembur, berdrainase baik dan memiliki pH antara 5.5 sampai 6.7. Anyelir dapat hidup 18 sampai 20 bulan dan merupakan salah satu bunga yang tertua dan yang paling terkenal. Bunga anyelir memiliki 500 variasi yang berbeda. Bunga anyelir dapat dipanen sepanjang tahun. Tanaman anyelir berguna selain sebagai hiasan juga berguna bagi kesehatan. Sebagai hiasan, tanaman anyelir dapat digunakan sebagai tanaman pot, bunga potong, maupun bedding plant. Bunga anyelir dijadikan sebagai hiasan karena memiliki variasi warna yang menarik. Di bidang kesehatan, anyelir dimanfaatkan dalam pengobatan tradisional Tiongkok, seperti obat diare, wasir, penenang, infeksi saluran kencing, kencing batu, sembelit, anti-radang dan pembengkakan pada kulit. Bagian-bagian tanaman anyelir yang digunakan ialah daun dan bunga dalam keadaan segar atau setelah dikeringkan. Disamping itu, dilaporkan juga bahwa tanaman anyelir memiliki kandungan senyawa kimia yang sangat bermanfaat yang disebut dengan saponin. Selain itu, juga mengandung flavonoid dan minyak atsiri (Whealy 1992).
Perbanyakan Tanaman Anyelir
Perbanyakan tanaman anyelir dapat dilakukan dengan beberapa cara, yaitu dengan stek pucuk tunas samping, kultur jaringan, atau dengan biji. Stek pucuk biasanya diambil dari tanaman yang awalnya diintroduksi (tanaman impor). Tanaman induk sebagai sumber stek biasanya tidak digunakan untuk produksi bunga. Untuk mendapatkan pertumbuhan tanaman, kualitas pembungaan dan bunga yang terbaik, tanaman harus dinaungi dengan penaungan sebesar 20% (Hiatshwayo & Wahome 2010). Perbanyakan anyelir dengan teknik kultur jaringan sudah banyak dilakukan. Menurut Kharrazi et al. (2011), regenerasi tunas dipengaruhi oleh kultivar, jenis media dan konsentrasi zat pengatur tumbuh. Medium MS yang dilengkapi dengan 1-2 mg/L BAP dan 0,2 mg/L NAA merupakan medium multiplikasi tanaman yang optimal. Tanaman anyelir dapat dibudidayakan dengan masa produksi sekitar 2 tahun. Namun, agar bunga dapat memberikan hasil secara optimal, sebaiknya setelah umur 1.5 tahun pertanaman dibongkar dan diganti dengan tanaman yang baru.
Dalam upaya mengurangi ketergantungan negara akan benih impor anyelir, Balai Penelitian Tanaman hias (Balithi) sudah melakukan perakitan varietas unggul sejak tahun 1999. Sampai dengan tahun 2011, Balithi berhasil melepas delapan varietas baru, yaitu Top Beauty, Snazzy, Unique, Puspita Arum, Alifia, Sitari, Laura, dan Brenda. Kedelapan varietas ini merupakan hasil persilangan dari varietas-varietas anyelir komersial.
Sifat-Sifat Carnation mottle virus (CarMV) Arti Ekonomi Infeksi CarMV pada Tanaman Anyelir
Carnation mottle virus dalam taksonominya tergolong Famili
yang penyebarannya ke wilayah Indonesia harus dicegah karena keberadaannya belum dilaporkan (www.karantina.deptan.go.id [4 Juni 2013]). Gejala infeksi CarMV berupa keriting daun pada Begonia elatior dan menjadi masalah bagi petani selama musim dingin. Tanaman yang terinfeksi tidak dapat dijual karena memiliki kualitas rendah.
CarMV merupakan virus yang sangat penting secara ekonomi di beberapa negara di dunia. Tanaman anyelir yang bebas virus dapat kembali terinfeksi di rumah kaca dengan perkembangan reinfeksi CarMV pada tanaman bebas virus dengan mengikuti kurva berbentuk S (sigmoid). Hasil penelitian Sing et al., (2005) menunjukkan bahwa 53 kultivar anyelir yang dikumpulkan dari beberapa tempat di India, 90% positif terinfeksi CarMV berdasarkan indeksing menggunakan metode DAS ELISA dengan IgG polyclonal. Begitu pula di California dilaporkan bahwa dari 226 sampel yang diuji, insiden penyakit yang disebabkan oleh CarMV lebih tinggi dibandingkan oleh virus anyelir lainnya, yaitu sekitar 78% (Lommel et al. 1983). Cevik et al. (2010) juga melaporkan bahwa CarMV di Turki menyebabkan terjadinya penurunan hasil, ukuran, dan kualitas bunga anyelir (persentase penurunan tidak disebutkan). Di samping itu, semua kultivar anyelir yang ditanam di Antalya (Turki) terbukti terinfeksi oleh CarMV.
Kisaran Inang dan Gejala
CarMV pertama kali dilaporkan pada Dianthus spp oleh Kassanis (1955) (PVO 1996). Kisaran inang alaminya ialah Dianthus caryophyllus, D. barbatus, Saponaria vaccaria dengan gejala mild mottle, dan Begonia elatior, Begonia x
cheimantha, Daphne odora, D. chinensis, D. superbus, Saponaria officinalis
dengan gejala mottle.
Akhir-akhir ini diketahui bahwa di Taiwan, CarMV tidak hanya menginfeksi tanaman anyelir, tetapi juga menginfeksi tanaman anggrek
Phalaenopsis dengan gejala klorotik berbentuk cincin. Empat persen dari 280 tanaman Phalaenopsis yang diskrining menggunakan ELISA ditemukan terinfeksi oleh CarMV (Zheng et al. 2011).
Famili tanaman yang diketahui memiliki jenis tanaman yang rentan terhadap infeksi CarMV ialah lebih dari sembilan famili, di antaranya Amaranthaceae, Begoniaceae, Caryophyllaceae, Chenopodiaceae, Cruciferae, Cucurbitaceae, Leguminosae, Solanaceae, Portulaceae, Phytolaccaceae, dan Tetragoniaceae.
Morfologi, Sifat Fisika, dan Biokimia
Partikel CarMV dalam sap tanaman sakit memiliki sifat-sifat sebagai berikut: titik panas inaktivasi (Thermal inactivasion point/TIP) 90 oC, longevity in vitro (LIV) 70 hari atau 395 hari (untuk bentuk yang dilemahkan), dan titik batas pengenceran (dilution end point/DEP) 10-5. Infektivitas sap tidak berubah dengan perlakuan penggunaan di-ethyl ether, dan sap daun banyak mengandung virion.
Secara morfologi partikel CarMV berbentuk isometrik, tidak memiliki amplop, diameter partikel berukuran 34 nm (32-35 nm). Secara fisik, virus memiliki koefisien sedimentasi 122 S, dan titik isoelektrik pada pH 5.2. Secara biokimia, virion mengandung 20% asam nukleat dan 80% protein (Brunt & Martelli 2008; Eyu et al. 1994).
CarMV merupakan partikel virus dengan genom RNA utas tunggal positif yang linier. Total genom CarMV berukuran 4,5 kb, dan bersifat unipartit. Asam nukleat genom diisolasi oleh Carrington dan Moris pada tahun 1985 dan diketahui terdiri atas basa-basa dengan komposisi sebagai berikut: 27%G, 30% A, 19% C, dan 24% U (Brunt & Marteli 2008).
Penularan CarMV
CarMV dapat ditularkan dari tanaman yang sakit ke tanaman sehat melalui peralatan yang digunakan, seperti gunting stek dan pisau, inokulasi secara mekanis, penyambungan, dan kontak antara tanaman. CarMV tidak ditularkan melalui biji, tali putri, maupun kutu daun Myzus persicae dan Macrosiphum euphorbiae. Namun Aphis gossypii dilaporkan dapat menularkan virus secara persisten di India, meskipun belum dikonfirmasi kebenarannya (Brunt & Martelli 2008)
Deteksi Virus pada Anyelir
Keberadaan CarMV dalam jaringan tanaman anyelir sakit dapat dideteksi dengan beberapa metode yang sudah berkembang. Metode yang sudah umum digunakan ialah metode serologi yang dikenal dengan ELISA (Enzyme linked immunosorbent assay) (Sing et al. 2005). Di samping itu, deteksi dapat dilakukan dengan metode RT-PCR. Dengan menggunakan metode ini, RNA total diisolasi dari 100 mg daun sampel menggunakan suatu metode isolasi RNA satu tahap. Satu set primer yang spesifik digunakan ialah didesain dari gen Coat Protein
CarMV, yaitu primer forward BC57 (5’-GATCGCGATGAATCCCACTGTGC-
3’) dan reverse BC58 (5’-TCACATCCTATAAACAACCATTG-3’). Dengan primer tersebut diperoleh pita DNA dengan ukuran 1000 pb (Cevik et al. 2010). Hasil penelitian lainnya melaporkan bahwa CarMV dapat dideteksi dengan multiplek PCR (Raikhy et al. 2006).
secara rutin. Deteksi menggunakan teknik hibridisasi molekuler, 125 kali lebih sensitif dibandingkan dengan DAS ELISA (Sanchez-navaro et al.1996).
Organisasi Genom CarMV
CarMV memiliki lima open reading frame (ORF) yang menyandi lima protein (Raikhy et al. 2006). Genom CarMV linier, ssRNA(+) dengan panjang molekul genom 4-5.4 kb, tanpa suatu struktur cap dan poly (A) tail. RNA virion sangat menular dan berfungsi sebagai genom maupun messenger RNA (mRNA) virus. MP (movement protein) dan CP (coat protein) yang disandi oleh gen-gen pada bagian downstream ditranslasi dari subgenomik RNA (Rochon et al. 2012) (Gambar 2.1).
CarMV memiliki dua movement protein yaitu p7 dan p9 yang overlap (Vilar
et al. 2001). Movement protein (MPs) virus berperan aktif dalam pergerakan intra-interselullar RNA virus tanaman, sehingga jika terjadi gangguan pada
movement protein, infeksi virus juga terganggu. Movement protein p7 memiliki domain yang mampu mengikat RNA virus untuk bergerak secara interselular yaitu pada 19-asam amino peptide.
Strain Virus
CarMV dilaporkan memiliki strain-strain virus yang terdiri atas PSR, PR4 dan juga bentuk-bentuk strain yang lemah (PVO 1996). Strain PSR merupakan strain CarMV berdasarkan variasi secara biologi. Strain PSR menginduksi gejala lesio lokal pada beberapa tanaman inang ketika diinokulasi dengan tipe strain yang tidak dapat dibedakan secara serologi. Strain-strain yang lemah yang terjadi secara alami dilaporkan memiliki pengaruh yang kecil pada tanaman. Strain yang dilemahkan memunculkan lesio klorosis besar pada C.amaranticolor sekitar tiga minggu setelah inokulasi. Strain ini diisolasi dari anyelir setelah diberi perlakuan panas atau kultur ujung meristem (Brunt & Martelli 2008).
CarMV juga diketahui memiliki variasi secara molekuler, dimana varian-varian tersebut dinotasikan dengan PK, AN, dan PN (Brunt & Martelli 2008). CarMV secara genetik stabil. Namun, analisis CP yang dilakukan oleh Canizares
Gambar 2.1 Organisasi genom Carnation mottle virus (sumber: Brunt & Martelli 2008). ORF: Open reading frame, RdRp: RNA dependent RNA polymerase, MP: Movement protein.
:
et al. (2001) dalam Brunt & Martelli (2008) menunjukkan bahwa ada dua grup strain yang berbeda dan dinotasikan dengan PK dan AN, berdasarkan co-variasi antara asam amino pada posisi 164 yang terdapat pada domain S dan pada posisi 331 yang terdapat pada domain P. Kemudian Sing et al. (2005) menggolongkan isolat virus yang ditemukannya ke dalam suatu grup putative yang ketiga, yaitu PN.
Pengendalian CarMV
Cara terbaik untuk mengendalikan virus ini ialah menjaga supaya virus tidak masuk ke wilayah Indonesia yang dilakukan melalui sistem karantina, pengawasan (inspeksi) dan sertifikasi. Inang yang tidak menunjukkan gejala, periode inkubasi setelah inokulasi, dan tidak adanya gejala yang nyata pada biji, umbi lapis, dan stok bibit, kadangkala menjadikan pengendalian dengan karantina kurang efektif (Agrios 2005).
Sampai saat ini belum dilaporkan adanya bahan kimia yang benar-benar efektif dapat mengendalikan virus (virusida) seperti halnya fungisida, bakterisida, maupun nematisida. Namun ada beberapa bahan kimia yang sudah dicoba untuk mengendalikan virus yang penggunaannya dikombinasikan dengan teknik kultur jaringan, seperti ribavirin, virazole, dan amantadine (Diningsih et al. 2010; Wang
et al. 1990). Namun, untuk melakukan terapi terhadap materi tanaman terinfeksi terutama dengan ribavirin memerlukan biaya yang cukup tinggi karena harga ribavirin yang cukup mahal.
Penggunaan biji, umbi, tunas, dan bagian lainnya yang bebas virus merupakan suatu cara yang sangat penting untuk menghindari penyakit virus pada banyak tanaman, khususnya yang tidak mempunyai serangga vektor. Lisa (1995) melaporkan bahwa semua jenis anyelir di lapangan rentan terhadap infeksi virus. Hal ini menunjukkan bahwa kemungkinan sulit mendapatkan tanaman anyelir yang bebas virus di lapangan karena sekali terinfeksi virus, biasanya tanaman tidak dapat sembuh/diobati. Di samping itu, perbanyakan tanaman secara vegetatif, dan penggunaan tanaman induk yang secara terus menerus menyebabkan terakumulasinya virus pada tanaman dan penyebaran virus yang relatif cepat. Namun, berdasarkan hasil penelitian yang dimuat pada beberapa jurnal, tanaman bebas virus dapat dihasilkan dari tanaman yang terinfeksi dengan melakukan eliminasi terhadap virus-virus yang menginfeksi. Metode eliminasi virus ini merupakan salah satu strategi pengendalian yang dapat dilakukan untuk berbagai virus walaupun dengan keberhasilan yang rendah (Sepahpour et al. 2009; Wang et al. 1990).
Beberapa metode eliminasi virus pada tanaman anyelir yang sudah dilaporkan di antaranya ialah dengan metode tip culture dan thermotherapy
(Ahmed et al. 2012), kultur meristem (Kubilay 2011; Stone 1968), terapi panas (Mangal et al. 2004; Bhardwaj & Grag 1996), dan elektroterapi (Sepahpour et al. 2009). Penggunaan teknik pembebasan virus seperti ini sangat kecil kemungkinannya untuk mendapatkan 100% tanaman bebas virus. Namun cara pengendalian ini prospektif diterapkan karena tanaman bebas virus yang diperoleh dari perlakuan ini dapat digunakan sebagai tanaman induk untuk memproduksi stek-stek berikutnya yang bebas virus.
dapat menjaga atau mempertahankan materi tanaman tetap bebas virus dalam rentang waktu yang cukup lama. Teknik kultur teknis yang higienis merupakan cara yang terbaik untuk menjaga bahwa tanaman bebas virus yang sudah kita peroleh tetap bebas dari infeksi virus. Beberapa teknik kultur teknis yang higienis ini di antaranya ialah mencuci tangan dengan air panas yang bersabun sebelum menangani tanaman, pembuatan rumah kaca yang tahan aphid, sterilisasi peralatan yang digunakan untuk perbanyakan materi tanaman, dan lain sebagainya (Ahmed
et al. 2012). Hal ini bertujuan mencegah terjadinya penularan virus dari tanaman yang sakit pada tanaman yang sehat yang sudah diperoleh.
CarMV dilaporkan dapat dieliminasi dari tanaman dengan perlakuan panas pada 38 oC selama 2 bulan (Brunt & Martelli 2008), kultur ujung meristem (Stone 1968), kultur ujung meristem (3 mm) yang dikombinasikan dengan kemoterapi menggunakan ribavirin (5 mg/l) selama 5 minggu, kultur kalus dari petal, serta kultur ovul (Wang et al. 1990). Di samping itu, juga dilaporkan bahwa tanaman anyelir bebas CarMV dapat diperoleh melalui perlakuan arus listrik (10 mA) selama 15 menit dengan persentase tanaman anyelir bebas virus sebesar 16% (Sepahpour et al. 2009).
Selain melalui eliminasi virus dari jaringan tanaman yang sakit, pengendalian virus anyelir, terutama CarMV, dapat dilakukan dengan memproduksi tanaman yang tahan. Tanaman tahan CarMV dilaporkan dapat diperoleh melalui transfer gen CP dari virus ke tanaman, akan tetapi tanaman yang dimodifikasi secara genetik belum digunakan secara komersial (Brunt & Martelli 2008).
Mekanisme Kerja Senyawa Antiviral
Senyawa antiviral merupakan suatu substansi yang dapat menghasilkan suatu efek perlindungan atau terapi terhadap inang yang terinfeksi oleh virus (Abonyl et al. 2006). Antiviral yang efektif harus menghambat pertumbuhan virus dalam sel yang terinfeksi tanpa menjadi toksik terhadap sel normal di sekitarnya.
Terdapat beberapa target aktivitas antiviral, yaitu amplop, asam nukleat, dan protein virus (Abonyl et al. 2006). Amplop virus adalah membrane lapisan lipoprotein terluar yang umum dimiliki oleh virus. Untuk virus-virus yang beramplop, amplop virus adalah target terbaik untuk kemoterapi dengan antiviral karena destruksi amplop membuat virus rentan terhadap kerusakan dan penularan virus menjadi kurang efektif. Asam nukleat virus merupakan informasi genetik virus yang secara langsung berhubungan dengan perbanyakan virus dan diseminasi virus dalam jaringan tanaman. Implikasi dari hal tersebut ialah bahwa asam nukleat menjadi target sasaran agen kemoterapi antiviral. Pendekatan ini diharapkan menyebabkan pembentukan asam nukleat keturunannya yang tidak sempurna yang membuatnya tidak stabil, tidak menyandi protein/enzim virus dan tidak mempertahankan virulensi dari virus yang dihasilkan. Coat protein (CP) virus memiliki peran untuk pelekatan pada sel inang. Agen antiviral yang digunakan diharapkan dapat mencegah pelekatan virus pada inang.
Senyawa 2-thiouracil
Senyawa kimia 2-thiouracil analog dengan pirimidin yang dilaporkan dapat menginaktivasi beberapa virus tanaman, seperti TMV melalui mekanisme penghambatan replikasi virus. Sekitar 3-10% 2-thiouracil menyisip pada utas negatif dari RNA sehingga menghambat pembentukan utas positif. Penyisipan 2-thiouracil ke dalam utas RNA virus menyebabkan kesalahan pembentukan triplet kodon sehingga menyebabkan kesalahan dalam pembentukan asam amino dalam CP dan RdRp yang mengakibatkan hilangnya infektivitas virus. Hilangnya infektivitas virus pada tanaman dapat dibuktikan dengan dihasilkannya tanaman jeruk bebas virus sebesar 21.4% berdasarkan pengujian dengan ELISA dan RT-PCR pada konsentrasi thiouracil 25 mg/l. Perlakuan dengan senyawa 2-thiouracil tersebut dikombinasikan dengan penyambungan shoot tip (0.7 mm) secara in vitro (Sharma et al. 2007). Menurut Ilyefalvi et al. (2012), 2-thiouracil pada konsentrasi 25 mg/l mampu menghasilkan tanaman plum bebas virus sebesar 33.33%. Namun, 2-thiouracil berpengaruh buruk terhadap tanamam plum pada konsentrasi tersebut. Pada konsentrasi 25 mg/L 2-thiouracil menginduksi klorosis ringan dan menurunkan jumlah tunas yang dihasilkan, sedangkan pada konsentrasi 35 mg/L antiviral lebih bersifat toksik yang menyebabkan daun mengalami klorosis dan nekrosis.
Senyawa Amantadin
Amantadin (I-adamantanamine) merupakan senyawa tidak berwarna, stabil, dan larut dalam air. Amantadin adalah trycyclic amine yang mempunyai potensi besar dalam perlakuan dan pencegahan penyakit virus. Penggunaan amantadin ini dilaporkan umumnya efektif dalam pencegahan virus influenza A pada hewan ataupun manusia (Stanicova et al. 2001). Namun ada beberapa yang dilaporkan efektif terhadap penyakit tumbuhan (Diningsih et al. 2010).
Pada influenza A, amantadin dapat digunakan sebagai perlakuan untuk pencegahan karena secara spesifik menghambat replikasi virus yang terdapat pada konsentrasi mikromolar. Menurut Stanicova et al. 2001, amantadin secara in vitro
dapat menghambat virus (pada binatang) pada konsentrasi 30 ng/ml. Namun, dilaporkan juga bahwa terdapat strain virus yang resisten pada konsentrasi tersebut bahkan pada konsentrasi yang lebih tinggi (300 ng/ml).
Amantadin dan rimantadin sangat sesuai digunakan untuk perlakuan penyakit virus dengan beberapa alasan, yaitu: pertama, mempunyai tingkat selektivitas yang tinggi, kedua, efektif pada konsentrasi yang rendah, dan ketiga mempunyai karakteristik toksisitas yang rendah terhadap system sel yang diuji (Stanicova et al. 2001).
Dalam penghambatan replikasi virus, amantadin memutus sintesis asam nukleat oleh materi yang analog dengan nukleotida seperti azidotymidine (AZT) atau dideoxynosin (DDI). Pada virus influenza hewan, amantadin memblok M2 protein sehingga mereduksi pH lingkungan.
Kloning Gen
molekuler dimulai sekitar 30 tahun yang lalu (Hoy 2003). Teknik DNA rekombinan yang dikembangkan saat ini di antaranya ialah kloning gen. Klon merupakan suatu bentuk identik. Istilah kloning diartikan sebagai usaha mengisolasi suatu bagian yang sama persis dengan yang diinginkan dari banyak informasi dalam gen. Bahan yang diisolasi adalah mRNA.
Sebelum tahun 1970, tidak ada cara untuk memotong molekul DNA menjadi fragmen yang discrete dan predictable maupun cara untuk menggabungkan fragmen DNA spesifik. Penemuan suatu enzim yang disebut dengan restriction endonuclease dan ligases memecahkan masalah ini. Banyak teknologi rekayasa genetika tergantung pada kemampuan untuk memotong molekul DNA pada tempat yang spesisfik dan menggabungkannya menjadi molekul baru melalui pemasangan basa dan ligasi (Hoy 2003).
Perkembangan lainnya yang sangat penting adalah pemanfaatanplasmid dan
bacteriophage sebagai vektor untuk mereplikasi DNA asing (=clone) di dalam bakteri E. coli. Kloning memungkinkan sejumlah DNA spesifik diproduksi untuk penelitian dan manipulasi. Beberapa teknik untuk memonitor hasil manipulasi dikembangkan sehingga peneliti dapat mengidentifikasi perubahan dalam molekul DNA.
Saat ini teknik kloning dapat dimanfaatkan untuk memproduksi antiserum poliklonal. Produksi antiserum poliklonal melalui teknik kloning dan ekspresi gen di E. coli sudah dilakukan terhadap beberapa virus, di antaranya ialah Sweet potato feathery mottle virus (Ashoub et al. 2009), Apple stem pitting virus
(ASPV) (Komorowska & Malinowski 2009), Banana bunchy top virus (BBTV) (Abdilkader et al. 2004), Citrus tristeza virus (Nikolaeva et al. 1995; Iracheta-Cardenas et al. 2008), Potato mop-top virus (Cerovsca et al. 2003), Potato virus Y
(Folwarczna et al. 2008), Cucurbit yellow stunting disorder crinivirus (Cotillon et al. 2005) dan Potato virus X (Cerovsca et al. 2010).
Produksi antiserum melalui metode kloning dan ekspresi gen CP dalam E. coli memiliki beberapa keuntungan. Pertama, antibodi yang dihasilkan murni dari antigen (protein) virus yang kita inginkan, tidak bercampur dengan protein tanaman sehingga antiserum yang dihasilkan tidak bereaksi dengan protein tanaman. Kedua, dapat dilakukan untuk virus-virus yang memiliki titer yang rendah dalam jaringan tanaman (Cotillon et al. 2005).
Plasmid dan bakteri E. coli berturut-turut merupakan vektor dan media perbanyakan gen yang umum digunakan dalam metode kloning dan ekspresi gen. Plasmid adalah molekul DNA ekstra kromosom yang beragam dalam ukuran mulai dari 1 kb sampai lebih dari 200 kb (Sambrook & Russel 2001). Vektor ekspresi yang digunakan dalam penelitian ini adalah pET28a (Novagen). pET28a berukuran sekitar 5.8 kb yang memiliki promoter T7, lacI, synthetic ribosome-binding site (RBS), ATG (start codon), runutan 6xhis-tag, multiple cloning site
3 IDENTIFIKASI, KARAKTERISASI DAN KERAGAMAN
GENETIK
Carnation mottle virus
YANG MENGINFEKSI
TANAMAN ANYELIR (
Dianthus caryophyllus
L)
DI JAWA BARAT
Abstrak
Anyelir merupakan tanaman bunga potong yang memiliki nilai ekonomi tinggi di Indonesia. Hasil observasi lapangan pada beberapa sentra produksi anyelir di Jawa Barat, Indonesia ditemukan gejala yang khas dari infeksi
Carnation mottle virus. Penelitian ini bertujuan mengidentifikasi dan mengarakterisasi CarMV isolat Jawa Barat secara biologi maupun molekuler dan variasi genetiknya. Sampel didapatkan dari tiga daerah di Jawa Barat. Insidensi penyakit ditentukan secara serologi menggunakan empat antisera. Kisaran inang, morfologi partikel, serta karakter molekul dikaji dalam penelitian ini. Total RNA diamplifikasi menggunakan RT-PCR, dan DNA disekuen runutan basanya. Hasil penelitian menunjukkan bahwa di antara 403 sampel yang diuji, 336 sampel (83%) didominasi oleh infeksi Carnation mottle virus. Carnation ringspot virus
(CRSV) Carnation latent virus (CLV), dan Carnation vein mottle virus (CVMV) terdeteksi negatif pada semua sampel yang diuji. Inokulasi CarMV secara mekanis menunjukkan dapat menginfeksi sec