YASINTA RATNA ESTI WULANDARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Konstruksi Pustaka Genom Tibouchina langsdorffiana Baill adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2009
ABSTRACT
YASINTA RATNA ESTI WULANDARI. Construction of Genomic Libraries of Tibouchina langsdorffiana Baill. Under direction of SUHARSONO and UTUT WIDYASTUTI.
Tibouchina langsdorffiana Baill is tolerant plant to low pH and high aluminum (Al). Due its tolerance, this plant may be used as source of Al tolerant genes and model for tolerant plant to Al. Therefore genetic material of this plant must be kept in genomic library. Genomic library plays a crucial role in maintaining all genetic information belonging to an organism. This research aim to construct the genomic library of Tibouchina langsdorffiana using BlueSTAR-1 phage as a vector. The big fragments of plant DNA were obtained by partial digestion of total DNA using 0.01 unit Sau3AI per g DNA at 37ºC for 30 minutes. By using 0.5 g insert DNA and the molarity ratio between insert DNA : vector = 2.9 : 1, the titer of 1.7 x 105 plaque forming unit (pfu) per ml was obtained. Analysis of the recombinant rate by blue-white screening showed that T. langsdorffiana genomic library contains 8% phage recombinant. To determine the size of insert DNA, pBlueSTAR-1 recombinant plasmid was digested by EcoRI. This digestion resulted two DNA fragment, one is 2.1 kb fragment corresponding to pBlueSTAR-1 plasmid, and the other is 10 kb fragment corresponding to insert DNA. Since the genom size of T. langsdorffiana is unknown, Dissotis canescens was used as reference, because both species belong to Melastomataceae family. By using formula N = (ln (1-P))/( ln (1-f)), N = number of phage recombinant, f = insert DNA length ratio against genom length, so the probability (P) of all T. langsdorffiana genom found in genomic library is 17%.
RINGKASAN
YASINTA RATNA ESTI WULANDARI. Konstruksi Pustaka Genom Tibouchina langsdorffiana Baill. Dibimbing oleh SUHARSONO dan UTUT WIDYASTUTI.
T. langsdorffiana adalah tumbuhan yang toleran terhadap pH rendah dan aluminium (Al) tinggi. Oleh sebab itu tumbuhan ini dapat digunakan sebagai sumber gen dan tumbuhan model toleransi terhadap pH rendah dan Al tinggi. Untuk memanfaatkan toleransi T. langsdorffiana terhadap pH rendah dan Al tinggi dan kemampuannya dalam mengakumulasi Al, maka bahan genetik tumbuhan ini harus disimpan di dalam pustaka genom. Pustaka genom sangat penting untuk menyimpan seluruh informasi genetik yang dimiliki oleh suatu spesies.
Penelitian ini bertujuan untuk melakukan konstruksi pustaka genom T. langsdorffiana. Konstruksi pustaka genom dilakukan melalui beberapa tahapan yaitu: isolasi DNA total tanaman, pemotongan parsial DNA tanaman, penyisipan DNA T. langsdorffiana ke dalam fage , pengemasan DNA rekombinan, transveksi fage rekombinan ke E. coli dan analisis pustaka genom. Analisis pustaka genom meliputi eksisi dari fage menjadi plasmid, isolasi DNA plasmid, transformasi genetik dan pemotongan DNA plasmid dengan enzim restriksi.
Ukuran 7-20 kb DNA T. langsdorffiana didapat dari pemotongan 1 g DNA dengan 0.01 unit Sau3AI (Takara) pada 37ºC selama 30 menit. Pengemasan hasil ligasi 0.5 g DNA T. langsdorffiana dengan BlueSTAR-1 dengan rasio molaritas 2.9 : 1 menghasilkan titer sebesar 1.7 x 105plaque forming unit (pfu) tiap ml. Hasil seleksi biru-putih menunjukkan bahwa pustaka genom T. langsdorffiana yang dikonstruksi mengandung rata-rata 8% fage rekombinan. Untuk mengetahui ukuran sisipan, plasmid pBlueSTAR-1 rekombinan dipotong dengan enzim restriksi EcoRI yang menghasilkan dua fragmen DNA yaitu vektor plasmid pBlueSTAR-1 yang berukuran 2.1 kb dan DNA T. langsdorffiana yang tersisip yang berukuran 10 kb. Untuk mengetahui derajat kelengkapan suatu pustaka genom, maka informasi ukuran genom dari suatu organisme harus diketahui. Karena ukuran genom T. langsdorffiana belum diketahui, maka ukuran genom Dissotis canescens digunakan sebagai dasar perhitungan karena kedua spesies tersebut termasuk dalam famili Melastomataceae. Pada penelitian ini, volume fage yang disintesis adalah 500 µ l, sedangkan titer fage rekombinannya adalah 8% sehingga jumlah total fage rekombinan adalah 6.8 x 103 pfu. Dengan menggunakan rumus N = (ln (1-P))/( ln (1-f)), N = jumlah fage rekombinan, f = rasio ukuran DNA sisipan terhadap ukuran genom, maka peluang (P) seluruh genom T. langsdorffiana terdapat dalam pustaka genom adalah 17%. Hal ini berarti bahwa peluang untuk mendapatkan sembarang potongan DNA di dalam pustaka genom adalah 17%.
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tidak merugikan kepentingan yang wajar bagi IPB
KONSTRUKSI PUSTAKA GENOM
Tibouchina langsdorffiana Baill
YASINTA RATNA ESTI WULANDARI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Konstruksi Pustaka Genom Tibouchina langsdorffiana Baill
Nama : Yasinta Ratna Esti Wulandari
NIM : G351040131
Disetujui Komisi Pembimbing
Dr. Ir. Suharsono, DEA. Dr. Ir. Utut Widyastuti, M.Si. Ketua Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi Solihin, DEA. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
“Allah turut bekerja dalam segala
sesuatu untuk mendatangkan
kebaikan bagi mereka yang
mengasihi Dia”
Roma 8:28
Setitik usaha dan upaya kupersembahkan kepada...
Suamiku Herdamon Budianto dengan segenap pengorbanan waktu dan kesabarannya, Buah hatiku Dimas dan Michelle dengansegala keluguan dan kepolosannya, Papa dan Mama serta Dek’ Aris yang tidak lelah mendampingi dan memberiku semangat.
PRAKATA
Puji dan syukur penulis haturkan kepada „Bapa‟ oleh karena kasih dan
anugerah-Nya maka penulis dapat menyelesaikan karya ilmiah ini. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2006 sampai Desember 2008 adalah Konstruksi Pustaka Genom Tibouchina langsdorffiana Baill. Penelitian ini bertempat di Laboratorium Pusat Kerjasama Bioteknologi Indonesia-Belanda (BIORIN) dan Laboratorium Genetika Molekuler dan Seluler Tanaman, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB, Bogor.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Suharsono, DEA selaku ketua komisi pembimbing dan Ibu Dr. Ir. Utut Widyastuti, M.Si. selaku anggota komisi pembimbing yang telah banyak memberikan bimbingan dan saran selama pelaksanaan penelitian dan penyusunan karya ilmiah, serta Dr. Ir. Aris Tjahjoleksono, DEA selaku penguji yang telah banyak memberikan masukan yang berguna dalam penyelesaian penulisan karya ilmiah ini.
Terima kasih atas dana penelitian Proyek DIPA BIOTROP Tahun 2005
dengan judul “Construction of genomic Library and Isolation of Gene Involved in the Plant Tolerant to Low pH and High Solubility of Aluminium from Melastoma” dengan contract agreement No. 13.1/PSRP/SP-PEN/IV/2005 atas nama Dr. Ir. Suharsono, DEA. Terima kasih pula kepada rekan satu tim penulis yaitu Bapak Ir. Hadisunarso yang telah bersama-sama melakukan penelitian dari awal hingga berakhirnya penelitian ini. Terima kasih kepada Laboratorium BIORIN dan Laboratorium PPSHB IPB yang telah menyediakan tempat dan fasilitas dalam pelaksanaan penelitian. Terima kasih penulis sampaikan juga kepada Bapak Abdul Mulya dan Mbak Pepi Elvavina, serta Bapak Adi atas kerjasama dan bantuannya di laboratorium dan di rumah kaca.
Dalam kesempatan ini penulis mengucapkan terima kasih yang mendalam kepada suami tercinta Herdamon Budianto atas pengertian dan kesabarannya memperhatikan anak-anak saat penulis berada di laboratorium dan atas bantuannya dalam membantu mengedit tulisan karya ilmiah ini, Papa & Mama, Enpa & Enma atas dukungan semangat dan doanya, dek Aris yang telah memudahkan transportasi penulis pada masa-masa penulisan, serta seluruh keluarga dan kerabat atas doa, semangat dan kasih sayangnya, juga buat rekan-rekan yang berjuang bersama di Laboratorium BIORIN yaitu Ibu Sri Listyowati, Bu Ratna Yuniati, Pak Ulung, Pak Muzuni, Mbak Hanum, Bu Yohana, Niken, Pak Azis, Pak Neo, Rizky, Mbak Emma, Goto, dan Lulu.
Semoga Allah Bapa membalas kebaikan mereka dan semoga karya ilmiah ini dapat bermanfaat.
Bogor, Juli 2009
YASINTA RATNA ESTI WULANDARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Konstruksi Pustaka Genom Tibouchina langsdorffiana Baill adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2009
ABSTRACT
YASINTA RATNA ESTI WULANDARI. Construction of Genomic Libraries of Tibouchina langsdorffiana Baill. Under direction of SUHARSONO and UTUT WIDYASTUTI.
Tibouchina langsdorffiana Baill is tolerant plant to low pH and high aluminum (Al). Due its tolerance, this plant may be used as source of Al tolerant genes and model for tolerant plant to Al. Therefore genetic material of this plant must be kept in genomic library. Genomic library plays a crucial role in maintaining all genetic information belonging to an organism. This research aim to construct the genomic library of Tibouchina langsdorffiana using BlueSTAR-1 phage as a vector. The big fragments of plant DNA were obtained by partial digestion of total DNA using 0.01 unit Sau3AI per g DNA at 37ºC for 30 minutes. By using 0.5 g insert DNA and the molarity ratio between insert DNA : vector = 2.9 : 1, the titer of 1.7 x 105 plaque forming unit (pfu) per ml was obtained. Analysis of the recombinant rate by blue-white screening showed that T. langsdorffiana genomic library contains 8% phage recombinant. To determine the size of insert DNA, pBlueSTAR-1 recombinant plasmid was digested by EcoRI. This digestion resulted two DNA fragment, one is 2.1 kb fragment corresponding to pBlueSTAR-1 plasmid, and the other is 10 kb fragment corresponding to insert DNA. Since the genom size of T. langsdorffiana is unknown, Dissotis canescens was used as reference, because both species belong to Melastomataceae family. By using formula N = (ln (1-P))/( ln (1-f)), N = number of phage recombinant, f = insert DNA length ratio against genom length, so the probability (P) of all T. langsdorffiana genom found in genomic library is 17%.
RINGKASAN
YASINTA RATNA ESTI WULANDARI. Konstruksi Pustaka Genom Tibouchina langsdorffiana Baill. Dibimbing oleh SUHARSONO dan UTUT WIDYASTUTI.
T. langsdorffiana adalah tumbuhan yang toleran terhadap pH rendah dan aluminium (Al) tinggi. Oleh sebab itu tumbuhan ini dapat digunakan sebagai sumber gen dan tumbuhan model toleransi terhadap pH rendah dan Al tinggi. Untuk memanfaatkan toleransi T. langsdorffiana terhadap pH rendah dan Al tinggi dan kemampuannya dalam mengakumulasi Al, maka bahan genetik tumbuhan ini harus disimpan di dalam pustaka genom. Pustaka genom sangat penting untuk menyimpan seluruh informasi genetik yang dimiliki oleh suatu spesies.
Penelitian ini bertujuan untuk melakukan konstruksi pustaka genom T. langsdorffiana. Konstruksi pustaka genom dilakukan melalui beberapa tahapan yaitu: isolasi DNA total tanaman, pemotongan parsial DNA tanaman, penyisipan DNA T. langsdorffiana ke dalam fage , pengemasan DNA rekombinan, transveksi fage rekombinan ke E. coli dan analisis pustaka genom. Analisis pustaka genom meliputi eksisi dari fage menjadi plasmid, isolasi DNA plasmid, transformasi genetik dan pemotongan DNA plasmid dengan enzim restriksi.
Ukuran 7-20 kb DNA T. langsdorffiana didapat dari pemotongan 1 g DNA dengan 0.01 unit Sau3AI (Takara) pada 37ºC selama 30 menit. Pengemasan hasil ligasi 0.5 g DNA T. langsdorffiana dengan BlueSTAR-1 dengan rasio molaritas 2.9 : 1 menghasilkan titer sebesar 1.7 x 105plaque forming unit (pfu) tiap ml. Hasil seleksi biru-putih menunjukkan bahwa pustaka genom T. langsdorffiana yang dikonstruksi mengandung rata-rata 8% fage rekombinan. Untuk mengetahui ukuran sisipan, plasmid pBlueSTAR-1 rekombinan dipotong dengan enzim restriksi EcoRI yang menghasilkan dua fragmen DNA yaitu vektor plasmid pBlueSTAR-1 yang berukuran 2.1 kb dan DNA T. langsdorffiana yang tersisip yang berukuran 10 kb. Untuk mengetahui derajat kelengkapan suatu pustaka genom, maka informasi ukuran genom dari suatu organisme harus diketahui. Karena ukuran genom T. langsdorffiana belum diketahui, maka ukuran genom Dissotis canescens digunakan sebagai dasar perhitungan karena kedua spesies tersebut termasuk dalam famili Melastomataceae. Pada penelitian ini, volume fage yang disintesis adalah 500 µ l, sedangkan titer fage rekombinannya adalah 8% sehingga jumlah total fage rekombinan adalah 6.8 x 103 pfu. Dengan menggunakan rumus N = (ln (1-P))/( ln (1-f)), N = jumlah fage rekombinan, f = rasio ukuran DNA sisipan terhadap ukuran genom, maka peluang (P) seluruh genom T. langsdorffiana terdapat dalam pustaka genom adalah 17%. Hal ini berarti bahwa peluang untuk mendapatkan sembarang potongan DNA di dalam pustaka genom adalah 17%.
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tidak merugikan kepentingan yang wajar bagi IPB
KONSTRUKSI PUSTAKA GENOM
Tibouchina langsdorffiana Baill
YASINTA RATNA ESTI WULANDARI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Konstruksi Pustaka Genom Tibouchina langsdorffiana Baill
Nama : Yasinta Ratna Esti Wulandari
NIM : G351040131
Disetujui Komisi Pembimbing
Dr. Ir. Suharsono, DEA. Dr. Ir. Utut Widyastuti, M.Si. Ketua Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi Solihin, DEA. Prof. Dr. Ir. Khairil A. Notodiputro, M.S.
“Allah turut bekerja dalam segala
sesuatu untuk mendatangkan
kebaikan bagi mereka yang
mengasihi Dia”
Roma 8:28
Setitik usaha dan upaya kupersembahkan kepada...
Suamiku Herdamon Budianto dengan segenap pengorbanan waktu dan kesabarannya, Buah hatiku Dimas dan Michelle dengansegala keluguan dan kepolosannya, Papa dan Mama serta Dek’ Aris yang tidak lelah mendampingi dan memberiku semangat.
PRAKATA
Puji dan syukur penulis haturkan kepada „Bapa‟ oleh karena kasih dan
anugerah-Nya maka penulis dapat menyelesaikan karya ilmiah ini. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2006 sampai Desember 2008 adalah Konstruksi Pustaka Genom Tibouchina langsdorffiana Baill. Penelitian ini bertempat di Laboratorium Pusat Kerjasama Bioteknologi Indonesia-Belanda (BIORIN) dan Laboratorium Genetika Molekuler dan Seluler Tanaman, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB, Bogor.
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. Suharsono, DEA selaku ketua komisi pembimbing dan Ibu Dr. Ir. Utut Widyastuti, M.Si. selaku anggota komisi pembimbing yang telah banyak memberikan bimbingan dan saran selama pelaksanaan penelitian dan penyusunan karya ilmiah, serta Dr. Ir. Aris Tjahjoleksono, DEA selaku penguji yang telah banyak memberikan masukan yang berguna dalam penyelesaian penulisan karya ilmiah ini.
Terima kasih atas dana penelitian Proyek DIPA BIOTROP Tahun 2005
dengan judul “Construction of genomic Library and Isolation of Gene Involved in the Plant Tolerant to Low pH and High Solubility of Aluminium from Melastoma” dengan contract agreement No. 13.1/PSRP/SP-PEN/IV/2005 atas nama Dr. Ir. Suharsono, DEA. Terima kasih pula kepada rekan satu tim penulis yaitu Bapak Ir. Hadisunarso yang telah bersama-sama melakukan penelitian dari awal hingga berakhirnya penelitian ini. Terima kasih kepada Laboratorium BIORIN dan Laboratorium PPSHB IPB yang telah menyediakan tempat dan fasilitas dalam pelaksanaan penelitian. Terima kasih penulis sampaikan juga kepada Bapak Abdul Mulya dan Mbak Pepi Elvavina, serta Bapak Adi atas kerjasama dan bantuannya di laboratorium dan di rumah kaca.
Dalam kesempatan ini penulis mengucapkan terima kasih yang mendalam kepada suami tercinta Herdamon Budianto atas pengertian dan kesabarannya memperhatikan anak-anak saat penulis berada di laboratorium dan atas bantuannya dalam membantu mengedit tulisan karya ilmiah ini, Papa & Mama, Enpa & Enma atas dukungan semangat dan doanya, dek Aris yang telah memudahkan transportasi penulis pada masa-masa penulisan, serta seluruh keluarga dan kerabat atas doa, semangat dan kasih sayangnya, juga buat rekan-rekan yang berjuang bersama di Laboratorium BIORIN yaitu Ibu Sri Listyowati, Bu Ratna Yuniati, Pak Ulung, Pak Muzuni, Mbak Hanum, Bu Yohana, Niken, Pak Azis, Pak Neo, Rizky, Mbak Emma, Goto, dan Lulu.
Semoga Allah Bapa membalas kebaikan mereka dan semoga karya ilmiah ini dapat bermanfaat.
Bogor, Juli 2009
RIWAYAT HIDUP
Penulis dilahirkan di Jayapura pada tanggal 2 Januari 1981 dari ayah Drs. F.X. Soewarto Citrotaruno, M.S. dan ibu M.G. Soewarti Pujirahayu, S.E., M.M. Penulis merupakan putri pertama dari dua bersaudara. Pada tahun 2005, penulis menikah dengan Hugo Herdamon Budianto, SP. dan saat ini telah dikaruniai dua orang buah hati yaitu Alexander Dimas Raditya dan Brigita Michelle Radisti.
Tahun 1999 penulis lulus dari SMU Stella Duce I Yogyakarta dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur undangan seleksi masuk IPB (USMI). Penulis memilih Program Studi Biologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam.
x
DAFTAR ISI
Halaman DAFTAR GAMBAR... PENDAHULUAN Latar Belakang... Tujuan... KAJIAN PUSTAKA Karakter Tibouchina... Pustaka Genom... Bakteriofage Lambda... Vektor Pengklonan Bakteriofage Lambda ... Pengemasan DNA Lambda...BAHAN DAN METODE
Waktu dan Tempat Penelitian... 3 Bahan Penelitian... 3 Metode Penelitian...
Isolasi DNA total tanaman... 3 Pemotongan parsial DNA... 4 Penyisipan nukleotida pada ujung fragmen DNA... 4 Penyisipan fragmen DNA ke dalam vektor... 4 Pengemasan fage rekombinan... 12 Transveksi fage ke dalam E. coli…………... 12 Eksisi plasmid dari fage ... Isolasi DNA plasmid rekombinan…... 12 Transformasi bakteri... 4 Pemotongan plasmid dengan enzim restriksi EcoRI... HASIL DAN PEMBAHASAN
Pemotongan Parsial dan Penyisipan Nukleotida pada Ujung Fragmen
DNA... 19 Konstruksi Fage Rekombinan... 20 Ukuran DNA Sisipan... 23 Ukuran Pustaka Genom... 25
xi
1 Morfologi tanaman T. langsdorffiana……... 2 Peta genetik bakteriofage ... 3 Penyusunan virus bakteriofage λ... 4 Vektor pengklonan fage BlueSTAR-1... 5 BlueSTAR-1 (Novagen) yang dipotong dengan XhoI dan mengalami
pengisian dengan dCTP dan dTTP pada situs pengklonan…………... 6 Tahapan konstruksi pustaka genom... 7 Fragmen DNA T. langsdorffiana hasil pemotongan parsial dengan
Sau3AI...
8 Seleksi biru-putih terhadap plak... 9 DNA T. langsdorffiana menggantikan daerah lacZ, lambda, EMC, lambda,
EMC dari vektor fage ... 10 Plasmid rekombinan yang dipotong dengan EcoRI...
5 8 10 12
12 13 19 21
PENDAHULUAN
Latar Belakang
Tibouchina langsdorffiana Baill termasuk ke dalam famili Melastomataceae. Tumbuhan ini berbunga ungu cerah dan merupakan tumbuhan hutan hujan di Mexico, Hindia barat dan Amerika Selatan (Faravani & Bakar 2007).
T. langsdorffiana toleran terhadap pH rendah dan aluminium (Al) tinggi.
Tumbuhan ini dapat tumbuh dengan baik pada pH 3. Tumbuhan ini juga toleran terhadap Al hingga konsentrasi 0.8 mM baik pada pH 4 maupun pada pH 3. Pada 1.6 mM Al atau lebih dalam lingkungan pH 4, pertumbuhan panjang akar T. langsdorffiana terhambat walaupun batang dan tunas tidak terhambat
pertumbuhannya (Muhaemin 2008). Tumbuhan ini memiliki toleransi terhadap pH rendah dan Al tinggi sehingga tumbuhan ini dapat digunakan sebagai sumber gen toleransi tumbuhan terhadap pH rendah dan Al tinggi. Selain sebagai sumber gen, tumbuhan ini juga dapat digunakan sebagai model toleransi terhadap pH rendah dan Al tinggi. Gen yang diduga bertanggungjawab terhadap toleransi terhadap pH rendah dan Al tinggi dapat diuji di tumbuhan ini dengan metode gene silencing.
Analisis akumulasi Al menunjukkan bahwa tumbuhan ini mampu mengakumulasi 4.5 mg Al tiap gram bobot kering daun dan akar setelah mendapat perlakuan 3.2 mM Al selama dua bulan (Mutiasari 2008). Kemampuannya dalam mengakumulasi Al memungkinkan tumbuhan ini dapat digunakan sebagai fitoremediasi terutama pada lahan yang mempunyai kandungan Al tinggi.
sangat bermanfaat untuk mengisolasi gen utuh yang mengandung promoter, terminator dan intron untuk mengetahui regulasi ekspresi gen. Peta fisik suatu genom juga membutuhkan pustaka genom, sehingga pustaka genom merupakan bagian yang sangat penting dalam perbaikan genetika tanaman, baik melalui teknologi DNA rekombinan maupun melalui pemuliaan konvensional (Suharsono 2002).
Pustaka genom manusia dan beberapa hewan mamalia, ikan, dan tumbuhan sudah dikonstruksi. Beberapa pustaka genom telah dikonstruksi, seperti pustaka genom kedelai kultivar Slamet yang toleran Al (Suharsono 2002) dan kultivar Lumut yang peka terhadap Al (Suharsono 2007) dalam rangka menyimpan seluruh informasi genetik yang dimiliki oleh kedelai lokal Indonesia. Dari pustaka genom kedelai kultivar Lumut, penapisan dengan pelacak gen penyandi peroksidase dari Arabidopsis telah dilakukan untuk mendapatkan gen utuh penyandi peroksidase dari kedelai (Suharsono et al. 2003). Miftahudin et al. (1998) telah mengkonstruksi pustaka cDNA dari kedelai (MLG3474) melalui mRNA yang diisolasi dari tanaman yang mendapat cekaman kekeringan. Elvawati (1999) telah mengkonstruksi pustaka cDNA tanaman kedelai yang diinduksi cekaman Al. Kurnia (2005) juga telah berhasil mengisolasi gen penyandi glutathione S-transferase dari pustaka genom kedelai kultivar Slamet. Dari pustaka genom varietas tanaman yang sama, fragmen DNA yang mengandung gen penyandi peroksidase juga telah berhasil diisolasi oleh Rachman (2005). Kurniawan (2005), telah berhasil mengisolasi fragmen DNA yang mengandung gen penyandi glutathione S-transferase dari pustaka genom kedelai kultivar Lumut. Dari pustaka genom varietas tanaman yang sama, fragmen DNA yang mengandung gen penyandi peroksidase juga telah berhasil diisolasi oleh Rahmawati (2005).
Tujuan Penelitian
KAJIAN PUSTAKA
Karakter Tibouchina
Genus Tibouchina (sinonim dengan Chaetogastra, Hephestionia, Itatiaia, Lasiandra, Micranthella, Oreocosmus, Pleroma, Purpurella) terdiri dari 300 spesies (Faravani & Bakar 2007). Tibouchina biasa dikenal dengan nama
“princess flower”, “glory bushes” atau kadang-kadang “glory trees” (Judd et al. 2005; Faravani & Bakar 2007). Tanaman ini merupakan tanaman asli di hutan hujan Mexico, Hindia barat dan Amerika Selatan, terutama Brazil. Namanya berasal dari adaptasi tempat asalnya yaitu “Guiana” (Faravani & Bakar 2007).
Tibouchina merupakan anggota famili Melastomaceae (di dalam literatur biasa ditulis Melastomataceae), merupakan tanaman dikotil berbunga, berbiji tertutup (angiospermae). Famili melastomataceae terdiri dari 3000 spesies di neotropika, 1000 di Asia tropis, 240 di Afrika, 225 di Madagaskar (150-166 genus), dan 70 di Thailand (15 genus) (Renner et al. 2001). Melastomataceae kemudian menyebar di India, Australia, Sri Lanka, Asia Tenggara termasuk Filipina dan Taiwan, sampai Papua New Guinea, Pulau Pasifik, Mauritius, Jamaica, dan Amerika Serikat (Renner 1993).
T. langsdorffiana digunakan sebagai tanaman hias karena nilai estetikanya
yaitu warna bunga ungu cerah yang sangat menarik. Sebagian besar Melastomataceae dan Memecylaceae memiliki warna bunga ungu, bervariasi dari merah muda sampai magenta. Sebagai contoh, warna bunga ungu umumnya ditemui pada Dichaetanthera, Meriania, Mouriri, Rhynchanthera dan Tibouchina, dimana kebanyakan merupakan akumulator Al (Jansen et al. 2002).
Tanaman ini tumbuh dengan baik pada tanah yang bersifat asam. Jika tanah tidak cukup asam, ujung daun akan seperti terbakar, kemudian menjadi coklat atau bahkan daun akan mati. Jika hal itu terjadi, keasaman tanah dibuat dengan menambahkan sulfur ke tanah di sekitar akar, atau menggunakan pupuk yang bersifat asam. Tanaman ini tidak perlu dipangkas, karena dapat tumbuh menjadi pohon besar (http://www.abc.net.au/gardening/stories/s2040246.htm).
yaitu memiliki ciri-ciri semak berkayu lembut, mencapai tinggi 1.5 m dengan lebar tajuk 1 m, bunganya yang besar dan berwarna magenta muncul di bulan Desember sampai April, bunganya unik karena memiliki dua set benang sari yang berbeda satu dengan yang lain, lima di antaranya panjang berwarna ungu dengan ujung melengkung sementara lima lainnya lebih pendek dan berwarna kuning (http://www.plantzafrica.com/plantcd/dissotiscanes.htm).
Perbanyakan T. langsdorffiana ini melalui stek secara vegetatif karena tanaman ini tidak menghasilkan biji. Berbunga melimpah antara bulan Mei sampai Januari. Spesies T. langsdorffiana biasanya memiliki daun yang berbulu halus dengan tulang daun yang menonjol dan memperlihatkan warna bunga ungu menarik sehingga ditanam sebagai hiasan. Nama lokal tanaman ini di kalangan penjual tanaman hias, dikenal dengan nama violet, tibocina/tebocina (Sunda). Kedudukan T. langsdorffiana dalam taksonomi adalah sebagai berikut:
Domain : Eukariota Kingdom : Plantae
Subkingdom : Viridaeplantae Filum : Magnoliophyta Kelas : Magnoliopsida Subkelas : Rosidae
Ordo : Myrtales
Famili : Melastomataceae Genus : Tibouchina
Spesies : Tibouchina langsdorffiana Baill
T. langsdorffiana merupakan tanaman perennial, termasuk herba, semak,
atau pohon, tegak, dengan tinggi 0.5 m sampai 25 m (Gambar 1a), daun tunggal (Gambar 1b), bertangkai, duduk daun berhadapan, pertulangan daun menyirip, ujung runcing, pangkal tumpul, tepi rata, bentuk lanset, permukaan bersisik. Bunga T. langsdorffiana merupakan bunga terbatas tipe malai rata (corymbiform cyme) dengan jumlah bunga 5-25 kuntum bunga (Gambar 1c), kelopak (sepal)
5
(polyandrous) dengan panjang sama, tipe perlekatan tangkai sari dengan kepala sari yaitu versatile, tipe putik syncarp karena memiliki 5 buah karpel yang dipisahkan oleh sekat (septum), tipe kepala putik clavate, sedangkan tipe tangkai putik geneculate (Gambar 1e). Tipe plasentasi bakal buah axial (Gambar 1f), dan merupakan bakal buah tenggelam (inferior), tetapi dalam perkembangannya, bakal buah beserta biji di dalamnya akan gugur sehingga tanaman ini tidak menghasilkan buah dan biji.
Gambar 1 Morfologi tanaman T. langsdorffiana: a. tanaman berupa semak berkayu; b. daun tunggal; c. tipe malai cabang bunga; d. tipe kelopak dan mahkota bunga; e. tipe benang sari dan putik bunga; f. plasentasi bakal buah.
d 2 cm e 1 mm f 1 mm
Pustaka Genom
Suatu pustaka gen dapat diartikan sebagai sekumpulan sekuen (urutan) DNA dari suatu organisme yang masing-masing telah di klon ke dalam vektor tertentu untuk memudahkan pemurnian, penyimpanan dan analisisnya. Pada dasarnya terdapat dua macam pustaka gen yang dapat dikonstruksi, tergantung sumber DNA yang digunakan. Jika DNA yang digunakan adalah DNA genomik/kromosom, maka perpustakaan yang dihasilkan disebut pustaka genom. Sementara itu, jika DNA yang digunakan merupakan hasil transkripsi balik suatu populasi mRNA, maka pustaka yang diperoleh dinamakan pustaka complementary DNA (cDNA).
Hasil pengklonan seluruh DNA total dari spesies tertentu disebut dengan pustaka genom. Pustaka genom sangat bermanfaat dalam usaha isolasi dan karakterisasi suatu gen (Cross et al. 1999; Suharsono et al. 2003), dan juga untuk pemetaan gen secara fisik.
Pustaka genom dapat dibuat melalui sintesis cDNA dari mRNA atau DNA genom. Vektor yang diperlukan dalam pembuatan pustaka genom dapat berupa bakteriofage, P1 artificial chromosome (PAC), yeast artificial chromosome (YAC), bacterial artificial chromosome (BAC), atau kosmid, bergantung pada ukuran panjang fragmen DNA (Wahyudi 2001). Pada penelitian ini dipakai vektor pengklonan yaitu fage lambda ( BlueSTAR-1 (Novagen 1997). Fage BlueSTAR-1 adalah vektor yang didesain untuk membuat pustaka genom DNA dengan efisiensi kloning fragmen DNA berukuran 7-20 kb. Vektor mengandung gen untuk seleksi biru/putih yang unik dan cre-loxP yang digunakan untuk autosubkloning (Novagen 1997).
7
tertentu sehingga hasil potongannya cocok dengan fragmen DNA. Untuk menghindari adanya penyatuan kembali (religasi) ujung-ujung potongan biasanya dimodifikasi dengan penambahan nukleotida tertentu (fill-in).
Dalam mengkonstruksi pustaka genom DNA, DNA umumnya dipotong dengan enzim restriksi yang mengenali situs yang terdiri dari 4 pasang basa (pb) (contohnya Sau3AI). Pengenalan dan pemotongan sekuen 4 pb yang spesifik ini akan terjadi rata-rata sekali setiap 44 = 256 pb. Untuk meningkatkan kemungkinan semua daerah genom berhasil diklonkan dan terkandung dalam pustaka genom, DNA genom biasanya dipotong secara parsial untuk menghasilkan fragmen restriksi yang saling tumpang tindih (overlapping) yang berukuran besar, sekitar 20 kb. Vektor fage dapat menampung sekitar 20 kb.
Bakteriofage Lambda
struktur yang unik karena pada kedua ujungnya terdapat 12 basa tambahan berupa molekul DNA untai tunggal. Kedua ujung molekul DNA tersebut dapat membentuk ikatan komplementer jika terjadi pelingkaran DNA, sehingga ujung-ujung DNA tersebut disebut sebagai ujung-ujung kohesif (cohesive ends, disingkat COS) (Chauthaiwale et al. 1992).
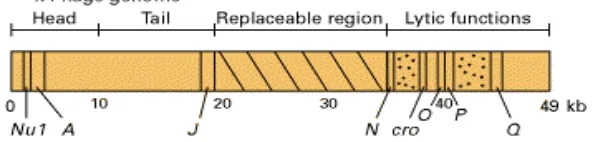
[image:31.595.174.470.370.441.2]Fage mempunyai gen-gen penyandi protein yang diperlukan dalam penyusunan kepala dan ekor dan gen-gen yang menyandikan protein yang diperlukan dalam siklus litik yang terdapat di bagian kedua ujung genomnya (Gambar 2). Beberapa daerah di bagian tengah dari genom dapat digantikan oleh DNA eksogen atau dihilangkan tanpa mempengaruhi kemampuan fage λ dalam menginfeksi sel inang dan menyusun virus baru. DNA eksogen yang menyisip diantara gen J dan N bisa berukuran lebih dari 25 kb. Terdapat sekitar 60 gen yang ada di dalam genom λ (Lodish et al. 2000).
Gambar 2 Peta genetik bakteriofage (Lodish et al. 2000).
Bakteriofage menginfeksi E. coli dengan cara menempel pada suatu reseptor spesifik yang terdapat pada permukaan sel E. coli, kemudian menginjeksikan DNAnya (Dale 1994). DNA linier utas ganda diubah menjadi bentuk sirkuler segera setelah terjadi infeksi. Setelah memasuki sel bakteri, ujung kohesif mengalami perpasangan basa membentuk molekul DNA sirkuler, dimana masih terdapat 2 buah nick pada tempat perpasangan basa tersebut. Kedua nick ini ditutup oleh DNA ligase inang sehingga dihasilkan molekul DNA sirkuler seutuhnya. DNA sirkuler ini berfungsi sebagai cetakan dalam proses transkripsi selama fase infeksi awal (Sambrook et al. 1989).
9
genom sel inang sebagai profage. Dalam kondisi cekaman nutrisi dan lingkungan, DNA yang terintegrasi dapat dikeluarkan dari kromosom inang dan selanjutnya memasuki siklus litik (Glick & Pasternak 1994). Ketika bakteriofage digunakan sebagai vektor pengklonan, dia mampu mengalami pertumbuhan litik, tetapi fungsi virus lainnya menjadi tidak relevan. Sebagai akibatnya, gen-gen yang terlibat dalam jalur lisogenik dan gen-gen virus lainnya yang tidak penting bagi jalur litik akan dihilangkan dari DNA virus dan digantikan dengan DNA yang akan diklonkan. Bakteriofage ini memiliki efisiensi pengemasan sebesar 78-108% dari ukuran DNA lambda tipe liar (Chauthaiwale et al. 1992). DNA asing yang berukuran di atas 25 kb dapat disisipkan ke dalam genom , menghasilkan DNA rekombinan yang dapat dikemas secara in vitro untuk membentuk virus-virus yang mampu bereplikasi dan membentuk plak di dalam sel inang E. coli (Lodish et al. 2000).
Vektor Pengklonan Bakteriofage Lambda
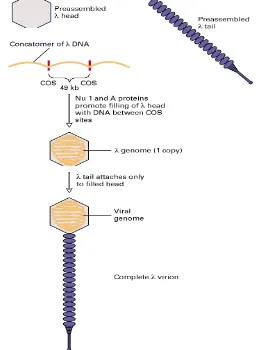
Bakteriofage merupakan salah satu vektor untuk konstruksi pustaka genom. Replikasi DNA di dalam sel inang menghasilkan molekul DNA multimerik, yang disebut concatomers, yang terdiri dari kopi-kopi ganda genom virus yang bersambungan dari ujung hingga ujung yang dibatasi oleh sekuen nukleotida spesifik yang disebut situs COS. Dua protein , yaitu Nu 1 dan A, terikat dengan situs COS dan menyisip secara langsung ke DNA di antara dua situs COS yang berdekatan kemudian masuk ke dalam kepala yang akan disusun (Lodish et al. 2000).
Setiap kepala fage mengemas genom tunggal sebesar 50 kb dari concatomers multimerik. DNA kromosom sel inang tidak menyisip ke dalam
dari genom λ mengandung COS. Protein λ Nu1 dan A yang menempel pada situs COS memicu penyisipan DNA diantara dua situs COS yang berdekatan ke dalam
kepala yang kosong. Setelah kepala-kepala terisi DNA, ekor yang siap disusun akan menempel, menghasilkan virus λ lengkap yang mampu menginfeksi sel-sel E. coli (Gambar 3).
[image:33.595.232.488.201.551.2]
Gambar 3 Penyusunan virus bakteriofage λ (Lodish et al. 2000).
Berbagai vektor pengklonan turunan dari fage telah dikonstruksi untuk berbagai tujuan berdasarkan ukuran fragmen DNA sisipan dan situs penyisipan (Singer & Berg 1991).
11
fragmen yang berukuran 13 kb. Lengan vektor akan bereligasi dengan lengan DNA genom, menghasilkan fage yang dapat menghasilkan β-galaktosidase aktif di dalam sel-sel yang terinfeksi. Virus rekombinan yang diinfeksikan ke bakteri ini, yang kemudian ditumbuhkan di cawan petri akan menghasilkan plak-plak rekombinan dalam jumlah besar. Setiap plak yang muncul dari virus rekombinan tunggal akan menghasilkan turunan fage yang jika ditumbuhkan akan identik secara genetik dimana klon yang dibentuk telah membawa insert DNA genomik khusus. Plak yang berbeda berhubungan dengan klon fage yang dibentuk, setiap plak membawa DNA insert yang berbeda, dan secara kolektif mereka menyusun pustaka genom .
Pengemasan DNA Lambda
Untuk menyiapkan virus yang infektif yang membawa DNA rekombinan, perakitan fage dilakukan secara in vitro dengan melakukan pengemasan molekul DNA fage . Salah satu metode untuk memproduksi protein pengemas fage adalah dengan menumbuhkan dua macam fage mutan secara terpisah. Kedua macam mutan ini hasil dari mutasi pada gen yang berbeda. Mutan yang satu tidak dapat mensintesis protein kepala A, dan mutan yang lain tidak mampu mensintesis protein kepala Nu 1. Dengan mencampur kedua ekstrak ini, fragmen DNA akan dikemas dalam kepala dan ekor fage akan ditempelkan pada kepala yang sudah mengandung DNA.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Maret 2006 sampai dengan Desember 2008 di Laboratorium Kerjasama Bioteknologi Indonesia-Belanda (BIORIN) dan Laboratorium Biologi Molekuler dan Seluler Tanaman (BMST), Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB.
Bahan Penelitian
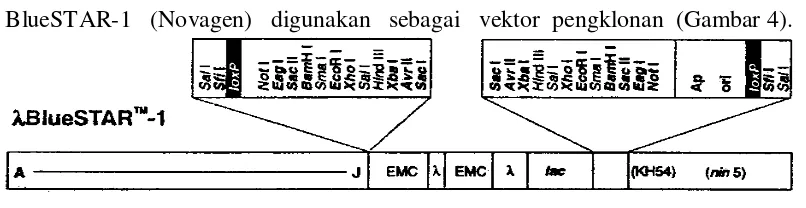
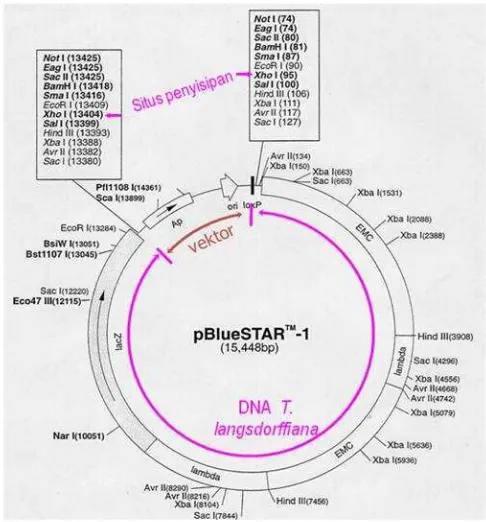
[image:35.595.111.514.306.410.2]Daun muda T. langsdorffiana digunakan sebagai bahan tanaman. Fage BlueSTAR-1 (Novagen) digunakan sebagai vektor pengklonan (Gambar 4).
Gambar 4 Vektor pengklonan fage BlueSTAR-1.
Fage ini telah dipotong dengan XhoI dan telah mengalami penyisipan (fill-in) dengan nukleotida dCTP dan dTTP sehingga menghasilkan potongan vektor dengan ujung menggantung (overhang) TC pada situs penyisipan (Gambar 5).
Gambar 5 BlueSTAR-1 (Novagen) yang dipotong dengan XhoI dan mengalami pengisian dengan dCTP dan dTTP pada situs pengklonan.
Kedua lengan dan pengisi tidak cocok
Pengisi lac
Sal I S fi I lo x P No t I E a g I Sac II B a m H I S m a I E c o R I X h o I Sal I H in d III X b a I A v r I Sac I Sac I A v r II X b a I H in d III Sal I X h o I E c o R I S m a I B a m H I Sac II E a g I No t I
Ap Ori lox
P S fi I Sal I BlueSTAR-1
Pemotongan dengan Xho I
[image:35.595.113.511.514.721.2]13
E. coli galur ER1647 digunakan sebagai inang untuk mengamplifikasi fage
rekombinan. E. coli galur BM25.8 digunakan sebagai inang untuk memproses eksisi dari fage rekombinan menjadi plasmid rekombinan. E. coli galur DH5 digunakan sebagai inang untuk mendukung replikasi plasmid.
Metode Penelitian
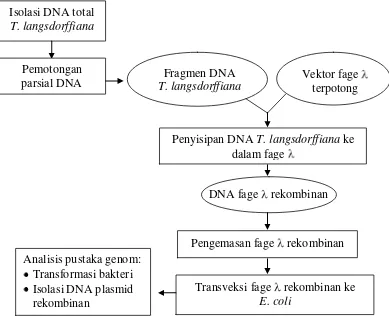
[image:36.595.116.505.385.703.2]Konstruksi pustaka genom dilakukan melalui beberapa tahapan yaitu: isolasi DNA total tanaman, pemotongan parsial DNA tanaman, penyisipan DNA T. langsdorffiana ke dalam fage , pengemasan DNA rekombinan, transveksi fage rekombinan ke E. coli dan analisis pustaka genom. Analisis pustaka genom meliputi eksisi dari fage menjadi plasmid, isolasi DNA plasmid, transformasi genetik dan pemotongan DNA plasmid dengan enzim restriksi. Tahapan penelitian ini disajikan pada Gambar 6.
Gambar 6 Tahapan konstruksi pustaka genom. Isolasi DNA total
T. langsdorffiana
Pemotongan parsial DNA
Fragmen DNA T. langsdorffiana
Vektor fage terpotong
Penyisipan DNA T. langsdorffiana ke dalam fage
DNA fage rekombinan
Pengemasan fage rekombinan
Transveksi fage rekombinan ke E. coli
Isolasi DNA total tanaman
Isolasi DNA total tanaman dilakukan dengan mengikuti prosedur Chang et al. (1993) yang dimodifikasi yaitu dengan penggantian LiCl dengan
15
kecepatan 14000 rpm, 4 C, 30 menit. Endapan DNA tersebut dikeringkan, kemudian disuspensikan di dalam TE pH 8.
Pemotongan parsial DNA
DNA total tanaman dipotong dengan enzim Sau3AI (Takara) pada suhu 37ºC selama 30 menit dengan berbagai konsentrasi yaitu: 0.01, 0.015, 0.02 dan 0.04 unit tiap µg DNA.
Penyisipan nukleotida pada ujung fragmen DNA
Setelah dipotong secara parsial kedua ujung fragmen DNA disisipi terlebih dahulu dengan dua nukleotida untuk mencegah terjadinya penyambungan kembali di antara fragmen-fragmen tersebut sesuai dengan prosedur Novagen (1997). Sebanyak 20 g fragmen DNA dicampur dengan larutan penyangga yang mengandung 50 mM Tris-HCl pH 7.3, 10 mM MgCl2, 50 g/ml bovin serum
albumin (BSA), 1 mM deoksiadenosina trifosfat (dATP), 1 mM deoksiguanosina trifosfat (dGTP) (Novagen), 4 µ l 100 mM ditiotreitol (DTT), dan 20 unit Klenow DNA polimerase (Takara) dalam volume total 400 l. Campuran tersebut diinkubasikan pada suhu 30oC selama 30 menit. Campuran dipanaskan pada 70oC selama 10 menit untuk menghentikan reaksi tersebut. Fragmen DNA yang berukuran 7-20 kb diisolasi dengan menggunakan kolom Chroma Spin 1000 (Clontech 1999).
Penyisipan fragmen DNA ke dalam vektor
Fragmen DNA hasil isolasi disisipkan ke dalam vektor fage dengan cara mencampur 0.5 g fragmen DNA yang ujungnya telah disisipi (fill-in) nukleotida dengan 0.5 g BlueSTAR-1 (Novagen), 4.5 unit T4 DNA ligase (Takara), dan bufer ligasi (30 mM Tris-HCl pH 7.8, 10 mM MgCl2, 10 mM DTT, 1 mM ATP,
5% polietilen glikol (PEG) 8000), dalam volume total 10 l. Campuran diinkubasi pada suhu 4oC selama 24 jam.
Pengemasan fage rekombinan
Setelah ligasi, DNA fage rekombinan yang dihasilkan selanjutnya dikemas dalam protein mantel. Sebanyak 10 l hasil reaksi ligasi dicampur dengan 50 l protein ekstrak pengemas (Gigapack III, Stratagene) sesuai prosedur Stratagene (2003). Campuran diinkubasikan pada suhu 22oC selama dua jam. Reaksi dihentikan dengan menambahkan 440 l bufer SM (5.8 g/l NaCl, 2 g/l MgSO47H2O, 0.01% gelatin, dan 50 mM Tris-HCl, pH 7.5). Jumlah titer
ditentukan dengan melakukan transveksi ke E. coli galur ER1647.
Transveksi fage ke dalam E. coli
Transveksi fage ke dalam E. coli dilakukan mengikuti prosedur Suharsono (2002). Fage hasil pengemasan diencerkan 100 kali dan 1000 kali agar memudahkan penghitungan. Sebanyak 100 l E. coli galur ER1647 (OD600=1) dicampur dengan 100 l fage . Campuran diinkubasi dalam balok
pemanas (heat block) pada suhu 37oC selama 30 menit, kemudian ditambah 4 ml molten top agarose (10 g/l bacto-tryptone, 5 g/l NaCl, 6 g/l agarosa) bersuhu 47oC dan telah ditambah X-gal dengan konsentrasi akhir 500 ppm untuk mengidentifikasi rekombinan. Campuran tersebut disebar dalam cawan petri yang mengandung 15 ml media luria bertani (LB) padat (10 g/l bacto-tryptone, 5 g/l ekstrak khamir, 10 g/l NaCl, 15 g/l bacto-agar) sesuai prosedur Novagen (1997). Setelah agarosa yang berada di atas media LB padat tersebut membeku, cawan ditutup, kemudian diinkubasikan pada suhu 37oC selama satu malam.
Eksisi plasmid dari fage
Transveksi fage juga dilakukan ke dalam E. coli galur BM25.8 (OD600=1) untuk melakukan eksisi dari bentuk fage rekombinan menjadi plasmid
rekombinan. Eksisi dilakukan dengan mencampurkan 100 l E. coli galur BM25.8 (OD600=1) dengan 100 l fage . Campuran diinkubasikan di dalam
17
Isolasi DNA plasmid rekombinan
Isolasi DNA plasmid dilakukan dengan menumbuhkan satu koloni bakteri E. coli galur BM25.8 dan DH5 di dalam 2 ml media LB cair yang mengandung
100 mg/l ampisilin yang diletakkan dalam inkubator bergoyang dengan kecepatan 250 rpm, pada suhu 37oC selama semalam. Bakteri diendapkan dengan sentrifugasi pada kecepatan 14000 rpm (Jouan, BR4i), pada suhu 4oC selama 10 menit. Endapan bakteri selanjutnya disuspensikan dalam 300 l larutan penyangga suspensi sel (10 mM EDTA, 50 mM Tris-HCl pH 7.5), kemudian ditambah 300 l larutan penyangga lisis (0.2 M NaOH, 1% SDS). Setelah bakteri tersebut mengalami lisis, ditambah 300 l larutan penyangga netralisasi (1.32 M Na-asetat pH 4.8). Campuran tersebut disentrifugasi pada kecepatan 14000 rpm pada suhu 4oC selama 20 menit. Cairan yang mengandung DNA plasmid diekstraksi dengan larutan PCI, kemudian divorteks dan disentrifugasi pada kecepatan 14000 rpm pada suhu 4ºC selama 20 menit. Supernatan diambil dan diperlakukan dengan RNAse (100 µg/ml) pada suhu 37oC selama semalam. Protein RNAse dipisahkan dari DNA plasmid dengan menambahkan larutan PCI. Cairan kemudian dipresipitasikan dengan penambahan 0.1x volume 3 M Na-asetat pH 5.2 dan 2x volume etanol absolut, diinkubasikan pada suhu -20oC selama dua jam. DNA plasmid selanjutnya diendapkan dengan sentrifugasi pada kecepatan 14000 rpm pada suhu 4oC selama 20 menit. Endapan DNA plasmid dibilas dengan etanol 70% dan dikeringkan dengan vakum. DNA plasmid tersebut disuspensikan di dalam H2O.
Transformasi bakteri
Bakteri kompeten dibuat dengan mengikuti prosedur Nakayama dan Nishikata (1995) dalam Suharsono (2002). Satu koloni bakteri E. coli galur DH5 dikulturkan dalam 2 ml media LB cair pada inkubator bergoyang dengan kecepatan 250 rpm, pada suhu 37oC selama semalam. Kemudian bakteri tersebut disubkultur dalam 100 ml media LB cair dengan kondisi yang sama hingga OD600=0.6. Bakteri diendapkan dengan disentrifugasikan pada kecepatan 4000
MnCl2.4H2O, 10 mM CaCl2.2H2O, 3 mM [Co(NH3)6]Cl3, 100 mM KCl, gliserol
10%, pH 7.5) dan diinkubasikan di dalam es selama 10 menit. Kemudian suspensi tersebut disentrifugasi pada kecepatan 4000 rpm. Endapan bakteri disuspensikan dalam 0.83 ml TFB dan ditambah 58.1 µ l DMSO 99.9%, lalu diinkubasikan di dalam es selama 10 menit sehingga didapat bakteri kompeten. Sebanyak 50 l bakteri kompeten dicampur dengan 10 l (50-100 ng) DNA plasmid dan diinkubasikan di dalam es selama 25 menit. Campuran ini kemudian diinkubasi pada suhu 42oC selama 45 detik, dimasukkan kembali ke dalam es selama 5 menit. Campuran ini ditambah 100 l media 2x YT (16 g/l tripton, 10 g/l ekstrak khamir, 5 g/l NaCl, pH 7.0) dan diinkubasikan pada inkubator bergoyang 250 rpm, 37oC selama 20 menit. Selanjutnya bakteri disebar pada media LB padat yang mengandung ampisilin 100 ppm dan diinkubasikan pada suhu 37oC selama semalam.
Pemotongan plasmid dengan enzim restriksi EcoRI
Plasmid hasil isolasi dipotong menggunakan enzim restriksi EcoRI pada suhu 37ºC selama semalam. Komponen restriksi dengan EcoRI adalah 0.5 µ l (5 unit) enzim EcoRI (Fermentas), 1.0 µl (50 ng) DNA, 2.0 µl (10x) bufer EcoRI (50 mM Tris-HCl pH 7.5, 10 mM MgCl2, 100 mM NaCl, 0.02% Triton
X-100, 0.1 mg/ml BSA), 16.5 µl ddH2O sehingga total volume menjadi 20 µ l.
1500 2000 2000 3000 2000 3000 5000 5000 5000 4000 3000 5000 4000 3000 2000
HASIL DAN PEMBAHASAN
Pemotongan Parsial dan Penyisipan Nukleotida pada Ujung Fragmen DNA
Konstruksi pustaka genom membutuhkan potongan DNA yang besar. Untuk mendapatkan fragmen-fragmen dengan ukuran relatif besar dilakukan pemotongan parsial dengan cara mengurangi jumlah enzim restriksi atau waktu pemotongan yang digunakan. Dengan menggunakan jumlah enzim restriksi yang sedikit, enzim restriksi tidak akan memotong DNA genom pada seluruh situs pengenalan yang ada dan hanya memotong pada beberapa situs saja sehingga menghasilkan fragmen-fragmen DNA genom yang relatif panjang.
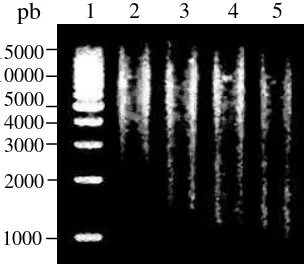
Ukuran 7-20 kb DNA T. langsdorffiana didapat dari pemotongan 1 g DNA dengan 0.01 unit Sau3AI (Takara) pada 37ºC selama 30 menit. Pada konsentrasi 0.015, 0.02 dan 0.04 U/µg DNA, DNA genom terpotong menjadi fragmen DNA yang lebih kecil (Gambar 7). Pada kedelai, pemotongan 1 g
Gambar 7 Fragmen DNA T. langsdorffiana hasil pemotongan parsial dengan Sau3AI. Lajur 1 = marker 1 kb ladder (Bexel Biotechnology); lajur 2 = DNA/Sau3AI 0.01 U; lajur 3 = DNA/Sau3AI 0.015 U; lajur 4 = DNA/Sau3AI 0.02 U; lajur 5 = DNA/Sau3AI 0.04 U.
DNA selama 30 menit pada 37oC dengan 0.01 U Sau3AI menghasilkan fragmen yang berukuran besar (Suharsono 2002, 2007). Hal ini menunjukkan bahwa pemotongan DNA genom tumbuhan dengan konsentrasi sekitar 0.01 U/µg DNA pada suhu 37oC selama 30 menit dapat digunakan sebagai acuan untuk mendapatkan fragmen DNA yang berukuran besar walaupun hasil pemotongan sangat ditentukan oleh beberapa faktor seperti kemurnian DNA, spesies asal DNA,
15000 10000
pb
1000
[image:42.595.228.382.396.529.2]keadaan (kemurnian) enzim restriksi (Sau3AI), lama dan suhu inkubasi (Suharsono 2002, 2007).
DNA genom yang telah dipotong menggunakan enzim restriksi Sau3AI tervisualisasi sebagai usapan (smear). Usapan ini merupakan kumpulan fragmen-fragmen DNA hasil potongan tersebut yang sangat bervariasi ukurannya.
Enzim Sau3AI mengenali situs spesifik 5 -GATC-3 dan memotong situs tersebut sebelum nukleotida G sehingga pemotongan DNA T. langsdorffiana menggunakan enzim Sau3AI menghasilkan ujung menggantung GATC. Untuk menghindari terjadinya penyambungan antarpotongan DNA, ujung-ujungnya telah diperlakukan dengan penambahan nukleotida dGTP dan dATP sehingga ujung menggantungnya menjadi GA. Ujung GA dari satu fragmen DNA T. langsdorffiana tidak dapat menyambung dengan ujung GA dari fragmen DNA T.
langsdorffiana lainnya. Vektor fage yang dipotong dengan XhoI yang mengenali
situs spesifik 5 -CTCGAG-3 dan memotong diantara C dan T pada situs tersebut, menghasilkan ujung menggantung TCGA. Penambahan nukleotida dCTP dan dTTP pada ujung situs sisipan (TCGA) dari vektor fage menghasilkan ujung menggantung TC sehingga tidak akan terjadi penyambungan antar vektor. Ujung menggantung GA dari fragmen DNA T. langsdorffiana hanya cocok dengan ujung menggantung TC dari vektor sehingga proses penyambungan akan terjadi antara DNA T. langsdorffiana dan vektor. Spesifikasi kecocokan antara ujung DNA T. langsdorffiana dan vektor fage menyebabkan efisiensi perakitan vektor rekombinan menjadi tinggi.
Konstruksi Fage Rekombinan
21
bening yang disebut dengan plak pada sebaran bakteri. Menurut Dale (1994), jumlah plak berkorelasi dengan jumlah partikel fage yang ditransveksikan pertama kali. Oleh sebab itu, agar penghitungan jumlah fage tidak salah maka jumlah bakteri yang diinfeksi harus sama dengan atau lebih besar daripada jumlah fage.
Pengemasan hasil ligasi 0.5 g DNA T. langsdorffiana dengan BlueSTAR-1 dengan rasio molaritas 2.9 : 1 menghasilkan titer sebesar 1.7 x 105 plaque forming unit (pfu) tiap ml. Fage yang terbentuk pada penelitian ini relatif
tinggi. Hal ini menunjukkan bahwa proses pengemasan DNA ke dalam protein mantel berjalan dengan baik.
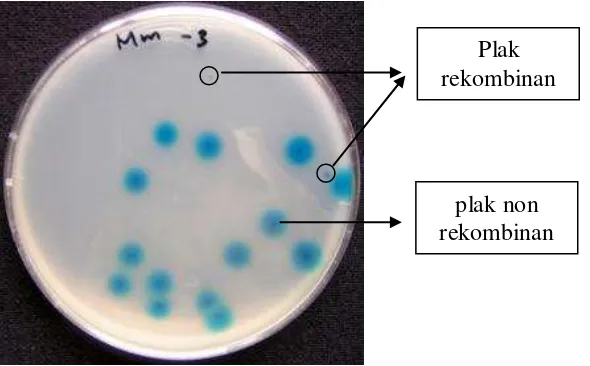
Untuk mengetahui jumlah klon rekombinan, pustaka genom yang terbentuk diambil 10 µ l dan diencerkan 100 kali dan 1000 kali, kemudian ditransveksikan ke E. coli galur ER1647 dan diseleksi biru-putih (Gambar 8).
Gambar 8 Seleksi biru-putih terhadap plak.
Terbentuknya plak jernih menunjukkan bahwa bakteriofage mengandung DNA sisipan untuk membentuk lambda rekombinan. Penggunaan X-gal pada penelitian ini bertujuan untuk membedakan lambda rekombinan dan bukan rekombinan. Plasmid pBlueSTAR-1 mengandung gen lacZ yang menyandikan β -galaktosidase. Pada lacZ terdapat daerah yang disebut daerah pengklonan ganda. Pada daerah pengklonan ini, terdapat banyak situs restriksi dari berbagai enzim restriksi. Bila gen lacZ tersisipi DNA asing, gen lacZ tidak diekspresikan sehingga
β-galaktosidase tidak disintesis. Tidak adanya β-galaktosidase menyebabkan X-gal tidak dapat dihidrolisis. X-gal bersifat kromogen yang akan menghasilkan warna biru bila dihidrolisis menjadi glukosa dan galaktosa. Warna biru itu sendiri terikat
Plak rekombinan
[image:44.595.216.511.340.523.2]pada galaktosa, dan hanya akan kelihatan jika galaktosa terlepas dari X-gal. Plak yang berwarna jernih menunjukkan bahwa plak tersebut tersusun dari fage rekombinan karena adanya DNA sisipan pada gen lacZ.
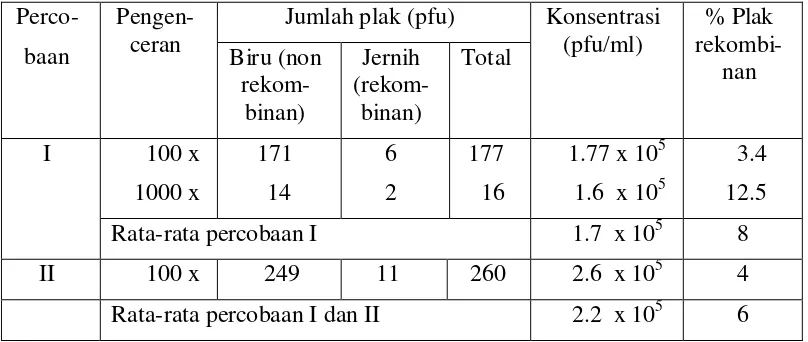
Hasil seleksi biru-putih menunjukkan bahwa pustaka genom T. langsdorffiana yang dikonstruksi pada penelitian ini mengandung rata-rata 8%
[image:45.595.113.517.234.405.2]fage rekombinan (Tabel 1).
Tabel 1 Hasil seleksi biru-putih terhadap pustaka genom T. langsdorffiana Perco-
baan
Pengen-ceran
Jumlah plak (pfu) Konsentrasi (pfu/ml) % Plak rekombi-nan Biru (non rekom-binan) Jernih (rekom-binan) Total
I 100 x 1000 x 171 14 6 2 177 16
1.77 x 105 1.6 x 105
3.4 12.5 Rata-rata percobaan I 1.7 x 105 8 II 100 x 249 11 260 2.6 x 105 4 Rata-rata percobaan I dan II 2.2 x 105 6
Walaupun proses pengemasan fage berjalan dengan baik, jumlah fage rekombinan yang terbentuk relatif kecil dibandingkan dengan pustaka genom kedelai kultivar Slamet dan Lumut (Suharsono 2002, 2007). Rendahnya jumlah fage rekombinan yang terbentuk dapat disebabkan oleh proses ligasi yang tidak berlangsung dengan baik sehingga tidak semua fragmen DNA T. langsdorffiana dapat menyambung dengan DNA vektor.
23
yang berbentuk gel tetap terbentuk dan bercampur dengan DNA. Menurut Renner (2001), ekstraksi dalam proses isolasi DNA seringkali diulang beberapa kali karena daun melastomataceae mengandung produk sekunder yang menyebabkan DNA sangat sulit untuk diisolasi. Kemurnian dan keutuhan DNA sangat menentukan keberhasilan percobaan pada tahap-tahap selanjutnya.
Ukuran DNA Sisipan
Untuk mengetahui ukuran DNA T. langsdorffiana yang tersisip di dalam vektor, satu plak yang berwarna jernih diambil dengan ujung pipet mikro berukuran 200 µ l yang telah dipotong ujungnya sehingga berukuran sedikit lebih besar dari ukuran plak. Fage yang terdapat di gel dielusi dalam 500 l bufer SM selama semalam. Fage ini ditransveksikan ke E. coli galur BM25.8 yang dapat mensintesis rekombinase cre. Rekombinase cre menginduksi terjadinya proses rekombinasi pada situs loxP yang dimiliki vektor BlueSTAR-1 (Suharsono 2007) sehingga membentuk plasmid pBlueSTAR-1 rekombinan yang mengandung DNA T. langsdorffiana. Proses rekombinasi pada dua situs loxP pada rekombinan menghasilkan plasmid pBlueSTAR-1 dan DNA T. langsdorffiana sebagai sisipan (Gambar 9).
[image:46.595.206.449.466.727.2]
10000 10000
Proses eksisi terbaik terjadi bila suspensi fage hasil elusi diencerkan 100 kali sebelum dilakukan transveksi pada E. coli galur BM25.8 seperti pada hasil Suharsono (2002, 2007). Pengenceran ini dimaksudkan agar terbentuk plak yang menyebar dan terpisah satu dengan lainnya. Plasmid yang berada di dalam E. coli galur BM25.8 tidak efisien dalam melakukan perbanyakan sehingga setelah diisolasi, plasmid tersebut diintroduksikan ke dalam E. coli galur DH5 .
Keberadaan plasmid di dalam E. coli DH5 diseleksi dengan ampisilin, sehingga hanya bakteri yang mengandung plasmid rekombinan adalah yang tumbuh di media tersebut. Adanya gen resistensi terhadap antibiotik di dalam plasmid rekombinan memudahkan proses seleksi terhadap klon bakteri yang membawa plasmid rekombinan. E. coli DH5 yang tidak mengandung plasmid rekombinan mengalami kematian pada media yang mengandung ampisilin.
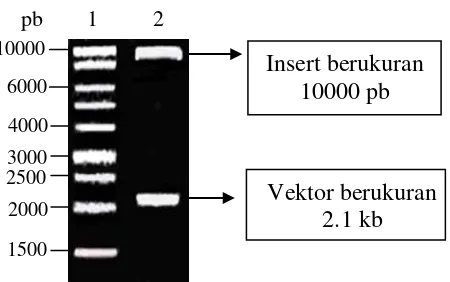
Untuk mengetahui ukuran sisipan, plasmid pBlueSTAR-1 rekombinan dipotong dengan enzim restriksi EcoRI. EcoRI adalah suatu enzim restriksi yang berasal dari E. coli RY 13 yang mengenali dan memotong rangkaian spesifik 6 pb yaitu 5 -GAATTC-3 dan secara teoritis memotong DNA pada sekuen spesifik tersebut sekali setiap 4096 pb (46). Ujung potongan yang dihasilkan enzim restriksi ini adalah ujung kohesif/“sticky” ends (Old & Primrose 1989; Murray et al. 1996). Pemotongan plasmid pBlueSTAR-1 rekombinan dengan EcoRI menghasilkan dua fragmen DNA yang masing-masing berukuran sekitar 2.1 kb dan 10 kb (Gambar 10). Fragmen DNA berukuran 2.1 kb adalah vektor plasmid pBlueSTAR-1 dan fragmen yang berukuran 10 kb adalah DNA T. langsdorffiana yang tersisip di dalam plasmid pBlueSTAR-1.
[image:47.595.262.487.574.715.2]
Gambar 10 Plasmid rekombinan yang dipotong dengan EcoRI. Lajur 1 = marker 1 kb ladder (Promega); lajur 2 = vektor rekombinan/EcoRI.
6000 4000 3000 2500 2000
1500
Vektor berukuran 2.1 kb
pb 1 2
25
Ukuran DNA sisipan yang relatif besar yaitu 10 kb ini sangat bermanfaat dalam konstruksi pustaka genom karena pustaka genom hanya membutuhkan titer rekombinan yang relatif sedikit untuk memuat semua informasi genetik yang dimiliki oleh suatu organisme. Ukuran yang besar juga sangat bermanfaat dalam isolasi gen utuh dan pemetaan fisik karena dapat mengandung lebih dari satu gen (Suharsono 2002, 2007). Gen pada eukariot rata-rata berukuran 1346 pb (Xu et al. 2006). Vektor lain yang dapat digunakan untuk mengklon fragmen-fragmen yang besar adalah BAC dan YAC, sehingga kedua vektor ini sering digunakan untuk konstruksi pustaka genom, tetapi kedua vektor ini lebih sulit untuk direkayasa dibandingkan dengan fage.
Ukuran Pustaka Genom
Konstruksi pustaka genom bertujuan untuk mengoleksi genom dari suatu organisme di dalam klon-klon rekombinan. Setiap klon rekombinan adalah turunan yang berasal dari sel tunggal hasil introduksi fage yang membawa molekul DNA rekombinan yang sama ke sel E. coli.
Untuk mengetahui derajat kelengkapan suatu pustaka genom, maka informasi ukuran genom dari suatu organisme harus diketahui. Ukuran pustaka genom dari suatu organisme tergantung dari jumlah DNA dari genom haploid organisme tersebut. Karena ukuran genom T. langsdorffiana belum diketahui, maka ukuran genom Dissotis canescens digunakan sebagai dasar perhitungan derajat kelengkapan pustaka genom karena kedua spesies tersebut termasuk dalam famili Melastomataceae. Menurut Hanson et al. (2001), genom haploid Dissotis canescens berukuran 1.81 x 105 kb sehingga dalam keadaan diploid menjadi 3.62 x 105 kb. Untuk memuat seluruh genom ini dengan ukuran sisipan 10 kb, maka pustaka genom memerlukan 3.62 x 104 klon rekombinan bila fragmen DNA sisipan tidak saling tumpang tindih. Bila potongan DNA sisipan merupakan daerah yang tumpang tindih letaknya di dalam genom, maka pustaka genom ini memerlukan jumlah klon rekombinan lebih besar daripada 3.62 x 104.
SIMPULAN DAN SARAN
Simpulan
Potongan besar DNA T. langsdorffiana dihasilkan dari pemotongan DNA secara parsial dengan menggunakan 0.01 U Sau3AI tiap µg DNA pada suhu 37ºC selama 30 menit. Potongan besar ini telah berhasil disisipkan ke dalam fage BlueSTAR-1. Pengemasan hasil ligasi 0.5 µg DNA T. langsdorffiana dengan BlueSTAR-1 dengan rasio molaritas 2.9 : 1 menghasilkan titer yang cukup tinggi yaitu 1.7 x 105 pfu/ml dan 8% diantaranya adalah rekombinan. Karena volumenya 500 µ l, maka pustaka genom genom T. langsdorffiana yang dikonstruksi mempunyai 6.8 x 103 pfu rekombinan. Analisis DNA sisipan menunjukkan bahwa DNA T. langsdorffiana yang tersisip di dalam BlueSTAR-1 berukuran 10 kb. Berdasarkan ukuran DNA sisipan ini dan genom Dissotis canescens yang berkerabat dekat dengan T. langsdorffiana maka peluang mendapatkan sembarang potongan DNA atau gen di dalam pustaka genom adalah 17% sehingga pustaka ini belum mengandung seluruh genom T. langsdorffiana.
Saran
Untuk mendapatkan pustaka genom T. langsdorffiana yang lengkap maka DNA yang digunakan harus murni sehingga proses pemotongan, fill-in dan ligasi dapat berjalan dengan baik.
Ucapan Terima Kasih
26
fage rekombinan, f = rasio ukuran DNA sisipan terhadap ukuran genom (Sambrook et al. 1989), maka peluang (P) seluruh genom T. langsdorffiana terdapat dalam pustaka genom adalah 17%. Hal ini berarti bahwa peluang untuk mendapatkan sembarang potongan DNA di dalam pustaka genom adalah 17%. Peluang ini sangat kecil dibandingkan dengan pustaka genom kedelai kultivar Lumut (Suharsono 2007).
Hal yang perlu diperhatikan dalam mengkonstruksi suatu pustaka genom adalah bahwa pustaka genom tersebut harus mempresentasikan semua gen yang ada di dalam sumber DNA asalnya. Dengan kata lain, suatu pustaka gen ini dikatakan representatif apabila mengandung semua DNA dari suatu organisme.
DAFTAR
PUSTAKA
Chang S, Puryear J, Cairney J. 1993. A simple method for isolating RNA from pine trees. Plant Mol Biol Rep 11:113-116.
Chauthaiwale VM, Therwath A, Deshpande VV. 1992. Bacteriophage lambda as a cloning vector. Microbiol Mol Biol Rev 56(4):577-591.
Clontech. 1999. Chroma Spin Columns. [Produk protokol]. California: Clontech.
Cross SH, Clark VH, Bird AP. 1999. Isolation of CpG islands from large genomic clones. Nucl Acid Res 27(10):2099-2107.
Dale JW. 1994. Molecular Genetics of Bacteria. Ed ke-2. England: John Wiley & Sons.
Elvawati. 1999. Konstruksi pustaka cDNA tanaman kedelai (varietas Yellow Biloxy) yang diinduksi cekaman aluminium menggunakan vektor [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Faravani M, Bakar BH. 2007. Descriptive analysis on the morphology, growth and branching patterns of princess flower (Tibouchina urvilleana Cogn.) in Peninsular Malaysia. J of food, Agriculture & Environment 5(1):234-238.
Glick BR, Pasternak JJ. 1994. Molecular Biotechnology, Principles and Applications of Recombinant DNA. Washington DC: American Society for Microbiology Pr.
Hanson L, McMahon KA, Johnson MAT, Bennett MD. 2001. First nuclear DNA C-values for 25 angiosperm families. Ann of bot 87:251-258. http://www.abc.net.au/gardening/stories/s2040246.htm [13 Mei 2009]. http://www.plantzafrica.com/plantcd/dissotiscanes.htm [13 Mei 2009].
Jansen S, Watanabe T, Smets E. 2002. Aluminium accumulation in leaves of 127 species in Melastomataceae, with comments on the order Myrtales. Ann of Bot 90:53-64.
Judd WS, Campbell CS, Kellog EA, Stevens PF, Donoghue MJ. 2005. Plant Systematics: A Phylogenetic Approach. Ed ke-2. USA: Sinauer Associates, Inc.
29
Kurniawan A. 2005. Isolasi fragmen DNA yang mengandung gen penyandi glutathione s transferase dari pustaka genom kedelai kultivar lumut [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lodish et al. 2000. Molecular Cell Biology. Ed ke-4. New York: Madison Avenue.
Miftahudin, Widyastuti U, Suwanto A, Jusuf M, Aswidinoor H. 1998. Construction of cDNA library from drought-stressed soybean. Hayati 5:34-37.
Muhaemin. 2008. Analisis pertumbuhan melastoma (Melastoma malabathricum auct. non. L. dan M. affine D. Don.) yang mendapat cekaman pH rendah dan aluminium [tesis]. Bogor: Sekolah pascasarjana, Institut Pertanian Bogor.
Murray K. 1977. Applications of Bacteriophage Lambda in Recombinant DNA Research. Di dalam: Scott WA, Werner R, editor. Molecular Cloning of Recombinant DNA. USA: Academic Pr. hlm. 133-154.
Mutiasari A. 2008. Akumulasi aluminium pada Melastoma affine dan Melastoma malabathricum [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Novagen. 1997. BlueStar Vector System. Madison: Novagen.
Old RW, Primrose SB. 1989. Principles of Gene Manipulation. Oxford: Blackwell.
Rachman F. 2005. Isolasi fragmen DNA yang mengandung gen penyandi peroksidase dari pustaka genom kedelai kultivar slamet [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Rahmawati. 2005. Isolasi gen peroksidase melalui penapisan terhadap pustaka genom kedelai kultivar lumut [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Renner SS. 1993. Phylogeny and classification of the Melastomataceae and Memecylaceae. Nordic J of Bot 13:519-540.
Renner SS, Clausing G, Meyer K. 2001. Historical biogeography of Melastomataceae the roles of tertiary migration and long distance dispersal. Am J of Bot 88(7):1290-1300.
Singer M, Berg P. 1991. Genes & Genomes. California: University Science Books.
Stratagene. 2003. Gigapack III Gold Packaging Extract, Gigapack III Plus Packaging Extract, and Gigapack III XL Packaging Extract. Instruction Manual. California: Stratagene Cloning System.
Suharsono. 2002. Konstruksi pustaka genom kedelai kultivar Slamet. Hayati 9:67-70.
Suharsono, Julianto T, Jusuf M. 2003. Penapisan pustaka genom tanaman kedelai kultivar Lumut menggunakan pelacak gen peroksidase dari Arabidopsis thaliana. Simposium Bioteknologi dan Sumberdaya Genetik, Balitbiogen Pertanian, Bogor. hlm. 11-12.
Suharsono. 2007. Pembuatan perpustakaan genom kedelai (Glycine max (L.) Merrill) kultivar Lumut di dalam fage lambda. Biosfera 24(2):83-89. Wahyudi AT. 2001. Perpustakaan gen: Bagaimana mengontruksinya? [ulasan].
Hayati 8:27-30.
KONSTRUKSI PUSTAKA GENOM
Tibouchina langsdorffiana Baill
YASINTA RATNA ESTI WULANDARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Konstruksi Pustaka Genom Tibouchina langsdorffiana Baill adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juli 2009
ABSTRACT
YASINTA RATNA ESTI WULANDARI. Construction of Genomic Libraries of Tibouchina langsdorffiana Baill. Under direction of SUHARSONO and UTUT WIDYASTUTI.
Tibouchina langsdorffiana Baill is tolerant plant to low pH and high aluminum (Al). Due its tolerance, this plant may be used as source of Al tolerant genes and model for tolerant plant to Al. Therefore genetic material of this plant must be kept in genomic library. Genomic library plays a crucial role in maintaining all genetic information belonging to an organism. This research aim to construct the genomic library of Tibouchina langsdorffiana using BlueSTAR-1 phage as a vector. The big fragments of plant DNA were obtained by partial digestion of total DNA using 0.01 unit Sau3AI per g DNA at 37ºC for 30 minutes. By using 0.5