SITI MUTTI SAWITRI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
SITI MUTTI SAWITRI. Ekspresi Gen Gα dan GST Pada Kedelai Kultivar Lumut Yang Mendapat Cekaman Aluminium. Dibimbing oleh SUHARSONO dan UTUT WIDYASTUTI SUHARSONO.
Dengan ini saya menyatakan bahwa tesis yang berjudul:
Ekspresi Gen Gα dan GST Pada Kedelai Kultivar Lumut Yang Mendapat Cekaman Aluminium
Adalah benar hasil karya saya sendiri dan belum pernah dipublikasikan untuk kepentingan lain. Semua sumber data dan informasi yang digunakan telah dinyatakan secara benar dan dapat diperiksa kebenarannya.
Bogor, Oktober 2007
SITI MUTTI SAWITRI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Nama : Siti Mutti Sawitri
NRP : P055030081
Disetujui Komisi Pembimbing
Dr. Ir. Suharsono, DEA Ketua
Dr. Ir. Utut Widyastuti, Msi Anggota
Diketahui
Ketua Program Studi Bioteknologi
Dr. Ir. Muhammad Jusuf
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil Anwar Notodiputro, MS
tiada terhingga kepada Allah Subhanallahu Wata’ala yang telah memberi kesempatan kepada penulis untuk menyelesaikan penelitian serta penulisan tesis ini.
Selama proses pelaksanaan penelitian dan penulisan tesis, penulis mendapat banyak bantuan dari berbagai pihak yang menjadi bagian dalam penyelesaian proses pembuatan tesis ini. Dengan penuh rasa hormat, penulis menyampaikan penghargaan dan terima kasih yang sebesar-besarnya kepada :
1. Dr. Ir. Suharsono, DEA selaku ketua komisi pembimbing yang telah memperkaya wawasan serta memberikan bimbingan, arahan dan kemudahan kepada penulis dari awal hingga akhir.
2. Dr. Ir. Utut Widyastuti Suharsono, Msi selaku anggota komisi pembimbing atas ilmu, waktu, bimbingan, nasehat, serta dorongan yang selalu diberikan kepada penulis selama ini.
3. Dr. Miftahuddin selaku dosen penguji atas saran dan kritik yang berguna dalam penyempurnaan penulisan tesis.
4. Rektor IPB, Dekan Sekolah Pascasarjana IPB dan Ketua Program Studi
Bioteknologi atas kesempatan yang diberikan untuk mengikuti pendidikan pascasarjana di IPB Bogor.
5. Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) yang telah
menyediakan fasilitas untuk melakukan penelitian.
6. Proyek Hibah Bersaing Perguruan Tinggi XII atas nama Dr. Ir. Utut Widyastuti Suharsono, Msi dengan judul Analisa Gen Penyandi Protein Heterotrimerik-G subunit α yang Terlibat dalam Sistem Toleransi Tanaman Kedelai terhadap Cekaman Aluminium, yang telah membiayai penelitian ini.
7. Rekan-rekan sejawat di Laboratorium Biologi Molekuler dan Seluler Tanaman
PPSHB IPB: Patner sejati Rizki Amelia Lubis, Mashuda, Ratna Wulandari, Syarifin Firdaus, Yasinta Ratna, Yassier Anwar, Rida Khastini, Jaya, Muzuni, Sri Listyowati, Hadi Sunarso, Hanum, Hakim, Thesiawaty, Niken, Ulfa, Abdul Mulya, Pepy dan rekan-rekan lainnya yang tidak dapat penulis sebutkan satu per satu, terima kasih atas kerjasama, bantuan dan dukungannya selama ini.
Secara khusus, penulis sampaikan rasa terima kasih kepada Ibunda Nong Setiawati dan Ayahanda Memet Hakim atas pengorbanan moril, materil, serta doa yang tiada putus, suami Riza Rinjani atas kerelaan kesabaran kesetiaan dan dukungan kepada penulis untuk menyelesaikan penelitian ini dan Raisa Rinjani atas waktu yang hilang selama penulis sibuk.
Sebagai penutup, penulis berharap semoga tulisan ini bermanfaat dan dapat memberikan sumbangan bagi perkembangan biologi molekuler kedelai Indonesia.
Bogor, Oktober 2007
Penulis dilahirkan di Tanjung Karang, Bandar Lampung pada tanggal 9 Oktober
1980 sebagai anak ketiga dari pasangan Bapak Memet Hakim dan Ibu Nong Setiawati.
Saat ini Penulis telah menikah dengan Riza Rinjani dan memiliki putri Raisa Rinjani.
Penulis menyelesaikan pendidikan sarjana di jurusan Budidaya Pertanian,
Fakultas Pertanian Universitas Padjadjaran tahun 2003. Pada tahun yang sama penulis
DAFTAR TABEL………... x Pengaruh Cekaman Aluminium Terhadap Tanaman...
Protein Heterotrimerik-G Subunit α... Penentuan Konsentrasi Cekaman Aluminium...
DAFTAR TABEL
Halaman
1. GST yang terdapat pada kedelai... 10
2. Reduksi perpanjangan akar kultivar Lumut... 18
3 Reduksi perpanjangan akar kultivar Slamet... 19
4. Ekspresi baku gen Gα pada kultivar Lumut... 22
5. Ekspresi baku gen Gα pada kultivar Slamet... 23
6. Ekspresi baku gen GST8 pada kultivar Slamet... 25
7. Ekspresi baku gen GST12 pada kultivar Lumut... 26
DAFTAR GAMBAR
Halaman
1. Tahapan yang dilakukan dalam analisis ekspresi gen Gα dan GST... 13
2. RNA total akar kedelai kultivar Lumut pada perlakuan pH 6, pH 4,
pH 4+1.6 mM Al …………... 20
3. Hasil PCR β-Aktin yang berasal dari cetakan cDNA murni... 21 4. Hasil PCR β-aktin yang cDNAnya terkontaminasi DNA genom... 21 5. Ekspresi gen Gα dan β-aktin pada pH 6, pH 4, dan pH 4+1.6 mM Al…..……… 23 6. (A) Ekspresi gen GST8 pada kultivar Lumut (peka) dan ekspresi pada kultivar
Slamet (toleran) pada pH 6 jam ke-0
(B) Ekspresi gen GST8 pada kultivar Lumut pada pH 6 (1) dan pH 4+1.6 mM
Al (2)
24
Kedelai (Glycine max (L). Merr) adalah salah satu bahan pangan penting
bagi rakyat Indonesia. Kebutuhan kedelai dalam negeri rata-rata 2 juta ton/tahun,
sedangkan produksi kedelai dalam negeri hanya 0.8 juta ton/tahun sehingga
pemerintah harus mengimpor kedelai sebesar 1.2 juta ton setiap tahunnya (Atman
2006). Tingginya impor kedelai membuat pemerintah mencanangkan program
bangkit kedelai.Implementasi program bangkit kedelai, akan ditempuh melalui 2
subprogram yaitu dengan intensifikasi, dan pengembangan kedelai pada lahan
kering dan peningkatan Intensitas Pertanaman (IP) pada lahan seluas 500.000 ha
selama 5 tahun.
Indonesia mempunyai tanah podzolik merah kuning (PMK) seluas 47.5
juta ha (CSAR 1997). Lahan ini dapat dimanfaatkan untuk peningkatan produksi
kedelai nasional. Kendalanya adalah tanah podzolik merah kuning memiliki
derajat keasaman yang tinggi dengan kelarutan Al yang tinggi sehingga menjadi
faktor pembatas produksi tanaman karena Al merupakan racun bagi tanaman.
Pada tanah asam (pH < 5), Al menjadi oktahedral hexahidrat yang larut
(Al3+) yang merupakan bentuk paling toksik bagi tanaman dengan gejala
umumnya adalah pertumbuhan akar terhambat, akar menjadi pendek dan menebal
khususnya akar utama (Ryan et al. 1993; Sasaki et al. 1994). Bagian ujung akar
(tudung akar, meristem, zona perpanjangan akar) mengakumulasi Al lebih banyak
dan paling mengalami kerusakan dibandingkan jaringan akar lainnya (Delhaize &
Ryan 1995). Pada kedelai yang sensitif, cekaman Al menyebabkan penghambatan
panjang akar yang signifikan (Lazof et al. 1994).
Pengembangan budidaya tanaman kedelai pada lahan asam dapat
dilakukan dengan perbaikan kesuburan tanah melalui pengapuran, pemupukan
dan pemberian bahan organik. Teknik perbaikan lahan ini mahal sehingga
memberatkan petani. Alternatif terbaik untuk pengembangan kedelai di lahan
asam adalah dengan menggunakan varietas kedelai yang toleran.
Penelitian untuk mendapatkan kultivar kedelai yang toleran terhadap tanah
asam dan isolasi gen-gen yang ekspresinya diduga diinduksi oleh cekaman Al
(2000) berhasil mengklon enam fragmen gen yang responsif terhadap cekaman Al
pada kedelai kultivar Lumut yaitu gmali1 (menyandikan H+-ATPase membran
plasma, gmali14 (menyandikan Histon H3), gmali20 (menyandikan katalase),
gmali49 (menyandikan NADH dehydrogenase), gmali50 (menyandikan
Auxin-induced Protein), dan sapali (menyandikan Aminoacyl Peptidase). Yuniati (2000)
juga telah berhasil mengklon fragmen gen A36 dari kedelai kultivar Slamet yang
toleran terhadap Al, dan diduga gen A36 menyandikan protein regulator
pertumbuhan (Suharsono et al. 2003).
Analisis ekspresi gen-gen yang diinduksi oleh aluminium pada tanaman
kedelai telah banyak dilakukan. Menurut Muzuni (2003) ekspresi gen gmali14
dan gen gmali50 pada kedelai kultivar Lumut spesifik diinduksi oleh Al. Pada
kultivar yang peka terhadap cekaman aluminium yaitu kultivar Lumut, gen
gmali50 memperlihatkan ekspresi tertinggi pada dosis aluminium lebih rendah
dibandingkan pada kultivar yang toleran cekaman aluminium yaitu kultivar
Slamet (Tistama 2003). Ekspresi gen G subunit α, GST8 dan GST12 pada kultivar Slamet diinduksi oleh cekaman aluminium (Mashuda 2007).
Pada kedelai terdapat dua kopi gen yang menyandikan protein
heterotrimerik-Gα yaitu SGA1 (Kim et al. 1995) dan SGA2 (Gotor et al. 1996). Suharsono & Suharsono (2004) berhasil mengisolasi gen SGA1 dari kedelai
kultivar Slamet dan Lumut. Analisis kesamaan terhadap urutan nukleotidanya
menunjukkan bahwa gen Gα yang diisolasi dari kedelai kultivar Lumut
mempunyai kemiripan 91% dengan SGA2 dari kedelai kultivar Williams,
sedangkan gen Gα dari kultivar Slamet mempunyai kemiripan dengan gen LlGA1
dari Lupinus luteus (Darlian 2005).
Protein G merupakan salah satu protein yang penting dalam komunikasi
sel untuk menanggapi perubahan lingkungan. Lintasan signal transduksi terjadi
karena adanya interaksi antara sinyal dan reseptor permukaan membran sehingga
sinyal sampai ke protein heterotrimerik-G yang diikuti dengan perubahan GDP
menjadi GTP. Protein heterotrimerik-G berfungsi menyampaikan informasi dari
reseptor protein G yang teraktivasi ke efektor di bagian hilir dari suatu jalur
(PIP2) untuk menghasilkan dua second messenger yaitu inositol 1,4,5-
triphosphate (IP3) yang dilepaskan ke dalam sitoplasma dan diacylglycerol
(DAG) yang tetap berada di membran, yang mengaktifkan protein kinase C (PKC)
(Becker et al. 2002). IP3 dapat mengikat reseptor membran seperti kanal Ca2+,
melepas Ca2+ke dalam sitosol sehingga level Ca2+ meningkat dan merubah fungsi
sel. Cekaman Al menghambat PLC, yang akhirnya akan menghambat PIP2
menjadi IP3 sehingga mengganggu Ca2+ di dalam sel (Jones & Kochian 1995).
Protein heterotrimerik-G berperan dalam meregulasi ketahanan terhadap
patogen (Blume et al. 2000; Beffa et al. 1995; Legendre et al. 1992) dengan
meningkatkan Ca2+ sistolik dalam sel (Aharon et al. 1998) sehingga mengaktifkan
lintasan signal downstream di dalam sel (Zimmerman et al. 1997). Protein G
berperan dalam regulasi lintasan biosintesis benzo phenathridine alkaloid
(Mahady et al. 1998), dan regulasi kanal K+ pada sel mesofil (Fairley-Grenot &
Asmann 1991; Li & Asmann 1993).
Protein G subunit α terletak di membran plasma. Protein G berinteraksi dengan molekul reseptor yang ada di membran plasma (Fujisawa et al. 2001).
Subunit α berperan dalam mengaktifkan kanal Ca2+ pada plasma membran tanaman tomat (Aharon et al. 1998), meningkatkan level IP3 pada tanaman
kedelai (Legendre et al. 1993), meningkatkan spesies oksigen aktif (AOS) H2O2
pada kultur sel tanaman kedelai (Legendre et al. 1992), dan bertindak sebagai
hulu dari GTPase Rac pada sistem pertahanan padi terhadap penyakit blas
(Suharsono et al. 2002). Subunit α (RGA1) berperan dalam perkembangan normal ruas batang dan benih padi. Hal ini ditunjukkan oleh mutan Daikoku d1 yang
mengalami mutasi pada RGA1 yang menyebabkan ketidaknormalan morfologi
tanaman ini yaitu kerdil, benih kecil, dan daun berwarna hijau tua (Fujisawa et al.
1999).
Akhir dari jalur transduksi sinyal adalah mengarah ke pengaturan satu atau
lebih aktivitas seluler ataupun pengaktifan beberapa gen spesifik untuk
menanggapi sinyal dari luar. Terdapat lebih dari 20 jenis gen yang ekspresinya
diinduksi oleh Al dan telah diisolasi dari berbagai spesies tanaman, diantaranya
yaitu Arabidopsis thaliana (Richard et al.1998) dan gandum (Triticum aestivum
S-Transferase) terekspresi sebagai respon ketahanan terhadap cekaman Al dan
cekaman oksidatif (Ezaki et al. 2004). Protein GST tidak hanya terekspresi oleh
cekaman Al tetapi juga oleh cekaman lain seperti cekaman garam (Roxas et al.
2000), patogen (Dean et al. 2005), dan cekaman osmotik (Galle et al. 2005). GST
merupakan protein yang banyak terlibat dalam menanggapi berbagai cekaman
kimia dan termasuk dalam golongan protein yang berhubungan dengan sistem
antioksidasi (Ulmasov et al. 1995). Gen GST ada pada setiap tahap perkembangan
tanaman dan ada pada setiap jaringan (McGonigle et al. 2000).
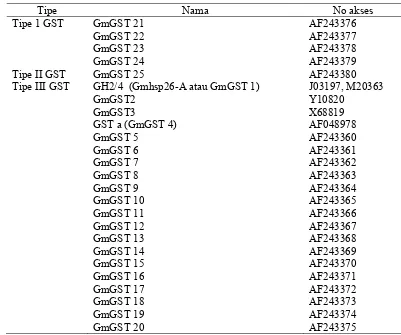
Pada kedelai, 25 jenis gen GST telah diindentifikasi dan dikelompokan
berdasarkan kemiripan sekuennya yaitu GmGSTI, GmGSTII, dan GmGSTIII.
GmGSTIII memiliki anggota paling banyak yaitu 20 jenis (GmGST1- GmGST20)
dan diekspresikan paling besar yaitu 92%, GmGST8 diekspresikan secara
melimpah yaitu sebesar 33% berdasarkan uji Expressed Sequence Taq (EST).
GmGSTI mempunyai 4 anggota (GmGST21-GmGST24) diekspresikan sebesar
6%, GmGSTII mempunyai 1 anggota yaitu GmGST25 diekspresikan sebesar 2%.
GmGST5, GmGST8, GmGST12 dan GmGST13 terdapat di akar (McGonigle et al.
2000; Droog et al. 1995).
Penelitian mengenai ekspresi gen Gα dan GST (GST8 dan GST12) pada
tanaman kedelai yang toleran tanah asam dan cekaman Al telah dilakukan oleh
Mashuda (2007). Cekaman Al pada kedelai toleran menyebabkan meningkatnya
ekspresi gen Gα, gen GST8, dan gen GST12. Ekspresi tertinggi gen Gα dan gen
GST12 terjadi pada 8 jam setelah perlakuan dan gen GST8 pada 24 jam setelah
perlakuan cekaman 1.6 mM Al. Untuk melihat ekspresi gen Gα dan GST secara
lebih jelas, maka perlu untuk mengkaji ekspresi gen-gen ini pada tanaman kedelai
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari ekspresi gen Gα dan GST pada
kedelai kultivar Lumut yang mendapat cekaman Al.
Hipotesis Penelitian
Ekspresi gen Gα dan GST pada kedelai kultivar Lumut tidak terinduksi
TINJAUAN PUSTAKA
Pengaruh Cekaman Aluminium Terhadap Tanaman
Pada kondisi asam atau pH 4 aluminium di dalam tanah dalam keadaan
terlarut dalam bentuk Al3+ yaitu Al(H2O2)63+. Ketika pH meningkat, Al dalam
bentuk Al(OH)2+ dan Al(OH)2+, dan ketika mendekati pH netral Al dalam bentuk
Al(OH)3. Pada kondisi basa Al dalam bentuk Al(OH)4- (Marschner 1995).
Aluminium menyebabkan penghambatan dalam penyerapan nutrisi dan
mineral sehingga menghambat pertumbuhan akar yaitu menghambat
perpanjangan axis akar utama dan lateral sehingga akar menjadi pendek dan
menebal (stubby). Ujung akar (tudung akar, meristem, dan zona perpanjangan)
mengakumulasi Al lebih banyak, dan mengalami kerusakan fisik lebih parah
dibandingkan jaringan akar lainnya (Delhaize & Ryan 1995). Aluminium juga
menghambat pembelahan dan pemanjangan sel akibat gangguan sintesis
DNA/RNA (Matsumoto 1991).
Tanaman mempunyai beberapa mekanisme toleransi terhadap cekaman
aluminium (Al) sehingga mampu hidup dalam keadaan mendapat cekaman Al
atau lingkungan yang asam (Kochian 1995). Mekanisme toleransi tanaman
terhadap aluminium dapat dibagi dua yaitu mekanisme eksternal dan mekanisme
internal. Mekanisme eksternal (exclusion mechanism) melalui imobilisasi Al pada
dinding sel, induksi pH di daerah rhizosfer atau apoplas akar, permeabilitas
selektif membran plasma terhadap Al, eksudasi fosfat dan efflux Al. Mekanisme
internal mencakup pengkelatan Al di sitosol oleh asam organik, protein, atau ligan
organik lain, mengurung Al di vakuola dan sintesis protein/ enzim yang toleran
Al.
Pada tanaman tembakau (Nicotiana tobacum L.) ekspresi gen parA dan
parB diinduksi oleh cekaman Al (Ezaki et al. 1997). Gen pAL111 (identik dengan
parA yang menyandi auksin) dan gen pAL142 (identik dengan parB yang
menyandi GST) pada tembakau ekspresinya diinduksi oleh aluminium dan
defisiensi Pi (Ezaki et al. 1995). Pada Arabidopsis, cekaman Al menginduksi
ekspresi beberapa gen yang juga berhubungan dengan sistem pertahanan terhadap
patogen (defense-response) seperti gen GST, peroxidase dan blue copper binding
yang diinduksi oleh cekaman akibat defisiensi fosfat (Ezaki et al. 1995),
keracunan metal (Snowden et al. 1995), infeksi patogen (Cruz-Ortega et al. 1997),
dan cekaman oksidatif (Richard et al. 1998). Menurut Richard et al. (1998)
ekspresi dari gen GST, peroxidase dan blue copper binding protein dipengaruhi
oleh aktifitas spesies oksigen aktif (AOS) H2O2 saat tanaman mengalami
cekaman.
Protein Heterotrimerik-G subunit α
Protein heterotrimerik-G adalah protein peripheral membran plasma yang
menghadap ke permukaan dalam sel (menghadap ke sitosol). Protein ini
merupakan reseptor membran sel dan berfungsi sebagai mediator penyampai
pesan/signal dari luar sel (eksternal) ke molekul efektor sehingga menghasilkan
respon intraseluler (Fujisawa et al. 2001). Protein heterotrimerik-G terdiri dari
subunit α, β, (Fujisawa et al. 2001).
Protein heterotrimerik-G disebut protein G karena mengikat
mononukleotida GDP dan GTP. Subunit α merupakan subunit yang mengatur pertukaran GTP-GDP pada mamalia (Fujisawa et al. 2001). Gα pada tanaman memiliki homologi yang sama dengan mamalia. Ada kemungkinan β mempunyai peranan secara langsung dalam meregulasi efektor dan interaksinya dengan
reseptor (Ma 1994).
Protein G subunit α atau Gα terdapat pada plasma membran (Weiss et al. 1997; Iwasaki et al. 1997). Protein Gα mengaktifkan kanal Ca2+ pada plasma membran tomat (Aharon et al. 1998), meningkatkan level IP3 kedelai (Legendre et
al. 1993) dan meningkatkan spesies oksigen aktif (AOS) H2O2 pada kultur sel
kedelai (Legendre et al. 1992). Berdasarkan analisis mutasi pada gen Gα
(dwarf1), maka Gα terlibat pada perpanjangan batang dan pembentukan benih
padi (Fujisawa et al. 2001) dan ketahanan terhadap patogen (Suharsono et al.
2002). Protein heterotrimerik-G berperan dalam meregulasi ketahanan terhadap
patogen (Aharon et al. 1998; Beffa et al. 1995; Legendre et al. 1993), regulasi
lintasan biosintesis benzo phenathridine alkaloid (Mahady et al 1998), dan
regulasi kanal K+ pada sel mesofil (Fairley-Grenot dan Asmann 1991; Li &
Pada kedelai ada dua kopi gen yang menyandikan protein
heterotrimerik-G subunit α yaitu SGA1 (Kim et al. 1995) dan SGA2 (Gotor et al. 1996). SGA1 diisolasi dari akar kedelai kultivar Williams. SGA1 juga telah diisolasi dari kedelai
kultivar Lumut dan Slamet, dan memiliki kemiripan 91% dengan SGA1 dari
kultivar Williams berdasarkan urutan nukleotidanya (Suharsono & Suharsono
2004). SGA2 diekspresikan pada semua organ vegetatif tanaman. Transkripsi
terjadi pada semua jenis sel akar, daun dan batang (Gotor et al. 1996).
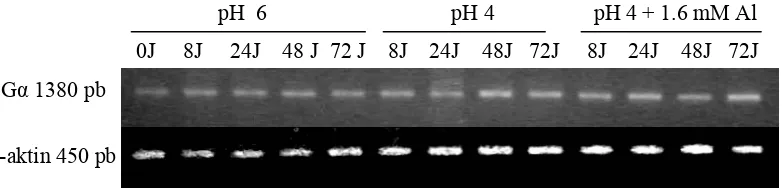
Gen Gα pada kultivar Slamet terinduksi pada 8 jam setelah perlakuan
cekaman aluminium. Kemungkinan setelah 72 jam perlakuan cekaman Al
beberapa sel sudah tidak aktif mengekspresikan gen Gα (Mashuda 2007).
Saat inaktif subunit α berikatan dengan GDP dan berasosiasi dengan β membentuk kompleks. Ketika ligan terikat pada permukaan sel reseptor, reseptor
menjadi aktif dan mengkatalisis perubahan ikatan GDP pada subunit α menjadi GTP. Hal tersebut menyebabkan terjadinya perubahan konformasi subunit α sehingga akhirnya berpisah dengan β (disosiasi). Subunit α akan meregulasi efektor dengan cara berikatan pada efektor dan mengaktifkan signal transduksi
seperti pada adenilat siklase. Protein heterotrimerik-G kembali tidak aktif ketika
GTP diubah menjadi GDP dan subunit α kembali berasosiasi dengan β (Becker et al. 2000; Ma 1994).
Protein heterotrimerik-G meregulasi banyak efektor yang berada di
bawahnya (downstream) seperti adenilat siklase, phosphalipaseC, dan efektor
transducin (Ma 1994). Phosphoinositide spesifik phospholipase C (PLC)
menghidrolisis phosphatidyl inositol 4,5-biphosphate (P1P2) menjadi 2 second
messengers yaitu inositol 1,4,5-triphosphate (IP3) dan diacylglycerol (DAG). IP3
dapat mengikat reseptor membran seperti kanal Ca2+, dan melepas Ca2+ dari
retikulum endoplasma ke dalam sitosol sehingga level Ca2+ meningkat. Protein
kinase C akan teraktifkan oleh level Ca2+ yang meningkat dan DAG. Ion Ca2+
mengaktifkan protein kalmodulin yang akan mengaktifkan protein kinase dan
fosfatase dalam satu atau lebih jalur persinyalan (Becker et al. 2000).
Akhir dari transduksi sinyal mengarah ke pengaturan satu atau lebih
aktifitas seluler, melalui pengaktifan enzim spesifik maupun sintesis enzim atau
memberikan respon terhadap sinyal yang diterima. Gluthathione S-Transferase
(GST) merupakan gen yang banyak terlibat dalam menanggapi respon yang
disebabkan oleh berbagai cekaman, diantaranya adalah cekaman patogen,
cekaman aluminium. GST juga termasuk golongan gen yang berhubungan dengan
sistem antioksidasi (Ezaki et al. 2004).
Glutathione S-Transferase
Tanaman memiliki mekanisme ketahanan yang sangat efektif untuk
menghadapi cekaman akibat kerusakan oksidatif (induced oxidative damages).
Salah satu protein yang terlibat dalam ketahanan sel terhadap cekaman oksidatif
adalah GST (Glutathione S-Transferase). GST adalah protein dengan berat
molekul sekitar 50 kDa, terdiri dari 2 subunit polipeptida (Dixon et al. 2002).
GST mengkatalis pemindahan tripeptida glutathione (γ
-glutamyl-cysteinyl-glycine; GSH) menjadi substrat (R-X) yang mengandung eletropilik reaktif untuk
membentuk hasil reaksi S-glutathionylated polar (Dixon et al. 2002).
Molekul-molekul yang telah berkonjugasi dengan GSH selanjutnya dikirim ke vakuola
melalui ATP-binding transporter. Pengiriman ke vakuola bertujuan untuk
membatasi efek dari penghambatan produk akhir GST dan melindung sel dari
bahaya lebih lanjut akibat senyawa-senyawa yang berkonjugasi dengan GSH (Rea
1999).
GST dikelompokkan berdasarkan identitas sekuennya dan dibagi menjadi
phi, tau, tetha, zeta dan lambda. Kelas tetha dan zeta banyak terdapat pada
mamalia sedangkan selebihnya terdapat pada tanaman (Dixon et al. 2002). Pada
Arabidopsis terdiri atas 48 gen GST dengan kelompok tau dan phi GST paling
banyak. Masing-masing terdiri dari 28 kelompok tau, 13 phi, 3 dari kelompok
theta, 2 zeta dan 2 lamda (Dixon et al. 2002). Pada jagung terdapat 12 kelompok
phi, 28 tau dan 2 zeta sedangkan pada kedelai terdapat 20 gen dari kelompok tau,
1 zeta dan 4 phi (McGonigle et al. 2000).
Berdasarkan kesamaan sekuennya, GST tanaman dibagi menjadi 3 tipe
yaitu GSTI, GSTII dan GSTIII (Droog et al. 1995). Menurut McGonigle et al.
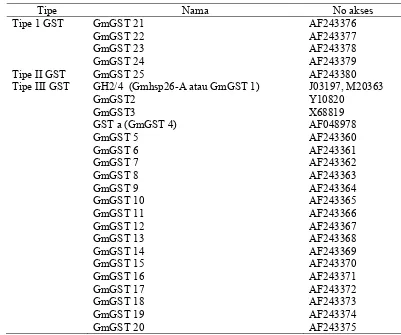
(2000) pada kedelai terdapat 25 sekuen GST (Tabel 1). Pada kedelai ada 4 tipe
6% tipe GSTI, 2% cDNA tipe GSTII, dan 92% adalah tipe GSTIII. Khusus sekuen
GST tipe III yaitu GmGST8 terdapat sebanyak 33%.
Struktur GST tanaman memiliki kesamaan yang tinggi dengan struktur
GST mamalia. GST ditemukan pada setiap tahap perkembangan tanaman dari
awal perkecambahan sampai tua dan terdapat di setiap jaringan tanaman
(McGonigle et al. 2000).
Tabel 1. GST yang terdapat pada kedelai (McGonigle et al. 2000)
Tipe Nama No akses
GH2/4 (Gmhsp26-A atau GmGST 1) GmGST2
Ekspresi gen GST8 pada akar kultivar Slamet diinduksi oleh cekaman Al
yaitu pada 8 jam dan 24 jam setelah perlakuan cekaman Al. GST8 tidak
terekspresi setelah 48 jam perlakuan cekaman Al. Lamanya perlakuan tidak
menyebabkan meningkatnya ekspresi GST8 tetapi menurunkan ekspresi GST8. Ini
menunjukkan bahwa pada kultivar Slamet gen GST8 memberi respon terhadap
cekaman Al di awal (Mashuda 2007). Sedangkan ekspresi gen GST12 pada akar
memperlihatkan ekspresi tertinggi pada 8 jam setelah perlakuan cekaman Al.
Kemudian seiring lamanya waktu cekaman menyebabkan penurunan ekspresi gen
GST12 (Mashuda 2007). Pola ekspresi ini menunjukkan bahwa ada keterlibatan
gen GST12 terhadap cekaman Al.
Aktivitas gen GST akan meningkat sebagai respon rangsangan adanya
kerusakan oksidatif (Marrs 1996; Droog 1997). Gen GST diinduksi oleh berbagai
rangsangan dari lingkungan meliputi serangan jamur, cekaman dehidrasi, etilen,
pelukaan (wounding) (Marrs 1996). Aktifitas gen GST meningkat akibat
pemanasan dan kondisi cekaman garam pada benih transgenik tembakau (Roxas
et al. 1997). Aktivitas GST di akar meningkat lebih tajam dibanding di batang
pada Triticum aestivum akibat cekaman osmotik (Galle et al. 2005). Auksin,
hormon-hormon, logam berat, H2O2, garam, suhu (heat shock), cekaman
lingkungan telah menginduksi promotor GH2/4 yang menyandi GST pada
tembakau transgenik (Ulmasov et al. 1995). Gen GST berperan dalam
detoksifikasi dan proteksi sel dari cekaman oksidatif, melindungi dari cekaman
biotik dan abiotik meliputi serangan patogen, xenobiotik dan racun logam berat
yang merupakan respon tanaman terhadap perubahan kondisi lingkungan
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilakukan dari bulan April 2006 sampai dengan bulan April
2007. Penelitian dilakukan di rumah kaca, laboratorium Biologi Molekuler Seluler
Tanaman, dan laboratorium BIORIN, Pusat Penelitian Sumberdaya Hayati dan
Bioteknologi IPB.
Bahan dan Alat
Bahan tanaman yang digunakan adalah kedelai kultivar Lumut yang peka
terhadap cekaman Al (Anwar et al. 2000). Cekaman dilakukan pada kultur cair
dengan menggunakan media kultur menurut Sopandie et al. (1996) yang
dimodifikasi Anwar (1999). RNA diisolasi menggunakan kit Trizol(Invitrogen).
Primer Gα didesain dari kedelai, yaitu SGAI (nomor aksesi L27418) dengan
primer forward (F) terletak pada 111 nukleotida sebelum kodon awal
(5’GCTTCACACTTCACACTTAACACT3’) dan primer reverse (R) terletak
pada 114 nukleotida sesudah kodon akhir
(5’ATATTGTTGTATACCTGACCTC3’). Ekspresi gen GST dideteksi dengan
menggunakan dua primer yaitu GST8 (nomor aksesi AF243363) dan GST12
(nomor aksesi AF243367). Primer F GST8 terletak pada 11 nukleotida sebelum
kodon awal (5’ATAGTGCTGCAATGGCTTCA3’) dan primer R terletak pada 16
nukleotida sebelum kodon akhir (5’AGATGTGGTGTGTGACTTAG3’). Primer
F gen GST12 terletak pada 2 nukleotida sebelum kodon awal
(5’CCATAGCAATGGCAGAGCAAG3’) dan primer R terletak pada 34
nukleotida sebelum kodon akhir (5’TATATATCATTCTGTGGCAG3’). Sebagai
kontrol untuk mengetahui kemurnian cDNA dari kontaminasi DNA genom
digunakan primer β-aktin yang didesain dari kedelai (nomor aksesi V00450) dengan primer F tepat pada kodon awal dari ekson 1
(5’ATGGCAGATGCCGAGGATAT3’) dan primer R tepat pada daerah ekson 2
(5’CAGTTGTGCGACCACTTGCA3’).
Alat utama yang digunakan untuk kultur cair adalah tray, bak, selang,
aerator, tong, gelas ukur. Alat untuk isolasi RNA dan PCR adalah sentrifugasi,
Metode Penelitian
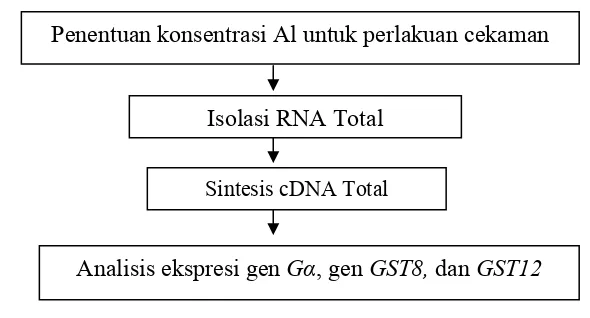
Analisis ekspresi gen Gα dan GST dilakukan melalui beberapa tahapan,
yaitu: (1) Penentuan konsentrasi Al untuk perlakuan cekaman, (2) Isolasi RNA
total, (3) Sintesis cDNA total, dan (4) Analisis ekspresi gen Gα, GST8 dan GST12,
seperti pada Gambar 1.
Gambar 1. Tahapan yang dilakukan dalam analisis ekspresi gen Gα dan GST
(1) Penentuan Konsentrasi Al untuk perlakuan cekaman
Penentuan konsentrasi Al untuk perlakuan cekaman Al dilakukan dengan
kultur kecambah di lartan hara. Langkah awal dari perlakuan cekaman Al adalah
menyeleksi biji kedelai kultivar Lumut yang memiliki ukuran yang sama. Benih
yang terpilih dikecambahkan selama dua hari. Benih dikecambahkan dalam kertas
merang, disimpan dalam ruang gelap dengan kelembaban yang tinggi. Setelah
berkecambah, kecambah dipindahkan ke dalam larutan hara dengan dosis 1/5 dari
yang digunakan Sopandie et al. (1996) dengan pH 6 selama 2 hari. Kecambah
ditanam di atas tray ukuran 20 cm x 30 cm yang telah dilubangi agar akar dapat
masuk. Tray tersebut diletakan di dalam bak plastik ukuran 25 cm x 35 cm x 15
cm yang telah berisi larutan hara pH 6 sebagai media tanamnya. Untuk menjaga
ketersediaan oksigen media cair diberi aerasi 4 lubang tiap bak. Posisi tray diatur
sedemikian rupa sehingga akar menyentuh media cair. Komposisi media tanam
adalah 0.375 mM Ca(NO3)2.4H2O, 0.2 M CuSO4.5H2O, 0.25 mM NH4NO3, 1
M ZnSO4.7H2O, 0.1 mM MgSO4.7H2O, 5 M H3BO3, 0.1 mM KH2PO4, 1 M
(NH4)6.Mo7O24.4H2O, 5 M MnSO4.H2O, 5 M Fe-EDTA.
Penentuan konsentrasi Al untuk perlakuan cekaman
Isolasi RNA Total
Sintesis cDNA Total
100
Tahapan pada hari berikutnya adalah pemberian perlakuan pH dan
cekaman. Perlakuan cekaman yang diberikan adalah pH 4, pH 4+1.2 mM Al dan
pH 4+1.6 mM Al. Perlakuan akan Al diberikan dalam bentuk AlCl3. Media pH 6
digunakan sebagai kontrol. Perlakuan dilakukan selama 3 x 24 jam, dengan media
diganti setiap 24 jam. Pengamatan panjang akar utama dilakukan pada jam ke-0,
jam ke-8, jam ke-24, jam ke-48 dan jam ke-72. Pengamatan dilakukan terhadap
10 sampel tanaman yang diambil secara acak, dengan mengukur panjang akar dari
pangkal batang sampai dengan ujung akar. Percobaan dilakukan dengan dua
ulangan. Pada saat pengamatan, ujung akar utama sekitar 0.3 cm diambil,
dibungkus dengan aluminium foil lalu difiksasi di dalam nitrogen cair dan
disimpan di freezer suhu - 40 ˚C.
Pemilihan konsentrasi Al dan lama cekaman yang optimum untuk
menghambat pertumbuhan akar ditentukan berdasarkan persentase perpanjangan
akar (delta) pada setiap jam perlakuan. Konsentrasi Al dan pH serta lama
cekaman yang menghambat pertumbuhan akar digunakan untuk analisis ekspresi
gen Gα dan gen GST. Reduksi atau stimulasi perpanjangan akar dihitung
berdasarkan nilai perbandingan pertambahan panjang akar dari perlakuan terhadap
pertambahan panjang akar dari kontrol dan merupakan nilai rataan dari dua
ulangan yang masing-masing terdiri dari 10 tanaman. Kontrol untuk percobaan
perlakuan cekaman Al dan pH adalah tanaman yang ditumbuhkan pada pH 4
sehingga reduksi perpanjangan akar dihitung dengan rumus:
atau
Dimana;
RPA :Reduksi panjang akar
Yti :Panjang akar dari tanaman kontrol pH 4 pada waktu ti
Yto :Panjang akar dari tanaman kontrol pH 4 pada waktu to
Xti :Panjang akar dari tanaman yang diperlakukan pada pH 6, pH 4+1.2 mM
Xto :Panjang akar dari tanaman yang diperlakukan pada pH 6, pH 4+1.2 mM
Al, pH 4+1.6 mM Al pada waktu to
PPAy :Pertambahan perpanjangan akar tanaman kontrol pH 4
PPAx :Pertambahan perpanjangan akar tanaman perlakuan x
Nilai RPA positif menunjukkan bahwa perlakuan menyebabkan reduksi
pertambahan panjang akar bila dibandingkan dengan kontrol, yaitu tanaman yang
ditumbuhkan pada pH 4. Nilai RPA negatif menunjukkan bahwa perlakuan
menyebabkan stimulasi pertambahan panjang akar dibandingkan dengan kontrol.
(2) Isolasi RNA dengan Metode Trizol
Sebanyak 50-100 mg ujung akar kedelai yang telah tersimpan dalam
aluminum foil di dalam freezer, diberi nitrogen cair langsung digerus dengan
menggunakan mortar sampai halus berbentuk bubuk. Bubuk dicampur dengan 800
l Trizol (Invitrogen). Suspensi sel dipindahkan ke dalam ependorf, dan
diinkubasikan pada suhu ruang selama kurang lebih 5 menit. Ke dalam ependorf
tersebut, kloroform (200 l) dimasukkan dan suspensi sel divortex sampai
tercampur. Campuran diinkubasikan pada suhu ruang selama 3 menit. Selanjutnya
ependorf tersebut disentrifugasi dengan kecepatan 9000 rpm (Jouan BR4i) dengan
suhu 6 ˚C selama 15 menit. Cairan bagian atas diambil sebanyak minimal 60%
dari volume Trizol. Supernatan tersebut dipindahkan ke dalam ependorf baru, dan
ditambah dengan isopropil alkohol lalu diinkubasikan dalam suhu ruang selama
10 menit. Setelah itu ependorf tersebut disentrifugasi dengan kecepatan 9000 rpm
selama 10 menit dengan suhu 6 ˚C. Supernatan dari hasil sentrifugasi dibuang,
dan endapannya diambil, kemudian ditambah dengan etanol 75%. Ependorf
kembali disentrifugasi dengan kecepatan 5700 rpm selama 5 menit dengan suhu 6
˚C. Etanol 75% dibuang, endapan dikeringkan dengan menggunakan vakum.
Setelah kering endapan disuspensikan dalam 30 l H2O-DEPC 0.1%.
Kuantitas RNA total dianalisis dengan menggunakan spektrofotometer,
absorbansi diukur pada panjang gelombang 260 ( 260), dan 280 ( 280). Keutuhan
RNA total dianalisis secara kualitatif menggunakan metode elektroforesis, dengan
3-Morpholinopropanesulfonic acid (C7H15NO4), 0,41 g/l Na-asetat, 0.37 g/l
Na2EDTA.H2O).
(3) Analisis ekspresi gen Gα dan gen GST
Analisis ekspresi gen dilakukan dengan menggunakan RT-PCR (Reverse
Transcript PCR). Karena mRNA mudah terdegradasi, maka mRNA diubah
menjadi cDNA. Keberhasilan sintesis cDNA dan kemurniannya dianalisis dengan
primer spesifik β-aktin.
Sintesis cDNA Total
Sintesis cDNA total melalui transkripsi balik (RT) dilakukan dengan
metode Suharsono et al. (2002). Sebanyak 500 ng RNA total dicampur dengan 4
l buffer (5x), 2 l 2 mM dNTP mix, 2 l 0.1 M dTT, 2 l primer oligo(dT), 0.2
l 0.1 U enzim reverse transcriptase (RT), dan H2O-DEPC hingga volume akhir
reaksi 20 l. Kondisi RT adalah 10 menit suhu 30 ˚C, 50 menit suhu 42 ˚C, 5
menit suhu 95 ˚C.
Evaluasi keberhasilan sintesis cDNA total dilakukan melalui PCR dengan
menggunakan primer β-aktin. PCR β-aktin dilakukan dengan mencampur 2 l cDNA total, 2 l buffer (10x), 1 l 2 mM dNTPmix, 0.8 l 25 mM MgCl, 0.1 l
0.1 U enzim taq polimerase, 2 l 10 pmol primer forward (F), 2 l 10 pmol
primer reverse (R), digenapkan dengan ddH2O hingga 20 l. Kondisi PCR adalah
pra-PCR 95 ˚C 5 menit, denaturasi 94 ˚C 30 detik, annealing 56 ˚C 30 detik,
ekstensi 72 ˚C 2 menit, siklus diulangi 30 kali, dan pasca-PCR 72 ˚C 5 menit.
Apabila cDNA yang disintesis adalah murni yang tidak terkontaminasi DNA
genom, maka PCR menghasilkan amplifikasi berukuran 450 pb. Apabila
terkontaminsi DNA genom, maka produk hasil PCR berukuran 540 pb karena
cetakan DNA genom yang diamplifikasi meliputi daerah ekson 1, intron dan
ekson 2. Selain untuk melihat keberhasilan sintesis cDNA dan kemurnian cDNA
dari kontaminan DNA genom, PCR β-aktin juga digunakan untuk menyetarakan konsentrasi cDNA pada berbagai perlakuan. Untuk mengetahui ukuran PCR β -aktin, dilakukan elektroforesis pada gel agarosa di dalam bufer elektroda TAE 1x
IApt IXpt
EBXpt =
Analisis ekspresi gen Gα dan gen GST
Analisis ekspresi gen Gα dan gen GST (GST8 dan GST12) dilakukan
dengan cara mengamplifikasi gen spesifik tersebut dengan menggunakan cDNA
sebagai cetakannya. Langkah dalam mencampur bahan untuk PCR gen Gα dan
gen GST sama dengan langkah PCR aktin kecuali primer yang disesuaikan dengan
gen yang dianalisis. Kondisi PCR gen Gα adalah pra-PCR 95 ˚C 5 menit,
denaturasi 94 ˚C 30 detik, penempelan primer 56 ˚C 30 detik, ekstensi 72 ˚C 2
menit, siklus diulang sebanyak 30 kali, dan pasca-PCR 72 ˚C 5 menit. Kondisi
PCR gen GST (GST8 dan GST12) sama dengan gen Gα, hanya suhu penempelan
primernya dilakukan pada suhu 52 ˚C 30 detik. Analisis ekspresi dilakukan
dengan membandingkan intensitas cahaya pita hasil PCR gen Gα dan GST
terhadap kontrol β-aktin dengan menggunakan perangkat lunak Digi Doc-it. Agar dapat diperbandingkan ekspresi antar gen sasaran pada waktu yang
sama pada berbagai perlakuan, maka ekspresi gen sasaran harus dibakukan.
Pembakuan ekspresi gen sasaran dilakukan dengan membandingkan ekspresi gen
sasaran dengan gen aktin pada waktu dan perlakuan yang sama. Ekspresi gen
yang dibakukan merupakan nilai rataan dari dua ulangan. Oleh sebab itu ekspresi
gen sasaran Gα, gen GST 8 atau gen GST12 dibakukan dengan menggunakan
rumus :
Dimana;
EBXpt: Ekspresi baku gen x pada perlakuan p waktu t
IXpt : Intensitas hasil PCR gen x pada perlakuan p waktu t
IApt : Intensitas hasil PCR β-aktin pada perlakuan p waktu t X : Gα, GST8 atau GST12
A : Aktin
HASIL DAN PEMBAHASAN
Penentuan Konsentrasi Cekaman Aluminium
Akar kedelai kultivar Lumut yang ditumbuhkan pada pH 6
memperlihatkan pertambahan panjang akar yang lebih besar yaitu sekitar
83%-95% dibandingkan pada kontrol pH 4 (Tabel 2). Rendahnya pertambahan panjang
akar pada pH 4 dibandingkan pH 6 menunjukkan bahwa pertumbuhan akar
dihambat oleh pH 4. Menurut Ismail dan Effendi (1993) pH yang paling baik
untuk pertumbuhan kedelai adalah pH 6.8, namun pada pH 5.5-6.0 sudah
dianggap cukup baik.
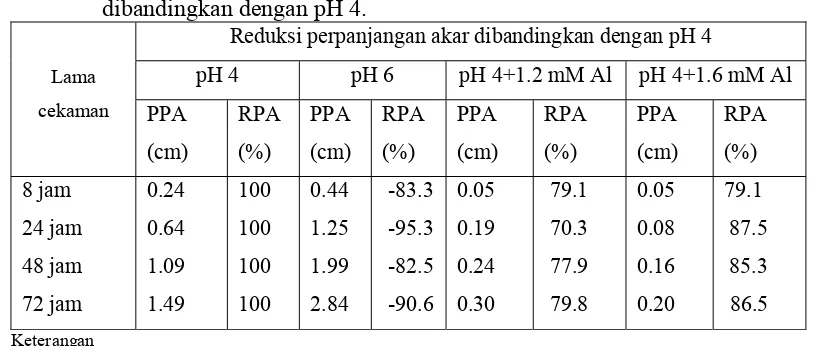
Tabel 2. Reduksi perpanjangan akar pH 6, pH 4+1.2 mM Al, pH 4+1.6 mM Al dibandingkan dengan pH 4.
Reduksi perpanjangan akar dibandingkan dengan pH 4
pH 4 pH 6 pH 4+1.2 mM Al pH 4+1.6 mM Al RPA : Reduksi panjang akar
Perlakuan pH 4+1.2 mM Al dan pH 4+1.6 mM Al, mengakibatkan reduksi
perpanjangan akar (RPA) kedelai sekitar 70%-88% (Tabel 2) dibandingkan
dengan kontrol pH 4. Hal tersebut dikarenakan cekaman Al pada tanaman
mengakibatkan pertumbuhan akar terhambat, akar menjadi pendek dan menebal
khususnya pada akar utama (Ryan et al. 1993). Persentase reduksi ini lebih besar
dibanding dengan Anwar (1999) yaitu hanya sekitar 60%.
Pada kedelai sensitif, cekaman Al menyebabkan penghambatan panjang
akar yang signifikan (Lazof et al. 1994).Menurut Anwar (1999) kedelai kultivar
Lumut termasuk kedelai peka karena telah terjadi RPA sebesar 50% pada
dibandingkan dengan cekaman 1.2 mM Al (Tabel 2). Setelah 8 jam perlakuan,
cekaman Al baik pada konsentrasi 1.2 mM Almaupun 1.6 mM Almenyebabkan
reduksi panjang akar sebesar 79% (Tabel 2). Setelah jam ke-24, ke-48, dan ke-72,
perlakuan 1.6 mM Al menyebabkan reduksi panjang akar sekitar 79%-88%, lebih
tinggi dari pada perlakuan cekaman 1.2 mM Alyaitu sekitar 70%-80% (Tabel 2).
Hasil penelitian Anwar (1999) menunjukkan bahwa kedua konsentrasi cekaman
tersebut tidak begitu berbeda, hanya berbeda 1%. Pada kedelai yang toleran yaitu
kultivar Slamet, RPA sekitar 76%-78% terjadi pada tanaman yang mendapat
cekaman 1.2 mM Al dan sekitar 79%-89% pada tanaman yang mendapat cekaman
1.6 mM Al (Tabel 3).
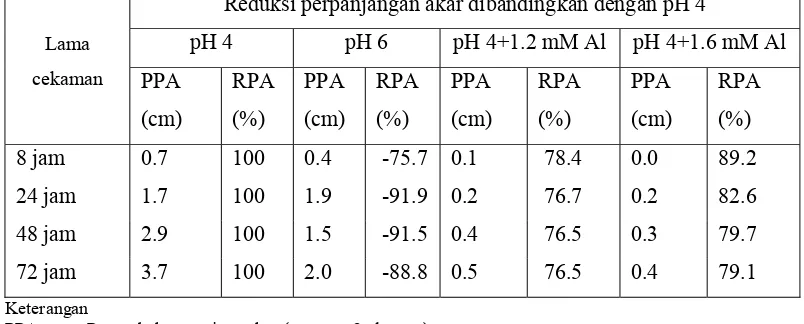
Tabel 3. Reduksi perpanjangan akar pada kultivar Slamet (Mashuda 2007)
Reduksi perpanjangan akar dibandingkan dengan pH 4
pH 4 pH 6 pH 4+1.2 mM Al pH 4+1.6 mM Al RPA : Reduksi panjang akar
Nilai RPA pada perlakuan dan waktu perlakuan yang sama yang dimiliki
kultivar Lumut (Tabel 2) tidak jauh berbeda dengan kultivar Slamet (Tabel 3). Ini
menunjukkan bahwa respon fisik kultivar peka (Lumut) dan yang toleran (Slamet)
terhadap cekaman Al yaitu berupa penghambatan pertumbuhan akar tidak jauh
berbeda. Hal ini diduga diakibatkan pemberian cekaman aluminium yang terlalu
tinggi
Agar pengaruh cekaman memberikan hasil yang nyata, maka respon
tanaman yang mengalami cekaman harus menampakkan perbedaan yang cukup
jelas. Berdasarkan hasil yang didapat, dari cekaman 1.6 mM Al menghasilkan
1.2 mM Al, sehingga analisis ekspresi gen pada tahap berikutnya hanya
menggunakan cekaman Al pada konsentrasi 1.6 mM Al.
Isolasi RNA Total
RNA total telah berhasil diisolasi dari akar pada perlakuan pH 6, pH 4
dan pH 4+1.6 mM Al dengan lama perlakuan 0 jam, 8 jam, 24 jam, 48 jam dan 72
jam. RNA total diisolasi dengan menggunakan kit Trizol, kemudian hasil isolasi
RNA total tersebut dianalisis keutuhan dan konsentrasinya. Keutuhan RNA total
dianalisis dengan metode elektroforesis. Konsentrasi RNA total dianalisis dengan
spektrofotometer. Analisis keutuhan RNA menunjukkan bahwa mRNA, rRNA
dan tRNA hasil isolasi adalah baik dan tidak terdegredasi yang ditunjukkan oleh
adanya dua pita rRNA yang berukuran 28s dan 18s (Gambar 2).
pH 6 pH 4 pH 4 + 1.6 mM Al
0J 8J 24J 48J 72J 8J 24J 48J 72J 8J 24J 48J 72J
Gambar 2. RNA total akar kedelai kultivar Lumut pada perlakuan pH 6, pH 4 dan pH 4+1.6 mM Al.
Sintesis cDNA Total
cDNA total telah berhasil disintesis berdasarkan RNA total sebagai
cetakannya. Hanya mRNA dari RNA total yang disintesis menjadi cDNA karena
oligo(dT) yang digunakan sebagai primer dalam sintesis cDNA hanya menempel
pada ekor poliA yang dimiliki oleh mRNA.
Untuk mengetahui keberhasilan sintesis cDNA dan juga kualitas RNA
maka dilakukan pengecekan melalui PCR menggunakan cDNA total sebagai
cetakannya dan primer untuk β-aktin. PCR dengan primer β-aktin dan cetakan cDNA total menghasilkan pita amplifikasi DNA berukuran 450 pb (Gambar 3).
Ini menunjukkan bahwa cDNA yang digunakan sebagai cetakan adalah murni
yang tidak terkontaminasi DNA genom atau RNA total yang telah diisolasi tidak
terkontaminasi dengan DNA. Bagian RNA total yang dijadikan sintesis cDNA
adalah mRNA, dimana mRNA merupakan hasil transkripsi dari DNA yang telah
mengalami pemrosesan sehingga hanya mengandung ekson tanpa intron. DNA
genom masih mengandung intron dan ekson. Primer reverse dan forward β-aktin terletak di daerah ekson 1 dan ekson 2 yang mengapit intron. PCR aktin dengan
cetakan cDNA murni hanya akan mengamplifikasi daerah ekson 1 dan ekson 2
tanpa intron sehingga pitanya berukuran 450 pb.
pH 6 pH 4 pH 4+1.6 mM Al
0J 8J 24J 48J 72J 8J 24J 48 J 72J 8J 24J 48J 72J
Gambar 3. Hasil PCR β-Aktin yang berasal dari cetakan cDNA murni.
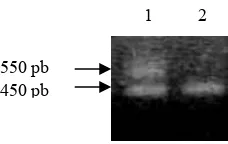
Hasil PCR β-aktin yang cetakan cDNA-nya berasal dari RNA total yang terkontaminasi DNA akan terlihat adanya dua pita yang berukuran 450 pb dan 550
pb (Gambar 4). Ukuran 550 pb ini disebabkan oleh adanya intron pada DNA yang
berukuran 90 pb yang terapit ekson 1 dan ekson 2 yang ikut teramplifikasi. Untuk
melakukan analisis ekspresi gen Gα dan GST hanya menggunakan cDNA murni
tanpa kontaminasi DNA (Gambar 3).
Gambar 4. Hasil PCR β-aktin yang cDNAnya terkontaminasi DNA genom (1), dan cDNA murni (2).
Analisis Ekspresi Gen Gα
Ekspresi gen Gα pada perlakuan pH 4 lebih rendah dibandingkan pH 6
pada jam ke-8, dan ekspresi perlakuan pH 4+1.6 mM Al lebih rendah
dibandingkan pH 4 pada jam yang sama (Tabel 4). Hal ini menunjukkan bahwa
pada awal perlakuan baik cekaman pH rendah maupun cekaman Al tidak
menginduksi ekspresi gen Gα. Pada pH 4 jam ke-24 ekspresi gen Gα sedikit lebih
tinggi dibandingkan pH 6 tetapi kemudian pada jam ke-48, ekspresi gen Gα
menurun, dan nilai ekspresi baku Gα tetap pada jam ke-72 (Tabel 4). Nilai
450 pb
450 pb 550 pb
ekspresi baku gen Gα (Tabel 4) dan pita hasil PCR (Gambar 5) tidak
menunjukkan banyak perbedaan antara pH 6 dan pH 4, yang menunjukkan bahwa
perlakuan cekaman pH rendah (pH 4) tidak menginduksi ekspresi gen Gα.
Pada jam ke-24, ekspresi gen Gα dari tanaman yang mendapatkan
cekaman pH 4+1.6 mM Al lebih tinggi daripada cekaman pH 4. Kemudian pada
jam ke-48 perlakuan cekaman pH 4+1.6 mM Al menunjukkan ekspresi Gα yang
lebih rendah dibandingkan pH 4 dan pada jam ke-72 perlakuan pH 4+1.6 mM Al
menyebabkan ekspresi Gα meningkat kembali dan lebih tinggi daripada perlakuan
pH 4 (Tabel 4). Hal tersebut menunjukkan bahwa ekspresi gen Gα pada kedelai
Lumut yang mendapat perlakuan pH 4+1.6 mM Al tidak memiliki pola yang jelas.
Nilai ekspresi baku gen Gα (Tabel 4) dan pita hasil PCR (Gambar 5) tidak
menunjukkan banyak perbedaan antara pH 4 dan pH 4+1.6 mM Al yang
menunjukkan bahwa cekaman Al tidak menginduksi gen Gα.
Tabel 4. Ekspresi baku gen Gα pada pH 4 dan pH 4+1.6 mM Al
Iapt : Intensitas aktin pada perlakuan ke-p dan waktu ke-t (rata-rata 2 ulangan) Ixpt : Intensitas Gα pada perlakuan ke-p dan waktu ke-t (rata-rata 2 ulangan) EBX : Ekspresi Baku gen Gα
%EBX : Ekspresi baku gen Gα dibandingkan dengan kontrol pH 6
Intensitas pita pH 6, pH 4 maupun pH 4+1.6 mM Al yang dihasilkan tidak
begitu berbeda (Gambar 5). Ini menunjukkan bahwa ekspresi gen Gα pada pH 6
tidak jauh berbeda dengan ekspresi perlakuan pH 4 maupun pH 4+1.6 mM Al.
Gen Gα tidak terinduksi baik oleh cekaman pH rendah yaitu pH 4 maupun
cekaman Al yaitu pH 4+1.6 mM Al. Diduga gen Gα pada kultivar Lumut adalah
gen konstitutif atau bersifat housekeeping gene.
Housekeeping gene diekspresikan secara terus menerus, sehingga produk
tergantung dari lingkungan dan terdapat di semua sel meski terekpresikan pada
level rendah. Mengacu pada sifat housekeeping gene, gen Gα diduga tidak
berhubungan dengan sistem toleransi terhadap cekaman Al pada kultivar Lumut
yang peka terhadap cekaman Al.
pH 6 pH 4 pH 4 + 1.6 mM Al
0J 8J 24J 48 J 72 J 8J 24J 48J 72J 8J 24J 48J 72J
Gambar 5. Ekspresi gen Gα dan β-aktin pada pH 6, pH 4, dan pH 4+1.6 mM Al.
Pada kultivar Slamet perlakuan pH 4 dan pH 4+1.6 mM Al
memperlihatkan ekspresi tertinggi pada jam ke-8, kemudian setelah jam ke-8
ekspresinya cenderung menurun (Tabel 5). Gen Gα pada kultivar Slamet
terinduksi oleh cekaman pH rendah dan cekaman Al (Mashuda 2007). Gen Gα
pada kultivar Slamet merupakan regulated gene atau gen teregulasi/terkendali
dimana ekpresi gen tergantung pada keadaan lingkungan. Meningkatnya ekspresi
gen Gα diduga berkaitan dengan metabolisme sistem pertahanan tanaman
terhadap cekaman aluminium pada kultivar Slamet yang toleran cekaman Al.
Tabel 5. Ekspresi baku gen Gα dan β-aktin pada kultivar Slamet (Mashuda 2007)
Ekspresi gen Gα
Iapt : Intensitas aktin pada perlakuan ke-p dan waktu ke-t (rata-rata 2 ulangan) Ixpt : Intensitas Gα pada perlakuan ke-p dan waktu ke-t (rata-rata 2 ulangan) EBX : Ekspresi Baku gen Gα
%EBX : Ekspresi baku gen Gα dibandingkan dengan kontrol pH 6
Kemungkinan ekspresi gen Gα dapat terinduksi Al dengan cekaman yang
lebih singkat, misalnya 4 jam perlakuan atau pada konsentrasi Al yang lebih
Gα
β-Aktin GST8
rendah. Tistama (2003) mendapatkan hasil bahwa ekspresi tertinggi gen gmali50
terjadi pada dosis Al yang lebih rendah yaitu 0.2 mM Al pada kultivar peka
(Lumut) daripada kultivar toleran (Slamet) yang terjadi pada dosis 0.4 mM Al.
Analisis Ekspresi gen GST8
Pada kultivar Lumut tidak ada satupun pita hasil PCR gen GST8 yang
terdeteksi. Ini berarti bahwa ekspresi gen GST8 baik itu pada pH 6, pH 4 maupun
pH 4+1.6 mM Al tidak ada atau diduga tidak terdeteksi karena kuantitasnya yang
sangat rendah. Hal ini diduga disebabkan tidak adanya aktivitas gen GST8 di
bagian akar (Gambar 6). Menurut McGonigle et al. (2000) GST8 pada kedelai
banyak berperan dalam menghadapi degradasi akibat cekaman xenobiotik.
Kemungkinan tidak adanya ekspresi gen GST8 berkaitan dengan tidak atau
kurangnya sistem pertahanan yang dimiliki kultivar Lumut yang peka terhadap
cekaman Al.
(A) (B)
Gambar 6. (A) Pada pH 6 jam ke-0, tidak ada ekspresi gen GST8 pada kultivar Lumut (peka) dan ada ekspresi pada kultivar Slamet (toleran), (B) Tidak ada ekspresi gen GST8 pada kultivar Lumut pada pH 6 (1) dan pH 4+1.6 mM Al (2)
Pada kultivar Slamet gen GST8 terekspresi di awal setelah pemberian
cekaman Al yaitu pada jam ke-8 dan jam ke-24. Gen GST8 tidak terekspresi pada
jam ke-48 dan jam ke-72 setelah perlakuan cekaman Al (Tabel 6). Hal ini
menunjukkan bahwa lamanya perlakuan cekaman Al pada kultivar Slamet tidak
menyebabkan meningkatnya ekspresi tetapi menurunkan ekspresi GST8. Pada
kedelai kultivar Slamet yang toleran terhadap Al ekspresi gen GST8 tidak
terinduksi oleh cekaman pH 4.
Lumut Lumut
Slamet
GST8 710 pb
β-aktin 450 pb
Tabel 6. Ekspresi baku gen GST8 pada kultivar Slamet (Mashuda 2007)
Iapt : Intensitas aktin pada perlakuan ke-p dan waktu ke-t (rata-rata 2 ulangan) Ixpt : Intensitas Gα pada perlakuan ke-p dan waktu ke-t (rata-rata 2 ulangan) EBX : Ekspresi Baku gen Gα
%EBX : Ekspresi baku gen Gα dibandingkan dengan kontrol pH 6
Adanya peningkatan ekspresi gen GST8 pada kultivar Slamet yang
meningkat pada awal cekaman Al diduga berkaitan dengan metabolisme sistem
pertahanan tanaman terhadap cekaman aluminium pada kultivar Slamet yang
cepat dalam menanggapi cekaman Al (Mashuda 2007).
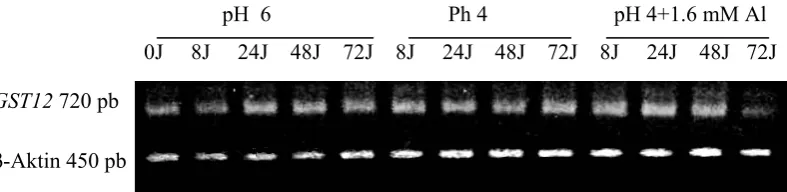
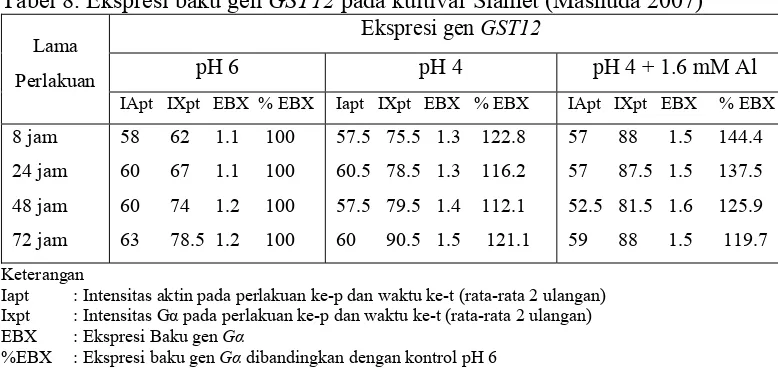
Analisis Ekspresi gen GST12
Ekspresi gen GST12 pada kedelai kultivar Lumut yang mendapat cekaman
pH 4 selama 8 jam, 48 dan 72 jam lebih rendah daripada pada tanaman yang
ditumbuhkan pada pH 6 pada saat yang sama (Tabel 7). Sedangkan perlakuan
selama 24 jam pada pH 4 memperlihatkan nilai ekspresi baku yang sama dengan
pH 6. Ini menunjukkan bahwa cekaman pH rendah tidak menginduksi ekspresi
gen GST12.
Ekspresi gen GST12 pada pH 4+1.6 mM Al selama 8 jam dan 24 jam
perlakuan sedikit lebih tinggi daripada pada perlakuan pH 4 pada jam yang sama,
sedangkan perlakuan selama 48 jam perlakuan pH 4+1.6 mM Al menyebabkan
ekspresi gen GST12 yang sama dengan perlakuan pH 4. Perlakuan cekaman
selama 72 jam menunjukkan bahwa perlakuan pH 4+1.6 mM Al menyebabkan
ekspresi gen GST12 yang lebih rendah dibandingkan perlakuan pH 4 (Tabel 7).
Pola ekspresi yang tidak teratur pada pH 4+1.6 mM Al (Tabel 7) berdasarkan nilai
ekspresi baku gen GST12 dan dicerminkan oleh intensitas pendaran pita hasil
PCR pada perlakuan pH 4 (Gambar 7) menunjukkan bahwa cekaman Al pada
konsentrasi 1.6 mM Al tidak menginduksi ekspresi gen GST12.
pH 6 Ph 4 pH 4+1.6 mM Al
0J 8J 24J 48J 72J 8J 24J 48J 72J 8J 24J 48J 72J
Gambar 7. Ekspresi gen GST12 dan β-aktin pada pH 6, pH 4 dan ph 4+1.6 mM Al
Ekspresi gen GST12 tidak dipengaruhi atau tidak terinduksi baik itu oleh
cekaman pH rendah maupun cekaman 1.6 mM Al pada kultivar Lumut yang
merupakan kultivar peka terhadap cekaman Al. Tidak terinduksinya ekspresi gen
ini pada kultivar Lumut yang peka terhadap Al kemungkinan disebabkan oleh
tingginya konsentrasi Al dan terlalu lamanya perlakuan cekaman. Hasil analisis
ekspresi gen gmali50 yang dilakukan oleh Tistama (2003) menunjukkan bahwa
ekspresi gen tersebut terinduksi pada perlakuan 0.4 mM Al pada kultivar yang
toleran dan 0.2 mM Al pada kultivar yang peka.
Tabel 7. Ekspresi baku gen GST12 pada perlakuan pH 4 dan pH 4+1.6 mM Al dibandingkan pH 6
Iapt : Intensitas aktin pada perlakuan ke-p dan waktu ke-t (rata-rata 2 ulangan) Ixpt : Intensitas Gα pada perlakuan ke-p dan waktu ke-t (rata-rata 2 ulangan) EBX : Ekspresi Baku gen Gα
%EBX : Ekspresi baku gen Gα dibandingkan dengan kontrol pH 6
Pada kultivar Slamet, yang mendapat perlakuan pH 4 dan pH 4+1.6 mM
Al ekspresi tertinggi gen GST12 yang terjadi pada 8 jam perlakuan, kemudian
setelah jam ke-8 cenderung menurun, sehingga ekspresi gen GST12 kultivar
Slamet diinduksi oleh cekaman pH rendah (pH 4) dan cekaman 1.6 mM Al pada
perlakuan selama 8 jam (Tabel 8). Menurut Mashuda (2007) ekspresi gen GST12
pada cekaman pH 4 dan pH 4+1.6 mM Al diduga dikendalikan oleh promoter
yang diinduksi oleh cekaman pH rendah dan aluminium. Oleh sebab itu gen
GST12 terlibat dalam sistem toleransi cekaman aluminium pada kultivar Slamet
yang toleran cekaman Al.
Tabel 8. Ekspresi baku gen GST12 pada kultivar Slamet (Mashuda 2007)
Ekspresi gen GST12
Iapt : Intensitas aktin pada perlakuan ke-p dan waktu ke-t (rata-rata 2 ulangan) Ixpt : Intensitas Gα pada perlakuan ke-p dan waktu ke-t (rata-rata 2 ulangan) EBX : Ekspresi Baku gen Gα
%EBX : Ekspresi baku gen Gα dibandingkan dengan kontrol pH 6
Pada penelitian ini ekspresi gen Gα dan GST12 pada kultivar Lumut yang
peka terhadap Al tidak terinduksi oleh cekaman pH rendah (pH 4) dan cekaman
aluminium pada konsentrasi 1.6 mM Al. Kedua gen tersebut diduga tidak terlibat
dalam sistem toleransi terhadap cekaman aluminium pada konsentrasi yang tinggi
SIMPULAN
Cekaman 1.6 mM Al menyebabkan reduksi perpanjangan akar yang lebih
besar dibandingkan dengan cekaman 1.2 mM Al setelah 24 jam perlakuan atau
lebih.
Cekaman pH 4 dan pH 4+1.6 mM Al tidak menginduksi ekspresi gen Gα
DAFTAR PUSTAKA
Aharon GS, Gelli A, Snedden WA, Blumwald E. 1998. Activation of a plant plasma membrane Ca2+ channel by Tgα1, a heterotrimeric G protein α subunit homologue. FEBS Lett 424: 17-21.
Anwar S. 1999. Pengklonan Gen-Gen yang Diinduksi oleh Aluminium pada Kedelai (Glycine max (L) Merr). [Disertasi]. Bogor: Sekolah Pascasarjana Institut Pertanian Bogor.
Anwar S, Jusuf M, Suharsono. 2000. Pengklonan gen-gen yang diinduksi oleh aluminium pada kedelai (Glycine max (L) Merr). J Biotek Pert Indon.
Atman R. 2006. Pengembangan kedelai di lahan masam. http://sumbar.litbang.deptan.go.id/sing270706_atr.pdf. [27 Juli 2006].
Beffa R et al. 1995. Cholera toxin elevates pathogen resistance and induces pathogenesis-related gene expression in tobacco. EMBO J 23: 5753-5762.
Becker WM, Kleinsmith LJ, Hardin J. 2000. The World of The Cell. 4th Ed. The Benjamin/Cummings Publishing Company, Madison.
Blume B, Nurnberger T, Nass N, Scheel D. 2000. Receptor-mediated increase in cytoplasmic free alcium required for ativaton of pathogen defense in parsley. Plant Cell 12: 1425-1440.
Cruz-Ortega R, Cushman JC, Ownby JD. 1997. cDNA clones encoding 1,3-β -glucanase and a fimbrin-like cytoskeletal protein are induced by Al toxicity in wheat roots. Plant Physiol 114: 1453-1460.
CSAR (Centre for Soil and Agroclimate Research). 1997. Statistik Sumberdaya Lahan Tanah Indonesia & Agroklimat. Badan Litbang Departemen Pertanian. Jakarta.
Darlian L. 2005. Analisis urutan nukleotida dari gen penyandi protein G subunit α dari kedelai (Glycine max (L). Merr) kultivar Lumut dan Slamet [Tesis]. Bogor: Sekolah Pascasarjana Institut Pertanian Bogor.
Dean JD, Goodwin PH, Hsiang T. 2005. Induction of glutathione s-transferase genes of Nicotiana benthamiana following infection by Colletotrichum destructivum and C.orbiculare and involvement of one in resistance. Exp BotanyJ 56: 1525-1533.
Dixon DP, Lapthorn A, Edwards R. 2002. Protein family review. Plant glutathione s-transferases. Genome Biol 3 (3): 3004.1-10.
Droog F. 1997. Plant glutathione s-transferases, a tale of theta and tau. J Plant Growth Regul 16: 95-107.
Ezaki B, Yamamoto Y, Matsumoto H. 1995. Cloning and sequencing of the cDNAs induced by aluminum treatment and Pi starvation in tobacco cultured cells. Plant Physiol 93: 11-118.
Ezaki B, Koyanagi M, Gardner RC, Matsumoto H. 1997. Nucleotide sequence of a cDNA for GDP dissociation inhibitor (GDI) which is induced by aluminum (Al) ion stress in tobacco cell culture (accession no.AF012823) (PGR 97-133). Plant Physiol 115: 314.
Ezaki B et al. 2004. Mechanism of gene expression of Arabidopis glutathione s-transferase, AtGST1 and AtGST11 in response to aluminum stress. Plant Physiol 134: 1672-1682.
Fairley-Grenot K, Assman SM. 1991. Evidence for G protein regulation of inward potassium ion channel current in guard cells of fava bean. Plant Cell 3: 1037-1044.
Fujisawa Y, Kato H, Iwasaki Y. 2001.Structure and function of heterotrimeric G protein in plants. Minireview. Plant Cell Physiol 42(8): 789-794.
Fujisawa F. 1999. Suppression of the heterotrimeric G protein causes abnormal morphology including dwarfism, in rice. Proc Natl Acad Sci 96: 7575-7580.
Galle A et al. 2005. Changes of glutathione S-transferase activities and gene expression in Triticum aestivum during polyethylene-glycol induced osmotic stress. Acta Biologica Szegedensis 49: 95-96.
Gotor C, Lam E, Cejudo FJ, Romero LC. 1996. Isolation and analysis of the soybean SGA2 gene (cDNA), encoding a new member of the plant G-protein family of signal transducer. Plant Mol Biol 32: 1227-1234.
Ismail I G, Effendi S. 1993. Pertanaman Kedelai pada Lahan Kering. Kedelai. Di dalam: Somaatmaja S, Ismunadji M, Sumarno, syam M, Manurung SO, Yuswadi, editor. Kedelai. Bogor: Balai Penelitian dan Pengembangan Pertanian. Pusat Penelitian dan Pengembangan Tanaman Pangan. hlm 103-119.
Jones DL, Kochian LV. 1995. Aluminum inhibition of the inositol 1,4,5-triphosphate signal transduction pathway in wheat roots: a role in aluminum toxicity? Plant Cell 7: 1913-1922.
Kim WY et al. 1995. Cloning and sequencing analysis of a full-length cDNA encoding a protein G α-subunit, SGA1, from soybean. Plant Physiol 108: 1315-1316.
Kochian LV. 1995. Cellular mechanism of aluminum toxicity and resistance in plants. Annu Rev Plant Mol Biol 46: 237-260.
Lazof B Dennis, Goldsmith JG, Rufty TW, Linton RW. 1994. Rapid uptake of aluminum into cells of intanct soyben root tips. Plant Physiol 106: 1107-1114.
Legendre L, Heinstein PF, Low PS. 1992. Evidence for participation of GTP-binding protein in elicitation of the rapid oxidative burst in cultured soybean cells. J Biol Chem 267: 20140-20147.
Legendre L et al. 1993. Phospholipase C activation during elicitation of the oxidative burst in cultured plant cells. J Biol Chem 258 (33): 24559-24563.
Li W, Assmann SM. 1993. Characterization of a G protein-regulated outward potassium current in mesophyl cell Vicia faba. Proc Natl Acad Sci 90: 262-266.
Ma H. 1994. GTP-binding protein Gs in plants: new members of an old family. Plant Mol Biol 26: 1611-1636.
Mahady GB, Liu C, Beecher CWW. 1998. Involvement of protein kinase C and G protein in the signal transduction of benzo phenanthridine alkaloid biosynthesis. Phytochem 48: 93-102.
Marss KA. 1996. The function and regulaton of plant Glutathione S-Transferase. Annu Rev Physiol Plant Mol Biol 47: 127-158.
Maschner, H. 1995. Mineral Nutrition of Higher Plants. 2nd Ed. Academic Press Harcourt Brace and Company, London.
Mashuda. 2007. Ekspresi Gen Gα dan GST pada Kedelai Kultivar Slamet yang Mendapat Cekaman Aluminium [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
McGonigle B, Keeler SJ, Lau S-MC, Koeppe MK, O’Keefe DP. 2000. A genomic approach to the comprehensive analysis of the glutathione s-transferase gene family in soybean and maize. Plant Physiol 124: 1105-1120.
Muzuni. 2003. Respons Spesifik Gen gmali14 dan gmali50 pada Kedelai (Glycine max (L). Merryl) terhadap Cekaman Aluminium [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Rea PA. 1999. MRP subfamily ABC transporters from plants and yeast. Exp Bot J 50: 895-913.
Richard KD, Snowden KC, Gardner RC. 1994. Wali 6 and Wali 7. Plant Physiol 107: 341-348.
Richards KD, Schott EJ, Sharma YK, Davis KR, Gardner RC. 1998. Aluminum induces oxidative cekaman genes in Arabidopsis thaliana. Plant Physiol 116: 409-418.
Roxas VP et al. 2000. Stress tolerance in transgenic tobacco seedling that overexpression glutathione s-transferase/glutathione peroxidase. Plant Cell Physiol 42 (11): 1229-1234.
Ryan PR, Ditomaso JM, Kochian LV. 1993. Aluminum toxicity in roots: an investigation of spatial sensitivity and the role of the root cap. Exp Bot J 44 (259): 437-446.
Sasaki M, Kasai M, Yamamoto Y, Matsumoto H. 1994. Comparation of the early response to aluminum stress between tolerant and sensitive wheat cultivars: Root growth, aluminum content and efflux of K+. J Plant Nutr 17 (7): 1275-1288.
Sopandie D, Jusuf M, Supijatno, Hamim.1996. Fisiologi dan Genetik Daya Adaptasi Kedelai terhadap Cekaman Kekeringan dan pH Rendah dengan Al Tinggi. Laporan Akhir RUT I. PAU Bioteknologi IPB Bogor.
Snowden KC, Richard KD, Gardner RC. 1995. Aluminum-induced genes. Induction by toxic metals, low cadnium, wounding and pattern exspression in root tips. Plant Physiol. 107: 341-348.
Suharsono U et al. 2002. The heterotrimeric G protein α subunit act upstream of the small GTPase Rac in disease resistance of rice. Proc Natl Acad Sci 99 (20): 13307-13312.
Suharsono U, Suharsono. 2004. Analisis gen penyandi heterotrimerik G subunit α yang terlibat di dalam sistem toleransi tanaan kedelai terhadap cekaman aluminium [Laporan Hibah Bersaing XI] Institut Pertanian Bogor.
Tistama R. 2003. Transkripsi gmali14 dan gmali50 pada Kedelai [Glycine max (L) Merryl] yang Mendapat Cekaman Beberapa Logam dan Garam. [Tesis]. Bogor: Sekolah Pascasarjana Institut Pertanian Bogor.
Ulmasov T, Ohyima A, Hagen G, Guilfoyle T. 1995. The soybean GH2/4 gene that encodes a Glutathione S-Transferase has a promotor that is activated by a wide range of chemical agents. Plant Physiol 108: 919-927.
Weiss CA, White E, Huang H, Ma H. 1997. The protein Gα subunit (Gpα1) is associated with the ER and the plasma membrane in meristematic cells of Arabidopsis and cauliflower. FEBS Lett 407: 361-367.
Yuniati R. 2000. Pengklonan cDNA Tanaman Kedelai (Glycine max (L.) Merryl) Varietas Slamet yang Diinduksi Cekaman Aluminium. [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Standar Deviasi
Lampiran 3. Pita ekspresi β-aktin, gen Gα, dan GST12 (dua ulangan)
Pita ekspresi aktin pada 2 ulangan
pH 6 pH 4 pH 4+1.6mM Al
Pita ekspresi GST12 pada 2 ulangan
aktin gst12 aktin gst12 aktin gst12 aktin gst12 perlakuan 8 jam 8 jam EBX 24 jam 24 jam EBX 48 jam 48 jam EBX 72 jam 72 jam EBX pH 6 44,000 60,000 1,364 47,000 62,000 1,319 47,000 76,000 1,617 48,000 75,000 1,563 pH 6 46,000 60,000 1,304 47,000 60,000 1,277 47,000 76,000 1,617 46,000 77,000 1,674 pH 4 48,000 63,000 1,313 48,000 62,000 1,292 48,000 80,000 1,667 50,000 82,000 1,640 pH 4 46,000 62,000 1,348 48,000 63,000 1,313 50,000 83,000 1,660 48,000 83,000 1,729 pH4+1.6mM Al 51,000 65,000 1,275 53,000 66,000 1,245 52,000 78,000 1,500 50,000 87,000 1,740 pH4+1.6mM Al 53,000 65,000 1,226 51,000 64,000 1,255 52,000 78,000 1,500 50,000 85,000 1,700
α α α α
PERLAKUAN N Mean StDev SE Mean PH4+1.6mM AL 8 jam 2 1,5009 0,0680 0,048 PH6 8 jam 2 1,6900 0,0566 0,040
Difference = mu (PH4+1.6mM AL 8 jam) - mu (PH6 8jam) Estimate for difference: -0,189075
95% CI for difference: (-0,983909; 0,605759)
T-Test of difference = 0 (vs not =): T-Value = -3,02 P-Value = 0,203 DF = 1 Estimate for difference: 0,101793
95% CI for difference: (-0,650261; 0,853848)
T-Test of difference = 0 (vs not =): T-Value = 1,72 P-Value = 0,335 DF = 1
Two-sample T for EBX gst12
PERLAKUAN N Mean StDev SE Mean PH4+1.6mM Al 8 jam 2 1,2505 0,0340 0,024 PH6 8 jam 2 1,3340 0,0419 0,030
Difference = mu (PH4+1.6mM Al 8 jam ) - mu (PH6 8 jam) Estimate for difference: -0,083530
95% CI for difference: (-0,568544; 0,401484)
T-Test of difference = 0 (vs not =): T-Value = -2,19 P-Value = 0,273 DF = 1
Two-sample T for EBX gst12
PERLAKUAN N Mean StDev SE Mean PH4+1.6mMAL 24 jam 2 1,25009 0,00680 0,0048 PH6 24 jam 2 1,2979 0,0301 0,021
Difference = mu (PH4+1.6mMAL 24 jam) - mu (PH6 24 jam) Estimate for difference: -0,047780
95% CI for difference: (-0,324945; 0,229386)
T-Test of difference = 0 (vs not =): T-Value = -2,19 P-Value = 0,273 DF = 1
Two-sample T for EBX gst12
PERLAKUAN N Mean StDev SE Mean PH4+1.6mM Al 72 jam 2 1,7200 0,0283 0,020 PH6 72 jam 2 1,6182 0,0788 0,056
Difference = mu (PH4+1.6mM Al 72 jam) - mu (PH6 72 jam) Estimate for difference: 0,101793
95% CI for difference: (-0,650261; 0,853848)
SITI MUTTI SAWITRI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
SITI MUTTI SAWITRI. Ekspresi Gen Gα dan GST Pada Kedelai Kultivar Lumut Yang Mendapat Cekaman Aluminium. Dibimbing oleh SUHARSONO dan UTUT WIDYASTUTI SUHARSONO.
Kedelai (Glycine max (L). Merr) adalah salah satu bahan pangan penting
bagi rakyat Indonesia. Kebutuhan kedelai dalam negeri rata-rata 2 juta ton/tahun,
sedangkan produksi kedelai dalam negeri hanya 0.8 juta ton/tahun sehingga
pemerintah harus mengimpor kedelai sebesar 1.2 juta ton setiap tahunnya (Atman
2006). Tingginya impor kedelai membuat pemerintah mencanangkan program
bangkit kedelai.Implementasi program bangkit kedelai, akan ditempuh melalui 2
subprogram yaitu dengan intensifikasi, dan pengembangan kedelai pada lahan
kering dan peningkatan Intensitas Pertanaman (IP) pada lahan seluas 500.000 ha
selama 5 tahun.
Indonesia mempunyai tanah podzolik merah kuning (PMK) seluas 47.5
juta ha (CSAR 1997). Lahan ini dapat dimanfaatkan untuk peningkatan produksi
kedelai nasional. Kendalanya adalah tanah podzolik merah kuning memiliki
derajat keasaman yang tinggi dengan kelarutan Al yang tinggi sehingga menjadi
faktor pembatas produksi tanaman karena Al merupakan racun bagi tanaman.
Pada tanah asam (pH < 5), Al menjadi oktahedral hexahidrat yang larut
(Al3+) yang merupakan bentuk paling toksik bagi tanaman dengan gejala
umumnya adalah pertumbuhan akar terhambat, akar menjadi pendek dan menebal
khususnya akar utama (Ryan et al. 1993; Sasaki et al. 1994). Bagian ujung akar
(tudung akar, meristem, zona perpanjangan akar) mengakumulasi Al lebih banyak
dan paling mengalami kerusakan dibandingkan jaringan akar lainnya (Delhaize &
Ryan 1995). Pada kedelai yang sensitif, cekaman Al menyebabkan penghambatan
panjang akar yang signifikan (Lazof et al. 1994).
Pengembangan budidaya tanaman kedelai pada lahan asam dapat
dilakukan dengan perbaikan kesuburan tanah melalui pengapuran, pemupukan
dan pemberian bahan organik. Teknik perbaikan lahan ini mahal sehingga
memberatkan petani. Alternatif terbaik untuk pengembangan kedelai di lahan
asam adalah dengan menggunakan varietas kedelai yang toleran.
Penelitian untuk mendapatkan kultivar kedelai yang toleran terhadap tanah
asam dan isolasi gen-gen yang ekspresinya diduga diinduksi oleh cekaman Al