LARUTAN SODIUM HIPOKLORIT 0,5% DAN
GLUTARALDEHID 2% TERHADAP
PERUBAHAN DIMENSI
SKRIPSI
Diajukan untuk memenuhi tugas dan melengkapi syarat memperoleh gelar Sarjana Kedokteran Gigi
Oleh:
TINESHRAJ SELVARAJ NIM : 110600207
FAKULTAS KEDOKTERAN GIGI
UNIVERSITAS SUMATERA UTARA
Tahun 2015
Tineshraj Selvaraj
Pengaruh Perendaman Cetakan Alginat Dalam Larutan Sodium Hipoklorit 0,5% dan Glutaraldehid 2% Terhadap Perubahan Dimensi.
xiii + 49 Halaman
larutan sodium hipoklorit 0,5% selama 5 dan 10 menit dan perendaman cetakan alginat dalam glutaraldehid 2% selama 5 dan 10 menit terhadap perubahan dimensi dengan nilai p = 0,0001 (p < 0,05). Hasil penelitian ini juga menunjukkan adanya perbedaan pengaruh yang signifikan pada perendaman cetakan alginat dalam glutaraldehid 2% selama 10 menit dengan nilai p = 0,0001 ( p < 0,05). Dari hasil penelitian ini dapat disimpulkan bahwa perendaman cetakan alginat dalam larutan sodium hipoklorit 0,5% dan glutaraldehid 2% mempengaruhi perubahan dimensi, perubahan dimensi yang minimal terdapat pada perendaman cetakan alginat dalam larutan sodium hipoklorit 0,5% selama 5 menit.
Skripsi ini telah disetujui untuk dipertahankan di hadapan tim penguji skripsi
Medan, 4 Juni 2015
Pembimbing Tanda tangan
Skripsi ini telah dipertahankan di hadapan tim penguji pada tanggal 4 Juni 2015
TIM PENGUJI
KETUA : Prof. Haslinda Z. Tamin, drg., M.Kes, Sp.Pros (K) ANGGOTA : 1. Eddy Dahar, drg., M.Kes
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini sebagai salah satu syarat untuk mendapatkan gelar Sarjana Kedokteran Gigi Universitas Sumatera Utara.
Rasa hormat dan ucapan terima kasih yang sebesar-besarnya penulis sampaikan kepada kedua orang tua tercinta, yaitu ayahanda Selvaraj dan ibunda Parameswari yang telah membesarkan, memberikan kasih sayang yang tidak terbalas, doa, nasehat, semangat, dan dukungan baik moril maupun materil kepada penulis. Penulis juga menyampaikan terima kasih kepada ketiga adik penulis Vimelesh, Kogulanraj dan Yamunaraj yang senantiasa memberikan semangat dan dukungan kepada penulis selama penulisan skripsi ini.
Dalam penulisan skripsi ini, penulis telah banyak mendapat bantuan, bimbingan, serta saran dari berbagai pihak. Untuk itu, penulis mengucapkan terima kasih serta penghargaan yang sebesar-besarnya kepada:
1. Eddy Dahar, drg., M.Kes selaku dosen pembimbing yang telah memberikan pengarahan, saran, nasehat, dorongan, serta meluangkan waktu, tenaga, pemikiran dan kesabaran kepada penulis selama penelitian dan penulisan sehingga skripsi ini dapat terselesaikan.
2. Prof. H. Nazruddin, drg., Ph.D., C.Ort, Sp.Ort selaku Dekan Fakultas Kedokteran Gigi Universitas Sumatera Utara.
4. Syafrinani, drg., Sp.Pros (K) selaku Ketua Departemen Prostodonsia Fakultas Kedokteran Gigi Universitas Sumatera Utara yang telah memberikan saran dan masukan kepada penulis dalam menyelesaikan skripsi ini.
5. Dwi Tjahyaning Putranti, drg., MS selaku Pembantu Dekan II Fakultas Kedokteran Gigi Universitas Sumatera Utara dan selaku anggota tim penguji skripsi yang telah memberikan saran dan masukan kepada penulis dalam menyelesaikan skripsi ini.
6. Putri Welda Utami Ritonga, drg., MDSc selaku anggota tim penguji yang telah memberikan saran dan masukan kepada penulis dalam menyelesaikan skripsi ini.
7. Siti Salmiah, drg., Sp.KGA selaku penasehat akademik atas motivasi dan bantuan selama masa pendidikan di Fakultas Kedokteran Gigi Universitas Sumatera Utara.
8. Seluruh staf pengajar serta pegawai Prostodonsia Fakultas Kedokteran Gigi Universitas Sumatera Utara atas motivasi dan bantuan dalam menyelesaikan skripsi ini hingga selesai.
9. Abang Muzakir dan kakak Asnidar selaku laboran serta pimpinan dan seluruh karyawan Unit UJI Laboratorium Dental Fakultas Kedokteran Gigi Universitas Sumatera Utara yang telah menbantu penulis dalam pembuatan sampel penelitian dan memberikan dukungan kepada penulis.
10. Maya Fitria, SKM., M.Kes dari Fakultas Kesehatan Masyarakat Universitas Sumatera Utara yang telah meluangkan waktu untuk membantu penulis dalam analisis statistik.
12.Teman-teman terdekat terutama Valarmaty, Shivaneshwary, Shubah Sanggiri, Vivekananthan, Shankar, Dhevanraj, Navinraj, Yuva, Priangka dan juga teman-teman angkatan 2011 yang tidak dapat disebutkan satu per satu atas segala bantuan, perhatian, dukungan, dan dorongan semangat yang diberikan dari awal hingga akhir penulisan skripsi ini.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan, oleh karena itu saran dan kritik yang membangun dari berbagai pihak sangat diharapkan. Akhir kata, penulis mengharapkan agar skripsi ini dapat berguna bagi pengembangan disiplin ilmu Departemen Prostodonsia, Fakultas Kedokteran Gigi Universitas Sumatera Utara, dan bagi kita semua.
Medan, 4 Juni 2015 Penulis
DAFTAR ISI
Halaman HALAMAN JUDUL ...
HALAMAN PERSETUJUAN ... HALAMAN TIM PENGUJI SKRIPSI ...
KATA PENGANTAR ... iv
DAFTAR ISI ... vii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR GRAFIK ... xii
DAFTAR LAMPIRAN ... xiii
BAB 1 PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Permasalahan ... 3
1.3 Rumusan Masalah... 4
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 5
1.5.1 Manfaat Praktis... 5
1.5.2 Manfaat Teoritis ... 5
BAB 2 TINJAUAN PUSTAKA 2.1 Bahan Cetak ... 6
2.1.1 Klasifikasi Bahan Cetak... 6
2.1.2.1 Bahan Cetak Non Elastik ... 6
2.1.2.2 Bahan Cetak Elastik... 7
2.2 Alginat ... 8
2.2.1 Komposisi ... 9
2.2.2 Proses Gelasi... 10
2.2.4 Sifat Imbibisi dan Sineresis ... 12
3.2 Sampel dan Besar Sampel Penelitian ... 24
3.6.2.4 Perlakuan Pada Sampel Kelompok Perendaman
4.1 Dimensi Cetakan Alginat Tanpa dan Sesudah Direndam Dalam Sodium Hipoklorit 0,5% dan Glutaraldehid 2% Selama 5 dan
10 Menit ... 35 4.2 Pengaruh Perendaman Cetakan Alginat Dalam Sodium
Hipoklorit 0,5% dan Glutaraldehid 2% Selama 5 dan 10 Menit
Terhadap Perubahan Dimensi ... 37 4.3 Perbedaan Pengaruh Yang Signifikan Antara Perendaman
Cetakan Alginat Dalam Sodium Hipoklorit 0,5% dan
Glutaraldehid 2% Selama 5 dan 10 Menit Terhadap Perubahan
Dimensi ... 38 BAB 5 PEMBAHASAN
5.1 Dimensi Cetakan Alginat Tanpa dan Sesudah Direndam Dalam Sodium Hipoklorit 0,5% dan Glutaraldehid 2% Selama 5 dan
10 Menit ... 39 5.2 Pengaruh Perendaman Cetakan Alginat Dalam Sodium
Hipoklorit 0,5% dan Glutaraldehid 2% Selama 5 dan 10 Menit
Terhadap Perubahan Dimensi. ... 41 5.3 Perbedaan Pengaruh Yang Signifikan Antara Perendaman
DAFTAR TABEL
Tabel Halaman
1 Komposisi bahan cetak alginat dan fungsinya ... 10
2 Definisi operasional variabel bebas ... 26
3 Definisi operasional variabel terikat ... 26
4 Definisi operasional variabel terkendali ... 26
5 Dimensi cetakan alginat tanpa dan sesudah direndam dalam sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit ... 35
6 Hasil uji One Way Anova pada perendaman cetakan alginat dalam sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit terhadap perubahan dimensi ... 37
DAFTAR GAMBAR
Gambar Halaman
1 Ukuran model induk ... 24
2 Model induk ... 27
3 Mold silindris ... 28
4 Mold silindris ditempatkan pada glass plate ... 28
5 Alginat dituangkan pada mold silindris ... 29
6 Glass plate kedua ditekan atas cetakan ... 29
7 Sampel dilepas dari model induk ... 30
8 Sampel dicuci dengan air mengalir... 30
DAFTAR GRAFIK
Grafik Halaman
1 Grafik dimensi cetakan alginat tanpa dan sesudah direndam dalam sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10
DAFTAR LAMPIRAN
Lampiran
1 Surat Permohonan Izin Penelitian di Lab. UJI Dental FKG USU 2 Hasil Pengukuran
3 Hasil Uji Analisis Statistik
4 Surat Persetujuan Komisi Etik Penelitian
Tahun 2015
Tineshraj Selvaraj
Pengaruh Perendaman Cetakan Alginat Dalam Larutan Sodium Hipoklorit 0,5% dan Glutaraldehid 2% Terhadap Perubahan Dimensi.
xiii + 49 Halaman
larutan sodium hipoklorit 0,5% selama 5 dan 10 menit dan perendaman cetakan alginat dalam glutaraldehid 2% selama 5 dan 10 menit terhadap perubahan dimensi dengan nilai p = 0,0001 (p < 0,05). Hasil penelitian ini juga menunjukkan adanya perbedaan pengaruh yang signifikan pada perendaman cetakan alginat dalam glutaraldehid 2% selama 10 menit dengan nilai p = 0,0001 ( p < 0,05). Dari hasil penelitian ini dapat disimpulkan bahwa perendaman cetakan alginat dalam larutan sodium hipoklorit 0,5% dan glutaraldehid 2% mempengaruhi perubahan dimensi, perubahan dimensi yang minimal terdapat pada perendaman cetakan alginat dalam larutan sodium hipoklorit 0,5% selama 5 menit.
BAB 1
PENDAHULUAN
1.1 Latar Belakang
membersihkan hasil cetakan dengan air dan selanjutnya melakukan desinfeksi sebelum diisi dengan gips. Hal ini dilakukan untuk mencegah infeksi silang, baik pada dokter gigi, asisten maupun laboran.1-4 American Dental Association (ADA) menganjurkan hasil cetakan harus dicuci terlebih dahulu dengan air untuk menghilangkan saliva dan darah yang melekat pada hasil cetakan kemudian direndam dalam larutan desinfektan untuk menghindari terjadinya kontaminasi bakteri sebelum dikirim ke laboratorium.5 Bahan desinfektan yang banyak digunakan dan mempunyai efektifitas desinfeksi pada mikroorganisme patogen adalah sodium hipoklorit, glutaraldehid, klorheksidin dan hidrogen peroksida.1-5 Pang SK (2006), menyatakan bahwa bahan desinfektan yang biasa digunakan untuk desinfeksi hasil cetakan antara lain adalah sodium hipoklorit, glutaraldehid, alkohol dan hidrogen peroksida. Sodium hipoklorit dan glutaraldehid merupakan desinfektan yang paling sering digunakan karena memiliki beberapa keuntungan diantaranya mudah diperoleh, kemampuan antimikrobial spektrum luas, aman dan tidak meninggalkan residu.8 Terdapat dua metode yang digunakan untuk mendesinfeksi hasil cetakan yaitu metode penyemprotan dan perendaman. Silva dan Salvador (2004) serta Saber FS, dkk (2010) mengatakan bahwa metode desinfektan dengan perendaman menunjukkan aktivitas antimikrobial yang sama dengan metode penyemprotan. Berdasarkan aplikasi praktisnya, desinfeksi dengan teknik perendaman dianggap sebagai metode yang paling sesuai dan aplikatif untuk dokter gigi.10,11
3 jam sesudah disemprot dengan larutan sodium hipoklorit 1% dan glutaraldehid 2% menemukan terjadi perubahan dimensi hasil cetakan antara kelompok kontrol dan kelompok yang sudah didesinfeksi kurang dari 24 µ m.14
1.2 Permasalahan
Hasil cetakan dapat dikatakan baik apabila keakuratannya terjamin dan memiliki kestabilan dimensi sampai nanti akan diisi gips. Akurasi dan stabilitas dimensi hasil cetakan merupakan hal penting untuk keberhasilan dalam pembuatan gigitiruan. Di dalam praktek sehari-hari kebanyakan dokter gigi menggunakan bahan cetak alginat untuk mendapatkan model negatif dari rahang dan jaringan sekitarnya yang selanjutnya diisi dengan gips untuk mendapatkan model kemudian digunakan untuk membuat gigitiruan.1-4 Menurut American Dental Association (ADA) hasil cetakan seharusnya dicuci terlebih dahulu dengan air mengalir untuk menghilangkan saliva dan darah yang melekat pada hasil cetakan, kemudian direndam dalam larutan desinfektan untuk menghindari terjadinya infeksi silang sebelum dikirim ke laboratorium.5
Terdapat beberapa jenis desinfektan yang beredar di pasaran diantaranya sodium hipoklorit, iodophor, glutaraldehid, fenol, dan klorheksidin. Dua metode yang digunakan untuk desinfeksi hasil cetakan yaitu dengan cara penyemprotan dan perendaman. Desinfeksi dengan cara perendaman merupakan cara yang lebih efektif dan aman dibandingkan dengan cara penyemprotan karena metode penyemprotan tidak semua permukaan hasil cetakan terdesinfeksi dengan sempurna dan juga partikel-partikel larutan desinfektan yang ada di udara dapat terhirup.1,4,5
perendaman hasil cetakan dalam sodium hipoklorit 0,5% akan menyebabkan terjadinya perubahan dimensi yang minimal dibandingkan dengan pengunaan desinfektan lain.15 Belum ada penelitian yang membandingkan larutan sodium hipoklorit 0,5% dan glutaraldehid 2% terhadap perubahan dimensi alginat. Hal ini sebagai upaya untuk mengetahui ada tidaknya perubahan dimensi hasil cetakan alginat yang nantinya akan menentukan ketepatan pada pembuatan model selanjutnya.
1.3 Rumusan Masalah
Berdasarkan permasalahan yang telah dijelaskan, maka dapat diambil rumusan masalah sebagai berikut:
1.Berapa dimensi cetakan alginat tanpa dan sesudah direndam dalam sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit?
2.Apakah ada pengaruh perendaman cetakan alginat dalam sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit terhadap perubahan dimensi ?
3.Apakah ada perbedaan pengaruh yang signifikan antara perendaman cetakan alginat dalam sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit terhadap perubahan dimensi ?
1.4 Tujuan Penelitian
1.Untuk mengetahui berapa dimensi cetakan alginat tanpa dan sesudah direndam dalam sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit.
2.Untuk mengetahui apakah ada pengaruh perendaman cetakan alginat dalam sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit terhadap perubahan dimensi.
1.5 Manfaat Penelitian
1.5.1 Manfaat Teoritis
a) Sebagai bahan masukan bagi perkembangan ilmu pengetahuan khususnya di bidang Prostodonsia.
b) Hasil penelitian ini dapat dijadikan sebagai referensi untuk penelitian lebih lanjut.
1.5.2 Manfaat Praktis
BAB 2
TINJAUAN PUSTAKA
2.1 Bahan Cetak
Bahan cetak adalah bahan yang digunakan di kedokteran gigi untuk mencetak dan mereproduksi hasil yang akurat dari gigi, jaringan lunak dan jaringan keras di dalam rongga mulut yang selanjutnya hasil cetakan diisi dengan bahan gips untuk dibuat model yang akan digunakan sebagai studi model dan tempat pembuatan gigi tiruan penuh, gigitiruan sebagian lepasan, mahkota, jembatan dan inlay.1-3
2.1.1 Klasifikasi Bahan Cetak
Bahan cetak dapat dikelompokkan menurut sifat mekanisnya. Ada 2 jenis bahan cetak, yakin bahan cetak non-elastis dan elastis.1-4
2.1.1.1 Bahan cetak non-elastis
Bahan cetak non elastis adalah bahan cetak yang tidak dapat melalui undercut
sehingga penggunaannya terbatas pada pasien edentulus dan tanpa ada undercut
tulang. Bahan cetak non elastis dapat dibagi menjadi plaster of paris, kompon dan okside seng eugenol.
1. Plaster of paris
Plaster of paris atau yang disebut juga sebagai gips cetak jarang digunakan sebagai bahan cetak sejak bahan elastomer telah tersedia. Gips cetak bersifat rigid dan lebih mudah patah. Bahan ini kaku setelah mengeras dan dimensinya stabil, karena itu paling cocok digunakan bila tidak ada undercut tulang. Gips ini harus disimpan dalam kantung kedap udara karena akan menyerap air dari udara dan akan mempengaruhi waktu pengerasan.1
2. Kompon
ADA. Tipe I digunakan untuk mencetak dan tipe II digunakan untuk preparasi sendok cetak. Walaupun jarang digunakan, kompon dapat dipakai untuk pencetakan mahkota penuh, cetakan rahang edentulus sebagian atau seluruhnya, dan membuat cetakan pada sendok cetak di mana cetakan akhir dibuat dengan menggunakan bahan lainnya. Kompon tidak dapat digunakan untuk mencetak undercut karena tidak bersifat elastis.1,3
3. Okside seng eugenol (OSE)
Bahan ini kaku setelah mengeras dan dimensinya stabil. Karena itu bahan ini lebih disukai dibandingkan dengan alginat pada semua kasus yang tidak mempunyai undercut tulang. Pemakaian OSE terutama adalah sebagai bahan cetak untuk gigitiruan pada linggir edentulus dengan undercut kecil atau tanpa ada undercut. OSE juga dapat digunakan sebagai cetakan pembersih di atas kompon pada sendok cetak atau pada sendok cetak individual akrilik.1
2.1.1.2 Bahan Cetak Elastis
Bahan cetak elastis dapat dibagi menjadi bahan cetak hidrokoloid dan bahan cetak elastomer. Bahan cetak hidrokoloid merupakan bahan cetak yang substansi dasarnya berupa koloid yang direaksikan dengan air, sehingga disebut hidrokoloid. Bahan cetak hidrokoloid sendiri dapat diklasifikasikan menjadi bahan cetak hidrokoloid reversibel dan ireversibel.1
1. Hidrokoloid
a) Hidrokoloid Reversibel (Agar)
Hidrokoloid reversibel adalah bahan cetak yang paling akurat untuk
b) Hidrokoloid Ireversibel
Alginat merupakan bahan cetak yang penggunaanya paling luas dalam kedokteran gigi. Alginat juga disebut dengan hidrokoloid alginat atau hidrokoloid ireversibel. Bahan ini dipakai untuk membuat cetakan anatomi untuk gigitiruan sebagian dan pesawat ortodontik.1-4
2. Elastomer
Elastomer meliputi bahan cetak polisulfid, polieter, silikon kondensasi, dan yang berpolimerisasi dengan penambahan. Bahan-bahan ini elatis dan mudah kembali ke bentuk semula dengan baik, dan stabil dimensinya, tetapi relatif mahal terutama silikon yang berpolimerisasi dengan penambahan. Kekentalannya bermacam-macam, mulai dari pasta yang sangat padat sampai yang sangat encer, menghasilkan kelompok bahan cetak yang cocok untuk berbagai penerapan klinis. Bahan-bahan ini bersih dan mudah penggunaannya, serta memiliki rentang waktu yang cukup untuk bekerja dan mengeras, sehingga cocok untuk hampir semua teknik.1-3
2.2 Alginat
Alginat merupakan bahan cetak hidrokoloid bersifat ireversibel yang telah diperkenalkan sejak tahun 1940. Alginat merupakan bahan cetak yang penggunaannya paling luas dalam bidang kedokteran gigi. Kelebihan dari bahan cetak alginat diantaranya adalah mudah dimanipulasi, tidak memerlukan banyak peralatan, relatif tidak mahal, nyaman dan mudah ditolerir oleh pasien, cepat mengeras dan terdapat aroma yang menyegarkan seperti permen karet untuk mengurangi reflek muntah. Sebaliknya penggunaan alginat juga memiliki beberapa kekurangan seperti adanya sifat sineresis yang menyebabkan terjadinya pengerutan dan imbibisi yang akan membuat perubahan dimensi pada hasil cetakan.1-4
untuk membuat gigitiruan atau sewaktu membuat cetakan akhir yang bertujuan untuk mencatat seakurat mungkin bentuk mukosa sekaligus sulkus secara fungsional. Selain itu, alginat juga dipakai untuk pencetakan pada pembuatan gigitiruan sebagian lepasan, alat ortodontik, dan model studi. Akan tetapi, alginat tidak cukup akurat untuk pembuatan mahkota dan jembatan.1-4
2.2.1 Komposisi Alginat
Komponen aktif utama dari bahan cetak hidrokoloid irreversibel adalah salah satu komponen alginat yang larut air, seperti natrium atau kalium. Bila komponen alginat yang larut dalam air dicampur dengan air, bahan tersebut akan membentuk sol. Sol tersebut sangat kental meskipun dalam konsentrasi rendah. Alginat dapat larut membentuk sol dengan cepat bila bubuk alginat dan air diaduk dengan kuat. Berat molekul dari campuran alginat sangat bervariasi tergantung pada buatan pabrik. Semakin berat molekul, semakin kental sol yang terjadi.4
Proporsi yang tepat dari masing-masing bahan kimia yang di gunakan bervariasi sesuai dengan jenis bahan mentah yang digunakan. Tujuan ditambahkannya
diatomaceous earth adalah sebagai pengisi. Bila bahan pengisi ditambahkan dengan jumlah yang tepat maka akan dapat meningkatkan kekuatan dan kekerasan gel alginat, menghasilkan tekstur yang halus, dan memastikan pembentukan permukaan gel padat yang tidak bergelombang. Bahan tersebut juga membantu permukaan sol dengan mendispersikan partikel bubuk alginat dalam air. Oksida sing juga berfungsi sebagai bahan pengisi dan mempengaruhi sifat fisik serta waktu pengerasan gel.4
Kalsium sulfat dapat digunakan sebagai reaktor. Bentuk dihidrat umumnya digunakan, tetapi untuk keadaan tertentu hemihidrat menghasilkan waktu penyimpanan bubuk yang lebih lama serta kestabilan dimensi gel yang lebih memuaskan. Fluorida, seperti kalium titanium fluorid ditambahkan pada alginat sebagai bahan mempercepat pengerasan stone untuk mendapat permukaan model stone yang keras dan padat terhadap cetakan.4
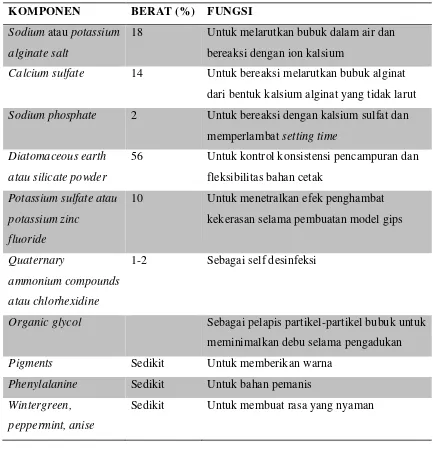
Tabel 1. Komposisi Bahan Cetak Alginat dan Fungsinya1,2,3,4
KOMPONEN BERAT (%) FUNGSI
Sodium atau potassium alginate salt
18 Untuk melarutkan bubuk dalam air dan bereaksi dengan ion kalsium
Calcium sulfate 14 Untuk bereaksi melarutkan bubuk alginat
dari bentuk kalsium alginat yang tidak larut
Sodium phosphate 2 Untuk bereaksi dengan kalsium sulfat dan
memperlambat setting time Diatomaceous earth
atau silicate powder
56 Untuk kontrol konsistensi pencampuran dan fleksibilitas bahan cetak
Potassium sulfate atau
potassium zinc fluoride
10 Untuk menetralkan efek penghambat kekerasan selama pembuatan model gips
Quaternary
ammonium compounds
atau chlorhexidine
1-2 Sebagai self desinfeksi
Organic glycol Sebagai pelapis partikel-partikel bubuk untuk
meminimalkan debu selama pengadukan
Pigments Sedikit Untuk memberikan warna
Phenylalanine Sedikit Untuk bahan pemanis
Wintergreen, peppermint, anise
Sedikit Untuk membuat rasa yang nyaman
2.2.2 Proses Gelasi
2Na3PO4 + 3CaSO4 Ca3 (PO4)2 + 3Na2SO4
Tahap kedua, setelah sodium fosfat telah bereaksi, sisa kalsium sulfat bereaksi dengan sodium alginat membentuk kalsium alginat yang tidak larut, yang dengan air akan membentuk gel: 4
H2O
Na alginat + CaSO4 Ca alginat + Na2SO4
(bubuk) (gel)
Menurut kecepatan proses gelasinya, alginat dibedakan menjadi dua jenis, yaitu: 1. Quick setting alginate, mengeras dalam 1 menit dan digunakan untuk
mencetak rahang anak-anak atau penderita yang mudah mual. 2. Regular setting alginate, mengeras dalam 3 menit dan dipakai untuk
pemakaian rutin.
Gelasi alginat yang normal tercapai dalam 3 menit. Gerakan pada waktu gelasi berlangsung, misalnya pasien batuk, bergerak, muntah, atau menelan akan menyebabkan stres internal pada alginat.
2.2.3 Manipulasi
Bubuk alginat dan air hendaknya diukur sesuai dengan yang dianjurkan oleh pabrik. Rasio bubuk dan air akan mempengaruhi hasil adonan alginat. Perbandingan bubuk dan air yang kurang akan meningkatkan waktu kerja, setting time dan fleksibilitas.3,4
konsistensi seperti krim, serta tidak menetes dari spatula apabila spatula diangkat dari
rubber bowl. Waktu pencampuran untuk alginat tipe regular adalah 1 menit dan untuk tipe fast 45 detik. Waktu pencampuran sangat penting karena pengadukan yang kurang dan berlebihan akan mempengaruhi kekuatan dari bahan cetak.3,4
2.2.4 Sifat Imbibisi dan Sineresis
Hasil cetakan alginat mempunyai sifat imbibisi yaitu menyerap air bila dalam lingkungan yang basah sehingga lebih mudah mengembang dan mudah terjadi pengerutan yaitu sineresis, saat dibiarkan terlalu lama pada udara terbuka. Hal ini menyebabkan terjadinya perubahan dimensi hasil cetakan. Seperti hidrokoloid lainnya, alginat mengandungi sejumlah air yang besar dan rentan terhadap di distorsi yang disebabkan oleh pengembangan yang terkait dengan imbibisi atau sineresis.20
Alginat adalah gel polimer dengan air sebagai media interstisial, oleh karena itu alginat diklasifikasikan sebagai hidrogel. Keberadaan fisik air pada polimer
hydrogel biasanya dalam bentuk padat, cair, dan uap. Air pada fase absorbsi dapat terikat (contoh padat, dimana air terperangkap) maupun tidak terikat atau bebas. Air bebas terletak pada pori-pori dari partikel filler seperti diatomaceous earth. Air bebas yang terperangkap di antara partikel filler rentan terhadap kenaikan dan penurunan volumetrik, hal ini diakibatkan oleh sineresis atau imbibisi. 16
2.2.4.1 Perubahan Dimensi Hasil Cetakan
cetakan alginat akan menyebabkan terjadi perubahan dimensi. Oleh karena itu untuk mencapai keakuratan yang maksimal, cetakan alginat harus diisi secepat mungkin. Bila hal ini tidak dapat dilakukan, maka cetakan harus disimpan pada kondisi dengan kelembaban relatif 100% agar tidak terjadi perubahan dimensi.1,3,4,9
Salah satu cara untuk melihat perubahan dimensi cetakan alginat yaitu dengan membandingkan ukuran die stone cetakan dengan master die cetakan yang dipergunakan. Panza, dkk (2006) dalam penelitiannya meneliti perubahan dimensi cetakan alginat yang direndam dalam sodium hipoklorit 0,5% dan glutaraldehid 2% dengan menggunakan master model yang terbuat dari besi yang dibandingkan dengan
die stone dan didapatkan perubahan dimensi yang terjadi sebesar 0,122.17 Vodjani, dkk (2006) telah mencobakan desinfeksi dengan penyemprotan dan perendaman dalam sodium hipoklorit 5,25% pada cetakan alginat dengan stone model.18 Cara lain untuk mengetahui perubahan dimensi cetakan alginat yaitu langsung mengukur cetakan alginat sesudah perendaman dalam larutan desinfektan dan dibandingkan dengan cetakan yang tanpa perendaman. Rodrigues SB, dkk (2012) dalam penelitiannya meneliti perubahan deformasi hasil cetakan alginat dengan menggunakan kaliper digital untuk mengukur perubahan deformasi.19
2.2.5 Setting Time
Berdasarkan spesifikasi American Dental Association (ADA) nomor 18 terdapat 2 tipe yaitu tipe I fast set (working time tidak kurang dari 1 menit 15 detik dan
setting time 1-2 menit) dan tipe II normal set (working time tidak kurang dari 2 menit dan setting time 2-4,5 menit).3
Untuk memperlambat setting time dapat dilakukan dengan beberapa cara yaitu mengurangi rasio bubuk alginat atau mengurangi suhu air. Pengurangan rasio bubuk alginat kurang dianjurkan karena dapat mengurangi kekuatan dan akuransi alginat, oleh karena itu, cara mengurangi suhu air lebih dianjurkan. Suhu air yang tinggi akan mempercepat setting time, sedangkan suhu air yang rendah akan memperlambat
2.3 Kontrol Infeksi
Dasar pemikiran untuk kontrol infeksi adalah untuk “mengkontrol” infeksi iatrogenik, nosokomial diantara pasien dan paparan potensial pada petugas kesehatan terhadap penyakit selama perawatan. Istilah kontrol infeksi tidak berarti pencegahan total terhadap infeksi iatrogenik, nosokomial diantara pasien dan paparan selama perawatan terhadap darah dan material yang berpotensi menginfeksi lainnya, namun istilah tersebut memiliki pengertian mengurangi resiko transmisi penyakit.5,20 Resiko transmisi penyakit bervariasi tergantung dari daya tahan tubuh, virulensi, infektivitas organisme, dosis atau jumlah mikroorganisme, waktu pemaparan, dan cara transmisi. Kontrol terhadap virulensi organisme pathogen atau mengurangi kerentanan pasien adalah hampir tidak mungkin. Petugas klinis harus mengerti tentang proses penyakit, cara transmisi, metode mengkontrol transmisi, dan mengimplementasikan kontrol infeksi selama perawatan untuk memutus rantai infeksi. Imunisasi terhadap penyakit, penggunaan peralatan pelindung, pengawasan pada teknik dan tempat kerja, desinfeksi permukaan atau peralatan, sterilisasi instrumen, dan penggunaan protokol aspetik selama perawatan harus selalu dilakukan.5,7,20,21
Di bidang kedokteran gigi, protokol dan prosedur yang terlibat dalam pencegahan dan pengendalian infeksi adalah untuk mengurangi kemungkinan risiko atau infeksi silang yang terjadi di prakek dokter gigi, sehingga dapat menghasilkan lingkungan yang aman bagi dokter gigi, staf dan pasien. Dokter gigi tidak mungkin yakin bahwa pasien yang datang untuk perawatan giginya adalah carrier
mikroorganisme infektif atau bukan, oleh karena itu semua pasien yang datang harus dianggap merupakan carrier dari mikroorganisme patogen. Semua prosedur klinis yang dilakukan pada pasien harus menggunakan kontrol infeksi yang umum.5,7,20,21
2.3.1 Cara kontrol infeksi
Dalam praktek kedokteran gigi, kontrol infeksi meliputi beberapa prosedur penting yaitu : evaluasi pasien, perlindungan diri, sterilisasi, pembuangan sampah bekas praktek dan desinfeksi.5,20
2.3.1.1 Evaluasi Pasien
Pasien yang datang berobat harus dilakukan pemeriksaan untuk mengetahui riwayat kesehatan yang lengkap dan data hasil pemeriksaan tersebut harus diperbaiki pada tiap kunjungan berikutnya, hal ini dimaksudkan agar dapat diketahui adanya kemungkinan terjadinya infeksi silang pada praktek dokter gigi. Dokter gigi tidak mungkin yakin bahwa pasien yang datang untuk perawatan giginya adalah carrier
mikroorganisme infektif atau bukan, oleh karena itu semua pasien yang datang harus dianggap merupakan carrier dari mikroorganisme patogen.7,20
2.3.1.2 Proteksi Diri
Terdapat beberapa perlindungan diri di praktek dokter gigi antaranya kebersihan diri, pemakaian baju praktek, proteksi misalnya penggunaan sarung tangan, kaca mata, masker, dan imunisasi. Kebersihan diri yang baik dapat mengurangi terjadinya infeksi silang di praktek dokter gigi. Secara umum seorang dokter gigi harus menghindari memegang sesuatu yang tidak dibutuhkan pada waktu merawat pasien, hindari kontak tangan dengan mata, hidung, mulut, dan rambut serta hindari memegang luka atau abrasi. Selain itu, dokter gigi juga harus menutupi luka atau lecet-lecet pada jari dengan plester karena luka tersebut dapat merupakan tempat masuknya mikroorganisme patogen dan mencuci tangan baik sebelum dan sesudah merawat pasien.5,7,20,21
2.3.1.3 Sterilisasi
penyimpanan yang aseptik. Disamping itu, sistem air dental unit juga harus dibersihkan dan bebas dari biofilm dan kontaminan anorganik lainnya, juga melakukan pembersihan secara berkala. Air atau bahan irigasi yang digunakan untuk perawatan pasien harus bebas dari mikroba jadi air harus disaring dan destilasi.5,20,21 Dalam bidang kedokteran gigi, sterilisasi dapat dilakukan dalam beberapa tahap yaitu:
a) Uap di bawah tekanan (autoclaving)
Di antara metode sterilisasi, sterilisasi uap adalah yang paling diandalkan dan ekonomis. Sterilisasi uap digunakan untuk barang-barang kritis dan semikritis yang tidak sensitif terhadap panas dan kelembaban misalnya kaca mulut, sonde dan pinset . Sterilisasi uap memerlukan pemaparan langsung dari setiap item untuk langsung menguapnya pada suhu dan tekanan dalam jangka waktu yang tertentu untuk membunuh mikroorganisme.20,21
b) Dry Heat
Strerilisasi dry heat digunakan untuk sterilisasi material yang dapat rusak oleh sterilisasi panas yang lembab (misalnya, bur dan beberapa instrumen ortodontik). Walaupun dry heat memiliki keuntungan biaya operasional yang rendah dan tidak korosif, namum membutuhkan waktu proses yang lama dan tempratur yang tinggi sehingga tidak cocok untuk beberapa barang dan instrumen.20,21
c) Unsaturated chemical vapor
Sterilisasi unsaturated chemical vapor melibatkan pemanasan larutan kimia alkohol primer dengan 0,23% formaldehyde pada ruangan tertutup bertekanan.
2.3.1.4 Pembuangan Sampah Bekas Praktek
Pembuangan barang-barang bekas pakai seperti sarung tangan, masker, tisu bekas dan penutup permukaan yang terkontaminasi darah atau cairan tubuh harus ditangani secara hati-hati dan dimasukkan dalam kantung plastik yang kuat dan tertutup rapat untuk mengurangi kemungkinan orang kontak dengan benda -benda tersebut. Benda-benda tajam seperti jarum atau pisau scalpel harus dimasukkan dalam tempat yang tahan terhadap tusukan sebelum dimasukkan ke dalam kantung plastik.20,21
2.3.1.5 Desinfeksi
Desinfeksi adalah penghancuran bakteri-bakteri patogenik dengan cara pemberian langsung bahan-bahan kimia atau fisik, sedangkan desinfektan adalah bahan-bahan kimia yang dapat membunuh organisme patogen bila diaplikasikan pada obyek mati. Beberapa faktor yang mempengaruhi efektifitas suatu larutan desinfektan dalam membunuh kuman seperti sifat dari mikroorganisme yang terkontaminasi, lamanya kontak antara desinfektan dengan mikroorganisme, proses atau aksi desinfektan dan jenis desinfektan yang akan dipakai untuk memahami cara kerjanya.
sodium hipoklorit 0,525% dengan cara penyemprotan pada bahan cetak alginat sangat efektif dan telah mendesinfeksi 96,6% dari total sampel.6 Aeran H, dkk (2010) membuktikan bahwa sodium hipoklorit 0,5% dan glutaraldehid 2% menunjukkan efektivitas yang sama terhadap organisme gram positif dan gram negatif dan mengatakan bahwa sodium hipoklorit 0,5% dan glutaraldehid 2% merupakan bahan desinfektan yang lebih efektif jika dibandingkan bahan desinfektan lain.29 Joana Correia-Sousa, Ana Margarida Tabaio dkk (2013) telah melaporkan bahwa penggunaan sodium hipoklorit lebih efektif dibandingkan dengan aquades dalam penurunan jumlah mikroba pada hasil cetakan alginat.30 Sunitha Kollu, Veena Hedge dkk (2013) menyatakan bahwa penggunaan klorheksidin 0,1% sebagai desinfektan mempunyai efek terhadap penurunan jumlah mikroba pada hasil cetakan alginat.31
2.3.1.5.1 Klasifikasi bahan desinfektan
Klasifikasi bahan desinfektan berdasarkan aktivitas spektrum. Bahan desinfektan ini dibahagikan tiga kelompok seperti berikut:23-25
1) Low level disinfectant
Desinfektan ini mengeliminasi hampir semua mikrobial patogen dan tidak dapat mengeliminasi spora. Desinfektan ini dipakai untuk alat-alat seperti dental unit,
x-ray heads, facebows. Bahan yang termasuk low level disinfectant adalah golongan alkohol, quats (quaternary ammonium compounds).23-25
2) Intermediate level disinfectant
Desinfektan ini mengeliminasi semua mikrobial patogen tetapi tidak dapat mengeliminasi spora. Desinfektan ini juga dipakai untuk alat-alat seperti kaca mulut, sendok cetak, amalgam condensers. Bahan yang termasuk intermediate level disinfectant adalah golongan fenol dan halogen.23-25
pengontrolan penyakit menganjurkan pemakaian larutan sodium hipoklorit sebagai bahan efektif untuk membunuh virus hepatitis B. Sodium hipoklorit telah terdaftar oleh ADA sebagai bahan desinfektan hasil cetakan. Keuntungan dari desinfektan sodium hipoklorit adalah spectrum luas, antimicrobial berlangsung cepat, ekonomis, dan efektif pada larutan encer. Kerugian sodium hipoklorit ini tidak tahan lama, baunya kurang enak, mengiritasi kulit dan mata, mengkorosi logam dan merusak pakaian.22,26
3) High level disinfectant
Desinfektan ini mengeliminasi semua mikrobial patogen dan mengurangi spora tetapi untuk jumlah yang besar tidak dapat mengeliminasi secara sempurna. Desinfektan ini dipakai untuk alat-alat seperti kaca mulut, sendok cetak, amalgam kondenser. Bahan yang termasuk high level disinfectant adalah golongan etilan oksida, glutaraldehid, formaldehid.23-25
terjadi karena jumlah kandungan air dalam larutan desinfektan, maka diasumsikan dalam larutan glutaraldehid mempunyai kandungan air yang lebih besar dibanding dengan sodium hipoklorit.
2.3.1.5.2 Teknik Desinfeksi Hasil Cetakan
Pemakaian desinfektan pada hasil cetakan dapat dengan cara perendaman ataupun penyemprotan dengan menggunakan sprayer.1 Lamanya perendaman atau penyemprotan tergantung dari jenis disinfektan yang digunakan. Berdasarkan aplikasi praktisnya, desinfeksi dengan teknik perendaman dianggap sebagai metode yang paling sesuai dan aplikatif untuk dokter gigi. Selain itu, metode perendaman merupakan metode desinfeksi yang paling dipilih oleh karena metode ini memungkinkan larutan desinfektan untuk mencapai seluruh permukaan terutama dearah undercut pada hasil cetakan alginat.5,17,20,27
2.4 Landasan Teori
Proses gelasi Manipulasi Setting time
Desinfeksi
Pengertian Cara kontrol infeksi
2.5 Kerangka Konsep
Cetakan alginat
Dibilas dengan air mengalir
Larutan Sodium Hipoklorit 0,5% Larutan Glutaraldehid 2%
Perendaman
Kandungan garam air laut dalam alginat dapat meningkatkan osmolaritas air yang berada disekitarnya
Air yang ada dalam larutan desinfektan diserap oleh alginat
secara osmosis (+)
Proses imbibisi (+)
Perubahan dimensi cetakan alginat (++)
Kandungan air rendah Kandungan air tinggi
Kandungan garam air laut dalam alginat dapat meningkatkan osmolaritas air yang berada
disekitarnya
Air yang ada dalam larutan desinfektan diserap oleh alginat
secara osmosis (++)
Proses imbibisi (++)
Perubahan dimensi cetakan alginat (+)
2.6 Hipotesis
1.Ada pengaruh perendaman cetakan alginat dalam sodium hipoklorit 0,5% selama 5 dan 10 menit terhadap perubahan dimensi.
2.Ada pengaruh perendaman cetakan alginat dalam glutaraldehid 2% selama 5 dan 10 menit terhadap perubahan dimensi.
BAB 3
METODOLOGI PENELITIAN
3.1 Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental laboratoris.
3.2 Sampel dan Besar Sampel Penelitian
3.2.1 Sampel Penelitian
Sampel yang digunakan dalam penelitian ini adalah alginat. Ukuran model induk dari stainless steel yang akan digunakan untuk pembuatan sampel adalah 12,5 mm x 20 mm (ANSI/ADA specification no. 18).
Gambar 1. Ukuran model induk19
3.2.2 Besar Sampel
Besar sampel pada penelitian ini dihitung berdasarkan rumus Federer:
Keterangan:
t = Jumlah perlakuan r = Jumlah replikasi
Dalam penelitian ini terdapat dua kelompok sampel dan satu kelompok kontrol, maka t = 3 dan jumlah sampel (r) dapat ditentukan sebagai berikut:
( t-1 )( r-1 ) ≥ 15
(3-1) (r-1) ≥ 15 2 (r-1) ≥ 15 2r –2 ≥ 15
2r ≥15 + 2 r ≥ 17/2
r ≥ 8,5 9 (untuk memudahkan maka sampel setiap kelompok 10)
3.3 Variabel Penelitian
3.3.1 Klasifikasi Variabel Penelitian
3.3.1.1 Variabel Bebas
Variabel bebas dalam penelitian ini adalah:
1. Cetakan alginat yang direndam dalam larutan sodium hipoklorit 0,5% selama 5 dan 10 menit.
2. Cetakan alginat yang direndam dalam larutan glutaraldehid 2% selama 5 dan 10 menit.
3.3.1.2 Variabel Terikat
Perubahan dimensi
3.3.1.3 Variabel Terkendali
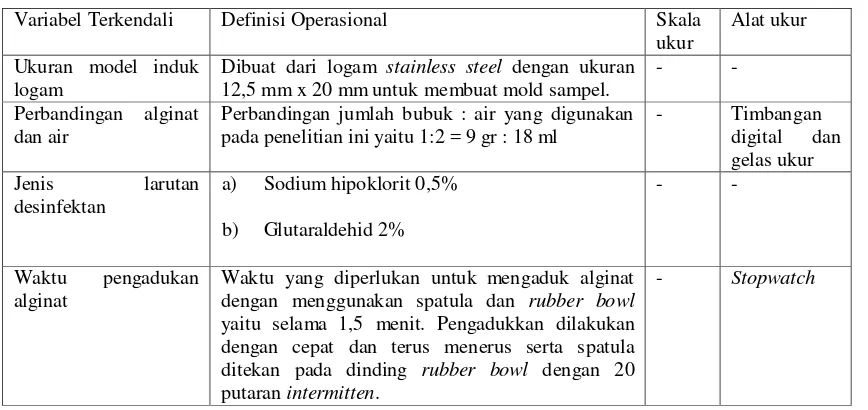
1. Ukuran model induk logam 2. Perbandingan alginat dan air 3. Jenis larutan desinfektan 4. Waktu pengadukan alginat
5. Waktu perendaman dengan larutan desinfektan
3.3.2 Definisi Operasional
Tabel 1. Definisi operasional variabel bebas
Variabel Bebas Definisi Operasional Skala
ukur
Alat ukur Cetakan alginat Bahan yang terdiri atas bubuk dan air yang setelah
pencampuran dituangkan ke dalam model induk logam untuk mendapatkan sampel alginat, yang kemudian direndam selama 5 dan 10 menit dalam larutan:
a) Sodium hipoklorit 0,5%
b) Glutaraldehid 2%
- -
Tabel 2. Definisi operasional variabel terikat
Variabel Terikat Definisi Operasional Skala ukur
Alat ukur
Perubahan dimensi Ukuran tinggi sampel yang direndam dalam larutan sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit.
Rasio Kaliper digital
Tabel 3. Definisi operasional variabel terkendali
Variabel Terkendali Definisi Operasional Skala ukur
Alat ukur
Ukuran model induk logam
Dibuat dari logam stainless steel dengan ukuran 12,5 mm x 20 mm untuk membuat mold sampel.
- -
Waktu yang diperlukan untuk mengaduk alginat dengan menggunakan spatula dan rubber bowl
yaitu selama 1,5 menit. Pengadukkan dilakukan dengan cepat dan terus menerus serta spatula ditekan pada dinding rubber bowl dengan 20 putaran intermitten.
- Stopwatch
3.4 Tempat dan Waktu Penelitian
3.4.1 Tempat Pembuatan dan Pengujian Sampel
3.4.2 Waktu Penelitian
Penelitian ini dilakukan pada bulan Febuari 2015
3.5 Alat dan Bahan Penelitian
3.5.1 Alat Penelitian
1. Model induk dari stainless steel berbentuk silindris dengan diameter 12,5 mm dan tinggi 20 mm.
2. Mold silindris dari stainless steel berbentuk silindris dengan diameter 30 mm dan tinggi 20 mm.
3. Timbangan digital 4. Rubber bowl dan spatula 5. Wadah plastik
6. Gelas ukur 7. Stopwatch
8. Pinset
9. Kaliper digital (Krisbow model KW 06-351) 10. Glass plate sebanyak 2 buah
3.5.2 Bahan Penelitian
1. Larutan sodium hipoklorit 0,5% 2. Larutan glutaraldehid 2%
Gambar 2. Model induk
Gambar 3. Mold silindris
3.6 Prosedur Penelitian
3.6.1 Pembuatan Sampel
Gambar 4. Mold silindris
ditempatkan pada glass plate.
2. Aduk bahan cetak alginat dengan P/W ratio 1:2 = 9 gr : 18 ml pada rubber bowl sampai homogen ( working time 1,5 menit ). Pengadukkan dilakukan dengan cepat dan terus menerus serta spatula ditekan pada dinding rubber bowl dengan 20 putaran intermitten.
3.Adonan alginat dituangkan ke dalam Mold silindris hingga penuh (Gambar 5).
Gambar 5. Alginat dituangkan pada mold silindris
5.Glass plate kedua ditekan di atas cetakan sehingga permukaan atas sampel sama rata dengan model induk (Gambar 6).
Gambar 6. Glass plate kedua ditekan di atas cetakan
6.Setelah alginat mengeras ( setting time 3 menit), sampel dilepas dari model induk (Gambar 7).
Gambar 7. Sampel dilepas dari model induk.
3.6.2 Perlakuan Pada Sampel
3.6.2.1 Perlakuan Pada Sampel Kelompok Tanpa Perendaman Dalam
1. Setelah prosedur pembuatan sampel selesai, sampel dicuci di bawah air mengalir selama 15 detik (Gambar 8).
Gambar 8. Sampel dicuci dengan air mengalir.
2.Pengukuran dimensi sampel dilakukan dengan mengukur sampel dari dasar sampai puncak sampel dengan menggunakan kaliper digital oleh operator yang sama. Pengukuran dilakukan sebanyak 3 kali pada titik yang sama untuk setiap sampel (Gambar 9).
Gambar 9. Pengukuran sampel
3.6.2.2 Perlakuan Pada Sampel Kelompok Perendaman Dalam Sodium
Hipoklorit 0,5% Selama 5 Menit (Kelompok B)
1. Setelah prosedur pembuatan sampel selesai, hasil cetakan dicuci di bawah air mengalir selama 15 detik, kemudian direndam dalam wadah plastik yang berisi 50 ml larutan sodium hipoklorit 0,5% selama 5 menit.
2. Setelah 5 menit, pengukuran dimensi sampel dilakukan dengan mengukur sampel dari dasar sampai puncak sampel dengan menggunakan kaliper digital oleh operator yang sama. Pengukuran dilakukan sebanyak 3 kali untuk setiap sampel.
3.Proses ini dilakukan sampai diperoleh 10 sampel untuk kelompok B.
3.6.2.3 Perlakuan Pada Sampel Kelompok Perendaman Dalam Sodium
Hipoklorit 0,5% Selama 10 Menit (Kelompok C)
1. Setelah prosedur pembuatan sampel selesai, hasil cetakan dicuci di bawah air mengalir selama 15 detik, kemudian direndam dalam wadah plastik yang berisi 50 ml larutan sodium hipoklorit 0,5% selama 10 menit.
2. Setelah 10 menit, pengukuran dimensi sampel dilakukan dengan mengukur sampel dari dasar sampai puncak sampel dengan menggunakan kaliper digital oleh operator yang sama. Pengukuran dilakukan sebanyak 3 kali untuk setiap sampel.
3. Proses ini dilakukan sampai diperoleh 10 sampel untuk kelompok C.
3.6.2.4 Perlakuan Pada Sampel Kelompok Perendaman Dalam
Glutaraldehid 2% Selama 5 Menit (Kelompok D)
1. Setelah prosedur pembuatan sampel selesai, hasil cetakan dicuci di bawah air mengalir selama 15 detik, kemudian direndam dalam wadah plastik yang berisi 50 ml larutan glutaraldehid 2% selama 5 menit.
3.6.2.5 Perlakuan Pada Sampel Kelompok Perendaman Dalam
Glutaraldehid 2% Selama 10 Menit (Kelompok E)
1. Setelah prosedur pembuatan sampel selesai, hasil cetakan dicuci di bawah air mengalir selama 15 detik, kemudian direndam dalam wadah plastik yang berisi 50 ml larutan glutaraldehid 2% selama 10 menit.
2. Setelah 10 menit, pengukuran dimensi sampel dilakukan dengan mengukur sampel dari dasar sampai puncak sampel dengan menggunakan kaliper digital oleh operator yang sama. Pengukuran dilakukan sebanyak 3 kali untuk setiap sampel.
3. Proses ini dilakukan sampai diperoleh 10 sampel untuk kelompok E.
3.7Analisis Data
Data yang diperoleh dari hasil pengukuran sampel dicatat kemudian dianalisis menggunakan :
1.Analisis univarian untuk mengetahui nilai rerata dan standar deviasi dimensi sampel pada kelompok A, B, C, D dan E.
2.Uji One Way Anova untuk mengetahui pengaruh perendaman cetakan
alginat dalam sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit terhadap perubahan dimensi.
3.8 Kerangka Operasional
Pembuatan cetakan alginat dengan menggunakan model indukdan mold silindris
Sampel
Dibilas dengan air mengalir selama 15 detik
BAB 4
HASIL PENELITIAN
4.1 Dimensi Cetakan Alginat Tanpa dan Sesudah Direndam Dalam
Sodium Hipoklorit 0,5% dan Glutaraldehid 2% Selama 5 dan 10 Menit.
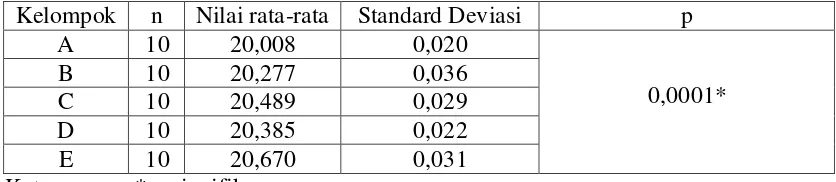
Hasil pengukuran kelompok A, B, C, D dan E yang diperoleh dari pengukuran dimensi sampel dengan kaliper digital dan dihitung reratanya. Rerata dan standar deviasi dimensi sampel pada kelompok kontrol yaitu tanpa perendaman dalam larutan desinfektan (A) adalah 20,008 ± 0,020 mm. Rerata dan standar deviasi sampel pada kelompok perendaman dalam sodium hipoklorit 0,5% selama 5 menit (B) adalah 20,277 ± 0,036 mm. Rerata dan standar deviasi sampel pada kelompok perendaman dalam sodium hipoklorit 0,5% selama 10 menit (C) adalah 20,489 ± 0,029 mm. Rerata dan standar deviasi sampel pada kelompok perendaman dalam glutaraldehid 2% selama 5 menit (D) adalah 20,385 ± 0,022 mm. Rerata dan standar deviasi sampel pada kelompok perendaman dalam glutaraldehid 2% selama 10 menit (E) adalah 20,670 ± 0,031 mm. Rerata dan standar deviasi dimensi cetakan alginat tanpa dan sesudah direndam dalam sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit dapat dilihat pada tabel 5.
Tabel 5. Dimensi cetakan alginat tanpa dan sesudah direndam dalam sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit.
Dimensi Cetakan Alginat (mm) Tanpa
perendaman
Sesudah perendaman
Dimensi Cetakan Alginat (mm) Tanpa
perendaman
Sesudah perendaman
Sodium hipoklorit 0,5% Glutaraldehid 2% No Kelompok
Untuk mempermudah dalam melihat nilai rerata dimensi cetakan alginat tanpa dan sesudah direndam dalam sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit digambarkan dalam grafik batang. (Grafik 1)
Grafik 1. Grafik dimensi cetakan alginat tanpa dan sesudah direndam dalam
sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit.
Keterangan :
A:tanpa perendaman dalam larutan desinfektan
B: perendaman dalam sodium hipoklorit 0,5% selama 5 menit C: perendaman dalam sodium hipoklorit 0,5% selama 10 menit D: perendaman dalam glutaraldehid 2% selama 5 menit
4.2 Pengaruh Perendaman Cetakan Alginat Dalam Sodium Hipoklorit
0,5% dan Glutaraldehid 2% Selama 5 dan 10 Menit Terhadap Perubahan
Dimensi.
Pengaruh perendaman cetakan alginat dalam larutan sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit terhadap perubahan dimensi dianalisis dengan uji One Way Anova. Sebelum dilakukan pengujian dengan uji One Way Anova, terlebih dahulu dilakukan uji normalitas data dengan menggunakan uji
Saphiro-Wilk untuk mengetahui bahwa data kelompok A, B, C, D dan E adalah
Pada tabel 6 dari hasil uji One Way Anova, diperoleh signifikansi p = 0,0001 (p < 0,05), hal ini berarti ada pengaruh yang signifikan perendaman cetakan alginat dalam larutan sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit.
4.3 Perbedaan Pengaruh Yang Signifikan Antara Perendaman Cetakan
Alginat Dalam Sodium Hipoklorit 0,5% dan Glutaraldehid 2% Selama 5 dan 10
Menit Terhadap Perubahan Dimensi.
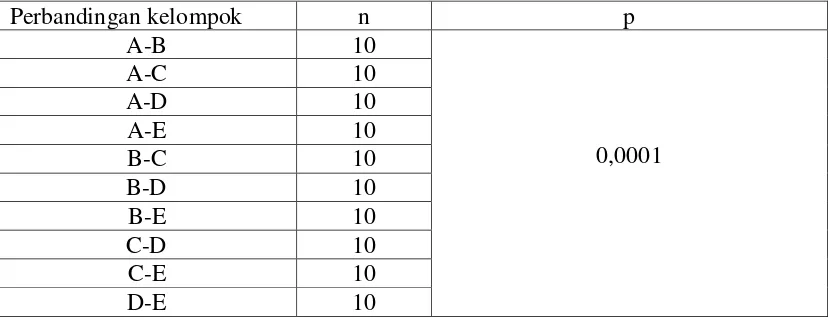
Setelah dilakukan uji One Way Anova, selanjutnya dilakukan uji LSD (Least Significant Difference) untuk mengetahui pasangan perlakuan mana yang bermakna. Hasil uji LSD pada penelitian ini menunjukkan adanya perlakuan yang bermakna
Tabel 7. Uji Post hoc LSD perendaman cetakan alginat dalam sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit terhadap perubahan dimensi.
Perbandingan kelompok n p
BAB 5
PEMBAHASAN
Rancangan penelitian yang digunakan pada penelitian ini adalah eksperimental laboratoris yaitu kegiatan percobaan yang bertujuan untuk mengungkapkan suatu gejala atau pengaruh yang timbul akibat adanya perlakuan tertentu. Penelitian ini untuk melihat kemungkinan adanya pengaruh antara beberapa kelompok penelitian dengan cara memberikan perlakuan kepada satu atau lebih kelompok penelitian, kemudian hasil dari kelompok yang diberi perlakuan tersebut dibandingkan dengan kelompok kontrol.33
5.1 Dimensi Cetakan Alginat Tanpa dan Sesudah Direndam Dalam
Sodium Hipoklorit 0,5% dan Glutaraldehid 2% Selama 5 dan 10 Menit.
menggunakan alginator untuk mengaduk alginat. Oleh karena itu, terjadinya human error di dalamnya serta tidak mencapai tingkat keakuratan yang lebih tinggi.
Nilai rerata dan simpangan baku kelompok A adalah 20,0080 ± 0,01989 mm. Nilai rerata dan simpangan baku kelompok B adalah 20,2770 ± 0,03561 mm. Nilai rerata dan simpangan baku kelompok C adalah 20,4890 ± 0,02923 mm. Nilai rerata dan simpangan baku kelompok D adalah 20,3850 ± 0,02173 mm. Nilai rerata dan simpangan baku kelompok E adalah 20,6700 ± 0,03091 mm. Hal ini menunjukkan perubahan stabilitas dimensi kelompok E yang paling tinggi dibandingkan dengan kelompok lain sedangkan perubahan stabilitas dimensi kelompok A paling rendah dibandingkan dengan kelompok lain. Perbedaan ini berlaku karena kandungan air dalam larutan desinfektan yang berbeda, misalnya glutaraldehid 2% mempunyai kandungan air yang tinggi dibanding dengan sodium hipoklorit 0,5%. Oleh karena itu, perubahan dimensi pada kelompok E lebih tinggi dibandingkan dengan kelompok lain. Selain daripada ini, lama perendaman juga mempengaruhi perubahan dimensi cetakan alginat, waktu perendaman cetakan alginat dalam larutan desinfektan meningkat, perubahan dimensi cetakan juga meningkat. Oleh karena itu, perubahan dimensi pada kelompok E tinggi dibanding dengan kelompok D walaupun direndam dalam larutan desinfektan yang sama.
penggunaan larutan desinfektan yang berbeda baik jenis maupun konsentrasi dan juga metode pengukurannya. Pada penelitian Panza, dkk (2006) dan Oderinu, dkk (2007), konsentrasi sodium hipoklorit yang dipakai lebih besar yaitu 1%. Semakin besar konsentrasi yang ada pada larutan desinfektan semakin sedikit kandungan air didalamnya sehingga mempengaruhi penyerapan air pada cetakan alginat.
5.2 Pengaruh Perendaman Cetakan Alginat Dalam Sodium Hipoklorit
0,5% dan Glutaraldehid 2% Selama 5 dan 10 Menit Terhadap Perubahan
Dimensi.
Sebelum dilakukan uji statistik, terlebih dahulu dilakukan uji Levene untuk mengetahui homogenitas data dan diperoleh hasil uji homogenitas menunjukkan nilai 1,555 dengan tingkat signifikansi p = 0,203 (p > 0,05). Nilai ini menunjukkan data yang diperoleh homogen. Setelah uji homogenitas, kemudian dilakukan uji One Way Anova. Hasil uji menunjukkan signifikansi p = 0,0001 ( p < 0,05) pada perubahan stabilitas dimensi. Nilai ini menunjukkan adanya pengaruh perendaman cetakan alginat yang direndam dalam larutan sodium hipoklorit 0,5% dan glutaraldehid 2% selama 5 dan 10 menit.
5.3 Perbedaan Pengaruh yang signifikan antara Perendaman Cetakan
Alginat Dalam Sodium Hipoklorit 0,5% dan Glutaraldehid 2% Selama 5 dan 10
Menit Terhadap Perubahan Dimensi.
Hasil uji LSD pada tabel 7 menunjukkan adanya perbedaan pengaruh yang bermakna antar semua kelompok, yaitu kelompok A dengan kelompok B dengan nilai p = 0,0001 (p < 0,05), kelompok A dengan kelompok C dengan nilai p = 0,0001 (p < 0,05), kelompok A dengan kelompok D dengan nilai p = 0,0001 (p < 0,05), 0,05) dan kelompok D dengan kelompok E dengan nilai p = 0,0001 (p < 0,05).
melakukan penelitian tentang efek antimikroba sodium hipoklorit 0,525% menyimpulkan bahwa penggunaan sodium hipoklorit 0,525% pada bahan cetak alginat sangat efektif dan telah mendesinfeksi 96,6% dari total sampel.6 Aeran H, dkk (2010) membuktikan bahwa sodium hipoklorit 0,5% menunjukkan efektivitas yang sangat signifikan terhadap organisme gram positif dan gram negatif.
BAB 6
KESIMPULAN DAN SARAN
6.1 Kesimpulan
Berdasarkan hasil penelitian yang telah dilakukan, maka dapat disimpulkan bahwa:
1. Nilai rerata dan standar deviasi dimensi cetakan alginat tanpa direndam dalam larutan desinfektan adalah 20,0080 ± 0,01989 mm, sedangkan direndam dalam larutan sodium hipoklorit 0,5% selama 5 menit adalah 20,2770 ± 0,03561 mm, dalam larutan sodium hipoklorit 0,5% selama 10 menit adalah 20,4890 ± 0,02923 mm, dalam larutan glutaraldehid 2% selama 5 menit adalah 20,3850 ± 0,02173 mm dan dalam larutan glutaraldehid 2% selama 10 menit adalah 20,6700 ± 0,03091 mm.
2. Ada pengaruh yang signifikan perendaman cetakan alginat dalam sodium hipoklorit 0,5% selama 5 menit dengan nilai p = 0,0001 (p < 0,05), sodium hipoklorit 0,5% selama 10 menit dengan nilai p = 0,0001 (p < 0,05), dalam glutaraldehid 2% selama 5 menit dengan nilai p = 0,0001 (p < 0,05) dan dalam glutaraldehid 2% selama 10 menit dengan nilai p = 0,0001 (p < 0,05) terhadap perubahan dimensi.
Dari hasil penelitian ini dapat disimpulkan bahwa perubahan dimensi yang minimal pada cetakan alginat yang direndam dalam larutan sodium hipoklorit 0,5% selama 5 menit dibandingkan dengan glutaraldehid 2%.
6.2 Saran
1. Diperlukan penelitian lebih lanjut untuk mengetahui pengaruh pemakaian bahan desinfektan terhadap perubahan dimensi cetakan alginat dengan menggunakan alat pengukur yang berbeda misalnya computerized digital calipers.
2. Diperlukan penelitian lebih lanjut untuk mengetahui pengaruh pemakaian larutan sodium hipoklorit 0,5% dan glutaraldehid 2% dengan metode penyemprotan.
3. Penelitian ini hanya menggunakan metode dan peralatan yang sederhana seperti cara mengaduk alginat yang masih manual dengan menggunakan rubber bowl
DAFTAR PUSTAKA
1. Hatrick CD, Eakle WS, Bird WF. Dental Material: Clinical Applications for Dental Assistants and Dental hygienists. 2th ed. St Louis: Saunders Elsevier, 2011: 176-177, 179-182, 190-1.
2. Power JM, Wataha JC. Dental Materials: Properties and Manipulation. 9th ed. St Louis: Mosby Elsevier, 2008: 169,172-80.
3. Power JM, Sakaguchi RL. Craig’s: Restorative Dental Material. Ed 12th. St Louis: Elsevier, 2009: 270-9.
4. Phillips RW. Science of Dental Material. 11th ed. Missouri: Mosby Elsevier, 2009: 207, 239-47.
5. Bhat VS, Shetty MS, Shenoy KK. Infection Control in The prosthodontics Laboratory. The Journal of Indian Prosthodontics Society 2007; 7(2): 62-5. 6. Gharamanloo A, Sadeghian A, Sohrabi K, Bidi A. A Microbiologic
Investigation Following the Disinfection of Irreversible Hydrocolloid Materials Using the Spray Method. J Calif Dent Assoc 2009; 37: 471-7. 7. British Dental Association. Advice Sheet: Infection Control in Dentistry.
London 2003: 10.
8. Pang SK, Miller BJ. Cross Infection Control of Impressions a Questionaire
Survey of Practice Among Private Dentists in Hong Kong. Hong Kong Dental
Journal 2006; 3: 89-93.
9. Muzaffar D, Braden M, Parker S, Patel MP. The effect of disinfecting solutions on the dimensional stability of dental alginate impression materials. Dental material 2012; 28(7): 749-55
11. Saber FS, Abolfazli N, Kohsoltani M. The Effect of Disinfection by Spray Atomization on Dimensional Accuracy of Condensation Silicone Impressions.
JODDD 2010; 4(4): 124-9.
12. Oderinu OH, Adegbulugbe IC, Shaba OP. Comparison of The Dimensional Stability of Alginate Impressions disinfected with 1% Sodium Hypochlorite
Using The Spray or Immersion Method. Nig Q J Hosp Med 2007; 17(2):
69-73.
13. Rad FH, Ghaffari T, Safavi SH. In Vitro Evalution of Dimensional Stability of Alginate Impressions After Disinfection by Spray dan Immersion Methods.
JODDD 2010; 4(4): 130-5.
14. Hiraguchi H, Kaketani M, Hirose H, Yoneyama T. The Influence of Storing Alginate Impressions Sprayed with Disinfectant on Dimensional Accurancy and Deformation of Maxillary Edentulous Stone Models. Dent Mat J 2010; 29(3): 309-15.
15. Amin WM et al. The Effect of Disinfectants on Dimensional Accuracy and Surface Quality of Impression materials and Gypsum Casts. J Clin Med Res 2009; 1(2): 81-9.
16. Imbery TA, Nehring J, Janus C, Moon PC. Accuracy and Dimensional Stability of Extended Pour and Convetional Alginate Impression Materials. J Am Dent Assoc 2010; 141:32-9.
17. Panza, Vadenal LD. Evaluation of Dimensional Stability of Impression Materials Immersed in Disinfectant Solution Using a Metal Tray. PUCRS 2006; 21(53): 261-5.
18. Vodjani M, Derafshi R. Evaluation of Dimensional Stability of Iralgin and Alginoplast Alginates After Disinfectant by Sodium Hypochlorite 5,2% with Immersion and Spraying Methods. J Dental Medicine 2006; 18(4): 87-94. 19. Rodrigues SB, Augusto CR, Leitune VCB, Samuel SMW, Collares FM.
Influence of delayed pouring on irreversible hydrocolloid properties. Braz Oral Res. 2012: 404-9.
21. Kohli A, Puttaiah R. Infection Control & Occupational Sefety Recommendations For Oral Health Professionals: Dental Concil of India, 2007: 46-51.
22. Rutala W, Webber D. Guidelines for Disinfection and Sterilization in Health Care Facilities. Healthcare Infection Control Practices Advisory Committee.
2008: 39-42.
23. Miller CH, Palenik CJ. Infection Control and Management of Hazardous Materials For The Dental Team. 3rd ed, St Louis: Mosby Elsevier, 2005: 309-10.
24. Fong D, Barn P. Cleaning, Disinfection and Sterilization at Personal Service Establishment. National Colaborating Centre for Enviromental. 2011: 1-12. 25. BC Ministry of Health. Best Practice Guidelines for Cleaning, Disinfection
and Sterilization of Critical and Semi-critical Medical Device. Toronto 2011: 11, 39-42.
26. Drovak G, Roth J, Amass S. Disinfection 101. IOWA: Center For Food Security and Public Health. 2005: 1-22.
27. Badrian H, Ghasemi E, Khalighinejad N, Hosseini N. The Effect of Three Different Disinfection Materials on Alginate Impression by Spray Method.
ISRN Dentistry 2012: 1-5.
28. Memarian M, Fazeli MR, jamalifar H, Azimnejad A. Disinfection Efficiency of Irreversible hydrocolloid Impressions Using Different Concentrations of Sodium Hypochlorite: Apilot Study. J Contemp Dent Pract 2007; 8(4): 27-34. 29. Aeran H, Jurel SK, Dhobhal A. Antimicrobial Efficacy of Spray Disinfectants
on Dental Impressions. Indian Journal of Dental Sciences 2010; 10-3.
30. Souse JC et al. The Effect of Water and Sodium Hypochlorite Disinfection on Alginat Impressions. Rev Port Estomatol Med Dent Cir Maxlofac. 2013; 54(1): 8-12.
32. Siswomihardjo W. Perubahan Dimensi Cetakan Alginat Setelah Direndam Dalam Air Sirih 25%. Jurnal Kedokteran Gigi Indonesia. 1994; 43(1): 69-71. 33. Notoatmodjo S. Metodologi Penelitian Kesehatan.Jakarta: PT Rineka Cipta,
Lampiran 2
Dimensi Cetakan Alginat Kelompok A (mm)
No 1 2 3 Rata-rata
Dimensi Cetakan Alginat Kelompok B (mm)
No 1 2 3 Rata-rata
Dimensi Cetakan Alginat Kelompok C (mm)
Dimensi Cetakan Alginat Kelompok D (mm)
No 1 2 3 Rata-rata
1 20,37 20,38 20,37 20,37
2 20,35 20,36 20,36 20,36
3 20,40 20,41 20,40 20,40
4 20,40 20,40 20,41 20,41
5 20,38 20,39 20,40 20,39
6 20,38 20,38 20,38 20,38
7 20,41 20,42 20,42 20,42
8 20,38 20,35 20,36 20,35
9 20,38 20,38 20,39 20,38
10 20,38 20,39 20,39 20,39
Dimensi Cetakan Alginat Kelompok E (mm)
No 1 2 3 Rata-rata
1 20,70 20,70 20,71 20,70
2 20,65 20,63 20,63 20,64
3 20,63 20,65 20,65 20,64
4 20,70 20,72 20,70 20,71
5 20,65 20,65 20,65 20,65
6 20,72 20,69 20,68 20,70
7 20,63 20,64 20,63 20,63
8 20,69 20,70 20,70 20,70
9 20,68 20,67 20,68 20,68
Lampiran 3
*. This is a lower bound of the true significance.
Varianc homogen, p>0,05
Ada beda p<0,05 (p=0,000), lanjut uji LSD
E -.28500* .01256 .000 -.3103 -.2597
E A .66200* .01256 .000 .6367 .6873
B .39300* .01256 .000 .3677 .4183
C .18100* .01256 .000 .1557 .2063
D .28500* .01256 .000 .2597 .3103