BAB 2
TINJAUAN PUSTAKA
2.1 Diabetes Mellitus 2.1.1 Definisi
Diabetes mellitus (DM) adalah suatu penyakit metabolik yang ditandai dengan hiperglikemia kronik dengan gangguan metabolisme karbohidrat, lemak dan protein, yang terjadi karena kelainan sekresi insulin, disfungsi insulin atau keduanya. Hiperglikemia kronik pada DM berhubungan dengan kerusakan jangka panjang, disfungsi atau kegagalan beberapa organ tubuh, terutama mata, ginjal, saraf, jantung, dan pembuluh darah (ADA, 2016; Purnamasari, 2009; Amod et al., 2012).
2.1.2 Klasifikasi
DM dapat diklasifikasikan menjadi empat kategori klinis, yaitu (ADA, 2016; PERKENI, 2011);
1. Diabetes melitus tipe 1, ditandai dengan adanya defisiensi insulin absolut akibat destruksi sel β pankreas yang dapat disebabkan oleh autoimun maupun idiopatik.
2. Diabetes melitus tipe 2, ditandai dengan adanya defisiensi insulin relatif atau resistensi insulin.
3. Diabetes melitus pada kehamilan (gestasional), dimana intoleransi glukosa didapati pertama kali pada masa kehamilan, biasanya pada usia kehamilan trimester kedua atau ketiga, yang belum dapat diketahui dengan pasti kaitannya terhadap diabetes.
4. Diabetes melitus akibat penyakit spesifik lain, seperti sindrom diabetes monogenik (misalnya diabetes neonatal, MODY (maturity-onset diabetes of the young), penyakit pankreas (misalnya fibrosis
2.1.3 Gejala klinis dan diagnosis DM
PERKENI (2011) membagi alur diagnosis DM menjadi dua bagian besar (Tabel 2.1) berdasarkan ada tidaknya gejala khas DM. Gejala khas DM terdiri dari poliuri, polidipsi, polifagia, dan penurunan berat badan tanpa sebab yang jelas, sedangkan gejala tidak khas DM diantaranya lemas, kesemutan, luka yang sulit sembuh, gatal, mata kabur, disfungsi ereksi dan pruritus vulva. Apabila ditemukan gejala khas DM, pemeriksaan glukosa darah abnormal satu kali saja sudah cukup untuk menegakkan diagnosis, namun apabila tidak ditemukan gejala khas DM, maka diperlukan dua kali pemeriksaan glukosa darah abnormal.
Tabel 2.1 Kriteria diagnosis Diabetes Mellitus
No Kriteria Diagnosis
1 Gejala klasik DM + glukosa plasma sewaktu ≥ 200 mg/dl (11,1 mmol/L)
Glukosa plasma sewaktu merupakan hasil pemeriksaan sesaat pada suatu hari tanpa memperhatikan waktu makan terakhir. 2 Atau, Gejala klasik DM + glukosa plasma puasa ≥ 126 mg/dl (7,0
mmol/L)
Puasa diartikan pasien tidak mendapatkan kalori tambahan sedikitnya 8 jam.
3 Glukosa plasma 2 jam pada TTGO (Test Toleransi Glukosa Oral)
≥ 200 mg/dl (11,1 mmol/L)
TTGO dilakukan dengan standar WHO, menggunakan beban glukosa yang setara dengan 75 gram glukosa anhidrus yang dilarutkan ke dalam air. Hasil pemeriksaan glukosa darah 2 jam setelah pembebanan: < 140 mg/dl Normal, 140 - < 200 mg/dl Toleransi Glukosa Terganggu, ≥ 200 mg/dl DM
American Diabetes Association (ADA) (2016) dan American Association of Clinical Endocrinologists (AACE) (2015) memasukkan
pemeriksaan HbA1C (hemoglobin glikosilat) sebagai salah satu kriteria
2.2 Anatomi dan Histologi Koklea
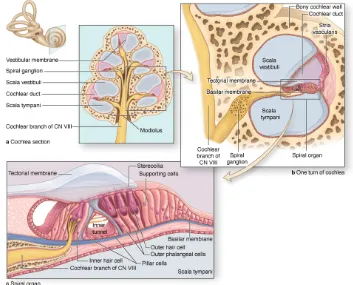
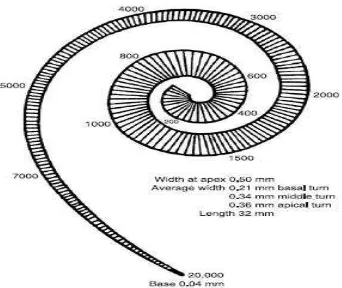
Koklea merupakan saluran tulang yang menyerupai cangkang siput dan bergulung 2,5 sampai 3 kali putaran, panjangnya kurang lebih 35 mm dengan sumbu panjang dari arah anterior ke posterior. Pusat koklea disebut modiolus, dan terletak di depan vestibulum. Koklea bersama dengan organ vestibuler berada dalam tulang temporal, dan merupakan salah satu tulang paling keras dalam tubuh manusia. Koklea bersama organ vestibuler sering disebut dengan labirin (Moller, 2006; Pawlowsky, 2004; Weber & Khariwala, 2014).
Koklea terdiri dari tiga ruang yaitu skala vestibuli, skala media, dan skala timpani. Skala media mempunyai penampang segitiga. Dasar segitiga tersebut dikenal dengan nama membran basilaris yang menjadi dasar dari organ korti (Gambar 2.1) (Moller, 2006; Weber & Khariwala, 2014).
Koklea pada telinga dalam mengandung sel-sel yang berperan terhadap persepsi suara. Koklea terdiri dari labirin tulang, dimana didalamnya terdapat labirin membran. Termasuk di dalam labirin tulang adalah kapsul otik yang merupakan batas luar dari koklea dan modiolus yaitu tabung tulang yang membentuk sumbu pusat koklea dan mengandung serat saraf auditori dan sel-sel ganglionnya. Stria vaskularis dan ligamentum spiralis terdapat dekat dengan tulang sepanjang dinding lateral koklea. Organ Corti, yang mengandung sel rambut (3 sel rambut luar dan 1 sel rambut dalam) sebagai sel sensoris dan sel penyokong, berbentuk spiral pada membran basilaris (Nagashima et al., 2005).
Di dalam organ Corti terdapat sel-sel Hensen, sel-sel Deiters, sel-sel pilar, sel-sel batas dalam, sel-sel rambut luar serta sel-sel rambut dalam, sulkus dalam dan limbus spiralis yang berisi sel-sel interdental dan membran tektorial (Gambar 2.1). Medial dari lamina spiralis pars osseus terdapat kanalis Rosental yang berisi ganglion spiralis dan berhubungan dengan modiolus (Moller, 2003; Guyton & Hall, 2006; Gillespie, 2006). Skala vestibuli dan skala timpani adalah labirin tulang dari koklea yang berisi cairan perilimfe. Skala vestibuli dan skala timpani saling berhubungan di helikotrema pada apeks koklea. Pada bagian basis koklea skala vestibuli berakhir di foramen ovale dan skala timpani pada foramen rotundum. Skala media yang berisikan cairan endolimfe berada di antara skala vestibuli dan skala timpani (Lonsbury, Martin & Luebke, 2003; Moller, 2003; Guyton & Hall, 2006).
Tabel 2.2 Komposisi Cairan Koklea
Komponen Endolimfe Skala Vestibuli Skala Timpani
Na (mM) 1.3 141 148
K (mM) 157 6 4.2
Ca (mM) 0.023 0.6 1.3
HCO3 (mM) 31 21 21
Cl (mM) 132 121 119
Protein (mg/dl) 38 242 178
pH 7.4 7.3 7.3
Stria vaskularis terdiri dari 3 lapisan sel yaitu sel marginal, sel intermediet dan sel basal. Sel-sel stria vaskularis merupakan satu-satunya sel yang berhubungan dengan pembuluh darah di koklea. Stria vaskularis bertanggung jawab dalam menjaga konsentrasi ion kalium dalam cairan endolimfe tetap tinggi dan menjaga potensial endolimfe skala media positif tetap tinggi (Pawlowsky, 2004; Gillespie, 2006).
Membran basilaris adalah struktur fibrosa yang berlapis-lapis dari lamina spiral pars osseus ke ligamentum spiralis. Elastisitas membran basilaris bervariasi di sepanjang koklea dari kekakuan dan kelebarannya. Membran basilaris tampak kaku dan sempit di daerah basis koklea dan tampak lebih fleksibel dan luas di daerah apeks koklea (Gambar 2.3) (Moller, 2003; Pawlowsky, 2004; Gillespie, 2006).
Organ Corti merupakan rumah dari sel sensoris pendengaran (Pawlowsky, 2004). Organ Corti terletak di sepanjang membran basilaris, dan menonjol dari basis ke apeks koklea (Despopoulos & Silbernagl, 2008). Ukuran organ Corti bervariasi secara bertahap dari basis koklea ke apeks koklea. Organ Corti di basal lebih kecil sedangkan organ Corti di apeks koklea lebih besar (Guyton & Hall, 2006). Organ Corti terdapat sel-sel yang terdiri dari sel-sel sensoris (sel-sel rambut dalam dan sel-sel rambut luar), sel pendukung (sel Deiters, sel Phalangeal dalam), ujung saraf aferen (ganglion spiral tipe 1 dan 2) dan eferen (olivokoklear medial dan lateral), sel pilar dalam dan luar dan sel Hensen (Moller, 2003; Guyton & Hall, 2006; Gillespie, 2006).
Gambar 2.3. Model Membran Basilaris dengan Organ Corti
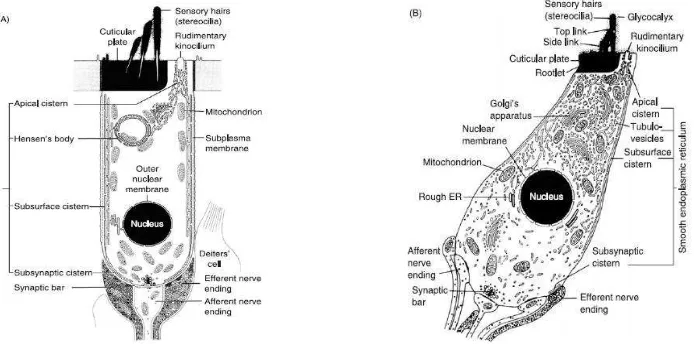
Sel rambut merupakan sel sensoris yang menghasilkan impuls saraf dalam menanggapi getaran membran basilaris. Di organ Corti terdapat 1 deret sel rambut dalam dan 3 deret sel rambut luar. Ada sekitar 4.000 sel rambut dalam dan 12.000 sel rambut luar (Pawlowsky, 2004; Gillespie, 2006). Bentuk dari sel rambut dalam seperti botol dan ujung sarafnya berbentuk piala yang menyelubunginya, sedangkan bentuk dari sel rambut luar seperti silinder dan ujung sarafnya hanya pada basis sel (Gambar 2.4) (Moller, 2003; Pawlowsky, 2004).
Badan sel dari kedua sel rambut ini berisikan banyak vesikula dan mitokondria dan di dinding lateralnya terdapat semacam protein membran yang dikenal sebagai prestin sebagai motor sel. Selain itu pada bahan sel rambut luar terdapat retikulum endoplasma di sepanjang dinding lateralnya yaitu apical cistern, Hensen body, subsurface cistern dan subsynaptic cistern (Moller, 2003; Gillespie. 2006; Probst, Greves & Iro, 2006).
Gambar 2.4 Skema Potong Lintang Sel Rambut Luar (A) dan Sel Rambut Dalam (B)
Ujung dari sel rambut terdapat berkas serabut aktin yang membentuk pipa dan masuk ke dalam lapisan kutikuler stereosilia (Gambar 2.5) (Pawlowsky, 2004). Stereosilia dari sel rambut dalam tidak melekat pada membran tektorial dan berbentuk huruf U sedangkan stereosilia dari sel rambut luar kuat melekat pada membran tektorial atasnya dan berbentuk huruf W (Gambar 2.5) (Pawlowsky, 2004).
Gambar 2.5 Sel Rambut Luar dan Dalam Dilihat dengan Mikroskop Elektron
Pada bagian ujung dari stereosilia terdapat filamen aktin yang terpilin, filamen tersebut nantinya akan dikenal sebagai tip link (Gillespie, 2006). Tip link menghubungkan ujung stereosilia dengan ujung stereosilia yang
sebuah penghalang yang kuat antara endolimfe dan perilimfe (Moller, 2003; Pawlowsky, 2004; Moller, 2005; Gillespie, 2006).
Membran tektoria adalah struktur seperti gel yang terdiri dari kolagen, protein dan glukosaminoglikan. Membran tektoria terletak di dekat permukaan lamina retikuler dari organ Corti. Membran tektoria kontak langsung dengan sel rambut luar. Sedangkan untuk sel rambut dalam tidak berkontak secara langsung dengan membran tektorial (Moller, 2003).
2.3 Fisiologi Pendengaran
Getaran suara dihantarkan lewat liang telinga dan telinga tengah ke telinga dalam melalui footplate dari stapes, menimbulkan suatu gelombang yang berjalan di sepanjang cairan koklea yang akan menggerakkan membran basilaris dan organ Corti. Puncak gelombang yang berjalan di sepanjang membran basilaris yang panjangnya 35 mm tersebut, ditentukan oleh frekuensi gelombang suara. Hal ini berakibat melengkungnya stereosilia, dengan demikian menimbulkan depolarisasi sel rambut dan menciptakan potensial aksi pada serabut-serabut saraf pendengaran yang melekat padanya. Di sinilah gelombang suara mekanis diubah menjadi energi elektrokimia agar dapat ditransmisikan melalui saraf kranialis ke-8 (Moller, 2006; Gacek, 2009).
2.4 Gangguan Pendengaran pada Diabetes Mellitus
Hubungan antara DM dengan gangguan pendengaran telah diteliti sejak berabad yang lalu. Dilaporkan bahwa gangguan pendengaran yang berkaitan dengan DM mencapai 93%. Gangguan pendengaran pada DM digambarkan memiliki karakteristik progresif, bilateral, sensorineural dengan onset bersifat gradual yang secara dominan mengenai frekuensi tinggi (Cullen & Cinnamond, 1993; Maia & de Campos, 2005; Aladag et al., 2009; Malucelli et.al, 2012).
Gangguan pendengaran sensorineural pada penderita DM dikaitkan dengan mikroangiopati pada telinga dalam, degenerasi neuronal dan diabetik ensefalopati, meskipun temuan mengenai hal tersebut masih sering diperdebatkan dan inkonsisten. Gangguan pendengaran pada penderita DM dapat juga merupakan akibat dari kekacauan metabolisme glukosa serta peningkatan stres oksidatif (Kakarlapudi, Sawyer & Staecker, 2003; Aladag et al., 2009).
Angiopati diabetik memiliki karakteristik berupa proliferasi endotelial, akumulasi glukoprotein pada lapisan intima pembuluh darah, dan penebalan membran basal kapiler serta pembuluh - pembuluh darah kecil. Selain itu juga dijumpai penebalan dan fibrosis dinding kapiler serta penyempitan lumen arteri auditorius interna (Maia & de Campos, 2005; Malucelli et.al., 2012). Penelitian mengenai hal ini sudah dilakukan, baik pada hewan coba maupun pada manusia. Penelitian oleh Fukushima et.al (2006) yang mempelajari tulang temporal manusia penderita DM menunjukkan adanya penebalan membran basilaris dan stria vaskularis, terutama pada dinding pembuluh darah stria vaskularis bagian basal selain itu juga didapati hilangnya sel rambut luar yang signifikan.
Telah dilaporkan bahwa gangguan metabolisme glukosa dan insulin mempengaruhi mikrosirkulasi. Diketahui bahwa agar telinga bagian dalam berfungsi dengan baik harus ada keseimbangan yang baik antara tingkat insulin dan glukosa. Pasien DM memiliki glukosa dalam darah, tetapi tidak bisa masuk sel-sel telinga bagian dalam karena kurangnya insulin sehingga menghasilkan gangguan fungsional. Hal ini mungkin merupakan faktor etiologi penting dalam kerusakan labirin. Mekanisme utama yang mendasari adalah gangguan transportasi nutrisi melalui dinding kapiler yang menebal, pengurangan aliran darah karena penyempitan pembuluh darah, dan degenerasi sekunder saraf vestibulokoklear yang menyebabkan neuropati (Aladag et al., 2009).
Fukushima et al. (2006) meneliti efek DM terhadap koklea manusia dan menyimpulkan bahwa pasien DM tipe 1 mungkin mengalami mikroangiopati koklea dan degenerasi dinding lateral koklea serta sel-sel rambut. Metabolisme glukosa secara signifikan mempengaruhi telinga dalam. Baik kadar gula yang rendah maupun tinggi dapat mempengaruhi fungsi telinga dalam. Pasien dengan gangguan metabolisme glukosa mungkin memiliki gejala gangguan pendengaran, vestibular, atau campuran keduanya.
Telinga dalam memperlihatkan aktivitas metabolik yang intens, tetapi tidak memiliki kemampuan untuk menyimpan energi. Oleh sebab itu perubahan kecil kadar gula mempengaruhi fungsi telinga dalam. Gangguan metabolisme telinga dalam, baik akibat pelepasan insulin oleh pankreas atau perubahan reseptor membran sel, cenderung mengakibatkan pergeseran kalium dari endolimfe ke perilimfe dan sebaliknya pada natrium, dimana mekanisme tersebut memicu timbulnya vertigo, tinitus, dan gangguan pendengaran (Aladag et al., 2009, Maluceli et al., 2012).
Penurunan pendengaran terutama terjadi pada frekuensi tinggi. Hal ini kemungkinan berkaitan dengan kurangnya glikogen jaringan sebagai sumber energi pada penderita DM. Proses transduksi pada organ korti membutuhkan energi (ATP) yang bersumber dari glikogen (Tan, Chow & Metz, 2002).
Faktor yang menyebabkan penurunan pendengaran pada frekuensi tinggi yang terjadi pada penderita DM tipe-2 adalah sebagai berikut (Kakarlapudi, Sawyer & Staecker, 2003):
1. Sel-sel rambut luar mengandung glikogen lebih banyak dari pada sel-sel rambut dalam, dan jumlahnya di bagian basal lebih sedikit dibandingkan di bagian apeks
3. Potensial endolimfatik pada bagian basal lebih tinggi sehingga memerlukan energi lebih banyak.
4. Skala timpani pada bagian basal lebih besar sehingga kebutuhan akan sumber energi eksternal (glukosa) dan oksigen lebih besar. Meskipun sel sel rambut dapat menggunakan substrat selain glukosa (seperti glutamat, piruvat, atau fumarat) untuk mempertahankan potensial endolimfatik, namun glukosa merupakan substrat yang paling efektif.
2.5 Respon Stres Oksidatif Seluler
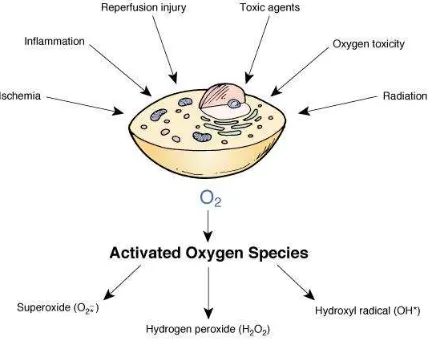
Radikal bebas adalah partikel dari suatu molekul atau atom yang mengandung gugusan elektron yang tidak berpasangan dan bersifat sangat reaktif serta cenderung melepaskan atau menerima elektron dari jaringan sekitarnya (Sarma, Mallick & Ghosh, 2010). Di dalam tubuh organisme, pembentukan radikal bebas dapat berasal dari metabolisme molekul oksigen. Reaksi-reaksi metabolisme pada umumnya merupakan reaksi oksidasi reduksi. Oksidasi adalah reaksi yang melepaskan elektron, sedangkan reduksi adalah reaksi yang menerima elektron.
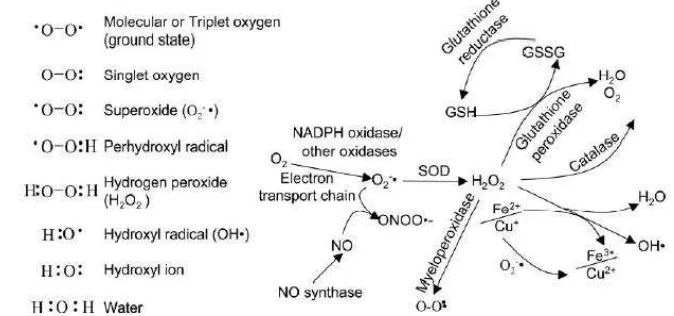
Gambar 2.6. Sumber Radikal Bebas
Dalam metabolisme aerobik, radikal bebas terpenting yang terdapat dalam tubuh adalah derivat oksigen atau oksiradikal atau yang disebut
juga dengan Reactive Oxygen Species (ROS). Jenis jenis reactive species dapat dilihat pada tabel 2.3 (Halliwell, 2001; Weidinger & Kozlov,
direduksi sempurna menjadi air dalam mitokondria melalui 4 tahap reaksi
penambahan 1 elektron sebagai berikut (Granot & Kohen, 2004):
O2 + e- O2•- (radikal anion superoksida)
Peroksil RO2•contoh : peroksil lipid
Alkoksil RO•
Kation Nitronium (nitril) NO2+
Alkil peroksinitrit ROONO
Apabila oksigen hanya tereduksi sebagian, maka terbentuklah radikal
bebas dari oksigen. Radikal-radikal bebas tersebut diantaranya adalah
radikal anion superoksida (O2•-), hidrogen peroksida (H2O2), radikal
Ion-ion logam diketahui dapat mengkatalis reaksi pembentukan radikal
bebas. Ion-ion logam tersebut misalnya Fe, Cu, Mn, Cr, Ni, V, Zn dan Al.
Proses oksidasi yang dikatalisasi oleh ion-ion logam melalui 2 mekanisme
yaitu reaksi ion-ion logam dengan hidroperoksida atau dengan molekul
lipid (Reische, et al., 2008).
ROS dimetabolisme melalui reaksi reduksi-oksidasi seluler dan
dibentuk secara alamiah sebagai produk sampingan dalam proses
metabolik aerobik normal serta dinetralisir oleh scavenger enzimatik
berupa antioksidan endogen alamiah dalam tubuh, meliputi superoxide
dismutase (SOD), catalase (CAT) dan glutathione peroxidase (GPx), yang
berguna sebagai mekanisme proteksi terhadap produksi ROS (Evans &
Halliwell, 1999). Berbagai molekul ROS serta reaksi pembentukan dan
detoksifikasinya dapat dilihat pada gambar 2.7 berikut:
Gambar 2.7 Molekul ROS, Reaksi Formasi dan Detoksifikasinya
Dalam keadaan normal, ROS berada dalam keadaan seimbang
dengan antioksidan endogen alamiah tubuh. Ketidakseimbangan antara
kadar antioksidan dan ROS maupun ketidakmampuan antioksidan untuk
menghambat produksi ROS berlebih akan menyebabkan terjadinya stres
oksidatif yang mampu merusak sel (Sies, 1997).
Pada prinsipnya stres oksidatif dapat terjadi karena (Halliwell, 2001):
1. Kurangnya kadar antioksidan, misalnya mutasi genetik yang
mempengaruhi sistem pertahanan enzim antioksidan (seperti CuZnSOD,
kadar antioksidan (misalnya beberapa xenobiotik yang dimetabolisme
melalui konjugasi dengan GSH, sehingga dapat menyebabkan deplesi
GSH meskipun xenobiotik yang bersangkutan tidak secara langsung
mengasilkan reactive species). Rendahnya konsumsi antioksidan dan
konstituen esensial lainnya juga dapat menyebabkan stres oksidatif.
2. Peningkatan produksiROS/RNS, misalnya pada keadaan terpapar zat
toksik dosis tinggi yang besifat reaktif atau zat toksik yang dimetabolisme
dengan hasil sampingan atau hasil akhir berupa spesies reaktif, atau akibat peningkatan aktivitas metabolik “alami” yang menghasilkan ROS/RNS (misalnya pada penyakit inflamasi seperti artritis rematoid dan
kolitis ulserativa).
ROS dihasilkan dalam keadaan metabolik normal dengan konsentrasi
yang relatif rendah, yang berguna sebagai molekul sinyalisasi untuk fungsi
seluler normal guna mengendalikan homeostasis sel dan jaringan,
pembelahan, migrasi dan kontraksi sel serta produksi mediator-mediator
(Evans & Halliwell, 1999; Le Prell, et al., 2007; Poirrier, et al., 2010;
Uchida, et al., 2011; Rewerska, et al., 2013).
Radikal bebas dianggap berkontribusi terhadap kejadian berbagai
penyakit termasuk penyakit Alzheimer (Christen, 2000), penyakit
Parkinson (Wood-Kaczmar, Gandhi & Wood, 2006), diabetes (Giugliano,
Ceriello & Paolisso, 1996; Davi, Falco & Patrono, 2005), artritis reumatoid
(Hitchon & El-Gabalawy, 2004), dan penyakit motor neuron neurogeneratif
(Cookson & Shaw, 1999).
Radikal bebas yang menyebabkan kerusakan oksidatif pada DNA
diketahui dapat menyebabkan terjadinya kanker. Beberapa enzim
antioksidan seperti SOD, CAT, GPx, GR, GST, dan lain-lain mampu
melindungi DNA dari stres oksidatif. Terdapatnya polimorfisme pada
enzim-enzim ini berhubungan dengan kerusakan DNA dan kemudian
risiko individu terhadap kerentanan terjadinya kanker (Khan, et al., 2010).
Mekanisme pertahanan lini pertama terhadap ROS adalah
menghilangkan ROS atau mengubahnya menjadi radikal bebas yang
radikal anion superoksida (O2•-) menjadi hidrogen peroksida (H2O2)
dengan proses dismutasi. Dismutasi merupakan istilah yang mengacu
kepada tipe reaksi khusus dimana 2 reaksi yang sama namun berlawanan
terjadi pada 2 molekul yang terpisah. Enzim SOD mampu mengambil 2
molekul radikal anion superoksida (O2•-) lalu melepaskan elektron ekstra
pada salah 1 molekul dan menempatkannya pada molekul lainnya,
sehingga jumlah elektron yang dimiliki oleh salah 1 molekul menjadi
berkurang lalu membentuk molekul oksigen normal, sedangkan molekul
lainnya memiliki elektron ekstra. Molekul yang memiliki elektron ekstra
kemudian secara cepat mengambil 2 ion hidrogen untuk membentuk
hidrogen peroksida (H2O2). Selanjutnya, hidrogen peroksida (H2O2) akan
diubah menjadi molekul air (H2O) dan oksigen (O2) oleh CAT. Enzim GPx
akan turut membantu CAT dalam mengkonversi hidrogen peroksida
(H2O2) dan glutathione tereduksi (GSH) menjadi molekul air (H2O) serta glutathione teroksidasi (GSSG). Proses konversi yang dilakukan oleh CAT
dan GPx ini dianggap sebagai mekanisme pertahanan lini kedua. Guna
menyelesaikan siklus reaksinya, glutathione reductase (GR) kemudian
akan mereduksi glutathione teroksidasi (GSSG) dengan bantuan NADPH
dan ion hidrogen menjadi glutathione tereduksi (GSH) dan NADP+ (Gambar 2.7) (Evans & Halliwell, 1999; Goodsell, 2007).
2.5.1 Hidrogen Peroksida (H2O2)
Hidrogen peroksida atau dihidrogen dioksida adalah produk sampingan
berbahaya dari banyak proses metabolisme normal. Senyawa tersebut
memiliki rumus kimia H2O2 dengan massa molekul 34.0147 gram/mol dan
merupakan peroksida paling sederhana (senyawa dengan ikatan tunggal
oksigen-oksigen) (Gambar 2.8). Bentuk murninya berupa cairan tidak
berwarna serta memiliki viskositas yang sedikit lebih tinggi daripada air.
Hidrogen peroksida (H2O2) merupakan oksidator kuat dan digunakan
sebagai agen pemutih dan desinfektan. Bahkan, konsentrat hidrogen
peroksida (H2O2) atau disebut juga dengan high-test peroxide digunakan
sebagai bahan pembakar dalam peroketan. Organisme aerob secara
proses respiratory burst (oxidative burst) sebagai bagian dari respon imun.
Respiratory burst (oxidative burst) merupakan proses pelepasan ROS
secara cepat dari beberapa jenis sel imun seperti neutrofil dan monosit
saat mengadakan kontak dengan bakteri ataupun jamur. Mekanisme
tersebut memegang peranan berarti di dalam sistem imun dan merupakan
reaksi yang penting terjadi pada fagosit guna mendegradasi
partikel-partikel berbahaya dan mikroorganisme (Abrahams, Collin & Lipscomb,
1951; Giorgio, et al., 2007).
Hidrogen peroksida (H2O2) memiliki kandungan oksidator dan reduktor,
bergantung pada pH. Dalam suasana asam, hidrogen peroksida (H2O2)
merupakan salah satu oksidator paling kuat, bahkan lebih kuat dari
chlorine, chlorine dioxide, dan kalium permanganat. Selain itu, melalui
proses katalisis, hidrogen peroksida (H2O2) dapat mengalami konversi
menjadi radikal hidroksil (OH•) yang sangat reaktif. Pada larutan asam, ion logam Fe2+ akan mengalami oksidasi menjadi Fe3+ akibat peran hidrogen peroksida (H2O2) sebagai agen oksidator dan sulfite (SO32-) akan
teroksidasi menjadi sulfate (SO42-). Dalam suasana basa, hidrogen
peroksida (H2O2) berperan sebagai reduktor yang mereduksi beberapa ion
anorganik. Saat berperan sebagai agen reduktor, gas oksigen (O2) juga
akan dihasilkan. Pada larutan basa, natrium hipoklorit (NaOCl) akan
mengalami reduksi menjadi natrium klorida (NaCl) akibat peran hidrogen
peroksida (H2O2) sebagai agen oksidator dan kalium permanganat akan
tereduksi menjadi mangan dioksida (MnO2) (Abrahams, Collin &
Lipscomb, 1951; Giorgio, et al., 2007).
Untuk mencegah terjadinya kerusakan sel dan jaringan, hidrogen
peroksida (H2O2) harus cepat diubah menjadi zat yang kurang berbahaya
lainnya. CAT berperan dengan cepat untuk mengkatalisis dekomposisi
hidrogen peroksida (H2O2) menjadi molekul air (H2O) dan oksigen (O2)
yang tidak reaktif dengan bantuan enzim GPx yang turut mengkatalisis
penguraian hidrogen peroksida (H2O2) menjadi molekul air (H2O) (Gaetani,
et al., 1996).
Mitokondria diketahui memiliki kandungan enzim CAT yang rendah,
sehingga bila terdapat hidrogen peroksida (H2O2) dalam konsentrasi yang
tinggi secara in vivo, maka CAT tidak cukup berperan menghancurkan
senyawa tersebut, kecuali bila hidrogen peroksida (H2O2) tersebut
melakukan difusi ke dalam peroksisom. Senyawa hidrogen peroksida
(H2O2) merupakan salah satu senyawa oksigen reaktif yang dihasilkan
pada proses metabolisme di dalam sel. Hidrogen peroksida (H2O2)
merupakan sumber toksik berbagai macam penyakit karena dapat
bereaksi menimbulkan kerusakan jaringan. Selain itu, hidrogen peroksida
(H2O2) dianggap sebagai metabolit kunci karena stabilitasnya relatif tinggi,
cepat menyebar dan terlibat dalam sirkulasi sel. Hidrogen peroksida
(H2O2) memiliki kemampuan untuk berdifusi ke dalam dan menembus
membran sel sehingga dapat menimbulkan kerusakan pada sel yang
terletak jauh dari tempat dibentuknya hidrogen peroksida (H2O2) (Halliwell
& Gutteridge, 1984).
Hidrogen peroksida (H2O2) dapat digunakan sel sebagai agen
antimikroba poten terhadap sel-sel yang terinfeksi suatu patogen. Namun,
beberapa jenis mikroorganisme patogen yang memiliki kandungan CAT,
seperti Mycobacterium tuberculosis, Legionella pneumophila, dan
Campylobacter jejuni, mampu menonaktifkan senyawa hidrogen peroksida
(H2O2), sehingga memungkinkan patogen tersebut untuk bertahan hidup
tanpa cedera dalam tubuh host (penjamu) (Srinivasa Rao, Yamada &
Sel darah putih diketahui mampu memproduksi hidrogen peroksida
(H2O2) untuk membunuh bakteri. Selain itu, hidrogen peroksida (H2O2)
dapat menjadi first responder terhadap tanda terjadinya suatu trauma. Hal
ini penting untuk diketahui karena para ilmuwan masih kurang mengetahui
bagaimana mekanisme jaringan untuk mendeteksi kerusakan yang terjadi
dan sinyal apa yang dikeluarkan akibat kerusakan tersebut. Para peneliti
menemukan peningkatan kadar hidrogen peroksida (H2O2) di dalam sel
ikan (zebrafish) setelah terjadi kerusakan jaringan, dimana hidrogen
peroksida (H2O2) dianggap memberikan sinyal terhadap sel darah putih
untuk berkumpul ke daerah kerusakan dan menginisiasi proses
penyembuhan. Saat gen yang memproduksi hidrogen peroksida (H2O2)
dirusak, ternyata sel darah putih tidak berakumulasi pada daerah
kerusakan. Meskipun penelitian ini dilakukan pada ikan (zebrafish), namun
karena ikan secara genetik memiliki kemiripan dengan manusia, proses
yang serupa dispekulasikan terjadi pada manusia. Penelitian ini
dihubungkan dengan penderita asma yang memiliki kadar hidrogen
peroksida (H2O2) yang tinggi pada paru-paru dibandingkan individu yang
sehat, dimana hal ini dapat menjelaskan kenapa penderita asma memiliki
kadar sel darah putih yang meningkat pada paru-paru mereka
(Niethammer, et al., 2009).
Pada manusia, hidrogen peroksida (H2O2) diproduksi secara utama
pada paru-paru, usus dan kelenjar tiroid. Oleh karena itu, Mitchison, et al.
berasumsi bahwa hidrogen peroksida (H2O2) memegang peranan di
dalam penyakit-penyakit yang terjadi pada daerah tersebut, seperti asma,
COPD dan beberapa penyakit inflamasi usus. Epitel paru-paru dan usus
akan memproduksi hidrogen peroksida (H2O2) dengan konsentrasi yang
tinggi karena terinflamasi secara kronik, yang ditandai dengan kadar sel
darah putih yang tidak normal (Niethammer, et al., 2009).
Hidrogen peroksida (H2O2) mampu merusak sel melalui oksidasi
langsung terhadap protein, lipid dan DNA ataupun berperan sebagai
molekul sinyal yang memicu jalur-jalur intraseluler penyebab kematian sel.
yang diberikan hidrogen peroksida (H2O2), ditemukan bahwa hidrogen
peroksida (H2O2) mampu menyebabkan membran plasma dari astrosit
primer menjadi lebih seperti gel (gel-like), sedangkan membran artifisial
dari vesikel yang mengandung ekstrak lipid dari jaringan otak tikus
menjadi lebih seperti kristal cair (liquid crystalline-like). Selain dampak
yang ditimbulkan terhadap kandungan membran, hidrogen peroksida
(H2O2) mampu memicu terjadinya polimerisasi aktin, menginduksi
pembentukan cytoneme dan tunneling nanotube (TNT)-like connection
dari sel ke sel pada astrosit serta meningkatkan kolokalisasi miosin Va
dengan F-actin. Actin dan miosin diketahui sebagai protein motor yang
berperan di dalam berbagai proses seluler seperti motilitas sel,
transportasi seluler, komunikasi seluler, pengendalian siklus sel, struktur
seluler dan sinyalisasi sel. Konsentrasi hidrogen peroksida (H2O2) yang
tinggi mampu menganggu segala proses ini akibat proses remodeling
terhadap actin dan miosin yang disebabkan oleh hidrogen peroksida
(H2O2) (Zhu, et al., 2005).
Selanjutnya, hidrogen peroksida (H2O2) juga memicu terjadinya
fosforilasi p38 mitogen-activated protein kinase (MAPK) yang mampu
merubah morfologi astrosit dengan cara mengubah fase membran
astrosit, vesikel lipid dan organisasi sitoskeleton. Hal ini mengindikasikan
peran hidrogen peroksida (H2O2) di dalam memicu stres oksidatif yang
dapat menyebabkan sejumlah penyakit neurodegeneratif. Hidrogen
peroksida (H2O2) juga telah dilaporkan mampu menginduksi pembentukan
kompleks adhesi fokal dan reorganisasi aktin pada sel endotel. Selain itu,
hidrogen peroksida (H2O2) juga menyebabkan aktivasi p38 MAPK yang
diikuti dengan aktivasi MAPK-activated protein kinase-2/3 dan fosforilasi
heat shock protein (HSP) (Zhu, et al., 2005).
Mitokondria merupakan organela kompleks yang terdapat sebagai
formasi jalinan tubular di dalam sel. Mitokondria memiliki 2 jalur berbeda
untuk mempertahankan keseimbangan dinamis dari formasi jalinan
filamen mitokondria dengan cara melakukan fusi dan fisi. Disregulasi dari
fusi mitokondria dimediasi oleh protein mitofusin-1 dan mitofusin-2 dan
bertanggung jawab di dalam pemanjangan serta penarikan mitokondria
yang berdekatan untuk membentuk formasi jalinan. Sebaliknya, proses fisi
mitokondria melibatkan pembelahan mitokondria dan dimediasi oleh
protein fission-1 dan dynamin-related protein (Drp-1) (Bolisetty & Jaimes,
2013).
Dalam kondisi normal, formasi jalinan tubular mitokondria dibangun
melalui peningkatan proses fusi. Namun, dalam keadaan stres oksidatif,
proses fisi mitokondria akan lebih berperan sehingga formasi jalinan
filamen mitokondria akan hancur menjadi fragmen-fragmen. Hidrogen
peroksida (H2O2) ditemukan mampu menginduksi terjadinya proses fisi
mitokondria pada berbagai sel termasuk fibroblas (Bolisetty & Jaimes,
2013).
Fragmentasi yang terjadi berhubungan dengan dosis (konsentrasi),
waktu dan bersifat reversibel. Artinya, konsentrasi yang tinggi dari
hidrogen peroksida (H2O2) serta lamanya senyawa tersebut berada di
dalam mitokondria akan mampu menyebabkan terjadinya fragmentasi
terhadap mitokondria akibat peningkatan proses fisi (Bolisetty & Jaimes,
2013).
Peran stres oksidatif terhadap disfungsi endotel pada mikrosirkulasi
telinga bagian dalam telah diselidiki. Telah dilaporkan bahwa konsentrasi
ROS yang tinggi (terutama hidrogen peroksida, H2O2) dapat menginduksi
apoptosis atau kematian mendadak dari sel endotel telinga bagian dalam.
Pada model percobaan in vitro terhadap stres oksidatif, ditemukan bahwa
pada konsentrasi yang rendah, hidrogen peroksida (H2O2) dapat
meningkatkan ekspresi molekul ICAM-1 (Intercellular Adhesion
Molecule-1) dan MHC (Major Histocompatibility Complex) kelas I. Respon-respon ini
berlangsung meskipun tanpa ada bukti terjadinya cedera seluler yang
ireversibel. Sebaliknya, konsentrasi hidrogen peroksida (H2O2) yang lebih
tinggi mampu menyebabkan sel endotel mengalami apoptosis, dan pada
konsentrasi paling tinggi, menyebabkan kematian mendadak pada kultur
Kerusakan sel yang diinduksi oleh senyawa hidrogen peroksida (H2O2)
pada telinga bagian dalam telah ditemukan melalui penelitian yang
dilakukan terhadap epitel neurosensorik dari koklea marmut. Setelah 2
jam pemberian 0.2 mM hidrogen peroksida (H2O2), sekitar 85% sel rambut
luar mengalami kerusakan. Sebaliknya, sel rambut dalam mengalami
kematian setelah 2 jam pemberian hidrogen peroksida (H2O2). Sel Deiter
dan sel Hensen tidak menunjukkan adanya tanda-tanda kerusakan akibat
hidrogen peroksida (H2O2) (Dehne, et al., 2000).
Oleh karena hidrogen peroksida (H2O2) merupakan senyawa yang
reaktif, terdapatnya ion-ion logam transisi bebas dapat mengkonversi
hidrogen peroksida (H2O2) menjadi radikal hidroksil (OH•) yang sangat
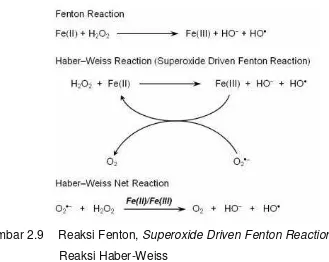
reaktif melalui reaksi Fenton ataupun reaksi Haber-Weiss (Winterbourn,
1995; Kehrer, 2000; Koppenol, 2001; Barbusinski, 2009).
Pada tahun 1894, Henry John Horstman Fenton menemukan bahwa
beberapa ion logam transisi memiliki kekuatan katalitik kuat untuk menghasilkan radikal hidroksil (OH•). Sejak saat itu, proses katalisis hidrogen peroksida (H2O2) oleh ion logam transisi disebut sebagai reaksi
Fenton (Winterbourn, 1995; Barbusinski, 2009), seperti yang dapat dilihat
pada reaksi kimia di bawah ini:
Mn+ + H2O2 M(n+1)++ OH• + OH
-Keterangan:
M dapat berupa ion logam Cu (n = 2); Mn (n = 2); Fe (n = 2)
Kemudian pada tahun 1934, Fritz Haber dan muridnya Joseph Joshua
Weiss, mengajukan konsep bahwa radikal hidroksil (OH•) juga dapat
dihasilkan dari interaksi antara radikal anion superoksida (O2•-) dan
hidrogen peroksida (H2O2). Reaksi ini disebut dengan reaksi Haber-Weiss
dan adanya ion logam transisi bebas berperan sebagai katalisis terjadinya
reaksi ini (disebut juga iron-catalyzed Weiss reaction atau
Haber-Weiss net reaction) (Kehrer, 2000), seperti yang dapat dilihat pada reaksi
O2•- + H2O2 O2 + OH• + OH
-Keterangan:
M dapat berupa ion logam Cu (n = 2); Mn (n = 2); Fe (n = 2)
Selain itu, keberadaan radikal anion superoksida (O2•-) juga mampu
mendorong semakin berlangsungnya reaksi Fenton melalui konversi ulang
ion logam oleh radikal anion superoksida (O2•-) terhadap ion logam produk
reaksi Fenton. Akibatnya, ion logam tersebut secara terus-menerus akan
mengadakan reaksi Fenton dengan hidrogen peroksida (H2O2). Reaksi ini
disebut juga superoxide driven Fenton reaction (Kehrer, 2000;
Barbusinski, 2009).
Contoh dari reaksi Fenton, reaksi Haber-Weiss dan superoxide driven
Fenton reaction akibat keberadaan ion logam Fe2+ dapat dilihat pada
Gambar 2.9 di bawah ini (Kehrer, 2000; Barbusinski, 2009):
Gambar 2.9 Reaksi Fenton, Superoxide Driven Fenton Reaction dan
Reaksi Haber-Weiss
Keterangan:
Pada reaksi Fenton, ion Fe2+ akan bereaksi dengan hidrogen peroksida
(H2O2) menghasilkan ion Fe3+, radikal hidroksil (OH•) dan anion hidroksida
(OH-). Pada reaksi Haber-Weiss, radikal anion superoksida (O2•-) akan
bereaksi dengan hidrogen peroksida (H2O2) yang dikatalisis oleh ion Fe2+
maupun Fe3+ menghasilkan oksigen (O2), radikal hidroksil (OH•) dan anion
hidroksida (OH-). Pada superoxide driven Fenton reaction, ion Fe3+ yang dihasilkan sebagai produk reaksi Fenton akan bereaksi dengan radikal
anion superoksida (O2•-) sehingga menghasilkan kembali ion Fe2+ dan
oksigen (O2). Ion Fe2+ yang dihasilkan akan mampu bereaksi kembali
dengan hidrogen peroksida (H2O2) dan kembali mencetuskan reaksi
Fenton secara terus-menerus.
Reaksi Haber-Weiss bersifat inklusif terhadap reaksi Fenton. Mengenai
apakah yang terjadi adalah reaksi Fenton atau reaksi Haber-Weiss,
semuanya bergantung pada stoikiometri reaktannya (hubungan kuantitatif
antara zat-zat yang terkait dalam suatu reaksi kimia). Jika kadar hidrogen
peroksida tinggi dan kadar ion logam transisi bebas rendah, maka reaksi
Haber-Weiss yang akan terjadi. Sebaliknya, jika kadar hidrogen peroksida
rendah dan kadar ion logam transisi bebas tinggi, maka reaksi Fenton
yang akan terjadi (Kehrer, 2000; Barbusinski, 2009).
ROS diketahui sebagai salah satu sumber kerusakan DNA karena
kemampuan mereka secara langsung memodifikasi DNA atau secara
tidak langsung menghasilkan lesi yang berbeda, yang keduanya dapat
mempengaruhi viabilitas sel. Proses kerusakan oksidatif dari DNA yang
terjadi dikelompokkan menjadi 5 kelas: oxidized bases dan abasic sites,
DNA–DNA intrastrand adduct, single-strand break (SSB), double-strand
break (DSB) serta DNA–protein crosslinks (Filomeni, Zio & Cecconi,
2015). Pada penelitian yang dipublikasikan oleh Ward, et al. (1985),
ditemukan bahwa hidrogen peroksida (H2O2) mampu mengakibatkan
terjadinya kerusakan DNA intraseluler tipe single-strand break (SSB) dan
double-strand break (DSB) pada mamalia. Mekanisme penyebab
terjadinya kerusakan DNA oleh hidrogen peroksida (H2O2) tersebut
berhubungan dengan produksi radikal hidroksil (OH•) dan reaksi
mengadakan reaksi Fenton dengan ion logam yang berikatan terhadap
sisi spesifik pada DNA sehingga membentuk radikal hidroksil (OH•) yang
akan segera merusak DNA (Ward, et al., 1987).
Mekanisme terjadinya kerusakan DNA tipe double-strand break (DSB)
oleh hidrogen peroksida (H2O2) melalui reaksi Fenton didahului dengan
kerusakan DNA tipe single-strand break (SSB) seperti yang terlihat pada
reaksi kimia di bawah ini (Ward, et al., 1987):
M+ + H2O2 M2+ + OH•
DNA + OH• SSB
Keterangan:
M dapat berupa ion logam dengan angka valensi bervariasi yang
berikatan terhadap lokasi spesifik pada DNA.
Reaksi di atas akan diikuti dengan proses reduksi metabolik yang
menghasilkan ion logam teroksidasi pada DNA seperti terlihat pada reaksi
di bawah ini:
M2+ M+
Selanjutnya molekul hidrogen peroksida (H2O2) berikutnya akan
mengadakan reaksi terhadap lokasi spesifik yang sama pada DNA seperti
sebelumnya dan kemudian menghasilkan radikal hidroksil (OH•) kembali
seperti terlihat pada reaksi di bawah ini:
M+ + H2O2 M2+ + OH•
Reaksi radikal hidroksil (OH•) kedua terhadap untaian DNA intak akan
menyebabkan terjadinya double-strand break (DSB) seperti terlihat pada
reaksi di bawah ini:
Kerusakan DNA tipe double-strand break (DSB) hanya ditemukan pada
konsentrasi hidrogen peroksida (H2O2) yang sangat tinggi (1 M selama 10
menit). Pada konsentrasi yang sangat tinggi, hidrogen peroksida (H2O2)
mampu menciptakan lingkungan berkondisi garam anisotonik yang
mempengaruhi efektivitas reaksi Fenton dengan cara menguraikan ion
logam dengan valensi bervariasi dari DNA dan/atau dengan mengubah
struktur kromatin (Ward, et al., 1987).
Hoffmann dan Meneghini (1979) juga menemukan bahwa hidrogen
peroksida (H2O2) berperan di dalam mekanisme kematian sel yang
melibatkan DNA sebagai target dan oleh sebab itu, hidrogen peroksida
(H2O2) turut berkontribusi terhadap terjadinya mutagenesis,
karsinogenesis dan penuaan. Mereka juga mengungkapkan bahwa
hidrogen peroksida (H2O2) menyebabkan kerusakan DNA tipe
single-strand break (SSB) dalam fibroblas manusia dengan bantuan mediator
berupa ion-ion logam intraseluler, yang akan bereaksi dengan hidrogen
peroksida (H2O2), sehingga memicu terjadinya reaksi Fenton dan
menghasilkan radikal hidroksil (OH•) yang sangat reaktif. Hasil penelitian
juga mendapati bahwa hidrogen peroksida (H2O2) senyawa yang
bertanggung jawab terhadap cedera mematikan pada fibroblas manusia
yang diproduksi oleh sel fagosit pada lokasi inflamasi (Filho, Hoffmann &
Meneghini, 1984).
2.5.2. Malondialdehyde (MDA) sebagai produk utama peroksidasi lipid
akibat stress oksidatif
Peroksidasi lipid dapat digambarkan secara umum sebagai suatu
proses dimana oksidan seperti radikal bebas menyerang lipid yang
mengandung ikatan ganda karbon, khususnya polyunsaturated fatty acid
(PUFA) (Ayala, Munoz & Arguelles, 2014).
Dua senyawa radikal paling umum memberikan pengaruh yang banyak
terhadap lipid terutama radikal hidroksil (OH•) dan hidroperoksil (HO2•).
Senyawa radikal hidroksil (OH•) berukuran kecil, sangat mobile, larut air
diproduksi dari oksigen (O2) pada metabolisme sel dan saat berada dalam
berbagai kondisi stres. Tiap 1 sel pada tubuh manusia memproduksi
sekitar 50 radikal hidroksil (OH•) setiap detik. Artinya, dalam 1 hari penuh,
tiap sel dapat menghasilkan 4 juta radikal hidroksil (OH•), yang dapat
dinetralkan ataupun malah menyerang biomolekul. Radikal hidroksil (OH•)
mampu menyebabkan kerusakan oksidatif pada sel karena secara tidak
spesifik menyerang biomolekul yang terletak kurang dari beberapa
nanometer dari lokasi pembentukan senyawa tersebut dan diketahui
terlibat dalam kelainan seluler seperti neurodegenerasi, penyakit
kardiovaskuler dan kanker. Di dalam sistem biologis, radikal hidroksil (OH•) dibentuk melalui siklus redoks melalui reaksi Fenton dan reaksi Haber-Weiss (Gambar 2.20) (Ayala, Munoz & Arguelles, 2014).
Peroksidasi lipid merupakan suatu reaksi berantai yang diinisiasi oleh
proses abstraksi atom hidrogen pada struktur PUFA penyusun membran
plasma sehingga mengakibatkan kerusakan oksidatif. Konfigurasi struktur
kimia rantai ganda karbon (C=C) yang dipisahkan oleh gugus metilen
(-CH2-) yang terdapat pada PUFA merupakan target sensitif radikal bebas
karena atom hidrogen yang terkandung pada gugus metilen tersebut
dapat dengan mudah dipisahkan, sehingga radikal bebas dapat berikatan
dengan struktur kimia rantai ganda karbon (C=C) pada PUFA yang
kemudian bereaksi dengan oksigen dan akan memicu reaksi berantai
yang menghasilkan produk radikal asam lemak yang tidak stabil.
Peroksidasi lipid merupakan salah satu penanda paling unggul dalam
menilai kadar ROS yang menyebabkan kerusakan jaringan sistemik.
Proses peroksidasi lipid terdiri dari 3 fase, yakni (Halliwell & Gutteridge, 1984; De Zwart, et al., 1999; Setiawan & Suhartono, 2007; Ayala, Munoz & Arguelles, 2014):
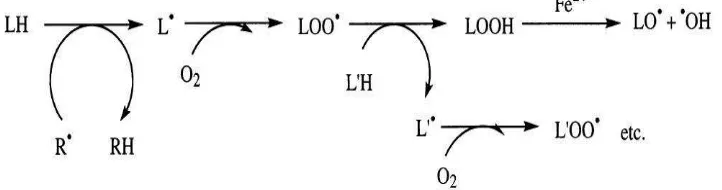
1. Inisiasi
Pada fase ini, radikal bebas (R•) akan mengabstraksi atom hidrogen
pada ikatan karbon-hidrogen pada gugus metilen bis-allylic carbon dari
molekul PUFA (LH) dan membentuk radikal bebas L• (alkyl radical)
yang secara cepat mengadakan reaksi dengan oksigen (O2) sehingga
terbentuk radikal peroksil (LOO•) yang berpotensi mengabstraksi atom
hidrogen dari gugus molekul PUFA yang berada di sebelahnya.
2. Propagasi
Radikal peroksil (LOO•) akan kembali mengabstraksi atom hidrogen
pada ikatan karbon-hidrogen pada gugus metilen bis-allylic carbon dari
molekul PUFA (LH) terdekat, kemudian membentuk radikal bebas L•
(alkyl radical) lain yang secara cepat akan bereaksi lagi dengan oksigen
(O2) lalu membentuk radikal L1OO• baru, L2OO•, LnOO• dan seterusnya
sehingga memicu reaksi peroksidasi lipid di sepanjang membran sel.
Selain itu, proses abstraksi yang dilakukan oleh radikal peroksil (LOO•)
terhadap atom hidrogen pada ikatan karbon-hidrogen pada gugus
metilen bis-allylic carbon dari molekul PUFA (LH) yang lainnya akan
membentuk hidroperoksida lipid (LOOH) yang merupakan produk
primer peroksidasi yang bersifat sitotoksik. Melalui pemanasan atau
reaksi yang melibatkan ion logam transisi seperti Fe2+, hidroperoksida lipid (LOOH) akan dipecah menjadi produk peroksidasi lipid sekunder,
yakni radikal lipid alkoksil (LO•) dan radikal hidroksil (OH•).
Radikal-radikal ini juga dapat menginisiasi reaksi peroksidasi lipid selanjutnya.
Proses ini akan terus berlangsung beberapa kali sampai berhenti jika
telah mencapai fase terminasi.
3. Terminasi
Radikal karbon L• (alkyl radical) yang terbentuk pada reaksi inisiasi
cenderung menjadi stabil melalui reaksi dengan radikal karbon L• (alkyl
peroksil (LOO•) dan lainnya pada tahap propagasi. Bila radikal bereaksi
dengan radikal lain seperti radikal karbon L• (alkyl radical), radikal
peroksil (LOO•) ataupun molekul dengan elektron tidak berpasangan,
maka rantai propagasi akan berhenti. Namun, bila radikal bereaksi
dengan senyawa non-radikal, reaksi tersebut akan selalu menghasilkan
radikal-radikal yang lain. Inilah sebabnya proses ini disebut sebagai
mekanisme reaksi berantai. Reaksi radikal akan berhenti saat 2
senyawa radikal bereaksi dan memproduksi senyawa non-radikal. Hal
ini hanya terjadi jika konsentrasi senyawa radikal cukup tinggi sehingga
memungkinkan terjadinya proses kolisi (tabrakan) terhadap 2 radikal.
Ilustrasi 3 fase peroksidasi lipid tersebut dapat dilihat pada Gambar
2.10 di bawah ini:
Gambar 2.10 Peroksidasi Lipid Suatu Reaksi Rantai Pembentuk Beberapa
Radikal Peroksida Lipid
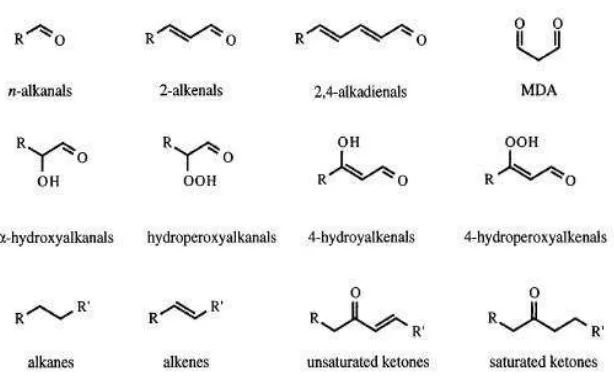
Produk akhir dari dekomposisi hidroperoksida lipid (LOOH) yang
dikatalisis oleh kompleks logam transisi bebas akan dapat melangsungkan
reaksi beta-cleavage sehingga membentuk senyawa aldehid reaktif yang
bersifat sitotoksik dan genotoksik seperti MDA dan senyawa alkena dan
karbonil seperti HNE, serta gas hidrokarbon seperti etana, dan lain
Gambar 2.11 Beberapa Produk Akhir Peroksidasi Lipid
Produk-produk akhir tersebut terlibat pada sebagian besar patofisiologi
terkait stres oksidatif pada sel maupun jaringan. Meskipun sebagai produk
akhir, secara kimiawi senyawa-senyawa tersebut tetap aktif dan
mempunyai reaktivitas yang tinggi terhadap berbagai biomolekul,
termasuk protein, fosfolipid dan DNA (Setiawan & Suhartono, 2007).
Senyawa aldehid bersifat relatif stabil sehingga mampu berdifusi ke dalam atau ke luar sel untuk menyerang target yang berada jauh dari tempat asal pembentukannya. Oleh sebab itu, senyawa aldehid dan metabolit-metabolitnya menjadi indikator parameter yang baik terhadap proses peroksidasi lipid, sehingga MDA digunakan sebagai biomarker biologis peroksidasi lipid dan menggambarkan derajat stres oksidatif (De Zwart, et al., 1999).
deoxyguanosine dan deoxyadenosine pada DNA. Pembentukan adduct atau addition product terbanyak terhadap DNA manusia adalah suatu pyrimidopurinone yang disebut M1G. Protein yang mengalami modifikasi akibat MDA menunjukkan adanya perubahan prilaku psikokimia dan antigenisitas. MDA merupakan senyawa yang toksik dan terbukti berhubungan dengan proses mutagenesis penuaan, karsinogenesis, nefropati diabetik, penyakit Alzheimer, dan lain-lain (Poirrier, et al., 2010). Konsentrasi MDA diketahui meningkat secara bermakna dalam suatu penelitian terhadap jaringan paru tikus yang mengalami inflamasi paru kronik setelah pemberian silikon dioksida akibat proses stres oksidatif intraseluler yang terjadi (Barsan, et al., 2013). Pada suatu penelitian terhadap otak tikus yang mengalami kerusakan akibat proses hipoksia iskemik, MDA ditemukan dalam kadar yang tinggi dan berperan di dalam terjadinya perubahan struktur dan morfologi sel neuron pada korteks otak tikus (Zheng, et al., 2009).
Pengukuran kinetika peroksidasi lipid yang dinilai berdasarkan dapat
dilakukan dengan beberapa metode, salah satunya TBA (Thiobarbituric
Acid) reactivity test, yang dapat dilakukan baik secara in vivo maupun in
vitro. Uji ini didasarkan pada reaksi kondensasi antara 1 molekul MDA
dengan 2 molekul TBA pada kondisi asam. Hasilnya adalah pigmentasi
berwarna merah yang dapat diukur pada panjang gelombang 532 nm.
Jumlah kadar MDA yang terdeteksi menggambarkan banyaknya
peroksidasi lipid yang terjadi.
Senyawa HNE dikenal sebagai second messenger radikal bebas dan
juga merupakan marker bioaktif utama peroksidasi lipid sehubungan
dengan sejumlah aktivitas biologisnya yang menyerupai aktivitas radikal
2.6 Pembentukan Reactive Oxygen Species (ROS) pada Diabetes Mellitus
Keadaan hiperglikemia yang berkepanjangan sampai saat ini diakui sebagai faktor utama yang berperan dalam patogenesis terjadinya berbagai komplikasi DM. Hiperglikemia menginduksi sejumlah besar perubahan dalam jaringan pembuluh darah, yang berpotensi menyebabkan aterosklerosis. Beberapa mekanisme utama yang mencakup sebagian besar perubahan patologis yang diamati dalam pembuluh darah penderita DM (Gambar 2.12) yaitu (1) glikosilasi nonenzimatik protein dan lipid, (2) aktivasi protein kinase C (PKC), (3) peningkatan fluks melalui jalur heksosamin (4) peningkatan stres oksidatif, dan (5) peradangan (Aronson, 2008; Vincent et.al, 2004).
Gambar 2.12 Aktivasi Signaling Berbagai Mekanisme Dalam Sel Akibat Hiperglikemia
aterosklerosis. Terdapat hubungan yang erat antara stres oksidatif yang diinduksi hiperglikemia dengan mekanisme kerusakan vaskuler akibat hiperglikemia melalui jalur yang lain seperti pembentukan AGEs, aktivasi PKC, dan peningkatan fluks melalui jalur heksosamin (Gambar 2.13) (Aronson, 2008; Vincent et.al, 2004).
Gambar 2.13 Hubungan antara Pembentukan Oksidan, Aktivitas Antioksidan, Stres Oksidatif dan Kerusakan yang Disebabkannya pada DM (Aronson, 2008).
superoksida, dan secara nyata meningkatkan produksi superoksida (Aronson, 2008).
Beberapa zat produk advanced glycosylation (AGEs / advanced glycosylation end products) seperti N(6) – Carboxymethyllysine (CML) dan pentosidin terbentuk dalam reaksi protein dengan glukosa hanya dalam kondisi oksidatif. Dengan demikian, beberapa AGEs yang dihasilkan oleh gabungan proses glikasi dan oksidasi disebut produk glikooksidasi. Setiap struktur AGE memiliki mekanisme pembentukannya sendiri dan ketergantungannya sendiri terhadap stres oksidatif. Namun, karena produk glikooksidasi pada protein bersifat ireversibel, disimpulkan bahwa zat tersebut dapat menjadi biomarker akumulasi stres oksidatif pada jaringan. Memang terdapat korelasi kuat antara tingkat produk glikooksidasi dalam kolagen kulit dengan tingkat keparahan komplikasi diabetes yang mengenai retina, ginjal, dan pembuluh darah penyakit (Aronson, 2008).
Mekanisme potensial lain yang berkontribusi terhadap stres oksidatif melibatkan transisi metal-catalyzed autoksidasi glukosa bebas. Melalui mekanisme ini, glukosa sendiri memulai reaksi autooksidasi dan produksi radikal bebas yang menghasilkan anion superoksida (O2-) dan hydrogen peroksida (H2O2). Reaksi ini sering dikatalisis oleh logam transisi, tetapi bahkan dengan katalis, reaksi berlangsung sangat lambat. Kemudian interaksi antara epitop AGE dan reseptor AGE di permukaan sel meregulasi gen respon terhadap stres oksidatif dan melepaskan radikal oksigen. Dengan demikian, hiperglikemia secara bersamaan meningkatkan baik pembentukan AGEs dan stres oksidatif maupun interaksi antara glikasi, dan oksidasi kimiawi dapat saling meningkatkan masing-masing proses tersebut. Selain itu, stres oksidatif yang dihasilkan akibat hiperglikemia dapat menyebabkan aktivasi DAGPKC dalam jaringan pembuluh darah (Aronson, 2008).
menunjukkan bahwa over produksi superoksida mitokondria akibat hiperglikemia dapat meningkatkan pembentukan AGEP, aktivasi PKC, dan aktivitas jalur hexosamine. Penghambatan produksi superoksida melalui overekspresi mangan dismutase (yang dengan cepat mengubah superoksida menjadi H2O2) atau uncoupling protein-1 mencegah kelebihan superoksida akibat hiperglikemia. Secara bersamaan, peningkatan pembentukan AGE intraseluler, aktivasi PKC, dan peningkatan pembentukan hexosamin dapat dicegah. Dengan demikian, beberapa mekanisme berkaitan hiperglikemia yang tampaknya tidak saling berhubungan, yang berkontribusi terhadap komplikasi vaskular diabetes, mungkin timbul dari satu proses yaitu kelebihan produksi molekul radikal bebas superoksida (Aronson, 2008).
dikenal sebagai spesies oksigen reaktif (ROS). Secara umum, ROS beracun bagi sel-sel karena kecenderungannya untuk menyebabkan kerusakan makromolekul. Meskipun H2O2 adalah oksidan ringan dan paling kurang reaktif dibandingkan ROS yang lainnya, semua sel aerob dilengkapi dengan berbagai enzim untuk mengeliminasi H2O2 karena H2O2 sangat mudah dikonversi menjadi radikal hidroksil yang sangat reaktif radikal melalui reaksi Fenton (D'Autreaux dan Toledano, 2007;. Giorgio et al, 2007; Rhee, 2006).
2.7 Curcuminoid
Curcuminoid adalah kelompok senyawa fenolik yang terkandung dalam rimpang tanaman famili Zingiberaceae antara lain: Curcuma longa syn. Curcuma domestica Val. (kunyit) dan Curcuma xanthorrhiza (temulawak).
Kunyit pertama kali diklasifikasikan secara taksonomi oleh seorang
ilmuwan asal Swedia bernama Carl Linnaeus pada tahun 1753 sebagai
berikut:
Divisi : Spermatophyta
Sub Divisi : Angiospermae
Kelas : Monocotyledoneae
Bangsa : Zingiberales
Suku : Zingiberaceae
Marga : Curcuma
Spesies : Curcuma longa Linnaeus
(Departemen Kesehatan dan Kesejahteraan Sosial RI Badan Penelitian
dan Pengembangan Kesehatan, 2001).
2.7.1 Sifat kimia dan fisik curcuminoid
Kandungan utama dari curcuminoid adalah curcumin yang memberikan warna kuning. Nama kimia untuk curcumin adalah diferuloylmethane atau
(1,7-bis[4-hydroxy-3-methoxyphenyl]-1,6-heptadiene-3,5-dione) dengan
rumus molekul C21H20O6 dan Nilai pKa-nya adalah 8.54. Curcumin
mengandung 60-70% karbohidrat, 8.6% protein, 5-10% lemak, 2-7% serat,
dan resin, sisanya mengandung mineral seperti magnesium, besi,
mangan, kalsium, natrium, kalium, timbal, seng, kobalt, aluminium dan
bismuth. Kandungan curcumin di dalam kunyit berkisar 3-4% (Eigner & Schulz, 1999; Joe, Vijaykumar & Lokesh, 2004). Komposisi curcuminoid
sekitar 70% curcumin (curcumin I), 17% demethoxycurcumin (curcumin II),
3% bis-demethoxycurcumin (curcumin III) dan sisanya (10%) disebut
dengan cyclocurcumin (curcumin IV) yang memiliki sedikit atau tanpa
aktivitas biologis. Curcumin tidak dapat larut dalam air dan eter, tetapi larut dalam etil asetat, etanol, metanol, aseton, asam asetat glasial, dimetilsulfoksida dan benzene. Beberapa peneliti telah membuktikan
sensitivitas curcumin terhadap cahaya, dan sebagai hasilnya
menyarankan bahwa sampel biologis yang mengandung curcumin harus
dilindungi dari cahaya. Masalah stabilitas lainnya terjadi ketika curcumin
ditempatkan dalam sistem penyangga fosfat dengan pH 7.2. Dalam
kondisi ini, sebagian besar curcumin (>90%) berdegradasi dalam waktu 30
menit dari penempatan (Araujo & Leon, 2001; Joe, Vijaykumar & Lokesh, 2004; Chattopadhyay, et al., 2004; Sharma, Gescher & Steward, 2005; Aggarwal & Shishodia, 2006; Trujillo, et al., 2013; Yadav, et al., 2013;
Model struktur curcuminoid dari kunyit dapat dilihat pada Gambar 2.14 di bawah ini:
Gambar 2.14. Struktur Molekul Komponen Curcuminoid
2.7.2 Target molekuler curcuminoid
Berbagai studi telah berhasil memperlihatkan peranan curcumin dalam memodulasi sejumlah target molekuler, meliputi faktor pertumbuhan,
reseptor faktor pertumbuhan, faktor transkripsi, sitokin, enzim, dan gen
pengatur apoptosis (Gambar 2.15). Meskipun belum diketahui reseptor
asli untuk curcumin, sejumlah molekul tempat melekatnya curcumin telah
teridentifikasi, diantaranya serum albumin, 5-LOX, xanthine oxidase,
thioredoxin reductase, zat besi, COX-2, IKK, p-glycoprotein, GST, PKA,
PKC, cPK, PhK, autophosphorylation-activated protein kinase, pp60c-src
tyrosine kinase, Ca2+-dependent protein kinase (CDPK), Ca2+-ATPase
retikulum sarkoplasma, reseptor aryl hydrocarbon, sitokrom p450 rat river,
Topo II isomerase, reseptor inositol 1,4,5-triphosphate, dan glutathione
Gambar 2.15. Target Molekuler Curcumin
2.7.3 Target penyakit curcumin
Pada sebuah penelitian preklinis menunjukkan curcumin dosis tunggal 1.380-3.500 mg/kgBB (3.7-9.5 mmol/kgBB) tidak menimbulkan efek samping pada tikus kecuali feses yang berwarna. Dalam sebuah penelitian yang dipublikasi, dinyatakan bahwa dosis tunggal curcumin di atas 5.000 mg/kgBB (13.6 mmol/kgBB) tidak mempunyai efek secara klinis ataupun efek terhadap berat relatif organ pada tikus jantan maupun betina (Chemoprevention Branch and Agent Development Committee, 1996). Penelitian pada tikus selama 90 hari, dimana tikus diberikan curcumin dengan dosis 1.140, 1.515, 1.995, 2.630 dan 3.500 mg/kgBB/hari (3.1-9.5 mmol/kgBB/hari) memiliki efek klinis feses berwarna dan bulu kekuningan. Pada tikus jantan, dijumpai penurunan jumlah retikulosit pada semua grup kecuali pada grup 1.515 mg/kgBB/hari dan dijumpai peningkatan Mean Corpuscular Hemoglobin (MCH) pada 2 grup (grup dosis 1.995 dan 2.630
mg/kgBB/hari) tidak signifikan secara biologis (Chemoprevention Branch and Agent Development Committee, 1996).
Penelitian mengenai curcumin menunjukkan bahwa toksisitas curcumin tidak signifikan. Pada tikus yang diberi curcumin pada makanannya dengan dosis 0.1-2.0% (0.1-2.7 mmol/kgBB/hari) selama 8 minggu, tidak ada efek pada nafsu makan, peningkatan berat badan, hematologi, kimia serum, atau perubahan histologi saluran pencernaan, hati, limpa dan ginjal yang diperiksa. Penelitian yang serupa, tikus diberikan curcumin hingga 1.000 mg/kgBB/hari per oral selama 3 bulan dan tidak ada efek samping pada pertumbuhan, perilaku, parameter biokimia dan histopatologi (Chemoprevention Branch and Agent Development Committee, 1996).
Penelitian pada tikus yang diberi curcumin 600 dan 1.600 mg/kgBB pada usia kehamilan 6-15 hari tidak menimbulkan efek terhadap implantasi, resorpsi dan tidak menimbulkan kematian pada embrio, tidak menimbulkan abnormalitas tulang dan organ dalam. Penelitian jangka panjang pada lebih dari tiga generasi tikus, tidak ada menunjukkan efek teratogenik atau gangguan pada reproduksi (Chemoprevention Branch and Agent Development Committee, 1996).
Berbagai penelitian yang memeriksa efek curcumin sebagai antioksidan menggunakan dosis curcumin yang beragam. Khan & Mahboob (2014) yang meneliti peranan antioksidan curcumin pada tikus yang diinduksi dislipidemia menggunakan curcumin 200 mg/kgbb tikus dan mendapatkan hasil yang signifikan. Pada tikus yang diberikan curcumin menunjukkan adanya peningkatan kadar dan aktivitas CAT,
SOD dan GSH, serta penurunan kadar MDA pada berbagai jaringan yang diambil dari hepar, jantung dan aorta. Wongeakin et al (2014) yang meneliti peranan curcumin terhadap disfungsi endotelial akibat ROS pada tikus yang diinduksi DM menggunakan dosis curcumin sebesar 300 mg/kgbb, dan mendapatkan hasil yang signifikan dalam hal penurunan produksi ROS pada tikus yang mendapatkan curcumin dibandingkan dengan tikus kontrol.
Dosis curcumin sebagai anti kanker yaitu sampai 10 g/hari (Aggarwal, Kumar & Bharti, 2003). Dosis curcumin sebagai terapi kanker kolorektal yaitu 2.2 g/hari (ekstrak curcuma). Kanker kolorektal stadium akhir diberikan dosis antara 0.45 dan 3.6 g/hari selama empat bulan (Jurenka, 2009; Burgos-Moron, et al., 2010).
Ekstrak etanol kunyit dengan berbagai dosis memperlihatkan efek anti inflamasi pada tikus yang diinduksi dengan karagen dimana pada dosis tinggi (1000 mg/kgBB) dapat menekan edema sebesar 78.37%. Pada penelitian tersebut menunjukkan semakin tingginya dosis ekstrak etanol kunyit, jumlah zat aktif yang terkandung di dalamnya semakin tinggi sehingga kemampuannya di dalam menginhibisi edema semakin besar (Rustam, Atmasari & Yanwirasti, 2007).
Konsentrasi perasan air kunyit 30% paling efektif dalam memperbaiki kerusakan sel hati pada mencit (Kardena & Winaya, 2011).
Penelitian dengan mengkombinasikan antibiotik dan curcumin pada sedian piringan diffusion assay dengan dosis curcumin 500 µg setiap piringan menghasilkan peningkatan aktivitas dari antibiotik Cefixime, Cefotaxime, Vancomycin dan Tetrasiklin (Moghaddam, et al., 2009).
Curcumin dapat melalui membran sel karena sifat lipofilisitasnya.
Namun curcumin memiliki kelarutan dalam air yang sangat rendah, yaitu
hanya 0.6 µg/ml, dimetabolisme dengan cepat di hati dan dinding usus,
serta rentan terhadap degradasi pada kondisi basa. Karakteristik ini
menjadi penyebab rendahnya bioavailibilitas curcumin, sehingga
konsentrasinya dalam darah menjadi kurang optimal untuk mencapai efek
terapeutik yang diharapkan (Naksuriya, et al., 2014). Nilai paruh waktu (T½) curcumin pada pemberian intravena (10 mg/kgBB) pada tikus dilaporkan sekitar 28.1 ± 5.6 jam dan pada pemberian oral (500 mg/kgBB) yaitu sekitar 44.5 ± 7.5 jam (Anand, et al., 2007).
fukosa dalam jaringan mendekati normal pada tikus yang mendapat curcumin. Penelitian juga dilakukan untuk melihat apakah stimulasi langsung oleh curcumin terhadap sel beta pankreas dapat berkontribusi terhadap aktivitas hipoglikemik. Berbagai penyakit yang diketahui menjadi target kerja curcumin dapat dilihat pada Gambar 2.16.
Gambar 2.16 Target Penyakit Curcumin
2.8. Penggunaan Streptozotocin untuk Membuat Hewan Coba Model Diabetes Melitus
Gambar 2.17 Struktur Kimia Streptozotocin
Mekanisme kerja STZ pada sel β pankreas telah dipelajari selama bertahun-tahun. Secara umum dianggap bahwa STZ diangkut melalui transporter glukosa GLUT2 pada membran sel, dan menyebabkan alkilasi
DNA dan kematian sel β pankreas (Deeds et al., 2011).
Penggunaan STZ sangat bervariasi dan memberikan hasil yang berbeda-beda, baik dalam hal mortalitas maupun keparahan DM yang dihasilkan. Selain itu, sensitivitas STZ juga sangat bervariasi pada tiap-tiap hewan coba yang digunakan. Berbagai metode dan dosis STZ telah dicoba dan disebutkan dalam literatur, tergantung kepada tingkat keparahan diabetes yang diinginkan sesuai protokol eksperimen tertentu. Penggunaan dosis dapat dibagi menjadi 3, yaitu dosis rendah dengan pemberian berulang, dosis sedang sekali pemberian, dan dosis tingggi sekali pemberian. Induksi dengan injeksi tunggal baik secara intravena maupun intraperitoneal dianggap sebagai teknik yang paling banyak digunakan (Deeds et al., 2011).
Dosis yang digunakan untuk menginduksi DM tipe 1 untuk intravena adalah 40-60 mg/kg, sedangkan dosis intraperitoneal adalah lebih dari 40 mg/kg BB. STZ juga dapat diberikan secara berulang, untuk menginduksi DM tipe 1 yang diperantarai aktivasi sistem imun. Untuk menginduksi DM tipe 2, STZ diberikan intravena atau intraperitoneal dengan dosis 40-60 mg/kg BB pada tikus yang berumur 2 hari kelahiran, pada 8-10 minggu tikus tersebut mengalami gangguan respon terhadap glukosa dan
sensitivitas sel β terhadap glukosa. Di lain pihak, sel α dan δ tidak
neonatal tersebut sehingga tidak membawa dampak pada perubahan glukagon dan somatostatin. Patofisiologis tersebut identik pada DM tipe II (Szkudelski, 2001; Jackerott et al., 2006; Tormo et al., 2006).
STZ menembus sel β Langerhans melalui tansporter glukosa GLUT 2.
Aksi STZ intraseluler menghasikan perubahan DNA sel β pankreas.
Alkilasi DNA oleh STZ melalui gugus nitrosourea mengakibatkan
kerusakan pada sel β pankreas. STZ merupakan donor NO (nitric oxide) yang mempunyai kontribusi terhadap kerusakan sel tersebut melalui peningkatan aktivitas guanilil siklase dan pembentukan cGMP. NO dihasilkan sewaktu STZ mengalami metabolisme dalam sel. Selain itu, STZ juga mampu membangkitkan oksigen reaktif yang mempunyai peran
tinggi dalam kerusakan sel β pankreas. Pembentukan anion superoksida
karena aksi STZ dalam mitokondria. Produksi ATP mitokondria yang terbatas selanjutnya mengakibatkan pengurangan secarea drastis nukleotida sel β pankreas (Szkudelski, 2001).
Peningkatan defosforilasi ATP akan memacu peningkatan substrat
untuk enzim xantin oksidase (sel β pankreas mempunyai aktivitas tinggi
terhadap enzim ini), lebih lanjut meningkatkan produksi asam urat. Xantin oksidase mengkatalisis reaksi pembentukan anion superoksida aktif. Dari pembangkitan anion superoksida, terbentuk hidrogen peroksida dan radikal superoksida. NO dan oksigen reaktif tersebut adalah penyebab
utama kerusakan sel β pankreas (Szkudelski, 2001).