BAB 3
METODE PENELITIAN 3.1 Jenis dan Rancangan Penelitian
Jenis penelitian adalah eksperimental laboratorik ex vivo, yang dipilih karena baik sampel maupun perlakuan lebih terkendali, terukur dan pengaruh perlakuan dapat lebih dipercaya. Rancangan penelitian ini menggunakan rancangan randomized post test only control group laboratory experimental design untuk mengetahui efek pemberian curcuminoid terhadap ekspresi SOD pada fibroblas koklea setiap unit eksperimen dengan pengukuran variabel yang hanya dilakukan setelah pemberian perlakuan. Pengambilan sampel dilakukan secara acak dan ada kontrol pembanding.
3.2 Tempat dan Teknik Pengambilan Data Penelitian 3.2.1 Tempat Penelitian
Penelitian dilakukan di laboratorium terstandardisasi dan mempunyai peralatan lengkap serta pengalaman memadai. Pemeliharaan hewan coba dilakukan di Laboratorium Biokimia Fakultas Kedokteran Universitas Airlangga Surabaya, pembuatan sediaan dan teknik pemeriksaan imunohistokimia dilakukan di Laboratorium Patologi Anatomi RSUD dr. Soetomo Surabaya.
3.2.2 Teknik Pengambilan Data
3.3 Variabel Penelitian 3.3.1 Variabel bebas
Variabel bebas adalah stres hiperglikemik yang didapatkan melalui injeksi streptozotocin 60 mg/kgbb/ekor dosis tunggal serta pemberian curcuminoid dengan dosis 200 dan 400 mg/kgbb/ekor/hari selama 5 dan 10 hari.
3.3.2 Variabel terikat
Respon molekuler pada fibroblas berupa ekspresi SOD.
3.3.3 Variabel terkendali
Tikus Rattus norvegicus galur Wistar, jenis kelamin tikus, kandang tikus terpisah, berat badan tikus, makanan dan minuman tikus, cara pemberian perlakuan injeksi streptozotocin serta curcuminoid, prosedur penelitian dan cara pemeliharaan hewan coba.
3.4 Sampel
Tikus dipilih menjadi sampel penelitian karena memiliki kemiripan struktur telinga dalam dengan manusia. Tikus telah digunakan sebagai model hewan coba untuk penelitian penyakit ketulian genetik manusia dan terbukti bermanfaat dalam membantu mengidentifikasi gen yang sesuai pada manusia yang berperan dalam perkembangan sistem auditorius. Melalui identifikasi genetik dan sekuensnya, tikus dinyatakan homolog (>70%) dengan manusia (Gravel & Ruben, 1996).
Tikus Rattus norvegicus galur Wistar, jenis kelamin jantan, kondisi sehat, umur dewasa (2-3 bulan), dengan berat badan 150-250 gram agar perubahan berat selama penelitian relatif kecil (Hume, et al.,1978).
Rancangan penelitian memiliki kriteria; pengambilan sampel dilakukan secara acak, streptozotocin diberikan dalam dosis tertentu sesuai berat badan tikus, ada kontrol pembanding, dan bersifat double blind.
Selanjutnya data yang diperoleh dianalisis dengan menggunakan uji variat untuk mencapai tujuan penelitian.
3.4.1 Besar sampel
Besar sampel ditentukan berdasarkan jumlah ulangan yang dianggap telah cukup baik (Federer, 1955), dengan rumus sebagai berikut:
Keterangan:
k = jumlah kelompok subyek penelitian (k=6) r = jumlah ulangan
Perhitungan:
(6-1) (r-1) ≥ 15; 5r-5 ≥ 15; 5r ≥ β0; r ≥ 4 n = r x k; n = 4 x 6 = 24
ditetapkan besar sampel secara keseluruhan yaitu minimal 24 ekor tikus.
3.4.2 Pengelompokan sampel
Berdasarkan rumus di atas maka besar sampel adalah tikus yang diambil peneliti secara random untuk tiap kelompok perlakuan, sehingga sampel yang digunakan dalam penelitian ini adalah 24 ekor tikus yang dibagi menjadi 6 kelompok sebagai berikut:
(k-1) (r-1) ≥ 15)
P1 (Perlakuan 1) K2 (Kelompok 2) Subyek
P0 (tanpa perlakuan = kontrol) K1 (Kelompok 1)
R P2 (Perlakuan 2) P3 (Perlakuan 3) P4 (Perlakuan 4) P5 (Perlakuan 5)
K1 : Kelompok kontrol, diberikan injeksi buffer natrium sitrat.
K2 : Kelompok perlakuan diberikan injeksi streptozotocin 60 mg/kgbb/ekor dosis tunggal.
K3 : Kelompok perlakuan dengan injeksi streptozotocin 60 mg/kgbb/ekor dosis tunggal dan pemberian curcuminoid 200 mg/kgbb/ekor/hari selama 5 hari.
K4 : Kelompok perlakuan dengan injeksi streptozotocin 60 mg/kgbb/ekor dosis tunggal dan pemberian curcuminoid 400 mg/kgbb/ekor/hari selama 5 hari.
K5 : Kelompok perlakuan dengan injeksi streptozotocin 60 mg/kgbb/ekor dosis tunggal dan pemberian curcuminoid 200 mg/kgbb/ekor/hari selama 10 hari.
K6 : Kelompok perlakuan dengan injeksi streptozotocin 60 mg/kgbb/ekor dosis tunggal dan pemberian curcuminoid 400 mg/kgbb/ekor/hari selama 10 hari.
3.4.3 Teknik pengambilan sampel
Tikus Rattus norvegicus galur Wistar didapat dari institusi penyedia yang memiliki kualifikasi standar. Sebelum digunakan sebagai subyek penelitian, hewan coba dilakukan evaluasi klinis dan dikondisikan dalam lingkungan yang sesuai (selama 14x24 jam) untuk meyakinkan bahwa hewan tersebut tidak berpenyakit atau tidak berpotensi menularkan penyakit.
Sebelum mendapatkan perlakuan penelitian, dilakukan skrining dengan beberapa kriteria, yaitu:
1. Kriteria inklusi: hewan coba berusia 2-3 bulan, jenis kelamin jantan dan berat badan 150-250 gram.
2. Kriteria eksklusi:
a. Hewan dinyatakan berpenyakit oleh dokter hewan konsultan, baik
penyakit menular atau tidak menular atau cedera fisik atau berpotensi
menularkan penyakit dalam kurun waktu evaluasi klinis di dalam kondisi
b. Hewan terdeteksi memiliki kelainan bawaan yang dinyatakan oleh dokter
hewan konsultan.
c. Hewan berperilaku agresif, dalam pengamatan sering menyerang
anggota kelompok lain.
Setelah didapatkan sampel yang homogen melalui skrining dengan kriteria inklusi dan eksklusi di atas, dilakukan pembagian kelompok sampel yang homogen secara alokasi random sehingga setiap anggota sampel mempunyai kesempatan sama untuk menempati kelompoknya. Penelitian berlangsung dengan prosedur pelakuan hewan secara benar ditinjau dari prinsip 3R (Reduction, Replacement, Refinement) serta prinsip 5F (Freedom from Hunger and Thirst, Freedom from Discomfort, Freedom from Pain, Injury or Disease, Freedom to Express Normal Behaviour, Freedom from Fear and Distress) (FAO, 2011) dan diberlakukan kriteria Putus Uji apabila subyek penelitian mengalami sakit atau kematian sehingga tidak bisa memenuhi prosedur penelitian yang membutuhkan waktu 5 - 10 hari. Selanjutnya tikus diterminasi dan dilakukan pengambilan jaringan koklea untuk dibuat sediaan dan pengecatan imunohistokimia untuk menganalisis ekspresi SOD.
3.5 Definisi Operasional Penelitian
1. Induksi Diabetes: injeksi Streptozotocin dengan dosis 60
mg/kgbb/ekor dosis tunggal secara intraperitoneal, kemudian kadar
gula darah diukur 2 hari pasca injeksi, sampai terjadi kondisi
hiperglikemia (KGD >200 mg/dl).
2. Hiperglikemia adalah keadaan dimana kadar gula darah tikus
mencapai >200 mg/dl yang diukur menggunakan strip pengukur kadar
gula darah merk Gluko DR® Bio Sensor dari allmedicus.
3. Fibroblas: sel yang terdapat pada jaringan dinding lateral koklea. Sel
berinti tunggal dalam bentuk yang panjang.
4. Ekspresi SOD diidentifikasi dengan pengecatan imunohistokimia yang
memperlihatkan sel fibroblas berinti tunggal berwarna coklat pada inti
dan sitoplasma pada jaringan dinding lateral koklea tiap kelompok di
bawah mikroskop cahaya yang dilengkapi mikrometer okuler dengan
(dokter spesialis Patologi Anatomi)) untuk kemudian dilakukan
penghitungan skor imunoreaktif. Skor imunoreaktif diperoleh dengan
mengalikan skor luas dengan skor intensitas.
Hasil ukur skor imunoreaktif: 0-9.
Dalam penelitian ini digunakan Polyclonal Anti-SOD1 Antibody catalog#:PA1345 dari Boster Immunoleader.
5. Curcuminoid: zat pigmen kuning yang diekstraksi dari tumbuhan
Curcuma domestica Val. atau Curcuma longa L. Pada penelitian ini
yang digunakan adalah curcuminoid serbuk dengan kadar 80%
curcuminoid standar dari Tradimun. Sediaan yang diberikan berupa
curcuminoid serbuk dengan dosis 200 dan 400 mg/kgbb/hari per ekor
tikus (dengan rerata berat badan tikus adalah 200 mg, maka dalam
penelitian ini dosis yang dipakai adalah 40 dan 80 mg/ekor/hari) karena
berdasarkan literatur dan penelitian terdahulu dosis tersebut dapat
meningkatkan ekspresi SOD.
3.6 Alat dan Bahan Penelitian
3.6.1 Hewan coba yang dikenai perlakuan
Tikus putih jantan Rattus norvegicus galur Wistar yang memenuhi kriteria inklusi dan eksklusi akan mendapatkan pembagian kelompok sesuai hasil randomisasi.
3.6.2 Bahan perlakuan
a. Streptozotocin
Streptozotocin disimpan pada suhu 200C. Konsentrasi
streptozotocin adalah 22,5 mg/l, disimpan dalam tabung reaksi
yang ditutup dengan aluminium foil (karena sensitif terhadap
cahaya).
b. Curcuminoid
Curcuminoid yang dipakai berasal dari Curcuma longa L. dengan
kadar curcuminoid (28,1 ± 1,0)% b/b dibandingkan dengan
standar yang distandarisasi menggunakan metode kromatografi
curcuminoid serbuk dengan dosis 200 dan 400 mg/kgbb/hari
perekor tikus.
c. Buffer natrium sitrat dibuat dengan melarutkan 1,47 gram Natrium
sitrat dalam 50 ml dH2O.
d. Carboxy Methyl Cellulose (CMC) dibuat dengan mensuspensikan
0.5 gram CMC dalam 100 cc larutan akuades.
e. Eter sebagai obat anestesi inhalasi.
3.6.3 Alat dan bahan pemeriksaan laboratorium
Alat yang digunakan pada penelitian ini, antara lain: kandang tikus, gunting bedah, disposible syringe, mikroskop binokuler, gelas obyek dan cover glass, mikrotom, tabung reaksi, pipet pasteur steril, tabung silikon, pipet mikro, beker gelas, NGT no.10, spuit 1 cc, spuit 3 cc, spuit 5 cc dan lemari es, Gluko DR® Bio Sensor, timbangan, aluminium foil, pot, formalin 10 % untuk fiksasi jaringan.
Untuk Hematoxillin Eosin dan Imunohistokimia meliputi H2O2 3%, xylol,
alkohol 100%, PBS, HCL 0.5 M, antibodi primer SOD dan biotinylated secondary Ab (anti rabbit), streptavidin berlabel peroksidase, pewarna Meyer-hematoxilen, TrisHCl pH 6.8, entelen, akuades steril, parafin lunak, poli-D-lysin, BSA 3%, tripsin 0.025%, substrat DAB.
3.7 Prosedur Penelitian 3.7.1 Tahap persiapan
Untuk menjamin bahwa semua prosedur yang dilakukan pada penelitian ini laik etik, maka sebelum dilakukan penelitian proposal diajukan terlebih dahulu pada komisi Etik Fakultas Kedokteran Universitas Sumatera Utara untuk mendapatkan penilaian dan pengesahan kelaikan etik.
3.7.2 Prosedur induksi diabetes menggunakan streptozotocin.
a. Tikus dipuasakan selama 4 jam untuk mengosongkan lambung dan mengurangi risiko aspirasi.
c. Hitung kebutuhan dapar sitrat yang dibutuhkan dengan konsentrasi streptozotocin 22,5 mg/ml dalam dapar sitrat.
d. Siapkan tabung dan bungkus dengan aluminium foil pada bagian luarnya.
e. 15 – 20 menit sebelum induksi, timbang streptozotocin yang dibutuhkan kemudian larutkan ke dalam dapar sitrat dengan volume yang telah ditentukan.
f. Masukan larutan streptozotocin yang diperoleh kedalam tabung berbungkus aluminium foil.
g. 30 detik – 1 menit sebelum induksi pindahkan larutan streptozotocin ke dalam spuit 1 ml.
h. Injeksikan larutan streptozotocin melalui intraperitoneal tikus sesuai dengan kebutuhan dosis per ekor. Induksi dilakukan hanya satu kali. i. Berikan larutan sukrosa 10% atau dekstrosa 10% sepanjang malam
pertama setelah induksi untuk menghindari sudden hypoglycemic post injection.
j. Setiap pagi tikus diperiksa kadar glukosa darah puasa (tikus dipuasakan dengan cara tidak diberi pakan dan kandang dikosongkan dari sekam selama 6 jam). Hiperglikemia yang bermakna akan dijumpai 2 hari setelah induksi.
3.7.3 Prosedur pemberian curcuminoid
Curcuminoid (kadar curcuminoid 80%) dosis 200 mg dan 400 mg disuspensikan dalam Carboxy Methyl Cellulose (CMC) 0.5% (CMC dibuat dengan mensuspensikan 0.5 gram CMC dalam 100 cc larutan akuades). Setelah disuspensikan, diberikan langsung ke lambung tikus dengan menggunakan Naso Gastric Tube (NGT).
3.7.4 Perlakuan pada tikus
Setelah tikus putih beradaptasi terhadap lingkungan kandang di laboratorium selama 2 minggu, selanjutnya perlakuan diberikan sesuai dengan kelompok yang direncanakan.
Tikus dikorbankan dengan inhalasi eter, dilakukan nekropsi jaringan tulang temporal kepala tikus. Sampel jaringan diambil, difiksasi dengan larutan buffer formalin 10% dan dilakukan dekalsifikasi dengan EDTA selama 4 minggu. Selanjutnya dilakukan pemeriksaan laboratorium.
3.7.6 Pemeriksaan laboratorium
a. Fiksasi jaringan dengan pembuatan paraffin block jaringan.
Jaringan tulang didekalsifikasi dengan menggunakan EDTA selama 4 minggu. Jaringan selanjutnya dicuci dengan PBS 3-5 kali untuk membersihkannya dari kontaminan. Kemudian jaringan difiksasi pada larutan formalin 10%. Setelah itu dilakukan dehidrasi dengan alkohol bertingkat (30%, 50%, 70%, 80%, 96% dan absolut) masing-masing selama 60 menit. Dilakukan clearing menggunakan xylol sebanyak 2 kali masing-masing 60 menit. Kemudian dilakukan impregnasi dengan parafin lunak selama 60 menit pada suhu 480C. Selanjutnya dilakukan blocking preparat dalam parafin keras pada cetakan dan didiamkan selama sehari.
b. Proses deparafinisasi
Dilakukan pemotongan blok parafin setebal 4 µm dengan rotary microtome. Jaringan yang sudah dipotong dimasukkan dalam air hangat, lalu diletakkan pada kaca.
c. Proses pewarnaan Hematoxilin Eosin
Dimasukkan sediaan ke dalam xylol sebanyak 2 kali masing-masing selama 5 menit, setelah itu dilakukan rehidrasi dengan alkohol berseri (absolut, 96%, 80%, 70%, 50% dan 30%) masing-masing selama 5 menit, kemudian bilas dalam dH2O selama 5
menit. Warnai sediaan dengan Hematoxilin selama 10 menit, setelah itu direndam dalam tap water selama 10 menit lalu dibilas dengan dH2O. Sediaan selanjutnya diwarnai kembali dengan
larutan Eosin selama 3 menit lalu didehidrasi dengan alkohol berseri 30% dan 50% masing-masing selama 5 menit, cuci dengan dH2O selama 5 menit dan dikering-anginkan. Inkubasi kembali
kemudian dilakukan mounting dengan entelan dan tutup dengan cover glass.
d. Pemeriksaan ekspresi SOD dengan teknik imunohistokimia.
Masukkan sediaan ke dalam xylol sebanyak 2 kali masing-masing selama 5 menit, setelah itu dilakukan rehidrasi dengan alkohol berseri (absolut, 96%, 80%, 70%, 50% dan 30%) masing-masing selama 5 menit, kemudian dibilas dalam dH2O selama 5 menit.
Masukkan kembali ke dalam H2O2 3% selama 20 menit, lalu cuci
menggunakan PBS pH 7.4 sebanyak 3 kali selama 5 menit. Blocking protein non-spesifik dilakukan dengan menggunakan 5% FBS yang mengandung 0.25% Triton X-100. lalu cuci kembali dengan PBS pH 7.4 sebanyak 3 kali, selama 5 menit. Inkubasi dengan menggunakan antibodi primer [Polyclonal Anti-SOD1 Antibody (Boster Biological Technology Co.,Ltd. cat#:1345)] selama 60 menit lalu cuci dengan PBS pH 7.4 sebanyak 3 kali selama 5 menit. Selanjutnya, sediaan direaksikan dengan antibodi sekunder (biotinylated secondary antibody) selama 60 menit, lalu cuci kembali dengan PBS pH 7.4 sebanyak 3 kali selama 5 menit. Inkubasi dengan dengan steptavidin-HRP selama 60 menit, lalu cuci menggunakan PBS pH 7.4 sebanyak 3 kali selama 5 menit. Tetesi dengan DAB dan inkubasi selama 30 menit, lalu cuci menggunakan dH2O selama 5 menit. Masukkan sediaan ke dalam
larutan Mayer Hematoxylin sebagai counterstaining dan diinkubasi selama 10 menit, lalu cuci menggunakan tap water. Selanjutnya, sediaan dibilas dengan dH2O dan dikering-anginkan. Kemudian
dilakukan proses mounting menggunakan entelan lalu ditutup dengan cover glass.
3.7.7 Penghitungan sel pada pemeriksaan imunohistokimia
1. Penghitungan dilakukan terhadap semua slide yang ada. Setiap hewan coba diambil sampel jaringan, difiksasi dengan 10% formalin, dilakukan dekalsifikasi dengan EDTA selama 4 minggu. Masing-masing sampel jaringan dibuat sediaan irisan setebal 4 µm, kemudian diwarnai dengan Hematoxilin Eosin (HE).
2. Semua slide yang sudah berkode ditutup nomor kodenya dan diberi nomor baru secara acak sehingga pemeriksa dan peneliti yang ikut memeriksa tidak mengetahui slide yang diperiksa milik sampel yang mana (double blind).
3. Penghitungan dilakukan secara semi kuantitatif yaitu dengan mengalikan skor luas (p) x intensitas (i) dimana skor luas ditentukan dengan melihat luas daerah yang terwarnai positif (warna coklat) dengan skor : 0 = 0%; 1 = 10%; 2 = 10–50%; 3 = 50%, sedangkan skor intensitas adalah 0 = tidak terwarna, 1 = low (intensitas lemah), 2 = moderate (intensitas sedang), 3 = strong (intensitas kuat). Sehingga didapatkan hasil perkalian adalah 0 – 9.
4. Pemeriksa terdiri dari 2 orang, masing-masing yaitu peneliti dan pemeriksa ahli (dokter spesialis patologi anatomi).
5. Pemeriksaan dan penghitungan sel dilakukan secara terpisah diantara ke 2 pemeriksa, disesuaikan dengan kemampuan/kesediaan waktu pemeriksa.
6. Pemeriksaan dan penghitungan sel dilakukan terhadap masing-masing slide pada bidang pandang di dinding lateral koklea yaitu daerah yang ditandai dengan adanya fibroblas dengan pembesaran 40x.
7. Hasil penghitungan sel sesuai dengan slide yang diperiksa ditulis di lembar kerja pada kotak yang sesuai.
3.9 Analisis Statistik
BAB 4
HASIL PENELITIAN
4.1 Profil Ekspresi SOD pada Fibroblas Koklea Tikus Model Diabetes Mellitus
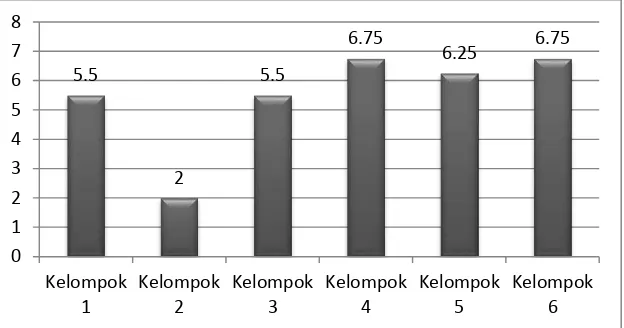
Hasil penelitian yang didapat berdasarkan pemeriksaan histopatologis dengan metode imunohistokimia. Diperoleh gambaran mikroskopis variabel yang mewakili tiap kelompok perlakuan yaitu ekspresi SOD pada fibroblas koklea tikus model DM (kelompok 2,3,4,5 dan 6). Gambaran jumlah sel yang mengekspresikan SOD pada keenam kelompok penelitian tampak pada gambar 4.1 dan tabel 4.1 dibawah ini:
Gambar 4.1 Nilai Rerata Ekspresi SOD pada Fibroblas Dinding Lateral Koklea Tiap Kelompok Perlakuan
Gambar 4.1 menunjukkan terjadinya penurunan ekspresi SOD pada fibroblas koklea tikus model DM yang tidak mendapatkan curcuminoid. Pemberian curcuminoid meningkatkan ekspresi SOD pada fibroblas koklea tikus model DM. Pada kelompok 4 dan 6 didapatkan perbedaan ekspresi SOD yang lebih tinggi, yang menunjukkan bahwa dosis curcuminoid yang lebih tinggi (400 mg/kgbb/hari/ekor) lebih baik dibanding dosis yang lebih rendah (200 mg/kgbb/hari/ekor) dalam meningkatkan ekspresi SOD pada fibroblas koklea yang diinduksi DM.
Tabel 4.1 Nilai Rerata dan Standar Deviasi Ekspresi SOD antara kelompok.
Kelompok (n=6)
Ekspresi SOD
Nilai Rerata Standar Deviasi
1 5.5 1.000
2 2 0.816
3 5.5 1.000
4 6.75 1.500
5 6.25 2.062
6 6.75 1.500
Keterangan:
- Nilai rerata ekspresi SOD terendah sebesar 2 ditemukan pada kelompok 2 dibandingkan kelompok lainnya, menggambarkan bahwa ekpresi SOD paling sedikit ditemukan pada kelompok model DM dibandingkan kelompok lainnya.
4.2 Pengecatan Hematoksilin Eosin dan Imunohistokimia Fibroblas Dinding Lateral Koklea
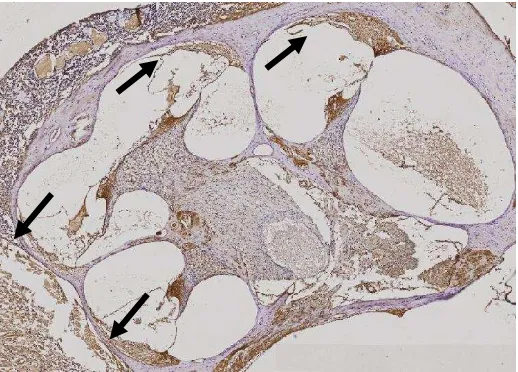
Pengecatan HE (Gambar 4.2) dilakukan untuk melihat potongan dinding lateral koklea yang tepat secara histopatologis dan kemudian digunakan sebagai pembanding untuk selanjutnya dilakukan pengecatan imunohistokimia (Gambar 4.3)
Gambar 4.2 Penampang Dinding Lateral Koklea Rattus Norvegicus (tanda panah) dengan Pengecatan HE (perbesaran 4)
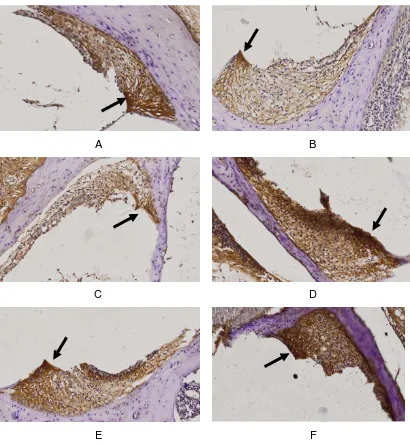
4.3 Hasil Uji Curcuminoid dalam meningkatkan Ekspresi SOD pada fibroblas koklea tikus model DM
A B
C D
E F
Keterangan:
Pada fibroblas koklea tikus model DM (kelompok 2) [Gambar 4.3 (B)] diatas menunjukkan densitas yang lebih rendah (warna coklat lebih pucat) dan ekspresi SOD (warna coklat yang lebih sedikit pada fibroblas koklea dibanding kelompok lainnya [Gambar 4.3 (A), (C), (D), (E), (F)]. Pada fibroblast koklea tikus model DM yang mendapatkan curcuminoid dosis 400 mg/kgbb/hari/ekor selama 5 dan 10 hari [Gambar 4.3 (D), (F)] menunjukkan densitas yang lebih tinggi dan ekspresi SOD yang lebih banyak dibandingkan kelompok yang mendapatkan curcuminoid dosis 200 mg/kgbb/hari/ekor selama 5 dan 10 hari [Gambar 4.3 (C), (E)]. Kelompok kontrol [Gambar 4.3 (A)] menunjukkan densitas dan ekspresi SOD yang lebih banyak dibandingkan kelompok DM [Gambar 4.3 (B)]. Hasil ini menunjukkan perbedaan jumlah sel yang mengekspresikan protein SOD pada fibroblas koklea antara semua kelompok.
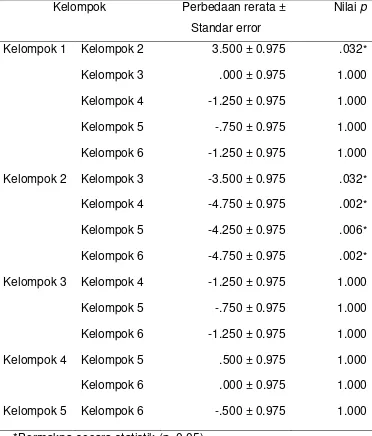
Tabel 4.2 Hasil Uji ANOVA terhadap Ekspresi SOD pada Setiap Kelompok
Kelompok Perbedaan rerata ± Standar error
Nilai p
Kelompok 1 Kelompok 2 3.500 ± 0.975 .032*
Kelompok 3 .000 ± 0.975 1.000
Kelompok 4 -1.250 ± 0.975 1.000
Kelompok 5 -.750 ± 0.975 1.000
Kelompok 6 -1.250 ± 0.975 1.000
Kelompok 2 Kelompok 3 -3.500 ± 0.975 .032*
Kelompok 4 -4.750 ± 0.975 .002*
Kelompok 5 -4.250 ± 0.975 .006*
Kelompok 6 -4.750 ± 0.975 .002*
Kelompok 3 Kelompok 4 -1.250 ± 0.975 1.000
Kelompok 5 -.750 ± 0.975 1.000
Kelompok 6 -1.250 ± 0.975 1.000
Kelompok 4 Kelompok 5 .500 ± 0.975 1.000
Kelompok 6 .000 ± 0.975 1.000
Kelompok 5 Kelompok 6 -.500 ± 0.975 1.000
*Bermakna secara statistik (p<0.05)
BAB 5 PEMBAHASAN
5.1 Pengaruh Curcuminoid terhadap Ekspresi SOD pada Fibroblas Koklea Rattus norvegicus
Penelitian ini dilakukan untuk menjelaskan efek curcuminoid terhadap perubahan molekuler fibroblas koklea yang mendasari mekanisme terjadinya kerusakan koklea akibat stress oksidatif pada diabetes melitus. Informasi yang ditemukan dalam penelitian ini diharapkan dapat menjadi kajian ilmiah dalam memperjelas mekanisme sampai memperbaiki kerusakan pada tingkat molekuler.
Pada penelitian ini induksi diabetes melitus dilakukan dengan menggunakan streptozotocin dosis tunggal yang akan mengakibatkan terjadinya kerusakan sel pankreas. Kerusakan sel pankreas tersebut selanjutnya menyebabkan stress hiperglikemik yang mendasari terjadinya patogenesis berbagai komplikasi diabetes melitus, termasuk kerusakan koklea. Pemberian curcuminoid diharapkan dapat mengatasi stress oksidatif yang dapat menyebabkan kerusakan yang terjadi secara molekuler sehingga gangguan pendengaran dapat dicegah.
Koklea, terutama stria vaskularis, adalah organ yang sangat tergantung pada mikrovaskuler. Permeabilitas endotel yang meningkat dapat mengakibatkan perubahan pada keseimbangan elektrolit dalam endolimfe yang berakibat kepada proses tranduksi dan transmisi sinyal pada sel-sel rambut (Frisina dkk., 2006). Sedangkan organ Corti sebagai organ pendengaran memiliki komponen yang kompleks dan menjadi target organ yang berpotensial rusak akibat hiperglikemia (Pemmaiah & Srinivas, 2011).
glycosylation end products atau AGEs melalui non enzim glikolasi dari protein intra dan ekstraselular, 2) hiperglikemi meningkatkan metabolisme glukosa melalui jalur sorbitol, 3) hiperglikemia meningkatkan pembentukan diasilgliserol yang mengakibatkan aktvasi protein kinase C atau PKC, 4) Hiperglikemi meningkatkan aliran darah melalui jalur heksosamin, yang menyebabkan terbentuknya fruktosa 6 fosfat, sebuah bahan yang menghasilkan produk glikosilasi O- linked dan proteoglikan (Powers, 2008).
Menurut Frisina et al (2006), hiperglikemi mengakibatkan perubahan biokimia dalam sistem metabolik. Tiga konsekuensi utama berupa pemecahan glukosa non enzimatik, aktivasi jalur polyol dan pembentukan Reactive Oxygen Species atau ROS. Meskipun semua individu dengan proses penuaan mengalami proses fisiologik abnormal yang sama seperti oksidasi yang meningkat, glikasi dan meningkatnya produk akhir selama metabolisme oksidatif, proses ini terjadi lebih cepat pada penderita diabetes melitus.
Pada penelitian penelitian sebelumnya yang menggunakan hewan coba dengan pajanan bising sebagai stresor mendapatkan bahwa fibroblas dinding lateral koklea merupakan sel yang labil dan responsif terhadap stimulus. Pajanan bising dapat menyebabkan gangguan pada fibroblas yang diamati secara histopatologi tanpa adanya kerusakan pada sel sensoris (Hirose & Liberman, 2003; Purnami, 2009).
Berdasar pada penelitian sebelumnya, pada penelitian ini digunakan curcuminoid dengan dosis 200 mg/kgbb/hari per ekor karena pada dosis tersebut curcuminoid mampu berperan sebagai antioksidan (Gonzalez-Salazar et al., 2011; Bayrak et al., 2008) dan digunakan dosis 2x lipatnya untuk melihat apakah terdapat pengaruh pemberian dosis terhadap ekspresi SOD. Selain itu juga dihipotesiskan bahwa terdapat pengaruh durasi pemberian curcuminoid terhadap ekspresi SOD (dose and time dependent) (Van Erk et al., 2004).
dengan terjadinya stres oksidatif akibat hiperglikemia. SOD merupakan enzim antioksidan lini pertama yang berperan dalam katalisis radikal superoksida menjadi hidrogen peroksida dan oksigen. SOD ekstraseluler juga merupakan satu satunya enzim antioksidan yang dapat berperan sebagai scavenger superoksida pada kompartemen ekstraseluler (Nozik-Grayck, Suliman & Piantadosi, 2005). Pada diabetes, keadaan hiperglikemia meningkatkan stress oksidatif melalui beberapa jalur. Mekanisme yang sangat penting adalah overproduksi anion superoksida melalui rantai transport elektron di dalam mitokondria. Pembentukan spesies oksigen fisiologis (terutama radikal superoksida) terjadi pada saat transfer elektron oleh sitokrom dalam proses rantai tranpor elektron. Hiperglikemia menyebabkan peningkatan produksi donor elektron (NADH dan FADH2) pada siklus trikarboksilat (Aronson, 2009).
Hasil tersebut diatas sesuai dengan hasil penelitian oleh Kasznicki et al (2012) yang mendapatkan penurunan kadar SOD secara signifikan pada plasma penderita diabetes yang menderita distal symmetric polyneuropathy (DSPN). Palma et al (2014) juga mendapatkan hal yang sama, bahwa aktivitas SOD menurun pada plasma dan hepar tikus model diabetes melitus.
jalur antioksidan (Jagetia & Rajanikant, 2015; Tapia et al., 2012). Selain itu curcumin bekerja melalui inhibisi aktivitas seluler yang menghasilkan ROS melalui inhibisi aktivitas enzim NADPH oksidase, lipoksigenase/siklooksigenase, xantin dehidrogenase, dan nitrit oksid sintase, yang pada akhirnya akan meningkatkan bioavailabilitas enzim antioksidan seluler (Khan & Mahboob, 2014).
Hasil tersebut diatas sesuai dengan penelitian yang dilakukan oleh Jagetia & Rajanikant (2015) yang mendapatkan bahwa pemberian curcumin sebelum dan sesudah radiasi pada tikus dapat meningkatkan ekspresi SOD. Tapia et al (2012) juga mendapatkan hal yang serupa pada percobaan yang melihat efek curcumin terhadap status oksidan-antioksidan pada ginjal tikus yang mengalami stres oksidatif akibat nefrektomi. Peranan curcumin dan regulasi ekspresi SOD juga didapati oleh penelitian Jena et al (2013). Penelitian tersebut memperlihatkan efektivitas curcuminoid dalam memperbaiki dan meningkatkan ekspresi SOD pada korteks serebrum dan serebelum yang mengalami stress oksidatif akibat PTU (6-propyl-2thiouracil).
Pada penelitian ini didapati perbedaan yang tidak signifikan secara statistik (p>0.05) dalam hal perbedaan dosis dan durasi pemberian curcuminoid. Besarnya dosis yang diberikan tidak mempengaruhi ekspresi SOD yang telihat pada kelompok 3 dan 4, serta 5 dan 6, dimana dosis 400 mg/kgbb/hari/ekor tidak menunjukkan peningkatan ekspresi SOD yang bermakna dibanding dengan dosis 200 mg/kgbb/hari/ekor.
Selain perbedaan besarnya dosis, perbedaan durasi pemberian curcuminoid juga tidak memberikan pengaruh terhadap ekspresi SOD. Hal ini terlihat pada kelompok 3 dan 5, serta 4 dan 6, dimana curcuminoid dengan dosis yang sama (200 mg/kgbb/hari/ekor atau 400 mg/kgbb/hari/ekor) diberikan dalam waktu yang berbeda (5 dan 10 hari) tidak menunjukkan perbedaan ekspresi SOD yang bermakna.
CAT pada fibroblas dinding lateral koklea yang diinduksi bising. Selain itu penelitian oleh Van Erk et al (2004) yang meneliti tentang peranan curcumin terhadap ekspresi berbagai gen pada sel kanker kolon mendapatkan hasil bahwa pada sel kanker kolon yang dipaparkan dengan dua konsentrasi curcumin yang berbeda serta beberapa durasi paparan curcumin yang berbeda, terjadi perbedaan ekspresi berbagai gen pada perbedaan perlakuan tersebut, yang mengindikasikan bahwa efek curcumin bersifat time and dose dependent.
Perbedaan hasil yang didapatkan pada penelitian ini dapat terjadi akibat variasi dosis pemberian curcuminoid antar kelompok tidak jauh berbeda (200 mg/kgbb/hari dan 400 mg/kgbb/hari), serta variasi durasi pemberian curcuminoid juga cukup kecil (5 hari dengan 10 hari) sehingga belum memberikan perbedaan dalam hal ekspresi SOD. Faktor lain yang dapat berpengaruh adalah sifat curcumin yang dapat berperan sebagai antioksidan pada dosis kecil, namun bersifat sebagai prooksidan pada dosis besar( Malik & Mukherjee, 2014). Hal tersebut telah ditunjukkan oleh beberapa penelitian, dimana curcumin pada dosis kecil mengurangi produksi ROS, namun pada dosis besar justru meningkatkan produksi ROS pada penelitian terhadap sel leukemia manusia (Chen et al., 2005). Penelitian lain menunjukkan bahwa curcumin dosis rendah (<10microM) dapat mencegah deplesi enzim antioksidan GSH namun pada dosis yang lebih tinggi malah menyebabkan penurunan GSH secara bertahap pada sel darah merah yang mengalami kerusakan oksidatif (Banerjee et al., 2008). Selain hal-hal tersebut diatas, faktor lain yang juga dapat berpengaruh adalah faktor farmakodinamik yang dapat mempengaruhi efikasi obat, yaitu ceiling effect yaitu aktivitas intrinsik maksimal obat, dimana penambahan dosis yang lebih besar tidak memberikan penambahan efikasi obat.
5.2 Keterbatasan Penelitian
BAB 6
KESIMPULAN DAN SARAN 6.1 Kesimpulan
Berdasarkan hasil penelitian yang dilakukan, dapat diambil beberapa kesimpulan sebagai berikut:
1. Curcuminoid dapat meningkatkan ekspresi SOD pada fibroblas koklea tikus model diabetes mellitus yang bermakna secara statistik (p<0.05). 2. Curcuminoid dosis 400 mg/kgbb/ekor/hari tidak terbukti lebih baik dibandingkan dosis 200 mg/kgbb/ekor/hari dalam meningkatkan ekspresi SOD pada Rattus norvegicus model diabetes mellitus, dimana pada pada penelitian ini didapatkan perbedaan yang tidak bermakna secara statistik (p>0.05).
3. Curcuminoid dosis 200 mg/kgbb/ekor/hari yang diberikan selama 10 hari tidak terbukti lebih baik dibandingkan dengan curcuminoid 200 mg/kgbb/ekor/hari yang diberikan selama 5 hari dalam meningkatkan ekspresi SOD pada Rattus norvegicus model diabetes mellitus, dimana pada pada penelitian ini didapatkan perbedaan yang tidak bermakna secara statistik (p>0.05).
6.2 Saran
Berdasarkan hasil penelitian yang dilakukan, dapat disampaikan beberapa saran sebagai berikut:
1. Perlu dilakukan penelitian dengan penambahan kelompok yang mendapatkan terapi curcuminoid sebelum dilakukan induksi diabetes melitus untuk melihat apakah curcuminoid memiliki sifat preventif terhadap terjadinya stres oksidatif pada fibroblas koklea.
2. Perlu dilakukan penelitian dengan pemilihan sediaan curcuminoid yang memiliki bioavailabilitas yang baik, seperti nanocurcumin atau kapsul liposom.