BAB I sebagian atau seluruh jaringan otak karena cetusan listrik pada neuron (sel saraf) peka rangsang yang berlebihan, yang dapat menimbulkan kelainan motorik, sensorik, otonom atau psikis yang timbul tiba-tiba dan sesaat disebabkan lepasnya muatan listrik abnormal sel-sel otak (Gofir dan Wibowo, 2006).
Epilepsi didefinisikan sebagai suatu gangguan atau terhentinya fungsi otak secara periodik yang disebabkan oleh terjadinya pelepasan muatan listrik secara berlebihan dan tidak teratur oleh sel-sel otak dengan tiba-tiba, sehingga penerimaan dan pengiriman impuls antara bagian otak dan dari otak ke bagian lain tubuh terganggu. Menurut Gibbs, epilepsi ialah suatu “paroxysmal cerebral dysrhytmia”, dengan gejala-gejala klinis seperti di atas. Dasar disritmia ini ialah elektrobiokimiawi (Maramis, 2005). Pada dasarnya setiap orang dapat mengalami epilepsi. Setiap orang memiliki otak dengan ambang bangkitan masing-masing apakah lebih tahan atau kurang tahan terhadap munculnya bangkitan. Selain itu penyebab epilepsi cukup beragam: cedera otak, keracunan, stroke, infeksi, infestasi parasit, tumor otak. Epilepsi dapat terjadi pada laki-laki maupun perempuan, umur berapa saja, dan ras apa saja. Jumlah penderita epilepsi meliputi 1-2% dari populasi. Secara umum diperoleh gambaran bahwa insidensi epilepsi menunjukan pola bimodal: puncak insidensi terdapat pada golongan anak dan usia lanjut.
faktor risiko untuk terkena kondisi maupun penyakit yang akan mengarahkan pada cedera otak adalah lebih tinggi dibanding negara industri (WHO, 2006).
Prevalensi epilepsi di Indonesia berkisar antara 0,5-2% (Paryono dkk, 2003). Sekitar 1,1 juta hingga 1,3 juta penduduk Indonesia mengidap penyakit epilepsi (Depkes, 2006). Pengobatan Epilepsi diantaranya bertujuan untuk membuat penderita terbebas dari serangan, khususnya serangan kejang, sedini/seawal mungkin tanpa mengganggu fungsi normal saraf pusat dan penderita dapat melakukan tugas tanpa bantuan. Terapi meliputi terapi kausal, terapi dengan menghindari faktor pencetus, dan memakai obat antikonvulsi (Utama dan Gan, 2012).
Salah satu obat yang berperan sebagai antiepilepsi dan antikonvulsi adalah fenobarbital. Fenobarbital adalah obat golongan barbiturat yang bekerja pada sistem saraf pusat yang dapat menekan letupan pada fokus epilepsi sehingga meredakan konvulsi yang terjadi. Beberapa sediaan fenobarbital dijumpai dalam bentuk tablet yang merupakan salah satu bentuk sediaan farmasi dengan tekstur yang padat.
Dalam setiap sediaan terdapat ketentuan atau syarat yang harus dipenuhi, begitu pula dengan sediaan tablet yang terdapat syarat mutlak yang harus disesuaikan. Farmakope Indonesia adalah pedoman yang telah distandarisasi bagi seluruh petugas kesehatan, khususnya farmasi, seperti bahan baku obat serta sediaan jadinya, sediaan produk biologis, alat kesehatan, metode analisis, prosedur beserta instrumennya dan lain sebagainya.
B. Identifikasi Masalah
Berdasarkan latar belakang yang telah diuraikan, maka identifikasi masalah dalam praktikum ini yaitu :
1. Epilepsi didefinisikan sebagai suatu gangguan atau terhentinya fungsi otak secara periodik.
2. Epilepsi adalah kelainan neurologis kronik yang terdapat di seluruh dunia. 3. Insiden epilepsi di dunia berkisar antara 33-198 tiap 100.000 penduduk tiap
tahunnya.
4. Sekitar 1,1 juta hingga 1,3 juta penduduk Indonesia mengidap penyakit epilepsi.
5. Salah satu obat yang berperan sebagai antiepilepsi dan antikonvulsi adalah fenobarbital.
6. Dalam setiap sediaan terdapat ketentuan atau syarat yang harus dipenuhi, begitu pula dengan sediaan tablet yang terdapat syarat mutlak yang harus disesuaikan.
7. Untuk tercapainya efek terapi yang diinginkan, setiap pasien seharusnya mendapatkan terapi pengobatan yang rasional, salah satunya dari segi ketepatan dosis yang diberikan.
C. Batasan Masalah
Adapun batasan masalah dalam praktikum ini adalah sebagai berikut :, 1. Sampel fenobarbital yang diujikan adalah sediaan tablet.
2. Penatapan kadar tablet fenobarbital menggunakan metode bromometri. D. Rumusan Masalah
Berdasarkan identifikasi serta batasan masalah yang telah dikemukakan, maka rumusan masalah dalam praktikum ini adalah sebagai berikut :
1. Bagaimana prinsip-prinsip dasar metode bromometri ?
E. Tujuan Praktikum
Tujuan dari percobaan ini adalah :
1. Mengetahui prinsip-prinsip dasar metode bromometri.
2. Menetapkan kadar tablet fenobarbital dengan metode bromometri. F. Manfaat Praktikum
BAB II
TINJAUAN PUSTAKA
A. Antiepileptika
Epilepsi (Yunani, serangan) atau sawan atau penyakit ayan adalah suatu gangguan saraf yang timbul secara tiba-tiba dan berkala, biasanya dengan perubahan kesadaran (Tan Hoan Tjay dan Kirana Rahardja, 2015). Bangkitan ini biasanya disertai kejang (konvulsi), hiperaktivitas otonomik, gangguan sensorik atau psikis dan selalu disertai gambaran letupan EEG (abnormal dan eksesif). Untuk penyakit epilepsi, gambaran EEG bersifat diagnostik. Berdasarkan gambaran EEG, epilepsi dapat dinamakan disritmia serebral yang bersifat paraoksismal (Utama dan Gan, 2012).
Dikenal sejumlah jenis epilepsi dan yang paling lazim adalah bentuk serangan luas (grand mal, petit mal, absence) pada sebagian besar otak terlibat dan serangan parsial pada pelepasan muatan listrik hanya terbatas sampai sebagian otak (Tan Hoan Tjay dan Kirana Rahardja, 2015) :
1. Grand mal (Perancis, penyakit besar) atau serangan tonis-klonis ‘generalized’ (Yunani, tonis = kontraksi otot otonom yang bertahan lama, klonos = kontraksi ritmis). Bercirikan kejang kaku bersamaan dengan kejutan-kejutan ritmis dari anggota badan dan hilangnya untuk sementara kesadaran dan tonus. Pada umumnya serangan demikian diawali oleh suatu perasaan alamat khusus (aura). Hilangnya tonus menyebabkan penderita terjatuh, berkejang hebat dan otot-ototnya menjadi kaku.
berhenti bergerak, terutama anak-anak. Setelah serangan, anak kemudian melanjutkan aktivitasnya seolah-olah tidak terjadi apa-apa.
3. Parsial (epilepsi psikomotor). Bentuk serangan parsial pada umumnya berlangsung dengan kesadaran hanya menurun untuk sebagian tanpa hilangnya ingatan. Penderita memperlihatkan kelakuan otomatis tertentu seperti gerakan mengunyam dan/atau menelan atau berjalan dalam lingkaran.
Ini dapat disebabkan oleh berbagai hal: pengaruh pada pompa Na+, K+
akibat defisiensi energi (misalnya akibat hipoglikemia, hipoksia, inhibitor enzim), turunannya potensial membrane akibat gangguan elektrolit, depolarisasi membran sel akibat naiknya konsentrasi neurotransmitter eksitasi atau turunnya konsentrasi neurotransmitter inhibisi, atau gagalnya sinapsis inhibitorik. Sekelompok neuron yang mudah terangsang (neuron epileptik) membentuk suatu fokus (pengatur langkah, satuan epileptik fungsional). Keistimewaan fokus semacam ini adalah, bahwa neuron-neuronnya pada kondisi tertentu (misalnya dengan naiknya pH) akan dimuati bersama-sama (sinkron). Sinkronisasi ini merupakan syarat terjadinya serangan epilepsi. Manifestasi secara klinis akan terjadi jika aktivitas (hipersinkron) ini menyebar ke bagian lain system saraf, artinya rangsangan menyerang bagian otak lainnya (Mutschler, 1991).
B. Barbiturat
Barbiturat selama beberapa saat telah digunakan secara ekstensif sebagai hipnotik dan sedatif. Namun sekarang kecuali untuk beberapa penggunaan yang spesifik, barbiturat telah banyak digantikan oleh benzodiazepin yang lebih aman. Secara kimia, barbiturat merupakan derivat asam barbiturat. Asam barbiturat (2,4,6-trioksoheksahidropirirmidin) merupakan hasil reaksi kondensasi antara urea dengan asam malonat. Asam barbiturat sendiri tidak menyebabkan depresi SSP, efek hipnotik dan sedatif serta efek lainnya ditimbulkan bila pada posisi 5 ada gugusan alkil atau aril (Ganiswara, 1995).
neurotransmitor misalnya ACh, dan untuk repolarisasi membran sel neuron setelah depolarisasi (Utama dan Gan, 2012).
Barbiturat bekerja pada seluruh SSP, walaupun pada setiap tempat tidak sama kuatnya. Dosis nonanestesi teruatama menekan respons pasca sinaps. Penghambatan hanya terjadi pada sinaps GABA-nergik. Walaupun demikian efek yang terjadi mungkin tidak semuanya melalui GABA sebagai mediator. Barbiturat memperlihatkan beberapa efek yang berbeda pada eksitasi dan inhibisi transmisi sinaptik. Kapasitas barbiturat membantu kerja GABA sebagian menyerupai kerja benzodiazepine, namun pada dosis yang lebih tinggi bersifat sebagai aganis GABA-nergik, sehingga pada dosis tinggi barbiturat dapat menimbulkan depresi SSP yang berat (Ganiswara, 1995).
Barbital-barbital semuanya bersifat lipofil, sukar larut dalam air tetapi mudah larut dalam pelarut-pelarut non polar seperti minyak, kloroform dan sebagainya. Sifat lipofil ini dimiliki oleh kebanyakan obat yang mampu menekan SSP. Dengan meningkatnya sifat lipofil ini, misalnya dengan mengganti atom oksigen pada atom C2 menjadi atom belerang, maka efek dan lama kerjanya
dipercepat, dan seringkali daya hipnotiknya diperkuat pula (Tadjuddin, 2001). C. Fenobarbital
Fenobarbital asam 5,5-fenil-etil barbiturat merupakan senyawa organik pertama yang digunakan dalam pengobatan antikonvulsi (Utama dan Gan, 2012). Senyawa hipnotik ini (1912) terutama digunakan pada serangan grand mal dan status epileptikus berdasarkan sifatnya yang dapat memblokir pelepasan muatan listrik di otak. Untuk mengatasi efek hipnotiknya, obat ini dapat dikombinasi dengan kofein. Tidak boleh diberikan pada absences karena justru dapat memperburuknya (Tan Hoan Tjay dan Kirana Rahardja, 2015).
Kerjanya membatasi penjalaran aktivitas dan bangkitan dan menaikkan ambang rangsang. Fenobarbital masih merupakan obat antikonvulsi pilihan kaena cukup efektif dan murah (Utama dan Gan, 2012). Absorbsi di usus baik (70-90%) dan ± 50% terikat pada protein; plasma-t1/2 panjang, ± 3-4 hari, maka dosisnya
p-hidroksifenobarbital yang dieksresi lewat urin dan hanya 10-30% dalam keadaan utuh (Tan Hoan Tjay dan Kirana Rahardja, 2015).
Efek samping berkaitan dengan efek sedasinya yaitu pusing, mengantuk, ataksia, dan pada anak-anak mudah terangsang. Efek samping ini dapat dikurangi dengan penambahan obat-obat lain (Tan Hoan Tjay dan Kirana Rahardja, 2015). Selain itu, efek samping ini dapat diatasi dengan pemberian stimulant sentral tanpa mengurangi efek antikonvulsinya (Utama dan Gan, 2012).
Fenobarbital bersifat menginduksi enzim dan antara lain mempercepat penguraian kalsiferol (Vitamin D2) dengan kemungkinan timbulnya rachitis
(penyakit Inggris) pada anak kecil. Penggunaan bersama valproate harus hati-hati, karena kadar darah fenobarbital dapat ditingkatkan. Dilain pihak, kadar darah fenitoin dan karbamazepin serta efeknya dapat diturunkan oleh fenobarbital (Tan Hoan Tjay dan Kirana Rahardja, 2015).
D. Bromometri
Bromometri merupakan salah satu metode penetapan kadar suatu zat dengan prinsip reaksi reduksi-oksidasi. Oksidasi adalah suatu proses yang mengakibatkan hilangnya aatu elektron atau lebih dari dalam zat (atom, ion atau molekul). Bila suatu unsur dioksidasi, keadaan oksidasinya berubah ke harga yang lebih positif. Suatu zat pengoksidasi adalah zat yang memperoleh elektron dan dalam proses itu zat tersebut direduksi (Rivai, 1995).
Bromometri merupakan penentuan kadar senyawa berdasarkan reaksi reduksi-oksidasi dimana proses titrasi (reaksi antara reduktor dan bromin berjalan lambat), sehingga dilakukan titrasi secara tidak langsung dengan menambahkan bromin berlebih (Susanti, 1997).
Reduksi adalah suatu proses yang mengakibatkan diperoleh satu elektron atau lebih oleh zat (atom, ion atau molekul). Bila suatu unsur direduksi, keadaan oksidasi berubah menjadi lebih negatif (kurang positif), jadi suatu zat pereduksi adalah zat yang kehilangan elektron, dalam proses itu zat ini dioksidasi (Rivai, 1995).
Oksidasi dan reduksi selalu berlangsung dengan serempak. Ini sangat jelas karena elektron yang dilepaskan oleh sebuah zat harus diambil oleh zat yang lain.jika orang membicarakan oksidasi suatu zat, ia harus ingat bahwa pada saat yang sama reduksi dari suatu zat juga berlangsung (Underwood dan Day, 2002).
Bromometri merupakan salah satu metode oksidimetri dengan dasar reaksi dari ion bromat (BrO3). Oksidasi potensiometri yang relatif tinggi dari
sistem ini menunjukkan bahwa kalium bromat adalah oksidator kuat. Hanya saja kecepatan reaksinya tidak cukup tinggi. Untuk menaikkan kecepatan ini titrasi dilakukan dalam keadaan panas dan dalam lingkungan asam kuat. Adanya sedikit kelebihan kalium bromat dalam larutan akan menyebabkan ion bromida bereaksi dengan ion bromat, dan bromin yang dibebaskan akan merubah larutan menjadi warna kuning pucat, warna ini sangat lemah sehingga tidak mudah untuk menetapkan titik akhir (Wunas dan Said, 1986).
Brom dapat digunakan sebagai oksidator seperti iodium. Brom akan direduksi oleh zat-zat organik dengan terbentuknya senyawa hasil subtitusi yang tidak larut dalam air. Selain bromnya sendiri, brom dapat juga diperoleh dari hasil pencampuran kalium bromat dan kalium bromida dalam lingkungan asam kuat. Beberapa senyawa yang dapat ditetapkan kadarnya dengan larutan baku brom dalam Farmakope Indonesia Edisi IV : klorokresol, fenol, fenol cair, fenileprin HCl, resorsinol, dan timol (Gandjar, 2007).
BAB III
METODOLOGI PENELITIAN
A. Waktu dan Tempat Praktikum
Waktu dan tempat pelaksaan praktikum ini dilaksanakan pada tanggal 3 November 2016, dilaksanakan di Laboratorium Biologi dan Laboratorium Kimia Fakultas Ilmu Kesehatan Universitas Muhammadiyah Palangkaraya.
B. Metode Praktikum
i) Mortir dan stamper
Titrasi dengan larutan Na2S2O3 1 N hingga berwarna bening
Titrasi dengan larutan Na2S2O3 1 N hingga berwarna bening + Beberapa tetes larutan iodium 0,1 N hingga berwarna biru kehitaman + Beberapa tetes larutan iodium 0,1 N hingga berwarna biru kehitaman
+ 3 tetes indikator kanji 1% + 3 tetes indikator kanji 1%
Titrasi dengan Na2S2O3 1 N hingga berwarna cokelat
Titrasi dengan Na2S2O3 1 N hingga berwarna cokelat + 1 gr KI, simpan di tempat gelap selama 15 menit + 1 gr KI, simpan di tempat gelap selama 15 menit
BAB IV
HASIL DAN PEMBAHASAN
A. Hasil
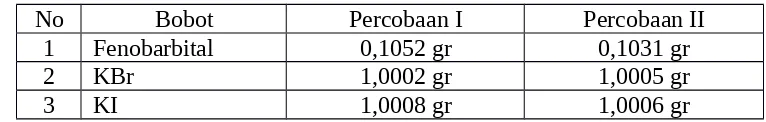
1. Data Penimbangan
Sampel yang digunakan adalah tablet fenobarbital dengan kandungan fenobarbital 30 mg setiap tabletnya dan percobaan dilakukan dengan 2 kali pengulangan.
Tabel 1. Data Penimbangan
No Bobot Percobaan I Percobaan II
1 Fenobarbital 0,1052 gr 0,1031 gr
2 KBr 1,0002 gr 1,0005 gr
3 KI 1,0008 gr 1,0006 gr
2. Data Pengamatan
Percobaan dalam penetapan kadar tablet fenobarbital ini dilakukan dengan 2 kali pengulangan. Berikut merupakan hasil pengamatan yang disajikan dalam bentuk tabel pengamatan :
Tabel
+ 1,0008 gr KI, simpan 15 menit di tempat yang gelap
Titrasi dengan larutan Na2S2O3
+ 3 tetes indikator kanji 1%
+ 50 tetes larutan iodium 0,1 N
Titrasi kembali dengan larutan
+ 1,0008 gr KI, simpan 15 menit di tempat yang gelap
B. Pembahasan
Fenobarbital merupakan obat golongan barbiturat yang berkhasiat sebagai hipnotik sedatif yang berefek utama depresif susunan saraf pusat (SSP). Hipnotika adalah zat-zat yang dalam dosis terapi diperuntukkan guna meningkatkan keinginan tidur dan mempermudah atau menyebabkan tidur. Lazimnya, obat ini diberikan pada malam hari. Bilamana zat-zat ini diberikan pada siang hari dalam dosis yang lebih rendah untuk tujuan menenangkan, maka dinamakan sedatif (obat-obat pereda). Hipnotika-sedativa termasuk dalam kelompok psikoepileptika yang mencakup obat-obat yang menekan atau menghambat fungsi-fungsi susunan saraf pusat.
Kini, hanya beberapa barbiturat yang masih digunakan untuk indikasi-indikasi tertentu seperti fenobarbital yang memiliki sifat antikonvulsif. Indikasi utama untuk antiepileptika dari golongan barbiturat ialah epilepsi mayor, terutama apa yang dinamakan epilepsi bangun tidur (serangan grand mal pada atau setelah bangun tidur) serta grand mal difus (serangan yang terjadi tanpa ada hubungan dengan ritme tidur-bangun). Disamping itu, fenobarbital digunakan pada status epileptikus yang resisten terhadap terapi lainnya (Mutschler, 1991). Overdosis barbital dapat menyebabkan depresi sentral dengan penghambatan pernapasan berbahaya, koma, hingga kematian.
Fenobarbital merupakan obat pilihan utama untuk terapi kejang demam pada anak. Dosis dewasa yang biasa digunakan adalah 2 kali 120 mg-250 mg sehari. Sedangkan dosis anak ialah 30-100 mg sehari. Untuk kejang demam yang berulang pada anak dapat diberikan dosis mua (loading dose) 6-8 mg/kgBB dan ditambah dengan dosis pemeliharaan 3-4 mg/kgBB. Untuk mengendalikan epilepsi disarankan kadar plasma optimal, berkisar antara 40µg/mL sering disertai gejala toksik yang nyata. Penghentian pemberian fenobarbital harus secara bertahap guna mencegah kemungkinan meningkatnya frekuensi bangkitan kembali, atau justru bangkitan status epileptikus (Utama dan Gan, 2012).
aktivitas GABA ditingkatkan, maka konvulsi yang terjadi dapat diturunkan atau diringankan. Selain itu, fenobarbital juga mencegah timbulnya pelepasan muatan listrik abnormal pada otak (focus) SSP sehingga meminimalisir terjadinya serangan yang dapat menimbulkan konvulsi dan epilepsi.
Pada percobaan ini dilakukan penetapan kadar fenobarbital yang terkandung pada sediaan tablet yang telah tersedia di laboratorium dengan menggunakan metode bromometri. Tablet fenobarbital adalah sediaan padat yang mengandung fenobarbital sebagai salah satu atau zat tunggal aktif. Bromometri merupakan penentuan kadar senyawa berdasarkan reaksi reduksi-oksidasi yaitu proses titrasi (reaksi antara reduktor dan bromin berjalan lambat) sehingga dilakukan titrasi secara tidak langsung dengan menambahkan bromin berlebih. Bromin yang dilepaskan akan merubah larutan menjadi warna kuning pucat. Warna ini sangat lemah sehingga tidak mudah untuk menetapkan titik akhir. Bromin yang dilepaskan tidak stabil karena mempunyai tekanan uap yang tinggi dan mudah menguap. Karena itu penetapan harus dilakukan pada suhu serendah mungkin, serta labu yang dipakai harus ditutup. Reaksi antara bromin dan zat yang akan ditetapkan kadarnya berjalan lambat, maka dilakukan titrasi secara tidak langsung, yaitu dengan menambahkan bromin dan dilakukan penetapan dengan dititrasi larutan natrium tiosulfat.
Sebelum dilakukan penimbangan, baik pada percobaan pertama maupun kedua, sampel digerus masing-masing menggunakan mortir dan stamper hingga halus. Pada percobaan pertama digunakan 105,2 mg sampel yang kemudian dilarutkan dengan 5 mL CHCl3 (kloroform). Penggunaan kloroform untuk
melarutkan fenobarbital karena menurut Farmakope Indonesia edisi V (2014), fenobarbital sukar larut dalam air dan dapat larut dalam etanol, eter serta kloroform. Selanjutnya ditambahkan 10 ml KBrO3 dan 1,0002 gr kalium bromida.
Baik sebelum maupun sesudah penambahan KBrO3 1 N dan KBr, larutan tidak
mengalami perubahan warna dan tetap dalam keadaan bening. Tujuan ditambahkannya larutan KBrO3 dan KBr yaitu untuk membentuk endapan Br2.
ditambahkan 5 mL H2SO4 1 N dan dihomogenkan sehingga larutan mengalami
perubahan warna menjadi kuning pekat. Penambahan H2SO4 dilakukan karena
titrasi ini berlangsung dengan menggunakan titran Na2S2O3 yang hanya boleh
dilaksanakan dalam suasana asam atau hampir netral. Hal ini disebabkan karena apabila tanpa penambahan asam dikhawatirkan akan terjadi disproporsionasi iod menjadi hipoiodit dan iodida, maka hipoiodit yang terbentuk akan mengoksidasi tiosulfat menjadi sulfat, sehingga dianggap penting dengan adanya H2SO4 untuk
membuat suasana asam. Selanjutnya, larutan tersebut ditambahkan 1,0008 gr KI sehingga larutan mengalami perubahan warna menjadi cokelat pekat dan larutan tersebut segera didiamkan di tempat yang gelap selama 15 menit. Sisa endapan Br2 yang sudah terbentuk tadi akan bereaksi dengan KI. Jadi, tujuan penambahan
KI yaitu untuk membebaskan I2. Adapun tujuan ditempatkan di tempat gelap yaitu
untuk menghasilkan iod yang baik karena iod mudah terpolarisasi oleh cahaya, sehingga nantinya tidak banyak iod yang terionisasi, berikut persamaan reaksi antara Br2 yang terbentuk dengan KI :
2KI + Br2 2KBr + I2
Setelah didiamkan, larutan dititrasi dengan larutan natrium tiosulfat (Na2S2O3) 1 N hingga larutan berubah warna menjadi cokelat. Volume larutan
Na2S2O3 yang digunakan adalah 4,2 mL. Kemudian, larutan sampel ditambahkan
3 tetes indikator kanji 1% dengan tujuan untuk mempertegas perubahan warna yang seharusnya terjadi pada perlakuan berikutnya. Selanjutnya larutan sampel ditambahkan 50 tetes larutan iodium 0,1 N dengan tujuan memberikan warna biru pada larutan, tetapi perubahan warna tersebut tidak dijumpai, selain itu pemberian larutan iodium 0,1 N juga dimaksudkan untuk memberikan kembali iod karena kemungkinan iod yang terkandung sudah terionisasi sempurna yang disebabkan karena titrasi yang berlebihan. Setelah itu, larutan tersebut kembali dititrasi dengan Na2S2O3 1 N hingga kembali menjadi bening dengan volume total Na2S2O3
yang digunakan adalah 6,2 mL. Pada percobaan ini, I2 bereaksi dengan Na2S2O3
dengan persamaan sebagai berikut :
Pada percobaan kedua, 103,1 mg sampel yang telah digerus halus diberikan perlakuan yang sama seperti pada percobaan pertama yaitu dilarutkan dalam 5 mL kloroform, ditambahkan 10 mL larutan KBrO3 1 N dan 1,0005 gr
KBr tanpa adanya perubahan warna larutan sehingga tetap dalam keadaan bening. Kemudian larutan sampel ditambahkan 5 mL H2SO4 1 N sehingga larutan
berwarna kuning pekat dan 1,0006 gr KI sehingga larutan berwarna cokelat pekat serta disimpan selama 15 menit di tempat yang gelap agar iod yang terkandung dapat terionisasi sempurna. Setelah penyimpanan, dilakukan proses titrasi menggunakan larutan Na2S2O3 1 N sehingga larutan berwarna cokelat dengan
volume larutan Na2S2O3 1 N yang digunakan sebanyak 4 mL. Kemudian, larutan
sampel ditambahkan 3 tetes indikator kanji 1% dan 50 tetes larutan iodium 0,1 N namun tidak ada perubahan warna yang terjadi. Selanjutnya larutan sampel dititrasi kembali dengan menggunakan larutan Na2S2O3 1 N sehingga larutan
kembali menajdi bening dengan volume larutan Na2S2O3 1 N yang digunakan
adalah sebanyak 8 mL.
Berdasarkan hasil percobaan ini dengan titik akhir titrasi saat larutan kembali bening, maka diperoleh kadar C12H12N2O3 pada percobaan pertama yaitu
1.368,7148% sedangkan pada percobaan kedua kadar C12H12N2O3 yaitu
1.802,0562% sehingga rata-rata dari keduanya adalah 1.585,3855%. Hal ini tidak sesuai dengan ketentuan yang terdapat pada Farmakope Indonesia edisi V (2014) yang menyatakan bahwa fenobarbital mengandung tidak kurang dari 98,0% dan tidak lebih dari 101,0% C12H12N2O3, dihitung terhadap zat yang telah dikeringkan.
Adanya ketidaksesuaian ini kemungkinan disebabkan oleh beberapa faktor, diantaranya yaitu kurangnya penambahan KBr, hal ini disesuaikan dengan persamaan reaksi berikut :
H2SO4 + 2KBr 2HBr + K2SO4
Dari persamaan tersebut, 1 mol H2SO4 bereaksi dengan 2 mol KBr yang
artinya untuk memperoleh suatu reaksi kimia, 5 ml H2SO4 harus ditambahkan 10
gr (2 kali) KBr. Selanjutnya, konsentrasi titran yang digunakan (Na2S2O3) terlalu
mol I2 memerlukan 2 mol Na2S2O3 sehingga seharusnya Na2S2O3 yang digunakan
adalah 0,2 N (2 kali normalitas I2).
BAB V PENUTUP
A. Kesimpulan
Bromometri merupakan penentuan kadar senyawa berdasarkan reaksi reduksi-oksidasi yaitu proses titrasi (reaksi antara reduktor dan bromin berjalan lambat) sehingga dilakukan titrasi secara tidak langsung dengan menambahkan bromin berlebih. Reaksi antara bromin dan zat yang akan ditetapkan kadarnya berjalan lambat, maka dilakukan titrasi secara tidak langsung, yaitu dengan menambahkan bromin dan dilakukan penetapan dengan dititrasi larutan natrium tiosulfat.
Berdasarkan hasil percobaan ini dengan titik akhir titrasi saat larutan kembali bening, maka diperoleh kadar C12H12N2O3 pada percobaan pertama yaitu
1.368,7148% sedangkan pada percobaan kedua kadar C12H12N2O3 yaitu
1.802,0562% sehingga rata-rata dari keduanya adalah 1.585,3855%. Hal ini tidak sesuai dengan ketentuan yang terdapat pada Farmakope Indonesia edisi V (2014) yang menyatakan bahwa fenobarbital mengandung tidak kurang dari 98,0% dan tidak lebih dari 101,0% C12H12N2O3, dihitung terhadap zat yang telah dikeringkan.
Adanya ketidaksesuaian ini kemungkinan disebabkan oleh beberapa faktor, diantaranya yaitu kurangnya penambahan KBr yang seharusnya diberikan 2 kali asam sulfat yang direaksikan. Selain itu konsentrasi titran yang digunakan (Na2S2O3) terlalu pekat yaitu 1 N dan seharusnya memiliki konsentrasi 0,2 N (2
kali normalitas I2).
B. Saran
1. Perlu ketelitian bagi praktikan dalam pengerjaan prosedur kerja agar tercapainya akurasi hasil pengamatan.
DAFTAR PUSTAKA
Dirjen POM.2014.Farmakope Indonesia Edisi V.Jakarta: Departemen Kesehatan Republik Indonesia.
Gandjar, Ibnu G., dan Abdul Rohman. 2007. Kimia Farmasi Analisis. Yogyakarta : Pustaka Pelajar.
Ganiswarna, Sulistia G.1995.Farmakologi dan Terapi Edisi IV. Jakarta: Departemen Farmakologi dan Terapeutik Fakultas Kedokteran Universitas Indonesia. Khopkar.2003.Konsep Dasar Kimia Analitik.Jakarta:Universitas Indonesia Press. Maramis, W.F. 2005.Catatan Ilmu Kedokteran Jiwa.Surabaya: Airlangga University
Press.
Mutschler, Ernst.1991.Dinamika Obat Edisi Kelima.Bandung: Penerbit ITB.
R. A. Day, JR dan A. L. Underwood. 2002. Analisis Kimia Kuantitatif Edisi ke Enam. Jakarta: Erlangga.
Rivai, H.1995. Asas Pemeriksaan Kimia.Jakarta: Universitas Indonesia Press.
Susanti, S., dan Jeanny Wunas. 1997. Analisa Kimia Farmasi Kuantitatif.Makassar: Universitas Hasanudin Press.
Tadjuddin, Naid.2001.Analisa Farmasi.Makassar: Universitas Hasanudin Press. Tjay, Tan Hoan., dan Kirana Rahardja.2015.Obat-Obat Penting.Jakarta: Penerbit PT
Elex Media Komputindo.
Utama, Hendra., dan Vincent H.S. Gan.2012.Farmakologi dan Terapi Edisi 5 Antiepilepsi dan Antikonvulsi. Jakarta: Departemen Farmakologi dan Terapeutik Fakultas Kedokteran Universitas Indonesia.
WHO. 2006. Epilepsy: Epidemiology, Etiology, And Prognosis. WHO Fact Sheet. Wibowo, S., dan Ahmad Gofir. 2006. Obat Antiepilepsi. Yogyakarta :Pustaka
Cendekia Press.
LAMPIRAN
Lampiran 2. Gambar Perlakuan Pada Sampel
Sampel dalam 5 mL kloroform
Setelah penambahan 5 mL H2SO4
Setelah penambahan KI
Lampiran 3. Gambar Hasil Titrasi
Titrasi pertama hingga berwarna cokelat
Lampiran 4. Perhitungan Kadar C12H12N2O3
a. Percobaan pertama dengan sampel pertama Diketahui :
N Na2S2O3 = Normalitas Natrium Tiosulfat = 1 N
V Na2S2O3 = Volume Natrium Tiosulfat = 6,2 ml
BE C12H12N2O3 = Bobot Equivalen C12H12N2O3 = 232,24 mg
Bobot Sampel = Bobot Sampel = 105,2 mg
Ditanya :
Kadar C6H8O6 (I) ?
Penyelesaian :
Kadar C6H8O6(I)=N Na2S2O3×VI2× BE C6H8O6
Bobot Sampel ×100
¿1N ×6,2ml ×232,24mg
105,2mg ×100
¿1.439,888
105,2mg ×100 Kadar C6H8O6(I)=1.368,7148
b. Percobaan kedua dengan sampel kedua Diketahui :
N Na2S2O3 = Normalitas Natrium Tiosulfat = 1 N
V Na2S2O3 = Volume Natrium Tiosulfat = 8 mL
BE C12H12N2O3 = Bobot Equivalen C12H12N2O3 = 232,24 mg
Bobot Sampel = Bobot Sampel = 103,1 mg
Ditanya :
Penyelesaian :
Kadar C6H8O6(II)=N Na2S2O3×VI2× BE C6H8O6
Bobot Sampel ×100
¿1N ×8ml ×232,24mg
103,1mg ×100
¿1.857,92
103,1mg×100
Kadar C6H8O6(II)=1.802,0562
c. Perhitungan Rata-Rata Kadar C12H12N2O3
Diketahui :
Kadar C12H12N2O3 (I) = 1.368,7148%
Kadar C12H12N2O3 (II) = 1.802,0562%
Ditanya :
Rata-rata kadar C12H12N2O3 ?
Penyelesaian :
Rata−ratakadar C12H12N2O3=Kadar C12H12N2O3(I)+Kadar C12H12N2O3(II)
2
¿1.368,7148+1.802,0562
2
¿3.170,771