PENGGUNAAN METHYLOBACTERIUM spp. UNTUK
INVIGORASI BENIH PADI (Oryza sativa L.)
Oleh DITA FITRIARINI
A34404051
PROGRAM STUDI
PEMULIAAN TANAMAN DAN TEKNOLOGI BENIH
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2008
PENGGUNAAN METHYLOBACTERIUM spp. UNTUK
INVIGORASI BENIH PADI (Oryza sativa L.)
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
Oleh DITA FITRIARINI
A34404051
PROGRAM STUDI
PEMULIAAN TANAMAN DAN TEKNOLOGI BENIH
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2008
RINGKASAN
DITA FITRIARINI. Penggunaan Methylobacterium spp. Untuk Invigorasi Benih Padi (Oryza sativa L.). Dibimbing oleh ENY WIDAJATI dan SELLY SALMA.
Penelitian ini bertujuan untuk mempelajari pengaruh penggunaan
Methylobacterium spp. untuk meningkatkan vigor benih padi dalam proses invigorasi. Penelitian ini dilaksanakan di Bagian Ilmu dan Teknologi Benih, Fakultas Pertanian, Institut Pertanian Bogor dan Laboratorium Mikrobiologi, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetika Pertanian Cimanggu Bogor mulai bulan April hingga Juni 2008.
Penelitian menggunakan Rancangan Kelompok Lengkap Teracak dengan dua faktor. Faktor pertama adalah enam isolat Methylobacterium spp., larutan
hormon auksin giberelin dan sitokinin, media Amonium Mineral Salt (AMS) +
metanol dan aquades. Faktor kedua adalah tiga tingkat viabilitas benih padi varietas IR-64 yaitu benih dengan daya berkecambah 70%, 82% dan 87%.
Pada perlakuan invigorasi menunjukan bahwa faktor tunggal perlakuan memperlihatkan pengaruh nyata untuk tolok ukurkecepatan tumbuh, indeks vigor dan berat kering kecambah total. Sedangkan pengaruh interaksi perlakuan dengan viabilitas benih, invigorasi memperlihatkan pengaruh nyata terhadap tolok ukur kecepatan tumbuh dan berat kering kecambah total.
Perlakuan invigorasi dapat meningkatkan daya berkecambah benih, potensi tumbuh maksimum dan indeks vigor secara nyata pada benih dengan tingkat viabilitas 82%.
Pada benih dengan tingkat viabilitas 70% perlakuan invigorasi dapat meningkatkan kecepatan tumbuh yaitu, dengan aquades sebesar 7.97%, GA3 8.93%, isolat TD-G3 9.98%, sitokinin 11.38% dan IAA 14.34%. Pada benih
dengan tingkat viabilitas awal 82% perlakuan invigorasi dapat meningkatkan kecepatan tumbuh yaitu, dengan media AMS + metanol sebesar 11.90%, sitokinin
12.18%, GA3 13.95%, isolat TD-J7 11.14%, TD-G3 11.31% , TD-J10 11.75% ,
TD-TPB3 12.45% dan TD-L2 13.13%.
Invigorasi menggunakan IAA dan isolat TD-G3 meningkatkan berat kering kecambah total secara nyata pada benih dengan tingkat viabilitas 70%
sebesar 0.054% dan 0.034%. Isolat TD-G3 meningkatkan berat kering kecambah total secara nyata pada benih dengan tingkat viabilitas 82% sebesar 0.044%. Isolat TD-TPB3 meningkatkan berat kering kecambah total secara nyata pada tingkat viabilitas 87% sebesar 0.044%.
Judul Skripsi : PENGGUNAAN METHYLOBACTERIUM spp. UNTUK INVIGORASI BENIH PADI (Oryza sativa L.)
Nama : Dita Fitriarini
NRP : A34404051
Menyetujui, Dosen Pembimbing
Pembimbing I Pembimbing II
Dr.Ir. Eny Widajati, MS. Dra. Selly Salma, MSi. NIP. 131 471 835 NIP. 080 101 348
Mengetahui, Dekan Fakultas Pertanian
Prof. Dr. Ir. Didy Sopandie, MAgr. NIP. 131 124 019
RIWAYAT HIDUP
Penulis lahir di Bogor 15 Juni 1985 dari pasangan Ir. H Supriadi, MSc. dan Hj. Ina Farini.
Pada tahun 1988 penulis bersekolah Taman Kanak-Kanak Permata Bunda
Bogor dan pada tahun 1990 bersekolah di Richmond Public School Sydney,
Australia. Pada tahun 1993 hingga 1997 penulis menyelesaikan pendidikan dasar di SDN Polisi I Bogor dilanjutkan dengan pendidikan menengah di SLTPN 2 Bogor pada tahun 1997 hingga 2000 dan pendidikan atas SMUN 3 Bogor pada tahun 2000 hingga 2003. Tahun 2004 penulis diterima di Institut Pertanian Bogor melalui jalur masuk Seleksi Penerimaan Mahasiswa Baru (SPMB).
Selama menjalani studi di IPB penulis aktif sebagai anggota Program Kreatifitas Mahasiswa (PKM) bidang Kewirausahaan 2008, Panitia Seminar Biodiesel sebagai Sumber Energi Alternatif dari Pertanian Indonesia, Magang liburan di Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB-Biogen) Cimanggu-Bogor .
KATA PENGANTAR
Pada kesempatan ini Penulis ingin menyampaikan terima kasih kepada pihak-pihak yang telah membantu terlaksananya penelitian “Penggunaan
Methylobacterium spp. Untuk Invigorasi Benih Padi (Oryza sativa.L)”:
1. Allah SWT atas berkah dan rahmatnya yang tiada henti dirasakan penulis.
2. Dr. Ir. Eny Widajati, MS. sebagai pembimbing akademik dan pembimbing
skripsi I atas bimbingan,dan saran yang telah diberikan.
3. Dra. Selly Salma, MSi. Sebagai pembimbing skripsi II atas masukan dan bimbingan yang telah diberikan selama penelitian.
4. Dr. Ir. Faiza C. Suwarno, MS. sebagai dosen penguji yang telah
memberikan saran untuk penyempurnaan skripsi ini.
5. Ibu Titi Tentrem, Ibu Aminah beserta staf Laboratorium Mikrobiologi
Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetika atas kerjasama dan bantuannya.
6. Staf Laboratorium Benih Leuwikopo dan Pak Larjo di Balai Penelitian
Padi Bogor atas bantuannya .
7. Ir.Abdul Qadir MS atas saran dan masukan yang telah diberikan
8. Dosen Pengajar Departemen Agronomi dan Hortikultura Institut Pertanian Bogor atas ilmu-ilmu berharga yang telah diberikan.
9. Mamah atas kesabaran, doa dan dukungan yang selalu diberikan kepada
penulis.
10.Papah atas bimbingan yang sangat berarti, dukungan yang tiada henti dan doa yang selalu diberikan.
11.Deni Kurniagraha,adikku tersayang. Semoga sukses.
12.Kel. Eyang Uti dan Kiki serta Kel. Eni Purwakarta atas doa yang selalu diberikan
13.Rekan-rekan satu penelitian Nuramin, Nurul Afifah serta Endah dan Weny Uroh atas bantuannya selama penelitian berlangsung.
14.Pemuliaan Tanaman dan Teknologi Benih 41 atas kebersamaanya selama
ini. Pajamas Party Girl’s: Eva, Pifit, Weny A, Imel , Novi, Mega, Nene untuk persahabatan yang indah.
15.Wakhyu Gumilar, SP. atas kasih sayang, masukan dan semangat yang diberikan.
16.KKP’ers Pancawati: Remmy, Cika,Yuni. Untuk semua kegembiraan yang
tidak terlupakan.
17.Kepada pihak-pihak tidak dapat disebutkan satu per satu. Terima kasih atas bantuannya.
Semoga skripsi ini dapat bermanfaat bagi yang memerlukan.Amin.
Bogor, September 2008
DAFTAR ISI
Halaman
DAFTAR ISI... vii
DAFTAR TABEL... viii
DAFTAR GAMBAR ... ix PENDAHULUAN ... 1 Latar Belakang ... 1 Tujuan Penelitian ... 2 Hipotesis... 2 TINJAUAN PUSTAKA ... 3
Morfologi dan Fisiologi Benih Padi... 3
Vigor Benih... 4
Kemunduran Benih dan Invigorasi ... 5
Methylobacterium ... 7
Hormon Tumbuhan ... 9
BAHAN DAN METODE ... 11
Tempat dan Waktu Penelitian ... 11
Bahan dan Alat... 11
Metode Penelitian ... 11
Pelaksanaan Penelitian ... 12
Pengamatan ... 13
HASIL DAN PEMBAHASAN... 15
Pertumbuhan Methylobacterium spp. Pada Media Cair... 15
Pengaruh Tingkat Viabilitas terhadap Tolok Ukur Daya Berkecambah Benih Padi... 16
Pengaruh Tingkat Viabilitas terhadap Tolok Ukur Potensi Tumbuh Maksimum Benih Padi ... 17
Pengaruh Perlakuan Invigorasi terhadap Kecepatan Tumbuh Benih Padi ... 18
Pengaruh Perlakuan Invigorasi terhadap Indeks Vigor Benih padi ... 19
Pengaruh Perlakuan Invigorasi terhadap Berat Kering Kecambah Total Benih Padi ... 20
KESIMPULAN DAN SARAN... 23
Kesimpulan ... 23
Saran... 23
DAFTAR PUSTAKA ... 24
DAFTAR TABEL
No. Halaman
Teks
1. Rekapitulasi Hasil Analisis Ragam Pengaruh Perlakuan Invigorasi terhadap Beberapa Tolok Ukur yang Diamati pada
Benih Padi (Oryza sativa L.)... 16 2. Pengaruh Tingkat Viabilitas terhadap
Tolok Ukur Daya Berkecambah Benih Padi (Oriza sativa L.) ... 17 3. Pengaruh Tingkat Viabilitas terhadap Tolok Ukur
Potensi Tumbuh Maksimum Benih Padi (Oryza sativa L.) ... 17 4. Pengaruh Interaksi Perlakuan Invigorasi dengan Tingkat
Viabilitas terhadap Nilai Rata-Rata Kecepatan Tumbuh
Benih Padi (Oryza sativa L.)... 18 5. Nilai Rata-Rata Indeks Vigor Kecambah Benih
Padi (Oryza sativa L.) ... 20 6. Pengaruh Interaksi Perlakuan Invigorasi dan Tingkat
Viabilitas Benih terhadap Nilai Rata-Rata Berat Kering Kecambah Benih Padi (Oryza sativa L.)... 21
Lampiran
1. Bahan Media Amonium Mineral Salt (AMS) ... 27 2. Komposisi Trace Element ... 27 3. Analisis Ragam Pengaruh Tingkat Viabilitas
terhadap Tolok Ukur Daya Berkecambah
Benih Padi (Oryza sativa L.)... 27 4. Analisis Ragam Pengaruh Tingkat Viabilitas
terhadap Tolok Ukur Potensi Tumbuh Maksimum
Benih Padi (Oryza sativa L.)... 28 5. Analisis Ragam Pengaruh Interaksi Perlakuan Invigorasi
dengan Tingkat Viabilitas terhadap Tolok Ukur
Kecepatan Tumbuh Benih Padi (Oryza sativa L.) ... 28 6. Analisis Ragam Pengaruh Perlakuan Invigorasi
terhadap Tolak Ukur Indeks Vigor Benih Padi (Oryza sativa L.) ... 29 7. Analisis Ragam Pengaruh Interaksi Perlakuan Invigorasi
dan Tingkat Viabilitas Benih terhadap Nilai Rata-rata Berat
DAFTAR GAMBAR
No. Halaman
Teks
1. Isolat bakteri Methylobacterium spp... 15
PENDAHULUAN
Latar Belakang
Padi merupakan komoditi pangan utama bangsa Indonesia yang berperan penting dalam stabilitas nasional. Permintaan padi akan meningkat seiring dengan meningkatnya jumlah penduduk. Peningkatan permintaan harus diiringi dengan peningkatan produksi padi. Hal utama yang dibutuhkan dalam rangka peningkatan produksi adalah dengan menggunakan benih padi bermutu.
Benih bermutu adalah benih yang memiliki viabilitas dan vigor yang tinggi, namun vigor benih dapat mengalami kemunduran seiring dengan lamanya penyimpanan. Kemunduran benih terjadi karena adanya enzim-enzim yang terdegradasi dan tidak aktif (Copeland dan McDonald, 2001). Proses kemunduran benih tidak dapat balik namun dengan menerapkan ilmu dan teknologi yang sesuai proses kemunduran benih dapat dikendalikan sehingga berlangsung dengan
lambat (Roesli dalam Justice dan Bass, 2002).
Invigorasi merupakan salah satu perlakuan benih yang bertujuan untuk memperbaiki vigornya. Invigorasi umumnya mempercepat perkecambahan, mengatasi kondisi lingkungan yang suboptimum, meningkatkan persentase
perkecambahan dan mengatasi serangan hama dan penyakit
(Prihatinah et al., 1990). Invigorasi dapat dilakukan dengan berbagai cara salah
satunya dengan memanfaatkan bakteri yang menghasilkan zat-zat tertentu yang dapat mengembalikan aktifitas enzim pada benih. Pada penelitian ini kegiatan
invigorasi dilakukan dengan memanfaatkan peranan Methylobacterium spp.yang
memiliki kemampuan menghasilkan hormon tumbuh sehingga dapat merangsang perkecambahan.
Methylobacterium spp. atau disebut juga Pink Pigmented Facultative Methylotroph (PPFM) dari marga Methylobacterium merupakan mikrobiota
normal pada filosfer hampir semua jenis tanaman, lumut dan paku-pakuan
(Salma et al., 2005). Bakteri ini menghasilkan pigmen karotenoid sehingga
koloninya tampak berwarna merah muda (pink). Secara morfologis
Methylobacterium mempunyai bentuk bulat, tepi koloni licin, elevasinya
berbentuk cembung dan konsistensinya lengket (Riupassa, 2003).
2
benih dan juga untuk pertumbuhan tanaman (Abdulaye, 2005). Beberapa strain
bakteri Methylobacterium juga dilaporkan menghasilkan Indole Acetic Acid
(IAA) (Lidstrom, 2002). Bakteri Methylobacterium juga mampu menghasilkan
urease, enzim yang berperan dalam metabolisme nitrogen (Holland dan Palaco
1992; Holland 1997 dalam Riupassa, 2003).
Dalam sektor pertanian Methylobacterium memberikan manfaat yang
besar karena dapat meningkatkan biomassa tanaman, hasil produksi, ketahanan tanaman pada suhu tinggi dan kekeringan, meningkatkan ketahanan terhadap patogen dan aplikasi bakteri tidak berbahaya bagi lingkungan (www.csttechnology.com).
Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mempelajari pengaruh penggunaan
Methylobacterium spp. untuk meningkatkan vigor benih padi dalam proses
invigorasi.
Hipotesis
Pemanfaatan Methylobacterium spp. untuk perlakuan invigorasi dapat
TINJAUAN PUSTAKA
Morfologi dan Fisiologi Benih Padi
Berdasarkan klasifikasi tanaman padi (Oryza sativa L.) dikelompokkan
menjadi :
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Monocotyledonae
Ordo : Poales
Famili : Graminae (Poaceae)
Genus : Oryza
Spesies : Oryza sativa
Tipe pertumbuhan padi adalah tegak merumpun dengan tipe penyerbukan sendiri. Bulir padi berada di ruas pelepah daun teratas yang menjadi linguale dan daun bendera. Bulir padi terdiri dari ruas yang pendek dimana pada tiap kedua belah ruas timbul cabang-cabang bulir dan pada ujung tiap-tiap cabang terdapat bunga (Siregar, 1985)
Bagian eksternal benih padi dilindungi oleh sekam yang terbentuk dari lemma dan palea yang bersatu dimana ukuran palea lebih besar dari lemma. Bagian internal benih padi terdiri dari pericarp, testa, embrio dan endosperma. Lapisan pericarp yang tersusun dari epicarp dan mesocarp bersatu dengan testa yang merupakan hasil perkembangan sel integumen ovul dan jaringan ovary
lainnya membentuk seed coat yang melindungi embrio dan endosperma. Kedua
jaringan pericarp dan testa memiliki peran yang penting dalam metabolisme air dan gas pada proses perkecambahan (Takahashi, 1995). Embrio dan endosperma
padi terletak di dalam seed coat dimana endosperma dilindungi oleh lapisan
aleuron yang merupakan tempat akumulasi protein, lemak dan enzim (Takahashi, 1995).
4 Meskipun benih padi mempunyai sekam, namun kemunduran dalam penyimpanan dapat terjadi, salah satunya karena benih padi mengandung asam lemak tak jenuh yaitu oleat dan linoleat yang menempati jumlah terbesar dari asam lemak dalam benih dan dapat menyebabkan kemunduran dengan adanya
aktivitas enzim lipoksigenase (Saenong et al.,dalam Fachrurrozi,1997).
Vigor Benih
Vigor merupakan kemampuan benih untuk berkecambah dan berkembang menjadi tanaman normal pada lingkungan yang sub optimum. Vigor benih menentukan besarnya hasil produksi lapang, hal ini karena kondisi lapang terkadang tidak sesuai dengan kondisi optimum yang diharapkan misalkan dari segi cuaca, hama penyakit maupun kondisi nutrisi tanah. Benih yang tidak vigor tidak dapat memberikan hasil produksi yang optimum. Faktor-faktor yang mempengaruhi vigor benih adalah konstitusi genetik, kondisi lingkungan selama perkembangan benih dan penyimpanan benih (Copeland dan McDonald, 2001).
Benih yang tumbuh menjadi tanaman normal pada kondisi yang sub optimum dikatakan benih yang memiliki vigor kekuatan tumbuh. Vigor kekuatan tumbuh mengindikasikan vigor benih mengatasi lahan pertanian yang kondisinya dapat sub optimum dan menghasilkan tanaman yang tegar yang pada akhirnya membuahkan produksi yang optimal meski keadaan alam sub optimum
(Sadjad et al., 1999).
Sutopo (2002) menyatakan benih yang bervigor tinggi memiliki ciri-ciri (1) tahan untuk disimpan lama, (2) tahan dengan serangan hama dan penyakit, (3) tumbuh cepat dan merata, dan (4) mampu menghasilkan tanaman dewasa yang normal dan berproduksi baik dalam keadaan lingkungan tumbuh yang sub optimum. Menurut Copeland dan McDonald (2001) karakter penting yang harus dimiliki oleh benih vigor adalah (1) Aktifitas reaksi dan proses biokimia seperti reaksi enzim dan proses respirasi berlangsung cepat selama perkecambahan, (2) kecepatan dan keseragaman dari perkecambahan dan pertumbuhan benih dan (3) kemampuan untuk cepat tumbuh di bawah lingkungan yang sub optimum.
5
Kemunduran Benih dan Invigorasi
Kemunduran dalam benih dapat dikatakan sebagai proses kehilangan viabilitas benih sebagai akibat dari proses fisiologi atau adanya patogen. Kemunduran benih mengantarkan kepada kematian benih karena benih yang sudah hilang viabilitasnya gagal berkecambah pada lingkungan yang optimum.
(West, 1986). Tiga konsep kemunduran benih menurut Delouche dalam Copeland
dan McDonald (2001) adalah (1) Kemunduran benih merupakan sesuatu yang tidak dapat dihindari, (2) Kemunduran benih merupakan proses yang tidak dapat balik, dan (3) Kemunduran benih berbeda antar benih dalam satu populasi.
Terdapat beberapa teori mengenai penyebab kemunduran benih, Justice dan Bass (2002) mengemukakan bahwa perubahan pada struktur protein, berkurangnya cadangan makanan, perubahan kromosom, kerusakan membran, pembentukan asam lemak dan respirasi terjadi selama proses kemunduran berlangsung. Gejala kemunduran benih dapat diketahui dari adanya perubahan fisiologi dan biokimia. Abdul Baki dan Anderson (1970) menyatakan perubahan fisiologi dapat diketahui dari perubahan warna benih, penundaan perkecambahan dan peningkatan kecambah abnormal, sementara perubahan respirasi dan jalur sintetik, peningkatan kerusakan kromosom, peningkatan permeabilitas membran, perubahan komponen penyimpanan dan penurunan aktifitas enzim merupakan perubahan biokimia yang terjadi pada benih yang mengalami kemunduran. Copeland and McDonald (2001) menambahkan kandungan asam lemak meningkat seiring dengan kemunduran benih.
Penurunan aktifitas enzim akan menurunkan respirasi potensial pada benih. Hal ini mengakibatkan penurunan energi (ATP) pada proses
perkecambahan. Menurut Sadjad et al. (1999) kemunduran benih berkaitan erat
dengan adanya asam lemak bebas yang terakumulasi dalam benih, hal ini terkait dengan aktifitas enzim. Enzim lipoksigenase berkurang sehingga terjadi akumulasi asam lemak bebas dalam benih sehingga kebocoran membran meningkat. Justice and Bass (2002) menambahkan bahwa beberapa bukti menunjukan bahwa kematian benih sering disertai dengan terbentuknya asam lemak.
6 Proses kemunduran benih tidak dapat dihentikan namun dengan menerapkan ilmu dan teknologi yang sesuai proses kemunduran benih dapat
dikendalikan sehingga berlangsung dengan lambat (Roesli dalam Justice dan
Bass, 2002).
Invigorasi merupakan kegiatan perlakuan benih yang dapat meningkatkan vigor benih yang telah mengalami kemunduran. Invigorasi dilakukan untuk mengatasi rendahnya produktifitas yang disebabkan oleh penggunaan benih bervigor rendah (Silalahi, 1999). Invigorasi dapat dilakukan dengan berbagai cara
yaitu dengan hidrasi-rehidrasi dan conditioning yang bertujuan untuk
meningkatkan kecepatan tumbuh dan daya berkecambah, memperluas rentang suhu benih untuk berkecambah serta meningkatkan keseragaman tumbuh (Copeland dan McDonald, 2001).
Conditioning adalah perbaikan fisiologis dan biokimia yang berhubungan
dengan kecepatan, keserempakan perkecambahan, perbaikan dan peningkatan perkecambahan dalam benih selama hidrasi yang terkontrol dan penundaan perkecambahan oleh potensial air yang rendah dari media imbibisi baik yang
berbentuk cairan atau padatan lengkap (Khan et al., dalam Silalahi 1999).
Copeland dan McDonald (2001) mengelompokkan conditioning menjadi
osmoconditioning dan matriconditioning.
Osmoconditioning adalah perlakuan benih melalui pengendalian masuknya
air dengan menempatkan benih dalam udara lembab, media lembab atau larutan
yang bertekanan osmotik tinggi (Widajati et al., 1990). Khan (1977)
menambahkan kelebihan osmoconditioning adalah dapat meningkatkan kecepatan
tumbuh benih serta meningkatkan daya kecambah benih pada kondisi sub
optimum. Menurut Heydecker dalam Khan (1977) benih Capsicum annum
tumbuh lebih seragam dan dapat bertahan lebih baik dibandingkan dengan benih
yang tidak diberikan perlakuan osmoconditoning.
Matriconditioning merupakan perlakuan benih dengan menggunakan
media padat yang dilembabkan seperti serbuk gergaji, arang sekam dan vermikulit
(Bradford dalam Hasanah, 2004). Menurut Khan (1977) matriconditioning yang
ditambahkan hormon dapat lebih efektif dibandingkan dengan matriconditioning
7
perlakuan matriconditioning dengan GA 200 µM secara efektif dapat
meningkatkan daya berkecambah benih tomat dan lada pada kondisi suboptimum.
Ningsih (2003) menambahkan perlakuan matriconditioning dengan kombinasi
inokulan Bradyrhizobium japonicum dan Azospirillum lipoferum yang
menghasilkan hormon auksin dan giberelin pada suhu kamar dapat meningkatkan mutu benih kedelai yang ditunjukkan dengan nilai daya berkecambah, kecepatan tumbuh relatif dan indeks vigor lebih tinggi dibandingkan dengan kontrol. Pada invigorasi kakao konsentrasi zat pengatur tumbuh yang digunakan untuk invigorasi akan mempengaruhi jumlah dan kecepatan penyerapan (imbibisi) yang terjadi pada benih serta tingkat efektifitasnya bagi pertumbuhan bibit kakao (Rachmawati, 1999).
Methylobacterium
Pink Pigmented Facultative Methylotroph (PPFM) dari genus Methylobacterium merupakan mikrobiota normal pada filosfer hampir semua jenis
tanaman, lumut dan paku-pakuan (Salma et al., 2005). Bakteri ini menghasilkan
pigmen karotenoid sehingga koloninya tampak berwarna merah muda (pink).
Secara morfologis Methylobacterium mempunyai bentuk bulat, tepi koloni licin,
elevasinya berbentuk cembung dan konsistensinya lengket (Riupassa, 2003).
Bakteri Methylobacterium adalah bakteri Gram negatif dan mampu
memanfaatkan senyawa berkarbon tunggal (C1) dari tanaman yaitu metanol
(CH3OH) sebagai sumber karbonnya (Riupassa, 2003). Kemampuan
Methylobacterium untuk mengkolonisasi permukaan daun disebabkan oleh bakteri
ini dapat memanfaatkan senyawa karbon beratom tunggal seperti metanol yang diemisikan oleh stomata karena adanya aktivitas enzim metanol dehidrogenase
8
Green (1992) mengklasifikasi Methylobacterium spp. sebagai berikut :
Kingdom : Bacteria
Phylum : Proteobacteria
Class : Alpha proteobacteria
Ordo : Rhizobiales
Family : Methylobacteriaceae
Genus : Methylobacterium spp.
Methylobacterium menghasilkan fitohormon untuk menstimulasi
perkecambahan benih dan juga untuk pertumbuhan tanaman (Abdulaye, 2005). Pada kondisi kurang ideal, benih mampu berkecambah normal bila diinokulasi
atau diimbibisi dengan suspensi kultur Methylobacterium. Keberadaan bakteri
Methylobacterium juga dapat meningkatkan viabilitas benih. Viabilitas tersebut
ditingkatkan oleh produksi sitokinin dalam jumlah rendah yang dihasilkan oleh
bakteri Methylobacterium ( Holland dalam Riupassa, 2003). Sitokinin merupakan
salah satu zat pengatur tumbuh yang ditemukan pada tanaman dan memiliki peranan dalam proses pembelahan sel. Selain sitokinin beberapa strain bakteri
Methylobacterium dilaporkan menghasilkan Indole Acetic Acid (IAA) (Lidstrom,
2002). Abduoulaye et al.(2005) menambahkan Methylobacterium mampu
menstimulasi perkembangan tanaman karena menghasilkan vitamin B12.
Bakteri Methylobacterium juga mampu menghasilkan urease, enzim yang
berperan dalam metabolisme nitrogen. Pada tanaman kedelai yang gen ureasenya
mengalami mutasi sehingga tidak aktif, Methylobacterium memberikan aktifitas
urease pada kultur sel kedelai sehingga bila urea sebagai sumber karbon ditambahkan ke dalam media kultur, maka sel kedelai mutan mampu tumbuh
normal (Holland dan Palaco 1992; Holland 1997 dalam Riupassa, 2003). Selain
itu, efek bakteri Methylobacterium juga dapat dilihat pada pertumbuhan tanaman
kedelai. Pengujian pada tanaman kedelai menunjukan bahwa perlakuan dengan
menginokulasikan Methylobacterium pada benih yang dipanaskan dapat
mengembalikan laju perkecambahan dan pertumbuhan ke level normal
9
Methylobacterium memiliki hubungan simbiosis mutualisme dengan
tanaman karena Methylobacterium memanfaatkan metanol yang diemisikan
stomata dan memanfaatkannya sebagai sumber karbon serta menghasilkan hormon auksin, sitokinin dan giberelin yang bermanfaat bagi pertumbuhan dan
perkembangan tanaman itu sendiri. Pemanfaatan bakteri Methylobacterium untuk
kebugaran tanaman merupakan green technology yang ramah lingkungan serta
tidak mengganggu keseimbangan alam. Hal ini disebabkan bakteri tersebut secara alami hidup pada tanaman dan dalam tanah sehingga kita tidak menambahkan
benda asing hasil rekayasa genetik pada lingkungan. Inokulasi Methylobacterium
pada tanaman dapat mengatasi cekaman lingkungan akibat dari suhu tinggi, kekeringan dan patogen karena tanaman tumbuh dan berkembang dengan lebih
baik.(www.csttechnology.com)
Hormon Tumbuhan
Menurut Wattimena (1988) hormon tanaman didefenisikan sebagai senyawa organik bukan nutrisi yang aktif dalam jumlah kecil yang disintesis pada bagian tertentu tanaman dan umumnya diangkut ke bagian tanaman lain dimana zat tersebut menimbulkan reaksi secara biokimia, fisiologis dan morfologis. Hormon tersebut harus memenuhi beberapa syarat yaitu (1) senyawa organik dihasilkan oleh tanaman itu sendiri, (2) dapat ditranslokasikan, (3) tempat sintesis dan kerja berbeda, dan (4) aktif dalam konsentrasi rendah.
Hormon berperan dalam merangsang perkecambahan benih dan mematahkan dormansi, setiap hormon memiliki peranan tersendiri dan umumnya satu hormon tidak dapat menggantikan peranan hormon yang lain (Khan, 1977). Menurut Bewley and Black (1985) hormon berperan dalam (1) pertumbuhan dan perkembangan benih (2) akumulasi penyimpanan cadangan makanan, (3) Pertumbuhan dan perkembangan jaringan seminal tambahan, (4) Penyimpanan cadangan makanan untuk penggunaan selanjutnya selama perkecambahan dan awal pertumbuhan benih, dan (5) efek fisiologi yang beragam pada jaringan dan organ untuk perkembangan buah.
10 Wattimena (1988) mengelompokkan hormon tumbuhan menjadi auksin, giberelin, sitokinin, asam absisik dan etilen. Hormon yang umumnya menstimulir perkecambahan benih adalah auksin, giberelin dan sitokinin.
Giberelin berperan mensintesa enzim hidrolisis setelah benih mengalami
imbibisi (Murniati et al., 1985). Sintesis enzim ini termasuk protease yang
mencerna protein menjadi asam amino termasuk tripthopan yang berperan sebagai prekursor auksin (Leshem, 1973). Madiki (1998) menambahkan pemanjangan kecambah benih padi melibatkan peran giberelin sehingga meningkatkan ketahanan bibit terhadap cekaman oksigen.
Auksin berperan penting dalam aktifitas meristematik, pembesaran ovary dan perkembangan pematangan buah serta menginduksi perpanjangan koleoptil
pada kecambah dengan meningkatkan plastisitas dinding sel (Salisburry et al.,
1969).
Sitokinin memiliki peranan dalam mengatur permeabilitas membran sel dengan mengendalikan permeabilitas membran etioplast (Thomas, 1975). Sitokinin memberikan peranan besar dalam aktifitas fisiologi giberelin (Jann dan Amen, 1977).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilakukan pada bulan April hingga Juni 2008 di Bagian Ilmu dan Teknologi Benih Fakultas Pertanian dan Laboratorium Mikrobiologi Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian (BB-Biogen) Cimanggu-Bogor .
Bahan dan Alat
Bahan yang digunakan adalah benih padi varietas IR-64 berasal dari Balai Penelitian Padi Muara Bogor dengan tingkat viabilitas awal ± 70%, 82% dan
87%. Isolat-isolat Methylobacterium spp. yang digunakan adalah PPU-K10,
TD-L2, TD-J7, TD-J10, TD-TPB3 dan TD-G3, merupakan koleksi Laboratorium Mikrobiologi BB-Biogen. Bahan-bahan lain yang digunakan pada penelitian ini
adalah media Amonium Mineral Salt (AMS), metanol, hormon IAA, sitokinin
(Trans Zeatin) dan giberelin (GA3).
Alat yang digunakan adalah laminar air flow, autoclaf, APB IPB-732-A, oven, rotary shaker dan lainnya.
Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Kelompok (RKLT) dengan
dua faktor. Faktor pertama adalah isolat Methylobacterium spp. yaitu : PPU-K10,
TD-L2, TD-J7, TD-J10, TD-TPB3, TD-G3, hormon IAA, GA3 dan sitokinin,
aquades. Faktor kedua adalah benih padi dengan tingkat viabilitas yaitu ± 70% , 82% dan 87%. Data yang diperoleh dari hasil pengamatan diuji dengan menggunakan uji F dan bila perlakuan berpengaruh nyata maka dilakukan dengan uji lanjut DMRT dengan taraf 5%.
12
Model matematika rancangan ini adalah : Yijk = µ + γk+ αi + ßj + ( αß)ij + Σ ijk Dimana:
Yijk = Total hasil pengamatan untuk faktor jenis perlakuan (A) taraf ke- i, faktor benih (B) level ke- j dan pada ulangan ke- k.
µ = nilai tengah umum
γk = ulangan ke- k
αi = pengaruh perlakuan (A) pada jenis ke- i
ßj = pengaruh viabilitas benih ke- j
αßij = interaksi perlakuan dan benih pada jenis perlakuan ke- i, jenis
benih ke- j
Σ ijk = galat percobaan
Pelaksanaan Penelitian
Pembuatan Suspensi Kultur Isolat Methylobacterium spp.
Pembuatan media tumbuh dilakukan dengan mencampurkan bahan-bahan media AMS dengan aquades sebanyak 1 liter dan ditambahkan 0.5 ml trace element. Media cair tersebut dibagi ke dalam erlenmeyer 100 ml sebanyak masing-masing 50 ml, kemudian disterilisasi dalam autoclaf selama 120 menit
dengan tekanan 1 atm pada suhu 1210C. Sebelum inokulasi bakteri, media
ditambah dengan metanol 1% sebagai satu-satunya sumber karbon secara aseptis. Komposisi media AMS dan trace element dapat dilihat pada Tabel Lampiran 1 dan 2. Inokulasi dilakukan menggunakan rotary shaker selama 7 hari pada suhu kamar.
Selanjutnya dilakukan subkultur dengan menginokulasikan masing-masing 1 ml suspensi kultur isolat ke dalam media cair AMS yang telah dimodifikasi. Inkubasi dilakukan menggunakan rotary shaker selama 7 hari pada suhu kamar. Setelah akhir masa inkubasi suspensi kultur siap digunakan untuk merendam benih.
13
Larutan hormon
Larutan hormon yang dibutuhkan untuk perendaman benih adalah
masing-masing 30 ml untuk hormon IAA, sitokinin dan GA3 pada tiga tingkat viabilitas.
Konsentrasi masing-masing hormon yang digunakan adalah 0.5 ppm.
Perendaman
Benih yang telah dipilih direndam dengan masing-masing suspensi kultur
Methylobacterium spp., larutan hormon IAA, sitokinin, GA3 dan aquades selama
24 jam selanjutnya dikering anginkan selama 1 jam. Kegiatan ini dilakukan di Bagian Ilmu dan Teknologi Benih Fakultas Pertanian IPB.
Penanaman
Penanaman benih menggunakan metode UKDdp (uji kertas digulung dan didirikan dalam plastik) benih diletakkan diatas tiga lembar kertas merang yang telah dibasahi dan dibawahnya dialasi plastik lalu ditaruh dalam alat pengecambah benih (APB IPB 73-2A). Masing-masing perlakuan terdiri dari tiga ulangan dengan jumlah benih per ulangan sebanyak 25 butir.
Pengamatan
Tolok ukur yang diamati adalah daya berkecambah, kecepatan tumbuh, indeks vigor, potensi tumbuh maksimum dan bobot kering kecambah. Kegiatan ini dilakukan di Bagian Ilmu dan Teknologi Benih Fakultas Pertanian IPB.
1. Daya Berkecambah (DB)
Pengamatan dilakukan terhadap jumlah kecambah normal pada hitungan pertama (hari ke-5) dan pada hitungan kedua (hari ke-7) dengan rumus Sadjad (1994) :
Keterangan :
DB = Daya Berkecambah KN = Kecambah Normal
14
2. Kecepatan Tumbuh (KCT)
Pengamatan dilakukan terhadap kecambah normal sejak hari pertama hingga hari ketujuh setelah tanam. Perhitungan dengan cara menjumlahkan hasil pembagian antara persentase kecambah normal yang tumbuh pada setiap pengamatannya.
3. Indeks Vigor
Perhitungan indeks vigor berdasarkan jumlah kecambah normal pada
hitungan pertama ( first count) yaitu pada hari ke-5.
4. Potensi tumbuh maksimum
Potensi tumbuh maksimum dihitung berdasarkan jumkah persentase kecambah yang tumbuh.
5. Berat Kering Kecambah Total
Berat kering kecambah total dilakukan dengan menimbang kecambah
yang telah diamati pada hari keenam lalu dikeringkan dalam oven bersuhu 60˚C
HASIL DAN PEMBAHASAN
Pertumbuhan Methylobacterium spp. Pada Media Cair
Isolat Methylobacterium spp. yang digunakan berupa kultur cair dapat
dilihat pada Gambar 1. Menurut Riupassa (2003) walaupun secara morfologi isolat-isolat bakteri berwarna pink namun faktor genetiknya sangat beragam sehingga walaupun tergabung dalam satu kelompok metilotrof namun kemungkinan memiliki kemampuan beradaptasi dengan lingkungan yang beragam. Kombinasi hormon sitokinin, auksin dan giberelin yang dihasilkan
masing-masing isolat bakteri Methylobacterium spp. berpengaruh pada
kemampuannya untuk meningkatkan vigor benih padi pada tiga tingkat viabilitas benih yaitu 70%, 82% dan 87%.
Gambar 1. Isolat Methylobacterium spp. untuk invigorasi
Hasil analisis ragam pengaruh perlakuan invigorasi terhadap tolok ukur
daya berkecambah, potensi tumbuh maksimum, kecepatan tumbuh benih, indeks
vigor, berat kering kecambah dapat dilihat pada Tabel lampiran 3-7. Hasil
rekapitulasi sidik ragam pengaruh perlakuan invigorasi terhadap beberapa tolok ukur yang diamati dapat dilihat pada Tabel 1.
16
Tabel 1. Rekapitulasi Hasil Analisis Ragam Pengaruh Perlakuan Invigorasi terhadap Beberapa Tolok Ukur yang Diamati pada Benih Padi ( Oryza sativa L.)
Tolok Ukur P V P*V
Daya berkecambah tn ** tn
Kecepatan Tumbuh * ** *
Indeks Vigor * ** tn
Berat Kering Kecambah Total * ** *
Potensi Tumbuh Maksimum tn ** tn
Keterangan : * = berpengaruh nyata α = 5%
** = berpengaruh sangat nyata pada α = 1%
tn = tidak berpengaruh nyata
P = perlakuan
V = viabilitas
P*V = interaksi perlakuan dan viabilitas
Perlakuan invigorasi pada benih padi dengan beberapa tingkat viabilitas menunjukkan berpengaruh nyata untuk tolok ukur kecepatan tumbuh, indeks vigor dan berat kering kecambah total. Viabilitas benih berpengaruh sangat nyata terhadap semua tolok ukur yang diamati. Pengaruh interaksi perlakuan dan viabilitas benih menunjukan hasil yang berpengaruh nyata untuk tolok ukur kecepatan tumbuh dan berat kering kecambah total.
Pengaruh Tingkat Viabilitas terhadap Tolok Ukur Daya Berkecambah Benih Padi
Pada benih tingkat viabilitas 82% perlakuan invigorasi dapat meningkatkan daya berkecambah secara nyata, hal ini karena pada benih dengan
viabilitas sedang organel sel dan cadangan makanan relatif masih baik
(Widajati et al.,1990), sehingga dengan invigorasi viabilitas dapat diperbaiki.
Tolok ukur daya berkecambah mengindikasikan viabilitas potensial benih yaitu kemampuan benih untuk menghasilkan tanaman normal pada kondisi yang optimum.
17
Perlakuan invigorasi tidak meningkatkan daya berkecambah benih dengan tingkat viabilitas 70% dan 87% secara nyata. Nilai rata-rata pengaruh tingkat viabilitas terhadap tolok ukur daya berkecambah dapat dilihat pada Tabel 2.
Tabel 2. Pengaruh Tingkat Viabilitas terhadap Tolok Ukur Daya Berkecambah
Benih Padi (Oryza sativa L.)
Tingkat Viabilitas Daya Berkecambah
…….%...
70% 80.22a
82% 95.89b
87% 82.44a
Keterangan : Nilai yang diikuti huruf yang berbeda menunjukkan perbedaan
yang nyata menurut uji DMRT pada taraf α = 5%
Pengaruh Tingkat Viabilitas terhadap Tolok UkurPotensi Tumbuh Maksimum Benih Padi
Potensi tumbuh maksimum benih meningkat secara nyata karena invigorasi pada benih dengan tingkat viabilitas 82%, namun invigorasi tidak meningkatkan potensi tumbuh maksimum pada benih dengan tingkat viabilitas 70% dan 87%. Nilai rata-rata pengaruh perlakuan invigorasi terhadap potensi tumbuh maksimum benih dapat dilihat pada Tabel 3.
Tabel 3. Pengaruh Tingkat Viabilitas terhadap Tolok Ukur Potensi Tumbuh
Maksimum Benih Padi (Oryza sativa L.)
Tingkat Viabilitas Potensi Tumbuh Maksimum
….%...
70 % 85.11b
82 % 96.67a
87% 87.33b
Keterangan: Nilai yang diikuti huruf yang berbeda menunjukkan perbedaan yang
18
Pengaruh Perlakuan Invigorasi terhadap Kecepatan Tumbuh Benih Padi
Perlakuan invigorasi menggunakan aquades, hormon IAA, sitokinin, GA3
dan isolat bakteri TD-G3 dapat meningkatkan kecepatan tumbuh benih padi dengan tingkat viabilitas 70% secara nyata. Isolat TD-G3 diduga menghasilkan kombinasi auksin, sitokinin dan giberelin yang sesuai untuk meningkatkan vigor benih dengan tingkat viabilitas 70%, hal ini terlihat dari kesamaan pengaruh yang
diberikan isolat TD-G3 dengan hormon IAA, sitokinin dan GA3 (Tabel 4).
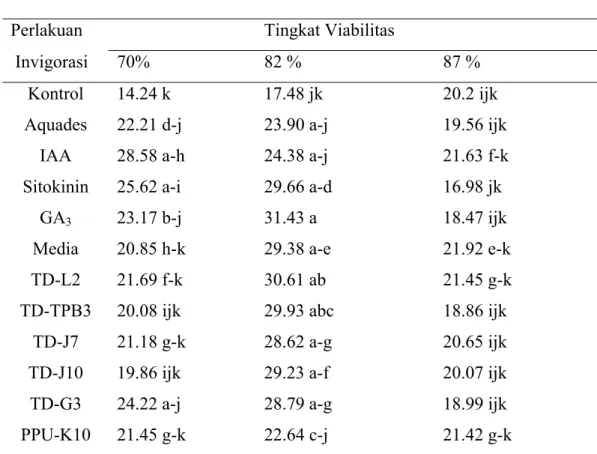
Tabel 4. Pengaruh Interaksi Perlakuan Invigorasi dengan Tingkat viabilitas
terhadap Nilai Rata-Rata Kecepatan Tumbuh Benih Padi (Oryza sativa L.)
Perlakuan Tingkat Viabilitas
Invigorasi 70% 82 % 87 %
Kontrol 14.24 k 17.48 jk 20.2 ijk
Aquades 22.21 d-j 23.90 a-j 19.56 ijk
IAA 28.58 a-h 24.38 a-j 21.63 f-k
Sitokinin 25.62 a-i 29.66 a-d 16.98 jk
GA3 23.17 b-j 31.43 a 18.47 ijk
Media 20.85 h-k 29.38 a-e 21.92 e-k
TD-L2 21.69 f-k 30.61 ab 21.45 g-k
TD-TPB3 20.08 ijk 29.93 abc 18.86 ijk
TD-J7 21.18 g-k 28.62 a-g 20.65 ijk
TD-J10 19.86 ijk 29.23 a-f 20.07 ijk
TD-G3 24.22 a-j 28.79 a-g 18.99 ijk
PPU-K10 21.45 g-k 22.64 c-j 21.42 g-k
Keterangan : Nilai yang diikuti huruf yang berbeda menunjukkan perbedaan yang
nyata menurut uji DMRT pada taraf α = 5%
Pengaruh invigorasi terlihat meningkatkan kecepatan tumbuh secara nyata pada tingkat viabilitas 82% yaitu pada perlakuan menggunakan hormon sitokinin,
GA3, media dan isolat bakteri TD-L2, TD-TPB3, TD-J7, TD-J10, TD-G3.
Menurut Sadjad et al.(1999) benih yang vigor memiliki proses reaktifasi yang
19
tidak terhambat sehingga proses katabolisme maupun anabolisme berjalan normal dan benih menunjukkan kecepatan tinggi dalam proses pertumbuhannya. Katabolisme adalah perombakan bahan cadangan makanan menjadi senyawa kimia yang sederhana dan anabolisme adalah proses pembentukan struktur tumbuh benih dari bahan kimia sederhana menjadi bentuk yang lebih kompleks (Sadjad, 1994).
Kombinasi giberelin dan sitokinin yang diproduksi isolat bakteri TD-L2, TD-TPB3, TD-J7, TD-J10 dan TD-G3 mampu meningkatkan kecepatan tumbuh benih pada tingkat viabilitas 82%. Menurut Copeland and McDonald (2001) giberelin mempunyai peranan besar dalam perkecambahan dan perkembangan
benih dengan cara memicu sintesis enzim-enzim hidrolisis seperti α amilase,
ribonuklease, endo-β-glukanase dan fosfatase. Sitokinin berperan dalam aktifitas
fisiologi giberelin dengan cara mengatur permeabilitas membran sel sehingga pada konsentrasi rendah giberelin tetap efektif karena peran sitokinin (Thomas, 1975 ; Jann dan Amen, 1977).
Pada tingkat viabilitas 87%, perlakuan invigorasi tidak meningkatkan kecepatan tumbuh secara nyata, hal ini karena organel sel dan cadangan makanan benih masih baik sehingga perlakuan invigorasi tidak meningkatkan kecepatan tumbuh.
Pengaruh Perlakuan Invigorasi terhadap Indeks Vigor Benih Padi
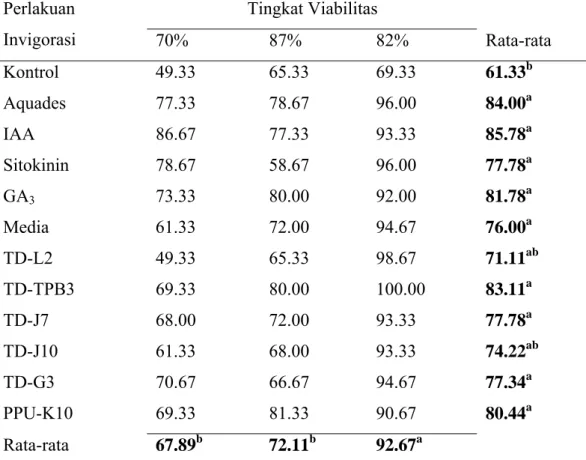
Peningkatan indeks vigor pada benih dengan tingkat viabilitas 82% karena perlakuan invigorasi nyata lebih tinggi dibandingkan benih dengan tingkat viabilitas 70% dan 87%. Tabel 5 menunjukkan bahwa perlakuan dengan aquades, IAA, sitokinin, giberelin, media, TD-TPB3, TD-J7, TD-G3 dan PPU-K10 dapat meningkatkan indeks vigor benih padi pada benih dengan tingkat viabilitas 70%, 82% dan 87%.
Menurut Bryd (1983) benih yang berkecambah lebih lambat dan mempunyai perbedaan yang besar antara hitungan pertama dan terakhir mempunyai vigor yang rendah.
20
Tabel 5. Nilai Rata-Rata Indeks Vigor Kecambah Benih Padi (Oryza sativa L.)
Tingkat Viabilitas Perlakuan Invigorasi 70% 87% 82% Rata-rata Kontrol 49.33 65.33 69.33 61.33b Aquades 77.33 78.67 96.00 84.00a IAA 86.67 77.33 93.33 85.78a Sitokinin 78.67 58.67 96.00 77.78a GA3 73.33 80.00 92.00 81.78a Media 61.33 72.00 94.67 76.00a TD-L2 49.33 65.33 98.67 71.11ab TD-TPB3 69.33 80.00 100.00 83.11a TD-J7 68.00 72.00 93.33 77.78a TD-J10 61.33 68.00 93.33 74.22ab TD-G3 70.67 66.67 94.67 77.34a PPU-K10 69.33 81.33 90.67 80.44a Rata-rata 67.89b 72.11b 92.67a
Keterangan: Nilai rata-rata yang diikuti huruf yang berbeda pada baris dan kolom menunjukkan perbedaan yang nyata menurut uji DMRT pada taraf
α = 5%
Pengaruh Perlakuan Invigorasi terhadap Berat Kering Kecambah Total Benih Padi
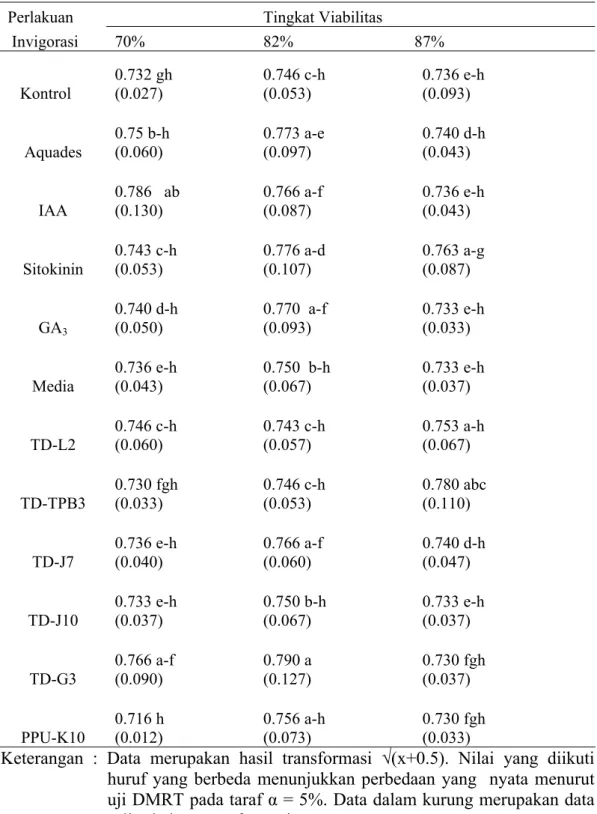
Tabel 6 menunjukkan bahwa perlakuan menggunakan IAA dan isolat TD-G3 dapat meningkatkan berat kering kecambah total benih padi secara nyata pada benih dengan tingkat viabilitas 70%. Pada tingkat viabilitas benih 82% perlakuan isolat bakteri TD-G3 dapat secara nyata meningkatkan berat kering kecambah total sama dengan bobot kering yang dihasilkan benih dengan tingkat viabilitas 87%. Hormon auksin yang dihasilkan isolat bakteri TD-G3 mampu meningkatkan berat kering kecambah total dengan tingkat viabilitas 70% dan
82%. Menurut Lidstrom (2002) beberapa strain bakteri Methylobacterium
21
Tabel 6. Pengaruh Interaksi Perlakuan Invigorasi dan Tingkat Viabilitas Benih terhadap Nilai Rata-Rata Berat Kering Kecambah Total Benih Padi (Oryza sativa L.)
Perlakuan Tingkat Viabilitas
Invigorasi 70% 82% 87% Kontrol 0.732 gh (0.027) 0.746 c-h (0.053) 0.736 e-h (0.093) Aquades 0.75 b-h (0.060) 0.773 a-e (0.097) 0.740 d-h (0.043) IAA 0.786 ab (0.130) 0.766 a-f (0.087) 0.736 e-h (0.043) Sitokinin 0.743 c-h (0.053) 0.776 a-d (0.107) 0.763 a-g (0.087) GA3 0.740 d-h (0.050) 0.770 a-f (0.093) 0.733 e-h (0.033) Media 0.736 e-h (0.043) 0.750 b-h (0.067) 0.733 e-h (0.037) TD-L2 0.746 c-h (0.060) 0.743 c-h(0.057) 0.753 a-h(0.067) TD-TPB3 0.730 fgh (0.033) 0.746 c-h (0.053) 0.780 abc (0.110) TD-J7 0.736 e-h (0.040) 0.766 a-f (0.060) 0.740 d-h (0.047) TD-J10 0.733 e-h (0.037) 0.750 b-h (0.067) 0.733 e-h (0.037) TD-G3 0.766 a-f (0.090) 0.790 a (0.127) 0.730 fgh (0.037) PPU-K10 0.716 h (0.012) 0.756 a-h (0.073) 0.730 fgh (0.033)
Keterangan : Data merupakan hasil transformasi √(x+0.5). Nilai yang diikuti
huruf yang berbeda menunjukkan perbedaan yang nyata menurut
uji DMRT pada taraf α = 5%. Data dalam kurung merupakan data
22
Perlakuan isolat bakteri TD-TPB3 dapat secara nyata meningkatkan berat kering kecambah benih padi dengan tingkat viabilitas 87%, hal ini karena isolat bakteri TD-TPB3 diduga menghasilkan kombinasi hormon yang sesuai untuk meningkatkan berat kering kecambah benih padi dengan tingkat viabilitas 87%.
Menurut Sadjad (1994) berat kering kecambah menjadi tolok ukur viabilitas potensial benih yang mengindikasikan kemampuan lot benih untuk tumbuh normal pada kondisi optimum. Apabila lot benih menghadapi kondisi sub optimum, kemampuan potensial belum tentu dapat mengatasi. Lot benih yang mempunyai kemampuan lebih dari kemampuan potensial mampu menghasilkan pertanaman normal pada kondisi yang sub optimum.
KESIMPULAN DAN SARAN
KESIMPULAN
Perlakuan invigorasi dapat meningkatkan daya berkecambah benih, potensi tumbuh maksimum dan indeks vigor secara nyata pada benih dengan tingkat viabilitas 82%.
Pada benih dengan tingkat viabilitas 70% perlakuan invigorasi dapat meningkatkan kecepatan tumbuh yaitu, dengan aquades sebesar 7.97%,
GA3 8.93%, isolat TD-G3 9.98%, sitokinin 11.38% dan IAA 14.34%. Pada benih
dengan tingkat viabilitas awal 82% perlakuan invigorasi dapat meningkatkan kecepatan tumbuh yaitu, dengan media AMS+metanol sebesar 11.90%, sitokinin
12.18%, GA3 13.95%, isolat TD-J7 11.14%, TD-G3 11.31% , TD-J10 11.75% ,
TD-TPB3 12.45% dan TD-L2 13.13%.
Invigorasi menggunakan IAA dan isolat TD-G3 meningkatkan berat kering kecambah benih secara nyata pada benih dengan tingkat viabilitas 70% sebesar 0.054% dan 0.034%. Isolat TD-G3 meningkatkan berat kering kecambah benih secara nyata pada tingkat viabilitas 82% sebesar 0.044%. Isolat TD-TPB3 meningkatkan berat kering kecambah benih secara nyata pada tingkat viabilitas 87% sebesar 0.044%.
SARAN
Perlu dilakukan penelitian lanjutan perlakuan untuk varietas lainnya dengan tingkat viabilitas 65%, 80% dan 95 %.
25
DAFTAR PUSTAKA
Abdul Baki, A. A and J. D Anderson.1970. Physiological and biochemical
deterioration of seeds, p.283-317. In: Kozlowski (Ed.). Seed biology
II. Academic Press, New York.
Abdoulaye, Sy and A. C. J. Timmers. 2005. Methylotrophic metabolism is
advantageous for methylobacterium extorquens during colonization of
medicago truncatula under competitive condition.Applied and environtal microbiology.p.7245-7252. American society for microbiology.
Andreoli, C. and A. A. Khan. 1999. Matriconditioning integrated with giberelic acid to hasten seed germination and improve stand establishment of pepper and tomato. Agropec Brasilia Vol:34 (10).p.1953-1958.
Bewley, J. D. and M. Black. 1985. Seeds Physiology of Development and
Germination. 2nd ed. Plenum press, New York. 367 p.
Bryd, H. W. 1983. Pedoman Teknologi Benih (terjemahan). PT Pembimbing Masa, Jakarta. 79 hal.
Copeland, L. O and M. B. McDonald. 2001. Principle of Seed Science and
Technology. 4th Edition. Kluwer Academic Publisher. United States of
America.p 467.
Fachrurrozi, A.A. 1997. Pengaruh kondisi lingkungan optimum dan suboptimum
terhadap vigor benih padi (Oryza sativa L) pada periode konsepsi
Steinbauer-Sadjad. Skripsi. Institut Pertanian Bogor. Bogor. 67 hal.
Green, P. N. 1992. The Genus Methylobacterium, p. 2342-2349. In: A. Balows, H.
G. Truper, M. Dworkin (Eds.). The Prokaryotes. Springer- Verlag,
New York.
Hasanah, M. 2004. Perkembangan teknologi budidaya adas
(Foeniculum vulgare Mill.). Jurnal Litbang Penelitian
Vol: 23(4) p.139-144. Balai Penelitian Tanaman Rempah dan Obat. Bogor.
Jann, R. C. and R.D. Amen. 1977. What is germination.p.139-170. In: Khan, A. A
(Ed.) The Physiology and Biochemistry of Seed Dormancy and
Germination, New York.
Justice O. L. and L. N. Bass. 2002. Prinsip dan Praktek Penyimpanan Benih (terjemahan). Raja Grafindo Persada, Jakarta. 446 hal.
26
Khan, A. A. 1977. Preconditioning, germination and performance of seeds. p:283-312. In: A. A Khan (Ed.). The Phisiology and Biochemistry of Seed
Dormancy and Germination. North Havana Publishing Company, New York.
Lidstrom, M. E. and L. Chistoserdova. 2002. Plants in pink : Cytokinin production by methylobacterium. Jurnal of bacteriology p.1818-1839. American
society for microbiology.
Leshem, Y. 1973. The Molecular and Hormonal Basis of Plant Growth Regulation. Pergamon Press, Oxford. 156 hal.
Madiki, A. 1998. Deteksi dini sifat toleransi dan peranan perlakuan invigorasi benih dalam mengatasi cekaman oksigen pada berbagai varietas/galur
padi sawah (Oryza sativa L). Tesis. Institut Pertanian Bogor. Bogor.
71 hal.
Murniati, E., T. Kartika dan S. Saenong. 1985. Pengaruh giberelic acid pada benih
jagung (Zea mays L.)yang diberi dan tidak diberi etanol terhadap daya
berkecambah benih dan aktifitas enzim α-amilase.vol XVI no 1 hal
18-28.
Ningsih, S. 2003. Peningkatan mutu benih dan pertumbuhan tanaman kedelai (Glycine max. L. merr) dengan teknik invigorasi benih menggunakan
matriconditioning yang diintegrasikan dengan inokulan mikroba. Tesis. Institut Pertanian Bogor. Bogor. 72 hal.
Prihatinah, S., F. C. Suwarno dan Suwarto. 1990. Osmoconditioning terhadap
nilai viabilitas benih kedelai (Glycine max (L.)Merr). Keluarga Benih
vol: 1(2).p. 2-10.
Rachmawati, F. 1999. Pengaruh tingkat kadar air dan invigorasi dengan NAA dan
GA3 terhadap viabilitas benih kakao ( Theobroma cacao L.). Skripsi.
Institut pertanian Bogor. Bogor. 70 hal.
Riupassa, P. A. 2003. Kelimpahan dan keragaman genetik bakteri pink pigmented
facultative metilotroph dari beberapa daun sayuran lalapan. Tesis.
Institut Pertanian Bogor. Bogor. 33 hal.
Salisbury, F. B. and C. Ross. 1969. Plant Phisiology. National Book Store Inc,
27
Salma, S., A. Suwanto, A. Tjahjoleksono dan A. Meryandini. 2005. Keanekaragaman bakteri filosfer dari beberapa tanaman asal Kalimantan Timur. Forum Pascasarjana Vol(28):1.p.1-10. Institut Pertanian Bogor. Bogor.
Sadjad, S., H. Suseno dan S. S. Harjadi. 1974. Dasar-dasar Teknologi Benih. IPB. 215 hal.
Sadjad, S. 1994. Kuantifikasi Metabolisme Benih.PT Gramedia Widiasarana Jakarta. 145 hal.
Sadjad, S., E. Murniati dan S. Ilyas. 1999. Parameter Pengujian Vigor Benih Dari Komperatif ke Simulatif. PT Grasindo, Jakarta. 185 hal.
Silalahi, V. S. E. 1999. Pengaruh perlakuan penyimpanan dan invigorasi terhadap perubahan molekuler dan viabilitas benih pinus.Tesis. Institut Pertanian Bogor. Bogor. 160 hal.
Siregar, H. 1981. Budidaya Tanaman Padi di Indonesia. Sastra Hudaya, Jakarta. 320 hal.
Sutopo, L. 2002. Teknologi Benih. Cet 5. PT Raja Grafindo Persada, Jakarta. 238 hal.
Takahashi, N. 1995. Phisiology of seed germination and dormancy.p:35-77.In:
Takane Matsuo, Kikuo Kumazawa (Eds.). Science of the Rice Plant
Vol 2: Phisiology. Food and Agriculture Policy Research Center, Tokyo.
Thomas, TH. 1975. Cytokinin active compounds and seed germination,
p.111-137. In: A. A Khan (Ed). The Phisiology and Biochemistry of Seed
Dormancy and Germination. North Havana Publishing Company, New York.
Wattimena, G.A. 1988. Zat Pengatur Tumbuh Tanaman. Pusat Antar Universitas Institut Pertanian Bogor. Bogor. 145 hal.
Widajati, E., F. C. Suwarno dan E. Murniati. 1990. Pengaruh perlakuan priming
terhadap vigor bibit kacang tanah. Keluarga Benih vol :1(1) p. 14-21. Keluarga Benih Vol (1):1.
West, S.H. 1986. Physiological Interactions Affecting Seed Deterioration. Proceeding. Corp Science Society of America, Inc Madison,
Wisconsin USA. 50 hal.
28
Tabel Lampiran 1. Bahan Media Amonium Mineral Salt (AMS)
Bahan Satuan K2HPO4 1.74 g NaH2PO4.H2O 1.38 g (NH4)2SO4 0.5 g MgSO4.7H2O 0.2 g CaCl2.2H2 0.025 mg FeSO4.7H2O 4.8 mg
Tabel Lampiran 2. Komposisi Trace Element
Kandungan Satuan ZnSO4.7H2O 5 mg MgCl.4H2O 40 mg CaCl2.6H2O 0.1 mg CuSO4.5H2O 0.04 mg H3BO3 200 mg Na2MoO4.2H2O 50 mg
Tabel Lampiran 3. Analisis Ragam Pengaruh Tingkat Viabilitas terhadap Tolok
Ukur Daya Berkecambah Benih Padi (Oryza sativa L.)
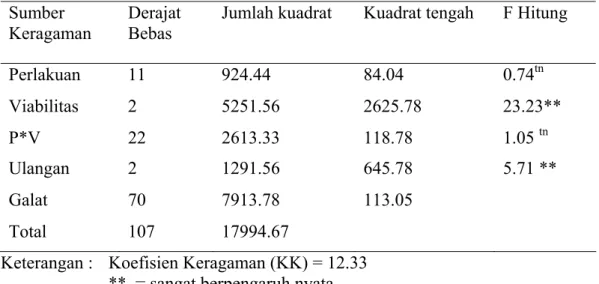
Sumber Keragaman
Derajat Bebas
Jumlah kuadrat Kuadrat tengah F Hitung
Perlakuan 11 924.44 84.04 0.74tn Viabilitas 2 5251.56 2625.78 23.23** P*V 22 2613.33 118.78 1.05 tn Ulangan 2 1291.56 645.78 5.71 ** Galat 70 7913.78 113.05 Total 107 17994.67
Keterangan : Koefisien Keragaman (KK) = 12.33 ** = sangat berpengaruh nyata tn = tidak berpengaruh nyata
29
Tabel Lampiran 4. Analisis Ragam Pengaruh Tingkat Viabilitas terhadap Tolok
Ukur Potensi Tumbuh Maksimum Benih Padi
(Oryza sativa L.)
Sumber
Keragaman Derajat Bebas Jumlah kuadrat Kuadrat tengah F Hitung
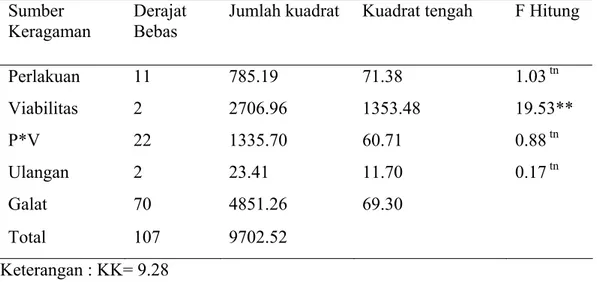
Perlakuan 11 785.19 71.38 1.03 tn Viabilitas 2 2706.96 1353.48 19.53** P*V 22 1335.70 60.71 0.88 tn Ulangan 2 23.41 11.70 0.17 tn Galat 70 4851.26 69.30 Total 107 9702.52 Keterangan : KK= 9.28
** = sangat berpengaruh nyata tn = tidak berpengaruh nyata
Tabel Lampiran 5. Analisis Ragam Pengaruh Interaksi Perlakuan Invigorasi
dengan Tingkat Viabilitas terhadap Tolok Ukur Kecepatan
Tumbuh Benih Padi (Oryza sativa L.)
Sumber Keragaman
Derajat Bebas
Jumlah Kuadrat Kuadrat Tengah F Hitung
Perlakuan 11 416.88 37.90 2.48* Varietas 2 988.19 494.09 32.32** P*V 22 629.99 28.64 1.87* Ulangan 2 127.85 63.93 4.18* Galat 70 1070.27 15.29 Total 107 3233.17 Keterangan: KK = 16.97 * = berpengaruh nyata ** = sangat berpengaruh nyata
30
Tabel Lampiran 6. Analisis Ragam Pengaruh Perlakuan Invigorasi terhadap
Tolok Ukur Indeks Vigor Benih Padi(Oryza sativa L.)
Sumber
Keragaman Derajat Bebas Jumlah Kuadrat Kuadrat Tengah F Hitung
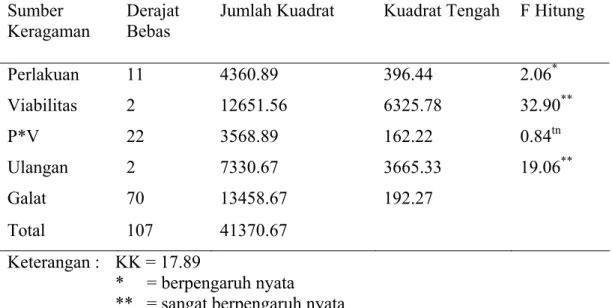
Perlakuan 11 4360.89 396.44 2.06* Viabilitas 2 12651.56 6325.78 32.90** P*V 22 3568.89 162.22 0.84tn Ulangan 2 7330.67 3665.33 19.06** Galat 70 13458.67 192.27 Total 107 41370.67 Keterangan : KK = 17.89 * = berpengaruh nyata
** = sangat berpengaruh nyata tn = tidak berpengaruh nyata
Tabel Lampiran 7. Analisis Ragam Pengaruh Interaksi Perlakuan Invigorasi dan
Tingkat Viabilitas Benih terhadap Nilai Rata-Rata Berat
Kering Kecambah Total Benih Padi (Oryza sativa L.)
Sumber
Keragaman Derajat Bebas Jumlah Kuadrat Kuadrat Tengah F Hitung
Perlakuan 11 0.0103 0.0009 2.40* Viabilitas 2 0.0086 0.0043 10.94** P*V 22 0.0165 0.0007 1.91* Ulangan 2 0.0124 0.0062 15.86** Galat 70 0.0274 0.0004 Total 107 0.0751
Data merupakan hasil transformasi √x+0.5
Keterangan: KK = 2.64
* = berpengaruh nyata
** = sangat berpengaruh nyata tn = tidak berpengaruh nyata
31