PENGARUH BOBOT UMBI DAN WAKTU PERLAKUAN PERENDAMAN SITOKININ TERHADAP PEMATAHAN DORMANSI BENIH KENTANG (Solanum tuberosum L) TESIS OLEH:
Teks penuh
Gambar
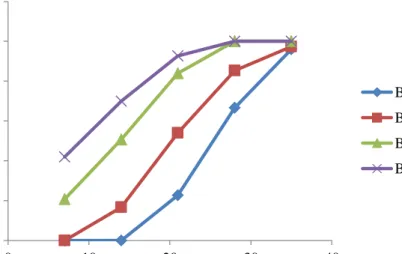
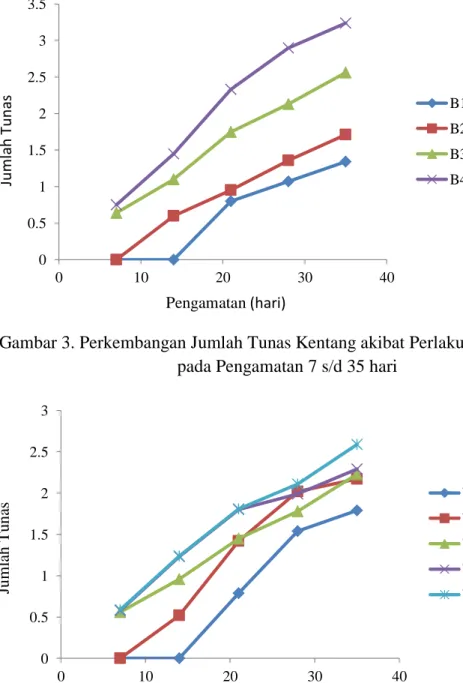
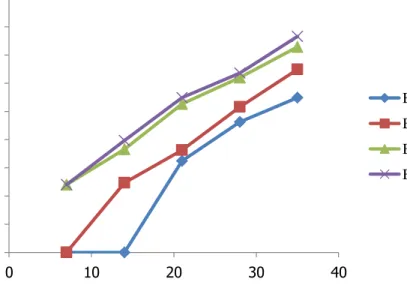
Dokumen terkait
In control and hypercholesterolemic rabbits treated with 17b- estradiol, charybdotoxin alone or with apamin or glibenclamide suppressed this indomethacin- and L -
Pengaruh Kualitas Sumber Daya Manusia, Pemanfaatan Teknologi Informasi, Dan Pengendalian Intern Akuntansi Terhadap Nilai Informasi Pelaporan Keuangan Pemerintah Daerah (Studi
Terjadinya pendangkalan di kolam Pelabuhan Jetty Pertamina dan abrasi pantai di sekitar perairan Pertamina Balongan diakibatkan terganggunya gerak aliran arus sejajar pantai dan
Vitamin E juga melindungi β-kroten dari oksidasi (Gunawan, 2007), fungsi utama vitamin E adalah sebagai antioksidan yang larut dalam lemak dan mudah memberikan hidrogen dari
Sebuah situs harus memiliki database yang dapat menjaga integritas keutuhan data sehingga bila terjadi sesuatu data tetap dapat diakses; (3) situs harus dapat mengembalikan
Standar biaya perolehan salinan informasi TNI di lingkungan Tentara Nasional Indonesia tersebut akan dilaksanakan oleh Pejabat Pengelola Informasi dan Dokumentasi
Berdasarkan hasil penelitian eksperimen yang telah dilaksanakan dan pembahasan pada pembelajaran IPA materi Perubahan Kenampakan Bumi dengan menggunakan model pembelajaran
Hal ini dikarenakan, pada diameter 10 mm, pitch atau spasi antar pin fin semakin besar sehingga menyebabkan interaksi perpindahan panas antar pin fin menjadi berkurang, akibatnya