DENGAN PENCELUPAN NaOH 5%
BERDASARKAN VARIASI WAKTU PEMANASAN
TUGAS AKHIR
Diajukan untuk memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Teknik
Jurusan Teknik Mesin
Disusun oleh:
Nama : BENEDIKTUS KRISNA ARIYADI NIM : 025214064
PROGRAM STUDI TEKNIK MESIN
JURUSAN TEKNIK MESIN
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS SANATA DHARMA
YOGYAKARTA
2007
IMMERSING BASED ON HEATING TIME
VARIATION
FINAL PROJECT
Presented as Partial Fulfillment of the Requirements to Obtain the Sarjana Teknik Degree
in Mechanical Engineering
by
BENEDIKTUS KRISNA ARIYADI Student Number : 025214064
MECHANICAL ENGINEERING STUDY PROGRAM
MECHANICAL ENGINEERING DEPARTMENT
SAINS AND TECNOLOGY FACULTY
SANATA DHARMA UNIVERSITY
YOGYAKARTA
2007
Dengan ini saya menyatakan bahwa dalam tugas akhir ini tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu Perguruan Tinggi, dan sepanjang pengetahuan saya juga tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah dan disebutkan dalam daftar pustaka.
Yogyakarta, 3 November 2007
Penulis
Benediktus Krisna Ariyadi
Penelitian ini bertujuan untuk mengetahui pengaruh larutan NaOH 5%
dengan variasi waktu terhadap absorptivitas dan emisivitas pelat Aluminium
dengan tebal 2 mm.
Ada 2 variasi pencelupan dalam pembuatan spesimen yaitu : variasi A
pencelupan pelat aluminium dalam larutan NaOH 5% dengan pemanasan 50ºC
dicuci, dan variasi B pencelupan pelat aluminium dalam larutan NaOH 5% dengan
pemanasan 50ºC tidak dicuci. Setiap variasi pencelupan dibagi lagi berdasarkan
lama pencelupan yaitu : 10 menit, 20 menit, 30 menit. Setelah dilakukan
pencelupan, kemudian dilakukan pengujian radiasi untuk mengetahui besar
absorptivitas dan emisivitas termal pada aluminium yang telah mengalami
pencelupan NaOH 5%.
Dari pengujian absorptivitas dan emisivitas, disimpulkan dengan metode
dipping in chemical baths (permukaan dikasarkandengan direndam dalam larutan kimia NaOH), dengan metode pemanasan 50ºC dapat meningkatkan absorptivitas
dan emisivitas, penyerapan suhu meningkat 2,40C – 24,40C dibandingkan dengan pelat yang tidak mendapatkan perlakuan.
Penulis mengucapkan puji dan syukur kepada Tuhan Yang Maha Esa atas
segala kasih, rahmat dan bimbingan-Nya sehingga dapat menyelesaikan Tugas
Akhir dengan baik. Maksud dan tujuan dari Tugas Akhir ini adalah sebagai
pemenuhan salah satu syarat mencapai gelar Sarjana Teknik di Jurusan Teknik
Mesin Fakultas Sains Dan Teknologi Universitas Sanata Dharma.
Penulis dalam kesempatan ini mengucapkan banyak terima kasih atas
bantuan, dukungan serta bimbingan yang diberikan dalam proses penyusunan ini,
oleh karena itu penulis menyampaikan ucapan terima kasih kepada:
1. Romo Ir. Greg. Heliarko SJ.,S.S.,B.S.T.,M.A.,M.Sc., Dekan Fakultas
Teknik Universitas Sanata Dharma Yogyakarta.
2. Bapak Budi Setyahandana, S.T., M.T., Dosen Pembimbing yang telah
membimbing dalam penyelesaian Tugas Akhir ini.
3. Laboran Laboratorium Teknologi Mekanik dan Laboratorium Perpindahan
Panas Universitas Sanata Dharma yang telah membantu penelitian penulis.
4. Segenap dosen dan karyawan Jurusan Teknik Mesin FT-USD yang telah
membantu dan selalu membimbing dalam masa-masa kuliah.
5. Keluarga besar penulis, Bapak-Ibu (M. Bambang Priyadi) dan (Y.
Sujiyah), Kakek dan Nenek ( Adiatmadja ) dan ( Cermojiyono ) serta buat
adik-adik penulis Wiwin, Niko, dan Bayu.
6. Teman-teman Anton, Budi, Lukas, Luis, Trimbil, Sigit, Tomo, Dwi, Cb,
Sigit, Heri Kabul, Doni Ateng, Ucok, Nano, Bowo dan semua
7. Dik Anita yang selalu mendukung dalam doa, memberikan semangat dan
perhatian yang besar kepada penulis.
8. Semua teman-teman kampung Beni W, Wahana, Jati, Pepsi, Mas
Ganggeng, Triyono dkk yang selalu membantu penulis dalam segala hal.
Semoga penulisan Tugas Akhir ini dapat berguna dan memberikan manfaat
bagi para pembaca maupun pihak lain, sebagai ilmu pengetahuan dan informasi.
Yogyakarta, 3 November 2007
Penulis
HALAMAN JUDUL……….………..………... i
HALAMAN JUDUL BAHASA INGGRIS... ii
HALAMAN PENGESAHAN PEMBIMBING... iii
HALAMAN PENGESAHAN PENGUJI DAN DEKAN... iv
HALAMAN PERNYATAAN... v
INTISARI... vi
KATA PENGANTAR... vii
DAFTAR ISI... ix
DAFTAR GAMBAR... xii
DAFTAR TABEL... xiii
BAB I PENDAHULUAN... 1
1.1Latar Belakang... 1
1.2Batasan Masalah... 3
1.3Tujuan Penelitian... 3
BAB II DASAR TEORI... 4
2.1Pengertian... 4
2.2Perpindahan Kalor... 5
2.3Pelat Absorber... 10
2.3.1 Pembuatan Permukaan Selektif... 10
2.3.2 Bahan Pelat Absorber………... 12
2.4.2 Unsur Yang Terkandung Dalam Alumunium... 17
2.5 Larutan Kimia... 21
2.5.1 Pencelupan (Bath Dipping) NaOH... 22
2.5.2 Konsentrasi Larutan... 23
2.5.3 Sifat-sifat Larutan... 25
BAB III METODE PENELITIAN... 30
3.1Diagram Alir Penelitian... 30
3.2Bahan... 31
3.3Proses Pencelupan Dalam NaoH... 31
3.4Larutan... 32
3.5Pengujian Bahan... 33
3.5.1 Pengujian Absorptivitas Surya... 33
3.5.2 Pengujian Emisivitas Thermal... 35
3.5.3 Pengujian Sinar Matahari……… 38
BAB IV DATA PENELITIAN DAN PEMBAHASAN... 41
4.1Analisis Pengujian Absorptivitas... 41
4.2Analisis Pengujian Emisivitas... 46
4.3Analisis Pengujian dengan Sinar Matahari... 52
BAB V KESIMPULAN DAN PENUTUP... 57
5.1Kesimpulan... 57
5.2Penutup... 57
DAFTAR PUSTAKA... 59
Gambar 2.1. Sudut Azimut dan Sudut Polar... 7
Gambar 3.1. Diagram Alir Penelitian... 30
Gambar 3.2. Bentuk Benda Uji... 31
Gambar 3.3. Alat Pengujian Absorptivitas... 34
Gambar 3.4. Pemasangan Spesimen... 36
Gambar 3.5. Panel Indikator... 37
Gambar 3.6. Pemasangan Spesimen... 39
Gambar 4.1. Diagram Absorptivitas pada Material Awal... 44
Gambar 4.2. Diagram Pengaruh Waktu Pemanasan pada Absorptivitas... 45
Gambar 4.3. Diagram Pengaruh Waktu Pemanasan pada Absorptivitas... 45
Gambar 4.4. Diagram Pengaruh Pencelupan NaOH pada Absorptivitas ... 46
Gambar 4.5. Diagram Emisivitas pada Material Awal... 50
Gambar 4.6. Diagram Pengaruh Waktu Pemanasan pada Emisivitas... 51
Gambar 4.7. Diagram Pengaruh Waktu Pemanasan pada Emisivitas... 51
Gambar 4.8. Diagram Pengaruh Pencelupan NaOH pada Emisivitas... 52
Gambar 4.9. Diagram Pengaruh Pencelupan NaOH pada Suhu yang Diserap... 54
Gambar 4.10. Foto Permukaan Alumunium dengan Dicuci... 55
Gambar 4.11. Foto Permukaan Alumunium Tanpa Cuci... 55
Tabel 2.1. Kalsifikasi Paduan Alumunium Cor………... 16
Tabel 2.2. Klasifikasi Paduan Alumunium Tempa... 17
Tabel 2.3. Contoh Beberapa Asam………... 27
Tabel 2.4. Contoh Beberapa Basa... 29
Tabel 4.1. Data Hasil Pengujian Absorptivitas Surya pada Material Awal…... 41
Tabel 4.2. Data Hasil Pengujian Absorptivitas Surya Tanpa Pencucian……… 41
Tabel 4.3. Data Hasil Pengujian Absorptivitas Surya Dengan Pencucian……. 42
Tabel 4.4. Data Hasil Pengujian Emisivitas Thermal pada Material Awal…… 47
Tabel 4.5. Data Hasil Pengujian Emisivitas Surya Tanpa Pencucian………… 47
Tabel 4.6. Data Hasil Pengujian Emisivitas Surya Dengan Pencucian………. 48
Tabel 4.7. Data Hasil Pengujian Dengan Sinar Matahari……….. 53
1
1.1 Latar Belakang
Segala sesuatu di alam ini tidak pernah lepas dari energi, tak sedikit
kebutuhan hidup manusia yang memanfaatkan energi. Energi yang paling
banyak dimanfaatkan adalah energi yang berasal dari alam sendiri, salah
satunya adalah minyak bumi sebagai sumber energi utama. Namun seiring
berjalannya kehidupan manusia yang semakin meningkat pertumbuhan
ekonomi dan pertambahan penduduknya, konsumsi energi juga terus
meningkat, sementara cadangan energi yang tersimpan di perut bumi yang
dimiliki Indonesia jumlahnya semakin berkurang dan suatu saat akan habis.
Kenyataan ini membuat orang semakin berpikir dan yakin bahwa
sumber energi pengganti merupakan alternatif yang dipilih sebagai sumber
energi di masa mendatang yang keberadaannya tidak akan habis/tersedia
sepanjang masa, cuma-cuma, dan ramah lingkungan. Energi yang berpotensi
untuk dimanfaatkan di Indonesia ini diantaranya : biomassa, panas bumi,
energi surya, energi air, energi angin, dan energi gelombang samudra.
Energi–energi tersebut mempunyai peluang untuk dikembangkan. Indonesia
memiliki keuntungan sebagai negara tropis yang memiliki potensi energi
surya yang besar. Dengan memanfaatkan potensi energi tersebut, digunakan
suhunya, yakni dengan mengkonversi radiasi surya menjadi panas. Untuk
mengambil panas dari surya menggunakan alat penerima/pengumpul
(kolektor) yang berfungsi untuk mengumpulkan radiasi surya sebanyak
mungkin dan mengalirkan energi yang didapat melalui fluida kerja.
Hal yang harus diperhatikan dalam kolektor ini adalah efisiensi
konversi, yang semuanya dipengaruhi oleh sifat-sifat pada pelat absorber
pada kolektor itu sendiri. Namun demikian juga harus diperhatikan
faktor-faktor yang mempengaruhi pelat absorber, dalam penggunaannya untuk
menyerap radiasi surya (radiasi gelombang pendek), dalam hal ini disebut
faktor absorptivitas, semakin besar nilai absorptivitasnya maka semakin
besar efisisensi konversi pelat absorber tersebut. Dengan keadaan pelat
absorber yang menyerap radiasi surya maka temperatur pelat akan naik,
sehingga dengan sifat alami suatu benda yang bertemperatur lebih tinggi dari
benda/sekitar akan memancarkan energi secara radiasi (radiasi gelombang
panjang).
Untuk memenuhi sifat ideal pelat absorber tersebut sangat tidak
mungkin diperoleh dari alam, tetapi untuk memperoleh permukaan selektif
secara teknologi dapat dibuat. Untuk membuat permukaan selektif terdapat
1.2. Batasan Masalah
1. Material yang digunakan dalam penelitian ini adalah pelat aluminium
dengan tebal 2 mm.
2. Metode peningkatan absorptivitas termal pelat yang digunakan adalah
secara dipping inchemical baths.
3. Dengan metode dipping in chemical baths benda uji permukaannya dikasarkan dengan cara direndam pada larutan NaOH dengan waktu
dan cara yang beragam.
4. Hanya dilakukan pengujian untuk mencari besar absorptivitas dan
emisivitas.
1.2 Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan untuk :
1. Mengetahui absorptivitas surya termal pada pelat aluminium yang
telah direndam dalam larutan NaOH.
2. Mengetahui emisivitas surya termal pada pelat aluminium yang telah
direndam larutan NaOH.
3. Mencari data untuk mendukung pengadaan energi alternatif yang lebih
BAB II
DASAR TEORI
2.1. Pengertian
Mekanisme dari peralatan konversi energi surya sangat erat
hubungannya dengan perpindahan panas dan yang sangat mempengaruhi
besar kecilnya energi yang di konversi adalah aliran fluidanya, pada
umumnya menggunakan fluida cairan karena koefisisen aliran laminer dan
koefisien perpindahan panas dalam pipa sama. Untuk memperbesar
perpindahan panas biasanya aliran laminer dibuat supaya aliran menjadi
turbulen dengan memberikan gangguan pada aliran itu.
Panas dalam kolektor yang disebabkan oleh energi surya
menggunakan prinsip perpindahan kalor secara konduksi, konveksi dan
radiasi. Panas yang diserap oleh pelat penyerap secara konduksi dari daerah
yang bertemperatur tinggi ke daerah yang bertemperatur rendah dialirkan
sepanjang pelat tersebut dan melalui dinding saluran, kemudian panas
dialirkan ke fluida dalam saluran secara konveksi. Selanjutnya pelat
penyerap yang panas itu melepaskan panas ke pelat penutup kaca (umumnya
menutupi kolektor) secara radiasi.
Dalam sebuah kolektor surya yang terpenting adalah bagaimana cara
menggunakan energi surya itu secara optimal, yaitu dengan mengatur
kedudukan permukaan kolektor pada berbagai sudut terhadap bidang
horisontal. Untuk bidang permukaan yang miring harus dihitung secara
khusus dengan mengukur radiasi pada permukaan tersebut.
2.2. Perpindahan Kalor
Sebagai dasar prinsip sebuah kolektor perlu mengetahui suatu
gambaran bahwa perpindahan panas yang diserap melalui tiga cara yang
berbeda yaitu :
1. Konduksi
Perpindahan panas dari daerah yang bertemperatur tinggi ke daerah
yang bertemperatur rendah secara langsung/dengan bantuan media
padat sebagai penghantar. Laju perpindahan panas yang terjadi
dinyatakan dengan hukum Fourier seperti dibawah ini :
⎟ ⎠ ⎞ ⎜ ⎝ ⎛ − =
dx dT kA
q W(watt) ………. ( 2.1 )
Di mana :
K = konduktivitas termal, W/(m.K)
A = luas penampang tegak lurus pada aliran panas, m2
dT/dx = gradien temperatur dalam arah aliran panas, -K/m.
2. Konveksi
Perpindahan panas dengan media penghantar yang bergerak,
seperti halnya jika udara yang mengalir di atas suatu permukaan
panas kemudian permukaan lain menjadi panas. Apabila aliran
udara/fluida disebabkan oleh sebuah blower maka disebut konveksi
paksa. Dalam perancangan sebuah kolektor surya biasanya
perpindahan panas konveksi dinyatakan dengan hukum
)
(T T
hA
q= W − W(watt) ……….. ( 2.2 )
Yang diketahui di mana :
H = koefisisen konveksi, W/(m2.K)
A = luas permukaan, m2
TW = temperatur dinding
T = temperatur fluida, K
3. Radiasi
Perpindahan panas yang terjadi tanpa media perantara atau transfer
panasnya berupa gelombang elektromagnetik. Perpindahan panas
secara radiasi yang mengenai sebuah benda akan dipantulkan
(reflected), sebagian akan diserap (absorbed), dan jika benda tersebut transparan maka sisanya akan diteruskan (transmitted). Hubungan antara reflektivitas (ρ), absorptivitas (α), dan
transmisivitas (τ) pada suatu panjang gelombang tertentu (λ)
adalah:
αλ + ρλ + τλ = 1 ……… ( 2.3 )
Bila ditinjau dengan hukum Kirchoff, maka suatu benda yang
berada dalam kesetimbangan termodinamik akan mempunyai
absortivitas (α) yang sama dengan emisivitas (ε) pada suatu
panjang gelombang tertentu (λ) atau dapat dinyatakan dengan
persamaan :
Perlu diketahui bahwa persamaan di atas hanya berlaku pada
permukaan yang tidak bergantung pada sudut azimut (ф), dan
sudut polar (μ). Seperti tersaji pada Gambar 2.1.
W
E N
S P erm ukaan
horisontal
S udut azim ut F A
µ Sudut polar Z
P
Gambar 2.1. Sudut azimut dan sudut polar
Tetapi jika permukaan tersebut tergantung pada sudut azimut (ф),
dan sudut (μ) maka persamaan di atas menjadi :
ελ (μ,ф) = αλ (μ,ф) ……… ( 2.5 )
Tetapi pada permukaan yang tidak transparan (opaque), radiasi yang diterima hanya akan diserap dan dipantulkan karena pada
permukaan yang tidak transparan tidak meneruskan radiasi (τ = 0),
sehingga persamaannya menjadi:
αλ + ρλ = ελ + ρλ = 1 ………. ( 2.6 )
atau secara umum :
ελ (μ,ф) = αλ (μ,ф) = 1 - ρλ(μi,фi) ……… ( 2.7 )
Dari persamaan di atas dapat disimpulkan emisivitas dan
Efisiensi pada kolektor surya dalam mengkonversi energi
surya menjadi energi termal tergantung pada :
a. Faktor absorptivitas surya pelat absorber pada radiasi surya
yang datang.
b. Emisivitas termal pelat absorber pada panjang gelombang yang
panjang.
c. Kerugian panas karena konduksi, konveksi, dan radiasi.
Dengan melihat persamaan efisiensi bahwa jika faktor
absorptivitas surya (α) membesar maka efisiensi (η) akan
membesar. Koefisien kerugian (UL) dipengaruhi oleh faktor
emisivitas termal di mana semakin besar begitu juga dengan
koefisien kerugian yang terjadi, hal ini juga akan mengakibatkan
berkurangnya efisiensi termal. Jadi bila ditinjau dari keadaan
tersebut untuk idealnya pelat absorber harus memiliki faktor
absortivitas surya yang besar dan emisivitas surya termal yang
rendah. Dari beberapa metode peningkatan efisiensi kolektor,
penggunaan permukaan selektif merupakan cara yang paling
efektif dan ekonomis dan dari beberapa penelitian yang dilakukan
ternyata peningkatan harga faktor absortivitas surya memberikan
pengaruh yang lebih besar dibandingkan penurunan faktor
emisivitas termal terhadap peningkatan efisiensi kolektor.
Faktor lain yang mempengaruhi koefisien kerugian adalah
koefisien kerugian. Bahan pelat absorber harus memiliki
konduktivitas termal yang baik dan panas jenis yang kecil. Dalam
tinjauan ini emisivitas thermal adalah perbandingan total energi
yang dipancarkan suatu permukaan dengan total energi yang
dipancarkan benda hitam pada temperatur yang sama. Bila ditinjau
pada permukaan nyata maka perpindahan panas netto emisivitas
termal merupakan fungsi panjang gelombang radiasi, sudut datang,
temperatur permukaan dan keadaan permukaan (kekasaran, warna,
bahan, dll). Dengan persamaan Stefan-Boltzmann dinyatakan sebagai berikut :
(
4 4)
A
S T
T
q=εσ − ……… ( 2.8 )
Di mana :
q = energi yang dipancarkan (W/m2)
ε = emisivitas termal
σ = konstanta Stefan-Boltzmann, 5.67×10-8 W/(m2.K4)
TS = temperatur permukaan pelat penyerap, K.
TA = temperatur sekitar/permukaan kaca, K.
Pada benda hitam faktor emisivitas termal (e) = 1, sehingga
persamaan menjadi :
(
4 4)
A S
b T T
q =σ − ……… ( 2.9 )
b
q q
=
ε ……… ( 2. 10 )
Pada penelitian ini energi yang dipancarkan (q) diukur dengan
radiometer sehingga emisivitas termal (ε) dapat diketahui.
2.3. Pelat Absorber
Untuk mendapatkan efisiensi yang baik dalam pemanfaatan energi
surya harus diperhatikan mengenai sifat-sifat dari bahan pelat absorber.
Sifat-sifat pelat absorber yang perlu dibutuhkan dalam hal ini adalah :
1. Faktor absorptivitas yang besar (mendekati satu)
2. Faktor refleksifitas yang rendah
3. Faktor Emisivitas termal yang kecil (mendekati nol)
4. Sifat optik dan fisik yang stabil
5. Kualitas kontak pelat dengan lapisan selektif yang baik
6. Mudah diaplikasikan
7. Proses pelapisan permukaan selektif yang murah dan tidak merusak
lingkungan (Pandey dan Banerjee, 1998).
2.3.1. Pembuatan Permukaan Selektif
Untuk proses pembuatan permukaan selektif ini, ada banyak
cara untuk memperolehnya. Namun yang memerlukan perhatian
lebih adalah bagaimana cara memperoleh permukaan selektif yang
ideal dengan proses yang ada. Dimana dari hasil permukaan selektif
besar berkisar 0 (nol) sampai 1 (satu), dengan angka semakin
mendekati 1 (satu) akan semakin baik, dan faktor emisivitas termal
(ε) yang kecil berkisar 0 (nol) sampai 1 (satu), dengan angka
semakin mendekati 0 (nol) semakin baik. Dari beberapa percobaan
dan penelitian yang pernah ada, diantaranya seperti berikut :
a. Permukaan selektif dengan lapisan oksida tembaga.
Lapisan oksida tembaga dibentuk dengan konversi kimia, yaitu
dengan mencelupkan pelat tembaga yang telah dibersihkan dan
dipolis ke dalam larutan sodium hydroxide dan sodium chloride
panas selama waktu tertentu. Faktor absorptivitas surya (α) yang
didapatkan sebesar 0,89 dan faktor emisivitas termal (ε) yang
didapatkan sebesar 0,17 (Choudhury, 2002). b. Permukaan selektif oksida cobalt.
Dapat dibuat dengan metode electroplating pada pelat baja-nikel, dengan metode ini didapatkan faktor absorptivitas surya (α) antara
0,87 – 0,92 dan faktor emisivitas termal (ε) antara 0,07 – 0,08
(Choudhury, 2002).
c. Permukaan selektif dengan metode sputtering.
Dengan mengganti lapisan anti korosi dari nickel-chromium
menjadi copper-nickel. Dengan metode ini dapat menaikkan absorptivitas surya (α) dari 0,89 – 0,91 menjadi 0,97, dan
menurunkan faktor emisivitas termal dari 0,12 menjadi 0,06
d. Permukaan selektif dengan metode elektrokimia.
Dengan oksidasi alumunium dan pigmentasi nikel, dapat
menghasilkan absorptivitas surya (α) sebesar 0,91 dan emisivitas
termal sebesar 0,17 (Kadirgan et al, 1999). e. Permukaan selektif dengan metode grinding.
Untuk memperoleh permukann selektif dengan metode grinding
ini, menggunakan kekasaran permukaaan 1μm - 2μm.
Absorptivitas surya (α) yang dihasilkan sebesar 0,90 dan emisivitas
termal (ε) yang dihasilkan sebesar 0,25 (Konttinen et al, 2003). Namun dengan metode grinding ini, setelah diuji dengan mikrostruktur terdapat variasi pada penggunaan komposisi dan
struktur dari alat grinding. Penggunaan komposisi dan struktur yang tepat dapat mempengaruhi hasil absorptivitas surya (α)
sampai diatas 0,94.
2.3.2. Bahan Pelat Absorber
Dalam pemilihan bahan pelat absorber yang ditentukan dengan
pertimbangan antara lain efisiensi, biaya proses yang relatif murah,
mudah dalam mendapatkannya serta tidak berdampak pencemaran
lingkungan maka dipilih aluminium sebagai pelat absorber. Selain
hal tersebut pembutannya mudah dilakukan, karena alumumium
sangat mudah dikerjakan dengan teknologi mekanik dan sifat
2.4. Aluminium
Aluminium merupakan logam non-ferro mempunyai ketahanan korosi
yang baik dan hantaran listrik yang baik dan sifat-sifat yang baik lainnya
sebagai sifat logam. Aluminium sendiri pertama kali ditemukan sebagai
suatu unsur kemudian mengalami reduksi sebagai logam. Secara terpisah
aluminium diperoleh dari alumina dengan cara elektrolisa dari garamnya
yang terfusi, sampai sekarang proses ini masih dipakai untuk memproduksi
aluminium. Penggunaan aluminium sebagai logam setiap tahunnya
menempati urutan kedua setelah besi dan baja, yang tertinggi di antara
logam non-fero.
.Sebagai tahanan terhadap, kekuatan mekanisnya yang sangat
meningkat dengan penambahan Cu, Mn, Si, Mn, Zn, Ni, dsb, secara satu per
satu atau bersama-sama, memberikan juga sifat-sifat baik lainnya seperti
ketahanan korosi, ketahanan aus, koefisien pemuaian rendah dsb. Material
ini dipergunakan dalam bidang yang luas bukan saja unutuk peralatan rumah
tangga tapi juga dipakai untuk keperluan material pesawat terbang, mobil,
kapal laut, konstruksi dsb.
2.4.1. Jenis-jenis Aluminium Dan Paduannya
a. Aluminium murni
Aluminium murni diperoleh dengan cara elektrolisa dengan
Aluminium terhadap korosi tergantung pada kemurniannya,
semakin murni semakin tahan terhadap korosi.
b. Al-Cu dan Cu-Mg
Sebagai bahan coran dipakai aluminium paduan dengan
komposisi 4-5 % Cu, karena mudah terjadi retakan pada
coran maka perlu ditambahkan Si. Sedangkan untuk
memperhalus butir, ditambahkan Ti, setelah mengalami
perlakuan panas kekuatan tariknya akan meningkat menjadi
25 kg/mm
± 2
. Paduan Al-Cu adalah paduan yang
mengandung 4 % Cu dan 0,5 % Mg, dengan penuaan pada
temperatur biasa dalam beberapa hari paduan ini dapat
mengeras sehingga sangat dalam. Paduan ini disebut juga
Duralium. c. Paduan Al-Mn
Mn dipakai untuk memperkuat Al, tanpa mengurangi
ketahanan terhadap korosinya. Paduan Al-Mn merupakan
paduan tahan korosi yang tidak mengalami perlakuan panas.
d. Paduan Al-Si
Paduan antar aluminium denagan sislikon ini mempunyai
sifat :
1. Mudah mencairkannya
2. Permuakaanya sangat bagus
4. Sangat baik sebagai paduan coran
5. Tahan terhadap korosi
6. Ringan dan Koefisien pemuaiannya kecil
7. Merupakan penghantar panas yang baik
e. Paduan Al-Mg
Mempunyai sifat tahan terhadap korosi, dan sejak lama
dikenal dengan nama Hidronalium. Dengan 2-3 % Mg, paduan ini mempunyai sifat-sifat : mudah ditempa, mudah
dirol dan mudah diekstrusi.
f. Paduan Al-Mg-Si
Pengerasan dengan penuaan sangat jarang terjadi bila Al
hanya dicampur sedikit dengan Mg. Dengan penambahan Si,
paduan dapat dikeraskan dengan penuaan panas setelah
perlakuan pelarutan. Paduan ini mempunyai sifat-sifat :
Kurang baik sebagai bahan tempaan, mempunyai mampu
bentuk yang baik, sangat liat dan tahan terhadap korosi.
g. Paduan Al-Mg-Zn.
Paduan ini dapat dibuat menjadi sangat keras dengan penuaan
setelah perlakuan pelarutan, mempunyai sifat patah getas oleh
retakan korosi tegangan. Sifat-sifat yang tidak baik ini
berhasil dihilangkan dengan menambahkan 0,3 Mn atau Cr
(hal ini akan membuat butiran kristal padatnya menjadi halus
Duralumin Super Extra. Paduan ini juga merupakan paduan Al dengan kekuatan paling tinggi diantara paduan-paduan
lainnya. Paduan ini paling banyak dipakai sebagai bahan
konstruksi pesawat terbang dan sebagai bahan konstruksi
umum.
Paduan aluminium diklasifikasikan dalam berbagai standar
oleh berbagai negara. Paduan aluminium dapat
diklasifikasikan menjadi dua kelompok umum, yaitu :
a. Paduan aluminium tuang/cor (cast aluminium alloys)
Paduan dengan perlakuan panas (heat treatable alloys)
Paduan tanpa perlakuan panas ( non heat treatable alloys )
b. Paduan aluminium tempa (wrought aluminium alloys)
Paduan dengan perlakuan panas (heat treatable alloys)
Paduan tanpa perlakuan panas ( non heat treatable alloys )
Sistem penandaan untuk kedua kelompok paduan tersebut
dapat dilihat pada Tabel 2.1 dan Tabel 2.2.
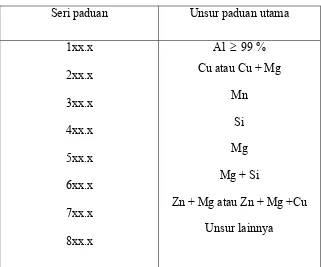
Tabel 2.1. Klasifikasi paduan aluminium cor
Seri paduan Unsur paduan utama
1xx.x
2xx.x
3xx.x
4xx.x
Al ≥ 99 %
Cu
Si + Cu atau Mg
5xx.x
6xx.x
7xx.x
8xx.x
Mg
Tidak digunakan
Zn
Sn
Tabel 2.2. Klasifikasi paduan aluminium tempa
Seri paduan Unsur paduan utama
1xx.x
2xx.x
3xx.x
4xx.x
5xx.x
6xx.x
7xx.x
8xx.x
Al ≥ 99 %
Cu atau Cu + Mg
Mn
Si
Mg
Mg + Si
Zn + Mg atau Zn + Mg +Cu
Unsur lainnya
2.4.2. Unsur-unsur yang terkandung dalam Aluminium
a. Silikon (Si)
Keuntungan dari unsur silikon dalam paduan aluminium :
Mempermudah proses pengecoran
Memperbaiki sifat-sifat atau karakteristik coran
Menurunkan penyusutan dalam hasil cor
Kerugian unsur silikon adalah :
Penurunan keuletan bahan terhadap beban kejut
Hasil cor akan rapuh jika kandungan silicon terlalu tinggi
b. Tembaga (Cu)
Keuntungan unsur Cu :
Meningkatkan kekerasan bahan
Memperbaiki kekuatan tarik
Mempermudah proses pengerjaan dengan mesin
Kerugian unsur Cu :
Menurunkan daya tahan terhadap korosi
Mengurangi keuletan bahan
Menurunkan kemampuan dibentuk dan dirol
c. Mangan (Mn)
Keuntungan unsur Mangan (Mn) adalah :
Meningkatkan kekuatan dan daya tahan terhadap
temperatur tinggi
Mengurangi pengaruh buruk unsur besi
Kerugian unsur Mangan (Mn)
Menurunkan kemampuan penuangan
Meningkatkan kekasaran butiran partikel
d. Magnesium (Mn)
Keuntungan unsur Magnesium :
Mempermudah proses penuangan
Meningkatkan kemampuan pengerjaan mesin
Meningkatkan daya tahan terhadap korosi
Meningkatkan kekuatan mekanis
Menghaluskan butiran kristal secara efektif
Meningkatkan ketahanan terhadap beban kejut/impak
Kerugian unsur Mg :
Meningkatkan kemungkinan timbulnya cacat pada hasil
cor
e. Nikel (Ni)
Keuntungan unsur Ni :
Meningkatkan kekuatan dan ketahanan terhadap
temperatur tinggi
Meningkatkan daya tahan terhadap korosi
Unsur nikel tidak menimbulkan kerugian dalam paduan
f. Besi (Fe)
Keuntungan unsur Fe :
Mencegah terjadinya penempelan logam cair pada
cetakan selama proses penuangan
Kerugian dari unsur Fe :
Penurunan sifat mekanis
Penurunan tekanan tarik
Timbulnya bintik keras pada hasil cor
Peningkatan cacat porositas
g. Seng (Ze)
Keuntungan unsur Zn :
Meningkatkan sifat mampu cor
Meningkatkan kemampuan di mesin
Mempermudah dalam pembentukan
Meningkatkan keuletan bahan
Meningkatkan kekuatan terhadap beban kejut/impak
Menurunkan ketahanan terhadap korosi
Menurunkan pengaruh baik dari unsur besi
Bila kadar Zn terlalu tinggi akan dapat menimbulkan
cacat rongga udara
h. Titanium (Ti)
Keuntunga Ti :
Meningkatkan kekuatan hasil cor pada temperatur tinggi
Memperhalus butir kristal pada permukaan
Mempermudah proses penuangan
Kerugian unsur Ti :
Meningkatkan viskositas logam cair dan menguragi
fluidisitas logam cair
2.5. Larutan Kimia
NaOH adalah larutan kimia yang akan digunakan dalam pengujian
ini. NaOH merupakan senyawa yang sangat reaktif, terutama pada suhu
yang sangat tinggi. NaOH dalam pasaran dikenal dengan nama sodium hidroksida, namun secara umum kita menyebutnya natrium hidroksida. Ada juga yang menyebut senyawa ini dengan istilah caustik soda atau
dapat mengganggu saluran pencernaan serta memiliki sifat yang korosif.
Reaktifnya senyawa NaOH juga tergantung elemen lain yang berada
dimana NaOH berada, serta kondisi temperatur setempat. Dalam pasaran,
NaOH terdiri dari dua jenis yaitu NaOH PA (Pro Analisis) dan NaOH
Teknis. NaOH sebagai senyawa basa (alkali) bersifat kaustik, artinya dapat merusak kulit kita, jika kita mencelupkan jari tangan kita kedalam larutan
NaOH encer, jari tangan kita terasa licin hal ini disebabkan karena
terbentuknya sabun sebagai hasil reaksi NaOH dengan lemak pada kulit
kita.
2.5.1. Pencelupan (Bath Dipping) NaOH
Pencelupan adalah hal pertama yang harus dilakukan
sebelum pengujian absortivitas surya dan pengujian emisivitas
termal. Bahan aluminium dicelupkan dalam larutan NaOH dengan
konsentrasi larutan 5 %. Dalam hal ini cara pencelupan dilakukan
dengan cara dipanaskan.
Dalam mengukur tingkat kosentrasi larutan NaOH kita
gunakan timbangan elektrik. Karena media yang akan dipakai
untuk melarutkan NaOH adalah air maka kita tentukan dahulu
kadar airnya, untuk NaOH konsentrasi 5 % kita ambil NaOH
seberat 5 gr kemudian kita larutkan kedalam air sebanyak 95 gr,
kemudian melakukan pencelupan benda uji ke dalam larutan.
Wadah yang digunakan adalah gelas dari bahan keramik. Gelas
pada waktu terjadi proses korosi. Pencelupannya sendiri
menggunakan rentang waktu yang telah ditentukan yaitu 10 menit,
20 menit, 30 menit dengan variasi tertentu.
Setelah dilakukan pencelupan (bath dipping) maka kita bisa melakukan pengujian absorbtivitas surya dan emisivitas termal dari
aluminium.
2.5.2. Konsentrasi Larutan
Dalam larutan dari pada suatu zat di dalam zat lain, zat yang
dilarutkan disebut zat terlarut atau solut (solute). Zat yang melarutkan zat terlarut itu disebut pelarut atau solven (solvent). Bila suatu zat terdapat dalam jumlah yang relati lebih banyak dari
yang lain, maka zat itulah yang biasanya dianggap sebagai pelarut.
Zat terlarut maupun pelarut dapat berupa zat padat, zat cair dan
gas.
Konsenterasi dinyatakan dalam satuan fisika
Bila kita menggunakan satuan fisika, konsetrasi larutan
dapat dinyatakan dengan salah satu dari cara-cara berikut :
1) Dengan massa zat terlarut per satuan volume larutan
Contoh : 20 gram larutan per liter
2) Dengan persen komposisi, atau jumlah satuan massa telarut per
Contoh : larutan 10% dalam air mengandung 10 g NaCl dalam
100 g larutan. 10 g NaCl dilarutakn dalam 90 g air untuk
mendapatkan 100 g larutan.
3) Dengan volume zat telarut per satuan volume larutan.
Konsentrasi larutan dinyatakan dalam satuan kimia
Jika satuan dinyatakan dengan satuan kimia maka
konsentrasi larutan dinyatakan dengan cara sebagai berikut :
1) Konsentrasi molar (molar concentration), M ialah jumlah mol
zat terlarut yang terkandung di dalam satu liter larutan. M
merupakan lambang kuantitas, yaitu konsentrasi molar, dan M
lambang satuan, mol/L.
larutan volume
molar i konsentras
M= =molzatterlarut
2) Normalitas (normality) suatu larutan, N ialah jumlah gram
ekuivalen zat terlarut yang terkandung di dalam satu liter
larutan. Bobot ekuivalen ialah fraksi (bagian) bobot molukul
yang berkenaan dengan satu satuan tertentu reaksi kimia, dan
satu gram ekuivalen adalah fraksi yang sama dari pada satu
mol.
larutan volume
larutan normalitas
N= = gramekuivalenzatterlarut
3) Molalitas suatu larutan ialah banyaknya mol zat terlarut per
Molalitas (m) tidak dapat dihitung dari konsentrasi molar (M),
kecuali jika rapatan (densitas) larutan ini diketahui.
larutan volume ) ( molar i konsentras
m= = n zatterlarut
4) Fraksi mol (mole fraction), x, suatu komponen dalam larutan
didefinisikan sebagai banyaknya mol (n) komponen itu, dibagi
dengan jumlah mol keseluruhan komponen dalam larutan itu.
Jumlah fraksi mol seluruh komponen dalam setiap larutan
adalah satu. Dalam larutan dua komponen,
) ( ) ( ) n(terlarut (terlarut) x pelarut n terlarut n + = ) ( ) ( n(pelarut) (pelarut) x pelarut n terlarut n + = komponen saluran mol an bersangkut yang komponen mol komponen mol fraksi
x = =
Dalam persentase fraksi mol dinyatakan sebagai mol persen.
2.5.3. Sifat-sifat Larutan
1. Asam
Asam adalah zat yang menaikkan kosentrasi ion H+ di
dalam larutan.
Contoh :
-9 H2SO4 yang terionisasi menjadi 2H+ + SO42-
Asam dapat terjadi bila oksida non logam direaksikan dengan
air :
Oksida nonlogam + Air Asam
Contoh :
9 CO2(g) + H2 O(l) H2CO3 (aq)
Karbon dioksida asam karbonat
9 N2O5(g) + H2O(l) 2HNO3(aq)
Nitrogen oksida asam nitrat
Oksida non logam pembentuk asam disebut juga dengan oksida asam.
Tidak semua oksida non logam dapat membentuk asam bila
direaksikan dengan air. Oksida oksida itu antara lain : CO, NO,
N2O, NO2, BrO3. Asam yang bukan berasal dari oksidanya (tidak
mengandung atom oksigen) antara lain :
Asam yang berasal dari unsur golongan halogen (VIIA)
HF : asam fluorida
HCl : asam klorida
HBr : asam bromida
HI : asam yodida
HCN : asam cianida
H2S : asam sulfida
Asam organik, yaitu asam yang dijumpai pada makhluk hidup atau
Contoh :
CH3COOH : asam asetat
H2C2O4 : asam oksalat
HCOH : asam formaldehid
HCOOH : asam formiat
C6H5COOH : asam benzoat
Ciri-ciri larutan asam :
- Rasa masam
- Bersifat korosif dan melarutkan beberapa logam
- Semua larutan asam dapat menghasilkan ion hidrogen (H+)
- Larutannya bersifat elektrolit
- Memerahkan kertas lakmus biru
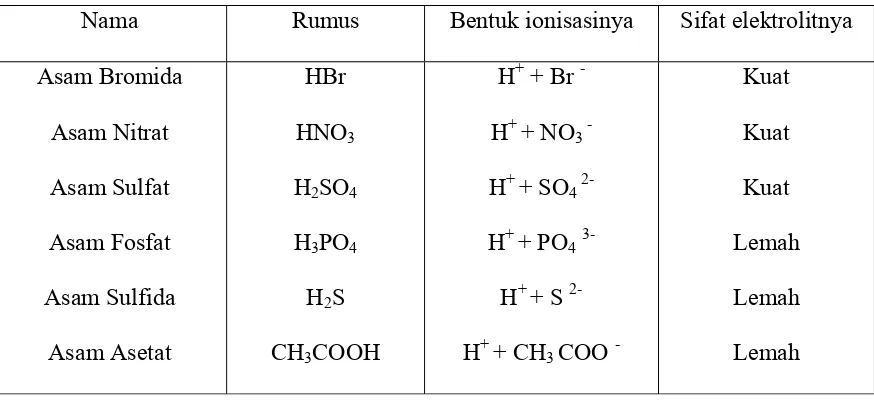
Tabel 2.3. Contoh beberapa asam
Nama Rumus Bentuk ionisasinya Sifat elektrolitnya
Asam Bromida
Asam Nitrat
Asam Sulfat
Asam Fosfat
Asam Sulfida
Asam Asetat
HBr
HNO3
H2SO4
H3PO4
H2S
CH3COOH
H+ + Br -
H+ + NO3 -
H+ + SO4 2-
H+ + PO43-
H+ + S 2-
H+ + CH3 COO
-Kuat
Kuat
Kuat
Lemah
Lemah
2. Basa
Basa adalah zat yang menaikkan konsentrasi ion OH- di
dalam larutan.
Contoh :
-NaOH yang terionisasi menjadi Na+ + OH-
Natrium Hidroksida
- Ca(OH)2 yang terionisasi menjadiCa2- + 2OH
Catatan :
NH4OH dapat bila gas amaoniak (NH3) dilarutkan didalam air
menurut reaksi :
NH3(g) + H2O(l) NH4OH(aq)
Valensi basa ialah. Jumlah ion OH- yang dilepaskan oleh satu
molekul basa
Contoh : NaOH valensinya 1
Ca(OH)2 valensinya 2
Terbentuknya basa :
Basa dapat terjadi bila oksidasi logam direaksikan dengan air :
Oksida nonlogam + Air Asam
Contoh :
- CO2(g) + H2 O(l) H2CO3 (aq)
Karbon dioksida asam karbonat
- N2O5(g) + H2O(l) 2HNO3(aq)
Ciri-ciri larutan basa :
- Rasanya pahit dan dapat merusak kulit
- Terasa licin di tangan (seperti merasakan larutan sabun)
- Di dalam larutan membentuk ion logam atau gugus
(kumpulan atom) lain yang bermuatan positif dan ion
hidroksil (OH) yang bermuatan negatif.
- Larutannya bersifat elektrolit
- Membirukan kertas lakmus merah
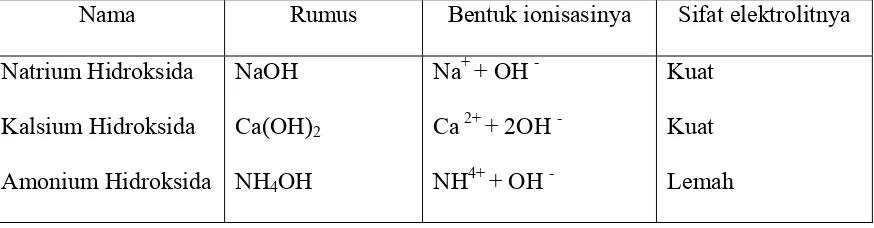
Tabel 2.4. Contoh beberapa basa
Nama Rumus Bentuk ionisasinya Sifat elektrolitnya
Natrium Hidroksida
Kalsium Hidroksida
Amonium Hidroksida
NaOH
Ca(OH)2
NH4OH
Na+ + OH -
Ca 2+ + 2OH -
NH4+ + OH
-Kuat
Kuat
Lemah
Menentukan Ph Larutan :
Ph larutan NaOH 5% yang dicelupkan ke dalam air 95%
BAB III
METODE PENELITIAN
3.1. Diagram alir penelitian
Bahan Pelat Aluminium
Al tanpa dicelupkan NaOH
Al dicelupkan NaOH 5% pemanasan 500C
dengan variasi waktu 10 menit, 20 menit, dan 30 menit dengan pencucian
Pembuatan Spesimen
Al dicelupkan NaOH 5 % pemanasan 50
dengan variasi waktu 10 menit, 20 menit dan 30 menit tanpa
pencucian
C
0
Pengujian Absorptivitas Surya
Pengujian Emisivitas Thermal
Pengujian Kenaikan Suhu
Analisa Data
Pembahasan
Kesimpulan
Gambar 3.1. Diagram Alir Penelitian
3.2. Bahan
Pertama-tama harus dipersiapkan sebelum dicelupkan dalam
NaOH adalah plat aluminium yang sudah dipotong-potong sesuai ukuran
yang diinginkan, dalam pengujian ini ukuran dimensinya 50 ×30 ×2 mm.
Dapat dilihat dalam gambar dibawah ini :
50 mm 2 mm
30 mm
Gambar 3.2. Bentuk benda uji
3.3. Proses Pencelupan dalam NaOH
Pencelupan spesimen dilakukan dalam beberapa proses secara bertahap,
diantaranya sebagai berikut ini :
1. Spesimen yang telah dibentuk sesuai dengan ukuran dibersihkan dari
berbagai macam kotoran sisa yang menempel pada spesimen saat
proses pembuatan.
3. NaOH ditimbang sesuai dengan jumlah yang diinginkan.
4. NaOH yang telah ditimbang tersebut dilarutkan pada air dengan
volume tertentu untuk mendapatkan molaritas atau kepekatan yang
diinginkan.
5. Selanjutnya spesimen dimasukkan ke dalam gelas yang berisi larutan
NaOH dalam jangka waktu tertentu, cara pencelupan spesimen
dalam NaOH yaitu dengan cara dipanaskan pada waktu pencelupan.
6. Setelah spesimen direndam dengan cara seperti pada no 5 dalam
larutan NaOH dalam waktu yang diinginkan lalu diangkat kemudian:
a. Al tanpa dicuci dan dikeringkan
b. Al dicuci dan dikeringkan
3.4. Larutan
Pencelupan spesimen dalam larutan NaOH untuk mendapatkan
permukaan yang baik dengan 2 macam variasi :
1. Variasi A, Pencelupan dengan kadar NaOH 5 % dengan cara
dipanaskan lalu diangkat tanpa dicuci.
Diketahui :
Air : 95 g
NaOH : 5 g
A1 waktu pencelupan = 10 menit
A2 waktu pencelupan = 20 menit
2. Variasi B, Pencelupan dengan kadar NaOH 5 % dengan cara
dipanaskan lalu diangkat dan dicuci.
Diketahui :
Air : 95 g
NaOH : 5 g
B1 waktu pencelupan = 10 menit
B2 waktu pencelupan = 20 menit
B3 waktu pencelupan = 30 menit
3.5. Pengujian Bahan
Spesimen yang sudah di celupkan ke dalam NaOH baik
yang dengan cara dipanaskan lalu dicuci maupun yang tidak dicuci
akan dilakukan pengujian absorptivitas surya dan pengujian
emisivitas termal.
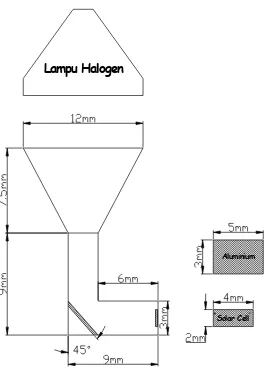
3.5.1. Pengujian Absorptivitas Surya
Tujuan dari pengujian absorptivitas surya ini adalah
mencari besar energi yang diserap oleh aliminium yang telah
dicelupkan kedalam larutan NaOH. Dalam pengujian ini digunakan
lampu hologen 150 W yang berfungsi sebagai sumber radiasi gelombang pendek, dan sebagai pembaca radiasi gelombang
pendek yang dipancarkan oleh permukaan pelat aluminium di
gunakan solar cell. Untuk outputnya dapat dibaca menggunakan multi meter dinyatakan dalam tegangan (Volt) pada skala 20 Volt
Selanjutnya setelah besar energi yang dipantulkan diketahui, maka
besar energi yang diserap oleh aluminium dapat diketahui dengan
persamaan, yaitu:
αλ + ρλ= 1 ...( 3.1 )
Di mana,
αλ = absorptivitas surya pada suatu panjang
gelombang tertentu.
ρλ = reflektivitas surya pada suatu panjang gelombang tertentu
Lampu Halogen
Solar Cell Aluminium
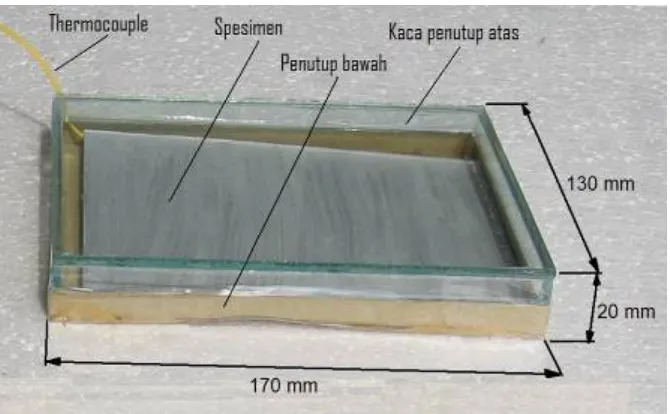
Dalam pengujian ini dilakukan dengan mengunakan kotak yang
terbuat dari kertas tebal berbentuk siku yang tidak dapat tertembus
cahaya luar dan dilengkapi dengan lampu halogen 150 W seperti yang tersaji dalam gambar 3.3.
Tujuan pengujian absorptivitas surya adalah :
Untuk mengetahui besar faktor absorptivitas surya suatu bahan
dalam menyerap panas.
3.5.2. Pengujian Emisivitas Termal
Untuk pengujian emisivitas thermal ini digunakan alat
penguji radiasi thermal
Langkah penelitian :
a. Mempersiapkan benda uji
Benda yang akan diuji dipasang pada pemegang yang sudah
dipersiapkan sebelumnya sesuai bentuk dan dimensi benda
uji. Yang perlu diperhatikan dalam hal ini adalah pemegang
benda uji harus tahan panas tinggi. Pemasangan benda uji ini
Gambar 3.4. Pemasangan Spesimen
b. Pelaksanaan penelitian
Pelaksanaan penelitian dilakukan di Laboratorium Perpindahan
Panas Universitas Sanata Dharma. Dengan menggunakan alat
penguji radiasi termal dapat diteliti kemampuan radiasi suatu
bahan bila diberi panas. Selanjutnya setelah benda uji
terpasang dengan benar, begitu juga dengan thermocouple dan radiometer, maka hidupkan source (sumber panas) dengan memasang daya pada 4,5 strip skala alat ukur. Pemasangan
benda uji berjarak 50 mm dari source dan 60 mm dari radiometer dengan posisi seperti pada Gambar 3.4. Semua
pengambilan data berdasarkan sebuah data dengan kondisi awal
sebagai berikut:
TS1 = suhu awal permukaan aluminium ( ° C )
TS2 = suhu akhir permukaan aluminium ( ° C )
TA = suhu sekitar ( ° C )
= 27° C
R0 = radiasi awal
= 2
R1 = radiasi akhir
t = waktu pemberian panas (menit)
= 5 menit
Alat untuk membaca data suhu dan radiasi bisa dilihat Gambar
3.5 dibawah ini.
Gambar 3.5. Panel indikator
Setelah diketahui nilai radiasi akhir ( R1 ) dan suhu akhir ( TS ),
maka dapat diketahui nilai emisivitas termalnya dengan
persamaan berikut:
di mana :
q : energi yang dipancarkan (W/m2)
: 5,59 × R1
ε : emisivitas termal
σ : konstanta Stefan boltzmann = 5,67 x 10-8 W/(m2.K4)
TS : temperatur akhir permukaan ( K )
TA : temperatur sekitar ( K )
c. Tujuan pengujian emisivitas thermal
1. Untuk mengetahui besar panas yang dilepas oleh suatu
bahan.
2. Untuk mengetahui cara pelepasan panas dari suatu bahan
atau spesimen.
3.5.3. Pengujian sinar matahari
Dalam pengujian ini menggunakan sinar matahari secara
langsung. Untuk pengujian yang satu ini spesimen yang digunakan
berukuran 12,5cm x 16,5cm. Ukuran spesimen dalam pengujian
sinar matahari ini dibuat agak besar dengan tujuan agar sinar
matahari yang dipancarkan ke permukaan benda dapat ditampung
Tujuan pengujian sinar matahari ini adalah untuk mengukur
berapa panas yang bisa diserap oleh aluminium (spesimen)
setelah dicelupkan ke dalam larutan NaOH 5 % dengan variasi
waktu tertentu yang disertai pengadukan.
Langkah penelitian :
a. Alat uji
Alat uji menggunakan sinar matahari secara langsung.
b. Mempersiapkan benda uji
Benda uji dari aluminium (spesimen) tadi dimasukan pada
sebuah penampang yang terbuat dari kaca transparan dengan
tujuan panas dari sinar matahari yang dipancarkan ke
spesimen dapat masuk dari berbagai sudut dan panas tersebut
tidak mudah keluar atau hilang ke udara bebas, sehingga
membuat suhu stabil. Dapat dilihat pada Gambar 3.6
c. Pelaksanaan penelitian
Setelah spesimen tadi terpasang, kemudian spesimen tadi
dijemur di bawah sinar matahari langsung, tetapi sebelum di
jemur di ukur terlebih dahulu suhu awal spesimen dengan
menggunakan thermokopel. Setelah menentukan suhu awal,
benda di jemur hingga mendapatkan suhu panas yang
BAB IV
DATA PENELITIAN DAN PEMBAHASAN
4.1. Analisis Pengujian Absorptivitas
Pengujian absorptivitas ini bertujuan untuk mengetahui kemampuan
setiap spesimen menyerap energi panas setelah dicelupkan dalam larutan
NaOH dengan kadar 5 %. Hasil pengujian disajikan dalam Tabel 4.1 sampai
Tabel 4.3.
Tabel 4.1. Data Hasil Pengujian Absorptivitas Surya Pada Material Awal
No Material Awal Spesimen Tegangan Solar Cell Tanpa Pantulan (volt) Tegangan Solar Cell Pantulan dari Al
(volt)
Reflektivitas Al( ρAl )
Absorptivita s Al (αAl)
Rata-rata Absorptivitas
1 3,16 2,68 0,848 0,152
2
3,16 2,66 0,842 0,158
Tabel 4.2. Data Hasil Pengujian Absorptivitas Surya Pada Pelat Al Terkorosi NaOH 5 % Tanpa Cuci
Spesime n Varisasi waktu celup (menit) Tegangan Solar Cell Tanpa
Pantulan (volt) Tegangan Solar Cell Pantulan dari Al
(volt)
Reflektivitas Al (ρAl)
1 Al
3 3,16 2,71 0,858
0,151
0,142
Absorptivitas Al (αAl)
Rata-rata Absorptivitas
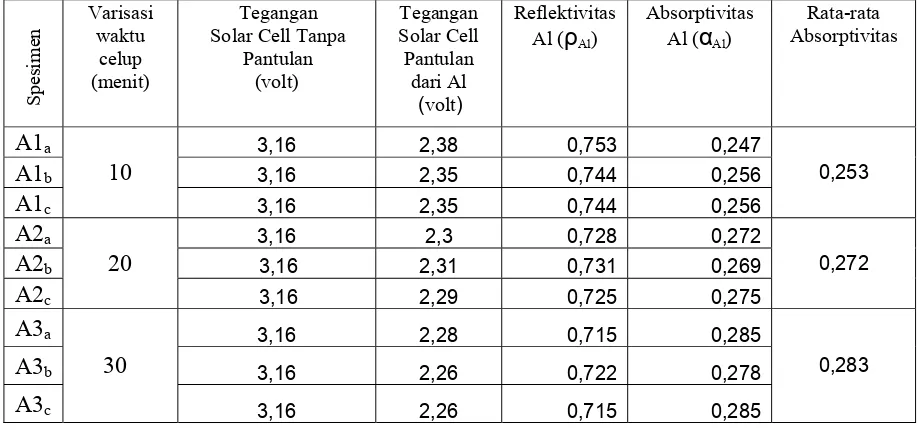
A1a 3,16 2,38 0,753 0,247
A1b 3,16 2,35 0,744 0,256
A1c
10
3,16 2,35 0,744 0,256
0,253
A2a 3,16 2,3 0,728 0,272
A2b 3,16 2,31 0,731 0,269
A2c
20
3,16 2,29 0,725 0,275
0,272
A3a 3,16 2,28 0,715 0,285
A3b 3,16 2,26 0,722 0,278
Tabel 4.3. Data Hasil Pengujian Absorptivitas Surya Pada Pelat Al Terkorosi NaOH 5 % Dengan Dicuci
Varisasi waktu celup
(menit) Tegangan Solar Cell Tanpa Pantulan (volt) Tegangan Solar Cell Pantulan dari Al (volt Reflektivitas Al (ρAl)
Spesime
n Absorptivitas
Al (αAl)
Rata-rata Absorptivitas
B1a 3,16 2,75 0,858 0,142
B1b 3,16 2,75 0,870 0,130
B1c
10
3,16 2,71 0,870 0,130
0,134
B2a 3,16 2,72 0,861 0,139
B2b 3,16 2,73 0,864 0,136
B2c
20
3,16 2,74 0,867 0,133
0,136
B3a 3,16 2,73 0,867 0,133
B3b 3,16 2,73 0,864 0,136
B3c
30
3,16 2,74 0,864 0,136
0,135
Penambahan waktu pemanasan tidak berpengaruh secara signifikan
pada hasil pengujian absorptivitas. Di sini tidak dapat disimpulkan bahwa
semakin lama waktu pemanasan semakin besar nilai absoptivitasnya atau
sebaliknya. Hal itu kemungkinan disebabkan oleh beberapa faktor yang
kurang sempurna antara lain :
- Proses pencelupan
- Proses pemanasan
- Proses pengeringan
- Pembacaan multi meter
- Kadar NaOH yang rendah
Dari pengujian absorptivitas ini mendapatkan dua hasil yang
berbeda. Dengan pemanasan tanpa cuci dapat mencapai angka absorptivitas
yang diharapkan lebih besar dari permukaan aluminium awal/tidak diproses,
absorptivitas yang diharapkan yaitu lebih kecil dari permukaan aluminium
awal/tanpa proses.
Dengan pengujian radiasi dapat diketahui besar angka reflektivitas,
yang besarnya berbanding terbalik dengan besar absorptivitas. Untuk
mencari besar absortivitas melalui perbandingan besar tegangan solar cell
pantulan dari aluminium dengan besar tegangan langsung dari solar cell, dapat dicari menggunakan persamaan sebagai berikut:
αλ + ρλ= 1 ... ( 1 )
di mana,
αλ : absorptivitas surya
ρλ : reflektivtas surya
maka,
αλ= 1 - ρλ ... ( 2 )
= 1 - ⎟⎟
⎠ ⎞ ⎜⎜
⎝ ⎛
Solarcell Tegangan
Al Pantulan cell
Diagram Uji Absorptivitas
0.1424 0.1582
0.1519
0 0.02 0.04 0.06 0.08 0.1 0.12 0.14 0.16 0.18
1 2 3
Spesimen Awal
Ab
so
rpti
vi
tas
0.2532 0.2722 0.2827 0 0.05 0.1 0.15 0.2 0.25 0.3
10 20 30
Waktu Pemanasan (menit)
A b sor p si vit a s
Gambar 4.2. Diagram pengaruh waktu pemanasan pada absorptivitas (pengeringan alami)
0.1340 0.1361 0.1350
0 0.02 0.04 0.06 0.08 0.1 0.12 0.14 0.16
10 20 30
Waktu Pemanasan (menit)
A b sor p ti vi ta s dicuci
0.2532
0.2722 0.2827
0.1340 0.1361 0.1350
0.1508
0 0.05 0.1 0.15 0.2 0.25 0.3
A A1 A2 A3 B1 B2 B3
Spesimen
A
b
sor
p
ti
vit
a
s
A = tanpa perlakuan, A1 = pemanasan 10 menit (tanpa cuci), A2 = pemanasan 20 menit (tanpa cuci), A2 = pemanaan 30 menit (tanpa cuci) B1 = pemanasan 10 menit (dicuci), B2 = pemanasan 20 menit (dicuci),
B3 = pemanasan 30 menit (dicuci)
Gambar 4.4 Diagram pengaruh pencelupan NaOH pada absorptivitas untuk seluruh spesimen
4.2. Analisis Pengujian Emisivitas
Pengambilan data emisivitas ini bertujuan untuk mengetahui
seberapa besar suatu bahan melepas energi panas. Cara merusak permukaan
suatu bahan Aluminium dengan mencelupkan ke dalan larutan NaOH dapat
menyebabkan perubahan emisivitas pada bahan tersebut. Data-data yang
diambil dalam penelitian ini adalah data emisivitas thermal, disajikan dalam
Tabel 4.4. Data Hasil Pengujian Emisivitas Termal Pada Material Awal.
Thermocouple 1
Thermocouple 2 No Material
Awal
Spesimen Suhu Al (TS)
(°C)
Suhu Sekitar (TA)
(°C) Radiasi Thermal (R) Energi yg Dipancarkan
(q) (W/m2)
Emisivitas Thermal
(
ε
)Rata-rata Emisivitas
1 42,1 26 4 22,36 0,211
2 40,2 26 4 22,36 0,242
1
Tabel 4.5. Data Hasil Pengujian Emisivitas Thermal Pada Pelat Al Terkorosi NaOH 5 % Tanpa cuci
Thermocouple 1 Spesime Varisasi waktu celup (menit) Suhu Al (TS)
(°C)
Suhu Sekitar
(TA)
(°C)
Radiasi Thermal
(R)
Energi yg Dipancarkan (q)
(W/m2)
Emisivitas Thermal
(
ε
)Rata-rata Emisivitas
A1a 47.2 26 16 89.44 0.626
A1b 47.8 26 16 89.44 0.607
A1c
10
46.9 26 16 89.44 0.636
0.623
A2a 47.4 26 21 117.39 0.813
A2b 48.8 26 20 111.8 0.722
A2c
20
50.6 26 20 111.8 0.663
0.733
A3a 52.2 26 21 117.39 0.649
A3b 53.8 26 22 122.98 0.635
A3c
30
55.2 26 23 128.57 0.628
0.637
Al
3 40,1 26 4 22,36 0,244
0,232
No Material Awal
Spesimen Suhu Al (TS)
(°C)
Suhu Sekitar (TA)
(°C) Radiasi Thermal (R) Energi yg Dipancarkan
(q) (W/m2)
Emisivitas Thermal
(
ε
)Rata-rata Emisivitas
1 48 33 4 22,36 0,276
2 46 33 4 22,36 0,253
1 Al 0,237
Thermocouple 2 Spesime Varisasi waktu celup (menit) Suhu Al (TS)
(°C)
Suhu Sekitar
(TA)
(°C)
Radiasi Thermal
(R)
Energi yg Dipancarkan (q)
(W/m2)
Emisivitas Thermal
(
ε
)Rata-rata Emisivitas
A1a 48 33 16 89,44 0,853
A1b 48 33 16 89,44 0,853
A1c
10
49 33 16 89,44 0,796
0,834
A2a 50 33 21 117,39 0,978
A2b 50 33 20 111,8 0,932
A2c
20
51 33 20 111,8 0,876
0,928
A3a 54 33 21 117,39 0,777
A3b 53 33 22 122,98 0,858
A3c
30
52 33 23 128,57 0,949
0,861
Tabel 4.6. Data Hasil Pengujian Emisivitas Thermal Pada Pelat Al Terkorosi NaOH 5 % Dengan Dicuci
Thermocouple 1 Spesime Varisasi waktu celup (menit) Suhu Al (TS)
(°C)
Suhu Sekitar
(TA)
(°C)
Radiasi Thermal
(R)
Energi yg Dipancarkan (q)
(W/m2)
Emisivitas Thermal
(
ε
)Rata-rata Emisivitas
B1a 36,7 26 2 4 0,327
B1b 38,6 26 2 4 0,275
B1c
10
38,1 26 2 4 0,287
0,296
B2a 38,5 26 2 4 0,277
B2b 39,6 26 2 4 0,253
B2c
20
40,7 26 2 5 0,291
0,274
B3a 39,7 26 2 5 0,314
B3b 41,4 26 2 5 0,277
B3c
30
44,8 26 2 5 0,223
Thermocouple 2 Spesime Varisasi waktu celup (menit) Suhu Al (TS)
(°C)
Suhu Sekitar
(TA)
(°C)
Radiasi Thermal
(R)
Energi yg Dipancarkan (q)
(W/m2)
Emisivitas Thermal
(
ε
)Rata-rata Emisivitas
B1a 43 33 4 22,36 0,328
B1b 44 33 4 22,36 0,296
B1c
10
45 33 4 22,36 0,270
0,298
B2a 45 33 4 22,36 0,270
B2b 46 33 4 22,36 0,248
B2c
20
46 33 5 27,95 0,311
0,276
B3a 47 33 5 27,95 0,287
B3b 30 48 33 5 27,95 0,267 0,273
B3c 48 33 5 27,95 0,267
Dalam pengujian ini lamanya waktu pencelupan dengan pemanasan
juga tidak dapat menentukan besar kecilnya nilai emisivitas benda uji, ini
disebabkan beberapa faktor yang hampir sama pada pengujian absorptivitas.
Hal ini bisa juga terjadi jika kurangnya pendinginan alat pemanas, yang
mengakibatkan kondisi awal yang berbeda pada saat pengukuran suhu dan
radiasinya.
Dengan mengetahui suhu aluminium, suhu sekitar dan radiasi dapat
diketahui emisivitas thermal menggunakan persamaan sebagai berikut:
(
4)
A 4 S T T σ ε
q= − ... ( 3 )
dimana :
q : energi yang dipancarkan (W/m2)
: 5,59 × R
ε : emisivitas thermal
σ : konstanta Stefan boltzmann = 5,67 x 10-8 W/(m2.K4)
TA : temperatur sekitar ( K )
Diagram Uji Emisivitas
0.2114
0.24190.2484 0.2438 0.2484
0.2132
0 0.05 0.1 0.15 0.2 0.25 0.3
1 2 3
Specimen
Em
is
iv
it
as
Thermocouple1 Thermocouple 2
0.7328 0.6374 0.6231 0.8337 0.9283 0.8614 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
10 20 30
Waktu Pemanasan (menit)
Emisi
v
itas
Thermocouple 1 Thermocouple 2
Gambar 4.6. Diagram pengaruh waktu pemanasan pada emisivitas (tanpa cuci) 0.2716 0.2962 0.2740 0.2733 0.2982 0.2764 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35
10 20 30
Waktu Pemanasan (menit)
Em is iv it as Thermocouple 1 Thermocouple 2
0.2324 0.6231 0.7328 0.6374 0.2962 0.2716 0.2740 0.2367 0.8337 0.9283 0.8614 0.2733 0.2764 0.2982 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1
A A1 A2 A3 B1 B2 B3
Spesimen
Emisi
v
itas Thermocouple1
Thermocouple2
A = tanpa perlakuan, A1 = pemanasan 10 menit (tanpa cuci), A2 = pemanasan 20 menit (tanpa cuci), A2 = pemanasan 30 menit (tanpa cuci) B1 = pemanasan 10 menit (dicuci), B2 = pemanasan 20 menit (dicuci),
B3 = pemanasan 30 menit (dicuci)
Gambar 4.8. Diagram pengaruh pencelupan NaOH pada emisivitas untuk seluruh spesimen
4.3. Analisis Pengujian dengan Sinar Matahari
Pengambilan data pada pengujian langsung dengan sinar matahari ini
bertujuan untuk mengetahui seberapa besarnya suatu bahan menerima panas
matahari setelah merusak membuat kasar permukaan suatu bahan
Aluminium dengan mencelupkan ke dalam larutan NaOH 5 %. Data-data
yang diambil dalam penelitian ini adalah besarnya suhu pada setiap benda
Tabel 4.7. Data Hasil Pengujian dengan Sinar Matahari
Suhu Al Tanpa dicuci (ºC)
Suhu Al dicuci (ºC) Waktu
Penjemuran (menit)
Suhu Al dicat hitam (ºC)
10 menit 20 menit 30 menit 10 menit 20 menit 30 menit
0 27.4 27,4 27,4 27,4 27,4 27,4 27,4
5 62.7 56,2 53,2 54,8 39,8 38,6 42,1
10 72.4 62,7 62,6 62,6 49,6 47,2 48,2
15 74.7 64,1 65,2 63 53 49,5 51
20 81.1 69,1 69,7 71 56,2 52,6 52,4
25 85.5 75,5 75,7 78,4 59,6 56,4 55,8
30 87.6 78,4 79,4 82,1 62,6 59,9 58,3
35 88.3 79,9 81,2 84,9 64,1 61 60,6
40 89.8 81,6 83,3 86,7 65,3 62,3 62,6
45 90.5 83,1 85,2 89,5 66,7 64,5 62,9
50 90.2 81,8 84 87,2 66,1 64,5 61,6
55 82.9 74,7 77,4 79,9 64,5 61,4 60,2
60 88.7 81,2 83,2 86,3 65,5 62 61,3
Rata2 78,60 59,17 58,97 59,53 47,6 45,28 46,15
ΔT 61,3 53,8 55,8 58,9 38,1 34,6 33,9
Dalam pengujian ini lamanya waktu pencelupan dengan pemanasan
berpengaruh pada hasil pengujian dengan sinar matahari untuk waktu yang
sama. Disimpulkan bahwa semakin lama waktu pencelupan dengan
pemanasan 50°C dengan pengeringan alami tanpa cuci maka semakin besar
suhu yang dicapai atau sebaliknya. Sedangkan semakin lama waktu
pencelupan dengan pemanasan 50°C dengan dicuci semakin kecil suhu yang
dicapai. Dari data ini dapat dilihat adanya perubahan peningkatan suhu
antara Al tanpa pencelupan NaOH dengan Al setelah mengalami pencelupan
0
10
20
30
40
50
60
70
80
90
100
0
5
10
15
20
25
30
35
40
45
50
55
60
Waktu Pemanasan (menit)
S
uhu
(º
C)
tanpa perlakuan dipanaskan (10 menit),tanpa cuci dipanaskan (20 menit) tanpa cuci dipanaskan (30 menit) tanpa cuci dipanaskan(10 menit) dicuci dipanaskan (20 menit) dicuci dipanaskan (30 menit) dicuci
Gambar 4.11. Foto Permukaan Aluminium Dengan Pemanasan 50°C Dicuci
Al murni Variasi pemanasan 10 menit
Variasi pemanasan 20 menit Variasi pemanasan 30 menit
Gambar 4.12. Foto Permukaan Aluminium Dengan Pemanasan 50°CTanpa
Cuci
BAB V
KESIMPULAN DAN PENUTUP
5.1. Kesimpulan
Dari hasil penelitian, pengujian dan analisis, maka dapat
disimpulkan:
1. Dari pengujian absorptivitas dan emisivitas, disimpulkan dengan metode
dipping in chemical baths (permukaan dikasarkan dengan dipanaskan lalu direndam dalam larutan kimia NaOH) dapat mengubah
absorptivitas, meningkat 1-2 kali lipat.
2. Untuk pengujian emisivitas, disimpulkan dengan metode dipping in chemical baths dapat mengubah emisivitas, meningkat 1-4 kali lipat. 3. Pada pengujian menggunakan sinar matahari pelat yang mendapat
perlakuan penyerapannya lebih tinggi, naik ± 20C – 250C dibandingkan
dengan pelat yang tidak mendapatkan perlakuan dan didapatkan suhu
tertinggi 86,3 0C pada spesimen dengan perlakuan.
5.2. Penutup
Di dalam pembuatan permukaan selektif dengan metode dipping in chemical baths (permukaan direndam dalam larutan kimia NaOH) ini diharapkan dapat membantu semua pihak dalam memahami faktor
absorptivitas dan emisivitas.
Akhir kata penulis mengucapkan terima kasih kepada semua pihak
yang telah banyak membantu selama proses penyusunan Tugas Akhir ini.
Bila terjadi ketidakakuratan data, disebabkan oleh keterbatasan dana,
peralatan dan ketilitian dalam pengamatan. Kritik dan saran untuk kemajuan
sangat penulis harapkan, sehingga ini dapat berguna bagi semua pihak.
5.3. Saran
Sebagai acuan penelitian berikutnya perlu diperhatikan hal-hal berikut :
- Gunakan variasi waktu yamg lebih lama dan kadar NaOH yang besar
untuk mendapatkan permukaan yang kasar.
- Dalam pengambilan data pengujian sinar matahari display disesuaikan
jumlah spesimen agar data lebih akurat.
- Gunakan air aquadest sebagai pelarut untuk mendapatkan larutan yang
lebih akurat.
Daftar Pustaka
Choundhuryn, G. M. 2002. Selective Surface for Efficient Solar Thermal
Conversion. Bangladesh Reneweble Energy News Letter. Vol. 1 No 2, Vols 1 & 2, July 2000-December 2002. Commotte for Promotion and
Dissemination of Renewable Energy in Bangladesh. Bangladesh.
Gelin, K. 2004. Preparation and Charcteration of Sputter Deposited Spectrally Selective Solar Absorber. Comprehensive Summaries of Uppsala Dissertation from the Faculty of Science and Tecnology. Uppsala
University.
Holman, J. P. 1993. Perpindahan Kalor. Erlangga : Jakarta.
Jansen, T. J. Teknologi Rekayasa Surya. Pradnya Paramita : Jakarta. Rosenberg, J. L. 1996. Kimia Dasar. Erlangga : Jakarta.
Surdia, T. 1991. Pengetahuan Bahan Teknik. Pradnya Paramita : Jakarta.