SKRIPSI
KLONING DAN KARAKTERISASI
GEN PENYANDI α-AMILASE (amyA) Aspergillus niger
SERTA KONSTRUKSI EKSPRESI DENGAN TEKNOLOGI GATEWAY
Oleh : OVI SARASWATI
F24063321
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
KLONING DAN KARAKTERISASI
GEN PENYANDI α-AMILASE (amyA) Aspergillus niger
SERTA KONSTRUKSI EKSPRESI DENGAN TEKNOLOGI GATEWAY
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN Pada Departemen Ilmu dan Teknologi Pangan
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh : OVI SARASWATI
F24063321
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kloning dan Karakterisasi Gen Penyandi α-amilase (amyA)
Aspergillus niger serta Konstruksi Ekspresi dengan
Teknologi Gateway Nama : Ovi Saraswati
NIM : F24063321
Menyetujui,
Pembimbing Akademik I
Dr. Ir. M. Arpah, M.Si NIP : 19600608.198603.1.002 Pembimbing Akademik II Dr. Djoko Santoso NIK : 110.700.295 Mengetahui, Ketua Departemen
Dr. Ir. Dahrul Syah. NIP : 19650814.199022.1.001
Ovi Saraswati. F24063321. Kloning dan Karakterisasi Gen Penyandi α-amilase (amyA) Aspergillus niger serta Konstruksi Ekspresi dengan Teknologi Gateway. Di bawah bimbingan Muh. Arpah dan Djoko Santoso
RINGKASAN
Enzim α-amilase (α-1,4-D-glukan glukanohidrolase, EC 3.2.1.1, endoamilase) merupakan enzim ekstraseluler yang mampu mengkatalisis hidrolisis ikatan α-1,4 glukosidik pada pati dan glikogen secara acak dari tengah atau bagian dalam molekul, tetapi tidak dapat menghidrolisis ikatan glukosidik α-1,6 pada percabangan amilopektin. Enzim α-amilase adalah salah satu enzim hidrolitik yang paling penting dalam industri berbasis pati dan komersialisasinya merupakan yang tertua.
Kebutuhan α-amilase di dunia sangat tinggi, pada tahun 2004 saja mencapai penjualan sekitar US$ 2 milyar dan diperkirakan akan terjadi peningkatan jumlah per tahun dengan laju 3,3%. Pemanfaatan untuk sektor makanan dan minuman adalah sekitar 90% dari karbohidrase yang dihasilkan. Penjualan tahunan enzim α-amilase diperkirakan mencapai US$ 11 juta. Produksi amilase oleh Bacillus licheniformis dan Aspergillus sp. sekitar 300 ton enzim murni pertahun (Sivaramakrishnan et al., 2006). Biaya yang dikeluarkan Indonesia untuk mengimpor enzim produksi luar negeri sangat tinggi. Berdasarkan data Badan Pusat Statistik (BPS), impor enzim di Indonesia mencapai US$ 12,5 juta pada tahun 2005, meningkat menjadi US$ 16,7 juta di tahun 2006, selanjutnya pada tahun 2007 mencapai US$ 19 juta. Pada tahun 2008 dan 2009 mencapai US$ 20,2 juta dan US$ 20,3 juta.
Saat ini enzim α-amilase banyak diteliti dan dihasilkan di Indonesia, tetapi penelitian produksi amilase melalui teknologi kloning gen penyandi α-amilase belum banyak dilakukan di Indonesia. Hal ini disebabkan oleh biaya yang dibutuhkan relatif mahal dan diperlukan keahlian khusus untuk melakukan teknologi kloning. Namun, teknologi kloning gen penyandi α-amilase dapat dilakukan dengan cepat dan hasil yang diperoleh dapat diperkirakan sebelumnya. Oleh karena itu, perlu dilakukan penelitian kloning, karakterisasi, dan konstruksi ekspresi gen penyandi α-amilase (amyA). Gen penyandi α-amilase diperoleh dari Aspergillus niger karena kelompok A. niger berbagai strain diketahui mampu memproduksi amilase dan produksi enzim α-amilase secara komersial banyak dihasilkan dari kapang Aspergillus sp. Selain itu, pertumbuhan A. niger relatif mudah. Penelitian ini sangat berguna untuk menghasilkan enzim α-amilase melalui E. coli yang telah ditransformasikan dengan konstruk gen penyandi enzim α-amilase dari Aspergillus niger sehingga enzim α-amilase dapat diproduksi di Indonesia dengan harga yang lebih murah dan Indonesia tidak perlu lagi melakukan impor enzim α-amilase dengan biaya yang sangat mahal. Adapun tujuan jangka pendek dari penelitian ini adalah kloning dan karakterisasi gen amyA yang menyandi enzim α-amilase.
Penelitian ini diawali dengan amplifikasi gen penyandi α-amilase dengan metode reverse transcriptase polymerase chain reaction (PCR). Proses RT-PCR berlangsung dalam dua tahap, yaitu sintesis cDNA dan amplifikasi DNA. Sintesis cDNA diawali dengan isolasi mRNA Aspergillus niger untuk selanjutnya
5 diubah menjadi cDNA dengan bantuan enzim transkriptase balik (reverse transcriptase). First strand cDNA synthesis atau first strand reaction menggunakan kit SuperScriptTM II Reverse Transcriptase dari Invitrogen. Messenger RNA (mRNA) yang telah diisolasi digunakan sebagai templat. Selain itu, digunakan primer oligo dT dalam first strand cDNA synthesis karena mRNA mempunyai basa poli (A) pada ujung 3 OH’ yang umumnya dijumpai pada organisme eukariot seperti Aspergillus niger. Setelah diperoleh utas tunggal cDNA, dilakukan proses amplifikasi gen penyandi α-amilase dengan teknik PCR
(Polymerase Chain Reaction). DNA templat yang digunakan adalah cDNA yang
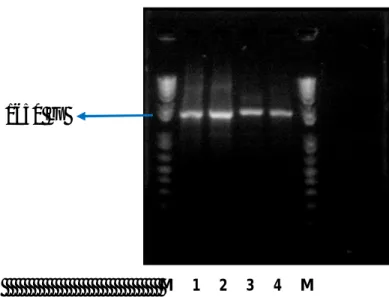
telah disintesis, sedangkan sepasang primer yang digunakan bersifat sequence specific yang masing-masing dirancang untuk dapat menempel secara spesifik pada daerah tertentu pada DNA templat Aspergillus niger, yaitu daerah penyandi gen α-amilase A. niger. Setelah proses PCR selesai, diperoleh produk PCR yaitu DNA hasil amplifikasi (amplikon) yang kemungkinan merupakan gen penyandi α-amilase dari Aspergillus niger. Ukuran produk PCR ini sesuai dengan ukuran segmen DNA yang dibatasi oleh kedua primer. Hasil amplifikasi yang diduga merupakan gen penyandi α-amilase pada Aspergillus niger diverifikasi menggunakan elektroforesis gel agarosa 1%. Fragmen DNA yang terbentuk kemudian dimurnikan dari gel agarosa menggunakan Pure Link Quick Gel Extraction Kit dari Invitrogen.
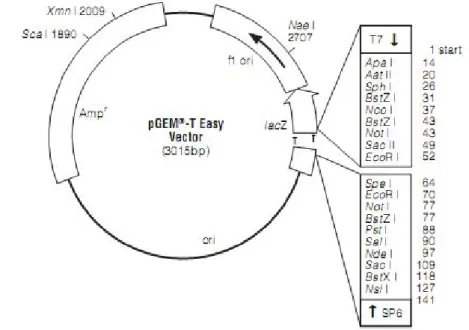
Setelah amplifikasi gen penyandi α-amilase dengan metode reverse transcriptase polymerase chain reaction, dilakukan pengklonan DNA yang telah dimurnikan dari gel agarosa ke sel inang, yaitu Escherichia coli. Proses ini meliputi ligasi, transformasi, seleksi transforman, dan PCR koloni. Ligasi dilakukan dengan cara menggabungkan fragmen DNA dengan vektor pengklonan pGEM-T Easy (Promega). Vektor ini disebut juga vektor T karena memiliki basa timin pada ujung 3’ sehingga vektor ini dapat menempel dengan fragmen DNA hasil amplifikasi yang memiliki kelebihan basa adenine (A) tanpa adanya tahapan pemotongan dengan enzim restriksi. Enzim yang digunakan untuk menyambung DNA adalah enzim yang gennya berasal dari genom virus (bakteriofag) T4 sehingga disebut T4 DNA ligase. Proses ligasi ini menghasilkan plasmid (vektor) rekombinan, yaitu plasmid yang sudah tersisipi oleh gen α-amilase dari Aspergillus niger. DNA rekombinan selanjutnya ditransformasikan ke sel E. coli galur XL-1 blue yang telah dibuat kompeten dengan perlakuan CaCl2.
Transformasi DNA rekombinan ke sel E. coli dilakukan dengan heat shock. Heat shock yang terjadi dari suhu 0 oC menjadi 42 oC menyebabkan membran sel kompeten menjadi permeabel terhadap molekul asing sehingga memudahkan plasmid rekombinan masuk ke dalam sel E. coli. Setelah proses transformasi, dilakukan seleksi transforman menggunakan metode koloni putih biru (blue white screening) pada media LB agar yang mengandung antibiotik ampisilin, X-gal, dan IPTG (isopropil-tiogalaktosidase). Koloni yang berwarna putih menunjukkan sel transforman (mengandung DNA plasmid), sedangkan koloni yang berwarna biru menunjukkan sel nontransforman (tidak mengandung DNA plasmid). Oleh karena itu, diambil 10 koloni yang berwarna putih secara acak karena diduga merupakan sel transforman. Koloni yang berwarna putih belum tentu merupakan sel transforman karena proses ligasi tidak hanya menghasilkan DNA rekombinan, tetapi juga produk-produk lain. PCR koloni dapat mengkonfirmasi sel transforman yang terbentuk sudah tersisipi DNA rekombinan atau belum. Pereaksi untuk PCR
6 koloni sama dengan PCR biasa, tetapi pada PCR koloni harus dilakukan lisis sel terlebih dahulu. Produk PCR koloni diverifikasi menggunakan gel agarosa 1 % dengan membandingkan ukuran pita produk PCR koloni yang terbentuk dengan ukuran pita DNA yang telah diamplifikasi. Setelah proses PCR koloni dan diperoleh koloni E. coli yang mengandung plasmid rekombinan, tahapan selanjutnya adalah isolasi DNA plasmid dari koloni yang positif mengandung plasmid rekombinan. Isolasi DNA plasmid menggunakan High Pure Plasmid Isolation Kit dari Invitrogen. DNA plasmid yang telah diisolasi selanjutnya diverifikasi menggunakan elektroforesis gel agarosa 1 %. Untuk lebih memastikan bahwa fragmen DNA yang telah diamplifikasi merupakan gen penyandi α-amilase dilakukan proses sekuensing DNA dan selanjutnya sekuen tersebut dianalisis dengan program BLAST (Basic Local Alignment Search Tool).
Tahapan berikutnya adalah ekspresi gen penyandi α-amilase (amyA) melalui teknologi kloning gateway. Kloning gateway terdiri dari empat tahap. Tahap pertama adalah PCR menggunakan DNA plasmid dan primer gateway. Kedua, purifikasi DNA hasil amplifikasi. Gen penyandi α-amilase yang telah dipurifikasi selanjutnya disisipkan ke dalam entry vector (vektor donor) pDONR 221 dengan reaksi BP. Gen amyA mempunyai situs attB1 dan attB2 pada saat amplifikasi, sedangkan vektor donor pDONR 221 mempunyai situs attP1 dan situs attP2 yang merupakan tempat untuk rekombinasi dengan hasil PCR yang telah mempunyai situs attB1 dan attB2. Adanya situs untuk rekombinasi ini menyebabkan tidak ada kemungkinan kesalahan orientasi gen yang direkombinasikan. Reaksi ini dikatalisis oleh enzim BP ClonaseTM sehingga dalam metode gateway reaksi rekombinasi pada vektor donor disebut reaksi BP (BP reaction). Reaksi BP merupakan tahap ke tiga proses ekspresi gen penyandi α-amilase (amyA) melalui teknologi kloning gateway. Plasmid rekombinan selanjutnya ditransformasikan ke sel E. coli galur XL-1 blue yang telah dibuat kompeten dengan perlakuan CaCl2. E. coli hasil transformasi kemudian
ditumbuhkan dalam media LA yang mengandung antibiotik kanamisin 50 ppm karena vektor pDONR 221 memiliki resistensi terhadap kanamisin. Koloni yang diduga mengandung DNA rekombinan selanjutnya dilakukan PCR koloni dan dilanjutkan dengan isolasi DNA plasmid. Tahap keempat ekspresi gen penyandi α-amilase (amyA) melalui teknologi kloning gateway adalah LR reaction. Reaksi LR ini digunakan untuk menyisipkan gen α-amilase ke dalam destination vector (vektor ekspresi), yaitu pDEST 24. Plasmid rekombinan yang telah diikat oleh situs attL1 dan attL2 direkombinasikan ke vektor destinasi yang membawa situs attR1 dan attR2. Reaksi ini dikatalisis oleh enzim LR ClonaseTM II sehingga dalam metode gateway reaksi rekombinasi ini disebut reaksi LR (LR reaction). pDEST 24 merupakan vektor ekspresi untuk mengekspresikan gen penyandi α-amilase pada E. coli. Tahapan reaksi LR hampir sama seperti reaksi BP, yaitu transformasi ke E. coli XL-1 blue kemudian dilakukan PCR koloni.
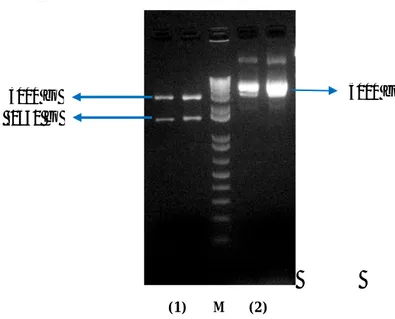
Penelitian ini berhasil mengisolasi gen penyandi α-amilase Aspergillus niger menggunakan primer spesifik. Hasil pengujian elektroforesis dengan gel agarosa 1 % menunjukkan bahwa gen tersebut memiliki ukuran 1650 bp dan analisis BLAST menunjukkan bahwa gen tersebut homolog dengan gen penyandi α-amilase yang terdapat di bank gen. Proses pembuatan kaset ekspresi gen ke dalam E. coli yang menggunakan sistem kloning gateway (Gateway Cloning) menunjukkan bahwa gen tersebut telah berhasil disubkloning ke vektor ekspresi
7 pDEST 24. Hal ini dibuktikan dengan elektroforesis hasil PCR koloni E. coli XL-1 blue yang telah disisipi plasmid pDEST 24 rekombinan. Pita elektroforesis dengan ukuran 1650 bp menunjukkan bahwa gen penyandi α-amilase telah berhasil dikloning untuk ekspresi pada E. coli.
CLONING AND CHARACTERIZATION OF
α-AMILASE GENE (amyA) OF Aspergillus niger AND CONSTRUCTION OF THAT GENE EXPRESSION BY GATEWAY TECHNOLOGY
Ovi Saraswati1, M. Arpah1, Djoko Santoso2
1)Departemen Ilmu dan Teknologi Pangan, Institut Pertanian Bogor, Kampus IPB
Darmaga Bogor 16002, Indonesia
2) Balai Penelitian Bioteknologi Perkebunan Indonesia, Bogor
Abstract
Cloning of the a-amylase gene of Aspergillus niger chromosomal DNA on pDEST 24 plasmid to increase the enzyme activity has been investigated. The transformation was conducted with several steps, including isolation of the messenger RNA, ligation by T4-DNA ligase, transformation of the recombinant DNA, and selection of the transformants using PCR colony. Gene encoding α -amylase isolated using RT-PCR (Reverse Transcriptase Polymerase Chain Reaction technique) and inserted into the pGEM-T Easy vector. Electrophoresis of the PCR products showed that the gene has a size of approximately 1650 bp. BLAST analysis of the DNA sekuen showed that this gene is homologous with the gene encoding α-amylase accessible from the gene bank. Expression of the gene encoding α-amylase of Aspergillus niger used gateway cloning technology. It showed that this gene has been successfully cloned in the cells of Escherichia coli through destination vector (pDEST 24). Electrophoresis of the PCR colony showed that the gene has a size of approximately 1650 bp.
RIWAYAT HIDUP PENULIS
Penulis dilahirkan di Solo pada tanggal 9 Juni 1988. Penulis merupakan anak ke empat dari empat bersaudara dari pasangan Djoko Lupito dan Sri Kartini. Penulis menyelesaikan pendidikan dasar di SD Negeri Wonosaren 1 Surakarta tahun 2000, pendidikan menengah pertama di SMP Negeri 4 Surakarta tahun 2003, dan pendidikan menengah atas di SMA Negeri 1 Surakarta tahun 2006. Penulis aktif di berbagai kegiatan kepanitiaan Himpunan Mahasiswa Ilmu dan Teknologi Pangan (Himitepa) selama menjalani studi di Institut Pertanian Bogor, diantaranya Musyawarah Kerja Nasional HMPPI (Himpunan Mahasiswa Peduli Pangan Indonesia) 2007, BAUR 2008, TECHNO-F 2008, PLASMA 2008 (Pelatihan Sistem Manajemen Halal), dan Kampanye Ketahanan Pangan dan Penyuluhan Edukatif 2008. Penulis pernah mengikuti beberapa seminar seperti Seminar Kloning tahun 2010 dan Economic Seminar and Entrepreneur Talkshow tahun 2008. Penulis juga aktif sebagai pengajar Bimbel dan pengajar privat.
Sebagai tugas akhir, penulis melakukan penelitian di Laboratorium Biologi Molekuler, Balai Penelitian Bioteknologi Perkebunan Indonesia (BPBPI) dengan judul “Kloning dan Karakterisasi Gen Penyandi α-amilase (amyA) Aspergillus niger serta Konstruksi Ekspresi dengan Teknologi Gateway.” dibawah bimbingan Dr. Ir. M. Arpah, M.Si dan Dr. Djoko Santoso.
i KATA PENGANTAR
Segala puji dan syukur penulis panjatkan atas kehadirat Allah SWT, shalawat serta salam semoga selalu tercurah kepada Nabi Besar Muhammad SAW. Atas kehendak dan karunia-Nya, penelitian yang berjudul “Kloning dan Karakterisasi Gen Penyandi α-amilase (amyA) Aspergillus niger serta Konstruksi Ekspresi dengan Teknologi Gateway” dapat diselesaikan. Penelitian ini dilakukan sebagai bagian dari tugas akhir untuk memperoleh gelar Sarjana Teknologi Pertanian pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor.
Tidak lupa penulis ucapkan terima kasih yang sedalam-dalamnya kepada pihak-pihak yang telah banyak memberikan bantuan dalam pembuatan laporan tugas akhir ini, yaitu:
1. Allah SWT, terima kasih atas segala nikmat dan karunia yang telah diberikan. Sungguh tak pernah sanggup diri ini untuk menghitung nikmatMu.
2. Dr. Ir. M. Arpah, M.Si selaku dosen pembimbing atas waktu, pengertian, kritik, saran, dan seluruh bentuk bimbingan dan kebaikan yang telah diberikan. Mohon maaf atas segala kesalahan dan kekurangan Penulis. Semoga Bapak selalu dalam lindungan-Nya dan mendapat balasan dari Allah atas kebaikan Bapak. Amin.
3. Dr. Djoko Santoso selaku pembimbing di Balai Penelitian Bioteknologi Perkebunan Indonesia yang telah memberikan kesempatan kepada Penulis untuk melakukan penelitian ini. Terima kasih banyak atas waktu, bimbingan, motivasi, kritik, dan saran sehingga skripsi ini dapat terselesaikan. Semoga Bapak mendapat balasan dari Allah atas kebaikan Bapak dan selalu dalam Rahmat-Nya. Amin.
4. Balai Penelitian Bioteknologi Perkebunan Indonesia atas kesempatan dan dana yang diberikan hingga penelitian ini selesai.
5. Teh Rini, Teh Nina, Mbak Alin, Mbak Urip, Teh Niyyah, Teh Riana, Teh Aan, Teh Herti, Mas Lutfi, Mas Heri, Mas Topan, Mas Wahyu, Mbak Saeli, dan Mbak Izzah atas segala bimbingan, bantuan, dorongan, dan keceriaan yang diberikan selama Penulis melakukan penelitian di Balai Penelitian
ii Bioteknologi Perkebunan Indonesia. Semoga mendapat balasan dari Allah dengan balasan yang baik. Amin.
6. Keluargaku tercinta, Ibu, Mbak Danik, Mas Sigit, Mbak Ita, Mas Abid, Mas Erfan dan keponakan-keponakanku tersayang. Terima kasih atas doa, dorongan, motivasi, dukungan, perhatian, dan kasih sayang yang telah diberikan. Kalian semua adalah anugerah terindah dalam hidup ini.
7. Anak-anak Wisma SAS dan kontrakan Bengkel Sepeda, Penghuni Wisma Melati, khususnya Tina, Reni, Titis, dan Rias. Terima kasih banyak untuk semuanya yang telah menjadi keluarga sekaligus sahabat dan selalu memberikan semangat kepada Penulis. Sungguh bahagia bisa bersama dalam suka dan duka selama ini.
8. Sahabat-sahabatku ITP 43, yang banyak menginspirasi penulis, yang tidak dapat disebutkan satu persatu, namun tidak mengurangi rasa terima kasih yang sedalam-dalamnya. Sangat bangga dan bersyukur pernah mengenal orang-orang hebat seperti kalian.
9. Pegawai-pegawai di Departemen, UPT, PITP, Perpus PAU, dan LSI. 10. Keluarga besar ITP 41, 42, 44, dan 45.
11. Dan semua pihak yang sudah membantu dalam menyelesaikan tugas akhir ini. Penulis menyadari bahwa laporan ini masih memiliki banyak kekurangan. Oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun dari pembaca. Akhir kata, semoga laporan tugas akhir ini dapat memberi manfaat bagi semua yang menggunakannya.
Bogor, Oktober 2010 Penulis
iii DAFTAR ISI
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN PENELITIAN ... 3
II. TINJAUAN PUSTAKA ... 4
A. ENZIM α-AMILASE ... 4
1. Keluarga α-Amilase ... 5
2. Mekanisme Katalitik α-Amilase ... 9
3. Sumber α-Amilase ... 11
4. Karakteristik Biokimiawi α-Amilase Mikrobial ... 12
5. Aplikasi α-Amilase dalam Industri... 13
6. Kestabilan α-Amilase ... 16
B. Aspergillus niger ... 16
C. PCR ... 19
D. RT-PCR ... 23
E. PENGKLONAN GEN α-AMILASE ... 26
F. VEKTOR ... 29
G. TRANSFORMASI SEL INANG ... 32
H. ELEKTROFORESIS GEL AGAROSA ... 34
I. BIOINFORMATIKA ... 36
J. PENGKLONAN GATEWAY ... 37
III. METODE PENELITIAN ... 40
A. BAHAN DAN ALAT... 40
B. METODE PENELITIAN ... 40
1. Amplifikasi Gen Penyandi α-Amilase ... 40
2. Ekstraksi dan Purifikasi DNA Hasil Amplifikasi ... 42
iv
4. PCR Koloni ... 44
5. Isolasi DNA Plasmid ... 44
6. Kloning dengan Metode Gateway ... 45
a. PCR dengan DNA Plasmid... 45
b. Purifikasi DNA Hasil Amplifikasi ... 46
c. BP Reaction ... 46
d. LR Reaction ... 47
IV. HASIL DAN PEMBAHASAN ... 49
A. AMPLIFIKASI GEN amyA ... 49
1. Sintesis cDNA ... 49
2. Amplifikasi DNA dengan Teknik PCR ... 51
B. PENGKLONAN FRAGMEN DNA DENGAN pGEM-T Easy ... 55
1. Ligasi ... 55
2. Transformasi ... 55
3. Seleksi Transforman ... 56
4. PCR Koloni ... 57
5. Isolasi DNA Plasmid ... 59
C. ANALISIS SEKUEN GEN ... 61
D. EKSPRESI GEN PENYANDI α-AMILASE DENGAN KLONING GATEWAY ... 63
1. Proses Amplifikasi Gen amyA dengan Primer Gateway ... 63
2. Purifikasi DNA Penyandi α-Amilase dari Gel Agarosa ... 65
3. BP Reaksi ... 66
4. LR Reaksi ... 68
V. KESIMPULAN DAN SARAN ... 71
A. KESIMPULAN ... 71
B. SARAN ... 71
DAFTAR PUSTAKA ... 72
v DAFTAR TABEL
Halaman Tabel 1. Enzim-Enzim yang Termasuk dalam Klan GH-H Keluarga
α-Amilase ... 8 Tabel 2. Empat Daerah Lestari pada β-Sheet dalam Urutan Asam
Amino dari Enzim-Enzim Keluarga α-Amilase ... 9
Tabel 3. Karakteristik Pasangan Primer Spesifik Gen Penyandi
Enzim α-Amilase A. niger ... 41 Tabel 4. Karakteristik Pasangan Primer A. niger ... 51 Tabel 5. Analisis BLAST Sekuen Fragmen DNA A. niger ... 62
vi DAFTAR GAMBAR
Halaman
Gambar 1. Struktur Tiga Dimensi α-Amilase ... 6
Gambar 2. Struktur dan Topologi TIM barrel ... 7
Gambar 3. Mekanisme α-Retaining Double Displacement ... 10
Gambar 4. Skema Susunan Subsite dengan Penempatan Oligosakarida pada Subsite -5 sampai 3 ... 11
Gambar 5. Aspergillus sp. ... 18
Gambar 6. Polymerase Chain Reaction ... 21
Gambar 7 Tahapan Proses RT-PCR ... 25
Gambar 8. Tahapan Kloning Gen ... 27
Gambar 9. Peta Restriksi Vektor pGEM-T Easy ... 31
Gambar 10. Peta Restriksi Vektor pDONR 221 ... 31
Gambar 11. Peta Restriksi Vektor pDEST 24 ... 32
Gambar 12. Reaksi BP dan LR Gateway ... 38
Gambar 13. Mekanisme Sintesis cDNA Menggunakan Primer oligo dT ... 50
Gambar 14. Hasil Amplifikasi Gen Penyandi α-Amilase A. niger dengan RT-PCR... 53
Gambar 15. Pure Link Quick Gel Extraction Kit ... 54
Gambar 16. Hasil Purifikasi DNA Hasil Amplifikasi Gen Penyandi α-Amilase ... 54
Gambar 17. Hasil PCR Koloni E. coli yang diduga Mengandung Plasmid Rekombinan ... 59
Gambar 18. High Pure Plasmid Isolation Kit ... 60
Gambar 19. Profil Elektroforesis Pengujian DNA Plasmid ... 61
Gambar 20. Hasil Amplifikasi Gen Penyandi α-Amilase dengan Primer Gateway ... 65
Gambar 21. Profil Elektroforesis Hasil Purifikasi Gen Penyandi α-Amilase 65 Gambar 22. Hasil PCR Koloni E. coli yang diinsersi Plasmid Rekombinan ... 67
Gambar 23. Profil Elektroforesis DNA Plasmid pDONR 221... 68
Gambar 24. Hasil PCR Koloni E. coli yang disisipkan Gen Penyandi α-Amilase melalui Vektor pDEST 24 ... 70
vii DAFTAR LAMPIRAN
Halaman Lampiran 1. Hasil BLAST Gen Penyandi α-Amilase Aspergillus niger ... 78
1
I.
PENDAHULUAN
A. LATAR BELAKANG
Enzim dihasilkan oleh semua makhluk hidup untuk mengkatalis reaksi biokimia dalam tubuh makhluk hidup tersebut sehingga reaksi-reaksi itu dapat berlangsung lebih cepat. Enzim memegang peranan penting dalam dunia industri seperti industri tekstil, detergen, bahan pangan dan minuman, bahan kimia, obat-obatan dan industri kulit (Muchtadi et al., 1992).
Enzim α-amilase adalah salah satu enzim hidrolitik yang paling penting dalam industri berbasis pati dan komersialisasinya merupakan yang tertua. Pada tahun 1984, α-amilase dari Aspergillus oryzae diproduksi dan dipasarkan secara komersial (dikenal dengan Taka diastase) untuk membantu penanganan kelainan pencernaan. Kini α-amilase diaplikasikan dalam berbagai industri seperti makanan, deterjen, tekstil, dan kertas untuk menghidrolisis pati (Sivaramakrishnan et al., 2006).
Enzim α-amilase secara umum dihasilkan oleh hewan, tanaman, dan mikroba. Namun, enzim α-amilase yang berasal dari kapang dan bakteri mendominasi aplikasi dalam sektor industri. Keuntungan utama dalam produksi α-amilase menggunakan mikroba adalah kapasitas produksinya yang besar dengan biaya murah dan mikroba dapat dimanipulasi untuk memperoleh enzim dengan karakteristik yang diinginkan. Selain itu, enzim yang berasal dari mikroba lebih stabil dibandingkan enzim yang diperoleh dari hewan atau tanaman (Gupta et al., 2003).
Produksi enzim α-amilase didominasi oleh bakteri dari genus
Bacillus sp., diantaranya B. subtilis, B. licheniformis, dan B.
amyloliquefaciens. Selain itu, kapang dari genus Aspergillus sp., seperti Aspergillus niger dan Aspergillus oryzae juga banyak digunakan untuk produksi enzim α-amilase secara komersial (Sivaramakrishnan et al., 2006). Beberapa jenis enzim α-amilase yang telah diproduksi oleh Aspergillus sp. secara komersial diantaranya Multifresh yang diproduksi oleh Enzyme Bio-Systems Ltd. (USA), Alfamart VT produksi Jerman, Amylase P (Belanda), Biobake (Belanda), Biodiastase (Jepang), MKC-Fungal Amylase (Jerman),
2 Mycolase (Belanda), Rohalase M (Jerman), Sanactase (Jepang), Sanzyme (Jepang), dan Veron A, AV, AC produksi Jerman (Uhlig, 1998).
Penelitian α-amilase dari kapang di negara berkembang terutama dilakukan pada Rhizopus sp. dan A. niger karena mudah tumbuh dan nutrisi pertumbuhannya mudah diperoleh dari lingkungan. Kelompok Aspergillus niger berbagai strain mampu memproduksi amilase. Spora Aspergillus niger berwarna coklat atau coklat kehitaman, tebal, dan dihasilkan dalam jumlah banyak. A. niger dapat tumbuh pada kondisi aerobik dan pada konsentrasi ion hidrogen yang tinggi. Suhu optimum pertumbuhannya antara 25 sampai 35
o
C. A. niger mampu meggunakan substrat kompleks hingga sederhana
sehingga enzim amilase dapat dengan mudah ditumbuhkan dan dimanfaatkan untuk kepentingan laboratorium (Shafique et al., 2009).
Kebutuhan α-amilase di dunia sangat tinggi, pada tahun 2004 saja mencapai penjualan sekitar US$ 2 milyar dan diperkirakan akan terjadi peningkatan jumlah per tahun dengan laju 3,3%. Pemanfaatan untuk sektor makanan dan minuman adalah sekitar 90% dari karbohidrase yang dihasilkan. Penjualan tahunan enzim α-amilase diperkirakan mencapai US$ 11 juta. Produksi amilase oleh Bacillus licheniformis dan Aspergillus sp. sekitar 300 ton enzim murni pertahun (Sivaramakrishnan et al., 2006).
Saat ini, industri di Indonesia yang memanfaatkan enzim terutama α-amilase, masih bergantung pada enzim produksi luar negeri. Padahal kebutuhan enzim α-amilase pada industri yang berbasiskan proses konversi pati menjadi glukosa dalam negeri terus meningkat. Biaya untuk mengimpor enzim produksi luar negeri sangat tinggi sehingga biaya produksi juga akan lebih mahal. Berdasarkan data Badan Pusat Statistik (BPS), impor enzim di Indonesia mencapai US$ 12,5 juta pada tahun 2005, meningkat menjadi US$ 16,7 juta di tahun 2006, selanjutnya pada tahun 2007 mencapai US$ 19 juta. Pada tahun 2008 dan 2009 mencapai US$ 20,2 juta dan US$ 20,3 juta.
Impor enzim yang sangat mahal berdampak pada naiknya harga produk-produk hasil olahan pati. Indonesia merupakan negara yang memiliki kekayaan alam yang tinggi, termasuk keanekaragaman mikroorganisme. Beberapa jenis mikroorganisme dapat dimanfaatkan untuk produksi α-amilase
3 (Naiola, 2002). Oleh karena itu, diperlukan penelitian untuk mengembangkan α-amilase dalam negeri khususnya yang berasal dari mikroba galur lokal.
Saat ini enzim α-amilase yang banyak diteliti dan dihasilkan di Indonesia masih dengan cara konvensional, yaitu fermentasi enzim menggunakan substrat tertentu lalu dilakukan panen enzim yang diekskresikan ke luar sel. Melalui cara konvensional ini, sulit diperoleh enzim yang bersifat stabil, aktivitasnya tinggi, aman dikonsumsi, dan dihasilkan dalam jumlah yang banyak. Padahal, α-amilase yang dimanfaatkan industri harus dapat diproduksi dalam jumlah besar dan aktivitasnya tinggi dengan biaya produksi yang ekonomis. Oleh karena itu, perlu dilakukan penelitian produksi α-amilase melalui teknologi kloning (Knorr, 1987).
Produksi α-amilase dihasilkan melalui kloning gen penyandi alpha amilase dari Aspergillus niger ke E. coli yang telah dibuat kompeten. Proses mengekspresikan gen α-amilase pada E. coli dilakukan dengan metode gateway cloning. Walaupun metode ini tergolong baru dan cukup mahal, tetapi metode kloning ini lebih cepat, sederhana, efektif, dan tidak memerlukan enzim restriksi dan ligase.
B. TUJUAN PENELITIAN
Penelitian ini bertujuan untuk kloning, karakterisasi, dan konstruksi ekspresi gen penyandi enzim α-amilase (amyA) dari Aspergillus niger. Penelitian ini diharapkan nantinya akan menghasilkan enzim α-amilase dari melalui E. coli yang telah ditransformasikan dengan konstruk gen penyandi enzim α-amilase sehingga enzim α-amilase dapat diproduksi di Indonesia dengan harga yang lebih murah karena proses rekayasa genetik dapat dikendalikan sesuai kebutuhan kita.
4
II.
TINJAUAN PUSTAKA
A. ENZIM α-AMILASE
Pada dasarnya terdapat empat kelompok enzim pengkonversi pati, yaitu endoamilase, eksoamilase, debranching enzymes dan transferase. Endoamilase merupakan jenis enzim yang menghidrolisis ikatan α-1,4 glikosidik pada bagian dalam (endo) dari rantai amilosa atau amilopektin sehingga menghasilkan oligosakarida berkonfigurasi α dengan panjang yang bervariasi. Eksoamilase menghidrolisis ikatan α-1,4 atau α-1,6 glikosidik dari residu glukosa eksternal amilosa atau amilopektin dan menghasilkan produk berkonfigurasi α atau β. Debranching enzymes hanya menghidrolisis ikatan α-1,6 glikosidik sehingga menghasilkan polisakarida yang lurus dan panjang. Transferase memutus ikatan α-1,4 glikosidik dari molekul donor dan mentransfer bagian dari donor ke sebuah akseptor glikosidik melalui pembentukan ikatan glikosidik yang baru (Van der Maarel et al., 2002).
Enzim α-amilase (α-1,4-D-glukan glukanohidrolase, EC 3.2.1.1, endoamilase) merupakan enzim ekstraseluler yang mampu mengkatalisis hidrolisis ikatan α-1,4 glukosidik pada pati dan glikogen secara acak dari tengah atau bagian dalam molekul, tetapi tidak dapat menghidrolisis ikatan glukosidik α-1,6 pada percabangan amilopektin (Qader et al., 2006). Produk akhir dari enzim ini adalah oligosakarida dengan konfigurasi alfa pada karbon pertama (Shetty, 2006).
Cara kerja enzim α-amilase pada molekul amilosa melalui dua tahap. Pertama, degradasi amilosa menjadi maltosa dan maltosa triosa yang terjadi secara acak. Degradasi ini terjadi sangat cepat diikuti menurunnya viskositas dengan cepat. Kedua, terjadi pembentukan glukosa dan maltosa sebagai hasil akhir dan caranya tidak acak. Tahap kedua ini relatif lebih lambat dibandingkan tahap pertama (Winarno, 1980).
Fogarty (1983) menyatakan bahwa hidrolisa amilopektin oleh α-amilase menghasilkan glukosa, maltosa, dan berbagai jenis α-limit dekstrin, yaitu oligosakarida yang terdiri dari empat atau lebih residu gula yang semuanya mengandung ikatan glikosidik α-1,6. Enzim-enzim α-amilase yang
5 berlainan akan menghasilkan α-limit dekstrin yang berbeda. Selain α-limit dekstrin bercabang tunggal, ada kemungkinan bahwa enzim tersebut akan menghasilkan α-limit dekstrin bercabang banyak.
Terdapat dua jenis enzim α-amilase yaitu saccharifying α-amilase dan liquefying α-amilase. Enzim α-amilase likuifaksi mampu memutuskan ikatan α-1,4 glikosidik secara acak menghasilkan dekstrin serta sebagian kecil maltosa dan glukosa. Penguraian molekul pati menjadi molekul-molekul kecil inilah yang menyebabkan penurunan viskositas larutan hasil gelatinisasi (Stephanie, 2002). Enzim α-amilase sakarifikasi mampu memproduksi gula pereduksi (glukosa) hasil hidrolisis dalam jumlah dua kali lebih banyak dari α-amilase likuifaksi. Enzim α-amilase fungi umumnya merupakan α-amilase sakarifikasi sedangkan α-amilase bakteri umumnya adalah α-amilase likuifaksi (Gunawan, 2001).
1. Keluarga α-Amilase
Berdasarkan homologi urutan asam aminonya, hampir semua enzim yang mengubah pati tergolong dalam satu keluarga, yaitu keluarga α-amilase atau keluarga 13 glikosil hidrolase (GH 13) (Henrissat, 1991). Keluarga GH 13 dapat diklasifikasikan lebih lanjut ke dalam unit yang lebih besar yang disebut klan. Sebuah klan terdiri dari dua keluarga atau lebih yang memiliki struktur tiga dimensi domain katalitik yang sama. Namun, tingkat kemiripan urutan asam amino antara satu keluarga dengan yang lain di dalam suatu klan sangat rendah. Saat ini empat belas klan (GH-A sampai GH-N) telah didefinisikan untuk glikosidase dan transglikosidase, dan enzim-enzim dari keluarga-keluarga α-amilase, yakni 13, 70, dan 77 yang termasuk dalam klan GH-H. Keluarga GH 13 merupakan keluarga GH yang paling kompleks dibandingkan GH 70 dan GH 77 karena cakupan GH 13 cukup luas meliputi hidrolase, transferase, dan isomerase dengan hampir 30 spesifisitas enzim dan lebih dari 2000 sekuen (Machovic dan Janecek, 2007).
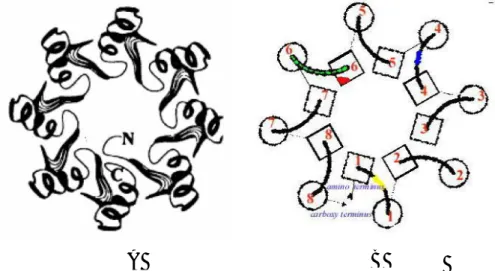
6 Gambar 1. Struktur tiga dimensi α-amilase (Rosahdi, 2008)
Enzim α-amilase merupakan enzim multidomain yang terdiri dari tiga domain utama, yaitu domain A, B, dan C. Struktur tiga dimensi enzim α-amilase ditunjukkan pada Gambar 1. Domain A adalah N-terminal dari struktur TIM barrel, domain B terdiri dari loop panjang yang menonjol di antara β-strand 3 dan α-heliks 3 dan domain C dengan struktur β-sheet berhubungan dengan domain A. (β/α)8 Barrel terdiri dari delapan β-strand
yang dikelilingi oleh delapan α-heliks seperti yang ditunjukkan Gambar 2. TIM barrel terdiri dari empat daerah lestari yang berhubungan dekat dengan sisi aktif yang terdapat pada semua enzim α-amilase. Menurut Sivaramakrishnan et al. (2006), empat daerah lestari tersebut adalah sebagai berikut.
a. Ujung C-terminal β-strand 3 dan residu histidin yang berinteraksi dengan residu glukosa pada substrat.
b. β-strand 4 dengan residu aspartat yang beraksi sebagai nukleofil selama katalisis.
c. β-strand 5 dengan residu asam glutamat yang beraksi sebagai donor atau akseptor proton.
7 d. β-strand 7 dengan residu histidin dan residu aspartat yang bisa membentuk ikatan hidrogen dengan residu glukosa pada substrat.
Gambar 2. Struktur (A) dan topologi (B) (β/α)8 atau TIM barrel
= α-heliks, = β-strand (Rosahdi, 2008)
Konsep pengelompokkan enzim α-amilase diusulkan pada tahun 1992. Enzim-enzim yang termasuk dalam keluarga α-amilase dapat dilihat pada Tabel 1. Menurut Sivaramakrishnan et al. (2006), anggota keluarga α-amilase memiliki ciri-ciri sebagai berikut.
a. Harus beraksi pada rantai α-glukosidik dan menghidrolisisnya untuk menghasilkan monosakarida anomerik dan oligosakarida atau membentuk rantai α-glukosidik melalui transglikosilasi.
b. Mempunyai empat daerah lestari dalam struktur primernya yang terdiri dari sisi katalitik dan bagian pengikat substrat yang penting. Keluarga α-amilase yang mempunyai empat daerah lestari ditunjukkan pada Tabel 2.
c. Mempunyai residu Asp, Glu, Asp sebagai sisi katalitik berdasarkan Asp206, Glu230, dan Asp297 pada Taka amilase A.
d. Mempunyai domain katalitik (β/α)8 atau TIM barrel.
8 Tabel 1. Enzim-enzim yang termasuk dalam klan Glikosil Hidrolase H (GH-H)
keluarga α-amilase (Machovic dan Janecek, 2007)
Kelas Enzim Enzim EC Keluarga GH
Hidrolase α-amilase 3.2.1.1 13 Oligo-1,6-glukosidase 3.2.1.10 13 α-glukosidase 3.2.1.20 13 Pululanase 3.2.1.41 13 Amilopululanase 3.2.1.1/41 13 Siklomaltodekstrinase 3.2.1.54 13 Maltotetraohidrolase 3.2.1.60 13 Isoamilase 3.2.1.68 13 Dekstranglukosidase 3.2.1.70 13 Trehalosa-6-fosfat hidrolase 3.2.1.93 13 Maltoheksaohidrolase 3.2.1.98 13 Maltotriohidrolase 3.2.1.116 13 Maltogenik α-amilase 3.2.1.133 13 Maltogenik amylase 3.2.1.133 13 Neopululanase 3.2.1.135 13 Maltooligosiltrehalosa hidrolase 3.2.1.141 13 Maltopentaohidrolase 3.2.1.- 13 Transferase Amilosukrase 2.4.1.4 13 Glukosiltransferase 2.4.1.5 70 Sukrosa fosforilase 2.4.1.7 13
Enzim branching glukan 2.4.1.18 13
Siklodekstrin glukanotransferase 2.4.1.19 13
4-α-glukanotransferase 2.4.1.25 13,77
Enzim debranching glukan 2.4.1.25/3.2.1.33 13
Alternansukrase 2.4.1.140 70
Maltosiltransferase 2.4.1.- 13
Isomerase Isomaltulosa sintase 5.4.99.11 13
Trehalosa sintase 5.4.99.15 13
9 Tabel 2. Empat daerah lestari pada β-sheet dalam urutan asam amino dari
enzim-enzim keluarga α-amilase (Kuriki dan Imanaka, 1999)
Bagian yang diberi warna adalah residu asam amino katalitik yang lestari (Van der Maarel et al., 2002).
2. Mekanisme Katalitik α-Amilase
Mekanisme katalitik dari keluarga α-amilase adalah α-retaining double displacement seperti diusulkan oleh Koshland (1953). Dalam mekanisme ini hanya dua dari tiga residu lestari yang terlibat secara langsung, yaitu aspartat pada ujung terminal C dari β-sheet 4 yang berperan sebagai nukleofil dan asam glutamat pada ujung β-sheet 5 yang berperan sebagai asam atau basa. Residu lestari yang ketiga adalah aspartat yang terletak pada ujung terminal C dari β-sheet 7. Residu ini berperan
Enzim Sumber β2 β4 β5 β7
α-Amilase Aspergillus oryzae 117DVVANH 202GLRIDTVKH 230EVLD 292FVENHD
CGTase Bacillus macerans 135DFAPNH 225GIRFDAVKH 258EWFL 324FIDNHD
Pululanase Klebsiella aerogenes 600DVVYNH 671GFRFDLMGY 704EGWD 827YVSKHD
Isomilase Pseudomonas
amyloderamosa
292DVVYNH 371GFRFDLASV 435EPWA 505FIDVHD
Enzim branching Escherichia coli 335DWVPGH 401ALRVDAVAS 458EEST 521LPLSHD
Neopululanase Bacillus
stearothermophilus
242DAVFNH 324GWRLDVANE 357EIWH 419LLGSHD
α -Amilase-pululanase Clostridium thermohydrosulfulcum 488DGVFNH 594GWRLDVANE 627ENWN 600LLGSHD α- Glukosidase Saccharomyces carlsbergenesis
106DLVINH 210GFRIDTAGL 276EVAH 344YIENHD
Siklodekstrinase Thermoanaerobacter ethanolicus
238DAVFNH 321GWRLDVANE 354EVWH 416LIGSHD
Oligo-1,6-glukosidase
Bacillus cereus 98DLVVNH 195GFRMDVINF 255EMPG 324YWNNHD
Dekstran glukosidase
Streptococcus mutans 98DLVVNH 190GFRMDVIDM 236ETWG 308FWNNHD
Amilomaltase Streptococcus pneumonia
224DMWAND 291IVRIDHFRG 332EELG 391YTGTHD
Enzim
debranching
glikogen
10 penting dalam pembentukan interaksi hidrogen dengan residu glukosa dari substrat dan pendistorsian substrat (Uitdehaag et al., 1999). Mekanisme katalitik oleh enzim α-amilase ditunjukkan oleh Gambar 3.
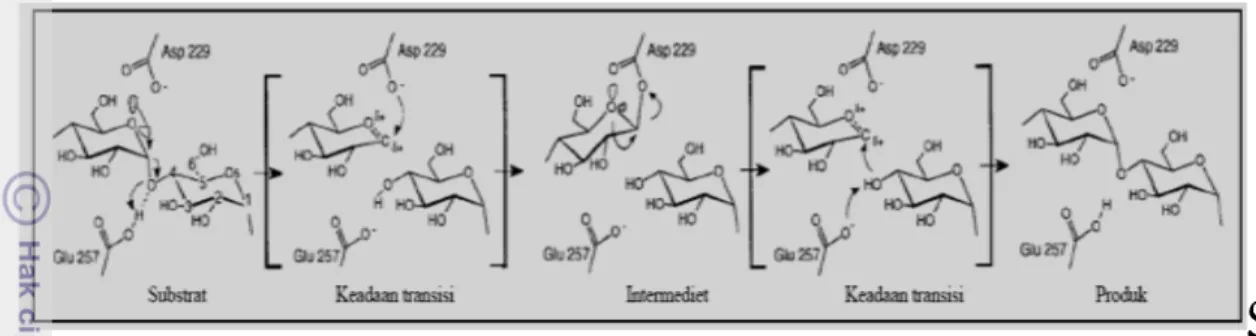
Gambar 3. Mekanisme α-retaining double displacement (Uitdehaag et al., 1999)
Mekanisme α-retaining double displacement berlangsung dalam lima tahap. Pertama, substrat terikat oleh sisi aktif enzim lalu asam glutamat dalam bentuk asam mendonorkan sebuah proton pada oksigen ikatan glikosidik, yaitu oksigen di antara dua molekul glukosa pada subsite -1 dan +1. Pada saat yang sama, satu residu aspartat yang tidak membentuk ikatan hidrogen dengan substrat melakukan serangan secara nukleofilik terhadap C1 pada glukosa pada subsite -1. Kedua, ion oksokarbonium pada keadaan transisi selanjutnya terbentuk melalui pembentukan intermediet kovalen. Ketiga, molekul glukosa diprotonasi pada subsite +1 meninggalkan sisi aktif sementara molekul air atau molekul glukosa baru bergerak ke arah sisi aktif dan menyerang ikatan kovalen di antara molekul glukosa pada subsite -1 dan aspartat. Tahap ke empat yaitu pembentukan kembali ion oksokarbonium pada keadaan transisi. Kelima, oksigen katalis basa glutamat melakukan penyerangan terhadap air yang masuk atau glukosa yang baru pada subsite +1 sehingga glutamat akan kembali asam. Kemudian, oksigen pada air atau molekul glukosa yang masuk pada subsite +1 menempati ikatan oksokarbonium di antara molekul glukosa pada subsite -1 dan aspartat membentuk gugus hidroksil baru pada posisi C1 glukosa pada subsite -1 (hidrolisis) atau ikatan glikosidik baru di antara glukosa pada subsite -1 dan +1 (transglikosilasi) (Van der Maarel et al., 2002).
11 Sisi aktif enzim pada keluarga α-amilase dapat diumpamakan dengan sejumlah subsite. Setiap subsite dapat berinteraksi dengan satu residu glukosa pada substrat. Masing-masing subsite terdiri dari rantai samping residu asam amino yang terletak pada loop dalam struktur enzim yang menghubungkan ujung C-terminal β-strand dengan ujung N-terminal heliks yang berdekatan pada domain katalitik (β/α)8-barrel. Skema subsite
ini dapat dilihat pada Gambar 4.
Gambar 4. Skema susunan subsite dengan penempatan oligosakarida pada subsite -5 sampai 3. Pemutusan terjadi antara subsite -1 dan +1, yang ditandai oleh tanda panah. Ujung pereduksi terikat pada subsite +3 (Rosahdi, 2008)
3. Sumber α-Amilase
Enzim α-amilase dihasilkan oleh hewan, tanaman, dan mikroorganisme. Namun, produksi enzim α-amilase paling banyak dihasilkan dari kapang dan bakteri (Qader et al., 2006). Selain kemudahan dalam manipulasi mikroba terutama fungi dan bakteri untuk mendapatkan enzim dengan karakteristik yang diinginkan, keuntungan dari penggunaan sumber mikroba untuk produksi skala industri adalah efisiensi biaya, konsistensi produk, efektivitas waktu dan ruang, dan kemudahan optimasi dan modifikasi proses produksi (Sivaramakhrisnan et al., 2006).
Kapang penghasil α-amilase antara lain Aspergillus niger, A. oryzae, A. flavus, A.fumigatus, A. awamori, A. foetidus, A. usamii,
Cryptococcus S-2, Paecilomyces sp., Thermomyces lanuginosus,
Trichoderma viride, Thermomyces lanuginosus. Sedangkan bakteri
12
Bacillus coagulans, B. stearothermophilus, B. subtilis, B.
amyloliquefaciens, B. licheniformis, B. circulans, B. coagulans, B. cereus, B. thermoamyloliquefaciens, B. brevis, B megaterium, B. acidocaldarius,
Streptococcus bovis JBI, Micromonospora melanosporea,
Thermomonospora curvata, dan Pyrococcus furiosus (Satyanarayana et al., 2006).
4. Karakteristik Biokimiawi α-Amilase Mikrobial
Karakteristik biokimiawi α-amilase dari berbagai sumber mikroba telah dipelajari secara ekstensif. Beberapa karakteristik biokimiawi dari α-amilase mikrobial adalah sebagai berikut.
a. Spesifisitas substrat
Spesifisitas enzim α-amilase terhadap substrat pada tiap mikroorganisme berbeda-beda, tetapi pada umumnya α-amilase mempunyai spesifisitas tinggi terhadap amilosa, amilopektin, siklodekstrin, glikogen, dan maltotriosa (Satyanarayana et al., 2006). Menurut Gupta (2003), urutan spesifisitas substrat α-amilase dari yang tertinggi adalah pati, amilosa, amilopektin, siklodekstrin, glikogen, dan maltotriosa.
b. pH optimum
pH optimum produksi α-amilase bervariasi antara 2 sampai 12. Produksi optimum α-amilase dari kapang dan bakteri terjadi pada pH asam hingga netral. Enzim α-amilase dari Aspergillus niger dihasilkan pada pH optimum 5. Alicyclobacillus acidocaldarius menghasilkan α-amilase pada pH optimum asam, yaitu pada pH 3, sedangkan α-amilase dari Bacillus sp. dihasilkan pada pH basa yaitu antara pH 9 hingga pH 10,5 (Satyanarayana et al., 2006).
c. Suhu optimum
Suhu optimum untuk aktivitas α-amilase tergantung pada suhu optimum pertumbuhan mikroorganisme. Suhu
13 optimum Aspergillus niger untuk menghasilkan enzim α-amilase adalah 50 oC. Fusarium oxysporum mempunyai suhu optimum paling rendah, yaitu 20-30 oC. Archaebacteria, Pyrococcus furiosus dan P. woesei memiliki suhu optimum paling tinggi, yaitu 100-130 oC. Stabilitas enzim α-amilase pada suhu tinggi memerlukan ion kalsium untuk menjaga konformasi enzim. Oleh karena itu, α-amilase merupakan calcium metalloenzyme dependent (Sianturi, 2008). Selain itu, stabilitas α-amilase juga dipengaruhi oleh substrat dan stabilizer lain. Malhotra et al. (2000) melaporkan bahwa α-amilase yang dihasilkan oleh Geobacillus thermoleovorans dapat stabil selama tiga jam pada suhu 100 oC (Satyanarayana et al., 2006).
d. Massa molekul
Berat molekul α-amilase bervariasi. Berat molekul terendah α-amilase dihasilkan oleh Bacillus caldolyticus, yaitu 10 kDa sedangkan bobot molekul tertinggi pada B. thermoamyloliquefaciens, yaitu 78 kDa. Berat molekul α-amilase antara 50 sampai 60 kDa digunakan untuk analisis gen α-amilase yang dikloning (Satyanarayana et al., 2006).
5. Aplikasi α-Amilase dalam Industri
Enzim α-amilase merupakan enzim pertama yang diproduksi secara komersial dan dipasarkan. Pasar global untuk enzim adalah sekitar $2 miliar pada tahun 2004 dan diperkirakan akan terjadi peningkatan jumlah per tahun dengan laju 3,3% (Sivaramakhrisnan et al., 2006). Pemanfaatan α-amilase untuk sektor makanan dan minuman adalah sekitar 90% dari karbohidrase yang dihasilkan. Penjualan tahunan α-amilase di pasar global sekitar $11 juta (Kilara et al., 2002). Produksi α-amilase dunia dari Bacillus licheniformis dan Aspergillus sp. sekitar 300 ton enzim murni per tahun (Lee, 1996). Berbagai aplikasi α-amilase diantaranya sebagai berikut.
14 a. Industri roti dan pengembang sebagai agen antistaling
Enzim ini digunakan untuk meningkatkan volume roti, memberikan warna yang lebih baik, dan tekstur yang lebih lembut. Saat ini berbagai enzim seperti protease, lipase, xilanase, pululanase, selulase, glukosa oksidase, dan lipoksigenase digunakan pada industri roti untuk berbagai tujuan, tetapi tidak satu pun dapat menggantikan peran α-amilase. Penambahan α-amilase dalam tepung tidak hanya meningkatkan laju fermentasi dan mereduksi viskositas adonan, tetapi juga menambah gula dalam adonan yang dapat meningkatkan rasa, warna kulit, dan kualitas roti setelah dipanggang (Van Dam dan Hille, 1992). Selama penyimpanan serat roti menjadi kering dan kaku, kulit roti kehilangan kegaringannya, dan tepung mengeras. Penambahan α-amilase pada adonan roti dapat memperlambat proses staling roti (De Stefanis dan Turner, 1981).
b. Likuifaksi dan sakarifikasi pati
Pasar utama α-amilase adalah untuk produksi hidrolisat pati seperti glukosa dan fruktosa. Pati dikonversi menjadi sirup fruktosa jagung yang digunakan sebagai pemanis pada industri minuman misalnya untuk soft drink. Proses ini memerlukan α-amilase yang sangat termostabil untuk proses likuifaksi pati yang suhunya mencapai 110 oC (Gupta et al., 2003).
c. Desizing tekstil
Proses produksi modern untuk tekstil membutuhkan kekerasan benang selama proses weaving. Benang harus dicegah agar tidak patah sehingga dibutuhkan pelapisan dengan pati. Penggunaan pati didasarkan karena pati lebih murah, jumlahnya banyak, dan mudah dilepaskan kembali
15 dari benang. α-amilase dibutuhkan untuk melepaskan pati dari serat kain tanpa merusaknya (Hendriksen et al., 1999).
d. Industri kertas
Pada produksi kertas α-amilase digunakan untuk menurunkan viskositas pati yang terlalu tinggi sebagai pelapis kertas (Bruinenberg et al., 1996). Lapisan pati meningkatkan kekakuan dan kekuatan kertas sehingga dapat melindungi kertas dari kerusakan mekanik selama proses pembuatannya. Suhu saat proses pelapisan pati ini sekitar 45-60 oC. Viskositas pati alami terlalu tinggi untuk pelapisan ini sehingga perlu ditambahkan α-amilase untuk menghidrolisis sebagian pati.
e. Pembuatan deterjen
Keuntungan penggunaan enzim pada deterjen adalah lebih lembut daripada deterjen bebas enzim, lebih ramah lingkungan, dan menurunkan suhu pencucian. α-amilase telah digunakan pada deterjen bubuk sejak tahun 1975 dan sekarang hampir 90 % deterjen cair mengandung enzim ini. Kebanyakan α-amilase sensitif terhadap oksidan yang umumnya adalah komponen utama deterjen. Kestabilan enzim ini melawan oksidan dapat diperoleh dengan menambahkan enzim lain seperti protease.
f. Analisis medis dan klinikal kimia
Beberapa proses medis dan klinis melibatkan α-amilase, misalnya penggunaan enzim ini sebagai reagen cair stabil untuk sistem klinikal kimia Ciba Corning Express (Becks et al., 1995). Proses deteksi oligosakarida yang melibatkan α-amilase juga telah dikembangkan (Giri et al., 1990). Metode ini dinyatakan lebih efisien daripada tes nitrat-perak. Biosensor dengan transducer electrolyte isolator
semiconductor capacitor (EIS-CAP) untuk proses
16 6. Kestabilan α-Amilase
Kebutuhan enzim untuk industri telah banyak menimbulkan permintaan untuk meningkatkan kestabilan enzim terutama dalam hal temperatur dan pH. Secara umum, α-amilase stabil pada rentang pH 4 - 11 (Nimmagadda dan Sambasiva, 2003). Sedangkan temperatur optimum untuk α-amilase berhubungan dengan pertumbuhan dari mikroorganisme (Vihinen dan Mantsala, 1989). Termostabilitas α-amilase dipengaruhi oleh banyak faktor diantaranya kalsium, substrat dan penstabil lainnya (Nimmagadda dan Sambasiva, 2003).
Ion kalsium dapat mempengaruhi stabilitas amilase. Afinitas α-amilase terhadap ion kalsium lebih tinggi dibandingkan ion lain. Jumlah ikatan dengan kalsium bervariasi antara 1 hingga 10. Kalsium dapat dihilangkan dari enzim dengan cara dialisis menggunakan EDTA. Namun, enzim α-amilase bebas kalsium sangat peka terhadap denaturasi oleh asam, panas, atau urea dan dapat segera terdegradasi oleh protease. Enzim α-amilase yang telah dihilangkan kalsiumnya dapat diaktifkan kembali dengan penambahan kalsium. Inhibitor enzim α-amilase antara lain kation logam berat, kelompok sulfidril, N-bromosuccinimide, p-hydroxy mercuribenzoic acid, BSA, EDTA, dan EGTA (Satyanarayana et al., 2006).
B. Aspergillus niger
Aspergillus niger merupakan kapang berfilamen yang termasuk Ascomycotina. Aspergillus niger dapat tumbuh dengan mudah di alam sehingga dapat diisolasi dengan mudah dari tanah, sisa makanan, dan udara (Baker, 2006). Kapang ini memproduksi mikotoksin yang dapat membahayakan manusia dan hewan pada dosis tertentu. Aspergillus niger dapat menghasilkan aflatoksin yang sering tumbuh pada kacang tanah, kopra, jagung, dan beras. Aspergillus niger jarang menyebabkan penyakit dibandingkan jenis Aspergillus lainnya, tetapi jika sejumlah besar sporanya terhirup maka akan mengakibatkan penyakit paru-paru yang disebut aspergillosis. Aspergillus niger merupakan kapang yang penting secara
17 ekonomi karena memiliki peranan yang besar dalam industri fermentasi, termasuk produksi asam sitrat dan asam glukonat. Aspergillus niger juga cukup potensial untuk menghasilkan enzim khususnya enzim karbohidrase seperti α-amilase, β-amilase, glukoamilase, pektinase, dan selulase (Kamilawati, 2000). Kedudukan A. niger secara taksonomi adalah sebagai berikut. Domain : Eukaryota Kingdom : Fungi Filum : Ascomycota Subfilum : Pezizomycotina Kelas : Eurotiomycetes Order : Eurotiales Famili : Trichocomaceae Genus : Aspergillus Spesies : A. niger
Kapang merupakan fungi multiselular yang memiliki filamen dan pertumbuhannya pada makanan dapat dilihat karena penampakannya yang berserabut seperti kapas (Fardiaz, 1989). Tubuh atau thalus suatu kapang terdiri dari dua bagian yaitu miselium dan spora (Pelczar dan Chan, 1986). Dijelaskan lebih lanjut bahwa thalus tersusun dari filamen yang bercabang disebut hifa. Hifa adalah struktur menyerupai benang yang tersusun dari dinding berbentuk pipa. Dinding ini menyelubungi membran plasma dan sitoplasma hifa. Sitoplasma kapang mengandung organel eukariotik. Kebanyakan hifa dibatasi oleh dinding melintang atau septa. Septa mempunyai pori besar yang cukup untuk dilewati ribosom, mitokondria, dan kadangkala inti sel yang mengalir dari sel ke sel.
Hifa membentuk jaringan yang disebut miselium. Miselium menyusun jalinan-jalinan semu menjadi thalus. Pembentukan miselium (struktur miselia spesifik) merupakan sifat untuk membedakan kelompok-kelompok didalam fungi hingga dapat digunakan dalam identifikasi. Miselium juga berperan dalam proses penyerapan makanan.
18 Ciri-ciri dari Aspergilus niger antara lain memiliki hifa septap, miselia bercabang (terdapat dibawah permukaan merupakan hifa vegetatif, sedangkan yang muncul di atas permukaan umumnya hifa fertil), koloni kompak konidiofora septap atau non septap, muncul dari foot cell (sel miselium yang membengkak dan berdinding tebal), sterigmata atau fialida biasanya sederhana berwarna atau tidak berwarna, konidia membentuk rantai yang berwarna coklat atau hitam. Penampakan A. niger dapat dilihat pada Gambar 5. A. niger dapat tumbuh pada kondisi aerobik dan pada konsentrasi ion hidrogen yang tinggi. Suhu optimum pertumbuhannya antara 25 sampai 35 oC. A. niger mampu menggunakan substrat kompleks hingga sederhana sehingga dapat dengan mudah ditumbuhkan dan dimanfaatkan untuk kepentingan laboratorium (Shafique et al., 2009).
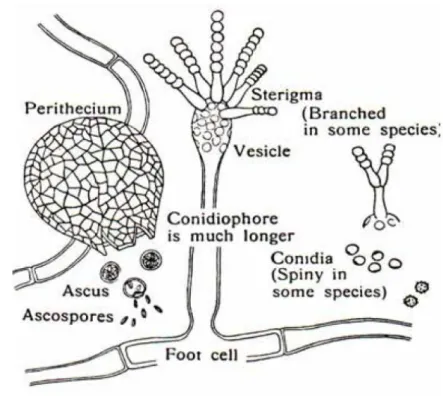
Gambar 5. Aspergillus sp. (Funder, 1961)
Koloni A. niger terdiri atas suatu lapisan basal yang kompak berwarna putih hingga kuning dan suatu lapisan konidiofor yang lebat yang berwarna coklat tua hingga hitam. Kepala konidia berwarna hitam, berbentuk bulat, dan cenderung merekah menjadi kolom-kolom pada koloni berumur
19 tua. Konidia berbentuk bulat hingga semibulat, berwarna coklat, dan memiliki ornamentasi berupa tonjolan dan duri-duri yang tidak beraturan (Omemu et al., 2004).
C. POLYMERASE CHAIN REACTION (PCR)
Polymerase Chain Reaction (PCR) merupakan metode molekuler
untuk penggandaan DNA secara in vitro menggunakan enzim dan sepasang primer yang bersifat spesifik terhadap DNA target. Dengan metode ini, segmen tertentu pada DNA dapat digandakan hingga jutaan kali lipat dalam waktu relatif singkat sehingga memudahkan teknik lain yang menggunakan DNA (Singleton, 2000).
Cara kerja PCR sangat mirip dengan mekanisme replikasi DNA di dalam sel. Pada awalnya, utas ganda DNA dipisahkan satu sama lain. Masing-masing utas tunggal yang terbentuk kemudian digunakan sebagai templat untuk membentuk utas baru. Proses ini diikuti oleh penempelan primer pada masing-masing utas tunggal. Setelah itu, primer dipanjangkan oleh enzim polimerase sehingga terbentuk utas baru DNA. Jumlah DNA utas ganda akan menjadi dua kali lipat setiap siklus PCR. Setelah siklus terjadi berulang-ulang maka akan terbentuk sejumlah fragmen DNA yang merupakan hasil amplifikasi daerah yang dibatasi oleh kedua primer. Oleh karena itu, ukuran produk PCR (amplikon) bergantung pada posisi tempat masing-masing primer menempel (Artika, 2008).
PCR menggandakan segmen khusus pada DNA target atau DNA yang dibatasi oleh kedua primer. Setiap molekul DNA dapat digunakan sebagai target asalkan sekuen DNA pada bagian tepi yang akan diamplifikasi diketahui sehingga dapat dirancang primer yang spesifik menempel pada daerah tersebut (Bartlett dan Stirling, 2003).
Setiap siklus PCR terdiri dari tahap denaturasi, penempelan primer (annealing), dan elongasi atau pemanjangan primer. Tahap denaturasi bertujuan untuk memisahkan utas ganda DNA menjadi utas tunggal dengan menggunakan energi panas. Proses ini umumnya dilakukan pada suhu tinggi yaitu 94-96 oC selama 1-2 menit (kecuali siklus awal PCR yang dilakukan
20 selama 5 menit). Pemisahan ini menyebabkan DNA menjadi tidak stabil dan siap menjadi templat bagi primer (Rapley, 2002).
Tahap penempelan primer (annealing) bertujuan untuk memberikan kondisi optimum bagi proses penempelan primer pada DNA templat. Tahap ini umumnya dilakukan pada suhu 50-65 oC selama 1-2 menit. Primer menempel pada bagian DNA templat yang memiliki urutan basa yang bersifat komplementer dengan urutan basa primer. Penempelan ini bersifat spesifik. Suhu yang tidak tepat dapat menyebabkan primer tidak menempel atau menempel secara tidak spesifik (Artika, 2008).
Tahap pemanjangan atau elongasi berfungsi untuk memberikan kondisi optimum bagi enzim DNA polimerase dalam memanjangkan primer sehingga terbentuk utas DNA yang baru. Tahap ini biasanya berlangsung pada suhu 72 oC selama 2 menit. Suhu untuk proses ini bergantung pada jenis DNA polimerase yang digunakan (Oliver, 2008 ; Rapley, 2002).
Siklus PCR terjadi secara berulang hingga 30-35 siklus (Rapley, 2002). DNA hasil amplifikasi bertambah secara logaritmik seiring bertambahnya siklus PCR karena pada setiap siklus terjadi proses penggandaan DNA. Namun, fase logaritmik hanya berlangsung hingga jumlah siklus tertentu dan setelah itu PCR akan mengalami fase plateau (Nicholl, 2002). Siklus PCR dapat dilihat pada Gambar 6.
21 Gambar 6. Polymerase chain reaction (Brown, 2010)
Pereaksi untuk PCR terdiri dari DNA templat, sepasang primer, DNA polimerase, ion Mg2+, dNTP, dan bufer. DNA templat merupakan DNA yang akan diamplifikasi. DNA ini berfungsi sebagai templat tempat primer menempel untuk membentuk utas baru. DNA templat dapat berupa fragmen
DNA templat
1.Denaturasi DNA templat pada suhu 94 oC
3.Sintesis utas DNA baru pada suhu 74 oC
Siklus berulang 25-30 kali
Primer 2.Annealing pada suhu
22 DNA, DNA genom, plasmid rekombinan, virus atau sampel yang mengandung DNA. Jumlah DNA templat yang dibutuhkan bervariasi bergantung pada kompleksitas sekuennya. Untuk DNA mamalia misalnya diperlukan DNA templat sebanyak 1.0 µg per reaksi (Oliver, 2008)
Primer merupakan oligonukleotida yang umumnya berukuran 20-30 basa yang berfungsi mengawali proses pembentukan utas DNA. Secara alami, DNA polimerase tidak mampu memulai proses pembentukan utas baru DNA, tetapi hanya mampu memanjangkan utas baru yang telah terbentuk. Proses PCR membutuhkan sepasang primer (forward dan reverse) yang masing-masing dirancang untuk menempel secara spesifik pada daerah tertentu pada DNA templat. Kedua primer ini juga berfungsi untuk membatasi daerah DNA yang akan diamplifikasi. Segmen yang diamplifikasi dalam PCR adalah daerah yang berada di antara kedua primer termasuk daerah tempat primer tersebut menempel (Dimmock et al., 2007).
DNA polimerase adalah enzim yang berfungsi mensintesis utas baru DNA dengan cara memanjangkan primer yang sudah menempel pada templat. DNA polimerase yang digunakan bersifat tahan panas karena proses PCR berlangsung pada suhu tinggi. Enzim DNA polimerase sudah diproduksi secara komersial yang bervariasi dalam hal efisiensi, keakuratan, dan kemampuan dalam mensintesis DNA berukuran panjang. DNA polimerase standar yang umumnya digunakan adalah Taq DNA polimerase yang diisolasi dari Thermus aquaticus yang tergolong Archaea termofilik, Thermus flavus (Tfl polymerase), dan Thermus thermophilus (Nicholl, 2002).
Semua enzim DNA polimerase memerlukan kation divalen bebas (umumnya digunakan Mg2+) sebagai kofaktor untuk aktivitasnya. Oleh karena itu, pereaksi PCR mengandung ion magnesium yang dibutuhkan untuk aktivitas DNA polimerase. Konsentrasi molar ion magnesium harus lebih banyak dibandingkan konsentrasi molar gugus fosfat dNTP dan oligonukleotida karena ion magnesium dapat diikat oleh dNTP dan oligonukleotida pada pH 7.0 (Verkuil et al., 2008).
Komponen deoksinukleosida trifosfat (dNTP) yang terdiri dari dATP (deoksiadenosin trifosfat), dTTP (deoksitimidin trifosfat), dCTP
23 (deoksisitosin trifosfat), dan dGTP (deoksiguanosin trifosfat) digunakan untuk menyediakan sumber basa nukleotida yang diperlukan untuk amplifikasi DNA. Larutan stok dNTP sebaiknya memiliki pH netral (7.0) dan keempat jenis basa harus ditambahkan dalam konsentrasi ekuivalen untuk meminimalkan kesalahan penggabungan basa dalam proses sintesis DNA (Verkuil et al., 2008). Dalam reaksi PCR biasanya digunakan dNTP dengan konsentrasi 200-250 µM untuk reaksi yang mengandung 1.5 mM MgCl2
(Artika, 2008). dNTP dalam bentuk campuran dATP, dTTP, dCTP, dan dGTP dalam konsentrasi yang sama sudah banyak dikomersilkan, misalnya dari Roche dan Promega. dNTP komersial ini memiliki kemurnian yang tinggi, yaitu lebih dari 99% dan bebas kontaminasi nukleotida yang termodifikasi dan tetrapirofosfat. Walaupun harga dNTP komersial ini lebih mahal, tetapi dNTP dengan kemurnian tinggi dapat membantu amplifikasi DNA untuk DNA yang jumlahnya sangat rendah (Verkuil et al., 2008).
Bufer berfungsi untuk menjaga kestabilan pH selama proses PCR berlangsung, menjaga kekuatan ionik dan suhu penempelan primer (annealing) pada DNA templat. Bufer yang umum digunakan terdiri dari KCl dengan konsentrasi 50 mM dan Tris-HCl konsentrasi 10 mM. Bufer memiliki pH 8.3 pada suhu 25 oC atau suhu ruang (Kolmodin dan Williams, 1997). Nilai pH akan turun menjadi sekitar 7.2 pada suhu 72 oC (Oliver, 2008).
D. REVERSE TRANSCRIPTASE POLYMERASE CHAIN REACTION
(RT-PCR)
Isolasi gen yang mengkode suatu protein umumnya dilakukan dengan cara mengisolasi mRNA (messenger RNA) hasil transkripsi gen tersebut. mRNA harus diubah menjadi turunan (complementary) DNA (cDNA) karena RNA tidak stabil (Oliver, 2008). Dalam hal ini, fragmen DNA yang mengandung suatu gen tidak diisolasi secara langsung dari genom, tetapi dibuat turunannya dengan menggunakan mRNA (Yuwono, 2009).
Proses perbanyakan cDNA dengan mRNA sebagai cetakan (template) dinamakan Reverse Transcriptase Polymerase Chain Reaction (RT-PCR). Proses ini terdiri dari dua tahap yaitu tahap sintesis cDNA dan
24 tahap amplifikasi DNA. Tahap pertama diawali dengan isolasi mRNA untuk selanjutnya diubah menjadi cDNA utas tunggal (first strand DNA) dengan bantuan enzim transkriptase balik (reverse transcriptase) (Singleton, 2000 ; Primrose dan Twyman, 2006). Tahap ini dikenal dengan sebutan first strand cDNA synthesis atau first strand reaction (Artika, 2008). Pada tahap ini cDNA dibentuk dengan menggunakan RNA sebagai templat. Untuk tujuan ini, diperlukan sebuah primer. Primer yang digunakan umumnya poli (T) oligonukleotida (oligo dT) yang mempunyai 12-18 basa yang tersusun atas basa T. Primer yang bersifat spesifik terhadap gen umumnya oligo dT agar dapat menempel pada mRNA hasil transkripsi gen tertentu karena mRNA mempunyai basa poli (A) di ujung 3’ OH (Oliver, 2008). Tahap sintesis cDNA umumnya dilakukan pada suhu 50 oC selama kurang lebih satu jam (Artika, 2008).
Pada tahap kedua, cDNA diamplifikasi menggunakan teknik PCR. Hasil amplifikasi dapat dideteksi melalui 30-40 siklus tergantung jumlah mRNA hasil transkripsi yang digunakan. Selanjutnya, hasil amplifikasi dideteksi menggunakan elektroforesis gel agarosa. Untuk tujuan ini digunakan sepasang primer yang bersifat sequence spesific atau pasangan primer forward yang bersifat sequence spesific dengan primer reverse berupa oligo dT (Artika, 2008). Tahap RT-PCR ditunjukkan oleh Gambar 7.
25 Gambar 7. Tahapan proses RT-PCR (Hoy, 2003)
RT-PCR dapat digunakan untuk memonitor ekspresi gen pada tingkat ekspresi pada jaringan atau sel tertentu karena gen umumnya diekspresikan melalui mRNA (Mulhardt, 2007). Metode ini memiliki sensitivitas tinggi sehingga dapat digunakan untuk mendeteksi sampel yang spesifik meskipun jumlah RNA yang dianalisis sedikit. Selain itu, metode RT-PCR memiliki ketepatan tinggi dan mudah dilakukan (Wang dan Yang, 2010).
Pereaksi untuk sintesis cDNA terdiri dari molekul mRNA, pemicu reaksi (primer), bufer, dNTP, ditriotreitol (DTT), inhibitor ribonuklease, dan enzim reverse transcriptase. Primer berfungsi untuk mengawali sintesis
26 cDNA. Bufer digunakan untuk mempertahankan pH larutan pereaksi. Penambahan dNTP (dATP, dTTP, dCTP, dan dGTP) digunakan untuk menyediakan sumber basa nukleotida yang diperlukan untuk sintesis cDNA. DTT berperan dalam menstabilkan enzim reverse transcriptase. Inhibitor ribonuklease digunakan untuk menghambat kerja enzim ribonuklease yang dapat menghancurkan sampel RNA (Artika, 2008). Enzim reverse
transcriptase berfungsi mensintesis cDNA dengan menggunakan RNA
sebagai templat. Enzim transkripsi balik biasanya berasal dari virus-virus yang berasal dari burung dan tikus, seperti avian myeloblastosis virus (AMV), Moloney strain of murine leukemia virus (Mo-MLV), Variants of Mo-MLV reverse transcriptase yang menghambat aktivitas RNase H, atau enzim Tth yang diisolasi dari bakteri T. thermophilus. Enzim Tth dapat digunakan untuk transkripsi balik RNA sekaligus untuk polimerisasi DNA sehingga proses transkripsi balik dan PCR dapat dilakukan pada satu tahap (Oliver, 2008).
Pereaksi untuk amplifikasi cDNA memiliki kandungan yang hampir sama dengan komponen pereaksi PCR konvensional, antara lain sepasang primer, DNA polimerase, ion Mg2+, dNTP, dan bufer. Dalam hal ini dilakukan penambahan cDNA hasil sintesis yang berfungsi sebagai DNA templat (Artika, 2008).
E. PENGKLONAN GEN α-AMILASE
Sejak ditemukan enzim endonuklease restriksi pada tahun 1970 yang kemudian dilanjutkan dengan penggunaan enzim ligase DNA pada tahun 1972 yang dapat menyambung potongan-potongan DNA yang dihasilkan kerja endonuklease restriksi, maka kemudian sejak tahun 1973 berkembang teknologi baru dalam pengubahan sifat-sifat genetik suatu jasad yang dikenal dengan teknologi DNA rekombinan atau secara umum disebut dengan rekayasa genetik (genetic engineering) atau kloning DNA (Koswara, 1999). Teknologi ini pada dasarnya adalah teknik untuk menggabungkan molekul-molekul DNA secara in vitro sehingga diperoleh molekul DNA rekombinan sesuai dengan yang diharapkan (Yuwono, 2008).
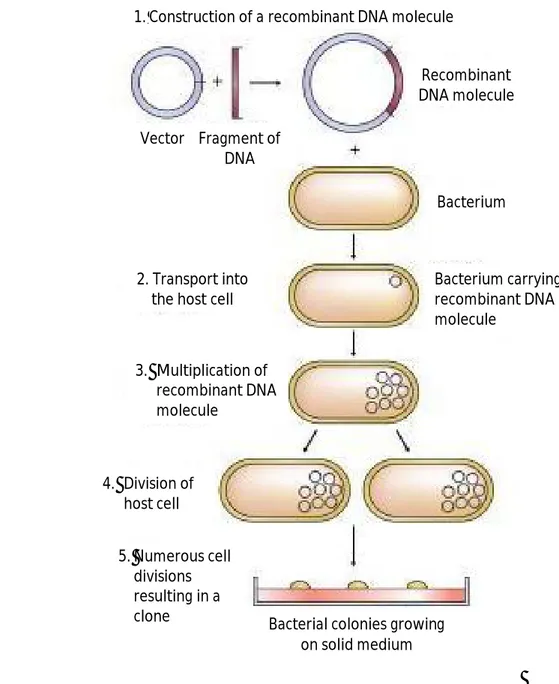
27 Teknik rekombinasi DNA secara in vitro terdiri dari enam tahap. Pertama, isolasi molekul DNA (gen) yang akan digabungkan. Kedua, pemotongan DNA dengan menggunakan enzim endonuklease restriksi. Tahap selanjutnya adalah penyambungan molekul-molekul DNA dengan menggunakan enzim DNA ligase ke dalam suatu molekul DNA vektor. Tahap ke empat adalah transformasi sel inang dengan DNA rekombinasi hasil ligasi. Tahap berikutnya yaitu analisis dan konfirmasi keberadaan DNA rekombinan dalam sel inang dan tahap terakhir adalah karakterisasi fungsional gen yang diklon (Brown, 2010). Tahapan kloning gen dapat dilihat pada Gambar 8.
Gambar 8. Tahapan kloning gen (Brown, 2010) 1.Construction of a recombinant DNA molecule
Vector Fragment of DNA Recombinant DNA molecule Bacterium 3. Multiplication of recombinant DNA molecule 2. Transport into the host cell
Bacterium carrying recombinant DNA molecule
Bacterial colonies growing on solid medium 5.Numerous cell divisions resulting in a clone 4. Division of host cell