Materi Azas Rekayasa Proses Page 1
MATERI
Materi Azas Rekayasa Proses Page 2
BAB I
KONSEP TEKNIK KIMIA
Pengertian Teknik Kimia
¤ Menurut Bahasa atau asal katanya.
Teknik adalah proses atau cara membuat sesuatu, sedangkan Kimia adalah bahan-bahan yang bersifat biologis maupun fisis yang sering digunakan oleh manusia didalam kehidupannya sehari-hari.
Jika di gabung maka teknik kimia menurut bahasa adalah proses/cara membuat sesuatu yang bahan dasanya berupa zat baik bersifat biologis maupun fisis yang sering diketemukan dalam kehidupan sehari-hari.
¤ Menurut Pandangan Umum.
Teknik kimia atau yang biasa disebut Chemical Engineering adalah ilmu teknik atau rekayasa yang mempelajari pemrosesan bahan mentah menjadi barang yang lebih berguna, dapat berupa barang jadi ataupun barang setengah jadi. Ilmu teknik kimia diaplikasikan terutama dalam perancangan dan pemeliharaan proses-proses kimia, baik dalam skala kecil maupun dalam skala besar seperti perusahaan-perusahaan yang berbahan dasar kimia.
Ilmu-ilmu yang menjadi dasar dalam teknik kimia, antara lain adalah: Neraca massa
Neraca energy
Peristiwa perpindahan massa, energi, momentum Reaksi kimia
Termokimia Termodinamika
Materi Azas Rekayasa Proses Page 3
Mekanika fluida
Ilmu tentang material
Selain ilmu dasar dan ilmu pendukung, terdapat pula kemampuan-kemampuan dan pengetahuan-pengetahuan aplikatif yang perlu dikuasai oleh seorang insinyur teknik kimia, antara lain:
Pengendalian proses kimia Instrumentasi
Perancangan proses kimia Penanganan limbah pabrik
Prosedur keselamatan pabrik kimia Evaluasi ekonomi pabrik kimia Manajemen proyek
Ruang lingkup pekerjaan seorang Teknik Kimia : Process Engineer,
Project Engineer,
Plant Operation/production dalam pengoperasian pabrik, Plant Technical Service,
Quality Control,
Research and Development (R&D), Environment Risk Assessor , Environment Safety and Health, Technical Sales,
Customer Technical Sales,
Peneliti dalam bidang penelitian dan pengembangan, Konsultan dalam pembangunan atau operasi pabrik,
Materi Azas Rekayasa Proses Page 4
BAB II
SISTEM SATUAN DAN VARIABEL PROSES
Besaran apapun yang kita ukur seperti panjang, massa atu kecepatan, terdiri dari angka dan satuan. Sering kita diberikan besaran dalam satuan tertentu dan kita ingin menyatakannya dalam satuan lain. Misalnya kita mengetahui jarak dua kota dalam satuan kilometer dan kita ingin mengetahui berapa jaraknya dalam satuan meter, untuk itu kita harus mengkonversi satuan tersebut. Konversi berarti mengubah. Sebelum kita melakukan konversi satuan, kita harus memahami pengertian satuan, dimensi, dan faktor koreksi.
Satuan : sesuatu yang digunakan untuk menyatakan ukuran besaran, contoh : meter, feet, mili (panjang) ; gram, pound, slug (massa).
Dimensi : satuan yang dinyatakan secara umum dalam besaran primer, contoh : massa (M), panjang (L).
Factor konversi : angka tak berdimensi yang merupakan ekivalensi satuan yang bersangkutan.
Satuan :
1. Satuan internasional (SI)
Kelebihan Satuan Internasional (SI) adalah kemudahan dalam pemakaiannya, karena menggunakan sistem decimal (kelipatan 10) dan hanya satu satuan
Sasaran Pengajaran :
• Menjumlahkan, mengurangi, mengalikan dan membagi satuan
• Mengubah satuan-satuan dan fungsi persamaan dalam massa, panjang, gaya,dll • Mendefinisikan dan menggunakan factor konversi Gc
Materi Azas Rekayasa Proses Page 5
pokok untuk setiap besaran dengan penambahan awalan untuk satuan yang lebh besar atau lebih kecil.
2. FPS
Tabel 1. Sistem Unit Satuan
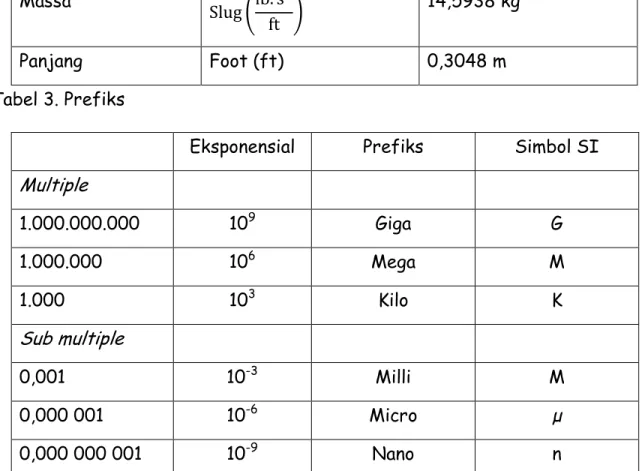
Nama Panjang Waktu Massa Gaya
SI Meter (m) Detik (s) Koligram (kg) Newton (N) FPS Foot (ft) Detik (s) Slug ( ) Pound (lb)
Tabel 2. Faktor Konversi Satuan
Kwantitas FPS SI Gaya Pound (lb) 4,4482 N Massa ( ) 14,5938 kg Panjang Foot (ft) 0,3048 m Tabel 3. Prefiks
Eksponensial Prefiks Simbol SI Multiple 1.000.000.000 109 Giga G 1.000.000 106 Mega M 1.000 103 Kilo K Sub multiple 0,001 10-3 Milli M 0,000 001 10-6 Micro µ 0,000 000 001 10-9 Nano n
Materi Azas Rekayasa Proses Page 6 Contoh : 1. 125 = ……… Penyelesaian : 125 x x = 0,01058 2. 20 mN x 10 MN = ……….. kN2 Penyelesaian : 20 mN x 10 MN = [ ( ) ] x [ ( ) ] = ( ) = ( ) X ( ) = 200 kN2
Dalam kehidupan kita sehari-hari ada 4 sistem satuan yang dikenal, yaitu : Absolute dynamic system : (cgs : cm, gram, sec)
English absolute system : (fps : ft, pound, sec) SI ( System International) : (mks : meter, kg, sec) Gravitational system :
1. British Eng’ng (BE) : ft, sec, slug
2. American Eng’ng (AE) : ft, sec, lbm , lbf
Pada operasi penambahan dan pengurangan dimensi dari bilangan yang dioperasikan
harus sama, sedangkan dalam perkalian dan pembagian tidak ada syarat dalam operasinya.
Permasalahan:
Tentukan hasil dari operasi matematika di bawah ini : 1. 10 kg + 400 meter =
Materi Azas Rekayasa Proses Page 7
2. 200 feet + 21 cm = 3. 500 meter × 2 sekon = 4. 2 joule / 4 meter = Contoh soal :
Selesaikanlah perhitungan dibawah ini : (a) 20 jam + 4 meter =
(b) 2 joule + 50 Btu = Jawaban :
(a) dapat kita lihat bahwa satuan dan dimensi yang digunakan berbeda, 20 jam berdimensi waktu sedangkan 4 meter berdimensi panjang, maka operasi tersebut tidak dapat diselesaikan.
(b) satuan yang digunakan berbeda namun dimensinya sama, keduanya sama-sama dimensi energi, maka operasi dapat dilakukan dengan mengubah satuannya menjadi sama ( konversi ), baik itu dalam joule atau Btu.
karena 1 joule = 9,484.10-4 Btu maka
2 joule + 50 BTU = 2 ( 9,484.10-4 ) Btu + 50 Btu = 50,00189 Btu
Dalam contoh soal diatas kita melihat adanya perubahan satuan dari joule ke Btu hal inilah yang disebut dengan konversi. Konversi sering dilakukan apabila data yang tersedia dinyatakan dalam satuan yang berbeda.
Contoh Soal :
Jika sebuah mobil menepuh jarak Jakarta bandung dengan kecepatan 10m/s dan sebuah bus melaju dengan kecepatan 150% dari kecepatan mobil tersebut, berapakah kecepatan bus tersebut dalam kilometer perjam?
Jawaban :
Materi Azas Rekayasa Proses Page 8
15 meter × 1 kilometer × 3600 sekon = 54 kilometer/jam sekon 1000 meter 1 jam
Soal-Soal Latihan !
1. Ubahlah 3785 m3/jam menjadi gal/min
2. Di suatu tempat dengan percepatan grafitasi 4,5 ft/sec2 seseorang mempunyai
berat 100 lbf . Berapa Lbf kah berat orang itu di bumi??
3. Kapasitas panas spesifik untuk toluene diberikan oleh persamaan berikut : Cp = 20,869 + 5,239.10-2 T dimana Cp dalam Btu/(lbmol)(0F) dan T(0F)
Nyatakan persamaan dalam cal/(gmol)(K) dengan T(K)
BEBERAPA BESARAN PENTING
Pada perhitungan yang menyangkut reaksi kimia sering dijumpai besaran – besaran kuantitatif dengan berbagai treminologi yang mempunyai pengertian khusus. Besaran tersebut antara lain :
a. MOL
Mol adalah hasil bagi massa suatu zat dengan berat molekulnya. b. Densitas (ρ)
Densitas atau kerapatan adalah massa persatuan volum c. Volum spesifik (Vs)
volum spesifik adalah kebalikan dari densitas, yaitu volum persatuan massa d. Spesifik gravity / berat jenis (b.j. atau s.g.)
Berat jenis adalah perbandingan kerapatan zat tsb dengan zat pembanding (standar). Berat jenis tidak mempunyai dimensi. sebagai pembanding biasanya digunakan air dalam suhu 40C. Berat jenis zat cair atau padat tidak bergantung kepada tekanan tetapi bergantung kepada suhu, oleh karena itu dalam menyatakan berat jenis harus disebutkan suhunya.
Materi Azas Rekayasa Proses Page 9
e. Komposisi.
Komposisi merupakan perbandingan antara suatu zat dengan seluruh campuran. Komposisi dapat dinyatakan dalam :
o Fraksi massa atau persen berat.
Fraksi massa A = WA/WTOTAL % berat A = WA/WTOTAL × 100%
o Fraksi volum atau persen volum
Fraksi volum A = VA/VTOTAL % volum A = VA/VTOTAL × 100%
o Fraksi mol atau persen mol
Fraksi mol A = mol A / mol total campuran % mol A = mol A / mol total campuran × 100% f. Konsentrasi.
Merupakan jumlah zat tersebut yang terlarut dalam sejumlah pelarut. Konsentrasi dapat dinyatakan sebagai :
o berat / volum = gram / cm3, gram / liter dll. o mol / volum = mol / liter, lbmol / ft3
o parts per million (ppm)
Dalam gas ppm dinyatakan dalam mol. contoh :
o 100 ppm CO2 dlm udara berarti tdpt 100 mol CO2 dlm 106 mol udara
o 20 ppm besi dlm air berarti tdpt 20 gram besi setiap 106 gram air.
o Molaritas : mol / liter larutan o Molalitas : mol / 1000 gram pelarut o Normalitas : gram ekivalen / liter larutan
Materi Azas Rekayasa Proses Page 10
g. Temperatur ( Suhu ).
Suhu ditetapkan dari titik tripel air, yaitu 00C atau 273,15 K.
Terdapat 4 skala suhu yang biasa dipakai dalam perhitungan, yaitu :
skala suhu nol mutlak ttk beku normal air ttk didih normal air celcius - 273, 15 0C 0 0C 100 0C
Kelvin 0 K 273,15 K 373,15 K Fahrenheit - 459,67 0F 32 0F 212 0F
Renkine 0 0R 492 0R 672 0R
Hubungan antara keempat skala suhu tersebut adalah sbb: TC = 5/9(TF - 32)
TK = TC + 273,15 TR = TF + 459,67 Hubungan selisih suhu :
Δ TC = Δ TK 1,8 Δ TC = Δ TF Δ TF = Δ TR 1,8 Δ TK = Δ TR
h. Tekanan.
Tekanan merupakan gaya persatuan luas yang tegak lurus gaya tersebut. P = gaya / luas = F / A ( Pascal, Psi, Atm, Bar, Torr )
1 atm = 760 mmHg 1 bar = 100 kPa 1 torr = 1 mmHg 1 Psi = 1 lbf / in2
Materi Azas Rekayasa Proses Page 11
Contoh Soal :
1. Hitunglah densitas merkuri dalam lbm/ft3 jika diketahui spesifik grafity
merkuri pada 200C adalah 13,546 dan hitunglah volume dalam ft3 jika
diketahui massa merkuri 215 kg ? Jawab :
a. ρHg = spesifik gravity × massa jenis air pada suhu 200C
= 13,546 × 62,43 lbm/ft3
= 845,7 lbm/ft3
b. V = 215 kg × 1lbm / 0,454 kg × 1 ft3 / 845,7 lbm = 0,56 ft3
2. Hitunglah mol glukosa yag terkandung dalam 10 kg gula jika fraksi berat glukosa dalam gula 16 % !!!!
Jawab :
berat glukosa dalam gula = 16 % × 10 kg = 1,6 kg mol glukosa = berat glukosa / Mr glukosa
= 1600 gram / 160 gram/mol = 10 mol
3.Jika suatu larutan NaOH pada pabrik sabun mengalir dengan laju alir 240 liter per menit, maka berapa mol kah NaOH yang mengalir tiap detiknya jika diketahui konsentrasi NaOH adalah 0,02 M
Jawab :
Jumlah NaOH yang mengalir tiap detik = 240 liter/min × 1 min/60det = 4 liter/det
mol NaOH tiap detik = 4 liter/det × 0,02 mol/liter = 0,08 mol/det
4.Hitunglah perbedaan suhu dalam 0C jika sebuah konduktor mengalami
pemanasan dari 800F menjadi 1400F !
Jawab :
Materi Azas Rekayasa Proses Page 12 cara 1. 800F = 5/9 (80 – 32) = 26,6 0C 1400F = 5/9 (140 – 32) = 59,90C ΔT = 33,3 0C cara 2. 1,8 ΔTc = ΔTf = (120 – 80) / 1,8 = 33,3 0C SOAL LATIHAN :
1. Jika suatu pabrik gula dalam sehari dapat menghasilkan gula sebanyak 100 kg, maka berapa % mol glukosa yang terkandung dalam gula tersebut jika diketahui komposisi gula tersebut adalah 20% berat glukosa dan sisanya adalah air !
diketahui : Mr H2O = 18 dan glukosa = 160
2. Jika suatu alat pemanas air dapat memanaskan air dengan laju pemanasan 100C/menit maka berapakah suhu akhir dalam 0R jika air dengan suhu 293 K
dipanaskan selama 2 jam ?
3. Suatu dongkrak hidrolik mempunyai luas penampang 250 cm2, jika pada pompa
tersebut diberikan gaya sebesar 200 Newton maka berapa Psi kah tekanan yang diterima pompa tersebut ?
4. Suatu campuran hidrokarbon mempunyai komposisi berikut (% berat): n-C4H10 50
n-C5H12 30
n-C6H14 20
Hitunglah: (a) Fraksi mol setiap komponen
(b) Berat molekul rata-rata campuran
5.Suatu larutan mengandung 25% berat garam dalam air. Jika densitas larutan tersebut adalah 1,2 g/cm3. Nyatakan komposisinya dalam:
Materi Azas Rekayasa Proses Page 13
(b) lb garam per ft3 larutan
6. Campuran gas terdiri dari 3 komponen: argon, B dan C. Komposisi campuran adalah sebagai berikut:
40% (mol) argon 18,75% (massa) B 20% (mol) C
Berat molekul argon adalah 40 dan berat molekul C 50. Hitunglah: (a) Berat molekul B
(b) Berat molekul rata-rata campuran
7. Suatu manometer menggunakan kerosene (berat jenis = 0,82) sebagai fluidanya. Jika terbaca beda tinggi manometer 5 in, berapa beda tingginya dalam mm jika digunakan air raksa?
Materi Azas Rekayasa Proses Page 14
BAB III
PERSAMAAN KIMIA dan STOIKHIOMETRI
Persamaan kimia merupakan suatu gambaran atau data yang memuat data kualitatif dan kuantitatif dalam suatu reaksi kimia.
Gambaran kualitatif dapat berupa : o Zat pereaksi (reaktan) o Zat hasil reaksi (produk)
o Efek panas (endoterm/eksoterm) Sedangkan gambaran kuantitatif dapat berupa :
o Komposisi o Hubungan kuantitatif o Jumlah contoh : N2 + 3 H2 → 2 NH3 ΔHf = - 1230 kj kualitatif kuantitatif
reaktan N2 & H2 1 mol N2 bereaksi dengan 3 mol H2 produk NH3 menghasilkan 2 mol NH3
reaksi eksotermis
Suatu pabrik DRY ICE ingin menghasilkan 500 kg/jam dry ice dari proses pembakaran heptana. Jika hanya 50 % CO2 yang dapat diubah menjadi dry
ice maka berapa kg hepatana yang harus dibakar setiap jamnya?
Apakah yang dimaksud dengan basis dan reaktan pembatas? Pada saat bagaimana basis dan reaktan pembatas digunakan?
Materi Azas Rekayasa Proses Page 15
Reaksi kimia adalah perubahan yang terjadi saat satu atau lebih zat terkonversi menjadi zat lain, dinyatakan dengan persamaan reaksi yang menunjukkan hubungan molar antara reaktan dan produk.
Contoh:
Jika kita meniup menggunakan sedotan ke dalam larutan yang mengandung Ca(OH)2,
terjadi reaksi berikut: Ca 2+ + H
2O + CO2 → CaCO3 + 2H +
Persamaan di atas menunjukkan bahwa satu mol Ca2+ membutuhkan satu mol CO 2
untuk bereaksi yang menghasilkan produk satu mol padatan CaCO3 dan 2 mol ion H+.
Jika diketahui larutan mengandung 0,10 gram ion Ca2+, maka jumlah CO
2 yang
dibutuhkan dapat dihitung dengan cara berikut: Ca2+ + H
2O + C2O → CaCO3 + 2H+
0,10 X 1 mol Ca2+ ~ 1 mol CO
2
Jadi CO2 yang dibutuhkan = 0,1 gram x 44 grm/mol = 0,11 grm CO2
40 gr/mol
Jenis-Jenis Reaksi Kimia:
1. Reaksi penggabungan: dua reaktan bergabung membentuk senyawa baru. Contoh: H2 + Cl2 → 2HCl
2. Reaksi pertukaran: dua rekatan saling mempertukarkan ionnya. Contoh: NaCl + AgNO3 → AgCl + NaNO3
3. Reaksi pembakaran: reaksi yang melibatkan oksigen atau udara sebagai reaktan. Contoh: C2H5OH + O2 → 2CO2 + 3H2O
4. Reaksi oksidasi dan reduksi (redoks): reaksi yang mengoksidasi dan atau mereduksi suatu zat. Contoh: reaksi pembakaran.
Materi Azas Rekayasa Proses Page 16
5. Reaksi penggantian: reaksi dimana suatu komponen menggantikan komponen lainnya. Contoh: reaksi redoks berikut:
2Al + Fe2O3 → 2Fe + Al2O3 dimana Al menggantikan Fe di dalam oksida.
Stoikiometri kimia adalah hubungan kuantitatif antara reaktan dan produk, didasarkan pada kenyataan bahwa materi tersusun atas atom dan molekul. Karena atom dari berbagai unsur dan molekul-molekul dari berbagai zat mempunyai berat berbeda, hubungan kuantitas yang digunakan dinyatakan dalam mol.
Stoikhiometri merupakan perhitungan yang berhubungan dengan reaksi kimia dan proporsional dengan koefisien reaksi kimia.
Contoh:
2H2 + O2 → 2H2O
Artinya 2 mol hidrogen bereaksi dengan 1 mol oksigen menghasilkan 2 mol air. Kemampuan yang harus dipelajari dalam stoikiometri:
1. Kemampuan mengubah banyaknya zat dari satuan massa ke dalam mol, atau sebaliknya.
2. Kemampuan untuk mengerti perubahan atau reaksi kimia (mengetahui reaktan dan produk yang dihasilkan, serta .menuliskan persamaan reaksi (balance) Untuk mempermudah perhitungan dalam stoikhiometri kita sering menggunakan basis. Basis adalah acuan yang dipilih sebagai dasar perhitungan.
contoh soal :
Dalam pembakaran pentana ingin dihasilkan 440 kg gas CO2, berapa kg kah pentana
yang harus digunakan untuk reaksi tersebut jika 50% CO2 menyublim menjadi dry
ice? Jawab :
Materi Azas Rekayasa Proses Page 17
berarti CO2 yang harus dihasilkan dalam proses pembakaran :
440 kg / 0,5 = 880 kg
mol CO2 = 880 kg/ 44 gram/mol
= 20 kmol
reaksi yang terjadi (stoikhiometri): C5H12 + 8 O2 → 5 CO2 + 6 H2O
4 kmol 20 kmol
Materi Azas Rekayasa Proses Page 18
BAB IV
REAKSI KIMIA DALAM INDUSTRI
Pada kenyataan di dalam industri meskipun reaktan yang dipakai tepat stoikiometris tetapi reaksi yang terjadi tidak sempurna, yang dimaksud tidak sempurna disini adalah ada reaktan yang tidak terpakai atau bersisa. Karena ketidaksempurnaan inilah maka ada beberapa pengertian yang berhubungan dengan reaksi:
1. Reaktan pembatas (limitting reactant):
Reaktan yang perbandingan stoikiometriknya paling kecil/ sedikit
2. Reaktan berlebih (excess reactan):
Reaktan yang melebihi reaktan pembatas.
% kelebihan = mol kelebihan X 100% mol yg stoikiometrik dg reaktan pembatas
misalnya kelebihan udara (excess air): udara berlebih terhadap kebutuhan teoritis untuk pembakaran sempurna pada proses pembakaran
3. Konversi (tingkat kesempurnaan reaksi):
Bagian dari umpan/reaktan yang berubah menjadi hasil/produk. % Konversi = jumlah mol zat yang bereaksi x 100 %
jumlah mol zat mula-mula
4. Selektivitas (selectivity) :
Perbandingan (%) mol produk tertentu (biasanya yang diinginkan) dengan mol produk lainnya (biasanya sampingan) yang dihasilkan
Materi Azas Rekayasa Proses Page 19 5. Yield :Untuk reaktan dan produk tunggal adalah berat/mol produk akhir
dibagi dengan berat/mol reaktan awal, sedangkan untuk reaktan & produk yang lebih dari 1 harus dijelaskan reaktan yang menjadi dasar yield.
% Yield = berat atau mol produk x 100 % berat atau mol reaktan awal
MACAM-MACAM LAJU ALIR
1. Point linear velocity (Laju alir linear titik): laju alir ditinjau pada satu titik. V [=] 1/t [=] m/jam, ft/det , m/jam dsb
2. Average linear velocity (Laju alir linear rata-rata) : laju alir linear rata-rata pada seluruh penampang
V = Q / A = debit/luas = l3/t = l/t = m/det = ft/det dsb
l2
3. Volumetric flow rate (laju alir volum) : sejumlah volum yang mengalir per satuan waktu (debit = Q)
Q = volum / waktu = A . V = l3/t = m3/menit , gallon/menit =
4. Mass flow rate (laju alir massa) : sejumlah massa yang mengalir per satuan Waktu
= massa/waktu = m / t = kg/menit ; ton/jam ; lb/detik ; dsb
5. Molal flow rate (laju alir molal) : sejumlah mol yang mengalir per satuan waktu = mol / waktu = massa/BM = gmol/menit; lbmol/det ; dsb
T
Contoh soal 1 :
Antimon dibuat dengan cara memanaskan stibnit (Sb2S3) dengan serpihan besi, lelehan antimon dikeluarkan dari bawah reaktor. Sebanyak 0,6 kg stibnit dan 0,25 kg serpihan besi dipanaskan bersama-sama ternyata dihasilkan 0,2 kg antimon. Rx : Sb2S3 + 3Fe → 2 Sb + 3 FeS
Materi Azas Rekayasa Proses Page 20
Hitunglah:
a. reaktan pembatas b. reaktan berlebih c. tingkat kesempurnaan reaksi d. % konversi e. selektivitas f. Yield Jawab:
Rx : Sb2S3 + 3Fe → 2 Sb + 3 FeS
a & b. Menentukan reaktan pembatas dan berlebih:
untuk bereaksi dengan 1,77 mol Sb2S3 membutuhkan 3 X 1,77 mol = 5,31 mol Fe
sedangkan Fe yang tersedia hanyalah 4,48 mol. Disini terlihat bahwa Fe stiokiometrik terkecil jumlahnya maka Fe merupakan reaktan pembatas, dan Sb2S3 adalah reaktan berlebih.
c. Walaupun Fe adalah reaktan pembatas tetapi tidak semua Fe habis bereaksi, jika dilihat dari produk Sb yang dihasilkan hanya 1,64 mol ini berarti Fe yang bereaksi sebanyak:
3 mol Fe X 1,64 mol Sb = 2,46 mol Fe 2 mol Sb
maka tingkat kesempurnaan reaksi Fe menjadi FeS = 2,46 / 1,77 x 100 % = 55 % sedangkan untuk 1.64 mol Sb maka Sb2S3 yang bereaksi sebanyak:
1 mol Sb2S3 X 1,64 mol Sb = 0,82 mol Sb2S3
2 mol Sb
Materi Azas Rekayasa Proses Page 21
maka tingkat kesempurnaan reaksi Sb2S3 menjadi Sb =
0.82 /1,77 X 100% = 46,3%
e. Selektivitas didasarkan pada Sb2S3 yang seharusnya dapat dikonversikan dengan Fe yang ada :
selektivitas = (0,82 / 1,49) x 100 % = 55 %
f. Yield = kg Sb terbentuk = 0,2 kg x 100 % = 33,5 % ( Sb/Sb2S3 )
kg Sb2S3 mula-mula 0,6 kg
Contoh soal 2:
Alumunium sulfat dapat dibuat dengan mereaksikan pecahan biji bauksit dengan asam sulfat menurut reaksi :
Al2O3 + 3 H2SO4 → Al2(SO4)3 + 3 H2O
Biji bauksit mengandung 55,4% alumuniumoksida dan sisanya pengotor. Sedangkan asam sulfat berkadar 77,7% H2SO4 (sisanya air). Untuk menghasilkan 800 kg
alumunium sulfat dipergunakan 480 kg biji bauksit dan 1200 kg asam sulfat. Pertanyaan:
a. Zat manakah yang berlebih dan berapa % b. Berapa % reaktan berlebih yang terpakai c. Berapa tingkat kesempurnaan reaksi d. Berapa yield alumunium sulfat
Jawab :
55,4% Al2O3 H2O
77,7% H2SO4 Al2(SO4)3
Materi Azas Rekayasa Proses Page 22
Zat BM Massa (Kg) Mol (kmol) Reaktan Al2O3 H2SO4 101.9 98.1 0,554 x 480 0,777 x 1200 2,61 9,50 Produk Al2(SO4)3 342,1 800 2,33 Rx: Al2O3 + 3 H2SO4 → Al2(SO4)3 + 3 H2O
a. Menentukan reaktan berlebih :
Untuk bereaksi dengan 2,61 kgmol Al2O3 membutuhkan 3 x 2,61 = 7,83 kgmol
H2SO4 sedangkan H2SO4 yang tersedia 9,505 kgmol jadi H2SO4 lebih maka
reaktan berlebihnya adalah H2SO4 sedangkan reaktan pembatasnya adalah Al2O3
% H2SO4 berlebih = 9,505 − 7,83 X 100% = 21,39 %
9,505
b. Menghitung reaktan berlebih yang terpakai : Produk Al2(SO4)3 2,338 kgmol ini memerlukan:
2,338 kgmol Al2(SO4)3 X 3 kgmol H2SO4 = 7,014 kgmol H2SO4
1 kgmol Al2(SO4)3
% H2SO4 terpakai = 7,014 kgmol X 100% = 73,79%
9,505 kgmol
c. Tingkat kesempunaan reaksi : (dipandang atas dasar Al2O3 yang bereaksi)
= (2,333/ 2,61) X 100% = 89%
d. Yield = kg Al2(SO4)3 = 800 = 1,66 (Al2(SO4)3/ Al2O3)
kg Al2O3 480
dalam hal ini yield lebih dari satu karena perhitungan dalam berat padahal BM produk jauh lebih besar dari pada reaktan.
Materi Azas Rekayasa Proses Page 23
Soal-soal Latihan
1. Gypsum (CaSO4.2H2O) dihasilkan dengan mereaksikan kalsium karbonat dan
asam sulfat. Analisa dari batu kapur adalah: CaCO3 96,89%; MgCO3 1,14%;
inert 1,7%. Untuk mereaksikan seluruh batu kapur seberat 5 ton tentukan : a. Berat gypsum anhidrat (CaSO4) yang dihasilkan
b. Berat larutan asam sulfat (98% berat) yang dibutuhkan c. Berat Karbondioksida yang dihasilkan
(BM: CaCO3 = 100; MgCO3 = 84,32; H2SO4 = 98; CaSO4 = 136; MgSO4 =120;
H2O = 18; CO2 = 44)
2. Sintesis amonia menggunakan reaksi berikut: N2 + 3 H2 → 2 NH3
Pada sebuah pabrik, 4202 lb nitrogen dan 1406 lb hidrogen diumpankan kedalam reaktor perjam. Produk amonia murni yang dihasilkan oleh reaktor ini sebanyak 3060 lb per jam.
a. Tentukan reaktan pembatas b. Berapa % excess reaktan
c. Berapa % konversi yang didapatkan berdasarkan pada reaktan pembatas 3. 5 lb bismut (BM=209) dipanaskan bersama dengan 1 lb sulfur untuk
membentuk Bi2S3 (BM= 514). Pada akhir reaksi, zat yang dihasilkan
mengandung 5% sulfur bebas. Tentukan: Reaksi : 2 Bi + 3 S → Bi2S3
a. Reaktan pembatas b. % excess reaktan
Materi Azas Rekayasa Proses Page 24
BAB V
KESETIMBANGAN MATERI
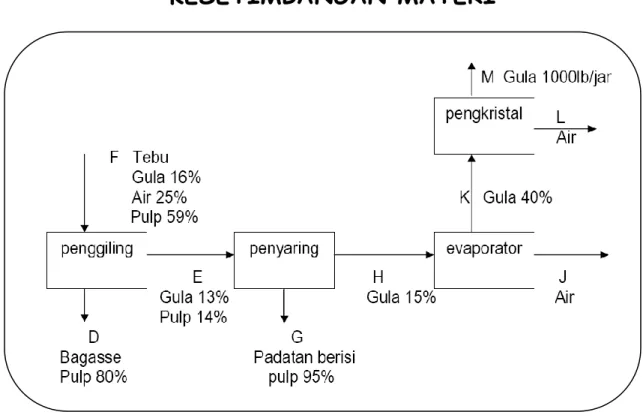
Gambar di atas adalah lembar alir sederhana untuk pabrik gula. Tebu dimasukan ke dalam sebuah penggilingan dengan sirup diperas keluar dan “bagase” yang dihasilkan mengandung 80% pulp. Sirup E yang mengandung potongan-potongan halus pulp dimasukan kedalam saringan yang menghilangkan semua pulp dan menghasilkan sirup jernih pada aliran H yang mengandung 5% gula dan 85% air. Evaporator membuat sirup kental dan kristalizer menghasilkan 1000 lb/jam kristal gula.
Dari keterangan yang diberikan ini dapatkah anda mencari:
1. Berapa banyak air yang dihilangkan didalam evaporator (lb/jam) ?
2. Berapa besar fraksi massa komponen-komponen dalam arus buangan G ? 3. Berapa besar laju masukan tebu kedalam unit (lb/jam) ?
Materi Azas Rekayasa Proses Page 25
NERACA BAHAN
Neraca bahan adalah perincian dari jumlah bahan-bahan yang masuk, keluar dan yang menumpuk di dalam sebuah sistem. Sistem ini dapat berupa satu alat proses maupun rangkaian dari beberapa alat proses, bahkan rangkaian dari banyak alat proses.
Prinsip dari neraca bahan itu sendiri adalah:
1. Neraca bahan merupakan penerapan hukum kekekalan massa terhadap suatu
sistem proses atau pabrik.
2. Massa berjumlah tetap, tidak dapat dimusnahkan maupun diciptakan
RUMUS UMUM NERACA BAHAN
Input = masukan ke system Output = keluaran dari system Generate = terbentuk hasil reaksi Consumption = digunakan oleh reaksi Accumulation = terkumpul dalam system
JENIS-JENIS PROSES
Berdasarkan kejadiannya proses terbagi menjadi dua yaitu proses Batch (per-angkatan) dan proses kontinyu (berkesinambungan)
A. Proses Batch :
Pemasukan reaktan dan pengeluaran hasil dilakukan dalam selang waktu tertentu/ tidak terusmenerus.
Contoh: - Proses memasak didalam sebuah panci (panci menjadi alat proses) Input - output + generate - Consumption = Acumulation
Materi Azas Rekayasa Proses Page 26
- Pemanasan air dengan koil pada teko B. Proses Kontinyu:
Proses dengan pemasukan bahan dan pengeluaran produk dilakukan secara terus menerus/ berkesinambungan dengan laju tertentu.
Bahan masuk dengan laju tetap
Produk keluar dengan laju tetap
Berdasarkan keadaannya proses dibedakan menjadi dua yaitu proses dalam keadaan tunak (steady) dan keadaan tak tunak (unsteady)
A. Proses steady:
Semua aliran di dalam sistem mempunyai laju, komposisi, massa dan suhu yang tetap atau tidak berubah terhadap waktu. Sehingga pada keadaan ini jumlah akumulasi di dalam sistem tetap.
Laju alir masuk = Laju alir keluar
in out
B. Proses Unsteady
Dalam proses unsteady terjadi perubahan dalam sistem terhadap waktu. Baik berupa perubahan laju, komposisi, massa maupun suhu. Karena adanya perubahan laju maka terdapat perubahan akumulasi di dalam sistem sehingga akumulasi massa harus diperhitungkan.
Materi Azas Rekayasa Proses Page 27
PENYUSUNAN PERSAMAAN NERACA BAHAN
Neraca massa dibuat untuk satu alat/unit atau rangkaian alat dengan batasan sistem (system boundary) tertentu/jelas, jumlah bahan yang dihitung adalah hanya bahan-bahan yang masuk dan keluar dari sistem yang telah ditentukan batasnya. Neraca yang dibuat harus berdasarkan Hukum kekekalan massa yaitu massa tidak dapat diciptakan atau dimusnahkan; kalaupun berubah hanya bentuk atau tempatnya. Tahap-tahap pembuatan neraca bahan:
1. Tentukan jenis proses
2. Jika pada proses tidak menyangkut reaksi kimia, neraca bahan dapat dibuat
dalam satuan massa atau mol untuk satu periode waktu tertentu.
3. Jika terdapat reaksi kimia , sebaiknya digunakan satuan mol untuk setiap
unsur/komponen karena jika disusun neraca molekul harus diperhatikan senyawa-senyawa yang berkaitan satu sama lain secara stoikiometrik.
4. Persamaan neraca yang terbentuk akan berupa persamaan linier atau non
linier; baik persamaan-persamaan tersebut tidak tergantung (independent) ataupun saling tergantung (dependent) atau keduanya. Penyelesaian persamaan-persamaan tersebut dapat dilakukan dengan cara eliminasi, substitusi atau jika perlu diselesaikan secara serempak (simultan). Ada satu ukuran yang dapat memberikan indikasi apakah persamaan neraca bahan dapat diselesaikan atau tidak ukuran ini adalah Degree of freedom atau
Derajat Kebebasan (DK), DK akan kita bahas setelah contoh-2 soal berikut.
Contoh soal 1
Suatu bahan dengan kandungan air 60% dikeringkan sampai 75% airnya menguap. Hitunglah :
a) Jumlah air yang diuapkan tiap kg bahan basah b) Komposisi bahan akhir
Materi Azas Rekayasa Proses Page 28
jawab:
1. Buatlah diagram alir dan tulis hal-hal yang diketahui (besaran kualitas dan kuantitas)
2. Tentukan basis
Basis: 100 kg bahan basah
air dalam bahan basah: 0,6 x 100 = 60 kg air yang menguap : 0,75 x 60 = 45 kg
padatan yang terdapat dalam bahan basah = 0,4 x 100 = 40kg 3. Buatlah persamaan neraca bahan:
air yang tersisa dalam bahan = air dalam bahan – air yang menguap = 60 kg – 45 kg = 15 kg
a. jumlah air yang diuapkan tiap kg bahan basah = 45 / 100 = 0,45 kg b. komposisi bahan akhir :
air = ( 15/ 15+ 40 ) x 100 % = 27,3 % padatan = 100% - 27,3% = 72,7%
KESETIMBANGAN MATERI TANPA REAKSI KIMIA
Pada kesetimbangan materi tanpa reaksi kimia, rumus umum yang digunakan adalah :
Laju masuk - laju keluar = akumulasi
hal ini karena tidak adanya pembentukan zat ataupun reaksi kimia yang menggunakan zat tersebut,
Materi Azas Rekayasa Proses Page 29
Contoh soal 2
Sebanyak 100 mol/jam larutan etilen diklorida 40% dalam toluena dimasukkan ke sebuah kolom (menara) distilasi. Di dalam menara distilasi proses berlangsung secara kontinyu dan tidak terjadi akumulasi sehingga 100 mol/jam bahan juga keluar dari kolom. Aliran keluar kolom dibagi menjadi dua yaitu aliran distilat (D) dan aliran dasar (B = bottom) Aliran distilat keluar dari puncak kolom mengandung 10% mol etilen diklorida. Tentukan laju alir masing-masing aliran tersebut.
Jawab:
Neraca massa (mol) total : F = D + B ...(1)
Neraca massa (mol) komponen (dalam soal ini hanya satu komponen) : F . XF = D . XD + B . XB ...(2) (1) 100 mol/jam = D + B B = 100 mol/jam – D (2) 100 . (0,4) = D . (0,95) + B . (0,1) 40= 0,95D + (100-D) . (0,1) 40 = 0,95D + 10 - 0,1D 30 = 0,85D D = 35,3 mol/jam B = 100 mol/jam – 35,3 mol/jam B = 64,7 mol/jam
Materi Azas Rekayasa Proses Page 30
Dua buah contoh soal di atas merupakan contoh sederhana dari suatu system proses yang tidak melibatkan reaksi kimia. Persamaan-persamaan neraca massa yang terbentuk masing-masing merupakan persamaan linier yang dapat diselesaikan dengan cara eliminasi biasa. Berikut ini adalah contoh system proses yang melibatkan reaksi kimia.
KESETIMBANGAN MATERI DENGAN REAKSI KIMIA.
Pada keadaan ini rumus yang digunakan sama dengan rumus umum kesetimbangan materi yaitu:
Contoh soal 3
Pada suatu pembakaran, sebanyak 300 kg udara dan 24 kg karbon diumpankan ke dalam reaktor pada suhu 600oF. Setelah pembakaran sempurna tidak ada bahan
tersisa di dalam reaktor. Hitunglah:
a. Berapa berat karbon, oksigen & berat total bahan yang keluar dari reaktor? b. Berapa mol karbon & mol oksigen yang masuk dan keluar dari reaktor? c. Berapa mol total yang masuk dan berapa yang keluar reaktor?
Jawab:
Neraca massa adalah:
Input - output + generation - consumption = accumulation ( 0 ) input + generation = output + consumption
Materi Azas Rekayasa Proses Page 31
Neraca yang digunakan:
1. Neraca mol total (semua komponen) 2. Neraca mol komponen : CO2 dan O2
Basis : 24 kg C dan 300 kg udara Komponen yang masuk ke reaktor:
Reaksi yang terjadi : C + O2 → CO2
Dari stoikiometri diketahui untuk membakar sempurna 2 kmol C dipakai 2 kmol O2
jadi masih terdapat sisa O2
Neraca O2 : O 2 input + O2 generate = O2 output + O2 consumption
2,17 kmol + 0 = O2 output + 2 kmol
O2 output = 0,17 kmol
Neraca N2 : N 2 input + N2 generate = N2 output + N2 consumption
8,17 kmol + 0 = N2 output + 0 N2 output = 8,17 kmol
Neraca C : C input + C generate = C output + C consumption 0 + 2 kmol = C output + 0
C output = 2 kmol
Materi Azas Rekayasa Proses Page 32
a. Tidak ada karbon keluar dalam bentuk C, tetapi dalam bentuk CO2 seberat 88 kg
dimana dalam CO2 tersebut mengandung C seberat 24 kg. O2 yang keluar 0,17
kmol, sisanya keluar dalam bentuk CO2. Berat bahan total yang keluar sama
dengan berat bahan total yang masuk yaitu 324 kg
b. 2 kmol C dan 2,17 kmol O2 yang masuk kedalam reaktor, sedangkan yang keluar
dari reaktor adalah 0 kmol C dan 0,17 kmol O2
c. 2,34 kmol total masuk ke reaktor dan 10,34 kmol keluar dari reaktor.
Contoh soal 4:
Dalam suatu proses pembakaran, gas etana dicampur dengan oksigen dengan perbandingan 80% etana dan sisanya oksigen campuran ini dibakar dengan udara berlebih 200%. Pada pembakaran tersebut ternyata 80% gas etana terbakar menjadi CO2, 10% menjadi CO dan 10% tidak terbakar. Hitung komposisi gas hasil
bakar (dasar basah)
Materi Azas Rekayasa Proses Page 33
Basis : 100 mol bahan bakar
C2H6 = 80% x 100 mol = 80 mol
O2 = 20% x 100 mol = 20 mol
Reaksi:
Oksigen dari udara yang masuk 200% berlebih berarti 3 x dari yang dibutuhkan secara teoritis untuk pembakaran sempurna.
Oksigen teoritis yang dibutuhkan untuk pembakaran sempurna :
Oksigen yang terikut dalam bahan bakar = 20 mol
Oksigen teoritis yang dibutuhkan dari udara = 280 mol – 20 mol = 260 mol Oksigen total yang masuk dari udara = 3 x 260 mol = 780 mol
Nitrogen yang masuk bersama udara = 79/21 x 780 mol 2934,3 mol Menghitung komposisi produk (hasil):
Untuk reaksi (1) CO2 : (0,8 x 80 mol) x 2 = 128 mol CO2 H2O : (0,8 x 80 mol) x 3 = 192 mol H2O Untuk reaksi (2) CO : (0,1 x 80 mol) x 2 = 16 mol CO H2O : (0,1 x 80 mol) x 3 = 24 mol H2O Total H2O = 192 + 24 = 216 mol
Materi Azas Rekayasa Proses Page 34
Total O2 terkonsumsi:
reaksi (1) : (0,8 x 80 mol) x 3,5 = 224 mol reaksi (2) : (0,1 x 80 mol) x 2,5 = 20 mol total = 224 + 20 = 244 mol O2
O2 yang keluar bersama gas hasil pembakaran = 800 – 244 = 556 mol
C2H6 sisa = 0,1 x 80 mol = 8 mol
Ringkasan hasil hitungan
Jika dianalisis orsat ( dasar kering) H2O tidak dihitung. Jumlah mol total = 3642,3
mol.
Komposisi gas kering: CO2 = 3,51%
O2 = 15,26%
CO = 0,45% C2H6 = 0,22%
N2 = 80,56%
Materi Azas Rekayasa Proses Page 35
Walaupun massa total yang masuk sama dengan massa total yang keluar (sesuai dengan hukum kekekalan massa), tetapi jumlah mol yang masuk tidak sama dengan jumlah mol yang keluar. Hal Hal ini disebabkan oleh adanya reaksi kimia pada komponen-komponennya.
NERACA BAHAN DENGAN “tie component” ATAU ”key component”
Banyak persoalan neraca bahan yang seolah-olah rumit tetapi sebenarnya kalau diperhatikan dengan seksama dapat disederhanakan karena terdapat tie component atau key component . Komponen ini adalah komponen yang selama proses dari satu aliran ke aliran lain tidak mengalami perubahan sama sekali (numpang lewat doang).
Misalnya pada contoh soal 1, yang menjadi tie component adalah bahan padat (karena tidak mengalami perubahan sama sekali dan jmlahnya tetap) , sedangkan pada contoh soal 3 dan 4 yang menjadi tie component adalah Nitrogen (karena tidak ikut bereaksi/ inert).
DERAJAT KEBEBASAN ATAU DEGREE OF FREEDOM
Ada suatu ukuran yang dapat memberikan indikasi bahwa suatu persamaan (neraca bahan) mungkin dapat diselesaikan atau tidak. Ukuran ini adalah degree of freedom atau derajat kebebasan dari suatu persoalan. Seharusnya bila ada n besaran yang tidak diketahui maka untuk menyelesaikannya dibutuhkan n buah persamaan yang independen.
Bila jumlah persamaan yang tersedia kurang dari n buah maka persoalan tersebut tidak dapat diselesaikan. Sebaliknya jika terdapat lebih dari n buah persamaan maka harus diambil hanya n buah persamaan untuk menyelesaikannya. Itu pun dengan resiko bila persamaan yang kita ambil salah maka dapat terjadi ketidak
Materi Azas Rekayasa Proses Page 36
konsistenan ketentuan di antara persamaan – persamaan yang berlebih tersebut sehingga hasil yang diperoleh salah.
Derajat kebebasan adalah ukuran yang sederhana untuk mengetahui hal tersebut. Analisis derajat kebebasan merupakan mekanisme yang sistematis untuk menghitung semua variabel, persamaan-persamaan neraca dan hubungan-hubungan yang terkait dalam permasalahan.
Derajat Kebebasan (DK) =
Jika DK > 0 : Permasalahan tdk dapat diselesaikan (kurang terspesifikasi)
Jika DK < 0 : Permasalahan kelebihan spesifikasi dapat menyebabkan inkonsistensi Jika DK = 0 : Permasalahan terspesifikasi dengan benar karena jumlah var yang tidak diketahui sama dengan jumlah persamaan yang ada
Contoh 1 menghitung DK
Suatu umpan kolom destilasi dengan laju alir 1000 mol/jam mempunyai komposisi sebagai berikut (%mol): 20% propane, 30% isobutane, 20% isopentane dan sisanya normal pentane Destilat yang dihasilkan mengandung semua propane dan 80% isopentane yang masuk kolom, serta mengandung 40% isobutane. Produk bawah (bottom prod) mengandung semua normal pentane yang masuk kolom. Hitung komposisi kedua produk tersebut.
Analisis:
1. Terdapat 1 kolom destilasi (1 alat saja) 2. Terdapat 3 aliran (1 masuk, 2 keluar)
Jumlah variabel aliran yang independen - Jumlah persamaan neraca yang independen - Jumlah veriabel aliran terspesifikasi yang independen – Jumlah hubungan yang terkait ( yg membentuk persamaan)
Materi Azas Rekayasa Proses Page 37
3. Anggaplah tiap-tiap aliran mempunyai 4 variabel yaitu 1 var laju alir dan 3 var komposisi. Dengan demikian untuk ketiga aliran tersebut masingmasing terdapat 4 var aliran yang nantinya dapat disusun menjadi 4 persamaan neraca bahan yang independen.
4. Variabel-veriabel aliran yang terspesifikasi (biasanya ditentukan atau diketahui) sehingga variabel independen dari aliran adalah:
a. 3 var indep komposisi umpan = 20% C3, 30% C4, 20% C5
b. 2 var indep komposisi destilat = 0% C5 dan 40% C4
c. 1 var indep komposisi bottom prod = 0% C3
d. 1 var indep laju umpan = 1000 mol/jam Berdasarkan analisis diatas maka dapat dijawab sbb: - Jumlah variabel aliran = 3 aliran x 4 var/aliran = 12 var
- Jumlah persamaan neraca bahan independen = jumlah komponen yang terdapat dalam sistem yaitu 4 persamaan
- Jumlah var terspesifikasi ada 2 macam yaitu : * komposisi ada 6 (a,b & c)
* aliran ada 1 (d)
- Jumlah hubungan terkait berupa perolehan di destilat (80%) Maka:
Jumlah variabel aliran yang independen = 12 Jumlah persamaan neraca yang independen = 4 Jumlah veriabel aliran terspesifikasi yang independen
Komposisi = 6
Aliran = 1
Jumlah hubungan yang terkait ( yg membentuk persaman) = 1 _ - Derajat Kebebasan (DK) = 0
Materi Azas Rekayasa Proses Page 38
Disini permasalahan terspesifikasi dengan benar sehingga persoalan hanya memiliki satu penyelasaian. Tetapi perhitungan jumlah variabel dan spesifikasi ini sering tidak sama pada berbagai literatur karena adanya penyederhanaan oleh masing-masing analis, meskipun hasil akhirnya (DK) tetap sama. Seperti contoh di atas, bisa saja jumlah variabel aliran hanya 10 karena kita sudah mengetahui bahwa komposisi dari C5 pada produk destilat = 0. Dengan demikian untuk perhitungan jumlah
variabel komposisi aliran yang terspesifikasi juga akan berkurang 2 (kedua komposisi tadi) sehingga menjadi 4 Maka:
DK = 10 var aliran - 4 persamaan neraca bahan independen - 4 komposisi – 1 aliran - 1 hub terkait
DK = 0
Contoh 2 menghitung DK
Titanium dioksida TiO2 banyak digunakan sebagai zat warna pada industri cat dan
kertas. Dalam suatu unit pencuci pada pabrik zat tersebut diinginkan untuk memproduksi 4000 lb/jam TiO2 kering dan maksimum mengandung 100 ppm garam
basis kering. Keluar dari alat pembuatnya zat pewarna tersebut (raw pigmen) mengandung 40% TiO2, 20% garam dan sisanya air (% massa).
Pemurnian dilakukan dengan cara pencucian menggunakan air (H2O) kemudian
pemisahan dengan pengendapan hingga diperoleh produk pewarna yang bersih (washed product) dan air bekas mencuci yang disebut waste water. Pewarna yang dikehendaki minimal haruslah mengandung 50% TiO2. Karena air buangan bekas cuci
tersebut akan dibuang ke sungai maka komposisinya harus diketahui dengan tepat. Hitunglah
Materi Azas Rekayasa Proses Page 39
ncuci
• Dari diagram diatas dapat dilihat bahwa jumlah variabel aliran-aliran tersebut adalah: - Pewarna kotor 3 - Air pencuci 1 - pewarna bersih 3 - Air cucian 2 9
• Jumlah komponen dalam soal ini ada 3, jadi pesamaan neraca independen juga ada 3 • Jumlah komposisi yang terspesifikasi : 2 untuk pewarna kotor, 1 untuk pewarna
bersih
• Jumlah hubungan tambahan, kapasitas produk dan kandungan garam, ada 2 Maka:
Jumlah variabel aliran yang independen = 9 Jumlah persamaan neraca yang independen = 3 Jumlah veriabel aliran terspesifikasi yang independen = 3 Jumlah hubungan yang terkait ( yg membentuk persaman) = 2 _ Derajat Kebebasan (DK) = 1
Materi Azas Rekayasa Proses Page 40
DK = 1 atau >0 hal ini berarti soal tersebut tidak bisa diselesaikan (kurang terspesifikasi), Ada 3 variabel yang tidak diketahui sedangkan hanya ada 2 persamaan jadi perlu satu persamaan lagi, persaman ini bisa berasal dari komposisi, laju alir atau perbandingan lain yang menyebabkan tambahan hubungan diantara veriabel-variabel yang tidak dketahui tersebut. Sekarang coba selesaikan dengan tambahan keterangan perbandingan penggunaan massa air pencuci/pewarna adalah 6 lb H2O per lb pewarna atau F2/F1 = 6
Materi Azas Rekayasa Proses Page 41
Bypass, Recycle, Purge, Spliter & Mixer
Pada diagram di atas dapat dilihat terdapat beberapa aliran dan alat, berikut akan dijelaskan tiap aliran dan alat yang digunakan:
I adalah alat yang disebut dengan separator: alat ini berfungsi untuk memisahkan komposisi tertentu dari suatu aliran sehingga komposisi pada aliran yang dihasilkan berbeda dengan aliran awal.
II adalah alat yang disebut dengan spliter: alat ini berfungsi untuk memisahkan aliran tetapi tanpa mengubah komposisi yang terdapat pada lairan sehingga komposisi aliran yang dihasilkan sama dengan komposisi aliran awal.
III adalah alat yang disebut dengan mixer: alat ini berfungsi untuk mencampurkan aliran.
Untuk separator dan spliter bisa terdapat pada aliran yang akan di purge, recycle ataupun yang akan di bypass, tetapi mixer biasanya hanya terdapat pada aliran yang akan dicampur.
Aliran R adalah aliran Recycle (Daur ulang), aliran ini berfungsi untuk mengembalikan zat-zat, yang masih dibutuhkan, yang masih terdapat dalam aliran keluar untuk kembali mengalami proses.
Materi Azas Rekayasa Proses Page 42
Aliran B adalah aliran Bypass, aliran ini adalah aliran yang melewati satu atau beberapa tahap proses yang langsung menuju pada proses selanjutnya.
Aliran P adalah aliran Purge aliran ini adalah aliran pembuangan untuk mengeluarkan akumulasi dari inert atau materi yang tidak diinginkan yang jika tidak dikeluarkan akan tertimbun dalam aliran Recycle.
Dalam neraca massa dengan reaksi kimia kita akan menemui istilah fraction conversion , fraction conversion yang dimaksud di sini adalah banyaknya jumlah zat yang digunakan dalam suatu proses dibandingkan dengan jumlah input zat tersebut. Faktor konversi dibedakan menjadi 2 jenis yaitu :
1. Overall fraction conversion (konversi keseluruhan )
2. Single pass atau once through conversion
Secara singkat dapat dikatakan bahwa single pass hanya menghitung konversi pada satu alat saja, sedang overall menghitung konversi dalam sistem.
SOAL 1
Asam asetat dapat diproduksi melalui reaksi berikut:
2C2H5OH + 2Na2Cr2O7 + 8H2SO4 3CH3COOH + 2Cr2(SO4)3 + 2Na2SO4 + 11H2O
Reaksi berlangsung dalam system dengan recycle seperti digambarkan dalam diagram berikut:
Materi Azas Rekayasa Proses Page 43
Konversi etanol overall sebesar 90% dicapai jika laju alir recycle sama dengan laju umpan segar C2H5OH. Laju umpan segar H2SO4 dan Na2Cr2O7 masing-masing
berlebih 20% dan 10% secara stoikiometrik terhadap jumlah umpan segar C2H5OH.
Jika aliran recycle mengandung 94% H2SO4 dan sisanya C2H5OH (% dalam mol),
hitunglah:
a. Laju alir produk (P)
b. Laju alir dan komposisi produk limbah (W) c. Konversi single pass reactor etanol
SOAL 2
Dalam suatu industri minuman, jus jeruk segar mengandung 12% padatan dan sisanya air; sedangkan produk jus kental mengandung 42% padatan. Jika proses pengentalan dilakukan dengan proses evaporasi tunggal, sebagian kandungan zat-zat volatile ikut teruapkan bersama air dan mengakibatkan rasa yang hambar. Untuk mengatasi masalah ini, sebagian aliran jus jeruk segar di bypass untuk kemudian digabungkan dengan aliran keluaran evaporator. Sementara itu, aliran jus jeruk segar dikentalkan dalam evaporator hingga kandungan padatan menjadi 58%.
a. Gambarkan proses yang terjadi!
b. Hitunglah julah produk jus kental yang dihasilkan per 100 kg jus jeruk segar yang diumpankan ke proses!
Materi Azas Rekayasa Proses Page 44
c. Hitunglah fraksi jus jeruk segar yang di bypass! Gunakan notasi-notasi berikut:
F = Aliran jus jeruk segar; E = aliran keluaran evaporator; B = aliran bypass; P = aliran produk jus kental.
GAS, UAP, CAIRAN DAN PADATAN
4.1 HUKUM GAS IDEAL
Gas ideal adalah gas imajiner yang memenuhi persamaan : P V = n R T
Dengan :
P = tekanan gas V = volum total gas n = jumlah mol gas R = konstanta gas ideal T = Suhu dalam kelvin
Persamaan ini dapat diterapkan untuk komponen murni atau campuran.
Sejumlah keadaan standar yang ditentukan secara sembarang atau yang dikenal dengan standard condition dari suhu dan tekanan ditentukan untuk mengetahui nilai R, jadi kenyataan bahwa sebuah unsur tdk berwujud gas pada 0oC dan 1 atm (dalam keadaan standar) tidaklah penting. Sebagai contoh uap air pada 0oC tdk dapat
berada dalam tekanan yang lebih besar dari 0,61 kPa tanpa terjadi pengembunan.
4.1.1 Penerapan hukum gas ideal:
Hk gas ideal dapat digunakan untuk menentukan volume, tekanan, atau suhu suatu zat dalam keadaan tertentu.
Materi Azas Rekayasa Proses Page 45
Berapakah densitas O2 pada 27oC dan 250 kPa dalam satuan SI ?
27oC = 300 K ; R = 0,008314 kPa m3/mol K
basis = 1 m3 gas O 2
massa O2 = 3,2 kg
densitas O2 = 3,2kg/1m3 = 3,2 kg/m3
4.1.2 Campuran gas ideal dan tekanan gas parsial
Dalam kehidupan sehari-hari, gas biasanya berada dalam suatu campuran dengan gas lain. Dalam keadaan seperti ini anda tetap dapat menggunakan hukum gas ideal. Biasanya kita menggunakan kuantitas khayalan yang disebut tekanan parsial. Tekanan parsial dari gas I didefinisikan sebagai Pi. Jadi hukum gas idealnya menjadi:
Pi Vtotal = ni R T
Atau
Dimana Yi = Fraksi mol zat i Contoh soal:
Udara di bumi terdiri dari 21% (%V) oksigen dan 79% nitrogen. Tekanan parsial oksigen 21 kPa, berapakah tekanan total udara?
Materi Azas Rekayasa Proses Page 46
YO2 = 0,21
4.2 KEJENUHAN (SATURATION)
Kejenuhan adalah suatu keadaan setimbang daimana saat tekanan persial dalam gas sama dengan tekanan uap cairan tersebut, dalam keadaan ini tidak ada lagi zat cair yang menguap atau gas yang mengembun. Pada saat titik jenuh tercapai kita dapat menyatakan bahwa zat tersebut berada dalam titik embun (dew point). Dengan mengasumsikan bahwa sistem gas ideal berlaku pada saat jenuh maka kita dapat menuliskan hubungan tekanan (P) gas dengan tekanan (P) cairan dalam keadaan jenuh sebagai berikut.
4.3 KEJENUHAN PARSIAL DAN KELEMBAPAN
Kejenuhan parsial adalah kondisi dimana uap tidak berada dalam ekuilibrium dengan fase cair, dan tekanan parsial uap lebih kecil daripada tekanan uap cairan pada suhu tertentu. Ketika uap adalah uap air dan gas adalah udara, berlaku istilah khusus kelembapan (humidity). Untuk gas atau uap lainnya digunakan istilah
kejenuhan (saturation).
Materi Azas Rekayasa Proses Page 47
Dengan:
Puap = Tekanan parsial uap dalam campuran gas
Pjenuh = tekanan parsial uap dalam campuran gas jika gas jenuh pada suhu campuran yang diberikan (yaitu tekanan uap dari komponen uap)
Untuk ringkasnya :
Kejenuhan molal adalah cara lain untuk menyatakan konsentrasi uap dalam gas adalah menggunakan rasio mol uap terhadap mol gas bebas uap:
untuk suatu sistem biner dimana 1 menunjukan uap dan 2 menunjukkan gas kering:
Kelembapan atau Humidity (H) manunjukan massa uap cair per massa udara kering (bonedry air)
Kejenuhan (kelembapan) “Absolut”, Presentase Kejenuhan (Kelembapan).
Kejenuhan “Absolut” didefinisikan sebagai rasio mol uap per mol gas bebas-uap terhadap mol uap yang akan ada per mol gas bebas-uap jika campuran tersebut jenuh secara sempurna pada suhu dan tekanan total yang ada:
Materi Azas Rekayasa Proses Page 48
Dengan 1 untuk uap dan 2 untuk gas bebas uap Persen kejenuhan absolut =
Titik Embun. Selama gas yang jenuh secara parsial mendingin pada volume konstan, ataupun pada tekanan total konstan, gas yang takdapat mengembun akhirnya menjadi jenuh dengan uap, dan uap tersebut mulai mengembun. Suhu pengembunan dimulai pada titik embun (dew point).