Produksi dan Karakterisasi Enzim Phytase dari Mikroba Endopitik dan Aplikasinya untuk Meningkatkan Kualitas pakan Unggas
Production and Characterization of Phytase from Endophytic Microbe Its Aplication for Increase the Quality of Bird Ration
Yetti Marlida1) Gita Ciptaan1) and Rina Delfita2)
1) Department of Animal Nutrition, Faculty of Animal Science, Andalas University, Padang, Indonesia, [email protected]
2)Department of Biology, Andalas University, Padang, Indonesia
Abstract
The research was conducted to produce and characterization of phytase by Fusarium
verticillioides endophytic fungus that isolated from root of soy bean plant. The research
used experiment methode in laboratorium. The results of the research were based on the production of the phytase optimalization of the production exhibited in pH 5.0, temperature 50◦C and 48 h of incubation time. The fungus could be classified as themofilic fungus. Based on the characterization the partial purified phytase were exhibited pH activity 5.0, pH stability 2.5 – 5.0, otherwise temperature activity 50◦C and stability 30 - 60 ◦C . the enzyme had broad substrate specificity. The application of the enzyme to feed and ration 511 showed that rice bran more hydrolyze compared the other feed in released the an organic phosphate from binding in phytate acid or P-phytate linked.
Pendahuluan
Biji-bijian, legum dan minyak biji-bijian adalah tanaman yang lebih 90% tumbuh di dunia yang dapat dijadikan sebagai cadangan utama zat-zat makanan untuk ternak. Salah satu senyawa yang terpenting dalam tanaman adalah asam phytat (myo-inositol hexakisphosphat). Dalam bentuk garam, asam phytat disimpan dalam bentuk senyawa pospor yang tidak dapat larut, sekitar lebih dari 80% dari total pospor yang terdapat pada biji-bijian dan legum. Asam phytat juga disimpan dalam bentuk myo-inositol yang merupakan senyawa yang sangat penting dalam mempengaruhi pertumbuhan. Reddy et
al., (1989) menyatakan asam pitat dan myo-inositol turunan disimpan pada beberapa
fungsi fisiologi penting dalam tanaman.
Asam phytat mempunyai struktur kimia yang sangat stabil, sangat berbeda dari molekul organopospat yang dipunyai oleh senyawa pospat lainya, dimana menghasilkan muatan negatif (negative charge) yang tinggi pada perubahan pH yang luas. Di bawah kondisi fisiologi yang normal, asam phytat dapat mengkelat mineral essensial seperti Ca, Mg, Fe dan Zn. Asam phytat juga dapat mengikat asam amino dan protein dan menghambat pencernaan oleh enzim pencernaan (Pallauf and Rimbach, 1996). Selanjutnya asam phytat adalah komponen antinutrisi dalam tanaman untuk pangan maupun untuk pakan, karena itu enzimatik hidrolisis asam phytat sangat diperlukan sebelum dikonsumsi baik sebagai pangan maupun pakan.
Phosphatase adalah suatu enzim yang dapat mengkatalisis ikatan monopospoester
pada berbagai senyawa organopospat. Namun, enzim ini tidak dapat menghidrolisis ikatan monopospoester pada asam phytat, karena itu hirolisis asam phytat hanya dapat dikerjakan oleh spesial enzim yang dipunyai oleh enzim phytase. Enzim phytase (inositol hexakispospat pospohidrolase) dapat menghidrolisis asam phytat menjadi myo-inositol (myo-myo-inositol yang membebaskan pospat an organik). Enzim phytase tersebar dialam, seperti mikroorganisma, tanaman, dan jaringan tanaman. Beberapa enzim phytase telah di klon dan telah dikarakterisasi seperti enzim phytase dari
Aspergillus ficuum (ullah, 1988a), phytase dari Escherichia coli (Greiner et al,.1993), a
novel phytase dari Bacillus subtillis (Keovuo, 2000) dan phytase dari mamalia (Craxton
Mikroba endophytic adalah suatu mikroba yang diisolasi dari dalam tanaman baik dari akar, daun dan batang. Berbagai metabolit sekunder telah coba dihasilkan dan diteliti oleh sekelompok peneliti, baik sebagai senyawa antibiotik, antiviral dan senyawa antikanker, sebagai antioksidant, aktivitas antiinsektisida, dan antidiabetik dan senyawa antiimonosupresip (Strobel, 2002; Strobel and Daisy, 2003). Sementara penelitian antimikroba dan antikanker terus berlanjut untuk menghasilkan suatu novel menggunakan mikroba endopitik. Bare et al,. (2004) telah mengeksploitasi bakteri endopitik Burkholderia cepacia sebagai pitoremidasi senyawa organik yang larut air dan mudah terbang seperti toluene. Yetti (2001) menemukan bahwa Acremonium sp kapang endipitik dapat menghasilkan enzim amylase pendegradasi pati yang berasal dari sagu, kentang, beras, gandum, tapioca dan jagung dan pada tahun 2003 Yetti dkk telah juga mengeksploitasi kapang endopitik penghasil enzim sellulase yang dapat mendegradasi sellulosa pada limbah pertanian/industri (sabut sawit, sabut kelapa, bagase dan serbuk gergaji). Namun, kemampuan kapang endopitik (Rhizoctonia sp. dan Fusarium
verticillioides) dalam menghasilkan enzim phytase belum ada yang melaporkan terutama
untuk diaplikasikan dalam pakan ternak ayam yang mengandung phosphor berasal dari nabati, maka pada penelitian ini akan dicoba menemukan enzim phytase yang dihasilkan kapang endopitik yang diisolasi dari dalam akar, batang, daun tanaman kedelai. Diharapkan enzim yang dihasilkan mempunyai pH optimum sesuai dengan pH saluran pencernaan ayam sehingga enzim phytase dapat bekerja optimum dalam membebaskan mineral phosphor sehingga dapat dimanfaatkan ayam sebagai sumber mineral pospor.
Materi dan Metode Penelitian
1). Optimalisasi produksi enzim phytase dari kapang endopitik Rhizoctonia sp. Dan Fusarium verticillioides
pH awal fermentasi
Sebelum menggunakan fermentor volume 2.5 liter, digunakan tabung erlemeyer 250 ml yang berisi 100 ml medium fermentasi yang mengandung 1,5 g glukosa, 0,2 g NH4NO3, 0,05 g KCl, 0,05 g MgSO4, 0,03 g FeSO4 dan 0,03 g MnSO4 dan 0,05 g asam phytat dalam gelas piala yang berisi 100 ml akuades (pH awal diatur mulai dari 2 – 7.5 dengan 0.5). Kemudian disterilkan di dalam otoklaf pada suhu 1210C dengan tekanan 15 lbs selama 15 menit. Setelah itu inokulum Rhizoctonia sp. dan Fusarium verticillioides
masing-masing sebesar 2% di inokulasikan kedalam medium, medium yang telah diinokulasi kemudian ditempatkan pada shaker pada suhu ruang, selanjutnya enzim di panen setiap 6 jam sekali dan ditentukan aktivitas phytase dan kandungan protein terlarut enzim.
Suhu fermentasi
Suhu fermentasi juga sangat menentukan produksi dari suatu enzim, setelah diperoleh pH awal fermentasi, sumber C dan N optimum, maka dengan kondisi optimum tersebut ditentukan suhu optimum dengan menplot suhu fermentasi di mulai dari 30, 35, 4o, 45, 50, 55 dan 600C dengan metode sama denga metode diatas.
Lama fermentasi
Lama fermentasi dilakukan mengikuti metoda diatas pada pH, konsentrasi substrat dan suhu fermentasi optimum. Lama fermentasi diatur mulai dari 12, 24, 36. 48, 60, 72, 96 dan 120 jam.
2) Optimalisasi optimum kondisi hidrolisis enzim phytase (pH, suhu, substrat)
dihasilkan ini sangat berpotensi sekali membantu penyediaan mineral pospor bagi unggas dan membantu peternak dalam menurunkan harga pakan karena pospor anorganik yang ditambahkan ke dalam susunan ransum selama ini cukup mahal harganya. Disamping itu juga dapat membantu petani karena dapat mengurangi cemaran pospor pada lingkungan. 3). Mencari metoda degradasi asam phytat yang tepat pada bahan pakan (jagung, dedak, kedelai dan bungkil kelapa) dan pakan komersial.
Untuk menemukan metoda degradasi asam phytatat yang tepat pada bahan pakan dan pakan adalah dengan peningkatan mineral pospor yang di bebaskan dalam pakan maka berbagai perlakuan dilakukan pada bahan pakan yang akan diuji antara lain: Hidrolisis bahan pakan (bungkil kedelai, dedak dan jagung, bungkil inti sawit, bungkil kelapa) dengan phytase terlebih dulu sebelum dicampur dalam susunan ransum serta peningkatan mineral pospor dalam pakan komersial setelah diperlakukan dengan phytase yang dihasilkan.
Hasil dan Pembahasan
1). Optimalisasi produksi phytase kapang endopitik Rhizoctonia sp.& Fusarium verticillioides
Lama fermentasi
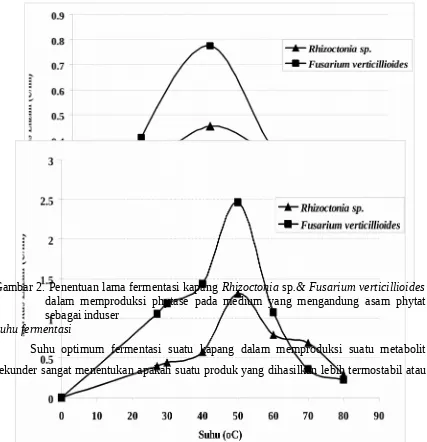
Sebelum melakukan produksi enzim phytase pada skala yang lebih besar seperti menggunakan fermentor 10 atau 50 liter maka optimalisasi produksi enzim menggunakan tabung erlemeyer 500 ml perlu dilakukan dimana lama fermentasi, suhu fermentasi dan pH awal fermentasi perlu dilakukan satu persatu agar diperoleh aktivitas phytase optimum dengan kondisi optimum. Pada Gambar 2, dapat dilihat bahwa lama waktu fermentasi 48 jam diperoleh aktivitas optimum pada kedua kapang ini namun kapang
Fusarium verticillioides menghasilkan aktivitas lebih tinggi yaitu 0.78 U/ml lebih tinggi
Kedua kapang ini memiliki masa adaptasi pertumbuhan yang cukup pendek hanya 10 jam, setelah itu mengalami masa pertumbuhan awal pada 11-30 jam, selanjutnya masa pertumbuhan eksponensial pada 30 – 48 jam, dimana pada periode pertumbuhan eksponensial ini enzim phytase di produksi. Namun pada periode lanjutan 41 – 70 jam terjadi periode penurunan pertumbuhan dimana komponen nutrisi yang dibutuhkan kapang sudah mulai menurun dan zat zat yang menghambat pertumbuhan juga sudah mulai dihasilkan. Sedangkan pada masa 71 -96 jam terjadi periode menuju kematian. Menurunnya aktivitas enzim phytase pada 41 -70 jam, hal ini disebabkan tingginya kosentrasi pospat an organik yang dibebaskan ke dalam medium karena kerja enzim phyase yang di produksi dalam medium, sehingga pospat an organik dapat menghambat (inhibit) aktivitas katalitik phytase. Hal yang sama juga dilaporkan oleh Greiner et al.,
[image:6.612.96.523.337.779.2](1993) dan Liu et al., (1998).
Gambar 2. Penentuan lama fermentasi kapang Rhizoctonia sp.& Fusarium verticillioides
dalam memproduksi phytase pada medium yang mengandung asam phytat sebagai induser
Suhu fermentasi
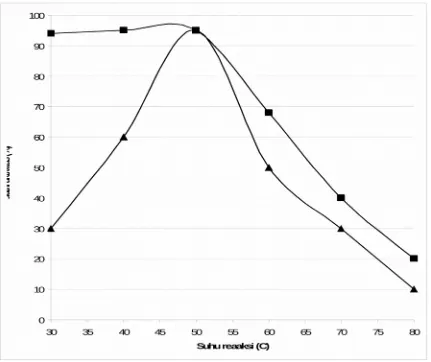
tidak, Pada penelitian ini diharapkan enzim phytase yang dihasilkan termostabil minimal sampai pada suhu 65◦C yang dapat tahan pada proses pelleting. Pada Gambar 3, dapat dilihat bahwa kedua kapang ini mempunyai aktivitas optimum pada suhu 50◦C, dimana phytase yang dihasilkan kapang Fusarium verticillioides mempunyai aktivitas lebih tinggi 1.5 kali dibandingkan dengan phytase yang dihasilkan Rhizoctonia sp. Pada suhu 60◦C phytase dari Fusarium verticillioides masih mempunyai aktivitas sekitar 60%. Penelitian yang sama juga telah dilaporkan untuk beberapa phytase yang berasal dari mikroba (Konietzny and Greiner, 2002) dengan optimum temperatur and within the optimum temperatur 45–55 ◦C ditentukan untuk pengkuran beberapa produk phytase (Boyce and Walsh, 2006).
Gambar 3. Penentuan suhu fermentasi kapang Rhizoctonia sp.& Fusarium verticillioides
dalam memproduksi phytase pada medium yang mengandung asam phytat sebagai induser
pH awal fermentasi
Gambar 4.Penentuan pH fermentasi kapang Rhizoctonia sp.& Fusarium verticillioides
dalam memproduksi phytase pada medium yang mengandung asam phytat sebagai induser
2) Optimalisasi optimum kondisi hidrolisis enzim phytase (pH, suhu, substrat)
Setelah diketahui suhu, lama dan pH fermentasi optimum untuk memproduksi enzim phytase maka enzim phytase selanjutnya di produksi dalam fermentor volume 10 liter dengan volume enzim 5 liter. Setelah 10 kali produksi maka diperoleh 50 liter enzim phytase kasar. Untuk pengujian termostabiliti, acid stabiliti dan substrate spesifik untuk enzim phytase yang diproduksi maka enzim phytase kasar harus dimurnikan terlebih dahulu menggunakan pegendapan dengan ammonium sulpat dengan kejenuhan antara 10-80%, sehingga diperoleh enzim phyase setengah murni (partial purified) yang aktivitasnya jauh lebih tinggi dibandingkan phytase kasar, karena protein lainya sudah tidak ada lagi dalam phytase. Phytase setengah murni kemudian diukur termostabiliti, acid stabiliti dan substrate spesifik.
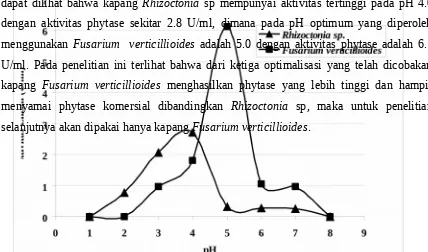
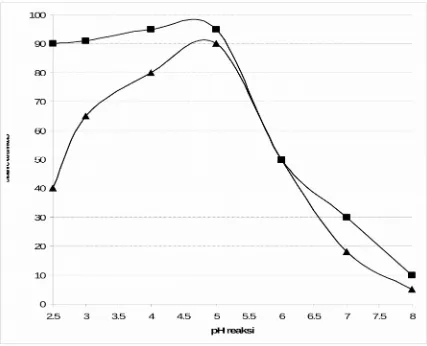
Partial purifikasi phytase meujukan pH maksimum 5.0 dengan pH stabilitas 2.5 – 5.0 yang dapat dilihat pada Gambar 5 dibawah ini. Pada pH 6.0 aktivitas hanya tinggal 50%, apabila pH terus ditingkatkan maka menjadi 7.0 aktivitas hanya tinggal 30%. Menurut Casey and Walsh (2004) menyatakan bahwa rang pH yang dapat memberikan fasilitas yang baik asam phytat dapat di degradasi dengan baik adalah dalam saluran saliva (pH 5.0 - 7.0), stomach/lambung (pH 3.5 - 4.5) karena adanya stimulasi sekresi asam, dan pada bahagian atas duodenum (pH 4.0 – 6.0).
Phytase yang dihasilkan pada penelitian ini hampir menyamai pH phytase komersial yang sangat cocok untuk diaplikasikan pada pakan ternak. Partial purifikasi phytase juga menunjukan stabilitas yang sangat signifikan pada pH rendah, dimana tidak terdapat kehilangan aktivitas bila diinkubasi pada pH 2.5 selama 6.5 jam.
Temperatur aktivitas dan stabilitas
Gambar 5.pH aktivitas dan stabilitas partial purifikasi phytase yang direaksikan pada pH 2.5 – 8.0
Substrat spesifisitas
myoinositol monopospat atau myoinositol. Phytase dengan substrat spesifisitas yang sempit mempunyai spesifik aktivitas khusus pada myoinositol 1-monopospat dan menghasilkan myoinositol tri dan bipospat yang terakumulasi selama degradasi oleh phytase.
Gambar 6.Temperatur aktivitas dan stabilitas partial purifikasi phytase yang direaksikan pada suhu 30 – 80 ◦C
terjadinya akumulasi intermediet yang sangat diinginkan untuk dapat diaplikasikan dalam pakan ternak.
3). Mencari metoda degradasi asam phytat yang tepat pada bahan pakan (jagung, dedak, kedelai dan bungkil kelapa) dan pakan komersial untuk tujua aplikasi
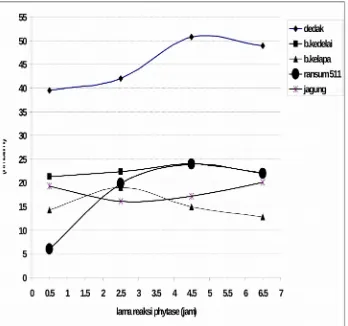
[image:12.612.93.524.255.669.2]Pengujian kemampuan phytase yag dihasilkan dalam penelitian dilanjutkan untuk mereaksikan partial purifikasi phytase yang ditemukan dengan unit tertentu dengan beberapa bahan pakan dan pakan komersial 511 pada pH 2.5 dengan lama reaksi berbeda pada suhu 50◦C. Pada Gambar 8, dapat dilihat bahwa dedak padi lebih baik didegradsi dibandingkan bahan pakan lain dan pakan komersial 511.
Banyak faktor yang dapat mempengaruhi tingkat hidrolisi asam phytat oleh enzim phytase, disamping suhu, pH, lama reaksi jenis bahan yang didegradasi juga sangat menentukan. Dedak padi mempunyai kandungan asam phytat paling tinggi dibandingkan bahan – bahan lain. Pada Gambar 8 dapat dilihat bahwa lama reaksi memberikan pengaruh yang sangat nyata pada pospat an organik yang di bebaskan. Profil kerja enzim memperlihatkan kurva kuadratik seiring dengan peningkatan waktu reaksi. Hal yang sama juga ditemukan oleh Wu et al., (2004); bahwa suplementasi ransum berbasis gandum dengan phytase menghasilkan tingkat hidrolisis P-phytat meningkat mengikuti pola kuadratik. Pada semua bahan yang diujikan dicapai optimal pospat yang di bebaskan adalah pada lama reaksi 4.5 jam. Yang cukup menarik pada penelitian ini adalah tingkat kekuatan hidrolisis berbeda sesuai dengan jenis bahan nya, setelah dedak padi, bungkil kedelai dan ransum 511 adalah pada urutan kedua dan ketiga, walaupun pada 0.5 jam pertama reaksi pospat yang dibebaskan ransum 511 sangat rendah hal ini diduga adanya mineral mikro dan makro yang ada dalam ransum dapat menjadi inhibitor, namum pada reaksi 2.5 jam pengaruh tersebut dapat ditolerir.
Hidrolisis asam phytat oleh enzim phytase juga dapa dipengaruhi konsentrasi P-phytat, konsentrasi enzim, sumber phytase dan ada/tidak adanya phytase endogenous dalam bahan pakan atau ransum. Pada gambar 8 dapat dilihat bahwa degradasi asam phytat paling rendah adalah pada jagung dan bungkil kelapa. Hal yang sama juga dilaporkan oleh Zyla et al ., (2000) menyatakan phytase secara nyata dapat membebaskan lebih banyak p-phytat pada ransom yang berbasis gandum dibandingkan ransom yang berbasis jagung 911.0 dan 7.8%). Wu et al ., (2003) juga menambahkan bahwa secara umum hasil penelitian in vitro diperoleh respon penambahan phytase tergantung pada ransom berbasis bijian, ransum yang berbasisi jagung umumya mempunyai tingkat responding lebih kecil dibandingkan ransum berbasis gandum.
KESIMPULAN
Penelitian yang telah dilakukan selama 10 bulan dapat disimpulkan bawa kapang
Fusarium verticillioides mampu menghasilkan enzim phyase yang dapat diaplikasikan
Berdasarkan suhu pertumbuhan kapang ini sudah tergolong kapang yang berjenis termopilik. Karakterisasi partial purifikasi phytase menunjukan bahwa enzim yang dihasilkan menpunyai pH stabilitas 5.0 dan pH stabilitas 2.5 -5.0, serta suhu stabilitas 50◦C dan suhu stabilitas 30 - 60◦C . Substrat spesifisitas enzim ini tergolong pada substrat spesifisitas yang luas yang dapat mendegradasi asam phyatat yang terdapat pada bahan pakan seperti dedak, jagung, bungkil kedelai dan bungkil kelapa.
[image:14.612.94.442.322.648.2]Aplikasi partial purifikasi phytase pada berbagai bahan pakan dan rasum komersial menunjukan bahwa pospat an organik yang dibebaskan tertinggi dihasilkan oleh dedak padi, diikuti oleh bunkil kedelai, ransum 511, bungkil kelapa dan jagung. Bervariasinya tingkat hidrolisis asam phytat oleh enzim phytase ternyata dipengaruhi oleh berbagai faktor tidak hanya suhu. pH dan lama reaksi tetapi juga jenis enzim dan subsrat yang digunakan.
DAFTAR PUSTAKA
AOAC. 2000. Official Methods of Analisis Associatiation of Agriculture Chemist Virginia,D.C., U.S.A, Chapter 4 p: 1-40
Anno, T., Nakanishi, K,. Matsuno, R., Kamikubo, T. (1995) Ezymatic elimination of of phytate in soybean milk. J. Japan Soc. Food Sci. Technol. 32, 174-180.
Billington, D. C. (1993) The Inositol Phosphates. Chemical Synthesis and Biological Significance. Verlag Chemie, Weinheim.
Blank, G. E., Pletcher, J. and Sax, M. (1971) The structure of myo-inositol hexaphosphate, dodecasodium salt octama-contahydrate: a single crystal x-ray analysis. Biochem. Biophys. Res. Commun. 44, 319-325.
Cheryan, M. (1980) Phytic acid interactions in food systems. CRC Crit. Rev. Food Sci. Nutr. 13,297-335.
Costello, A. J. R., Glonek, T. and Myers, T. C(1976) Phosporus-31 nuclear magnetic resonance – pH titration of hexaphosphate (phytic acid). Carbohydr. Res. 46, 156-171.
Craxton, A, Caffrey, J.J., Burkhart, W., Safrany, S.T. and Shears, S. B. (1997) Molecular cloning and expression of a rat hepatic multiple inositol polyphosphate phosphatase. Biochem, J. 328, 75-81.
Davies, N.T. (1982) Effects of phytic acid on mineral ovailability. In Dietary Fiber in Health and Disease. Vahoung, G. V. and Kritchevsky, D., Eds., Plenum Press, New York.
De Rham, O. and Jost, T. (1979) Phytate protein interactions in soybean extracts and lowphytate soy protein products. J. Food Sci. 44, 596-600.
Deshpande, S. S. and Cheryan, M. (1984) Effect of phytic acid, divalent cations, and their interactions on alpha-amylase activity. J. Food Sci. 49, 516-524.
Dvorakova, J. (1998) Phytase: sources, Preparation and Exploitation. Folia Microbiol. 43, 323-338.
Fretzdorff, B, Brummer, J. M. Rochen, W., Greiner, R., Konietzny, U. and Jany, K. D. (1995) Reduktion des Phytinsaure-Gehaites bei der Herstellung von Backwaren und Getreidenahmitteln. AID-Verhraucherdienst 40, 12-20.
Graf, E., Empson, K. and Eaton, J. W. (1987) Phytic acid. A natural antioxidant. J. Biol. Chem, 262, 11647-11651.
Greaves, M. P., Anderson, G. and Webley, D. M. (1967) The hydrolysis of inositol phosphates by Aerobacter aerogenes. Biochim. Biophys. Acta 132, 412-418.
Greiner, R., Konietzny, U. and Jany, K. D. (1993) purification and characterization of two phytases from Escherichia coli. Arch. Biochem. Biophys. 303, 107-113.
Greiner, R., Haller, E., Konietzny, U. and Jany, K.D. (1997) purification and characterization of a phytase from Klebsiella terrigena. Arch. Biochem. Biophys. 341, 201-206.
Howson, S. J. and Davis, R. J. (1983) Production of phytate-hydrolysing enzyme by fungi. Enzyme Microbiol. Technol, 5, 377-382.
Inagawa, J., Kiyosawa, I. and Nagasawa, T. (1987) effect of phytic acid on the hydrolysis of lactose with beta-galactosidase. Agric. Biol. Chem. 51, 3027-3032.
IUPAC-IUB (Commission on Biochemical Nomenclature) (1977) Nomenclature of phosphorus containing compounds of biochemical importance. Eur. J. Biochem. 79, 1-9.
Irving, G. C. J. and Cosgrove, D. J. (1971) Inositol phosphate phosphatase of microbial origin. Observations on the nature of the active center of a bacterial (Pseudomonas sp.) phytase. Austral. J. biol, sci. 24, 1559-1564.
Johnson, L. and Tate, M. (1969) the structure of myo-inositol penthaphosphates. Ann. A.N. acad. Sci. 165, 526-535.
Knuckles B.E., Betschart A.A. (1987): Effect of phytate and other myo-inositol esters on α-amylase digestion of starch. J. Food Sci., 52, 719–721.
Kim, Y. O., Kim, H. K., Bae, K. S., Yu, J. H. and Oh, T. K. (1998a) purification and properties of a thermostable phytase from Bacillus sp. DS11. Enzyme Microbiol. Technol. 22, 2-7.
Laboure, A. M., Gagnon, J. and Lescure, A. M. (1983) Purification and characterization of a phytase (myo-inositol hexakisphosphate phosphohydrolase) accumulated in maize (Zea mays) seedlings during germination. Biochem. J. 295, 413-419.
Laumen, K. and ghisalba, O. (1994) preparative scale chemo-enzymatic synthesis of optically pure D-myo-inositol 1-phosphate. Biosci, Biotech. Biochem. 58, 2046-2049.
Liu, B. L., Rafiq, A., Tzeng, Y. M. and Rob, A. (1998). The induction and characterization of phytase and beyond. Enzyme Microbiol. Technol. 22, 415-424. Maugenest, S., Martinez, I., Godin, B., Perez, P. and Lescure, A. M. (1999) Structure of
two maize phytase genes and their spatio-temporal expression during seedling development. Plant mol. Biol. 39, 503-514.
Mochizuki, D. and Takahashi, H. (1999) Method for producing phytase. Patent application EP 0931837-A.
Nayini, N. R. and Markakis, P. (1984) The phytase of yeast. Food Sci. Technol. 17, 126-132.
Nayini, N. R. and markakis, P. (1986) phytic Acid: Chemistry and Applications.
Pallauf,J. and Rimbach, G. (1996) Nutritional significance of phytic acid and phytase. Arch. Anim. Nutr. 50, 301-319.
Powar, V.K. and Jagannathan, V. (1982) Purfication and properties of phytate-specific phosphatase from Bacillus subtilis. J. Bacteriol. 151, 1102-1108.
Ravindran, V., S. Cabahug, G. Ravindran and W.L. Bryden, 1999. Influence of microbial phytase on apparent ileal amino acid digestibility of feedstuffsfor broilers. Poult. Sci., 78: 699-706.
Ravindran, V., P.H. Selle and W.L. Bryden, 2000. Role of microbial phytase in poultry and pig nutrition. Proceedings of the Third European Feed EnzymeSymposium, Noordwijkerhout, the Netherlands.
Rosen, G., 2002. Microbial phytase in broiler nutrition. In: Recent Advances in Animal Nutrition (Eds. Garnsworthy, P.C. and Wiseman, J.), Nottingham University Press, Nottingham, UK. pp: 105-117.
Reddy, N. R., Pierson, M. D., Sathe, S. K. and Salunkhe, D. K. (1989) Phytates is cereals and legumes. CRC Press, Inc., Boca Raton, Fla.
Sandberg A.S and Svanberg .U. 1991. Phytate hydrolysis by phytase in cereals;effect on in vitro estimation of iron availability. Journal of Food Science 56 (5) 1330-1333. Selle P.H., and V. Ravindran,2007. Microbial phytase in poultry nutrition, Anim. Feed
Scott, J.J. (1991) Alkaline phytase activity in nonionic detergent extracts of legume seeds. Plant physiol. 95, 1298-1301.
Shah, V.and Parekh, L.J. (1990) Phytase from Klebsiella sp. No. PG-2: Purification and properties. Indian J. Biochem. Biophys. 27, 98-102.
Shieh, T. R. and Ware, J. H. (1968) Survey of microorganisms for the production of extracellular phytase. Appl. Microbiol. 16, 1348-1351.
Shieh, T.R., Wodzinski, R. J. and Ware, J.H. (1969) Regulation of the formation of acid phosphatase by inorganic phosphate in Aspergillus ficuum. J. Bacteriol. 100, 1161-1165.
Shimizu, M. (1992) Purfication and characterization of phytase from Bacillus subtilis (natto) N-77. Biosci. Biotechnol. Biochem. 56, 1266-1269.
Simell, M., Turunen, M., Piironen, J. and Vaara, T. feed and food applications of phytase. Lecture at 3rd Meet. Industrial Applications of Enzymes, Barcelona, Spain. 1989. Singh, M. and Krikorian, A. D. (1982) inhibiton of trypsin activity in vivo by phytate. J.
Agric. Food Chem. 30, 799-805.
Tambe, S. M., Kaklij. G. S., Kelkar, S. M. and Parekh, L. J. (1994) Two distinct molecular forms of phytase from Klebsiella aerogenes: evidence for unusually small active enzyme peptide. J. Ferment. Bioeng. 77, 23-27.
Ullah, A. H. J. (1988a) Aspergillus ficuum phytase: partial primary structure, substrate selectivity, and kinetic characterization. Prep. Biochem. 18, 459-471.
Volfova, O., Dvorakova, J., Hanzlikova, A. and Jandera, A. (1994) Phytase from Aspergillus niger. Folia Microbiol. 39, 481-484.
Wodzinski, R. J. and Ullah, A. H. J. (1996) Phytase. Adv. Appl. Microbiol. 42, 263-302. Wyss, M., Pasamontes, L., Friedlein, A., Remy, R., Tessier, M., Kronenberger, A.,
Middendorf, A., Lehmann, M., Shnoebelen, L., Rothtlisberger, U., Kusznir, E., Wahl, G., Muller, F., Lahm, H. W., Vogel, K., and van Loon, A. P. G. M. (1999a) biophysical characterization of fungal phytases (myo-inositol hexakisphosphate phosphohydrolases): molecular size, glycosylation pattern, and engineering of proteolytic resistance. Appl. Environ. Microbiol. 65, 359-366.
Wu, Y.B., V. Ravindran, D.G. Thomas, B.J. Birtles and W.H. Hendriks, 2004. Influence of phytase and xylanase, individually or in combination, on the performance, apparent metabolisable energy, digestive tract measurements and gut morphology in broilers fed wheat-based diets containing adequate level of phosphorus. Br. Poult. Sci., 45: 76-84.
Yetti.M. 1994.Kandungan asam fitat, enzim fitase dan ketersediaan mineral Ca dan Fe pada proses pembuatan tahu menggunakan koagulan, GDL, CaSo4 dan asam. Thesis pada Fakultas Ilmu pangan, IPB. Bogor
_______2001. Isolation and purification of raw satarch degrading enzyme from
Acremonium endophytic fungus and its application for glucose production.
Disertation of Doctoral at University Putra Malaysia, Malaysia
________ 2003. Penampilan produksi ternak domba menggunakan pakan berserat tinggi yang difermentasi dan disuplementasi dengan enzim sellulase yang dihasilkan oleh kapang endopitik. Laporan HB X/II
Yoon, S. J., Choi, Y. J., Min, H. K., Cho, K. K., Kim, J. W., Lee, S. C. and Jung, Y. H. (1996) Isolation and identification of phytase-producing bacterium, Enterobacter sp. 4, and enzymatic properties of phytase enzyme. Enzyme Microbiol. Technol. 18, 449-454.
Zyla, K., J. Koreleski, S. Swiatkiewicz, A. Wikiera, M. Kujawski, J. Piironen and D.R. Ledoux, 2000. Effects of phosphorolytic and cell wall-degrading enzymes on performance of growing broilers fed wheat-based diets containing different calcium