SKRIPSI
Untuk Memenuhi Persyaratan Memperoleh Gelar Sarjana Kedokteran
ATMASARI PRATIWI
G0006182
FAKULTAS KEDOKTERAN
PENGESAHAN SKRIPSI
Skripsi dengan judul : Pengaruh Pemberian Ekstrak Biji Pepaya (Carica papaya) Peroral terhadap Jumlah Spermatid Mencit (Mus musculus)
Atmasari Pratiwi, NIM/Semester : G0006182/VII, Tahun : 2010
Telah diuji dan sudah disahkan di hadapan Dewan Penguji Skripsi Fakultas Kedokteran Universitas Sebelas Maret
Pada Hari Kamis , Tanggal 18 Maret 2010
Pembimbing Utama
Nama : E. Listyaningsih S, dr., M.Kes
NIP : 196408101998022001 ... Pembimbing Pendamping
Nama : H. Zainal Abidin, dr., M.Kes
NIP : 194602021976101001 ... Penguji Utama
Nama : Isdaryanto, dr., MARS
NIP : 195003121976101001 ………
Anggota Penguji
Nama : Bagus Wicaksono, drs., M.Si
NIP : 196209011989031003 ...
Surakarta, ...
Ketua Tim Skripsi Dekan FK UNS
Sri Wahjono, dr., Mkes Prof. Dr. A. A. Subijanto, dr., MS. NIP 194508241973101001 NIP 194811071973101003
PERNYATAAN
Dengan ini menyatakan bahwa dalam skripsi ini tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu Perguruan Tinggi, dan sepanjang pengetahuan saya juga tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah dan disebutkan dalam daftar pustaka.
Surakarta, Juni 2010
Atmasari Pratiwi NIM.G0006182
ABSTRAK
Atmasari Pratiwi, G0006182, 2010, Pengaruh Pemberian Ekstrak Biji Pepaya (Carica papaya) Peroral Terhadap Jumlah Spermatid Testus Mencit (Mus musculus). Fakultas Kedokteran Universitas Sebalas Maret Surakarta.
Tujuan penelitian : Indonesia dengan jumlah penduduk yang tinggi, usaha menemukan obat kontrasepsi pria yang berasal dari tanaman perlu dikembangkan, sehingga peran aktif pria dalam KB seimbang dengan wanita. Beberapa tanaman diantaranya adalah pepaya (Carica papaya), terutama bijinya, mengandung katekolamin yang bermanfaat sebagai bahan baku kontrasepsi. Penelitian ini bertujuan untuk mengetahui apakah pemberian ekstrak biji pepaya (Carica papaya) peroral dapat mempengaruhi jumlah sel spermatid mencit.
Metode penelitian : Jenis penelitian yang digunakan yaitu eksperimental laboratorik dengan rancangan penelitian the post test only controled group design. Sampel yang digunakan adalah 27 ekor mencit jantan, galur Swiss Webster, dipilih secara random sampling, dibagi tiga kelompok, yaitu kelompok kontrol (K) diberi diet standar, kelompok PI diberi diet standar dan ekstrak biji pepaya dosis 10mg/ekor/hari, kelompok PII diberi diet standard dan ekstrak biji papaya dosis 30mg/ekor/hari. Perlakuan diberikan selama 10 hari, pada hari ke 11 testis kanan dan kiri diambil untuk dibuat preparat dengan pengecatan HE. Data yang diperoleh dianalisis menggunakan uji anova.
Hasil penelitian : Penurunan jumlah rata-rata spermatid mencit pada kelompok perlakuan I dan kelompok perlakuan II adalah 10.773% dan 18.957%. Analisis dengan uji anova antar ketiga kelompok didapatkan nilai significancy 0.025. Kemudian setelah dilakukan LSD (Least Significant Difference) didapatkan nilai significancy 0.108 (p>0.05) antara kelompok kontrol dengan kelompok perlakuan I, 0.007 (p<0.05) antara kelompok kontrol dengan kelompok perlakuan II, dan 0.217 (p>0.05) antara kelompok perlakuan I dan kelompok perlakuan II.
Simpulan penelitian : Dapat disimpulkan bahwa pemberian ekstrak biji pepaya dengan dosis 30mg/ekor/hari dapat menyebabkan penurunan jumlah sel spermatid testis mencit.
ABSTRACT
Atmasari Pratiwi G 0006182, 2010. The Effect of Intragastric Administration Extract of The Papaya Seed (Carica papaya) on The Number of Spermatid Cells of Mice`s (Mus musculus) Testicle. Medicine Faculty of Sebelas Maret University, Surakarta.
Objective : Indonesia with high of population, effort to find a male contraceptive drug derived from plants should be developed, so that the active role of men in family planning balanced with the woman. Some plants such as papaya, especially seeds, containing catecholamines are useful as a raw material of contraception. This study aimed to determine whether the extract of papaya seeds (Carica papaya) peroral can affect the number of spermatid cells of mice.
Methods : The research is the laboratory experimental research design with the post test only design controled group. The samples used were 27 male mice, Swiss Webster, selected by random sampling, divided into three groups: control group (K) were given a standard diet, PI group was given standard diet and papaya seed extract doses 10mg/ekor/hari, PII groups were given standard diet and papaya seed extract 30mg/ekor/hari dose. Treatment was given for 10 days, on day 11 right and left testis was taken for the preparations made by HE staining. The data obtained were analyzed using anova test.
Results : Decrease in the average number of spermatids of mice in treatment groups I and II treated groups, respectively, are 10 773% and 18 957%. Analysis with anova test between the three groups got value significancy 0025. Then after the LSD (Least Significant Difference) showed the value significancy 0108 (p> 0.05) between the control group with treatment group I, 0007 (p <0.05) between the control group to group II, and 0217 (p> 0.05) between treatment groups treatment groups I and II.
Conclusion : This review has shown that that intragastric administration of extraxt of papaya`s seed with dosage 30mg/tail/day showed a potential activity to decrease the number of spermatid cells of mice`s testicle.
Keywords : extract of the papaya seeds, catecholamine, the decrease of spermatid cells.
KATA PENGANTAR
Puji dan syukur ke hadirat Allah SWT atas limpahan rahmat dan hidayahNya, sehingga peneliti dapat menyelesaikan skripsi berjudul “Pengaruh Pemberian Ekstrak Biji Pepaya (Carica papaya) Peroral terhadap Jumlah Sel Spermatid Testis Mencit (Mus musculus)”yang merupakan salah satu syarat memperoleh gelar kesarjanaan di Fakultas Kedokteran Universitas Sebelas Maret Surakarta.
Penyusunan skripsi ini tidak lepas atas dukungan yang diberikan oleh berbagai pihak. Untuk itu peneliti mengucapkan terima kasih kepada:
1. Prof. Dr. A. A. Subiyanto, dr., MS. Selaku Dekan Fakultas Kedokteran Universitas Sebelas Maret Surakarta.
2. Sri Wahjono, dr., MKes. Selaku Ketua Tim Skripsi beserta seluruh staf skripsi yang telah memberikan pengarahan dan bantuan.
3. Endang Listyaningsih S, dr., M.Kes, selaku Pembimbing Utama yang telah memberikan bimbingan, nasehat, pengarahan, dan motivasi bagi peneliti.
4. H. Zainal Abidin, dr., M.Kes, selaku Pembimbing Pendamping yang telah memberikan bimbingan, nasehat, pengarahan, dan motivasi bagi peneliti.
5. Isdaryanto, dr., MARS, selaku Penguji Utama yang telah menguji skripsi ini.
6. Bagus Wicaksono, drs., M.Si, selaku Anggota Penguji yang telah menguji skripsi ini. 7. Bagian skripsi Fakultas Kedokteran UNS, yang telah berkenan memberikan bimbingan
dalam penyusunan skripsi ini..
8. Segenap Staf Laboratorium Histologi Kedokteran UNS, Surakarta yang telah membantu dalam penelitian skripsi ini.
9. Orangtuaku tercinta beserta kakakku tersayang atas doa dan dukungannya.
10. Teman saya Mas Gigih, Marisa, Sita, Indah, Qara, Handayu, Alfonsus, dan teman-teman yang lain.
Akhirnya, peneliti berharap semoga skripsi ini dapat menjadi sumbangan pemikiran dan bermanfaat untuk semua pihak, bagi ilmu kedokteran pada umumnya dan bagi pembaca pada khususnya.
Surakarta, Juni 2010
DAFTAR ISI
KATA PENGANTAR ... vi
DAFTAR ISI ... vii
DAFTAR GAMBAR ... ix
DAFTAR TABEL ... x
DAFTAR LAMPIRAN ... xi
BAB I PENDAHULUAN... 1
A. Latar Belakang Masalah... 1
B. Perumusan Masalah ... 2
C. Tujuan Penelitian ... 2
D. Manfaat Penelitian ... 3
BAB II LANDASAN TEORI ... 4
A. Tinjauan Pustaka ... 4
B. Kerangka Pemikiran ... 19
C. Hipotesis ... 20
BAB III METODE PENELITIAN ... 21
A. Jenis Penelitian ... 21
B. Lokasi Penelitian ... 21
C. Subjek Penelitian ... 21
F. Identifikasi Variabel ... 23
G. Definisi Operasional Variabel ... 23
H. Instrumentasi dan Bahan Penelitian ... 25
I. Cara Kerja ... 26
J. Tekhnik Analisis Data ... 27
BAB IV HASIL PENELITIAN ... 28
A. Hasil Penelitian ... 28
B. Analisis Data ... 29
BAB V PEMBAHASAN ... 32
BAB VI SIMPULAN DAN SARAN ... 35
A. Simpulan ... 35
B. Saran ... 35
DAFTAR PUSTAKA ... 37 LAMPIRAN
DAFTAR GAMBAR
Gambar 1. Grafik jumlah rata-rata sel spermatid testis kiri dan testis kanan dari masing-masing kelompok
Gambar 2. Preparat kelompok K perbesaran 400x dengan pengecatan HE Gambar 3. Preparat kelompok PI perbesaran 400x dengan pengecatan HE Gambar 4. Preparat kelompok PII perbesaran 400x dengan pengecatan HE
DAFTAR TABEL
Tabel 1. Pembagian kerja yang diperantai lewat reseptor adrenergik Tabel 2. Jumlah rata-rata sel spermatid dari masing-masing kelompok Tabel 3. Hasil uji Anova searah antara ketiga kelompok untuk
Jumlah rata-rata sel spermatid
Tabel 4. Hasil uji LSD (Least Significant Difference) antara dua kelompok untuk rata-rata jumlah sel spermatid Tabel 5. Jumlah sel spermatid testis kiri dan kanan
untuk kelompok kontrol
Tabel 6. Jumlah sel spermatid testis kiri dan kanan
untuk kelompok perlakuan I
Tabel 7. Jumlah sel spermatid testis kiri dan kanan
untuk kelompok perlakuan II
Tabel 8. Distribusi F untuk α=0,05 ( Saleh, 2001)
Tabel 9. Konversi Dosis Manusia dan Hewan (Ngatidjan, 1991) Tabel 10. Volume Maksimal Bahan Uji pada Pemberian
DAFTAR LAMPIRAN
Lampiran 1. Surat ijin peminjaman alat ekstraksi
Lampiran 2. Surat keterangan telah melaksanakan pembuatan ekstrak biji pepaya (Carica papaya) di Laboratorium Galenika B2P2TO2T Tawangmangu Lampiran 3. Data hasil pengamatan mikroskopis
Lampiran 4. Hasil analisis data SPSS 15.0 for windows one way Anova dan LSD
Lampiran 5. Tabel distribusi F untuk α=0,05 (Saleh, 2001)
Lampiran 6. Konversi Dosis Manusia dan Hewan (Ngatidjan, 1991)
Lampiran 7. Volume Maksimal Bahan Uji pada Pemberian secara Oral (Ngatidjan, 1991)
Lampiran 8. Cara membuat ekstrak bici pepaya (cara maserasi) Lampiran 9. Foto-foto preparat
BAB I PENDAHULUAN
B. Latar Belakang Masalah
Indonesia merupakan negara dengan penduduk terbanyak keempat di dunia setelah RRC, INDIA, dan Amerika Serikat, yaitu sekitar 200 juta jiwa pada tahun 2000. Untuk menekan dan mengendalikan jumlah penduduk, maka pemerintah telah menggalakkan program Keluarga Berencana (KB) bagi pasangan usia subur. Untuk menyukseskan program tersebut diperlukan peran aktif pasangan suami istri tersebut. Pada saat ini, individu yang ikut serta dalam melaksanakan program KB mayoritas adalah para istri. Rendahnya keikutsertaan peranan suami dikarenakan masih terbatasnya, pilihan kontrasepsi untuk pria yang masih belum memberikan hasil yang memuaskan (Yurnardi dan Puji, 2001). Kontrasepsi pria yang dipakai sampai saat ini, yaitu kondom, coitus interruptus, vasektomi dan hormonal, ternyata mengandung berbagai kelemahan karena efek sampingnya dan belum seratus persen dapat mencegah kehamilan. Sampai saat ini masih terus dilakukan upaya untuk mencari metode kontrasepsi pria yang efektif, aman dan reversibel (Siri dan Sulaiman, 2002).
Indonesia dengan jumlah penduduk yang tinggi, usaha menemukan obat kontrasepsi pria yang berasal dari tanaman perlu dikembangkan, sehingga peran aktif pria dalam KB seimbang dengan wanita (Sudarsono, 2003). Penggunaan jamu atau tumbuhan obat sebagai kontrasepsi (KB) telah lama dikenal masyarakat terutama di beberapa daerah di Indonesia (Dian, 1997).
Indonesia kaya akan sumber tanaman obat. Hal ini menyebabkan Indonesia berpotensi sebagai penyediaan sumber bahan obat kontrasepsi yang berasal dari tanaman. Beberapa diantaranya adalah Carica papaya (pepaya), terutama bijinya, mengandung katekolamin yang bermanfaat sebagai bahan baku kontrasepsi. Selain itu biji pepaya juga mengandung enzim proteolitik yang dapat menurunkan viskositas semen (Raji dan Morakinyo, 2005).
Penelitian ilmiah secara spesifik mengenai ekstrak biji pepaya di Indonesia masih sangat sedikit. Hal inilah yang menarik peneliti untuk mengetahui lebih jauh lagi tentang efek ekstrak biji pepaya terhadap tubuh, terutama pengaruhnya terhadap testis. Peneliti ingin mengetahui sejauh mana ekstrak biji pepaya dapat mempengaruhi jumlah sel spermatid testis.
C. Perumusan Masalah.
Apakah pemberian ekstrak biji pepaya (Carica papaya) peroral dapat mempengaruhi jumlah sel spermatid testis mencit?
D. Tujuan Penelitian.
Untuk mengetahui apakah pemberian ekstrak biji pepaya (Carica papaya) peroral dapat mempengaruhi jumlah sel spermatid testis mencit.
E. Manfaat Penelitian. 1. Manfaat teoritits
Memberikan bukti ilmiah mengenai pengaruh pemberian ekstrak biji pepaya (Carica papaya) peroral terhadap jumlah sel spermatid testis mencit. 2. Manfaat aplikatif
Hasil penelitian ini diharapkan dapat mendorong peneliti lain yang lebih jauh lagi dalam hal meneliti manfaat ekstrak biji pepaya (Carica papaya) secara ilmiah, terutama sebagai obat antifertilitas.
BAB II
LANDASAN TEORI
B. Tinjauan Pustaka 1. Testis
Testis merupakan kelenjar ganda, karena secara fungsional bersifat eksokrin dan juga endokrin. Bagian eksokrin terutama menghasilkan sel kelamin (sel benih), sehingga testis dianggap sebagai kelenjar sitogenik. Bagian endokrin menghasilkan sekret internal yang dilepaskan oleh sel-sel khusus (Leeson et al., 1996). Testis bagian dalam terbagi atas lobulus yang terdiri dari tubulus seminiferus, sel-sel Sertoli dan sel-sel Leydig (Price dan Wilson, 1995).
Testis dikelilingi oleh simpai tebal jaringan ikat kolagen, yaitu tunika albuginea. Tunika albuginea menebal pada permukaan posterior testis membentuk mediastinum testis, dari situ terjulur septa fibrosa kedalam kelenjar, membaginya menjadi lebih kurang 250 kompartemen piramidal yang disebut lobulus testis. Setiap lobulus dihuni oleh 1-4 tubulus seminiferus, terpendam dalam dasar jaringan ikat longgar yang banyak pembuluh darah dan limfe, saraf, dan sel interstisial (Leydig). Sel interstisial mengsekresikan androgen testis (Junqueira et al., 1997). Produksi sperma, atau spermatogenesis, terjadi pada tubulus seminiferus (Price dan Wilson, 1995).
a. Tubulus Seminiferus
Tubulus seminiferus sangat berkelok dengan garis tengah kurang lebih 0,2 mm dan panjang 30 sampai 70 cm. Tubulus berakhir sebagi ujung bebas yang buntu atau beranastomosis dengan tubulus-tubulus didekatnya dari lobulus yang sama atau kadang-kadang dengan tubulus dari lobulus di sebelahnya. Pada puncak lobulus, tiap tubulus tidak berkelok-kelok lagi dan menjadi lurus dan disebut sebagai tubulus rectus. Tubulus seminiferus dibatasi oleh suatu epitel germinal kompleks atau epitel seminiferus, yang merupakan modifikasi epitel berlapis kuboid. Epitel seminiferus terdiri atas 2 kategori sel yang berbeda, yaitu sel untuk penyokong dan nutrisi serta sel spermatogenik atau sel benih. Sel-sel spermatogenik membentuk bagian terbesar dari lapisan epitel dan melalui proliferasi serta diferensiasi yang kompleks akan menghasilkan spermatozoa (Leeson et al., 1996).
b. Epitel Seminiferus
Epitel seminiferus merupakan lapisan kontinyu sel Sertoli dihubungkan oleh kompleks tautan yang mencolok. Ruang antara batas lateral sel-sel Sertoli yang berdekatan mengandung spermatogonia bersandar pada lamina basalis, spermatosit primer, spermatosit sekunder, spermatid dan spermatozoa (Johnson, 1994).
1) Sel Sustentakular Sertoli
Sel-sel penyokong, atau sel sustentakular Sertoli, jumlahnya relatif sedikit dan tersusun sepanjang tubulus pada jarak-jarak yang diatur, diantara sel-sel benih. Sel-sel Sertoli merupakan sel-sel tinggi seperti tiang, dengan dasarnya terletak diatas lamina basal tubulus. Bentuk sel tak teratur, tidak tampak jelas dan sangat kompleks karena kepala spermatozoa yang matang menempati cekungan-cekungan di sitoplasmanya. Inti sel letaknya pada jarak tertentu diatas dasar sel, pucat, bentuknya lonjong dengan sumbu panjangnya tersusun secara radikal. Anak inti sel ini jelas, sehingga mudah membedakannya dari unsur-unsur spermatogenik lain yang terdapat di tubulus. Anak inti tampak mencolok, terdiri atas bagian sentral yang asidofil dan bagian tepi yang lebih sedikit yang bersifat basofil (Leeson et al., 1996).
Sel Sertoli mempunyai banyak fungsi, misalnya (a) penyokong, pelindung, dan pemberi nutrisi bagi sperma (spermatid) yang berkembang; (b) fagositosis sitoplasma yang berlebihan (bahan residu) spermatid yang berkembang (Junqueira, 1997); (c) pembebasan sperma matang, spermiasi ke dalam tubulus seminiferus; (d) penghasil cairan testikular untuk nutrisi dan transpor sperma; dan (e) penghasil Androgen Binding Protein (ABP) dan hormon inhibin (Eroschenko, 2003).
2) Sel Spermatogenik
Sel spermatogenik atau sel benih ini membentuk lapisan epitel berlapis dengan ketebalan 4 sampai 8 sel melapisi tubulus seminiferus. Sel-sel berkembang secara progresif dari daerah basal tubulus ke arah lumen. Proliferasi mendorong sel-sel ke arah lumen, dan yang paling dekat dengan lumen berubah menjadi spermatozoa dan melepaskan diri dari epitel dan terletak bebas dalam lumen. Urutan kejadian disebut sebagai spermatogenesis, termasuk didalamnya kedua proses multiplikasi sel, dan peristiwa reduksi kromosom dari jumlah diploid menjadi haploid dan diferensiasi seluler (spermiogenesis).
3) Spermatogenesis
Spermatogenesis terjadi di dalam semua tubulus seminiferus selama kehidupan seksual aktif, sebagai akibat dari rangsangan oleh hormon gonadotropin hipofisis anterior, dimulai rata-rata pada usia 13 tahun dan berlanjut sepanjang hidup (Guyton dan Hall, 1997). Spermatogenesis merupakan suatu proses yang diduga mengambil waktu 64 hari , dimulai dengan spermatogonia yang letaknya tepat di atas lamina basal. Spermatogonia merupakan satu-satunya sel benih yang ada sampai pada masa pubertas. Tiap spermatogonia mengandung jumlah kromosom diploid dalam inti selnya (44 autosom dan 2 kromosom seks, X Y).
Menurut gambaran inti selnya, pada manusia dikenal tiga jenis spermatogonia:
a) Spermatogonia gelap tipe A, dengan inti sel lonjong berwarna gelap. Sel-sel tersebut membelah diri secara berkala untuk mempertahankan jumlah spermatogonia dan juga untuk membentuk spermatogonia pucat tipe A yang memiliki inti lonjong pucat.
b) Spermatogonia pucat tipe A, membelah diri secara mitosis untuk menjadi spermatogonia tipe B dan juga untuk menjadi spermatogonia pucat tipe A yang lain.
c) Spermatogonia tipe B, mempunyai inti bulat yang mengandung massa kromatin padat yang berhubungan dengan membran inti.
Bila spermatogonia tipe B membelah diri dengan mitosis, sel-sel tersebut menghasilkan sel-sel anak yang seluruhnya berdiferensiasi menjadi spermatosit primer. Sewaktu proses ini berlangsung , sel-sel anak menjauhi lamina basal, bertambah besar dan memperlihatkan perubahan sifat inti sel.
Spermatosit primer merupakan sel benih terbesar yang terdapat dalam tubulus seminiferus. Pembelahan yang terjadi di dalam spermatosit primer adalah pembelahan reduksi, meiosis. Sebagai akibat pembelahan meiosis, 23 kromosom (22 autosom ditambah satu kromosom seks, X atau Y), masuk kedalam setiap sel anak atau spermatosit sekunder. Spermatosit
sekunder kemudian membelah diri secara mitosis dan hasilnya adalah empat sel (spermatid).
Volume spermatosit sekunder kira-kira separuhnya spermatosit primer dan letaknya lebih ke arah lumen. Spermatosit sekunder jarang terlihat dalam potongan melintang tubulus seminiferus, karena umur selnya pendek dan cepat membelah menjadi spermatid. Akibat pembelahan terjadi pengurangan volume sampai separuh volume spermatosit sekunder. Spermatid terletak dekat lumen. Tidak terjadi pembelahan lebih lanjut dan tiap-tiap spermatid mengalami perubahan (transformasi) melalui diferensiasi yang pesat (spermiogenesis) menjadi spermatozoa (Leeson et al., 1996).
4) Spermiogenesis
Spermatid adalah sel yang dihasilkan dari pembelahan spermatosit sekunder. Spermatid dapat dikenali melalui ukurannya yang kecil (garis tengah 7-8 µm), inti dengan daerah-daerah kromatin padat, dan lokasi jukstaluminal di dalam tubulus seminiferus. Spermatid mengalami proses perkembangan rumit yang disebut spermiogenesis, yang mencakup pembentukan akrosom, pemadatan dan pemanjangan inti, pembentukan flagelum, dan kehilangan sebagian besar sitoplasmanya. Hasil akhirnya ialah spermatozoa matang, yang kemudian dilepaskan ke dalam lumen tubulus seminiferus (Junqueira et al., 1997).
Bagan Spermatogenesis
c. Jaringan Interstisial
Jaringan interstisial yang terdapat dalam lobuli testis, terletak diantara tubulus seminiferus. Jaringan interstisial mengandung beberapa serat kolagen, pembuluh darah dan limfe, saraf, dan beberapa sel mesenkin yang belum berkembang. Pembuluh darah dan saraf keluar-masuk melalui mediastinum dan membentuk anyaman sekitar tubulus. Sel-sel Leydig mensekresi
Spermatozoa Spermatogonium Spermatosit sekunder Spermatosit sekunder
Spermatosit primer Spermatosit primer
Spermatosit sekunder Spermatosit sekunder Spermatid Spermatid Spermatid Spermatid Spermatid Spermatid Spermatozoa Spermatozoa Spermatozoa Spermatozoa Spermatozoa Spermatid Spermatozoa Spermatozoa Spermatid
limfosit, sel mast dan sel interstisial Leydig (Johnson, 1994). Sel-sel interstisial Leydig letaknya berkelompok memadat pada daerah segitiga yang terbentuk oleh susunan-susunan tubulus seminiferus. Sel-sel tersebut besar, dengan sitoplasma sering tampak bervakuol pada sajian mikroskop cahaya. Inti selnya mengandung butir-butir kromatin kasar dan anak inti yang jelas (Leeson et al., 1996).
d. Fungsi testis
Testis mempunyai fungsi eksokrin dalam spermatogenesis dan fungsi endokrin untuk mensekresi hormon-hormon seks yang mengendalikan perkembangan dan fungsi seksual. Semua fungsi dari sistem reproduksi pria diatur melalui interaksi hormonal yang kompleks (Price dan Wilson, 1995). Regulasi hormonal dari proses spermatogenesis dan produksi androgen testis mencakup interaksi antara hipotalamus, hipofisis anterior dan testis, yang saling berhubungan yang dinamakan brain-testicular axis (Marieb, 1998).
Fungsi eksokrin testis yang terutama adalah menghasilkan sel-sel kelamin pria. Fungsi tersebut tergantung pada banyak faktor. Follicle Stimulating Hormone (FSH) dari lobus anterior hipofisis merangsang spermatogenesis mamalia. FSH mempengaruhi sel sertoli untuk merangsang sintesis suatu reseptor, protein pengikat androgen, yang akan berikatan dengan testosteron dan disekresikan kedalam lumen tubulus seminiferus. Sel sertoli juga mensintesis hormon testis yang lain yaitu inhibin, yang masuk kedalam
aliran darah serta akan menghambat sekresi FSH oleh hipofisis anterior. Pada manusia spermatogenesis berlangsung terus sepanjang masa kematangan seksual (Leeson et al., 1996).Untuk spermatogenesis di butuhkan suhu yang sesuai. Spermatogenesis memerlukan suhu yang jauh lebih rendah dibandingkan suhu interior badan. Testis normalnya dipertahankan pada suhu sekitar 32oC (Ganong, 1992).
Sekresi endokrin yang utama dari testis adalah testosteron, dihasilkan oleh sel intestisial. Produksi testosteron oleh testis tergantung pada rangsangan Luteinizing Hormon ( LH ). Oleh karena organ sasarannya merupakan sel-sel interstisial maka LH seringkali disebut sebagai Interstitial Cell Stimulating Hormone ( ICSH ). Selain pengaruhnya terhadap spermatogenesis, testosteron mengatur sifat-sifat seks sekunder, rangsang seks dan perkembangan serta pemeliharaan saluran-saluran kelamin dan kelenjar kelamin tambahan (Leeson et al., 1996).
e. Interaksi Hormonal
Bagian utama dari pengaturan fungsi seksual baik pada pria maupun wanita dimulai dengan sekresi gonadotropin releasing hormone (GnRH) oleh hipotalamus. Hormon ini selanjutnya merangsang kelenjar hipofisis anterior untuk menyekresikan dua hormon lain yang disebut hormon-hormon gonadotropin: (1) luteinizing hormone (LH) dan (2) follicle-stimulating
hormone (FSH). Selanjutnya, LH merupakan rangsangan utama untuk sekresi testosteron oleh testis, dan FSH terutama merangsang spermatogenesis.
Testosteron yang disekresikan oleh testis sebagai respons terhadap LH mempunyai efek timbal balik dalam menghentikan sekresi LH oleh hipofisis anterior. Testosteron menghambat sekresi LH dengan bekerja langsung terhadap hipotalamus dalam menurunkan sekresi GnRH. Keadaan ini sebaliknya secara bersamaan menyebabkan penurunan sekresi LH dan FSH oleh hipofisis anterior, dan penurunan LH akan menurunkan sekresi testosteron oleh testis. Testosteron mungkin juga mempunyai efek umpan balik negatif lemah, yang bekerja secara langsung pada hipofisis anterior.
Ketika tubulus seminiferus gagal menghasilkan sperma, sekresi FSH oleh hipofisis anterior meningkat dengan nyata. Sebaliknya, bila spermatogenesis berjalan terlalu cepat, sekresi FSH berkurang. Penyebab efek umpan balik negatif ini pada hipofisis anterior diyakini adalah satu jenis hormon lain yang disekresi oleh sel-sel Sertoli, yaitu inhibin. Hormon ini mempunyai efek langsung yang kuat terhadap kelenjar hipofisis anterior dalam menghambat sekresi FSH dan mungkin satu efek yang ringan terhadap hipotalamus dalam menghambat sekresi GnRH (Guyton dan Hall, 1997).
2. Pepaya (Carica papaya)
Pepaya merupakan tanaman buah dari family Caricaceae yang berasal dari Amerika Tengah dan Hindia Barat bahkan kawasan sekitar Mexsiko dan Coasta Rica. Tanaman pepaya banyak ditanam orang, baik di daerah tropis maupun subtropis. Kedudukan pepaya dalam sistematik (taksonomi) tumbuhan diklasifikasikan sebagai berikut:
Kingdom : Plantae (tumbuh-tumbuhan) Divisi : Spermatophyta (tumbuhan berbiji) Subdivisi : Angiospermae (biji tertutup) Kelas : Dycotyledonae (biji berkeping dua) Ordo : Caricales
Famili : Caricaceae
Spesies : Carica papaya L. (Rahmat, 2003)
Bentuk dan susunan tubuh bagian luar tumbuhan pepaya termasuk tumbuhan perdu yang umur sampai berbunganya dikelompokkan sebagia tanaman buah-buahan semusim, namun dapat tumbuh setahun atau lebih. Sistem perakaran memiliki akar tunggang dan akar-akar cabang yang tumbuh mendatar ke semua arah pada kedalamn 1 meter atau lebih dan menyebar sekitar 60-150 cm atau lebih dari pusat batang tanaman.
Batang tanaman pepaya bernemtuk bulat lurus dan berbuku-buku (beruas-ruas), dibagian tengahnya berongga dan tidak berkayu. Ruas-ruas batang
berlubang. Daun pepaya bertulang menjari(palminervus) dengan warna permukaan atas hijau tua, sedangkan warna bagian bawah hijau muda (Rahmat, 2003).
3. Kandungan zat kimia katekolamin
Katekolamin adalah senyawa yang di buat dari asam amino tirosin, diproduksi di dalam sel-sel kromafin medulla adrenal dan jaringan saraf postganglion dari sistem saraf simpatis. Katekolamin dapat larut dalam air dan dapat terikat protein plasma 50% sehingga mereka dapat bersirkulasi dalam darah. Katekolamin yang paling banyak ditemukan dalam tubuh ialah epinefrin (biasa dikenal sebagai adrenalin), norepinefrin (noradrenalin) dan dopamin.
Katekolamin memfasilitasi reaksi fisik yang berkenaan dengan persiapan aksi otot mencakup peningkatan denyut jantung dan paru-paru, penghambatan kerja lambung dan usus halus, konstriksi pembuluh darah di banyak wilayah tubuh, inhibisi kelenjar air mata, pembesaran pupil mata, relaksasi kandung kemih, dan penghambatan ereksi. Katekolamin menyebabkan fisiologi tubuh secara umum merubah diri untuk menyesuaikan menghadapi aktivitas fisik.
Epinefrin dan norepinefrin keduanya disintesis dan dikeluarkan oleh medulla adrenal. Norepinefrin juga dikeluarkan oleh susunan saraf simpatis, sehingga fungsinya sebagai hormone dan neurotransmitter. Efek hormone katekolamin diperantai oleh 4 reseptor protein permukaan sel: reseptor α-1, α-2, β-1, dan β-2 adrenergik. Epinefrin memiliki afinitas tinggi terhadap reseptor α dan
β; norepinefrin terutama bereaksi dengan reseptor α. Benyak sel sasaran mempunyai lebih dari satu tipe reseptor sel sasaran tertentu terhadap katekolamin ditentukan oleh jumlah dan tipe reseptor yang ada (Dianes, 1989).
Bekerja melalui 4 tipe reseptor ini katekolamin mengatur konentrasi 2 second messenger, cAMP dan kalsium. Perangsangan reseptor α-1 adrenergik mengakibatkan peningkatan konsentrasi kalsium intrasel. Perangsangan reseptor β-1 atau β-2, mengakibatkan pengaktifan adenilat siklase, sedangkan perangsangan reseptor α-2 memiliki efek yang berlawanan (Dianes, 1989).
Tabel 1. Pembagian kerja yang diperantai lewat reseptor adrenergik
Alfa-1 Alfa-2 Beta-1 Beta-2
Peningkatan glikogenolisis Kontraksi otot polos Stimulasi lipolisis Peningkatan glukoneogenesis hepatik
Relaksasi otot polos traktus genitourinarius Kontraksi miokardium Peningkatan glikogenolisis hepatik
pembuluh darah Kontraksi otot polos peningkatan laju Peningkatan glikogenolisis otot
traktus genitourinaris sebagian vascular peningkatan kekuatan Peningkatan pelepasan
Inhibin dari insulin
Lipolisis renin
pelepasan rennin Relaksasi otot polos
agregasi trombosit bronkus
sekresi insulin pembuluh darah
traktus genitourinarius
traktus gastrointestinal
Tingginya kadar katekolamin dalam darah diasosiasikan dengan stress yang bisa datang dari reaksi psikologis dalam diri sendiri atau tekanan dari lingkungan luar seperti bising, suasana yang tak nyaman, kondisi yang sulit, dan lain sebagainya. Kadar katekolamin yang sangat tinggi (dikenal juga sebagai toksisitas katekolamin) dapat terjadi akibat dari stimulasi atau kerusakan sel-sel saraf di batang otak. Beberapa obat seperti tolcapone (COMT-inhibitor pusat) dapat pula meningkatkan kadar katekolamin. Dua jenis katekolamin, yaitu dopamin dan epinefrin, berfungsi juga sebagai neurotransmitter di sistem saraf pusat disamping sebagai hormon dalam sirkulasi darah.
4. Efek penghambatan spermatogenesis oleh katekolamin
Spermatogenesis terjadi di dalam tubuli seminiferi. Untuk mempertahankan spermatogenesis diperlukan hormon FSH dan LH yang pada pria sering disebut ICSH (interstitial Cell Stimulating Hormone). Sekresi gonadotropin ini diatur oleh releasing hormon dari hipotalamus. ICSH mengatur sekresi testosteron yang dikeluarkan oleh sel-sel interstitial Leydig (Hanafiah, 1981).
FSH merangsang pertumbuhan dan pematangan sel-sel epitel germinal. FSH bekerja pada sel-sel sertoli untuk membentuk Androgen Binding Protein (ABP) dan bekerja sama dengan androgen untuk mempertahankan fungsi tubuli seminiferi dalam proses spermatogenesis. Pengeluaran FSH oleh hipofisis dipengaruhi pula oleh estrogen yang dibentuk testis dalam jumlah kecil.
Pemberian esterogen yang tinggi dapat memberikan umpan balik negatif terhadap hipofisis (Hanafiah, 1981).
Katekolamin memiliki reseptor pada α-adrenergik dan β-adrenergik. Pengikatan katekolamine pada α-adrenergik dapat menyebabkan hydrolisis membran phospoinositol dan menghasilkan diasilgliserol dan inositol triphosphate yang bekerja sebagai second messenger dan menginisiasi mobilisasi kalsium, aktifasi protein kinase (protein kinase C), dan protein phosphorilase. Aktifasi protein kinase dapat menstimulasi sekresi testosteron pada sel leydig. Pengikatan katekolamin pada β-1 adrenergik akan memacu sel leydig untuk menyekresi hormon testosteron dan pengikatan pada β-2 adrenergik juga dapat memacu sel sartoli untuk menyekresi inhibin dan merangsang spermatogenesis, namun ikatan katekolamin pada β-1 adrenergik lebih kuat dibanding ikatannya pada β-2 adrenergik. Jadi testosteron akan disekresikan dalam jumlah yang banyak (Artur, 1989). Tingginya konsentrasi testosteron akan berefek umpan balik negatif ke hipofisis yaitu tidak melepaskan FSH atau LH, sehingga akan menghambat spermatogenesis (winarno, 1997). Jika pelepasan FSH terganggu mengakibatkan proses spermatogenesis tertekan dan terjadi degenerasi epitel seminiferi (Hanafiah, 1981).
C. Kerangka Pemikiran
Hipofisis anterior
3
FSH
Sel Leydig Sel sartoli
Testoste ron Inhibin Spermatogenesis Katekolamin LH Degenerasi epitel seminiferus Ekstrak biji pepaya β-adrenergik β-2 β-1 α-adrenergik Keterangan: : menyebabkan/mengandung : menghambat
D. Hipotesis
Pemberian ekstrak biji pepaya (Carica papaya) peroral dapat mempengaruhi jumlah sel spermatid testis mencit.
BAB III
METODE PENELITIAN
A. Jenis Penelitian
Penelitian ini bersifat eksperimental laboratorik. B. Lokasi Penelitian
Penelitian ini dilaksanakan di Laboratorium Histologi Fakultas Kedokteran Universitas Sebelas Maret.
C. Subjek Penelitian
Subyek yang digunakan dalam penelitian ini adalah mencit (Mus musculus) jantan galur Swiss webster sebanyak 27 ekor berumur 6-8 minggu dengan berat badan + 20 g yang didapatkan dari Universitas Setia Budi. Sampel dibagi dalam tiga kelompok, masing-masing kelompok terdiri dari sembilan ekor mencit. Jumlah ini diperhitungkan menurut rumus Federer yaitu (k-1) (n-1) ≥ 15 (Purawisastra, 2001), dengan k=jumlah perlakuan, n=jumlah mencit untuk tiap perlakuan. Kelompok I adalah kelompok kontrol, dimana mencit diberi aquades. Kelompok II adalah kelompok mencit yang diberi ekstrak biji pepaya dengan dosis 10 mg/ekor. Kelompok III adalah kelompok mencit yang diberi ekstrak biji pepaya dengan dosis 30 mg/ekor.
D. Teknik Sampling
Pengambilan sampel dilakukan secara random sampling. E. Rancangan Penelitian
Rancangan penelitian ini adalah post test only control group design. (Taufiqqurohman, 2004).
Keterangan :
K = Kelompok kontrol, diberikan aquades
P1 = Kelompok perlakuan 1, diberikan ekstrak biji pepaya 10mg/ekor/hari peroral dan makan secukupnya P2 = Kelompok perlakuan 2, diberikan ekstrak biji pepaya
30mg/ekor/hariperoral dan makan secukupnya. Sampel mencit 27 ekor HP1 Bandingkan dengan uji statistik HK HP2 P1 P2 K
HK = Pengamatan histologis testis pada kelompok K. HP1 = Pengamatan histologis testis pada kelompok P1. HP2 = Pengamatan histologis testis pada kelompok P2. F. Identifikasi Variabel Penelitian
1. Variabel bebas adalah ekstrak biji pepaya (Carica papaya) 2. Variabel terikat adalah jumlah sel spermatid
3. Variabel luar
Variabel luar dari penelitian ini adalah sebagai berikut.
a. Variabel luar yang dapat dikendalikan : variasi genetik, umur, suhu udara, berat badan, dan jenis makanan mencit semuanya diseragamkan.
b. Variabel luar yang tidak dapat dikendalikan : kondisi psikologis mencit.
G. Definisi Operasional Variabel
1. Variabel bebas : Ekstrak biji pepaya (Carica papaya)
Pembuatan ekstrak biji pepaya (Carica papaya) dilakukan di B2P2TO2T. Dibuat 2 macam dosis yaitu 10 mg/ekor dan 30 mg/ekor. Pemberian ekstrak biji pepaya dilakukan secara per oral satu kali sehari selama 10 hari berturut-turut. Pemberian aquades diberikan pada kelompok kontrol. Pemberian ekstrak biji pepaya dengan dosis 10 mg/ekor/hari diberikan pada kelompok perlakuan 1. Pemberian ekstrak biji pepaya dengan dosis 30 mg/ekor/hari diberikan pada kelompok perlakuan 2. Skala pengukuran variabel bebas adalah skala ordinal.
2. Variabel terikat : jumlah sel spermatid.
Perubahan jumlah sel spermatid yaitu berubahnya jumlah sel spermatid setelah diberi perlakuan. Penghitungan jumlah sel spermatid dilakukan dengan cara memilih tubulus seminiferus yang bulat dan dihitung jumlah sel spermatid yang ada didalamnya. Skala pengukuran variabel terikat adalah skala rasio.
3. Variabel luar.
a. Variabel luar yang dapat dikendalikan. 1). Variasi genetik.
Jenis : mencit ( Mus musculus ) Galur : Swiss webster
2). Umur.
Umur : 5-8 minggu (Laird et al, 1996) 3). Suhu udara.
Hewan percobaan diletakkan dalam ruangan dengan suhu udara berkisar antara 25-28 derajat celcius.
4). Berat badan.
Berat badan hewan percobaan yaitu sekitar 20 g. 5). Jenis makanan.
b. Variabel luar yang tidak dapat dikendalikan 1). Kondisi psikologis mencit
Kondisi psikologis mencit dipengaruhi oleh lingkungan sekitar. Lingkungan yang terlalu ramai, pemberian perlakuan yang berulang kali, dan perkelahian antar mencit dapat mempengaruhi kondisi psikologis mencit.
2). Imunitas atau kekebalan tubuh dari masing-masing hewan coba H. Instumentasi dan Bahan Penelitian
1. Instrumen.
Instrumen yang digunakan adalah sebagai berikut : a. Kandang mencit.
b. Timbangan hewan. c. Timbangan neraca
d. Alat bedah hewan percobaan (scalpel, pinset, gunting, jarum, meja lilin). e. Sonde lambung.
f. Alat untuk pembuatan preparat histologi. g. Mikroskop cahaya media terang.
h. Alat penghitung (optic lab) i. Gelas ukur dan pengaduk. 2. Bahan.
Bahan yang akan digunakan adalah sebagai berikut : a. Ekstrak biji pepaya.
b. Makanan hewan percobaan (pelet). c. Aquades.
d. Bahan untuk pembuatan preparat histologi dengan pengecatan HE. I. Cara Kerja
Satu minggu sebelum perlakuan, mencit diletakkan dalam kandang tersendiri dan dijaga agar sesedikit mungkin mendapat gangguan. Semua perlakuan dilakukan antara pukul 08.00 WIB – 10.00 WIB.
Binatang percobaan terdiri atas 27 ekor mencit yang dibagi menjadi 3 kelompok, masing-masing kelompok terdiri atas 9 ekor. Dosis pemberian ekstrak biji pepaya pada mencit adalah 10 mg dan 30 mg (Sudarsono, 2003). Kelompok K adalah kelompok kontrol yang diberi makan pelet secukupnya. Kelompok P1 adalah kelompok perlakuan 1 yang diberi ekstrak biji pepaya 10 mg dan makanan pelet secukupnya. Kelompok P2 adalah kelompok perlakuan 2 yang diberi ekstrak biji pepaya 30 mg dan makanan pelet secukupnya.
Setelah mendapat perlakuan berupa pemberian ekstrak biji pepaya selama 10 hari yaitu sesuai dengan lama satu siklus spermatogenesis mencit (Nalbandov, 1990), binatang dibunuh secara neck dislocation. Testis masing-masing mencit diambil sebelah kanan dan kiri dan dimasukkan ke dalam fiksatif (larutan bouin). Kemudian spesimen ini diproses untuk dibuat sediaan histologik dengan metode parafin. Sediaan diwarnai dengan metode pewarnaan hematoksilin meyer eosin.
masing-masing preparat, kemudian diidentifikasi jenis-jenis sel spermatogenik yaitu spermatogonium, spermatosit, spermatid dan dihitung hanya sel spermatidnya saja.
Data dikumpulkan dari hasil pengamatan setiap hewan coba sesuai dengan kelompok masing-masing. Dari setiap hewan percobaan dibuat 3 buah sediaan masing-masing sediaan kemudian dihitung sel spermatidnya dari tubulus seminiferus yang bulat yang berasal dari testis kanan dan testis kiri. Setiap sediaan dilakukan pengamatan dengan bantuan mikroskop cahaya. Pengamatan preparat dilakukan dengan perbesaran 100x dilanjutkan dengan perbesaran 400x. Dihitung jumlah sel spermatid pada setiap lapangan bidang pandang dari irisan preparat untuk masing-masing testis kiri dan kanan. Perubahan jumlah sel spermatid diuji dengan rumus analisis varian dilanjutkan dengan uji post hoc.
J. Teknik Analisis Data
Data yang diperoleh dianalisis secara statistik dengan menggunakan uji statistic Anova searah (Schefler, 1999) untuk mengetahui adanya perbedaan rata-rata jumlah sel spermatid antara kelompok kontrol negatif (Kn), kelompok perlakuan I (KpI), dan kelompok perlakuan II (KpII) jika terdapat perbedaan maka dilanjutkan dengan uji LSD (Least Significant Difference) dengan derajat kemaknaan α=0,05 untuk mengetahui apakah terdapat perbedaan rata-rata jumlah sel spermatid diantara dua kelompok.
BAB IV
HASIL PENELITIAN
A. Data Hasil Penelitian
Data hasil penelitian berupa data rasio yaitu jumlah sel spermatid yang dihitung dari tiap preparat hewan coba. Setiap preparat hewan coba dipilih 1 irisan yang paling baik dan dihitung 1 tubulus yang paling bulat, lalu di hitung jumlah sel spermatidnya untuk masing-masing kelompok perlakuan. Kemudian dicari hasil rata-rata untuk tiap preparat hewan coba. Hasil perhitungan rata-rata jumlah sel spermatid dari masing-masing kelompok perlakuan akan disajikan dalam tabel berikut ini :
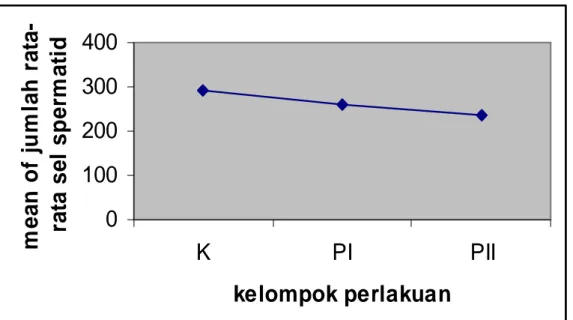
Tabel 2. Rata-rata jumlah sel spermatid testis kiri dan kanan dari masing-masing kelompok
Sumber : out put data SPSS
Tabel 1 di atas memperlihatkan nilai rata-rata jumlah sel spermatid untuk masing-masing kelompok perlakuan. Kelompok K memiliki nilai jumlah rata-rata=291,889; kelompok PI memiliki nilai jumlah rata-rata=260,444; kelompok PII
Perlakuan N
Jumlah rata-rata sel spermatid testis kiri dan kanan
K 9 291,889
PI 9 260,444
0
100
200
300
400
K
PI
PII
kelompok perlakuan
m
e
a
n
o
f
ju
m
la
h
r
a
ta
-ra
ta
s
e
l
s
p
e
rm
a
ti
d
Gambar 1. Grafik jumlah rata-rata sel spermatid testis kiri dan testis kanan dari masing-masing kelompok
B. Analisis Data 1. Uji Anova
Data dari tabel 1 dilakukan uji statistik Anova searah untuk mengetahui perbedaan rata-rata jumlah sel spermatid antara ketiga kelompok perlakuan yaitu : K, PI, dan PII. Hasil uji Anova searah dapat dilihat pada tabel dibawah ini :
Tabel 3. Hasil uji Anova searah antara ketiga kelompok untuk rata-rata jumlah sel spermatid
Df Fo Nilai p
Antar kelompok 2 4,332 0,025
Dalam kelompok 24
Total 26
Hasil analisis uji Anova rata-rata jumlah sel spermatid pada semua kelompok perlakuan didapatkan nilai p=0,025 (p<0,05), sehingga dapat disimpulkan bahwa terdapat perbedaaan yang bermakna rata-rata jumlah sel spermatid antara ketiga kelompok perlakuan (tabel 2). Analisis dilanjutkan dengan uji LSD (Least Significant Difference) dengan derajat kemaknaan α=0,05 untuk mengetahui letak perbedaan rata-rata jumlah sel spermatid antara dua kelompok.
2. Uji LSD (Least Significant Difference)
Hasil perhitungan statistik dengan Uji LSD (Least Significant Difference) didapatkan :
Tabel 4. Hasil uji LSD (Least Significant Difference) antara dua kelompok untuk rata-rata jumlah sel spermatid
NO Kelompok Perbedaan rata-rata P Confidence Interval 95% 1 K dan PI 31,444 0,108 -7,47 - 70,36 2 K dan PII 55,333 0,007 16,42 - 94,25 3 PI dan PII 23,889 0,217 -15,03 - 62,81 Sumber : out put data SPSS
Perhitungan statistik dengan uji LSD (Least Significant Difference) dengan derajat kemaknaan α=0,05 diperoleh nilai p > 0,05 pada kelompok K-PI dengan nilai perbedaan=31,444 pada confidence interval 95%= -7,47 s/d 70,36 dan kelompok PI-PII dengan nilai perbedaan=23,889pada confidence interval 95%= -15,03 s/d 62,81 dengan demikian Ho diterima (tidak ada perbedaan yang
sedangkan nilai p <0,05 pada kelompok K-PII dengan nilai perbedaan=55,333 pada confidance interval 95%= 16,42 s/d 94,25 dengan demikian Ho ditolak (ada perbedaan yang bermakna rata-rata jumlah sel spermatid antara 2 kelompok yang dibandingkan).
BAB V PEMBAHASAN
Penelitian dengan membarikan ekstrak biji pepaya selama 10 hari diperoleh hasil jumlah rata-rata sel spermatid testis kanan dan testis kiri untuk kelompok kontrol (K) 291,889, untuk kelompok perlakuan I (PI) 260,444, dan untuk kelompok perlakuan II (PII) 236,556. jumlah sel spermatid mengalami penurunan yang bermakna. Besar penurunan jumlah sel spermatid semakin besar dengan peningkatan dosis yang diberikan. Dari data diaas dapat disimpulkan pemberian ekstrak biji pepaya dosis 10mg/ekor/hari dan 30 mg/ekor/hari dapat menyebabkan perubahan jumlah rata-rata sel spermatid yang cenderung semakin menurun, semakin besar dosis yang diperlukan semakin besar pula penurunan jumlah sel spermatid. Penurunan jumlah sel spermatid ini menunjukkan adanya pengaruh ekstrak biji pepaya terhadap spermatogenesis.
Penurunan jumlah rata-rata sel spermatid pada kelompok perlakuan I sebesar {(291,889 – 260,444) / 291,889} x 100% = 10,773% dibanding dengan kelompok kontrol. Penurunan rata-rata jumlah sel spermatid pada kelompok perlakuan II sebesar {(291,889 – 236,556) / 291,889} x 100% = 18,957% dibanding dengan kelompok kontrol.
Uji Anova searah pada penelitian ini diperoleh nilai nilai p=0,000 (p<0,05) yang menunjukkan adanya perbedaan rata-rata jumlah sel spermatid yang bermakna diantara ketiga kelompok perlakuan. Post Hoc Test dilakukan untuk mencari letak perbedaan
perlakuan I diperoleh nilai p=0,108 (p>0,05) yang berarti tidak ada perbedaan yang bermakna diantara keduanya. Kelompok kontrol dengan kelompok perlakuan II diperoleh nilai p=0,007 (p<0,05) yang berarti ada perbedaan yang bermakna diantara keduanya. Kelompok perlakuan I dengan kelompok perlakuan II diperoleh nilai p=0,217 (p>0,05) yang berarti tidak ada perbedaan bermakna diantara kedua kelompok. Dari data diatas menunjukkan bahwa pada kelompok perlakuan II terjadi penurunan rata-rata jumlah sel spermatid jika dibanding dengan kelompok kontrol. Penurunan rata-rata ini diduga disebabkan oleh katekolamine. Mekanisme kerja senyawa katekolamine yang terkandung dalam ekstrak biji pepaya diduga bekerja menghambat laju metabolisme sel spermatogenik dengan cara mengganggu keseimbangan sistem hormon (Winarno, 1997).. Post Hoc Test yang membandingkan kelompok kontrol dengan kelompok perlakuan I; dan kelompok perlakuan II masing-masing diperoleh nilai p = 0,108; 0,007. Kelompok perlakuan II menunjukkan perbedaan yang bermakna (p<0,05). Hal ini menunjukkan bahwa pemberian ekstrak biji pepaya dosis 30mg/ekor/hari dapat menyebabkan penurunan rata-rata jumlah sel spermatid yang bermakna dibanding dengan kelompok kontrol. Tingkat penurunan rata-rata jumlah sel spermatid sebanding dengan peningkatan dosis pemberian ekstrak biji pepaya. Hal ini sesuai teori pada penelitian sebelumnya bahwa tikus putih yang mengkonsumsi ekstrak biji pepaya menunjukkan penurunan gambaran histologis spermatogenesis (Yumadi, 2001). Terjadi penurunan jumlah sel spermatid pada kelompok perlakuan karena adanya mekanisme umpan balik yang berlebihan ke hipofisis sehingga hipofisis tidak melepaskan FSH dan LH, sehingga akan menghambat spermatogenesis ( Winarno, 1997).
Penelitian sebelumnya yang dapat mendukung penelitian ini menunjukkan bahwa pemberian ekstrak biji pepaya selama 40 hari pada dosis 30 mg/ekor/hari dapat menyebabkan penurunan fertilitas tikus jantan yang dilakukan oleh Sudarsono. Hal ini dibuktikan dengan adanya penipisan epitel germinal dan peregangan jarak epitel tubuli seminiferi. Epitel germinal terdiri atas 2 macam sel, yaitu sel spermatogenik yang menghasilkan sperma dan sel penyokong (sel sartoli) yang memberi makan sperma yang sedang berkembang (Eroschenko, 2003). Penelitian ini berbeda dengan penelitian sebelumnya pada lama perlakuan dan objek yang diamati, yaitu: lama perlakuan terhadap mencit pada penelitian ini dilakukan selama 10 hari, mengikuti siklus spermatogenesis, sedangkan pada penelitian sebelumnya lama perlakuan 40 hari.
BAB VI
SIMPULAN DAN SARAN
A. Simpulan
Simpulan yang dapat ditarik dari hasil penelitian yang telah dilakukan uji statistik dan pembahasan adalah sebagai berikut:
1. Pemberian ekstrak biji pepaya peroral dapat mempengaruhi jumlah sel spermatid yang ditandai dengan adanya perbedaan rata-rata jumlah sel spermatid untuk masing-masing kelompok.
2. Tingkat perbedaan rata-rata jumlah sel spermatid mencit semakin menurun sebanding dengan besarnya dosis ekstrak biji pepaya yang diberikan, yaitu semakin besar dosis ekstrak biji pepaya yang diberikan, maka jumlah sel spermatid mencit semakin menurun.
3. Penurunan jumlah rata-rata sel spermatid testis mencit yang paling besar terjadi pada kelompok perlakuan II (30 mg/ekor/hari) yaitu sebesar 18,957%
B. Saran
1. Perlu dilakukan penelitian lebih lanjut tentang pengaruh ekstak katekolamin murni terhadap spermatogenesis.
2. Perlunya dilakukan penelitian lebih lanjut dengan dosis yang berbeda untuk mengetahui dosis efektif terhadap penurunan jumlah sel spermatid testis mencit.
3. Perlu diketahui pengaruhnya terhadap hormon gonadotropin FSH dan LH serta hormon testosteron (libido).
DAFTAR PUSTAKA
Dianes, C., 1989. Ringkasan Biokimiawi. Jakarta : PT Gamedia Pustaka Utama.
Dorland, dan Newman, W.A., 2006. Kamus Kedokteran Dorland. Edisi 29. Jakarta: EGC.
Eroschenko, V.P., 2003. Atlas Histologi di Fiore dengan Korelasi Fungsional. Jakarta: EGC. pp : 278-295.
Ganong, W.F., 1992. Buku Ajar Fisiologi Kedokteran. Jakarta: EGC. pp: 405-414.
Guyton, A.C., dan Hall, J.E., 1997. Fisiologi Kedokteran. Edisi 9. Jakarta : EGC. pp : 1265-1281.
Hanafiah, J.M.,1981. Fisiologi Sistem Hormonal dan Reproduksi dengan Pathofisiologinya. Bandung : Alumni
Herwiyanti, S. dan Ghufron, M., 1993. Gambaran Histologik Spermatogenesis Tikus Putih (Rattus norvegicus) setelah diberi Makan Juice Daun Pepaya (Carica papaya). Laporan Penelitian. Yogyakarta: Fakultas Kedokteran Universitas Gajah Mada.
Johnson, K.E., 1994. Seri Kapita Selekta Histologi dan Biologi Sel. Jakarta : Bina Rupa Aksara.
Junqueira,C., et al, 1997. Histologi Dasar. Edisi ke-8. Jakarta : EGC. pp : 419-432.
Leeson, C.R., et al, 1996. Buku Ajar Histologi. Jakarta : EGC. pp : 511-538.
Marieb, E.N., 1998. Human Anatomy and Physiology. California : Benjamin / Cummings Science Publishing. p : 1043.
Murthi, B., 1994. Penerapan Metode Statistik Non Parametrik Dalam Ilmu-Ilmu Kesehatan. Jakarta : PT Gamedia Pustaka Utama.
Nalbandov, A.V.,1990. Fisiologi Reproduksi pada Mamalia dan Unggas. Jakarta : Penerbit Universitas Indonesia (UI-Press).
Ngatidjan, 1991. Petunjuk Laboratorium Metode Laboratorium dalam Toksikologi. Yogyakarta : Pusat Antar Universitas Bioteknologi UGM.
Pointis, G.,dan Latreille, M.T., 1987. Chatecolamine-induced Stimulation of Testosteron Production by Leydig Cells From Fetal Mous Testis. www.reproduction-online.org/cgi/content/abstract/80/1/32. (20 agustus 2009)
Price, S.A., dan Wilson, L.M., 1995. Patofisiologi. Edisi 4. Jakarta : EGC. pp: 1146-1160.
Rahmat, Rukmana, 2003. Pepaya.
http://books.google.co.id/books?id=Ngr_Gr91RWwCdanpg=PA18danlpg=PA 18dandq=morfologi+tanaman+pepayadansource=bldanots=Fkid_tPZXBdansi g=Mv4tWuapDM_8148f30Sw4RTt04Edanhl=iddanei=dOXZStmOA8eBkQX 9obnLDgdansa=Xdanoi=book_resultdanct=resultdanresnum=1danved=0CAg Q6AEwADgK#v=onepagedanq=morfologi%20tanaman%20pepayadanf=false . (17oktober 2009)
Raji, Y. dan Morakinyo, A.O., 2005. Impact of the Chloroform Extract of Carica papaya Seeds on Oestrous Oycle and Fertility in Female Albino Rats. Nigeria: Departement of Physiology Collage of Medicine Ibadan University.
Schefler, W.C., 1999. Statistika untuk Biologi, Farmasi, Kedokteran, dan Ilmu yang Bertautan. Bandung : Penerbit ITB.
Siri, Z. dan Sulaeman, S., 2002. Efek Pemberian secara Oral Infusa Daun Tembakau (Nicotina tabacum L) terhadap jumlah, kecepatan dan morfologi spermatozoa mencit (Mus musculus). Majalah Andrologi Indonesia No. 3, september 2002.
2003.
Taufiqqurohman, M.A., 2003. Metodologi Penelitian Kedokteran dan Kesehatan. Surakarta : CSGF.
William, H.M., 1982. Cathecolamine Stimulation of Androgen Production by Mouse
Interstitial Cells in Primary Culture.
www.andrologyjournal.org/cgi/reprint/3/4/227.pdf. (17 oktober 2009)
Winarno, W.M., dan Sundari, Dian, 1997. Informasi Tanaman Obat Untuk
Kontrasepsi Tradisional.
http://www.kalbe.co.id/files/cdk/files/10InformasiTanamanObatuntukKontras epsi120.pdf/10InformasiTanamanObatuntukKontrasepsi120.html. (17 oktober 2009)
Yurnardi dan Puiji, Sari, 2001. Pengaruh Penyuntikan Ekstrak Biji Pepaya (Carica papaya L.) terhadap Konsentrasi Spermatozoa dan Keadaan Sel SpermatogenikTikus Jantan Strain LMR. http://www.mkb- online.org/index.php?option=com_contentdanview=articledanid=77:efek-biji- pepaya-carica-papaya-linn-terhadap-ketebalan-epitel-germinal-dan-jarak-