6 2.1 Kanker Serviks
Kanker serviks terjadi akibat tumbuhnya sel-sel abnormal pada jaringan serviks. Kanker serviks adalah kanker primer serviks (porsio dan kanalis servikalis) yang merupakan bagian ujung depan rahim yang menjulur ke vagina (Andrijono, 2012). Kanker serviks merupakan salah satu kanker terbanyak yang terjadi pada perempuan di dunia dan juga di Indonesia selain kanker payudara dan merupakan penyebab kematian terbanyak akibat penyakit kanker di negara sedang berkembang seperti Indonesia. Penyebab utama kanker serviks adalah infeksi
Human Papiloma Virus, meskipun terdapat beberapa faktor lain yang dapat
mempengaruhi progresifitas kanker (Schorge et al., 2008; Ziabarth et al., 2012).
2.2 Epidemiologi Kanker Serviks 2.2.1 Insiden kanker serviks
Kanker serviks merupakan jenis kanker pada wanita yang menempati urutan ketiga di seluruh dunia, dengan lebih dari 450.000 kasus didiagnosis setiap tahunnya (Ziebarth et al., 2012). Di Amerika Serikat, kanker serviks menempati urutan ketiga dari neoplasma ginekologis yang paling sering terjadi, di bawah kanker korpus endometrium dan kanker ovarium. Tahun 2010, The American
Cancer Society memperkirakan 12.200 kasus baru kanker serviks, dengan 4.210
wanita diprediksi meninggal akibat penyakit ini dan puncak insiden kasus ini terjadi pada usia 45 tahun (Ziebarth et al.,2012; Berek, 2007; Schorge et al.,
2008). Angka kematian mencapai 2,4 kematian per 100.000 wanita setiap tahun (NCI, 2010). Hal ini membuat kanker serviks menjadi salah satu ancaman terbesar untuk nyawa wanita.
Di Indonesia, prevalensi kanker serviks didapatkan dengan persentase 27% dari seluruh jenis kanker yang terjadi pada wanita dan menempati urutan pertama selama 3 dasa warsa. Kanker serviks masih menjadi masalah kesehatan tersendiri perempuan Bali terkait dengan insiden dan fatalitasnya. Insidennya adalah 0,92% dan cenderung meningkat dengan angka harapan hidup 5 tahun hanya 23,1% (Suwiyoga dan Suyasa Jaya, 2012).
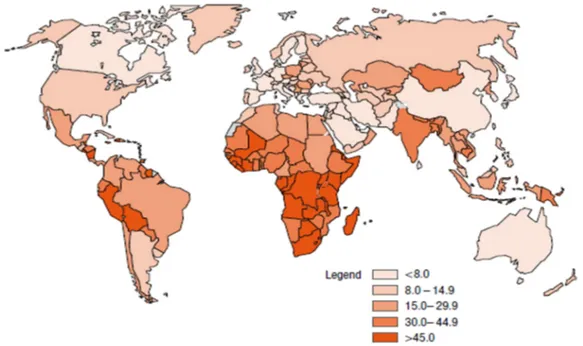
Gambar 2.1 Angka Insidensi Kanker Serviks di Seluruh Dunia per 100.000 Wanita (Semua Usia), Usia Terstandarisasi pada Populasi Standard WHO
(2005) (WHO, 2006)
Kematian yang sangat bervariasi ini dikaitkan dengan tingkat stadium ketika diagnosis kanker serviks ditegakkan. Di Indonesia, apabila dilakukan perhitungan kejadian kematian karena kanker serviks, setiap satu jam terjadi satu kematian oleh karena kanker serviks. Sementara di Bali, terdapat satu kematian setiap dua hari oleh karena kanker serviks (Suwiyoga, 2010).
2.2.2 Etiologi kanker serviks
Infeksi HPV (Human Papilloma Virus) terdeteksi pada 99,7% kanker serviks, sehingga infeksi HPV merupakan infeksi yang sangat penting pada perjalanan penyakit kanker serviks. Pada penelitian kasus-kontrol, prevalensi infeksi HPV pada kanker serviks jenis karsinoma sel skuamosa dijumpai sejumlah 78,4-98,1% (meta-analisis 12 negara). Prevalensi infeksi HPV pada kanker serviks jenis adenokarsinoma dijumpai sejumlah 85,7-100% (meta-analisis 9 negara). Pada penelitian kasus kontrol juga ditemukan adanya infeksi HPV pada lesi prakanker dan kanker invasif. Kejadian infeksi HPV risiko tinggi dijumpai sejumlah 80% pada NIS II, 90% pada NIS III dan sejumlah 98% pada karsinoma serviks invasif ( Andrijono, 2012 ). Lebih dari 70% kanker serviks disebabkan oleh infeksi HPV tipe 16 dan 18 (Kampono, 2011).
Berdasarkan hasil temuan pada penelitian epidemiologi, tipe HPV diklasifikasikan dalam tiga klasifikasi yaitu risiko tinggi, kemungkinan risiko tinggi dan risiko rendah (Andrijono, 2012).
Tabel 2.1 Klasifikasi Berdasarkan Epidemiologi (Andrijono, 2012)
Golongan Tipe HPV
Risiko tinggi 16, 18, 31, 33, 35, 39,45, 51, 52, 56, 58, 59 Kemungkinan risiko tinggi 26, 53, 66, 68, 73, 82
Risiko rendah 6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81
2.2.3 Faktor risiko kanker serviks
Berbagai faktor dianggap sebagai kofaktor terjadinya kanker serviks antara lain multiparitas, merokok, kontrasepsi hormonal, penyakit hubungan seksual, dan faktor nutrisi. Jumlah paritas meningkatkan risiko menderita kanker serviks. Risiko menderita kanker serviks meningkat dengan peningkatan jumlah batang rokok yang dikonsumsi. Penggunaan kontrasepsi hormonal meningkatkan risiko menderita kanker serviks. Lamanya penggunaan kontrasepsi hormonal meningkatkan risiko menderita kanker serviks, dan penggunaan 10 tahun meningkatkan risiko sampai dua kali. Penyakit hubungan seksual meningkatkan risiko menderita kanker serviks. Penelitian pada infeksi virus herpes dan HIV membuktikan adanya peningkatan risiko kanker serviks, dan faktor nutrisi ikut berperan dalam hal ini (Berek, 2007; Kampono, 2011; Andrijono, 2012).
Faktor viral load merupakan salah satu faktor risiko progresivitas lesi infeksi HPV menjadi lesi prakanker dan lesi kanker serviks invasif. Viral load pada NIS I berbeda jika dibandingkan dengan lesi NIS II-III. OR (odds ratio) meningkat dengan peningkatan viral load (medium viral load: 13.6 untuk NIS dan 54.6 untuk karsinoma serviks invasif). Sedangkan pada high viral load OR pada NIS
sebesar 10.8 dan 34.8 untuk karsinoma seviks invasif. Dengan demikian viral load dapat digunakan sebagai prediktor (Schorge et al., 2008; Andrijono, 2012).
2.3 Histopatologi Kanker Serviks
Secara histologis, serviks memiliki struktur yang berbeda dari bagian lain uterus. Struktur histologi serviks terdiri dari:
a. endoserviks: epitel selapis silindris penghasil mucus
b. serabut otot polos hanya sedikit dan lebih banyak jaringan ikat padat (85%). c. ektoserviks : bagian luar serviks yang menonjol kearah vagina dan memiliki lapisan basal, tengah, dan permukaan. Ektoserviks dilapisi oleh sel-sel epitel skuamosa non keratin.
Pertemuan epitel silindris endoserviks dengan epitel skuamosa ektoserviks disebut squamocolumnar junction. Epitel serviks mengalami beberapa perubahan selama perkembangannya sejak lahir sampai usia lanjut, sehingga letak
squamocolumnar junction juga berbeda pada perkembangannya.
Saat lahir, seluruh serviks dilapisi oleh epitel skuamosa. Sementara saat dewasa muda, terjadi pertumbuhan epitel silindris yang melapisi endoserviks. Epitel ini tumbuh hingga ke bawah ektoserviks, sehingga epitel silindris terpajan dan letak squamocolumnar junction berada di bawah ektoserviks. Saat dewasa, dalam perkembangannya terjadi regenerasi epitel skuamosa dan silindris, sehingga epitel skuamosa kembali melapisi seluruh ektoserviks dan terpajan, dan letak squamocolumnar junction kembali ke tempat semula.
Daerah tempat bertumbuhnya kembali epitel skuamosa atau tempat antara letak squamocolumnar junction saat lahir dan dewasa muda disebut zona
transformasi (Schorge et al., 2008; Ziebarth et al., 2012).
Suatu kasus dapat diklasifikasikan dalam karsinoma serviks bila pertumbuhan primernya berasal dari serviks. 85% jenis histopatologi adalah karsinoma sel skuamosa, 10% adenokarsinoma, dan 5% adenoskuamosa, sel jernih, sel kecil, sel verukosa, dan lain-lain. Derajat diferensiasi dengan berbagai metode dapat menunjang diagnosis, tetapi tidak dapat memodifikasi stadium klinis. Secara histopatologi kanker serviks dibagi menjadi: neoplasia intraepitel serviks derajat III, karsinoma skuamosa insitu, karsinoma skuamosa (berkeratinisasi, tidak berkeratinisasi, verukosa), adenokarsinoma insitu, adenokarsinoma insitu tipe endoservikal, adenokarsionma endometrioid, adenokarsinoma sel jernih, karsinoma adenoskuamosa, karsinoma kistik adenoid, karsinoma sel jernih dan karsinoma undifferentiated. Derajat histopatologi: diferensiasi baik, diferensiasi sedang dan diferensiasi buruk (Schorge et al., 2008; Kampono, 2011; Ziebarth et al., 2012).
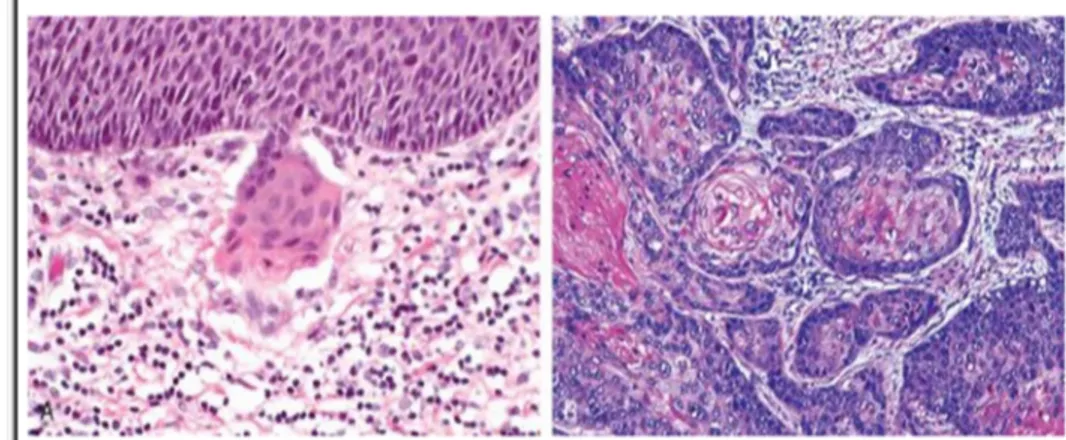
Gambar 2.2 Karsinoma Sel Skuamosa Serviks. A. Karsinoma sel skuamosa mikro invasif yang menginvasi sarang sel menembus membrana basalis dari
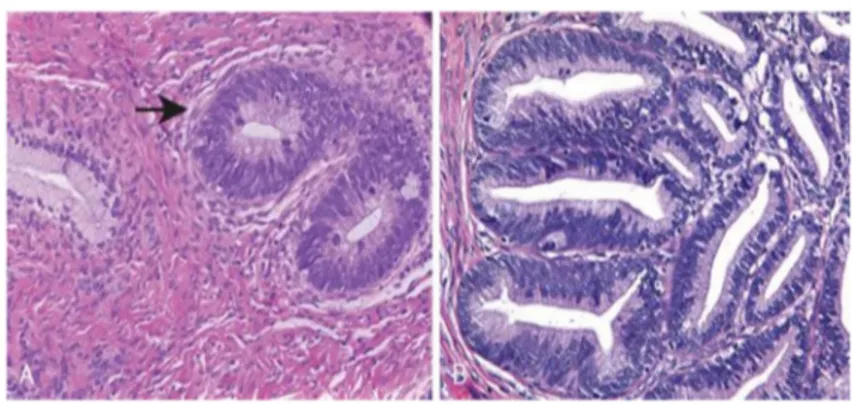
Gambar 2.3 Adenokarsinoma Serviks. A. Adenokarsinoma in situ (panah) menunjukkan kelenjar yang gelap menempel pada yang normal, kelenjar endoserviks yang pucat. B. Adenokarsinoma invasif (Kumar et al., 2010).
2.4 Human Papilloma Virus
Human Papilloma Virus ( HPV ) termasuk dalam famili Papovaviridae yang
terdiri dari dua genus yaitu Polyomavirus dn Papillomavirus. Karakteristik Papillomavirus merupakan virus berukuran kecil dengan diameter 45-55 nm, memiliki genom sirkular dengan double stranded DNA dengan kapsid berbentuk
icosahedral dan tidak berenvelop. Virus ini mempunyai tropisme pada sel epitel
kulit dan membrane mukosa (Andrijono, 2012).
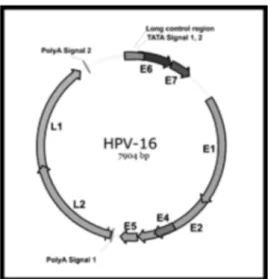
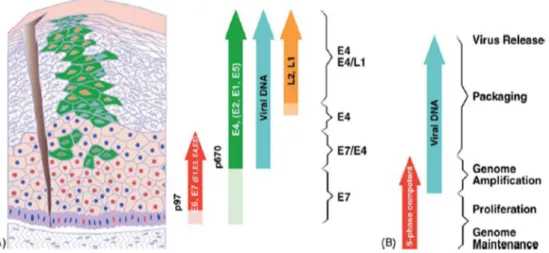
Genom HPV terdiri atas beberapa bagian, yaitu bagian Late (L), early (E) dan bagian non koding (NC). Bagian L terbagi menjadi dua bagian yaitu 95% bagian adalah L1 mayor (mengkode protein kapsid mayor) dan 5% adalah L2 minor (mengkode protein kapsid minor). Bagian E terdiri atas E1 – E8, tetapi hanya E1, E2, E4, E6 dan E7 yang banyak diteliti. Sedangkan produk E6 dan E7 merupakan suatu onkoprotein (Andrijono, 2012).
Gambar 2.4. Organisasi Genom HPV tipe 16 (Andrijono, 2012)
Fungsi gen Early Region ( E ) : E1 dan E2 memiliki peranan dalam replikasi dan menurunkan ekspresi E6 dan E7, E3 fungsinya belum diketahui, E4 berperan pada siklus pertumbuhan dan pematangan virus, mengkode protein kecil yang terlibat dalam transformasi sel hospes dengan mengganggu sinyal mitosis dan berinteraksi dengan keratin menyebabkan distabilitas keratin, E5 menstimulasi ekspresi E6 dan E7, E6 berperan sebagai onkogen, menstimulasi pertumbuhan dan transformasi sel hospes dengan menghambat p53, protein onkosupresor, E7 berperan sebagai onkogen, menginduksi proliferasi sel dengan menghambat protein pRb, p107 dan p130, E8 fungsinya belum diketahui (Andrijono, 2012).
Masa tunas infeksi HPV rata-rata 8 bulan (1-2 tahun) dan 70% mengalami seronegatif pada 24 bulan pasca infeksi. Infeksi HPV 95% terjadi karena hubungan seksual, dan multipartner merupakan faktor risiko tinggi terjadinya infeksi. Transmisi vertikal dari ibu hamil ke bayi dapat terjadi dengan risiko atau kejadian yang sangat kecil. Transmisi horizontal, kontak tidak langsung dapat
terjadi melalui pemakaian handuk bersama, dari kuku yang terkontaminasi HPV (Andrijono, 2012). Semua HPV yang dikenal secara eksklusif bersifat epiteliotropik, dan tidak seperti tipe virus papilloma pada hewan seperti bovine
papillomavirus type 1 (BPV 1) atau BPV 2, mereka tidak menginfeksi atau
mengekspresikan produk gen mereka pada lapisan dermis di bawahnya (Doorbar, 2007).
Gambar 2.5 Siklus Hidup Pada Waktu Infeksi Produktif Oleh HPV Tipe Supergrup A (Doorbar, 2007)
2.5 Onkogenesis HPV
Pada kebanyakan penderita, infeksi HPV akan sembuh dengan sendirinya. Infeksi yang menetap (persisten) dapat menginduksi keganasan pada serviks. Faktor-faktor yang mempengaruhi proses onkogenesis HPV adalah faktor virus, antara lain tipe virus (kemampuan integrasi, kemampuan ekspresi onkogen), faktor hospes (respon imun humoral dan seluler, multi paritas, faktor genetik seperti HLA, p53) dan faktor lingkungan (merokok, kontrasepsi hormonal,
penyakit hubungan seksual, misalnya virus Herpes, dan faktor nutrisi) (Andrijono, 2012).
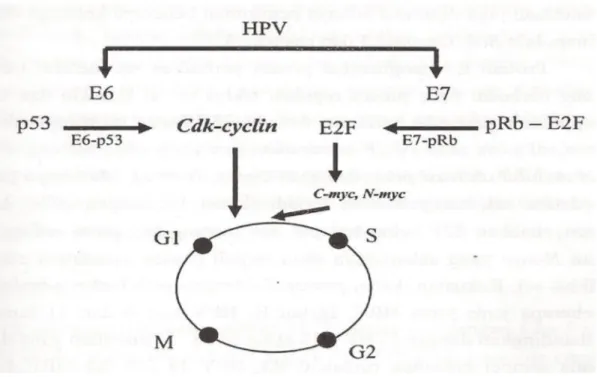
Human Papilloma Virus merupakan inisiator kanker serviks yang
menyebabkan terjadinya gangguan epitel serviks. Onkoprotein E6 dan E7 merupakan penyebab terjadinya degenerasi keganasan. Onkoprotein E6 akan berinteraksi dan menginaktivasi protein p53. Fungsi p53 adalah sebagai tumor
suppressor gene yang bekerja pada fase G1 dan p53 pada siklus sel berfungsi
menghentikan siklus sel pada fase G1. Kemampuan p53 menghentikan siklus sel melalui hambatannya pada kompleks cdk-cyclin. Kompleks ini berfungsi merangsang siklus sel untuk memasuki fase selanjutnya. Akibat hilangnya fungsi p53 maka penghentian sel pada fase G1 tidak terjadi, dan perbaikan DNA tidak terjadi sehingga sel akan terus masuk ke fase S tanpa ada perbaikan. Sel abnormal ini akan terus berproliferasi tanpa kontrol. Selain itu hilangnya fungsi p53 menyebabkan apoptosis tidak berjalan. Inaktivasi p53 dengan cara meningkatkan degradasi melalui ubiquitin-dependent proteolysis (Andrijono, 2012).
Pada karsinoma serviks didapatkan penurunan aktifitas Bcl-2, Bak, caspase 3
dan caspase 6, yang memiliki fungsi antiapoptosis. Onkoprotein E7 menghambat
proses perbaikan sel melalui mekanisme berbeda. Pada proses regulasi siklus sel di fase G0 dan G1, pRb berikatan dengan E2F, ikatan ini menyebabkan E2F menjadi tidak aktif (E2F merupakan protein yang akan merangsang siklus sel ). Masuknya onkoprotein E7 ke dalam sel, menyebabkan terjadinya ikatan E7 dengan pRb, ikatan ini menyebabkan E2F bebas terlepas dan merangsang proto-onkogen c-myc dan M-myc yang selanjutnya akan terjadi proses transkripsi
sehingga siklus sel berjalan. Kekuatan ikatan protein E7 dengan pRb berbeda-beda diantara beberapa jenis virus HPV. Ikatan E7 HPV tipe 6 dan 11 kurang kuat dibandingkan dengan E7 HPV tipe 16 dan 18 (Andrijono, 2012).
Integrasi DNA virus dengan genom sel tubuh merupakan awal dari proses yang mengarah ke transformasi. Integrasi DNA virus dimulai pada daerah E1-E2. Integrasi tersebut menyebabkan E2 tidak berfungsi sehingga menyebabkan overekspresi E6 dan E7. Hal tersebut menyebabkan siklus sel tidak terkontrol, perbaikan DNA dan apoptosis tidak terjadi.
Gambar 2.6 HPV menginduksi proliferasi sel dengan merangsang
cdk-cyclin,cmyc,N-myc ( Andrijono, 2012 )
Pada lesi jinak, genom virus dipertahankan dalam bentuk episom. Transkripsi sekuens yang mengkode E6/E7 akan menghasilkan mRNA yang mengandung sekuens 5’ AUUUA 3’ yang tidak stabil dan mempunyai waktu paruh pendek. Pada sel karsinoma serviks, genom virus terintegrasi ke dalam sel hospes.
Reorganisasi DNA virus ini mengakibatkan 3’ untranslated regions dikopi dari sekuens DNA hospes, akibatnya mRNA hybrid tidak mengandung sekuens
AU-rich yang tidak stabil. Hal ini meningkatkan stabilisasi mRNA virus yang
mengkode onkoprotein E6/E7. Artinya DNA HPV yang terintegrasi pada kanker serviks akan menghasilkan konsentrasi onkoprotein E6/E7 lebih tinggi (Andrijono, 2012).
Infeksi oleh HPV memerlukan partikel virus tersebut untuk dapat memasuki lapisan basal dari epitel serviks melalui mikrolesi. Infeksi tersebut menyebabkan terbentuknya genom HPV sebagai episom stabil di dalam sel tersebut. Protein virus E1 dan E2 diekspresikan untuk menginisiasi replikasi DNA virus, sedangkan
E6 dan E7 menginduksi aktivitas siklus sel pada sel-sel suprabasal yang
menyebabkan replikasi genom HPV melalui lapisan basal. Pada lapisan epitel sebelah atas dimana sel tereksfoliasi HPV mengekspresikan protein L1 dan L2 yang menyerupai struktur kapsid virus yang mengijinkan serangkaian genom yang bereplikasi dan penyebaran virus tersebut (Conesa-Zamora, 2013).
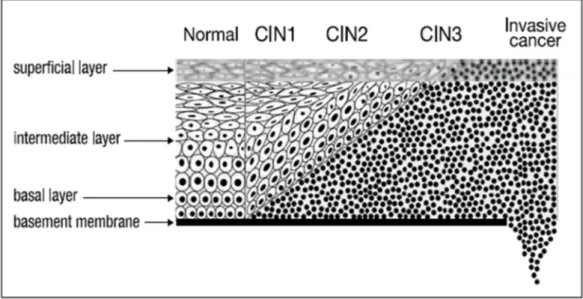
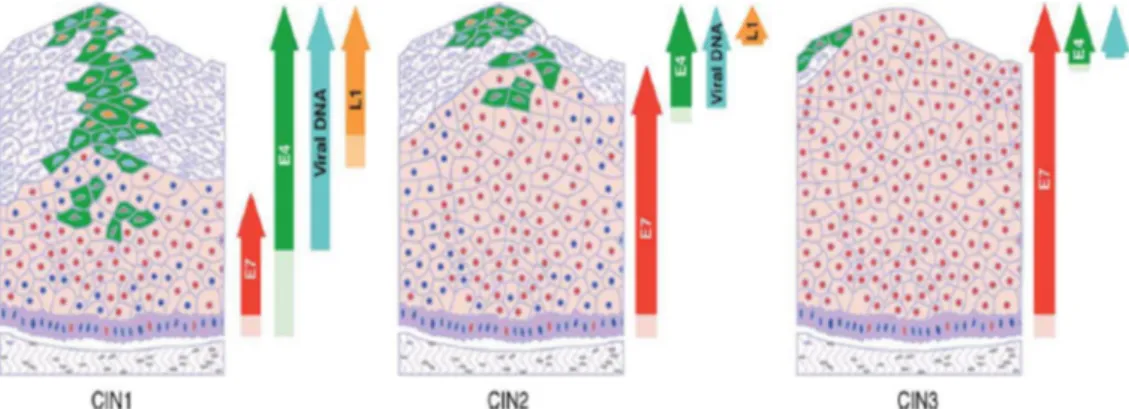
Pada sejumlah kecil persentase kasus, genotip high-risk HPV (HR-HPV) (HPV 16 dan 18) dapat menginisiasi terjadinya perubahan paksa dalam kendali siklus sel keratinosit yang dibuktikan secara morfologi dengan perubahan sitologi yang dikenal sebagai low-grade intraepithelial squamous intraepithelial lesions (LSILs) (yang juga dikenal sebagai NIS I atau kondiloma akuminata) yang dapat berkembang, sekitar 10% kasus, menjadi high-grade SIL (HSIL) (yang juga dikenal sebagai NIS 2-3). Meskipun diperkirakan 30% HSIL mengalami regresi, terdapat aktivasi yang berkesinambungan dari proliferasi oleh E7, diperberat
dengan peningkatan instabilitas kromosomal yang dikendalikan oleh E6.
Diperkirakan 20% NIS I akan berkembang menjadi NIS 2 dan 30% dari lesi ini akan berkembang menjadi NIS 3, dan 40% kasus, akan berkembang menjadi kanker serviks invasif. HSIL memiliki fase proliferasi yang lebih memanjang dibandingkan yang terutama disebabkan oleh perubahan ekspresi tingkat protein virus E6 dan E7 yang terjadi setelah integrasi genom virus ke dalam kromosom
sel inang (Andrijono, 2012; Conesa-Zamora, 2013).
Gambar 2.7 Proses Dari Epitel Normal Hingga Kanker Invasif (WHO, 2006)
Terdapat hubungan kuat antara derajat NIS dengan infeksi HPV. Pada NIS I atau LSIL infeksi yang dijumpai umummnya infeksi HPV tipe 6 atau 11. Kedua HPV ini tidak menyebabkan progresifitas ke derajat yang lebih tinggi. Pada HSIL terdapat hubungan yang kuat dengan infeksi HPV 16 dan 18, kedua tipe ini
merupakan tipe yang mempunyai onkoprotein. Infeksi ini menyebabkan perubahan lesi pada NIS II tanpa melalui NIS I. Dengan demikian terdapat dua alur perjalanan penyakit pada lesi prakanker yaitu melalui LSIL dan alur perjalanan penyakit langsung NIS II tanpa melalui LSIL (Andrijono, 2012).
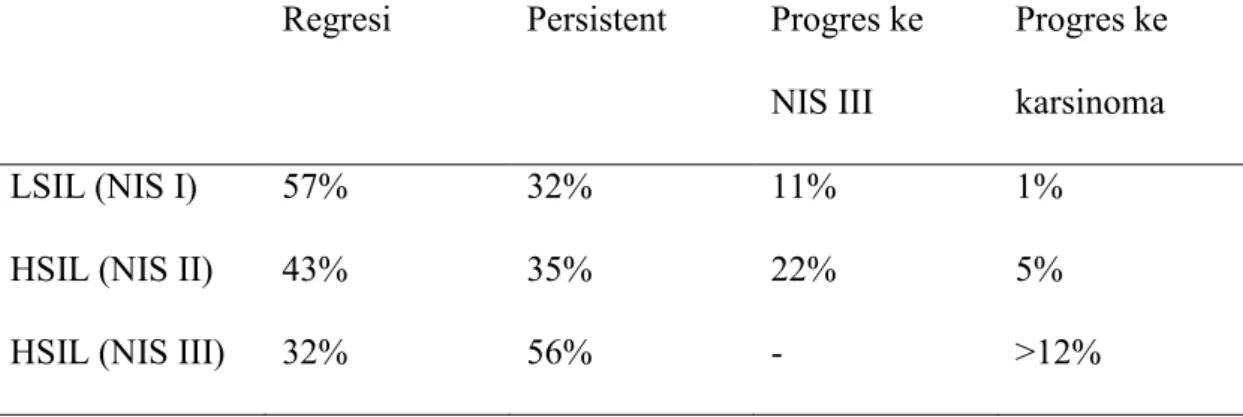
Tabel 2.2 Perjalanan Lesi Prakanker Serviks (Andrijono, 2012; Schorge et al.,2008)
2.6 Varian HPV pada Kanker Serviks
Data epidemiologi dan laboratorium menunjukkan bahwa infeksi persisten dari HPV karsinogenik menyebabkan hampir semua kanker serviks dan berbagai jenis kanker anogenital lainnya di seluruh dunia, berkontribusi terhadap jumlah satu setengah juta kanker anogenital setiap tahunnya. Tipe HPV servikal (n > 40) juga berperan sebagai agen yang ditularkan secara seksual, dan kebanyakan infeksi hilang dalam 1-2 tahun (Schiffman et al., 2008).
Tiga kelompok utama yang digabungkan termasuk spesies
alpha-papillomavirus α10, α8, α1 dan α13; α9, α11, α7, α5 dan α6; dan α4, α15, α3 dan
α2. Dicatat spesies α9, α11 dan α7 terdiri dari tipe karsinogenik yang dapat Regresi Persistent Progres ke
NIS III
Progres ke karsinoma
LSIL (NIS I) 57% 32% 11% 1%
HSIL (NIS II) 43% 35% 22% 5%
mengkode protein homolog E5, sedangkan yang lain kekurangan kemampuan
untuk mengkode E5 ORF dan/atau translasi kodon start untuk E5. Sebagai
pengecualian, tipe α10, yang menyebabkan kutil kelamin, juga dapat mengkode protein E5 (Schiffman et al., 2008).
HPV-16 memiliki prevalensi tertinggi dan penyebab terbanyak kanker atau CIN 3 jenis apapun. Tambahan pengujian PCR menunjukkan HPV 33 (α9) dalam 1 atau 2 kasus CIN 3/kanker berasal dari tipe HPV 11 saja, dan HPV 16 pada kasus yang berasal dari tipe HPV 71 saja (Schiffman et al., 2008).
2.7 Varian HPV-16
Faktor risiko primer pada perkembangan kanker serviks adalah infeksi persisten Human Papiloma Virus (HPV) tipe 16. Berdasarkan bukti penelitian potong-lintang bahwa diperkirakan 50% dari kanker serviks, dan bahkan lebih besar lagi persentase kanker serviks yang diinduksi HPV-non servikal (seperti kanker orofaringeal HPV postif), disebabkan oleh HPV 16 (Schiffman et al., 2008).
Sewaktu progresi dari NIS 1 ke NIS 3, regulasi normal dari siklus hidup virus papilloma hilang. NIS 1 secara umum menyerupai lesi produktif yang disebabkan oleh HPV tipe supergrup A lainnya, dan mengekspresikan protein selubung virus pada permukaan epitel. Pada lesi NIS 2 dan NIS 3, aturan dari kejadian siklus hidup HPV tidak berubah, tetapi meluas pada ekspresi E7 yang meningkat
Gambar 2.8 Perubahan Pada Siklus Hidup HPV 16 Sewaktu Perkembangan Kanker Serviks (Doorbar, 2007)
Untuk virus mukosa risiko tinggi seperti HPV 16, pembentukan dari lesi servikal difasilitasi oleh infeksi dari sel silinder, yang berlanjut untuk membentuk lapisan basal dari epitel berlapis atau zona transformasi (Doorbar, 2007).
2.8 Respon Imun
Transformasi maligna suatu sel dapat disertai dengan perubahan fenotipik sel normal dan hilangnya komponen antigen permukaan atau timbulnya neoantigen yang tidak ditemukan pada sel normal atau perubahan lain pada membran sel. Perubahan-perubahan tersebut dapat menimbulkan respon sistem imun (Kampono, 2011 ).
Efektor imun humoral dan seluler dapat menghancurkan sel tumor. Sistem imun adaptif terdiri dari imunitas selular dan humoral. Prinsip dari efektor imunitas selular adalah limfosit T, sedangkan prinsip dari efektor imunitas humoral adalah limfosit B. Baik limfosit T maupun B diturunkan dari stem cell. Sumsum tulang adalah tempat utama untuk maturasi dari sel B,
monosit-makrofag, sel dendritik dan granulosit yang terdiri dari sel stem pluripotensial. Prekursor sel T berasal dari sel stem hematopoetik dan berlokasi di timus untuk maturasinya. Limfosit T, limfosit B, monosit, dan sel dendritik yang matur memasuki sirkulasi dan tinggal di organ limfoid perifer (kelenjar getah bening, limpa) dan jaringan limfoid permukaan mukosa (usus, saluran kemih dan kelamin, serta saluran pernafasan) serta kulit dan membran mukosa untuk menunggu aktivasi oleh antigen asing (Fauci et al., 2008; Kampono, 2011).
Pada sel jaringan serviks, sistem imun bawaan seperti makrofag, sel Langerhans (LC), sel dendritik (DC), neutrofil, sel Natural Killer (NK), limfosit T γδ dan keratinosit, mengenali struktur asing yang tidak ditemukan pada hospes oleh reseptor-reseptor seperti Toll-like receptors (TLR) yang memberi tanda untuk menimbulkan ekspresi dari sitokin inflamasi dan kemokin seperti interleukin (IL) IL1β, IL6, IL8, IL12, tumor necrosis factor (TNFα) dan interferon (IFN) -α, -β dan -γ. Hal ini menyebabkan pengambilan sel-sel imun, sekresi dari faktor-faktor antimikrobial dan menghubungkan sistem imunitas bawaan dan adaptif. DC adalah antigen presenting cells (APC) yang pada pengenalan antigen dan sitokin inflamasi (seperti IFN-α, -β dan -γ yang menyajikan sel NK), melakukan upregulasi ekspresi dari MHC (HLA pada manusia) untuk mempresentasikan antigen yang telah diproses ke sel T. DC harus bermigrasi ke area sel T dari jaringan limfoid sekunder dan melakukan maturasi akhir melalui ekspresi dari molekul ko-stimulatorik seperti CD40 dan CD80 (B7.1) atau CD 86 (B7.2) yang akan mengikat pada CD154 (CD40L) atau protein CD28 yang diekspresikan oleh sel T antigen-spesifik. Ikatan ini menghasilkan rangsangan proliferasi sel T,
produksi IL-2 dan upregulasi agen anti-apoptosis (Conesa-Zamora, 2013).
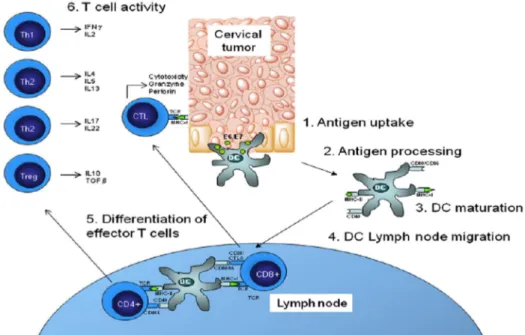
Gambar 2.9 Gambaran Sederhana dari Fungsi DC dan Aktivasi Sel T (Conesa-Zamora, 2013)
Dendritic cell (DC) dapat mengambil antigen HPV (seperti E6 dan E7) dari
tumor serviks, memproses mereka dan mempresentasikannya sebagai peptida pada molekul MHC kelas I dan II. Setelah proses maturasi melibatkan tambahan molekul ko-stimulatorik, DC bermigrasi ke kelenjar getah bening dimana kehadiran peptida-peptida terhadap sel T CD4 dan CD8, sel T Native akan diaktivasi oleh pengenalan kompleks MHC-peptida dan kemudian berproliferasi dan berdiferensiasi menjadi berbagai fenotip dengan fungsi efektor yang berbeda-beda pula (Conesa-Zamora, 2013).
2.8.1 Respon imun terhadap infeksi HPV
Human Papilloma Virus-16 risiko tinggi adalah genotipe yang paling sering
terlibat tetapi hanya sejumlah kecil wanita terinfeksi HPV yang berkembang menjadi HSIL, sedangkan sebagian besar virus tersebut hilang secara spontan. Terdapat banyak bukti yang menunjang pendapat bahwa status imunologis tergantung hospes dan perusakan sistem imun oleh HPV berperan dalam infeksi HPV persisten dan selanjutnya menyebabkan neoplasia serviks. Untuk itu peranan sistem imun tidak hanya untuk menghilangkan virus tetapi juga untuk pengenalan antigen tumor, yang sebagian besar bersangkutan dengan kasus karsinogenesis serviks (Karnen Garna Baratawidjaja, 2002; Conesa-Zamora, 2013).
Banyak bukti yang menunjukkan bahwa respon imun tergantung hospes yang sub-optimal yang dapat menjelaskan perbedaan antar individu mengenai prognosis dari infeksi HPV. Terlebih lagi, HPV terutama mampu menimbulkan reaksi imun yang buruk dengan meminimalisasi paparan antigen virus terhadap sel-sel epitel dan imunitas (Conesa-Zamora, 2013).
Sistem imun adaptif memainkan peran penting dalam proteksi vertebrata terhadap patogen dalam spektrum luas. Dalam konteks ini presentasi peptida antigenik oleh MHC kelas I terhadap Limfosit-T Sitotoksik (LTS) adalah kunci untuk respon imun seluler. Peptida-peptida ini pada mulanya berasal dari kompleks proteasom, suatu multisubunit, protease multikatalitik, dan ditranslokasikan dari sitosol ke dalam lumen retikulum endoplasma (RE) yang juga disebut sebagai transporter antigen peptide (TAP), yang merupakan anggota
dari protein ATP-binding cassette (ABC) protein superfamily dan dibentuk dari dua subunit TAP-1 dan TAP-2. Transport peptida oleh TAP adalah suatu proses
multi-step dalam hubungannya dengan singkatnya peptida terikat pada TAP,
diikuti dengan isomerisasi lambat dari kompleks TAP memicu terjadinya transport ikatan antigen-peptida tersebut (Ren et al., 2011).
Infeksi HPV yang persisten dan berubah menjadi perkembangan kanker serviks invasif terlihat sebagai gabungan efek dari virus tertentu (paling penting, genotip HPV) dan kemampuan tergantung hospes (pada dasarnya, status imunologis wanita). Mekanisme perusakan sistem imun oleh HPV mengakibatkan gangguan dalam tingkat yang berbeda-beda dari sistem imunitas bawaan dan adaptif termasuk pengiriman antigen, ekspresi sitokin, proses dan presentasi antigen. HPV jarang terdeteksi pada lokasi sistemik atau tipe sel lain selain sel epitel skuamosa. Hal ini menyebabkan minimalisasi paparan antigen HPV terhadap sel-sel imunitas, karena aktivitas virus tersebut yang sangat tergantung pada program diferensiasi dari keratinosit. Dalam hal ini, protein awal HPV diekspresikan dalam kuantitas rendah dan hanya terdapat di lapisan epitel basal dimana sel-sel memiliki kemampuan untuk berproliferasi, menyebabkan replikasi virus seiring dengan regenerasi epitel. Sedangkan, protein lanjut HPV, yang sangat imunogenik, hanya diekspresikan di lapisan bagian distal dimana APC sangat sedikit dan keratinosit dilepaskan ke dalam lumen serviks yang mempermudah proses penyebaran virus. HPV berkembang dengan mereduksi dan menghambat ekspresi protein kapsid (L1 dan L2).Mekanisme ini sebagian berdasarkan dari penggunaan HPV terhadap kodon sel mamalia yang jarang
digunakan sehingga produksi protein kapsid berkurang di lapisan basal dan tidak dapat bekerjasama dengan tRNA. Selanjutnya, HPV 16 E7 diekspresikan di
nukleus keratinosit dimana tidak dapat dicapai oleh APC dan menggunakan motif yang menyerupai protein manusia sehingga dapat menghindari pengenalan antigen (Conesa-Zamora, 2013).
Onkoprotein HPV mereduksi sekresi IFN pada keratinosit; E6 menginterfensi
β-IFN promoter-binding transcription factor IRF-3, mengurangi efek
transaktivasinya pada IFN-β. Selanjutnya, E7 memblok ekspresi gen IFN-α yang
dapat diinduksi. Protein E6 dan E7 mengurangi ekspresi TLR9. Protein awal HPV
juga mengganggu respon imun adaptif. Onkoprotein HPV E5, E6 dan E7
menginduksi down regulasi dari mesin untuk memproses dan mempresentasikan antigen dengan menghambat ekspresi dari TAP dan molekul MHC. HR dan LR-HPV dibedakan menurut kemampuannya melakukan down regulasi terhadap ekspresi MHC kelas I dan akhir-akhir ini didemonstrasikan bahwa HPV E7
mempengaruhi aktivitas histone deacetylase dan berperan pada peningkatan pengaruh LR HPV11 dan HR HPV16 pada inhibisi MHC (Conesa-Zamora, 2013). Pendesakan sistem imun melalui sebuah tekanan selektif oleh tumor menumbulkan mekanisme pengelabuan sistem imun yang dikenal immunoediting, terdiri dari (Conesa-Zamora, 2013):
a) Mereduksi ekspresi antigen tumor
b) Menghindarkan presentasi antigen oleh down regulasi MHC kelas I dan/atau ketidakefektifan antigen processing
d) Menginduksi ekspresi dari molekul dengan aktivitas imunosupresif e) Merekrut sel-sel imunitas yang menyebabkan berkurangnya reaksi imun.
Mekanisme-mekanisme tersebut adalah sama dengan mekanisme akibat penekanan protein HPV E6 dan E7 dan maka dari itu terjadi tumpang tindih pada
karsinogenesis servikal sehingga sulit untuk memisahkan perusakan sistem imun yang dikendalikan oleh HPV dan tumor karena dengan peningkatan ekspresi E6
dan E7 berkaitan dengan perkembangan kanker serviks (Conesa-Zamora, 2013).
Gambar 2.10 Mekanisme Utama Gangguan Sistem Imun yang Diinduksi HPV (Conesa-Zamora, 2013)
2.9 Major Histocompability Complex
Major Histocompatibility Complex (MHC) atau disebut juga sebagai Human Leucocyte Antigen (HLA) merupakan suatu molekul protein yang dapat
ditemukan pada permukaan sel berperan untuk pengenalan fragmen antigen, yang merupakan seluruh kompleks aloantigen yang terdapat pada permukaan sel manusia. Ekspresi MHC dikode oleh gen pada kromosom 6. Kompleks gen MHC merupakan suatu polimorfik (terdapat sekitar 50 alel pada lokus A, C dan 100 alel B yang berbeda) ( George and Mittal, 2011).
Fungsi MHC adalah untuk membedakan self dan nonself antigen, kemudian mempresentasikan antigen tersebut ke sel T, dan membedakan interaksi antara sel B, sel T dan sel tambahan lain. MHC yang mengikat suatu peptida oleh reseptor sel T adalah MHC yang tertentu saja. Peptida asing hanya dapat dikenali jika sel target memiliki molekul MHC yang sama dengan sel T itu sendiri. Peptida yang tepat dimuat oleh molekul MHC yang spesifik. MHC dibagi dalam 3 kelas, yaitu MHC kelas I, MHC kelas II, dan MHC kelas III (George and Mittal, 2011; NCBI, 2014).
Protein MHC kelas I ditemukan pada semua permukaan sel berinti. Protein ini bertugas mempresentasikan antigen peptida ke sel T sitotoksik yang secara langsung akan menghancurkan sel yang mengandung antigen asing tersebut. Protein MHC kelas I terdiri dari dua polipeptida, yaitu rantai membrane
integrated alfa (α) yang dikode oleh gen MHC pada kromosom nomor 6, dan non-covalently associated beta-2 mikroglobulin (β2m). Rantai α akan melipat dan
membentuk alur besar antara domain α1 dan α2 yang menjadi tempat penempelan molekul MHC dengan antigen protein. Alur tersebut tertutup pada pada kedua
ujungnya dan peptida yang terikat sekitar 8-10 asam amino. MHC kelas satu juga memiliki dua α heliks yang menyebar di rantai beta sehingga dapat berikatan dan berinteraksi dengan reseptor sel T (Neumann, L., 2008; NCBI, 2014).
Protein MHC kelas II terdapat pada permukaan sel B, makrofag, sel dendritik, dan beberapa APC khusus. Melalui protein MHC kelas II inilah, APC dapat mempresentasikan antigen ke sel-T helper yang akan menstimulasi reaksi inflamatori atau respon antibodi. MHC kelas II ini terdiri dari dua ikatan non kovalen polipeptida membran terintegrasi yang disebut α dan β. Biasanya, protein ini akan berpasangan untuk memperkuat kemampuannnya untuk berikatan dengan reseptor sel T. Domain α1 dan β1 akan membentuk tempat untuk pengikatan MHC dan antigen. Sementara untuk MHC-III masih belum dieksplorasi dan sedikit berhubungan dengan sistem imun (NCBI, 2014).
2.10 Alel HLA dan Risiko Kanker Serviks
Gen untuk Transporter Antigen Peptide (TAPs) terletak di dalam regio MHC kelas II pada kromosom 6 diantara lokus HLA DP dan HLA DQ, dan berperan penting pada jalur processing dan presentasi untuk antigen intraselular. Produk dari gen TAP membentuk kompleks heterodimerik yang mentranslokasi antigen peptida dari sitoplasma ke dalam retikulum endoplasma untuk mengikat molekul MHC kelas I untuk presentasi sel T sitotoksik CD8+ (Wang et al., 2012). Gen TAP terlibat pada proses antigen endogen sedangkan HLA-DM berpartisipasi pada proses antigen ekosgen (Xiaochun et al., 2008).
Transporter Antigen Peptide (TAP) adalah faktor kunci dari jalur presentasi
antigen tergantung MHC kelas I (Abele and Tampé, 2007). Sistem proteasom adalah sistem proteolitik sentral pada sel eukariotik dan memainkan peran penting dalam generasi peptida MHC kelas I (Wang et al., 2012). Kompleks peptida-MHC stabil ditransportasikan ke permukaan sel untuk mempresentasikan kargo antigenik nya ke limfosit-T sitotoksik CD8+. Pengenalan antigen virus atau tumor
menyebabkan eliminasi yang efisien terhadap sel yang terinfeksi atau sel malingansi. Mekanisme Manifold terlibat dalam regulasi aktivitas TAP. Sewaktu infeksi, ekspresi TAP mengalami upregulasi oleh interferon-γ. Kemudian, rangkaian dan stabilitas dari kompleks transport dipromosikan oleh faktor-faktor penunjang yang bervariasi. Akan tetapi, tumor dan virus mengembangkan strategi untuk menghindari serangan dari sistem imun dengan menekan fungsi TAP (Abele and Tampé, 2007; Neumann L. et al., 2007;Vermeulen et al., 2007; Wang
et al., 2012).
Gambar 2.11 Jalur Presentasi Antigen Melalui Molekul MHC Kelas I (Abele and Tampé, 2007)
Rantai berat MHC Kelas I ditranslokasikan secara ko-translasi ke dalam RE, kemudian melipat dan bergabung dengan β2-mikroglobulin dibantu oleh
immunoglobulin binding protein (BiP) dan calnexin. Berikutnya, molekul MHC
kelas I direkrut ke dalam makromolekular peptide-loading complex (PLC) yang terdiri dari calreticulin, Erp57, tapasin, TAP-1 dan TAP-2. Peptida yang diturunkan terutama dari degradasi proteasomal di dalam sitosol ditranslokasikan oleh TAP ke dalam lumen RE, yang kemudian dimasukan ke dalam molekul MHC kelas I yang belum terangkai. Kompleks peptida MHC yang stabil secara kinetik dapat menghindari kontrol kualitas RE dan ditransportasikan melalui Golgi ke permukaan sel. Ikatan reseptor sel-T dan ko-reseptor CD8 terhadap molekul MHC kelas I trimerik memicu pembunuhan sel target (Abele and Tampé, 2007).
2.11 Polimorfisme Genetik
Polimorfisme genetik adalah perbedaan rangkaian DNA yang terdapat di antara individu, kelompok, atau populasi. Perbedaan ini meliputi SNP (Single
Nucleotide Polymorphism), rangkaian pengulangan, insersi, delesi dan
rekombinasi. Poliformisme genetik dapat merupakan suatu hasil dari proses perubahan atau dapat juga diinduksi oleh agen dari luar dalam hal ini virus. Jika perbedaan pada rangkaian DNA yang terdapat pada seseorang berkaitan dengan adanya suatu penyakit, maka itu disebut mutasi genetik. (George and Mittal, 2011; Wang et al., 2012).
Single Nucleotide polymorphism (SNP) adalah suatu variasi rangkaian DNA
satu dengan yang lain pada satu spesies yang sama atau pada satu kromosom berpasangan pada manusia. SNP merupakan sumber variasi pada suatu genom. SNP merupakan penyebab paling umum dari variasi genetik yang tedapat pada genom manusia (90% dari semua polimorfisme DNA pada manusia). Kebanyakan
SNP yang umum hanya mempunyai dua alel (Cao et al., 2007; Wang et al., 2012).
Ada 2 bentuk substitusi basa nulkeotida yang dihasilkan SNP yaitu substitusi transisi yang terjadi antara basa purin (A,G) atau basa purimidin (C, T). Tipe substitusi transversi ini merupakan 2/3 dari jumlah total SNP, substitusi transversi yang terjadi di antara basa purin dan pirimidin. Dalam suatu populasi, penggunaan definisi SNP dapat juga dimaksudkan untuk suatu kelompok alel mayor yaitu alel dengan jumlah paling banyak pada suatu lokus yang diamati pada sebuah populasi yang umum. Ini dimaksudkan untuk menyederhanakan frekuensi dua alel menjadi SNP. Didapatkan variasi diantara populasi manusia, jadi alel SNP yang umum pada suatu geografis atau etnis tertentu dapat menjadi jarang didapatkan pada kelompok lain (Cao et al., 2007; Wang et al., 2012).
2.12 Transporter Antigen Peptide
Transporter Antigen Peptide (TAP) merupakan keluarga transporter ATP-binding cassete (ABC), yang mentranslokasi suatu substrat yang bervariasi secara
luas melalui membran yang digerakan oleh hidrolisis ATP. Human TAP membentuk heterodimer yang terdiri dari TAP-1 dan TAP-2. Kedua subunit tersebut sangat penting dan dibutuhkan untuk transport peptida. TAP terletak di dalam RE dan cis-Golgi. Masing-masing subunit terdiri sari suatu transmembrane
TMD terdiri dari kantung ikatan peptida dan jalur translokasi untuk substrat tersebut. Dari analisis hidrofobisitas dan penyetaraan sekuensi dari glikoprotein-P, heliks transmembran 10 dan 9 telah diprediksi untuk TAP-1 dan TAP-2, secara berturut-turut. Secara jelas, kekurangan TAP-1 dan TAP-2 berdasarkan empat dan tiga heliks transmembran, secara berturut-turut, ditargetkan pada membran RE dan dipasang ke dalam kompleks transport heterodimerik berfungsi secara lengkap, mendemonstrasikan bahwa regio terminal-N ekstra (domain-N) dari kedua subunit tidak diperlukan untuk ikatan dan transport peptida. Regio terminal-N ini telah diidentifikasi sangat diperlukan untuk ikatan tapasin dan penggabungan kompleks peptida yang dimasukan. NBD yang mengandung motif walker A/B yang sangat hemat dan C-loop (ABC-signature) memberikan energi transport peptida dengan ikatan ATP dan hidrolisis (Abele and Tampé, 2007; Neumann et al., 2008).
Gen TAP-1 berada pada lengan kromosom 6 pada urutan basa 32812986 hingga 32821748. Untuk gen TAP-2 dikenal juga dengan nama “transporter 2,
ATP-binding cassette, sub-family B (MDR/TAP)”berada pada lengan kromosom 6 pada urutan basa 32789610 hingga 32806547. Keduanya, dikodekan dalam wilayah MHC kelas II dari kromosom 6 yang merupakan bagian integral pengolahan protein untuk seleksi awal oleh molekul MHC kelas I. Mereka membawa peptida dengan konfigurasi yang benar untuk berhubungan dengan molekul MHC kelas I dari tempat pembelahan proteolitik pada sitoplasma ke lumen retikulum endoplasma dimana molekul MHC kelas I dirakit (NCBI, 2014).
lokus HLA pada kromosom. Regio MHC kelas II merupakan faktor suseptibilitas penting dan HLA-DR4 berhubungan dengan perjalanan penyakit yang berbahaya. Gen TAP terletak di regio kelas II kompleks HLA. Polimorfisme TAP-2 diidentifikasi dapat terjadi pada manusia. Mengingat presentasi antigen memainkan peran penting pada respon imun, hubungan antara MHC-encoded
antigen processing genes seperti TAP, LMP dan DMA telah diinvestigasi dapat
terjadi pada penyakit autoimun atau inflammatory bowel disease. Gen TAP-2 terlibat dalam presentasi antigen oleh molekul MHC kelas I, terutama pada transport peptida endogen (George and Mittal, 2011).
Siklus transport merupakan gabungan proses multi-langkah dari ikatan peptida dan ATP, hidrolisis ATP dan translokasi peptida. Perubahan bentuk yang kedua terjadi setelah ikatan ATP, dimulai sejak mobilitas membran lateral dari TAP berkurang secara drastis ketika timbul peptida dan ATP. TAP paling efisien mengikat dan mentransportasikan peptida dengan panjang 8-16 dan 8-12 asam amnio, secara berturut-turut. Spesifisitas peptida dari TAP terbatas pada tiga residu terminal-N dan residu terminal-C. Spesifisitas terhadap residu terminal-C sangat serupa diantara kompleks TAP, imunoproteasom, dan molekul MHC kelas I, menunjukkan ko-evolusi dari faktor-faktor ini. Akan tetapi panjang dari peptida sebagaimana spesifisitas terhadap residu terminal-N berbeda antar TAP, proteasom dan molekul MHC kelas I. Peptida yang ditransport oleh TAP berikutnya diolah oleh eksopeptidase amino di dalam RE. Rangkaiannya terdapat di antara regio jangkar ke duanya, yang dikenali oleh reseptor sel-T, yang sangat membedakan antara TAP dan ikatan MHC kelas I. Jenis dari promiskuitas
kelompok ini meyakinkan bahwa satu kombinasi kompleks TAP dengan yang terbatas pada alel MHC kelas I dapat menawarkan jumlah peptida yang hampir tidak terbatas untuk melindungi organisme terhadap patogen intraseluler maupun transformasi maligna (Abele and Tampé, 2007).
Peptida dan ATP mengikat secara independen satu terhadap yang lainnya terhadap TAP. Akan tetapi, hidrolisis ATP secara langsung berpasangan dengan transport peptida, ketika ikatan peptida berkolerasi dengan aktivitas ATPase. Pada proses ini, terdapat suatu kontrol kualitas, ketika peptida dengan rantai samping yang menonjol, yang mengikat tetapi tidak ditransportasikan oleh TAP, tidak menginduksi hidrolisis ATP. Meskipun kedua subunit TAP menunjukkan kemampuan fungsional asimetrik, keduanya terlibat dalam pembentukan energi transport peptida dalam suatu cara transportasi tergantung-peptida (Abele and Tampé, 2007; George and Mittal, 2011).
Gambar 2.12 Model Skematik dari Kompleks TAP (Abele and Tampé, 2007).
Transporter Antigen Peptide (TAP) membentuk suatu heterodimer yang
terdiri dari TAP-1 dan TAP-2. Setiap subunit terdiri dari suatu domain transmembran terminal-N dan suatu terminal-C, NBD Sitosolik (warna merah pada gambar). Domain transmembran dapat di subdivisikan ke dalam suatu domain inti mengandung enam heliks dan suatu ekstensi terminal NH2- dari empat
dan tiga heliks untuk TAP-1 dan TAP-2, secara berturut-turut. Disamping jalur translokasi, TMD juga membentuk regio ikatan-peptida (warna jingga pada gambar) (Abele and Tampé, 2007).
Subregio TAP terdiri dari dua gen yang dikenal sebagai TAP-1 dan TAP-2. Protein TAP-1 dan TAP-2 berpasangan untuk membentuk heterodimer yang bergabung ke dalam membran dari retikulum endoplasma. Transport molekul TAP dalam suatu jalur tergantung ATP peptida diturunkan dari protein sitoplasmik endogen ke dalam lumen untuk memuat molekul MHC kelas I yang baru disintesis. Kompleks peptida MHC kelas I diekspresikan pada permukaan sel dan dikenali oleh sel T CD8+ (Vermeulen et al., 2007; Xiaochun et al., 2008; George and Mittal, 2011).
Transporter Antigen Peptide (TAP) saja cukup untuk translokasi peptida ke
dalam lumen RE. Akan tetapi, di dalam jalur proses antigen MHC kelas I, TAP adalah bagian dari PLC multi komponen. Kompleks makro molekular ini terdiri dari satu heterodimer TAP, bersama-sama dengan empat tapasin dan empat molekul MHC kelas I. Sebagai tambahan, lectin-like chaperones calreticulin dan
calnexin, sebagaimana oksidoreduktase Erp57 adalah saling terkait. Calnexin, calreticulin dan Erp57, terlibat dalam pematangan molekul MHC kelas I. Tapasin
merekrut anggota lain dari PLC dan menghubungkan mesin translokasi peptida TAP ke resipien peptida MHC kelas I. Domain lumen RE dari tapasin terikat pada molekul MHC kelas I dengan stoikiometri 1:1. Interaksi ini menahan molekul MHC kelas I kemudian dibawa oleh peptida afinitas rendah di dalam RE dan meyakinkan bahwa hanya kompleks MHC-peptida stabil yang dapat meninggalkan RE. Mekanisme detil dari bagaimana tapasin memfasilitasi dan mengendalikan pengikatan peptida terhadap molekul MHC kelas I masih dalam perdebatan. Heliks transmembran dari tapasin terikat ke domain-N dari subunit TMD dari subunit TAP. Bagaimana tapasin berhubungan dengan TAP masih merupakan teka-teki, homologi antara domain-N dari TAP-1 dan TAP-2 memiliki sedikit perbandingan terhadap protein lainnya. Dengan peningkatan waktu paruhnya, tapasin juga menstabilkan kompleks TAP, menyebabkan tingkat ekspresi tingkat-stabil yang lebih tinggi dan, sebagai akibatnya, angka transport peptida lebih tinggi. Tingkat TAP yang lebih tinggi akibat peningkatan termostabilitas TAP dalam hadirnya tapasin. Pada defisiensi tapasin sel atau ekspresi sel mutan tapasin, yang tidak dapat terikat pada TAP, tingkat stabil TAP berkurang hingga 100 kali lipat (Abele and Tampé, 2007).
Stabilitas dari kompleks TAP tidak hanya tergantung dari interaksinya dengan tapasin, tetapi juga interaksi antara kedua subunit. TAP saja dapat diekspresikan pada sel T2 defisiensi TAP. Akan tetapi, ekspresi dari TAP-2 tunggal tidak terlihat pada sel-sel yang diisolasi dari pasien Bare Lymphocytes
Syndrome (BLS) tipe 1 yang kekurangan ekspresi TAP-1. Pada human melanoma cell line buf1280, gen TAP-1 mengalami mutasi delesi pada posisi 1489,
menyebabkan perubahan bentuk dan menyebabkan kodon stop dini. Pada sel ini, mRNA dari TAP-1 dan TAP-2 ada, tetapi, baik TAP-1 dan TAP-2 tidak dapat dideteksi pada tingkat protein. Setelah mengenalkan TAP-1 wild-type (wt) pada garis sel, ekspresi TAP-1 dan TAP-2 normal dikembalikan sebagaimana transport peptida. Untuk itu, tampaknya TAP-2 hanya stabil jika ada TAP-1 dan TAP-2 terdegradasi secara cepat, kemungkinan oleh jalur degradasi proteasomal. Menariknya, interferon-γ, yang dilepaskan sewaktu infeksi, meningkatkan ekspresi rantai berat MHC kelas I, β2m, tapasin, TAP-1, dan TAP-2. Penelitian pendahulunya menunjukkan bahwa ekspresi TAP-1 dan TAP-2 diatur sebagian besar oleh perbedaan jalur messenger ke dua dan faktor transkripsi (Abele and Tampé, 2007; George and Mittal, 2011).
Banyak virus, sebagian besar merupakan virus DNA bereplikasi lambat, berkembang dengan mekanisme tertentu untuk menghindari respon imun. Strategi ini mencegah atau menghambat pengenalan oleh sistem imun terhadap sel yang terinfeksi menyebabkan virus bereplikasi, berkoloni pada sel inang, dan berpindah pada individu lainnya. Seringkali, faktor virus memblok fungsi dari jalur presentasi antigen MHC kelas I dan, oleh sebab itu, mencegah pengenalan dan eliminasi dari limfosit T sitotoksik. Terutama pada virus persisten yang bergantung pada mekanisme pengenalan sel T. Sebagai tambahan disamping molekul MHC kelas I, TAP, dan faktor-faktor PLC merupakan suatu target penting dari serangan virus. Transport peptida ke dalam RE dapat terganggu dengan mekanisme yang berbeda-beda, termasuk downregulasi dari ekspresi TAP, meningkatkan degradasi yang dimediasi oleh faktor virus, memblokade transport
peptida dengan interaksi langsung (Abele and Tampé, 2007; George and Mittal, 2011).
Untuk sel yang terinfeksi oleh HPV onkogenik tipe 18 ditemukan downregulasi dari transkripsi TAP-1. Protein E7 dari HPV 18 dan protein E1A
dari Ad-12 menekan secara berulang-ulang aktivitas promoter TAP-1. Meskipun ke dua virus DNA tersebut termasuk kelas virus yang berbeda, dua faktor tersebut serupa dalam struktur dan fungsi (Abele and Tampé, 2007; Xiaochun et al., 2008). Variasi dari transporter ABC berkaitan dengan kanker pada manusia. Glikoprotein-P (ACBC1), anggota dari multi-drug resistance related protein (MRP), dan ABCG2 transport obat antikanker keluar dari sel, yang diduga merupakan penyebab resistensi sel terhadap kemoterapi. Selain itu, suatu downregulasi permukaan dari molekul MHC kelas I pada sel tumor seringkali terlihat, yang memfasilitasi sel-sel ini untuk menghindari serangan sistem imun dengan menekan presentasi antigen tumor-spesifik. Defisiensi ekspresi dari permukaan MHC kelas I dapat disebabkan oleh defek pada ekspresi atau fungsi dari faktor-faktor pada jalur presentasi antigen MHC kelas I. Sering kali, downregulasi dari MHC kelas I berkaitan dengan malfungsi TAP. Rendah atau hilangnya ekspresi TAP pada sel tumor mengganggu pembentukan kompleks peptida-MHC I di dalam RE. Lebih tingginya frekuensi delesi dari kompleks TAP terlihat pada lesi metastatik daripada lesi primer (Abele and Tampé, 2007).
Terdapat mekanisme yang berbeda-beda untuk downregulasi dari TAP pada sel-sel keganasan. Pertama, mutasi pada gen TAP-1. Tercatat pada salah satu kasus, di mana delesi dari satu nukleotida dari gen TAP-1 menyebabkan kodon
stop dini. Subunit yang rusak ini tidak dapat membentuk kompleks TAP fungsional. Kemudian lebih sering, tingkat mRNA dari TAP berkurang pada sel-sel malignansi. Pada kasus ini, ekspresi TAP dapat dikembalikan dengan terapi IFN-γ. Dengan chromatin immunoprecipitation assays, angka transkripsi dari gen TAP-1 dianalisis pada murine carcinoma cell lines. Dengan membandingkan tingkat RNA polimerase II pada 3’ dan mengkode regio dan regio sebelumnya dari gen TAP-1, hal ini menjadi semakin jelas bahwa reduksi angka transkripsi tergantung pada inisiasi gangguan dari transkripsi. Promoter TAP-1 tidak menunjukkan mutasi pada CMT.64 cell line. Analisis oleh promoter TAP-1 meningkatkan ekspresi enchanced green fluoroscent protein (EGFP) mendemonstrasikan bahwa aktivitas promoter dapat dikembalikan oleh IFN-γ, mengindikasikan bahwa promoter terdiri dari elemen cis-acting, mempengaruhi aktivitas yang relatif rendah pada sel yang defisiensi TAP-1. Selain itu, elemen
cis-acting, faktor trans-acting sepertinya terlibat dalam regulasi aktivitas promoter
TAP-1, ketika terjadi fusi dari sel karsinoma defisiensi TAP-1 dan wt fibroblas dikembalikan defisiensi TAP, paling sedikit sebagian besarnya. Pada epitel sel karsinoma dengan defisiensi TAP tidak semata-mata akibat inhibisi dari transkripsi, ketika terjadi penurunan tersebut tetapi aktivitas promoter dapat dideteksi. Kemudian, fusi fibroblas dengan epitel sel karsinoma defisiensi TAP-1, menunjukkan stabilitas terutama mRNA TAP-1, tetapi tidak berhubungan dengan mRNA. Akselerasi degradasi dari mRNA TAP-1 juga ditemukan pada human
SK-MEL-19 melanoma cell line mengandung delesi tunggal nukleotida pada posisi
IFN-γ, mRNA TAP-1 tidak dapat dideteksi. Mekanisme degradasi ini belum diketahui, tidak dipegaruhi oleh pengrusakan mRNA nonsense-mediated, karena delesi dari dua tambahan nukleotida pada regio ini, yang dikoreksi oleh mutasi
nonsense, tidak dapat mengembalikan stabilitas mRNA TAP1. Secara kontras
terhadap IFN-γ, interleukin-10 (IL-10) menyebabkan downregulasi dari TAP dan, berikutnya, mengurangi ekspresi permukaan molekul MHC kelas I, fakta ini menjadi sebuah relevansi klinis, semenjak sejumlah besar tumor manusia mensekresikan IL-10 (Abele and Tampé, 2007; Xiaochun et al., 2008).