IDENTIFIKASI KANDUNGAN DAGING BABI
PADA BEEF BURGER MENGGUNAKAN METODE RT-PCR
SKRIPSI
Oleh :
DEA YULIA IKHLAS SURI
13613087
PROGRAM STUDI FARMASI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS ISLAM INDONESIA
YOGYAKARTA MARET 2018
ii
IDENTIFIKASI KANDUNGAN DAGING BABI
PADA BEEF BURGER MENGGUNAKAN METODE RT-PCR
SKRIPSI
Diajukan untuk memenuhi salah satu syarat mencapai gelar Sarjana Farmasi (S.Farm) Program Studi Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Islam Indonesia Yogyakarta
Oleh :
DEA YULIA IKHLAS SURI
13613087
PROGRAM STUDI FARMASI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS ISLAM INDONESIA
YOGYAKARTA MARET 2018
vi
KATA PENGANTAR
Assalamu’alaikum Wr. Wb.
Alhamdulillahirabbil’aalamiin, puji syukur ke hadirat Allah SWT yang telah
melimpahkan rahmah, petunjuk dan kemudahan-Nya sehingga penulis mampu menyelesaikan penelitian skripsi yang berjudul “Identifikasi Kandungan Daging Babi Pada Beef Burger Menggunakan Metode RT-PCR”. Skripsi ini disusun dalam rangka memenuhi salah satu syarat untuk mencapai gelar Sarjana Farmasi Program Studi Farmasi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Islam Indonesia.
Banyak pihak yang memberikan bantuan dan masukan baik berupa moril dan materi. Untuk itu, penulis mengucapkan terimakasih yang sebesar-besarnya kepada:
1. Bapak Ari Wibowo, S.Farm., M.Sc., Apt. selaku dosen pembimbing utama atas segala bimbingan, arahan, dan dukungan sampai terselesaikannya skripsi ini.
2. Ibu Sista Werdyani, S.Farm., M.Biotech., Apt. selaku dosen pembimbing pendamping atas segala bimbingan, arahan dan dukungan sampai terselesaikannya skripsi ini.
3. Ibu Annisa Fitria, S.Farm., M.Sc., Apt. yang sudah bersedia menjadi penguji skripsi penulis.
4. Ibu Dr. Vitarani Dwi Ananda Ningrum, S.Si., M.Si., Apt. yang sudah bersedia menjadi penguji skripsi penulis.
5. Orang tua penulis (Bapak Ermunanto dan Ibu Risma Uli Siahaan) selaku kedua orang tua hebat yang bersedia menjadi tempat berkeluh kesah, memberikan doa dan memberi motivasi hingga terselesaikannya skripsi ini. 6. Laboran Mbak Naim, Mbak Yuli dan staf Program Studi Farmasi Fakultas
MIPA Universitas Islam Indonesia yang telah membantu dengan sabar hingga terselesaikannya skripsi ini.
viii
DAFTAR ISI
HALAMAN SAMPUL ... i
HALAMAN JUDUL ... ii
HALAMAN PERSETUJUAN ... Error! Bookmark not defined. HALAMAN PENGESAHAN ... iii
PERNYATAAN ... Error! Bookmark not defined. KATA PENGANTAR ... vi
DAFTAR ISI ... viii
DAFTAR GAMBAR ... x
DAFTAR TABEL ... xi
DAFTAR LAMPIRAN ... xii
INTISARI ... xiii
ABSTRACT ... xiv
BAB IPENDAHULUAN ... 1
1.1. Latar Belakang Masalah ... 1
1.2. Perumusan Masalah ... 2
1.3. Tujuan Penelitian... 3
1.4. Manfaat Penelitian ... 3
BAB IISTUDI PUSTAKA ... 4
2.1. Tinjauan Pustaka ... 4
2.1.1. Beef Burger ... 4
2.1.2. Daging Babi dan Keharamannya ... 4
2.1.3. DNA Babi ... 5
2.1.4. Deoxyribonecleic Acid (DNA) ... 5
2.1.5. Isolasi DNA ... 8
2.1.6. Polymerase Chain Reaction (PCR) ... 10
2.1.7. Real-Time PCR ... 16
2.1.8. Perbandingan Metode Mendeteksi Kandungan Babi ... 18
2.2. Landasan Teori ... 19
2.3. Hipotesis ... 20
BAB IIIMETODE PENELITIAN ... 21
3.1. Bahan dan Alat ... 21
ix
3.1.2. Alat ... 21
3.2. Sistematika Kerja Penelitian ... 21
3.2.1. Preparasi dan Isolasi DNA Kontrol ... 21
3.2.2. Pengumpulan Sampel Beef Burger ... 22
3.2.3. Preparasi dan Isolasi DNA Sampel Beef Burger ... 23
3.2.4. Uji Kualitatif DNA Menggunakan Elektroforesis ... 24
3.2.5. Uji Kuantitatif DNA Menggunakan Spektrofotometer ... 25
3.2.6. Amplifikasi DNA dengan Real-Time PCR ... 25
3.2.7. Uji Spesifisitas dan Sensitivitas ... 26
3.3. Analisa Hasil ... 27
3.4. Skema Penelitian ... 28
BAB IVHASIL DAN PEMBAHASAN ... 29
4.1. Hasil Isolasi DNA ... 29
4.2. Uji Spesifisitas Primer ... 32
4.3. Uji Sensitivitas ... 34
4.4. Uji Sampel Beef Burger ... 37
BAB VKESIMPULAN DAN SARAN ... 40
5.1. Kesimpulan ... 40
5.2. Saran ... 40
x
DAFTAR GAMBAR
Gambar 2.1 Struktur DNA ... 6
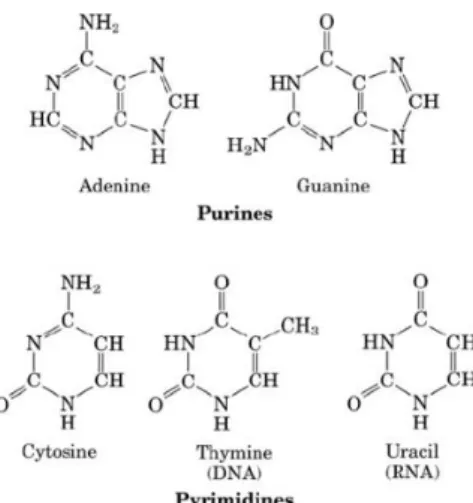
Gambar 2.2 Struktur Purin dan Pyrimidin (Adenin, Guanin, Cytosin,Tymin dan Urasil) ... 6
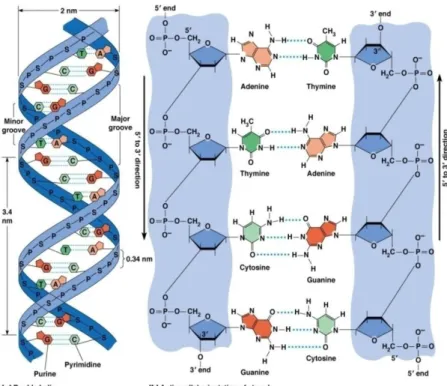
Gambar 2.3 Struktur Double Heliks DNA ... 7
Gambar 2.4 Siklus PCR ... 14
Gambar 2.5 Bentuk kurva pada Real-Time PCR ... 17
Gambar 4.1 Hasil Elektroforesis isolasi DNA kontrol pada gel agarosa 0,8% ... 29
Gambar 4.2 Hasil Elektroforesis isolasi DNA sampel beef burger pada gel agarosa 0,8% ... 30
Gambar 4.3 Hasil amplifikasi spesifisitas primer for pig detection macrogen® pada RT-PCR ... 33
Gambar 4.4 Hasil melt curve spesifisitas primer for pig detection macrogen® pada RT-PCR ... 33
Gambar 4.5 Hasil amplifikasi sensitivitas primer for pig detection macrogen® pada RT-PCR ... 34
Gambar 4.6 Hasil melt curve sensitivitas primer for pig detection macrogen® pada RT-PCR ... 35
Gambar 4.7 Hasil amplifikasi uji sampel beef burger menggunakan primer for pig detection macrogen® pada RT-PCR ... 37
Gambar 4.8 Hasil amplifikasi uji negatif palsu sampel beef burger menggunakan primer for pig detection macrogen® pada RT-PCR ... 38
Gambar 4.9 Hasil melt curve uji negatif palsu sampel beef burger menggunakan primer for pig detection macrogen® pada RT-PCR ... 39
xi
DAFTAR TABEL
Tabel 3.1 Kriteria pengumpulan sampel beef burger ... 23
Tabel 3.2 Amplifikasi DNA ... 26
Tabel 3.3 Gradien Konsentrasi Campuran Daging Babi dan Daging Sapi ... 26
Tabel 4.1 Hasil Kuantifikasi DNA menggunakan Spektrofotometer UV ... 31 Tabel 4.2 Hasil Sensitivitas primer for pig detection macrogen® pada RT-PCR . 36
xii
DAFTAR LAMPIRAN
Lampiran 1 Hasil elektroforesis Isolasi DNA ... 44 Lampiran 2 Perhitungan dari hasil kuantifikasi DNA dengan spektrofotomer ... 45 Lampiran 3 Hasil Kuantifikasi DNA dengan spektrofotometer ... 46
xiii
Identifikasi Kandungan Daging Babi
Pada Beef Burger Menggunakan Metode RT-PCR
Dea Yulia Ikhlas Suri Prodi Farmasi
INTISARI
Penduduk Indonesia sebagian besar adalah muslim, dan umat islam diharamkan untuk mengonsumsi produk yang mengandung daging babi. Oleh karena itu, diperlukan analisis untuk mendeteksi kandungan daging babi dalam daging olahan produk, seperti beef burger. Metode yang dapat digunakan untuk mengidentifikasi kandungan babi adalah Real-time PCR. Tujuan dari penelitian yaitu untuk mengetahui spesifisitas primer dan sensitifitas metode Real-Time PCR dalam mengidentifikasi kandungan rendah babi dalam beef burger. Pada penelitian ini primer yang digunakan adalah primer for pig detection macrogen®. Isolasi DNA daging babi, sapi, dan ayam yang dilakukan menggunakan Tiangen® kit, sedangkan isolasi DNA sampel dengan metode konvensional. Uji spesifisitas dilakukan menggunakan daging babi sebagai kontrol positif, daging sapi dan ayam sebagai kontrol negatif. Uji sensitivitas dilakukan dengan membandingkan penanda spesifik terhadap DNA daging babi dengan DNA daging sapi. Amplifikasi DNA dengan primer for pig detection macrogen® dilakukan kondisi enzim aktivasi pada suhu 98°C selama 3 menit, denaturasi pada suhu 98°C selama 15 detik, annealing pada suhu 59°C selama 30 detik, dan analisis melting curve 65-95°C; 0,5°C increment, 5 detik/langkah. Denaturasi dan annealing dilakukan selama 30 siklus. Pada penelitian menunjukkan bahwa primer dapat mengamplifikasi DNA babi secara spesifik dan dapat mendeteksi hingga konsentrasi 0,1% DNA babi dengan RT-PCR. Hasil dari 3 sampel beef burger menunjukkan bahwa tidak teramplifikasi DNA babi.
Kata kunci : Beef Burger, DNA babi, Real-Time PCR,Primer for Pig Detection
xiv
Identification of Pork in Beef Burger Using RT-PCR
Dea Yulia Ikhlas Suri Department of Pharmacy
ABSTRACT
Indonesia is the largest muslim country, and muslims are not allowed to consume any products containing pork meat. Therefore, an analysis is necessary to detect the presence of pork in processed meat products, such as beef burger. Real-time PCR can be used to identify contain of pork. This research was aimed to know specificity primer and sensitivity of Real-Time PCR in the identification low content of pork in beef burger. In this research, primer was used primer for pig detection macrogen®. Isolation DNA of pork, beef, and chicken was used Tiangen® kit, and isolation DNA of samples with conventional method. Specificity test was performed using pork as a positive control, beef and chicken as negative control. Sensitivity test was performed by comparing specific markers of pork DNA with beef DNA. Amplification DNA with primer for pig detection macrogen® was performed at 30 cycles the condition of enzyme activation at 98oC for 3 minutes, denaturation at 98oC for 15 seconds, annealing at 59oC for 30
seconds, and melting curve at 65-95oC, 0,5oC increment, 5 seconds/step. The result showed that primer can amplification pork DNA specifically and detect pork DNA up to 0,1% concentration with RT-PCR. The results of three beef burger showed that no amplified pork DNA.
Keyword : Beef Burger, Pork DNA, Real-Time PCR, Primer for Pig Detection Macrogen.
1
BAB I
PENDAHULUAN
1.1. Latar Belakang Masalah
Babi merupakan hewan yang secara keseluruhan diharamkan untuk dikonsumsi oleh umat Islam. Indonesia termasuk negara dengan mayoritas masyarakat beragama Islam sehingga menjadi kewajiban negara untuk memperhatikan kehalalan makanannya dari campuran daging babi. Sejumlah produk telah disertifikasi halal oleh MUI termasuk produk pangan daging(1).
Beberapa kasus pencampuran daging babi pada produk daging sapi olahan masih ditemukan. Pada September 2009, ditemukan kasus pencampuran daging babi dalam daging sapi di pasar tradisional Ibuh, kota Payakumbuh, Sumatera Barat.
Hal tersebut membuat penduduk Indonesia yang sebagian besar adalah muslim merasa sangat diresahkan(2).Oleh karena itu, diperlukan analisis untuk mendeteksi kandungan daging babi dalam daging olahan produk, seperti beef burger.
Salah satu upaya yang dapat dilakukan untuk mengidentifikasi adanya daging babi pada makanan olahan daging yaitu menggunakan metode non PCR dan PCR. Sebagai contoh metode non PCR, Boes (2000) melakukan analisis protein daging sapi segar yang diduga dicampur daging babi dengan teknik Kromatografi Cair Kinerja Tinggi (KCKT). Namun, teknik ini memiliki kelemahan yaitu sensitifitasnya rendah, tidak dapat mengidentifikasi daging matang serta biaya yang diperlukan relatif mahal(3). Metode PCR (polymerase
chain reaction) yang merupakan metode yang telah dianggap paling valid.
Sebagai contoh, keberhasilan isolasi DNA dan amplifikasi PCR konvensional dari sampel daging yang terkontaminasi daging babi juga telah dibuktikan oleh Alaraidh pada tahun 2008(4). Marseli, dkk (2016) yang mendeteksi secara molekuler cemaran daging babi pada beef burger di kota Yogyakarta menggunakan PCR konvensional dengan pendekatan pada gen 12S rRNA pada mitokondria babi(5). Penelitian lainnya yaitu Species authentication of commercial
beef jerky based on PCR-RFLP analysis of the mitochondrial 12S rRNA gene
2
dengan target gen 12S rRNA(6). Tanabe (2007) mendeteksi daging babi, ayam, daging sapi, daging kambing, dan kuda yang ada dalam makanan menggunakan metode Real-Time PCR(7).
Metode PCR-RFLP dan PCR konvensional memiliki beberapa kekurangan yaitu memerlukan waktu yang cukup lama dan memiliki sensitivitas yang lebih rendah daripada RT-PCR. Oleh karena itu, salah satu metode yang dapat digunakan yaitu Real-Time Polymerase Chain Reaction. Pengembangan uji analisis harus spesifik mendeteksi target untuk menjamin hasil uji yang diperoleh hanya dapat mendeteksi target tersebut. Primer yang digunakan adalah primer for
pig detection macrogen®. Primer tersebut diperoleh dari produsen dan telah dikatakan spesifik untuk mendeteksi DNA babi. Analisis sensitivitas juga sangat penting dalam mendeteksi target dengan jumlah kecil untuk mengetahui minimal konsentrasi target yang dapat dideteksi(8).
Real-time PCR merupakan metode modern untuk amplifikasi DNA. Pada time PCR jumlah DNA yang diamplifikasi bisa langsung diamati secara real-time sehingga tidak memerlukan analisis dengan elektroforesis gel untuk
mengetahui produk PCR. Real-time PCR lebih dikenal sebagai kuantitatif PCR karena kemampuan analisanya yang akurat, sensitif dan spesifik sehingga mengurangi kesalahan pada hasil(9). Oleh karena itu, penelitian ini bertujuan untuk memastikan metode Real-Time PCR spesifik dalam mendeteksi daging babi, sensitif mendeteksi kandungan daging babi dalam daging sapi yang sebagai kontrol positif dengan menggunakan berbagai konsentrasi daging babi dan dapat mendeteksi kandungan babi dalam beef burger yang sebagai sampel pada penelitian ini.
1.2. Perumusan Masalah
1) Apakah primer for pig detection macrogen® dapat digunakan secara spesifik untuk mendeteksi DNA babi?
2) Bagaimana sensitivitas metode Real-Time PCR dalam membedakan DNA babi dengan DNA sapi?
3
1.3. Tujuan Penelitian
1) Mengetahui spesifisitas primer for pig detection macrogen® dapat mendeteksi DNA babi.
2) Menentukan sensitifitas metode Real Time PCR dalam mengidentifikasi DNA babi dalam DNA lainnya.
1.4. Manfaat Penelitian
1) Mendapatkan metode yang selektif dan spesifik dalam mendeteksi kandungan DNA babi.
2) Mendapatkan metode yang sensitif dalam mengidentifikasi DNA babi dalam DNA lainnya.
3) Sebagai bahan pertimbangan dalam mengidentifikasi kandungan DNA babi pada produk beef burger yang telah beredar.
4
BAB II
STUDI PUSTAKA
2.1. Tinjauan Pustaka 2.1.1. Beef Burger
Menurut wikipedia, daging adalah bagian lunak pada hewan yang terbungkus kulit dan melekat pada tulang yang menjadi bahan makanan. Daging tersusun sebagian besar dari jaringan otot, ditambah dengan lemak yang melekat padanya, urat, serta tulang rawan(10).
Menurut kamus besar Bahasa Indonesia, hamburger adalah daging cacah (biasanya daging sapi, tetapi kadang-kadang juga daging lain) yang dibentuk bulat, kemudian dipipihkan dan digoreng dengan mentega atau dipanggang diatas bara, biasanya dimakan sebagai isi roti bulat, diberi daun selada, tomat, timun, saus tomat, dan bumbu lainnya(11).
2.1.2. Daging Babi dan Keharamannya
Seorang muslim menjadikan kitab suci Al-Qur’an sebagai pedoman hidup, yang dilarang menganiaya diri sendiri termasuk mengkonsumsi sesuatu yang membahayakan bagi umat islam. Allah SWT telah melarang manusia untuk mengkonsumsi babi. Hal ini dijelaskan didalam QS. Al-Baqarah ayat 173 yang artinya:
“Sesungguhnya Allah hanya mengharamkan bagimu bangkai, darah, daging babi, dan binatang yang ketika disembelih disebut nama selain Allah. Tetapi barang siapa dalam keadaan terpaksa memakannya sedang ia tidak menginginkannya dan tidak pula melampaui batas, maka tidak ada dosa baginya. Sesungguhnya Allah Maha Pengampun lagi Maha Penyayang.”
Dalam QS. Al-Anam ayat 145 yang artinya:
“Katakanlah tiada aku peroleh dalam wahyu yang diturunkan kepadaku sesuatu yangdiharamkan bagi orang yang hendak memakannya kecuali kalau makanan itu berupa bangkai, darah yang mengalir,maupun daging babi. Karena semuanya itu adalah kotor”
Sesuai dengan paparan tersebut sehingga dapat disimpulkan bahwa keseluruhan bagian dari babi adalah haram di dalam islam.
5
2.1.3. DNA Babi
DNA merupakan sub unit terkecil yang diturunkan dari generasi ke generasi secara stabil sehingga DNA dapat digunakan untuk dideteksi. DNA terdapat organel penting yaitu inti sel yang didalamnya terdapat kromosom, dimana DNA yang membentuk kromosom disebut DNA genom. Serangkaian molekul DNA yang terdapat didalam lokus (daerah tertentu) berfungsi sebagai penyandi genetik yaitu gen, sedangkan molekul DNA yang hanya memiliki susunan nukleotida khas disebut penciri(12).
Lokus PRE-1 yang diwakili oleh primer p14 hanya terdapat dalam DNA genom babi. Primer p14 merupakan salah satu dari 13 primer yang menunjukkan lokus PRE-1 pada genom babi, dan menjadi salah satu standar analisis makanan mengandung daging babi. Pada genom babi terdeteksi lokus intra-SINE PRE-1, lokus ini hanya terdapat pada genom babi. Teknik PCR menggunakan primer p131 dan p408, proses amplifikasi region PRE-1 pada produk makanan yang mengandung daging babi menghasilkan produk sepanjang 478 dan 458 pasang basa dan semua produk makanan yang mengandung daging babi dapat terdeteksi. Dengan demikian, upaya mendeteksi adanya daging babi di dalam produk olahan daging seperti beef burger dan bakso menggunakan teknik PCR memberikan hasil yang tidak meragukan(3). Sekuen DNA yang dapat diamplifikasikan juga dengan PCR adalah DNA mitokondria memiliki jumlah kopi yang banyak (lebih dari 1000 kopi) dalam tiap sel, laju mutasi yang tinggi, yaitu sekitar 10-17 kali DNA inti. Mitokondria diwariskan secara maternal, semua gen mitokondria berperilaku sebagai lokus haploid(12).
2.1.4. Deoxyribonecleic Acid (DNA)
Sebuah sel memiliki DNA yang merupakan materi genetik dan bersifat herediter pada seluruh sistem kehidupan. DNA memiliki struktur pilinan utas ganda yang antiparalel dengan komponen-komponennya, yaitu gula pentosa (deoksiribosa), gugus fosfat, dan pasangan basa. Satu komponen pembangun (building block) DNA terdiri atas satu gula pentosa, satu gugus fosfat dan satu
6
pasang basa yang disebut nukleotida(13). Struktur DNA dapat dilihat pada gambar 2.1.
Gambar 2.1. Struktur DNA(14).
Pasangan basa pada DNA terdiri atas dua macam, yaitu basa purin dan pirimidin. Basa purin terdiri atas adenin (A) dan guanin (G) yang memiliki struktur cincin ganda, sedangkan basa pirimidin terdiri atas sitosin (C) dan timin (T) yang memiliki struktur cincin-tunggal. Ketika guanin berikatan dengan sitosin, maka akan terbentuk tiga ikatan hidrogen, sedangkan ketika adenin berikatan dengan timin maka hanya akan terbentuk dua ikatan hidrogen(13).
Berdasarkan struktur purin dan pirimidin yang terlihat pada gambar 2.2 basa-basa purin (adenin, guanin) dan pirimidin (sitosin, timin) menunjukkan adanya gugus kromofor dan auksokrom. Gugus kromofor adalah sebuah gugus atom dalam senyawa organik yang dapat menyerap sinar ultraviolet dan sinar tampak, sedangkan gugus auksokrom adalah gugus fungsional yang mempunyai elektron bebas, seperti OH, O, NH2, dan OCH yang memberikan transisi n-π*(15).
7
Nukleus merupakan bagian sel yang memiliki materi genetik sel, asam deoksiribonukleat (deoxyribonecleic acid). DNA berfungsi memberikan kode atau instruksi untuk mengarahkan sintesis berbagai protein struktural dan enzimatik spesifik di dalam sel. Dengan mengarahkan jenis dan jumlah berbagai enzim dan protein lain yang diproduksi, nukleus secara tidak langsung mengatur sebagian besar aktivitas sel dan berfungsi sebagai pusat kontrol sel. DNA berperan dalam semua aktivitas sel. DNA menyimpan dan mengeskpresikan informasi genetik yang dapat diwariskan ke generasi berikutnya(17).
Manfaat DNA terletak pada kemampuannya untuk mengendalikan pembentukan protein di dalam sel. DNA melakukannya dengan bantuan sesuatu yang disebut dengan kode genetik, yaitu saat kedua untai molekul DNA dipisahkan, maka pemisahan ini akan memanjangkan basa purin dan pirimidin yang menonjol pada tiap sisi untai. Penonjolan basa-basa inilah yang membentuk kode genetik. Kode genetik terdiri atas “triplet” basa yang berurutan artinya, masing-masing ketiga basa berurutan tersebut adalah sebuah kata kode. Triplet yang berurutan tersebut akhirnya mengatur rangkaian asam amino dalam sebuah molekul protein yang akan disintesis di dalam sel(18).
8
DNA memiliki untai ganda yang berkomplementasi secara antiparalel melalui basa sebagai penyusunnya seperti terlihat pada Gambar 2.3. Ujung yang mengandung gugus phospat disebut ujung 5’ sedangkan ujung yang mengandung gugus hidroksil disebut ujung 3’. Kedua untai ini melilit satu sama lain membentuk struktur heliks ganda(19).
2.1.5. Isolasi DNA
Isolasi DNA memiliki beberapa tahapan, yaitu isolasi sel, lisis dinding dan membran sel, ekstraksi dalam larutan, purifikasi dan presipitasi. Prinsip dasar isolasi DNA dari jaringan adalah dengan memecah dan mengekstraksi jaringan tersebut sehingga akan terbentuk ekstrak sel yang terdiri atas sel-sel jaringan, DNA, dan RNA. Prinsip-prinsip dalam melakukan isolasi DNA ada 2, yaitu sentrifugasi dan presipitasi. Prinsip utama sentrifugasi adalah memisahkan substansi berdasarkan berat jenis molekul dengan cara memberikan gaya sentrifugal sehingga substansi yang lebih berat akan berada di dasar, sedangkan substansi yang lebih ringan akan terletak di atas. Teknik sentrifugasi tersebut dilakukan di dalam sebuah mesin yang bernama mesin sentrifugasi dengan kecepatan yang bervariasi, contohnya 2500 rpm (rotation per minute) atau 3000 rpm. Presipitasi merupakan langkah yang dilakukan untuk mengendapkan suatu komponen dari campuran(13).
Isolasi DNA merupakan langkah yang tepat untuk mempelajari DNA. Prinsip isolasi DNA adalah mendapatkan DNA murni yang tidak tercampur dengan komponen sel lainnya seperti protein dan karbohidrat.Isolasi DNA genom dapat dilakukan dengan metode lisis sel secara fisik dan kimia. Secara fisik sel dipecah dengan kekuatan mekanik yaitu secara freeze thaw, bead mill
homogenization dan resonansi misalnya dengan sonikasi. Sedangkan secara kimia
sel dirusak dengan buffer lisis berisi senyawa kimia yang dapat merusak integritas
barrier dinding sel, misalnya SDS (Sodium Dedocyl Sulfate) dan CTAB
(Cetyltrimethylammonium bromide)(20).
Seiring berkembangnya ilmu pengetahuan dan teknologi, metode isolasi DNA dapat dilakukan dengan waktu pengerjaan yang lebih efisien. Hal ini
9
dikarenakan kegiatan preparasi larutan yang mendukung kerja isolasi dapat diminimalkan atau tidak dilakukan. Salah satu pengembangan teknik isolasi DNA, yaitu dengan penggunaan kit komersial yang semua larutannya sudah tersedia dalam satu paket dengan pertimbangan untuk penggunaaan beberapa kali reaksi.
Tahap akhir DNA harus dimurnikan dari senyawa-senyawa non-DNA lainnya, seperti RNA, protein, polisakarida, metabolit sekunder dan sebagainya. Senyawa-senyawa tersebut harus dihilangkan semaksimal mungkin dari DNA, sebab dapat menghambat aktivitas enzimatik pada DNA tersebut. Protein dihilangkan dengan cara denaturasi dan presipitasi menggunakan kloroform atau fenol. Sedangkan RNA dapat dihilangkan dengan penambahan RNAse pada larutan DNA(20).
Larutan DNA yang didapatkan kemudian diamati kuantitas dan kualitas DNAnya. Analisis kualitas dilakukan dengan elektroforesis gel untuk mengetahui ada tidaknya DNA. Elektroforesis didasarkan pada pergerakan molekul yang bermuatan dalam media yang direndam dilarutan buffer dengan pengaruh medan listrik. Media yang umum digunakan adalah gel agarosa. DNA yang bermuatan negatif dimasukkan ke dalam sumuran yang terdapat pada gel agarosa dan diletakkan di kutup negatif, apabila dialiri arus listrik dengan menggunakan larutan buffer yang sesuai maka DNA akan bergerak ke kutup positif. Laju migrasi DNA dalam medan listrik berbanding terbalik dengan massa DNA. DNA yang berukuran kecil akan bermigrasi lebih cepat dibanding yang berukuran besar, sehingga elektroforesis mampu memisahkan DNA berdasarkan ukuran panjangnya. Untuk visualisasi maka ditambahkan larutan etidium bromida (EtBr) yang akan masuk diantara ikatan hidrogen pada DNA, sehingga pita fragmen DNA akan kelihatan dibawah lampu UV(21).
Pengukuran kuantitas DNA selanjutnya adalah pengukuran konsentrasi DNA, yang bertujuan untuk mengetahui banyak sedikitnya DNA yang terkandung dalam larutan. Konsentrasi DNA diukur melalui spektrofotometer yang didasarkan pada prinsip penyerapan sinar ultraviolet oleh nukleotida dan protein dalam larutan. Penyerapan sinar UV oleh DNA dicapai pada λ260 nm, sedangkan penyerapan protein dicapai pada λ280 nm. Pada λ260 nm, apabila optical density
10
(OD260) sama dengan 1, maka konsentrasi molekul DNA setara 50 ug/ml (untuk DNA heliks ganda) 40 ug/ml (untuk RNA) dan 33 ug/ml (untuk oligonukleotida)(20).
Kemurnian larutan DNA dapat dilihat dari rasio absorbansi DNA (A260:A280). Hasil isolasi DNA dikatakan murni apabila rasio perbandingan A260
nm dan A280 nm adalah 1,8 hingga 2,0. Apabila kemurnian dibawah 1,8 dan diatas 2,0 diindikasikan DNA masih terkontaminasi RNA dan protein(21).
2.1.6. Polymerase Chain Reaction (PCR) 2.1.6.1. Pengertian PCR
Metode Polymerase Chain Reaction (PCR) adalah suatu metode enzimatis untuk melipatgandakan sekuen nukleotida tertentu secara in vitro menggunakan mesin PCR. Metode ini sekarang banyak digunakan untuk berbagai macam manipulasi dan analisis genetik karena metode tersebut sangat sensitif(22).
PCR merupakan metode molekuler untuk menggandakan potongan DNA hingga berjuta kali lipat dalam waktu yang relatif singkat. Penggandaan tersebut tidak terlepas dari penggunaan enzim dan sepasang primer bersifat spesifik terhadap DNA target yang akan dilipatgandakan, sehingga nantinya dapat digunakan untuk keperluan lain yang berkaitan dengan DNA. Teknik ini sejumlah fragmen kecil DNA yang diinginkan akan diamplifikasi secara eksponensial sampai jutaan kali dalam beberapa jam(23).
Amplifikasi DNA pada PCR dapat dicapai bila menggunakan primer oligonukleotida yang disebut amplimers. Primer DNA adalah suatu sekuens oligonukleotida pendek yang berfungsi mengawali sintesis rantai DNA. PCR memungkinkan dilakukannya pelipatgandaan suatu fragmen DNA Primer yang berada sebelum daerah target disebut primer forward dan yang berada setelah daerah target disebut primer reverse. Enzim yang digunakan sebagai pencetak rangkaian molekul DNA yang baru dikenal disebut enzim polymerase. Untuk dapat mencetak rangkaian tersebut dalam teknik PCR, diperlukan juga dNTPs yang mencakup dATP (nukleotida berbasa Adenin), dCTP (sitosin), dGTP (guanin), dan dTTP (Timin)(22).
11
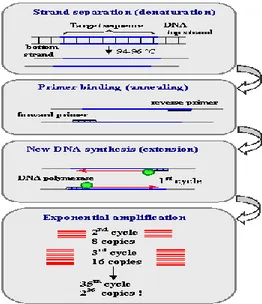
PCR melibatkan banyak siklus yang masing-masing terdiri dari tiga tahap berurutan, yaitu pemisahan (denaturasi) rantai DNA template, penempelan (annealing) pasangan primer pada DNA target dan pemanjangan (extension) primer atau reaksi polimerisasi yang dikatalisis oleh DNA polimerase.Pada akhir siklus pertama, suatu molekul DNA untai ganda dilipat gandakan jumlahnya menjadi dua molekul DNA untai ganda. Dua molekul DNA untai ganda hasil amplifikasi pada siklus pertama menjadi DNA target dan dilipat gandakan menjadi empat molekul DNA, dan selanjutnya empat molekul baru ini dilipat gandakan lagi jumlahnya menjadi delapan dan seterusnya(24).
2.1.6.2. Komponen PCR
Beberapa komponen yang harus ada dalam proses PCR antara lain DNA, primer, deoksiribonukleotida trifosfat (dNTP), DNA polimerase, dan senyawa buffer(22).
1. DNA Template
DNA Template adalah molekul DNA untai ganda yang mengandung sekuen target yang akan diamplifikasi. Ukuran DNA bukan merupakan faktor utama keberhasilan PCR, berapapun panjangnya jika tidak mengandung sekuen yang diinginkan maka tidak akan berhasil proses suatu PCR, namun sebaliknya jika ukuran DNA tidak terlalu panjang tapi mengandung sekuen yang diinginkan maka PCR akan berhasil.
Konsentrasi DNA juga dapat mempengaruhi keberhasilan PCR. Jika konsentrasinya terlalu rendah maka primer mungkin tidak dapat menemukan target dan jika konsentrasi terlalu tinggi akan meningkatkan kemungkinan
mispriming. Disamping itu perlu diperhatikan kemurnian template karena akan
mempengaruhi hasil reaksi(22).
2. Primer
Susunan primer merupakan salah satu kunci keberhasilan PCR. Primer yaitu suatu potongan atau sequence dari oligonukleotida pendek yang digunakan untuk mengawali sintesis DNA. Pasangan primer terdiri dari 2 oligonukleotida yang mengandung 18-28 nukleotida dan mempunyai 40-60% GC content. Fungsi
12
primer adalah menyediakan ujung 3'-OH yang akan digunakan untuk menempelkan molekul DNA pertama dalam proses polimerisasi. Sekuen primer yang lebih pendek akan memicu amplifikasi produk PCR non spesifik. Ujung 3' primer penting dalam menentukan spesifisitas dan sensitivitas PCR. Ujung ini tidak boleh mempunyai 3 atau lebih basa G atau C, karena dapat menstabilisasi
annealing primer non spesifik. Disamping itu ujung 3' kedua primer tidak boleh
komplementer satu dengan yang lain, karena hal ini akan mengakibatkan pembentukan primer-dimer yang akan menurunkan hasil produk yang diinginkan. Ujung 5' primer tidak terlalu penting untuk annealing primer, sehingga memungkinkan untuk menambahkan sekuen tertentu misalnya sisi restriksi enzim,
start codon ATG atau sekuen promoter.
Konsentrasi primer biasanya optimal pada 0,1-0,5 μM.
Konsentrasi primer yang terlalu tinggi akan menyebabkan mispriming (penempelan pada tempat yang tidak spesifik) dan akumulasi produk non spesifik serta meningkatkan kemungkinan terbentuk primer-dimer, sebaliknya bila konsentrasi primer terlalu sedikit maka PCR menjadi tidak efisien sehingga hasilnya rendah(23).
3. DNA polymerase
DNA polymerase adalah enzim yang melakukan katalisis reaksi sintesis rantai DNA. Dalam perkembangannya, kini banyak digunakan enzim Taq DNA
polymerase yang memiliki keaktifan pada suhu tinggi sehingga penambahan
enzim tidak perlu dilakukan disetiap siklus dan proses PCR dapat dilakukan dalam satu mesin(25).
Enzim Taq DNA polymerase terdiri atas dua macam yaitu enzim alami yang diisolasi dari sel bakteri Thermus aquaticus dan enzim rekombinan yang disintesis didalam sel bakteri Escherichia coli. Enzim ini masih mempunyai aktivitas eksonuklease dari 5' ke 3' tetapi tidak mempunyai aktivitas eksonuklease dari 3' ke 5'. Konsentrasi enzim yang dibutuhkan untuk PCR biasanya 0,5-2,5 unit. Kelebihan jumlah enzim mengakibatkan akumulasi produk non spesifik, sedangkan jika terlalu rendah maka dihasilkan sedikit produk yang diinginkan(25).
13
4. Deoxynucleotide Triphosphate (dNTP)
Deoxynucleotide Triphosphate (dNTP) terdiri atas dATP, dCTP, dGTP,
dTTP. Konsentrasi dNTP masing-masing sebesar 20-200 μM dapat menghasilkan keseimbangan optimal antara hasil, spesifisitas dan ketepatan PCR. Konsentrasi masing-masing dNTP harus seimbang untuk meminimalkan kesalahan penggabungan. Deoxynucleotide Triphosphate akan menurunkan Mg2+ bebas sehingga mempengaruhi aktivitas polimerase dan menurunkan annealing primer. Konsentrasi dNTP yang rendah akan meminimalkan mispriming pada daerah non target dan menurunkan kemungkinan perpanjangan nukleotida yang salah. Oleh karena itu spesifisitas dan ketepatan PCR meningkat pada konsentrasi dNTP yang lebih rendah(24).
5. Larutan buffer
Larutan buffer yang biasa digunakan untuk reaksi PCR mengandung 10 mM Tris-HCl pH 8,3; 50 mM KCl, dan 1,5 mM MgCl2. Optimalisasi konsentrasi
ion Mg2+merupakan hal yang penting(24).
6. Kofaktor Ion Metal
Magnesium klorida merupakan kofaktor esensial untuk DNA polymerase yang digunakan di dalam PCR dan konsentrasinya harus dioptimasi untuk setiap sistem primer:template. Keberadaan ion magnesium yang bebas penting sebagai kofaktor enzim dalam PCR. Konsentrasi ion ini mempengaruhi beberapa hal yaitu
annealing primer, suhu pemisahan untai template dan produk PCR, spesifisitas
produk, pembentukan primer-dimer serta aktivitas dan ketepatan enzim Taq
Polymerase. Konsentrasi ion magnesium harus melebihi total konsentrasi dNTP.
Biasanya, untuk memulai proses optimasi, sebanyak 1,5 mM MgCl2 ditambahkan
ke dalam PCR yang didalamnya terdapat 0,8 mM dNTP, sehingga terdapat sekitar 0,7 mM magnesium bebas untuk DNA polymerase. Secara umum, ion magnesium harus divariasikan dalam seri konsentrasi dari 1,5-4,0 mM(24).
14
2.1.6.3. Tahapan PCR
Berikut ini merupakan tahapan yang terjadi pada proses PCR:
Gambar 2.4 Siklus PCR(26).
1. Denaturasi
Selama proses denaturasi, DNA untai ganda akan membuka menjadi dua untai dan primer dapat mengikat pada untai tersebut jika temperaturnya diturunan kemudian yang selanjutnya akan dimulai rantai reaksi baru. Kemudian suhu diturunkan hingga mencapai suhu annealing yang bervariasi tergantung primer yang digunakan. Hal ini disebabkan karena suhu denaturasi yang tinggi menyebabkan putusnya ikatan hidrogen diantara basa-basa yang komplemen. Pada tahap ini, seluruh reaksi enzim tidak berjalan. Denaturasi biasanya dilakukan antara suhu 90-95°C selama 3 menit untuk meyakinkan bahwa molekul DNA yang ditargetkan ingin dilipat gandakan jumlahnya benar-benar telah terdenaturasi menjadi untai tunggal. Denaturasi yang tidak lengkap mengakibatkan DNA mengalami renaturasi (membentuk DNA untai ganda lagi) secara cepat, dan ini mengakibatkan gagalnya proses PCR. Untuk denaturasi berikutnya, waktu yang diperlukan hanya 30 detik pada suhu 95°C atau 15 detik pada suhu 97°C(25).
Suhu denaturasi dipengaruhi oleh sequen target. Jika sequen target kaya akan G-C maka diperlukan suhu yang lebih tinggi. Suhu denaturasi yang terlalu
15
tinggi dan waktu denaturasi yang terlalu lama mengakibatkan hilangnya atau berkurangnya aktivitas enzim Taq polymerase(22).
2. Penempelan primer
Pada tahap penempelan primer (annealing), primer akan menuju daerah yang spesifik yang komplemen dengan urutan primer. Kriteria yang umum digunakan untuk merancang primer yang baik adalah bahwa primer sebaiknya berukuran 18–25 basa, mengandung 50–60% G+C dan untuk kedua primer tersebut sebaiknya sama. Sekuens DNA dalam masing-masing primer itu sendiri juga sebaiknya tidak saling berkomplemen, karena hal ini akan mengakibatkan terbentuknya struktur sekunder pada primer tersebut dan mengurangi efisiensi PCR(29). Pada proses annealing ini, ikatan hidrogen akan terbentuk antara primer dengan urutan komplemen pada template. Proses ini biasanya dilakukan pada suhu 50-60°C. Selanjutnya, DNA polymerase akan berikatan sehingga ikatan hidrogen tersebut akan menjadi sangat kuat dan tidak akan putus kembali apabila dilakukan reaksi polimerisasi selanjutnya(25).
Suhu dan lamaya waktu yang dibutuhkan untuk annealing primer tergantung pada komposisi basa, panjang, dan konsentrasi primer. Waktu
annealing yang biasa digunakan dalam PCR adalah 30–45 detik. Semakin panjang
ukuran primer, semakin tinggi temperaturnya. Kisaran temperatur penempelan yang digunakan adalah antara 36°C sampai dengan 72°C, namun suhu yang biasa dilakukan itu adalah antara 50-60°C(23).
3. Reaksi polimerisasi
Umumnya reaksi polimerisasi (extension) atau perpanjangan rantai, terjadi pada suhu 72°C karena merupakan suhu optimum Taq polymerase. Primer yang telah menempel tadi akan mengalami perpanjangan pada sisi 3’nya dengan penambahan dNTP yang komplemen dengan template oleh DNA polymerase. . Lamanya masa inkubasi tiap temperatur, perubahan suhu dan jumlah siklus dikontrol secara terprogram menggunakan programmable thermal cycler(25).
Kecepatan penyusunan nukleotida oleh enzim tersebut pada suhu 72°C diperkirakan antara 35 sampai 100 nukleotida per detik, bergantung pada buffer,
16
pH, konsentrasi garam, dan molekul DNA target. Dengan demikian, untuk produk PCR sepanjang 2000 pasang basa, waktu 1 menit sudah lebih dari cukup untuk tahap pemanjangan primer ini. Biasanya di akhir siklus PCR, waktu yang digunakan untuk tahap ini diperpanjang sampai 5 menit, sehingga seluruh produk PCR diharapkan berbentuk DNA untai ganda(24).
2.1.7. Real-Time PCR
Real-Time PCR adalah suatu metode analisa yang dikembangkan dari
reaksi PCR. Dalam ilmu biologi molekular, Real-Time PCR adalah suatu teknik pengerjaan PCR di laboratorium untuk mengamplifikasi sekaligus dapat melakukan kuantifikasi jumlah target molekul DNA dari hasil amplifikasi tersebut(27).
Prinsip kerja Real-Time PCR adalah mendeteksi dan menguantifikasi fluoresensi yang diproduksi oleh molekul reporter yang meningkat sejalan dengan berlangsungnya proses PCR. Hal tersebut dapat terjadi karena akumulasi produk PCR pada tiap siklus amplifikasi. Molekul reporter dengan fluoresensi meliputi pewarna yang berikatan pada double-stranded DNA (menggunakan SYBR®Green atau EvaGreen®Reagents) atau menggunakan probe spesifik sekuens/sequence
specific probes (Molecular Beacons or TaqMan® Probes)(28). Hasil peningkatan
fluorescent digambarkan melalui kurva amplifikasi yang menunjukkan tiga fasa
yaitu fasa awal, fasa eksponensial atau puncak dan fasa plateau atau stabil. Peningkatan produk PCR yang signifikan pada fase eksponensial berhubungan dengan jumlah inisiasi gen target. Semakin tinggi tingkat ekspresi gen target maka deteksi emisi fluoresen semakin cepat terjadi(25). Analisis menggunakan Real time PCR memiliki sensitivitas tinggi dan lebih spesifik untuk produk PCR(29).
Instrumen Real-Time PCR memiliki tiga komponen utama yaitu thermal
block cycler sebagai akurasi data, optical system sebagai deteksi data, dan software sebagai analisis data. Real-Time PCR juga dapat menganalisis banyak
17
Merah: babi; kuning: daging; biru tua: ayam; hijau: kambing; biru: kuda. Gambar 2.5 Bentuk Kurva pada Real-Time PCR(31).
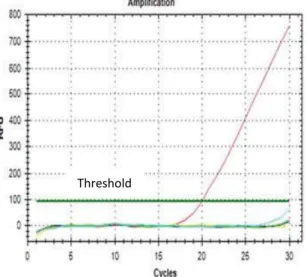
Bentuk kurva pada Real-Time PCR dapat dilihat pada gambar 2.5. Pemeriksaan secara molekuler melalui metode RT-PCR merupakan teknik yang mempunyai banyak kelebihan bila dibandingkan dengan metode PCR lainnya. Metode ini lebih sederhana, sangat spesifik, dan dapat mengurangi risiko kontaminasi silang di antara isolat uji serta tidak memerlukan waktu yang lama karena dapat mengamplifikasi beberapa gen dari isolat yang diuji secara sekaligus(32). Hasil RT-PCR dapat diketahui juga ∆Cq yang didapat dari setiap
kurva yang terbentuk. Nilai Cq didapat dari jumlah siklus pada proses PCR yang berpotongan dengan garis threshold. Threshold adalah garis yang menandai peningkatan sinyal fluoresensi secara signifikan berdasarkan variabilitas baseline, namum posisi threshold dapat diatur bebas pada setiap titik di fase eksponensial. Hasil melt curve pada RT-PCR yang baik akan menghasilkan satu puncak pada
melt peak dan menunjukkan melting temperature dari amplikon, sehingga primer
yang digunakan dapat dikatakan spesifik. Analisis melting curve juga dapat menunjukkan adanya primer dimer bila terdapat lebih dari satu puncak(27). Sistem pengukuran analisis real time menggunakan molekul probes yang dapat diukur pada tiap siklus reaksinya, sedangkaan PCR konvensional deteksinya memerlukan gel agarosa untuk proses elektroforesis DNA pada deteksi hasil amplifikasi DNA tersebut dan penggunaan EtBr yang merupakan senyawa karsinogenik.
18
2.1.8. Perbandingan Metode Mendeteksi Kandungan Babi
Metode berbasis DNA umumnya lebih spesifik dan sensitif. Spesifik karena setiap spesies memiliki fragmen sekuen DNA yang dapat menjadi DNA penanda/marker. Sensitif karena mampu mendeteksi DNA dalam jumlah yang sangat sedikit melalui proses amplifikasi DNA. Kandungan DNA spesifik spesies masih dapat dideteksi meskipun produknya telah mengalami proses pengolahan yang kompleks karena sifat DNA yang tahan panas. Teknologi analisis DNA diantaranya teknologi amplifikasi DNA menggunakan PCR, Real Time PCR, digital PCR serta LAMP (Loop mediated isothermal amplification), hibridisasi DNA, sequensing DNA dan microarray DNA. Metode PCR banyak digunakan untuk mendeteksi DNA spesifik spesies tertentu seperti spesifik babi, sapi, domba atau bahkan spesifik manusia. Metode PCR adalah metode amplifikasi urutan fragmen DNA tertentu secara in-vitro menggunakan sepasang primer (oligonukleotida) yang komplementer dengan urutan cetakan DNA tertentu dengan bantuan enzim DNA polymerase(33).
Winarsih, dkk (2017) mendeteksi fragmen DNA rendah pengkode gen sitokrom B (cyt b) babi pada sampel mie instan menggunakan metode Polymerase Chain Reaction (PCR) konvensional(34). Maryam, dkk (2016) mengidentifikasi
kontaminasi daging babi dengan pendekatan gen mitokondria d-loop686 dan cyt b pada sampel dendeng menggunakan metode RT-PCR(31). Metode RT-PCR sangat sensitif yang memungkinkan amplifikasi terjadi secara bersamaan serta kuantitas sekuen asam nukleat dapat diketahui. Selain memiliki sensitivitas lebih tinggi, kelebihan pengujian RT-PCR jika dibandingkan dengan PCR konvensional adalah lebih dinamis, risiko kontaminasi silang lebih sedikit, kemampuan aplikasi penggunaannya untuk pengujian lebih banyak. Penggunaan probe yang spesifik membantu peningkatan spesifisitas pada pengujian RT-PCR jika dibandingkan dengan pengujian PCR konvensional. Namun demikian, RT-PCR juga mempunyai kelemahan yaitu memerlukan peralatan dan reagen yang mahal serta pemahaman teknik yang benar untuk hasil yang akurat(25).
19
2.2. Landasan Teori
Metode analisis yang direkomendasikan untuk mengidentifikasi cemaran daging babi yaitu Polymerase Chain Reaction–Restriction Fragment Length
Polymorphism (PCR-RLFP), insulated isothermal (II-PCR), dan Real-Time PCR..
Metode PCR-RFLP, II-PCR dan PCR konvensional memiliki beberapa kekurangan yaitu memerlukan waktu yang cukup lama dan memiliki sensitivitas yang lebih rendah daripada RT-PCR.. Metode RT-PCR termasuk metode yang cepat dengan jumlah DNA yang diamplifikasi bisa langsung diamati secara seketika sehingga tidak memerlukan analisis dengan elektroforesis gel untuk mengetahui produk PCR. Real-time PCR lebih dikenal sebagai kuantitatif PCR karena kemampuan analisanya yang akurat, sensitif dan spesifik sehingga mengurangi kesalahan pada hasil(9). Metode uji analisis harus spesifik mendeteksi target untuk menjamin hasil uji yang diperoleh hanya dapat mendeteksi target tersebut. Primer yang digunakan adalah primer for pig detection macrogen®. Primer tersebut termasuk primer baru yang diperoleh dari produsen dan telah dikatakan spesifik mendeteksi DNA babi. Pada analisis sensitivitas juga sangat penting dalam mendeteksi target dengan jumlah kecil untuk mengetahui minimal konsentrasi target yang dapat dideteksi(8).
Metode RT-PCR lebih sensitif untuk melakukan amplifikasi secara bersamaan serta kuantitas sekuen asam nukleat dibandingkan dengan PCR konvensional. Penggunaan primer yang spesifik juga dapat membantu peningkatan spesifisitas pada pengujian RT-PCR jika dibandingkan dengan pengujian PCR konvensional(25).
Pada penelitian Maryam, dkk (2016) berjudul analisis cemaran DNA babi pada dendeng menggunakan primer mitokondria D-loop686 dan gen cyt b dengan metode PCR. Hasil identifikasi penelitian tersebut menunjukkan bahwa RT-PCR dengan primer D-Loop686 dan gen cyt b secara spesifik mampu mendeteksi DNA babi. RT-PCR juga dapat mendeteksi hingga konsentrasi terendah 0,5% DNA babi dalam campuran daging sapi pada produk olahan dendeng dengan produk hasil amplifikasi 114 dan 134 bp untuk D-Loop686 dan 149 bp untuk gen
RT-20
PCR yang selanjutnya akan dianalisis dengan melihat terbentuk tidaknya kurva hanya pada DNA babi. Hal ini digunakan sebagai jaminan hasil identifikasi produk beef burger mengandung atau tidaknya DNA babi.
2.3. Hipotesis
1. Metode Real-Time Polymerase Chain Reaction dapat digunakan secara spesifik untuk mengidentifikasi DNA pada daging babi.
2. Metode Real-Time Polymerase Chain Reaction sensitif dalam membedakan DNA babi dengan DNA sapi yang dapat ditunjukkan dengan uji sensitivitas.
21
BAB III
METODE PENELITIAN
3.1. Bahan dan Alat 3.1.1. Bahan
Bahan yang digunakan pada penelitian ini adalah sampel beef burger, daging sapi, daging babi, daging ayam, primer for pig detection (Macrogen®),
EvaGreen qPCR Master Mix (Bio-Rad), etanol 96% (General Labora®), proteinase K (Promega), pewarna etidium bromide (OmniPur®), buffer lisis, etanol 70% (General Labora®), kloroform (Bratachem®), buffer TE (Promega®), agarose (Promega®), TBE 10X (Invitrogen®), florosafe (1st Base®), loading dye
(Promega®), aquabideslata (Ikapharmindo®), nukleus free water (Invitrogen®), DNA Ladder 1 kb (Promega®), white tip (Axygen®), blue tip (ExtraGene®),
yellow tip (Axygen®), tabung konical (Falcon®), spin column (Tiangen®) dan
Tiangen® kit.
3.1.2. Alat
Alat Peralatan yang digunakan yaitu alat RT-PCR (Bio-Rad), sentrifuge (Mikro 22R Hettich Zentrifugen), waterbath (Memmort®), vortex (IKA), spin
down (Biosan), tube 1,5 ml (Eppendorf®), mikropipet (10 μl, 100μl, 1000μl) (Fransferpette®), tube RT-PCR (Bio-Rad), alat elektroforesis (Mufid-ExU), microwave (Panasonic), mortir, stamper, seperangkat alat gelas (labu ukur, gelas ukur, gelas beaker, erlenmeyer) (Pyrex®), timbangan analitik (Mettler Toledo SX 205), spektrofotometer UV/Vis (Shimadzu UV 1800), dan lemari pendingin (Sanyo Biomedical Freezer).
3.2. Sistematika Kerja Penelitian 3.2.1. Preparasi dan Isolasi DNA Kontrol
Sebanyak 3 kontrol DNA yaitu DNA daging babi sebagai kontrol positif, sedangkan DNA daging sapi dan ayam sebagai kontrol negatif dilakukan isolasi DNA dengan menggunakan Tiangen DNA ekstraction kit. Prosedur yang
22
dilakukan sesuai dengan protokol yang tertera pada kit sebagai berikut.
1. Ditimbang sebanyak ±20mg masing-masing kontrol, kemudian dimasukkan kedalam mikrotube 1,5ml.
2. Ditambahkan 200µl Buffer GA kedalam masing-masing mikrotube yang telah berisi daging.
3. Ditambahkan 20µl Proteinase K, kemudian divortek 15 detik. Diinkubasi dengan suhu 56°C selama 2-3jam (setiap 20 menit diinversi).
4. Ditambahkan 200µl Buffer GB, kemudian divortek 15 detik. Diinkubasi dengan suhu 70°C selama 10 menit. Disentrifuse selama 1 menit (10000rpm). 5. Ditambahkan 200µl ethanol (96-100%) kedalam sampel, dan divortek selama
15 detik. Disentrifuse selama 1 menit (10000rpm).
6. Diambil supernatan dan dipindahkan kedalam Spin Column CB3 dan disentrifuse 12000 rpm selama 30 detik. Dibuang cairannya dan ditempatkan kembali Spin Column kedalam tube.
7. Ditambahkan 500µl Buffer GD ke Spin Column CB3, dan disentrifuse 12000rpm selama 30 detik, kemudian dibuang cairannya dan ditempatkan kembali Spin Column kedalam tube.
8. Ditambahkan 600µl Buffer PW ke Spin Column CB3, disentrifuse 12000rpm selama 30 detik, kemudian dibuang cairannya dan ditempatkan kembali Spin Column kedalam tube.
9. Diulangi langkah sebelumnya.
10. Disentrifuse 12000rpm selama 2 menit untuk mengeringkan membran.
11. Dipindahkan Spin Column CB3 kedalam tube 1,5ml baru, dan ditambahkan 100µl Buffer TE di tengah membran.
12. Diinkubasi dengan suhu ruang (15-25°C) selama 4 menit, dan kemudian disentrifuse selama 2 menit (12000rpm). Untuk penyimpanan DNA jangka panjang di dalam suhu -20°C(35).
3.2.2. Pengumpulan Sampel Beef Burger
Sampel yang digunakan berupa beef burger yang beredar di pasaran sekitar jalan kaliurang dengan kriteria sebagai berikut :
23
Tabel 3.1. Kriteria pengumpulan sampel beef burger.
No. Kriteria Sampel 1 Sampel 2 Sampel 3 1. Memiliki logo Halal MUI - ✓ - 2. Memiliki nomor registrasi - ✓ -
3. Asal produk Pedagang kaki lima
Supermarket Pedagang kaki lima
4. Melalui proses penggorengan
- - ✓
3.2.3. Preparasi dan Isolasi DNA Sampel Beef Burger
Proses isolasi DNA sampel beef burger tidak menggunakan Tiangen kit dikarenakan kit tersebut tidak dapat memperoleh hasil DNA sampel sehingga kami menggunakan metode konvensional untuk mengisolasi DNA beef burger. Penyebab gagalnya isolasi DNA tersebut kemungkinan besar dikarenakan pada sampel beef burger terdapat banyak bahan tambahan makanan sehingga DNA daging sangat kecil dalam sampel yang menyebabkan kit tidak bisa mengisolasi DNA daging tersebut. Proses isolasi DNA sampel beef burger sebagai berikut. 1. Preparasi sampel dilakukan dengan cara masing-masing sampel ditimbang
2gram, kemudian digerus dengan mortir dan stamper hingga hancur dengan jaringan-jaringan pada sampel terbuka sehingga lebih mudah dilisiskan. 2. Tahap pre-lysis dengan menambahkan 2-3ml Buffer Lysis kedalam
masing-masing sampel hingga sampel tidak terlalu kental, kemudian digerus kembali. Ditempatkan pada tabung konikal dan kemudian divortek.
3. Ditambahkan 50μL proteinase K untuk menghilangkan protein yang terdapat pada sampel, kemudian divortek. Campuran diinkubasi pada 55°C selama semalam untuk melisiskan membran sel hingga jaringan benar–benar lisis. 4. Setelah inkubasi selama semalam, disentrifuge 3000rpm selama 20 menit,
kemudian supernatan yang terbentuk dimasukkan kedalam tabung konikal baru.
5. Ditambahkan kloroform (1:1) yang berfungsi untuk melisiskan membran sel, mengendapkan komponen polisakarida didalam buffer isolasi yang
24
mengkontaminasi DNA, dan memecahkan protein-protein seperti endonuklease yang bekerja untuk memotong-motong untai DNA, kemudian dishake dengan alat shaker selama 15-20 menit dan disentifuse 3000rpm selama 20 menit.
6. Setelah disentrifuse, supernatan dimasukan kedalam mikrotube 1,5ml. Ditambahkan etanol absolut (1:1) untuk terjadi dehidrasi DNA sehingga terbentuknya presipitasi, kemudian disentifuse dengan kecepatan 12speed selama 5 menit.
7. Ditambahkan etanol absolut secukupnya untuk mencuci benang-benangnya atau peletnya dan kemudian disentrifuse dengan kecepatan 12 speed selama 5 menit.
8. Pada tahap pengeringan, masing-masing mikrotube dibalik untuk mengkeringkan peletnya selama 2 jam.
9. Ditambahkan Buffer TE sebanyak 50-100μl untuk melarutkan DNA yang dihasilkan dan dapat menjaga DNA untuk tidak mudah rusak. Penyimpanan DNA untuk jangka panjang pada suhu -4°C.
3.2.4. Uji Kualitatif DNA Menggunakan Elektroforesis
DNA hasil isolasi kemudian diuji secara kualitatif dan kuantitatif untuk mengetahui kualitas DNA yang didapat. Gel yang digunakan untuk elektroforesis gel agarosa dengan konsentrasi 0,8% dengan tegangan 100volt selama 30 menit. Pemberian Loading Dye pada hasil isolasi DNA sebelum dimasukan kedalam sumuran gel berfungsi untuk sebagai pewarna bromophenol blue dan visualisasi pergerakan DNA pada saat elektroforesis dicampurkan kedalam DNA. Pada elektroforesis menggunakan ladder 1 kb sebagai marker hasil isolasi DNA. Proses uji kualitatif DNA sebagai berikut.
1. Dilakukan pembuatan gel agarose 0,8% dahulu dengan cara dituang 100ml buffer TBE 1X ke dalam labu ukur kedalam labu erlenmeyer.
2. Ditimbang 0,8g Agarose (konsentrasi 0,8%) gel elektroforesis. Setelah ditimbang, dimasukkan kedalam labu erlenmeyer, kemudian dicampur.
25
3. Dipanaskan dengan microwave, kemudian di aduk hingga agarose larut dalam buffer TBE 1X. Ditambahkan 20µl florosafe, hingga semua larut. Setelah larut, dituang kedalam cetakan yang sudah disiapkan.
4. Ditunggu hingga gel mengeras. Running elektroforesis dilakukan dengan dituang buffer TBE 1X ke dalam chamber mupid elektroforesis secukupnya. 5. Dimasukkan gel agarose yang sudah jadi dalam buffer TBE 1X (dalam
chamber).
6. Diambil kertas parafilm untuk membuat mix 2µl loading buffer, kemudian ditambah 5µl DNA.
7. Diambil 7µl mix (loading dan DNA), dimasukkan kedalam sumuran gel dengan hati-hati.
8. Ditutup mupid, ditekan tombol pengaturan waktu 30 menit, tombol voltase 100volt.
9. Ditekan tombol “RUN”.
10. Ditunggu sampai selesai matikan alat dengan menekan tombol “RUN”. 11. Dibuka tutup mupid, diangkat gel, dilepaskan tray dari gel.
12. Dilihat hasil running elektroforesis dibawah sinar UV. Buffer TBE 1X yang telah digunakan untuk running dapat disimpan kembali untuk running elektroforesis selanjutnya hingga 2-3X pemakaian(36).
3.2.5. Uji Kuantitatif DNA Menggunakan Spektrofotometer
Pertama, kuvet dibersihkan terlebih dahulu dengan aquades serta dilakukan uji blanko menggunakan aquades. Pengenceran DNA dilakukan sebanyak 100x dengan cara sampel DNA 5µl ditambahkan dengan 495µl aquades. Pengukuran absorbansi masing-masing DNA dilakukan pada panjang gelombang 260nm dan 280nm.
3.2.6. Amplifikasi DNA dengan Real-Time PCR
Hasil isolasi DNA dibuat dalam campuran untuk reaksi PCR yang mengandung DNA sesuai dengan yang dibutuhkan 1µL DNA, 5μL EvaGreen
26
ditambahkan PCR-grade water hingga volume campuran 10μL. Pada preparasi NTC (kontrol tanpa template) dibuat dengan mengganti 1µL DNA dengan 1µL PCR-grade water. Amplifikasi PCR dilakukan pada kondisi enzim aktivasi pada suhu 98ºC selama 3 menit, denaturasi pada suhu 98ºC selama 15 detik, annealing pada suhu 59ºC selama 30 detik. Analisis Melting Curve 65-95°C; 0,5°C
increment, 5 detik/langkah. Denaturasi dan annealing dilakukan selama 30
siklus(37). Sesuai dengan tabel 3.2.
Tabel 3.2 Amplifikasi DNA
Langkah Suhu Durasi Siklus Aktivasi Enzim 98°C 3 min 1
Denaturasi 98°C 15 detik
30
Annealing 59°C 30 detik
Analisis Melting
Curve 65-95°C; 0,5°C increment, 5 detik/langkah
3.2.7. Uji Spesifisitas dan Sensitivitas
Spesifisitas uji PCR dilakukan pada daging babi, sapi dan ayam. Uji spesifisitas dilakukan dengan melihat hasil dari DNA daging babi, daging sapi dan daging ayam dengan menggunakan primer for pig detection macrogen®. Primer tersebut didapatkan oleh produsen dengan sekuen yang tidak diketahui.
Sensitivitas uji PCR yang ditunjukkan dengan batas deteksi untuk 5 sampel dengan perbandingan konsentrasi. Pada umumnya semakin kecil konsentrasi DNA yang dapat dideteksi, maka sensitivitas uji PCR semakin meningkat(8).
Gradien konsentrasi yang digunakan tertera pada tabel 3.3.
Tabel 3.3 Gradien Konsentrasi Campuran Daging Babi dan Daging Sapi.
No Daging babi (%) b/b Bobot daging babi (mg) Bobot daging sapi (mg) Bobot total campuran (mg) 1 0,1 0,3 299,7 300 2 0,5 1,5 298,5 300 3 1 3 297 300 4 2,5 7,5 292,5 300 5 5 15 285 300
27
Uji sensitivitas primer dilakukan dengan membandingkan penanda spesifik terhadap DNA daging babi dan DNA daging sapi. Penanda dibuat dengan mencampurkan daging babi dan daging sapi dengan jumlah perbandingan massa dari daging babi dan massa dari daging sapi menggunakan %(b/b).
3.3. Analisa Hasil
Penelitian ini bertujuan untuk menganalisa ada atau tidaknya kandungan daging babi pada produk makanan daging sapi olahan. Sampel yang digunakan pada penelitian ini adalah burger sapi. Pengujian dilakukan melalui amplifikasi DNA menggunakan real-time PCR. Primer spesifik DNA babi yang digunakan yaitu primer for pig detection (macrogen®) sebagai pembanding dengan sampel.
Primer tersebut didapatkan oleh produsen dengan sekuen yang tidak diketahui. Uji kualitatif DNA menggunakan elektroforesis dilakukan dengan melihat terbentuknya pita pada gel agarosa, dan uji kuantitatif DNA menggunakan spektrofotometer dilakukan dengan menghitung konsentrasi DNA yang dapat diketahui dari nilai absorbansi DNA pada λ260nm dan λ280nm.
Uji spesifisitas dilakukan dengan mendeteksi hasil bentuk kurva dari DNA daging sapi dan ayam dengan menggunakan primer spesifik DNA babi. Pada hasil uji spesifisitas menunjukkan terbentuknya kurva hanya pada DNA daging babi, maka primer dapat dikatakan sebagai primer spesifik DNA babi. Uji sensitivitas primer dilakukan dengan pencampuran daging babi dan daging sapi dengan perbandingan konsentrasi (b/b). Apabila pada konsentrasi terkecil fragmen DNA babi masih muncul, hal ini menunjukkan primer yang digunakan sensitif untuk amplifikasi DNA babi. Analisis DNA saat ini semakin dikembangkan dengan relatif mendeteksi adanya campuran daging lain hingga konsentrasi 0,1%(38).
Identifikasi pada sampel dilakukan dengan mendeteksi hasil bentuk kurva DNA sampel dengan menggunakan primer spesifik DNA babi. Apabila hasil bentuk kurva sampel sama dengan kurva yang didapat pada DNA babi, maka sampel yang digunakan mengandung DNA babi. Apabila bentuk kurva sampel tidak terdapat kurva yang sama dengan kurva DNA babi, maka sampel yang digunakan dimungkinkan tidak mengandung DNA babi. Uji yang dilakukan untuk
28
memastikan tidak mendapatkan hasil negatif palsu pada sampel adalah uji negatif palsu dengan mencampurkan sampel dengan daging babi. Apabila bentuk kurva campuran sampel dan daging babi sama dengan kurva yang didapat pada kurva DNA babi, maka hasil yang didapatkan benar-benar negatif terhadap DNA babi.
Pada masing-masing amplifikasi DNA terdapat hasil melt culve untuk memeriksa spesifisitas reaksi RT-PCR yang dilakukan. Hasil melt curve yang baik seharusnya menghasilkan satu puncak pada melting peak dan menunjukkan
melting temperature dari amplikon. Analisis melting curve ini juga dapat
menunjukkan adanya primer dimer bila terdapat lebih dari satu puncak(39).
3.4. Skema Penelitian
Analisis Hasil
Penyiapan sampel penelitian dan pembanding / kontrol daging babi, daging sapi, dan daging ayam
Ekstraksi genomik
Elektroforesis dan kuantifikasi DNA Menggunakan Spektrofotometer
Amplifikasi DNA dengan Real-Time PCR
Uji Spesifisitas Uji Sensitivitas
29
BAB IV
HASIL DAN PEMBAHASAN
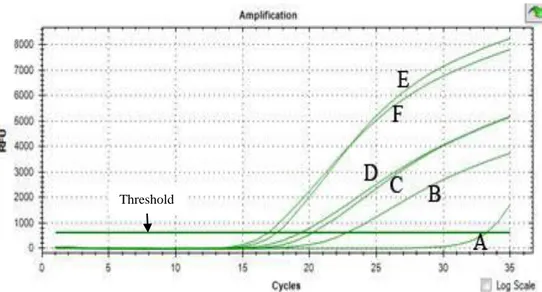
4.1. Hasil Isolasi DNA
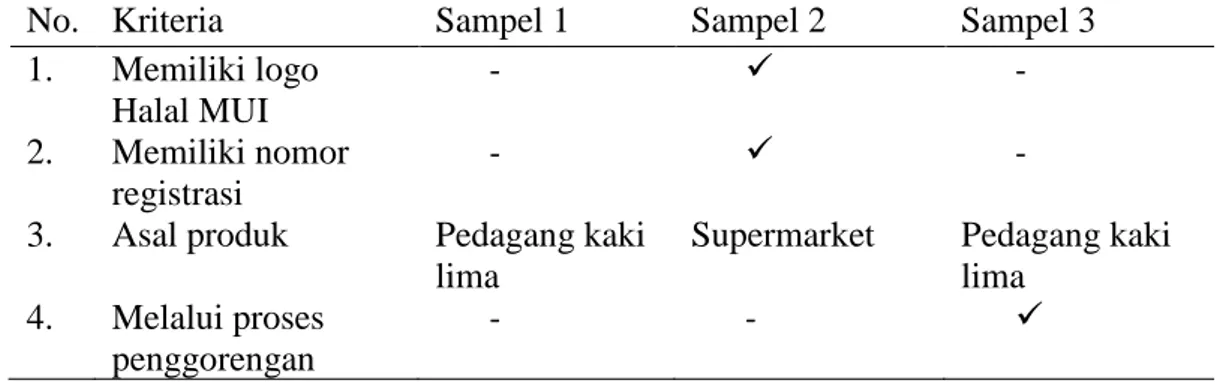
Tahap pertama pada isolasi DNA yaitu preparasi daging dan sampel. Tujuan dari percobaan ini adalah untuk mengisolasi atau memisahkan DNA yang berasal dari daging dan beef burger. Metode yang dilakukan dalam mengisolasi DNA dari kontrol terdiri dari daging babi, sapi dan ayam adalah Tiangen kit. Hasil isolasi DNA dapat dilihat dari hasil elektroforesis pada gambar 4.1.
M= ladder 1kb, 1=daging babi, 2=daging sapi, 3=daging ayam.
Gambar 4.1 Hasil Elektroforesis isolasi DNA kontrol pada gel agarosa 0,8%
Berdasarkan pada gambar 4.1 bahwa hasil isolasi DNA daging dapat terlihat walaupun pitanya sedikit tipis. Hal tersebut menunjukkan bahwa Tiangen kit telah mampu mengisolasi DNA daging dengan baik dan hasil isolasi dapat digunakan untuk Real Time PCR. Pita yang terbentuk pada daging babi, daging sapi, dan daging ayam berada di 10.000 bp. Pada penelitian ini hanya dilakukan secara kualitatif untuk melihat ada atau tidak DNA daging, sehingga pita pada hasil isolasi DNA yang tipis tidak mempengaruhi Real Time PCR.
M 1 2 3
30
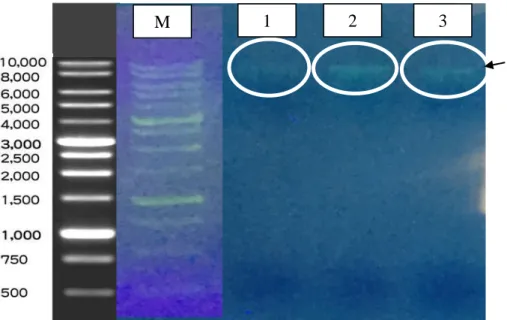
Isolasi DNA sampel beef burger menggunakan metode konvensional. Hasil isolasi 3 sampel beef burger dapat dilihat dari hasil elektroforesis pada gambar 4.2.
M= ladder 1 kb, 1= sampel 1, 2=sampel 2, 3= sampel 3
Gambar 4.2. Hasil elektroforesis isolasi DNA sampel beef burger pada gel agarose 0,8%
Pada gambar 4.2 menunjukkan pita hasil isolasi DNA sampel. Pita yang terbentuk pada sampel 1 dan sampel 2 berada di 6000 bp, sedangkan pada sampel 3 pita yang terbentuk berada di 10.000 bp. Hasil isolasi DNA sampel terlihat bentuk pita yang sedikit smear yang dapat disebabkan karena DNA yang terisolasi kurang murni dimana kemungkinan masih ada kontaminasi protein atau fragmen-fragmen lainnya. Pada penelitian ini hasil isolasi DNA sampel tersebut masih dapat digunakan untuk Real Time PCR karena didalamnya masih terkandung DNA yang diinginkan.
Uji kualitatif DNA dengan spektrofotometer bertujuan untuk melihat kualitas DNA yang dihasilkan dari isolasi DNA kontrol dan sampel. Selain itu juga untuk memastikan DNA yang diperlukan untuk melakukan uji PCR dengan menghitung konsentrasi DNA. DNA dapat dibaca absorbansinya pada λ260 nm
1 2 3 M
6.000 bp
31
dan λ280 nm dengan spektrofotometer UV karena DNA memiliki ikatan rangkap terkonjugasi pada basa purin dan pirimidin. Pada penelitian ini uji kuantifikasi DNA menggunakan rasio perbandingan absorbansi pada λ260 nm : λ280 nm. Hasil kuantifikasi DNA dapat dilihat pada table 4.1. Kemurnian larutan DNA dapat dihitung melalui perbandingan absorbansi λ260 nm:λ280 nm(20).
Tabel 4.1 Hasil Kuantifikasi DNA menggunakan Spektrofotometer UV
No Nama DNA λ260 (A) λ280 (B) Rasio (A:B) Konsentrasi DNA
(µg/ml) 1 Daging Babi 0,168 0,115 1,68 830 2 Daging Sapi 0,166 0,099 1,46 840 3 Daging Ayam 0,170 0,118 1,44 850 4 Sampel 1 0,190 0,129 1,47 950 5 Sampel 2 0,184 0,120 1,53 920 6 Sampel 3 0,183 0,117 1,56 915
Hasil isolasi DNA sampel beef burger dapat dikatakan murni apabila rasio perbandingan absorbansi λ260 nm dan λ280 nm adalah 1,8-2,0 dan telah memenuhi persyaratan yang dibutuhkan dalam analisis molekuler. Pada penelitian ini diperoleh kemurnian antara 1,4 sampai 1,6. Kisaran nilai tersebut menunujukkan bahwa jumlah DNA dalam sampel masih terkontaminasi karena apabila kemurnian dibawah 1,8 atau diatas 2,0 diindikasikan DNA masih terkontaminasi protein dan RNA(21). Kontaminasi yang terjadi dapat dimurnikan
kembali dengan melakukan ektraksi kloroform isoamilalkohol dan deproteinasi. Pengukuran kuantitas DNA juga dapat mengetahui konsentrasi DNA, yang bertujuan untuk mengetahui banyak sedikitnya DNA yang terkandung dalam larutan.
Konsentrasi DNA yang diperoleh bervariasi dapat disebabkan karena sampel yang diisolasi berasal dari daging segar dan makanan olahan daging berupa beef burger. Pada beef burger lebih banyak campuran bahan makanan tambahan dibandingkan dengan daging segar. Pada penelitian ini kemurnian DNA
32
tidak terlalu dipentingkan karena hanya untuk melihat kualitas hasil isolasi DNA yang diperoleh.
4.2. Uji Spesifisitas Primer
Pada uji spesifisitas primer dilakukan menggunakan kontrol positif yaitu daging babi, sedangkan yang sebagai kontrol negatif berupa daging sapi dan ayam. Pada penelitian menggunakan daging sapi dan ayam sebagai kontrol negatif karena daging tersebut lebih sering dikonsumsi oleh masyarakat dan lebih mudah diperoleh dipasaran. Primer yang digunakan adalah primer for pig detection
macrogen®, diberikan oleh produsen dan telah teroptimasi suhu annealing primer tersebut yaitu pada suhu 59°C. Primer tersebut tidak diketahui sekuen DNAnya.
Pada penelitian, DNA mengandung segmen yang akan diampllifikasi ditambahkan primer. Primer adalah dua oligonukleotida sintetik. Setiap oligonukleotida bersifat komplementer terhadap urutan yang pendek pada satu untai DNA untuk diamplifikasi. Sewaktu larutan mendingin, oligonukleotida membentuk pasangan basa dengan DNA dan berfungsi sebagai primer untuk mensintesis untai DNA yang dikatalisis oleh DNA polimerase tahan panas. Proses pemanasan, pendinginan, dan sintesis DNA baru diulang berkali-kali sampai diperoleh salinan DNA dalam jumlah besar. Proses dapat dilakukan secara otomatis sehingga setiap putaran replikasi hanya memerlukan waktu beberapa menit. Dalam 20 siklus pemanasan dan pendinginan, DNA dapat mengalami amplifikasi lebih dari sejuta kali(23).
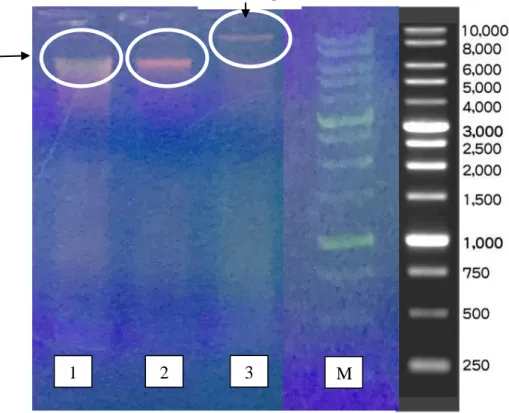
Hasil uji spesifisitas primer dapat dilihat pada gambar 4.3. Pada hasil RT-PCR dapat dilihat kurva yang terbentuk hanya pada DNA daging babi, sedangkan pada NTC, daging sapi dan daging ayam tidak terbentuk kurva. Primer yang digunakan dapat dikatakan spesifik karena primer tersebut hanya mengamplifikasi DNA daging babi sedangkan DNA daging sapi dan ayam tidak teramplifikasi oleh primer tersebut.
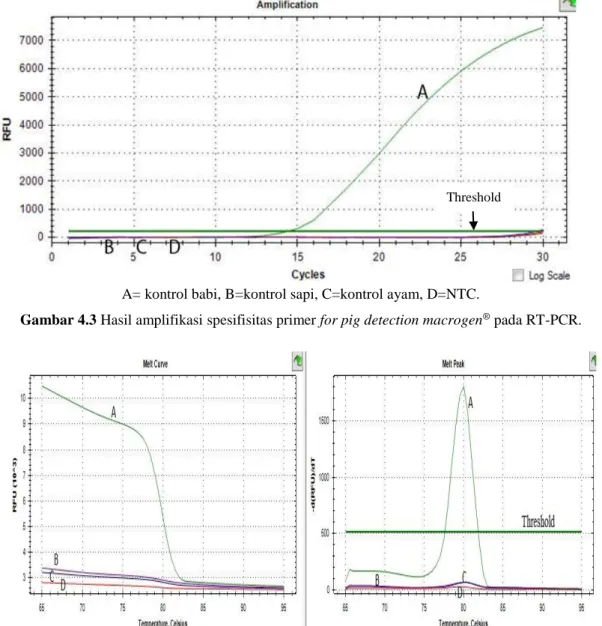
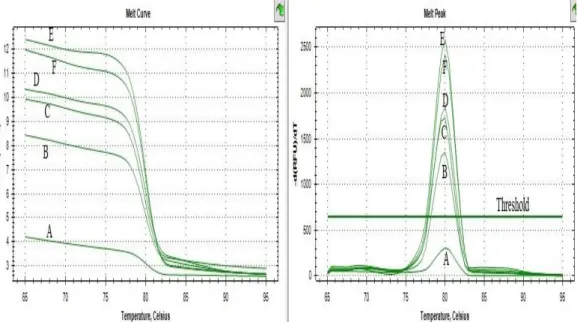
Pada gambar 4.4 yaitu hasil melt curve juga menunjukkan bahwa hanya DNA daging babi yang membentuk puncak kurva sedangkan pada DNA lainnya tidak terbentuk puncak kurva.
33
A= kontrol babi, B=kontrol sapi, C=kontrol ayam, D=NTC.
Gambar 4.3 Hasil amplifikasi spesifisitas primer for pig detection macrogen® pada RT-PCR.
A= kontrol babi, B=kontrol sapi, C=kontrol ayam, D=NTC
Gambar 4.4 Hasil melt curve spesifisitas primer for pig detection macrogen® pada RT-PCR.
Hasil melt curve yang baik akan menghasilkan satu puncak pada melt peak dan menunjukkan melting temperature dari amplikon, sehingga primer yang digunakan dapat dikatakan spesifik. Analisis melting curve juga dapat menunjukkan adanya primer dimer bila terdapat lebih dari satu puncak(39). Pada hasil melt curve dapat disimpulkan primer yang digunakan spesifik hanya mendeteksi DNA babi.