“TITRASI KONDUKTOMETRI”
Makalah disusun untuk memenuhi tugasMata Kuliah : Kimia Analisa Instrumen
Dosen Pengampu:
Dr. Sri Haryani, M.Si
Dr. Sri Wardani, M.Si
Oleh
Endang Susiani
0402513139
(PENDIDIKAN KIMIA-KERJASAMA KEMENAG)
PROGRAM PASCA SARJANA
PENDIDIKAN IPA KONSENTRASI KIMIA
UNIVERSITAS NEGERI SEMARANG
PENDAHULUAN A. Latar Belakang
Mempelajari titrasi amatlah penting bagi mahasiswa yang mengambil jurusan kimia dan bidang-bidang yang berhubungan dengannya. Titrasi sampai sekarang masih banyak dipakai di laboratorium industri disebabkan teknik ini cepat dan tidak membutuhkan banyak reagen. Titrasi merupakan salah satu teknik analisis kimia kuantitatif yang dipergunakan untuk menentukan konsentrasi suatu larutan tertentu, dimana penentuannya menggunakan suatu larutan standar yang sudah diketahui konsentrasinya secara tepat.
Titik equivalen dapat ditentukan dengan berbagai macam cara, cara yang umum adalah dengan menggunakan indikator. Indikator akan berubah warna dengan adanya penambahan sedikit mungkin titran, dengan cara ini maka kita dapat langsung menghentikan proses titrasi. Selain itu juga dapat menggunakan alat yang disebut dengan konduktometer. Tidak semua zat bisa ditentukan dengan cara titrasi akan tetapi kita harus memperhatikan syarat-syarat titrasi untuk mengetahui zat apa saja yang dapat ditentukan dengan metode titrasi untuk berbagai jenis titrasi yang ada.
B. Rumusan Masalah
1. Mempelajari tentang pengertian konduktometri
2. Mempelajari faktor yang berperan penting dalam proses titrasi konduktometri 3. Mempelajari macam-macam dari titrasi konduktometri
4. Mempelajari kelebihan dan kelemahan dari titrasi konduktometri
C. Tujuan Penulisan
Tujuan dari penulisan makalah ini adalah: 1. Mengetahui definisi konduktometri
2. Mengetahui faktor yang berperan penting dalam proses titrasi konduktometri 3. Mengetahui macam-macam dari titrasi konduktometri
4. Mengetahui kelebihan dan kelemahan dari titrasi konduktometri
BAB II PEMBAHASAN A. Pengertian Konduktometri
dalam larutan. Daya hantar listrik berhubungan dengan pergerakan suatu ion di dalam larutan ion yang mudah bergerak mempunyai daya hantar listrik yang besar.
Daya hantar listrik (G) merupakan kebalikan dari tahanan (R), sehingga daya hantar listrik mempunyai satuan ohm-1. Bila arus listrik dialirkan dalam suatu larutan mempunyai
dua elektroda, maka daya hantar listrik (G) berbanding lurus dengan luas permukaan elektroda (A) dan berbanding terbalik dengan jarak kedua elektroda (l).
G=1 R=k
A l
Dengan:
G = daya hantar listrik (ohm-1)
R = tahanan (ohm) k = Konduktovitas (Sm-1)
A = luas permukaan elektroda (m2)
l = jarak kedua elektroda (m)
Konduktometri merupakan metode untuk menganalisa larutan berdasarkan kemampuan ion dalam mengantarkan muatan listrik di antara dua elektroda. Ini berarti konduktometri adalah salah satu metode analisa elektrokimia di samping potentiometri, amperometri dan sebagainya.
Didalam titrasi konduktometri kita akan mendapatkan beberapa kemudahan yang
mungkin tidak kita dapatkan jika kita menggunakan dengan titrasi lainya, misal tidak menggunakan indikator, karena dalam titrasi konduktometri ini kita hanya mengukur daya hantar larutan. Jadi dalam titrasi konduktometri ini kita tidak perlu mencari titik eivalen dengan melihat adanya perubahan warna. Walaupun demikian masih banyak kelemahan– kelamahan dalam titrasi konduktometri ini. Karena kita tahu bahwa dalam titrasi konduktometri hanya terbatas untuk larutan yang tergolong kedalam larutan elektrolit saja. Sedangkan untuk larutan non elektrolit tidak dapat menggunakan titrasi konduktometri. Titrasi konduktometri ini sangat berhubungan dengan daya hantar listrik, jadi juga akan berhubungan dengan adanya ion–ion dalam larutan yang berperan untuk menghantarkan arus listrik dalam larutan. Arus listrik ini tidak akan bisa melewati larutan yang tidak terdapat ion– ion, sehingga larutan non elektrolit tidak bisa menghantarkan arus listrik.
Dalam titrasi konduktometri ini juga sangat berhubungan dengan konsentrasi dan temperatur dari larutan yang akan ditentukan daya hantarnya. Sehingga ikita harus menjaga temperatur larutan agar berada dalam keadaan konstan, sehingga kita dapat memebedakan perbedaan dari daya hantar larutan hanya berdasarkan perbedaan konsentrasi saja. Jika
temperatur berubah–ubah maka bisa saja konsentrasi yang besar seharusnya memilki daya hantar yang besar malah memiliki daya hantar yang kecil karena suhunya menurun. Sehingga ion – ion dalam larutan tidak dapat begeraka dengan bebas
B. Daya Hantar Ekivalen (Equivalen Conductance)
Kemampuan suatu zat terlarut untuk menghantarkan arus listrik disebut daya hantar ekivalen (^) yang didefinisikan sebagai daya hantar satu gram ekivalen zat terlarut di antara dua elektroda dengan jarak kedua electroda 1cm. Yang dimaksud dengan berat ekuivalen adalah berat molekul dibagi jumlah muatan positif atau negatif. Contoh berat ekivalen BaCl2
adalah BM BaCl2 dibagi dua. Volume larutan (cm3) yang mengandung satu gram ekivalen zat
terlarut diberikan oleh,
V = 1000 / C
dengan C adalah konsentrasi (ekivalen per cm-3), bilangan 1000 menunjukkan 1 liter = 1000
cm3. Volume dapat juga dinyatakan sebagai hasil kali luas (A) dan jarak kedua elektroda (1).
V= l A
Dengan l sama dengan 1 cm ,V = A = 1000 k / C
Substitusi persamaan ini ke dalam persamaan G diperoleh,G = 1/R = 1000k/C
Daya hantar ekivalen (^) akan sama dengan daya hantar listrik (G) bila 1 gram ekivalen larutan terdapat di antara dua elektroda dengan jarak 1 cm.
^ = 1000k/C
Daya hantar ekivalen pada larutan encer diberi simbol yang harganya tertentu untuk setiap ion.
C. Pengukuran Konduktivitas
Untuk mengukur konduktivitas suatu larutan, larutan ditaruh dalam sebuah sel yang tetapan selnya telah ditetapkan dengan suatu larutan yang konduktivitasnya diketahui dengan
perubahan dalam komposisi larutan di dekat elektrode, dengan demikian potensial-potensial listrik dapat timbul pada elektrode-elektrode.
Sumber arus bolak-balik dapat berupa jaringan listrik pusat yang memberi arus dengan frekuensi sampai 3000 Hz. Karena digunakan arus bolak balik, sel akan mempunyai kapasitan yang tak akan diimbangi dalam kontak resistansi standar R, maka perlu dimasukan sebuah kondensor Variabel paralel dengan kontak resistansi sehingga kapasitansinya dapat diimbangi.
Jika frekuensi arus dinaikkan sampai menjadi Hz, maka efek-efek kapasitansi dan induksi menjadi sangat penting, dan peralatan harus dimodifikasi untuk memperhitungkan efek-efek ini. Karena itu kita perlu meninjau cara-cara dalm pengukuran konduktivitas:
a. Titrasi konduktometri yang dilaksanakan dengan arus yang berfrekuensi rendah sampai dengan 3000 Hz
b. Titrasi yang dilakukan menggunakan arus pada frekuensi tinggi, kita lebih mengukur peubahan-perubahan dalam kapasitansi atu induktansi ketimbang konduktansinya maka titrasi-titrasi demikian biasanya disebut titrasi frekuensi tinggi.
Perhitungan konduktivitas secara langsung dari tahanan. Sampel dan dimensi sel I dan A tidak dapat diandalkan karena distribusi arusnya rumit. Dalam prakteknya, sel dikalibrasikan dengan sampel yang diketahui konduktivitasnya. Konduktivitas larutan bergantung pada jumlah ion yang ada dan biasa dikenal sebagai konduktivitas Molar L.
Pengukuran-pengukuran hantaran biasanya dilakukan pada larutan berair (H2O adalah
penghantar buruk, L H2O = 5 x 10-8 mho/cm) pada 25 0C. Pada konsentrasi tinggi, kenaikan
konsentrasi menyebabkan naiknya hantaran secara linier. Ini akan memiliki maksimum, untuk selanjutnya menurun
Teori tentang konduktometri merupakan kebalikan dari teori hokum ohm tentang hambatan listrik. Berdasarkan dan berangkat dari hukum ohm tersebut, maka disusunlah teori tentang konduktovitas yang merupakan kebalikan dari resistivitas
G=l/R
K=l/ρ
DenganG: Konduktovitansi (mho) atau (S) , I : Panjang material (meter)
ρ: Hambatan jenis atau resistivitas (ohm meter)
Konduktivitas larutan elektrolit pada temperatur konstan, tergantung pada jenis ion dan konsentrasinya. Jika larutan semakin encer, maka konduktovitasnya akan menurun. Ini terjadi karena jumlah ion persatuan luas semakin sedikit. Akantetapi, kemampuan tiap ion dalam meneruskan muatan akan semakin besar karenatidak ada nya hambatan antar ion pada larutan encer.
Karena konsentrasi larutan pada umumnya dinyatakan dalam satuan molar (mol/liter), Maka pada konduktometri terdapat istilah konduktovitas molar (Λ), yang mempunyai hubungan dengan konsentrasi secara:
Λ
= 1000K/C
Dimana:
Λ = konduktoitas molar (Scm2 mol-1)
C = konsentrasi (mol.dm-3)
K = Konduktovitas (Scm-1)
Konduktovitas di tentukan oleh jenis ion. Sehingga untuk mengetahui kemampuan tiap jenision, maka perlu dilakukan percobaan dengan larutan yang sangat encer, sehingga tidak di pengaruhi oleh ion lain. Pada kondisi seperti ini,maka konduktovitas larutan merupakan jumlah konduktovitas ion positif (Kation) dan ion negative (anion).
Λ
o=
+o
kation+
-oanion
Λo adalah konduktivitas molar ion pada larutan sangat encer (konsentrasi mendekati nol)
Contoh soal 1:
Hitung daya hantar listrik larutan HCl 0,01 N, bila daya hantar ion untuk: H+ = 350 dan Cl- =
76. Konstanta sel = 0,2 cm-1. Penyelesaian: ¿ 1 R= C 1000 . ∅¿ H+ + Cl-] = 10-2 / 1000 .∅ (350 + 76)
= 0,5 x 10-4 (426)
= 2,1 x 10-3 ohm-1
D. Pengukuran Daya Hantar
Pengukuran daya hantar memerlukan sumber listrik, sel untuk menyimpan larutan dan jembatan (rangkaian elektronik) untuk mengukur tahanan larutan.
1. Sumber Listrik
Hantaran arus DC (misal arus yang berasal dari batrei) melalui larutan merupakan proses faradai, yaitu oksidasi dan reduksi terjadi pada kedua elektroda. Sedangkan arus AC tidak memerlukan reaksi elektro kimia pada elektroda- elektrodanya, dalam hal ini aliran arus listrik bukan akibat proses faradai. Perubahan karena proses faradai dapat merubah sifat listrik sel, maka pengukuran konduktometri didasarkan pada arus nonparaday atau arus AC. 2. Tahanan Jembatan
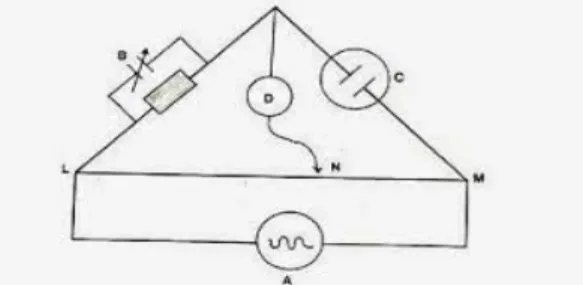
Jembatan Wheatstone merupakan jenis alat yang digunakan untuk pengukuran daya hantar.
Gambar 1. Jembatan Wheatstone untuk pengukuran Tahanan
Sumber listrik AC, S merupakan sumber arus litrik dengan frekuensi antara 60 sampai 1000 Hz, dan potensial antara 6 sampai 10 V. Besarnya tahanan RAC dan RBC dapat dihitung
dari posisi jarum pada C. ND adalah detektor kebisingan (Noisy Detector) yang biasanya menggunakan headphone. Head phone dapat diganti dengan magig eye, atau mikroamper, digital, sehingga Rsel dapat dihitung bila ND tak ada respon dengan menggeser kedudukan C.
Rs merupakan kapasitor yang dapat mencegah terjadinya arus bolak- balik bila tahanan dalam analit terlalu tinggi. Kemudian tahanan sel Rx dihitung berdasarkan.
R
x=
RsAC BC
Contoh soal 2:
50 mL CH3COOH diencerkan dengan 100 mL air. Tentukan daya hantar listrik larutan
Penyelesaian: CH3COOH CH3COO- + H+ −¿ CH 3 COO¿ ¿ +¿ H¿ ¿ ¿ Ka=¿ +¿ H¿ ¿ −¿ CH 3 COO¿ ¿ ¿ CH 3COO−¿ H+¿ +λ¿ λ¿ 1 R= C 1000. θ
(
50 150)
¿ CH 3 COO−¿ H+¿ +λ¿ λ¿ ¿ 10 −4 103(1)(
1 3)
¿ ¿10−7x1 3 x 390,0=1,3 x 10 −5 ohm−1 Contoh soal 3:Hitung daya hantar campuran 10 mL HCl 0,01 N; 40 mL CH3COOH 0,01 N; dan 100 mL air.
Penyelesaian:
Ion H+ dan HCl menyebabkan kesetimbangan penguraian CH
3COOH pada contoh soal 2
bergerak ke arah kiri, atau CH3COOH dapat dikatakan tak terionisasi, jadi daya hantar listrik
Cl−¿ H+¿ +λ¿ λ¿ 1 R= C 1000. θ
(
10 150)
¿ ¿ 10 −1 103(1)(
1 15)
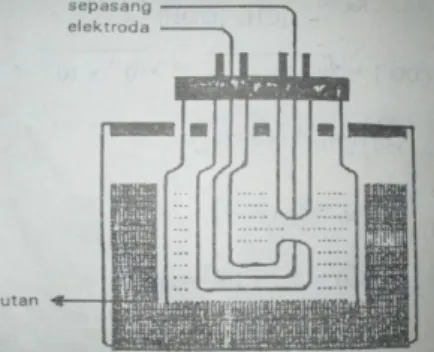
(350+76 ) ¿10−5x1 5 x 426=2,84 x 10 −4 ohm−1 3. SelSalah satu bagian konduktometer adalah sel yang terdiri dari sepasang elektroda yang terbuat dari bahan yang sama. Biasanya elektroda berupa logam yang dilapisi logam platina untuk menambah efektifitas permukaan elektroda.
Titrasi Konduktometri dapat digunakan untuk menentukan titik ekivalen suatu titrasi, berupa beberapa contoh titrasi konduktometri dibahas berikut, Titrasi asam kuat- basa kuat Sebagai contoh lrutan HCl dititrasi oleh NaOH. Kedua larutan ini adalah penghantar listrik yang baik. Daya hantar H+ turun sampai titik ekivalen tercapai. Dalam hal ini jumlah
H+ makin berkurang di dalam larutan, sedangkan daya hantar OH- bertambah setelah titik
ekivalen (Te) tercapai karena jumlah OH- di dalam larutan bertambah. Jumlah ion Cl- di
dalam larutan tidak berubah, karena itu daya hantar konstan dengan penambahan NaOH. Daya hantar ion Na+ bertambah secara perlahan-lahan sesuai dengan jumlah ion Na+.
Gambar 2. Sel Konduktometer
E. Macam-Macam dari Titrasi Konduktometri
Macam-macam titrasi konduktometri seperti yang diuraikan dalam paragraf berikut:
Dalam melakukan titrasi konduktometri diperlukan alat yang namanya konduktometer, berikut beberapa contoh alat konduktometer seperti pada Gambar 3a, 3b, sebagai berikut:
Gambar 3a. Konduktometer Gambar 3b. Konduktometer
Metode konduktometri dapat digunakan untuk menentukan titik ekivalen suatu titrasi. Beberapa contoh titrasi konduktometri dibahas berikut.
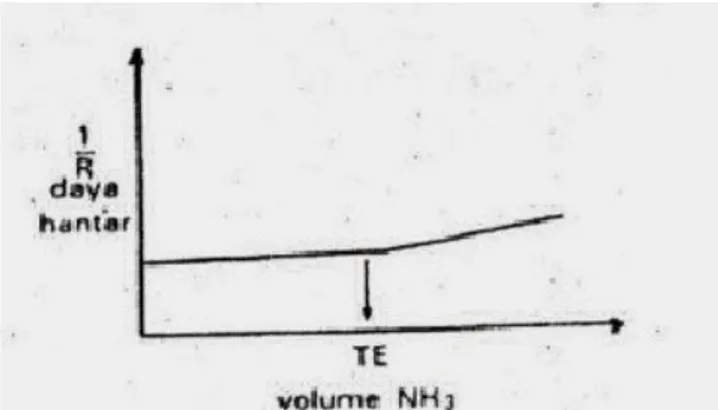
1. Titrasi Asam Kuat-Basa Kuat
Sebagai contoh larutan HCl dititrasi oleh NaOH. Kedua larutan ini adalah penghantar listrik yang baik. Kurva titrasinya ditunjukkan pada gambar 1. Daya hantar H+ turun
sampai titik ekivalen tercapai, dalam hal ini jumlah H+ makin berkurang di dalam
larutan. Sedangkan daya hantar OH- bertambah setelah titik ekivalen tercapai karena
jumlah OH- di dalam larutan bertambah. Jumlah ion Cl- di dalam larutan tidak berubah
karena itu daya hantarnya konstan dengan penambahan NaOH. Daya hantar ion Na+
bertambah secara perlahan-lahan sesuai dengan jumlah ion Na+.
Gambar 4. Kurva titrasi konduktometri asam kuat dan basa kuat
2. Kurva Titrasi Konduktometri Lainnya
Gambar 5. Kurva titrasi konduktometri asam kuat dan basa lemah
Gambar 6. Kurva titrasi konduktometri asam lemah dan basa kuat
Gambar 7. Kurva titrasi konduktometri asam lemah dan basa lemah
Berdasarkan konduktivitasnya, titrasi konduktometri terbagi menjadi dua, yaitu:
1. Titrasi Konduktometri Frekuensi Rendah
Penambahan suatu elektolit ke elektrolit lain pada keadaan yang tidak ada perubahan volum yang begitu besar akan mempengaruhi konduktovitas larutan terjadi reaksi ionik atau tidak. Jika tidak terjadi reaksi ionic, maka perubahan konduktovitas sedikit sekali atau hampir tidak ada. Bila terjadi reaksi ionic, maka perubahan konduktivitas yang relative cukup besar sehingga dapat di amati, seperti pada titrasi basa kuat oleh asam kuat. Dalam titrasi ini terjadi penurunan konduktivitas karena terjadi penggantian ion hydrogen, yang mempunyai konduktovitas tinggi, dengan kation lain yang mempunyai konduktovitas rendah.
Pada titrasi penetralan, pengendapan dll, penentuan titik ahir titrasi titrasi ditentukan berdasarkan perubahan koduktivitas (hantaran) dari reaksi kimia yang terjadi. Hantaran di ukur pada setiap penambahan sejumlah pereaksi dan titik pengukuran tersebut bila di alurkan memberikan 2 garis lurus yang saling berpotongan dinamakan titik ekivalen titrasi. Ketepatan metode ini bergantung pada sudut perpotongan dan kerapatan titik pengukuran. Secara praktik konsentrasi penitran 20-100 kali lebih kali pekat dari larutan yang di titrasi, Pada metode ini larutan yang dihasilkan harus seencer ungkin namun suatu hal yang perlu ditinjau lagi untuk efek keenceran harus dibuat dengan mengalikan nilai-nilai konduktifitas dengan faktor (V+v)/V, dimana V adalah volume asli dari larutan dan v adalah volume reagensia yang ditambahkan. Kelebihan titrasi ini, baik untuk asam yang sangat lemah seperti asam borat dan fenol yang secara potensiometri tidak dapat di lakukan. Selain itu, titrasi konduktometri tidak perlukan kontrol suhu. Selain itu hendaknya diperhatikan pengendalian temperatur dalam pengukuran-pengukuran konduktansi. Sementara penggunaan termostat tidaklah penting dalam titrasi konduktometri karena kekonstanan temperatur lebih diperhatikan, tetapi biasanya kita hanya perlu menaruh sel konduktivitas itu dalam bejana berisi air pada temperatur laboratorium.
Perubahan relatif dari konduktivitas larutan selama reaksi dan pada penambahan reagensia berlebih, sangat menentukan ketepatan titrasi. Elektrolit asing yang mengganggu proses reaksi ini tidak boleh ada karena zat-zat ini mempunyai efek yang besar pada ketepatan hasil titrasi.
2. Titrasi Konduktometri Frekuensi Tinggi
Dalam metode titrasi frekuensi tinggi sebuah sel yang sesuai yang mengandung sistem kimia itu dijadikan bagian dari atau dirangkaikan kesebuah rangkaian osilator yang beresonansi pada suatu frekuensi dari beberapa megahertz. Selain komposisi kimia itu berubah resistansi atau kapasitansi rangkaian tersebut juga berubah dan terjadilah perubahan karakteristik osilator. Setiap kuantitas ini dapat dimbil dan diukur sebagai indikasi dari perubahan dalam komposisi sistem kimia itu yaitu selagi suatu larutan dititrasi dengan suatu reagensia yang sesuai umumnya dapat diperoleh kurva-kurva yang menunjukan infleksi atau pematahan pada titik valen. Sifat fundamental dari sistem kimia yang mempengaruhi karakteristik osilator ialah tetapan dielektrik dan konduktifitasnya. Suatu keuntungan penting dari metode frekuensi tinggi ini adalah elektrode dapat ditaruh diluar sel dan elektrode tersebut tidak bisa berkontak langsung dengan larutan uji. Karenanya pengukuran-pengukuran dapat dibuat tanpa bahaya elektrolisis atau polarisasi elektrode sedangkan
spesifik karena bergantung hanya pada konduktivitas dan tetapan dielektrik sistem itu serta tidak bergantung pada identitas kimiawi dari komponen-komponen sistem itu.
Setiap ion atau molekul dipolar cendrung bergerak atau menjuruskan dirinya sendiri dalam arah elektrode yang polaritasnya berlawanan. Polaritas elektrode berubah satu kali setiap daur, dan ion atau dipol itu harus membalikan gerakan atau orientasinya. Konduktan larutan ialah hasil dari gerakan ion-ion negatif dan positif relatif terhadap ion-ion tersebut dan terhadap molekul-molekul terlarut. Setiap ion cendrung unutk bergerak mendahului atmosfer ioniknya dan akibatnya terbentuk distribusi muatan yang tidak simetris disetiap ion pusat serta terjadinya suatu gaya hambat atas ion dalam arah yang berlawanan dengan gerakannya. Pada frekuensi bolak balik yang lebih besar dari suatu megaherzt, ion pusat merubah geraknya begitu cepat dengan setiap daur dari medan yang dikenakan, sehingga tak banyak kesempatan untuk timbulnya asimetri drai atmosfer ionik dan akhirnya konduktanpun naik. Pada frekuensi-frekuensi tinggi, ion-ion mengalami oksidasi yang lebih kecil sehingga atmosfer ionik yang bermuatan berlawanan mengadaan gaya hambatan yang relatif lebih kecil ketimbang pada frekuensi rendah. Teknik ferkuensi tinggi ini adalah paling peka dalam titrasi-titrasi dimana konsentrasi total ion yang terlarut berubah, misalnya dalam reaksi pengendapan dan pembentukan kompleks. Teknik ini juga dapat diaplikasikan pada sebuah ion yang bergerak cepat digantikan oleh sebuah ion yang bergerak lambat misalnya dalam titrasi asam basa. Sebuah sel sederhana yang digunakan untuk titrasi frekuensi tinggi terdiri dari dua lempeng logam yang terpasang tetap pada dinding sebuah wadah kaca.
Contoh Titrasi Frekuensi Tinggi
Suatu larutan yang akan dititrasi harus diencerkan lebih lanjut dalam sel sampai volume total menjadi kira-kira 35 sehingga permukaan cairan berada lebih dari 1 cm diatas elektrode atas sel itu dan akhirnya akan memberikan konsentrasi yang terletak dalam jangkauan operasi optimum dari titrimeter yang digunakan. Selain itu titran harus mempunyai konsentrasi lima sampai sepuluh kali konsentrasi larutan uji, dan setelah penambahan reagensia titrimeter disesuaikan kembali. Dan terakhir kita harus melakukan pembacaan hasil instrumen pada grafik terhadap volume titran yang ditambahkan.
F. Kelebihan dan Kekurangan Titrasi Konduktometri Kelebihan titrasi konduktometer
a.
titrasi tidak menggunakan indikator, karena pada titik keivalen sudah dapat ditentukan dengan daya hantar dari larutan tersebut.c.
Dapat digunakan untuk titrasi yang dapat menimbulkan pengendapatand.
Lebih praktise.
Lebih cepat atau waktu yang diperlukan lebih sedikitf.
Untuk persen kesalahanya lebih kecil jika dibandingkan dengan titrasi volumetriKekurangan titrasi konduktometer
a.
Hanya dapat diterapkan pada larutan elektrolit sajab.
Sangat dipengaruhi temperaturc.
Dapat ditunjukka dengan tidak langsungd.
Peralatan cukup mahale.
Jika tidak hati – hati maka akan cepat rusakf.
Tidak bisa digunakan pada larutan yang sangat asam atau basa karena akan meleleh.G. Hal-Hal Berikut Harus Selalu Diingat-Ingat Ketika Melakukan Titrasi :
1. Penyesuaian pH.
Untuk banyak titrasi EDTA, pH larutan sangatt menentukan sekali; seringkali harus dicapai batas-batas dari 1 satuan pH dan sering batas-batas dari 0,5 satuan pH harus dicapai, agar suatu titrasi yang sukses dapat dilakukan. Untuk mencapai batas-batas kontrol yang begitu sempit, perlu digunakan sebuah pH-meter sewaktu menyesuaikan nilai pH larutan, dan bahkan untuk kasus di mana batas pH adalah sedemikian sehingga kertas uji pH boleh digunakan untuk mengontrol penyesuain pH, hanyalah kertas dari jenis dengan jangkau yang sempit boleh digunakan.
2. Pemekatan ion logam yang akan dititrasi.
Kebanyakan titrasi berhasil dengan baik dengan 0,25 milimol ion logam yang bersangkutan dalam volume 50-150 cm3 larutan. Jika konsentrasi ion logam itu terlalu
tinggi; maka titik akhir mungkin akan sangat sulit untuk dibedakan, dan jika kita mengalami kesulitan dengan titik akhir, maka sebaiknya mulailah lagi dengan satu porsi larutan uji yang lebih sedikit, dan encerkan ini sampai 100-150 cm3sebelum
menambahkan medium pembufer dan indikator, lalu diulangi titrasi itu. 3. Banyaknya indicator.
Penambahan indicator yang terlalu banyak merupakan kesalahan yang harus kita hindarkan. Dalam banyak kasus, warna yang ditimbulakan oleh indicator sanagt sekali bertambah kuat selama jalannya titrasi, dan labih jauh, banayak indicator memperlihatkan dikroisme, yaitu terjadi suatu perubahan warna peralihan pada satu dua tetes sebelum tiik akhir yang sebenarnya.
Dalam banyak titrasi EDTA, perubahan warna disekitar titik akhir, mungkin lambat. Dalam banyak hal-hal demikian, sebaiknya titran ditambahkan dengan hati-hati sambil larutan terus menerus diaduk; dianjurkan untuk memakai pengaduk magnetic. Sering, titik akhir yang lebih tajam dapat dicapai jika larutan diapnaskan samapi sekitar kira-kira 40OC. Titrasi dengan CDTA selalu lebih lambat dalam daerah titik akhir divbanding
dengan titrasi EDTA padanan. 5. Deteksi perubahan warna.
Dengan semua indicator ion logam yang digunakan pada titrasi kompleksometri, deteksi titik akhir dan titrasi bergantung pada pengenalan suatu perubahan warna yang tertentu; bagi banyak pengamat, ini dapat merupakan tugas yang sulit, dsan bagi yang menderita buta warna, bolehlah dikata mustahil. Kesulitan-kesulitan ini dapat diatasi dengan menggantikan mata dengan suatu fotosel yang jauh lebih peka, dan meniadakan unsurt manusiawi. Untuk melakukan operasi yang dituntut, perlu tersedia sebuah kolorimeter atau spektrofotometer dalam mana kompartemen kuvetnya adaalh cukup besar untuk memuat bejana titrasi (labu Erlenmeyer atau piala berbentuk tinggi) Spektrofotometer Unicam SP 500 merupakan contoh dari instrumen yang sesuai untuk tujuan ini, dan sejumlah fototitrator tersedia secara komersial.
6. Metode lain untuk mendeteksi titik akhir.
Disamping deteksi secara visual dan secara spektrofotometri dari titik akhir dalam titrasi EDTA denagn bantuan indicator ion logam, metode berikut ini juga tersedia untuk deteksi titik akhir.
H. Aplikasi Titrasi Konduktometri 1. Jurnal Internasional
Pembuatan dan Karakterisasi Biosensor Konduktometri untuk Penentuan Konsentrasi Diazinon
Pendahuluan
Diazinon merupakan senyawa organofosfat yang digunakan sebagai pestisida. Penggunaan yang berlebih andaridiazinon dapat meninggalkan residu yang membahayakan kesehatan manusia. Hal ini dapat menghambat aktivitas ester aseasetilkolin pada sistem saraf, yang mengarah kegejala serius dan kematian. Metode umum untuk menentukan konsentrasi diazinon dan organofosfat lainnya adalah kromatografi gas (GC) dan cair kinerja tinggi kromatografi (HPLC). Namun, metode ini membutuhkan biaya operasi yang tinggi dan optimasi yang rumit. Sebuah metode biosensing menggunakan biosensor yang mengatasi kerugian dari GC dan HPLC. Biosensor memiliki banyak keuntungan antara lain sangat selektif dan sensitif, mudah digunakan, cepat, dan portabel. Sebuah biosensor adalah
yang terhubung ketransduser. Biosensor elektrokimia adalah optik, piezoelektrik, atau termal. Biosensor yang paling umum digunakan untuk menentukan konsentrasi senyawa organofosfat adalah biosensor elektrokimia. Biosensor elektrokimia adalah potensiometri, amperometrik, konduktometrik. Dalam penelitian ini, menggunakan biosensor konduktometrik karena memiliki elektroda kecil, memiliki sensitivitas yang baik, tidak memerlukan alternating current(AC), referensi elektroda, dan memiliki potensi untuk diproduksi dalam skala besar karena biaya rendah.
Konsentrasi diazinon yang ditetapkan berdasarkan pengukuran konduktansi ketika diazinon menghidrolisis menjadi O, O dietil phosphorothioil, 2-isopropil-6-methylpyrimidin-4-ol, dan H +dikatalisasi oleh organofosfat hidrolase (OPH). OPH yang bergerak di
permukaan elektroda sehingga dapat digunakan berkali-kali. Dalam penelitian ini, metode imobilisasi OPH adalah adsorpsi. Metode ini sederhana dan tidak secara signifikan mengubah aktivitas OPH.
Media imobilisasi untuk metode ini adalah screenprinted sebuah elektroda karbon (SPCE) dimodifikasi dengan bovine albumin serum (BSA) dan glutaraldehid (GA). OPH yang bergerak di kutub negatif dari SPCEs karena molekul target pengukuran H +(karena H + memberikan konduktivitas tertinggi dibandingkan ion lain).
Suhu, pH, dan jumlahenzimmempengaruhiaktivitas enzim. Oleh karena itu, merekajugamempengaruhiKinerjabiosensor. Suhu optimum mencapai50-55°C dan pHuntuk OPH adalah 9. Dalam penelitian ini, suhu dibuat konstan pada suhu kamar untuk menghindari penguapan selama percobaan dan memudahkan operasi. Tujuan utama dari ini penelitian adalah untuk mempelajari pengaruh Ph dan jumlah enzim pada kinerjabiosensorsertamenganalisisbiosensorpada kondisioptimum. Jumlahenzimpada tahapbiosensormembangunsedangkanpHdipelajariselamakarakterisasibiosensor. Tujuan keduadaripenelitian ini adalah untukmelihat apakahperangkatinidapat diterapkandalam sampel sayuran.
Hasil dan Pembahasan
Faktoryangmempengaruhi kinerjabiosensordapat dipelajari ditahap manufakturbiosensor. Salah satu faktoradalahjumlahOPH yang ditambahkan kepermukaanmembran BSA-glutaraldehyde. Efekdari jumlahOPHterhadap
Sensitivitas menunjukkan perubahansinyalperunit perubahan dalamjumlahanalit. Sebuahbiosensordengansensitivitas yang lebih tinggidapat membedakansinyalantara duasampel yang berbedabaik daribiosensordengan sensitivitasyang lebih rendah. Perhitungan sensitivitas diringkas dalam Tabel 1.
Tabel 1. PengaruhBesaranEnzimpadabiosensorSensitivitas
Kode Biosensor Jumlah OPH (μg) Sensitivitas (μS/ppm) SD Sensitivitas (μS/ppm)
A 0.0 1.23 1.74 B 39.5 13.71 5.70 C 79.0 19.04 3.05 D 118.5 22.89 1.86 E 158.0 14.72 2.64 F 197.5 20.16 2.44
BiosensorA(tanpa enzim) memilikiterendahsensitivitas, yang menunjukkan bahwakonduktansi adalahrelatif konstanmeskipun adakenaikankonsentrasidiazinon. Fenomena inimembuktikan bahwaOPHmemainkan peran pentingdalambiosensorenzim. PeningkatansensitivitasdaribiosensorBkeDadalahdikaitkan denganpeningkatanjumlahOPH. Peningkatanjumlah enzimoleh duakali(dariBke C) harus diikutidengan peningkatansensitivitas dengan kedua waktu.
Peningkatan jumlah Enzim meningkatkan tingkat hidrolisis diazinon. Dalam hal ini, pengukuran konduktansi dilakukan dalam rentang waktu yang sama. Dengan demikian, pada diazinon yang konsentrasinya sama, sinyal yang dihasilkan akan lebih besar seiring bertambahnya jumlah enzim. Akibatnya, sensitivitas akan meningkat dua kali. Namun, hasil menunjukkan bahwa peningkatan jumlah enzim tidak konsisten dengan peningkatan sensitivitas. Penyebab masalah ini adalah mungkin ukuran pori yang homogen dari BSA-glutaraldehyde (Gbr. 1A). Meskipun hampir semua permukaan BSA-glutaraldehid ditutupi oleh OPH (Gbr. 1B), itu tidak menjamin bahwa semua molekul OPH ditambahkan pada permukaan yang bergerak. Fenomena ini akan melemahkan sinyal yang dihasilkan, yang mengarah ke penurunan kinerja.
PeningkatanjumlahOPHharus meningkatkansensitivitas(meskipun kenaikantidak konsisten). Namun, hasil biosensorElebih rendah daribiosensorDmeskipunbiosensorEmemiliki lebih banyak enzim. Fenomena ini
menunjukkan bahwajumlah enzim yang
berlebihandapatmenghambatdifusihidrolisisdiazinonprodukketransduser. Sinyalyang dihasilkanmelemah, sehingga mengarah kepenurunan kinerja. Biosensordengan kinerjaterbaik adalahbiosensorD, dengan sensitivitas22,89mikrodetik/ppm. Oleh karena itu,jumlah optimalOPHadalah118.5mg. Jumlah inidigunakansebagai variabel dependenuntuk mengkarakterisasibiosensor.
Gambar 1. Scanning Electron Microscope Gambar dari BSA-glutaraldehydePermukaantanpa OPH (A) dandengan OPH (B)
Tabel 2
.
PengaruhpHpadaSensitivitasdariBiosensorKonduktometrikpH
Sensitivitas (μS/ppm) S
DSensitivitas (μS/ppm)
7.5
17.22
4.08
8.0
18.55
3.98
8.5
29.35
2.02
9.0
31.83
6.42
9.5
26.49
4.27
Perubahan dalam muatan distribusi karena ada banyak residu asam amino dengan pKayang berbeda. Perubahandistribusi dapatmempengaruhi strukturgeometrisenzim, terutamastruktursitus aktif. Perubahan situs aktifmempengaruhi aktivitasOPH dan kinerjabiosensor. PHoptimumuntuk analisisadalah 8.5bukan9.0 yang memilikisensitivitas29,35mikrodetik/ppmdengan standar deviasi2,02mikrodetik/ppm. PHoptimumbergeser dari9,0menjadi 8,5menunjukkanbahwaimobilisasidapat mempengaruhiperubahan struktural dalamOPH. Oleh karena itu, pH8,5digunakanuntuk menganalisiskonsentrasiorganofosfatdalam sayuran.
Biosensorharusditandaipada kondisioptimumsebelumditerapkan dalamsampelsayuran. Salah satutujuannya adalah untukmembangunkurva kalibrasidalam
menentukankonsentrasidiazinondalam sayuran.
EnzimBiosensorditandaimenggunakanbiosensordengan118.5pgOPHpada
pH8,5kinerjaparameter(pada kondisi optimum) adalahwaktu respon, linierdinamis,sensitivitas, danbatas deteksi. Waktu responadalah30s. Oleh karena itu,pengukuranharus dilakukansetidaknya 30ssebelumsinyaldicatat. Linierdinamis , sensitivitas, danbatas deteksiditentukanoleh sinyalyangmenunjukkansetidaknya 30s. Sensitivitasbiosensoradalah42,21mikrodetik/ppm, sehingga dapatmembedakan0,1ppmperbedaan sekitar 4mikrodetikperubahankonduktansi. Standar penelitian yang digunakan sebesar 99,87% yaitu 3 kali standar deviasi.
Oleh karena itu, batasdeteksibiosensorini0.19ppm. Konsentrasidiazinondalamsayuranditunjukkan pada Tabel3. Sayurdenganresidupaling besar adalahbayam. Namun, hasil inidiperoleh darisolusidigunakan untukmerendamsayuran, bukandaridaunnya.
Jumlahresidu(dari daun) yang datang ketubuh manusiaharus kurang darijumlah yang ditampilkandiTabel3. Oleh karena itu,sangatpentinguntuk mencucisayuransebelum makan ataumemasak mereka. Jumlahresidudi kubisberada di bawah batasdeteksi. Oleh karena itu,jumlahresidu dalamkubistidak diketahui.
Tabel 3 KonsentrasiDiazinonResidudiSayuransampel Sampel KonsentrasiDiazinonResidu Sawi 0.9 Bayam 1.5 Kubis < LOD Kangkung 0.5
Selada 0.5
Kesimpulan
Pembangunan biosensor yang dipengaruhi oleh jumlah OPH ditambahkan pada SPCE-BSA-glutaraldehyde, sementara biosensor dipengaruhi oleh pH buffer. Jumlah optimum dari masing-masing enzim dan pH optimum adalah 118.5 mg dan 8,5. Biosensor Konduktometrikmemiliki waktu respon dari 30 detik, Kisaranlinierdinamis 0 sampai 1 ppm, sensitivitas
42,21 mikrodetik / ppm, dan batas deteksi 0,19 ppm. Biosensor dapat mendeteksi residu diazinon dalam semua sayuran kecuali kubis.
2. Jurnal Indonesia
Pengaruh Massa Organofosfat Hidrolase dan Luas Elektroda terhadap Kinerja Biosensor Konduktometri untuk Mendeteksi Residu Pestisida Klorpirifos dan Profenofos Berbasis
SPCE Kitosan
Pendahuluan
Dalam mengendalikan serangga atau hama pada hasil pertanian khususnya sayuran dan buah-buahan digunakan pestisida klorpirifos dan profenofos. Namun ternyata penggunaan pestisida tersebut dapat meninggalkan residu yang dapat membahayakan kesehatan. Standart Nasional Indonesia (SNI) menetapkan batas maksimum residu (BMR) pestisida pada hasil pertanian, yaitu 0,05 mg/kg – 0,5 mg/kg untuk residu profenofos, dan 0,05 mg/kg – 0,1 mg/kg untuk residu klorpirifos.
Kromatografi gas (GC) dan kromatografi cair tekanan tinggi (KCKT mampu mendeteksi kadar pestisida, namun dengan batas deteksi yang masih lebih besar dari BMR yang diijinkan [3,4,5]. Dengan demikian diperlukan metoda yang lebih sensitif. Biosensor diharapkan dapat mendeteksi kadar residu pestisida secara lebih sensitif karena kerja biosensor lebih selektif. Biosensor untuk mendeteksi pestisida telah dikembangkan secara konduktometri dan amperometri.
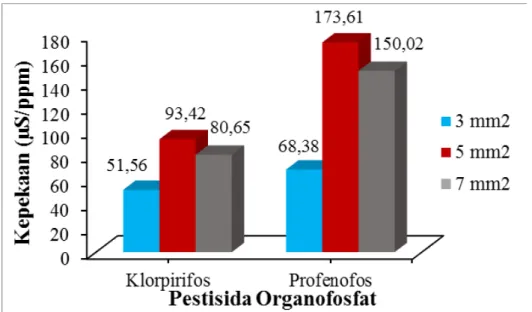
Daya hantar yang terbaca berbanding lurus dengan luas elektroda dan masa enzim yang digunakan. Jadi pada penelitian ini, menggunakan variasi pada massa enzim dan luas
dilapisi dengan OPH dengan bantuan membran kitosan dan larutan glutaraldehid. Jarak antar elektroda diatur sedemikian rupa hingga nilainya konstan.
Prosedur
a. Amobilisasi Organofosfat Hidrolase
Screen Printed Carbon Electrode dibuat dengan luas permukaan (1 x 3) mm2; (1 x 5)mm2; dan (1 x 7) mm2. Kemudian, sebanyak 10 μL larutan kitosan dilapiskan pada masing-masing elektroda dan dikeringkan selama kurang lebih 30 menit pada temperature kira-kira 50°C. Setelah kering, elektroda dilapisi dengan enzim organofosfat hidrolase dengan konsentrasi 5666 μg/mL sebanyak 25 μL (142 μg) dan glutaraldehid 0,5% sebanyak 10 μL, lalu dikeringkan dalam refrigerator selama 24 jam. Dilakukan tahapan yang sama untuk enzim organofosfat hidrolase dengan konsentrasi 7089 μg/mL (177 μg).
b. Pengukuran dan Optimasi Biosensor Konduktometri Organofosfat
Elektroda karbon yang tidak dilapisi dengan kitosan, enzim Organofosfat hidrolase, dan glutaraldehid 0,5% dihubungan pada kutub positif biosensor konduktometer. Selanjutnya elektroda kerja enzim OPH 142 μg dengan luas permukaan (1 x 3) mm2 dihubungkan padakutub negatif biosensor konduktometer. Jarak antar elektroda diatur kurang lebih 0,1 cm. Kemudian elektroda dicelupkan ke dalam masing-masing konsentrasi larutan uji profenofos dan klorpirifos secara bergantian. Diukur daya hantar masing-masing larutan uji organofosfat menggunakan biosensor konduktometer. Pengukuran ini dicatat setiap 10 detik (selama 1 siklus). Pengukuran diulang masing-masing 5 kali dengan elektroda baru. Lalu dibuat kurva hubungan daya hantar terhadap konsentrasi organofosfat. Dilakukan prosedur yang sama untuk luas permukaan elektroda lainnya dan enzim dengan massa 177 μg.
Hasil dan Pembahasan
a. Pengaruh Massa Organofosfat hidrolase terhadap Kinerja Biosensor Konduktometri
Dari data hasil penelitian diperoleh kurva hubungan antara massa OPH dengan kepekaan biosensor. Pada Gambar 4.1 kepekaan yang lebih besar dihasilkan oleh OPH
dengan massa 177 μg yaitu sebesar 1,18 μS/ppm (klorpirifos) dan 1,29 μS/ppm (profenofos). Kepekaan sebanding dengan massa OPH yang diamobilkan pada elektroda.
Ga mbar 4.1 Hubungan massa enzim organofosfat hidrolase terhadap kepekaan biosensor
OPH yang digunakan dalam penelitian ini adalah hasil isolasi dari bakteri Pseudomonas putida yang difraksinasi menggunakan ammonium sulfat. Enzim OPH dengan massa 142 μg merupakan enzim hasil fraksinasi 0 – 45%, sedangkan massa 177 μg merupakan enzim hasil fraksinasi 45 – 65%.
Berdasarkan hasil penelitian, massa OPH 177 μg yang memiliki kepekaan 11 kali lebih besar dibanding kepekaan yang ditunjukkan oleh massa OPH 142 μg. Massa OPH 177 μg digunakan untuk penentuan pengaruh luas permukaan elektroda terhadap kinerja biosensor.
Gambar 4.3. Hubungan luas elektroda dengan kepekaan biosensor menggunakan
massa OPH 177 μg
Penurunan kepekaan biosensor dengan luas elektroda 7 mm2 disebabkan ketidak
merataan enzim pada permukaan elektroda. Dibandingkan dengan luas permukaan 3 dan 5 mm2, konsentrasi ion H+ lebih sedikit berdifusi ke permukaan biosensor dengan luas
elekroda7 mm2. Hal ini dikarenakan, banyaknya massa enzim teramobilkan pada
biosensor denganluas elektroda 7 mm2 tidak mencukupi untuk mengubah substrat menjadi produk. Dengandemikian, pengaruh luas permukaan terhadap kinerja biosensor mengacu pada kepekaan yang ditunjukkan oleh biosensor dengan luas permukaan 5 mm2 yang merupakan luas permukaanoptimum untuk menentukan batas deteksi biosensor pada penelitian ini.
c. Karakterisasi Biosensor Konduktometri Organofosfat
Karakterisasi yang dilakukan pada biosensor konduktometri organofosfat pada penelitian ini berguna untuk menetukan kondisi optimal dari biosensor tersebut untuk menunjukkan kinerja yang baik. Data daya hantar yang ditunjukkan dalam tebel 4.1, digunakan untuk menetukan batas deteksi dari biosensor konduktometri.
Batas deteksi merupakan salah satu parameter karakterisasi untuk menunjukkan kinerja dari biosensor. Batas deteksi pada suatu metode analisis residu pestisida merupakan batas nilai terkecil dari residu pestisida dalam larutan uji yang dapat diukur dengan metode analisa yang digunakan. Batas deteksi yang didapat dari pengolahan data daya hantar dapat ditunjukkan oleh Tabel 4.1.
Tabel 4.1. Batas deteksi biosensor konduktometri organofosfat
Parameter Boisensor organofosfat
klorpirifos profenofos
Kisaran Konsentrasi 0-0,1 ppm 0-0,1 ppm
Kepekaan 93 μS/ppm 174 μS/ppm
Batas Deteksi 0,05 ppm 0,04 ppm
Berdasarkan Tabel 4.1 dapat diketahui bahwa biosensor konduktometri organofosfat pada penelitian ini memiliki batas deteksi di bawah ambang batas maksimum residu yang ditetapkan oleh Departemen Pertanian yaitu sebesar 0,1 ppm untuk residu klorpirifos dan 0,5 ppm untuk residu profenofos. Hal ini menunjukkan bahwa penelitian yang telah dilakukan menghasilkan kinerja biosensor konduktometri organofosfat yang optimum dengan amobilisasi enzim organofosfat hidrolase dengan massa 177 μg menggunakan elektroda SPC dengan luas permukaan 5 mm2. Berdasarkan
hasil optimalisasi tersebut, didapatkan biosensor konduktometri organofosfat dengan batas deteksi yaitu 0,04 ppm untuk profenofos dan 0,05 ppm untuk klorpirifos, dengan kepekaan dari masing-masing yaitu 93 μS/ppm dan 174 μS/ppm.
Kesimpulan
Berdasarkan penelitian yang telah dilakukan, massa enzim OPH dan luas elektroda berpengaruh terhadap kinerja biosensor konduktometri. Hasil penelitian menunjukkan kinerja biosensor optimum dihasilkan oleh massa enzim sebanyak 177 μg dengan luas biosensor sebesar 5 mm2. Biosensor konduktometri dapat digunakan untuk
mendeteksi organofosfat klorpirifos dan profenofos pada kisaran konsentrasi 0 – 0,1 ppm dengan kepekaan untuk masing-masing organofosfat berturut-turut 93 μS/ppm dan 174 μS/ppm. Batas deteksi yang didapatkan untuk klorpirifos yaitu 0,05 ppm dan untuk profenofos yaitu 0,04 ppm.
BAB III PENUTUP A. Kesimpulan
Dari pembahasan tersebut maka dapat disimpulkan beberapa hal sebagai berikut :
1. Daya hantar listrik dalam titrasi konduktometri sangat berhubungan dengan konsentrasi dan gerakan bebas dari ion.
2. Titik ekivalen dari titrasi konduktometri ditandai dengan konstanta nilai daya hantar yang tertera dalam konduktometer.
3. Titrasi konduktometri hanya dapat digunakan untuk larutan elektrolit.
4. Pengukuran daya hantar dalam titrasi konduktometri memerlukan 3 komponen penting yaitu: sumber listrik, sel untuk menyimpan larutan dan jembatan (rangkaian elektronik) untuk mengukur tahanan larutan.
5. Titrasi konduktometri terbagi 2 yaitu:
a. Titrasi konduktometri dengan frekuensi rendah : b. Titrasi konduktometri frekuensi tinggi
6. Ada beberapa hal yang perlu diperhatikan ketika melakukuan titrasi yaitu: a. Penyesuaian pH.
b. Pemekatan ion logam yang akan dititrasi. c. Banyaknya indicator.
d. Deteksi perubahan warna. e. Pencapaian titik-akhir.
f. Metode lain untuk mendeteksi titik akhir.
7. Salah satu aplikasi dari titrasi konduktometri yaitu analisis tablet aspirin
B .Saran
Dengan adanya makalah ini, kami berharap agar dapat memahami metode-metode yang dilakukan dalam titrasi konduktometri. Karena dalam melakukan suatu titrasi kita harus
memperhatikan beberapa hal penting yang menjadi acuan dalam melakukan suatu prosedur titrasi.
DAFTAR PUSTAKA
Bassett dkk. 2009. Buku Ajar Vogel Kimia Analisis Kuantitas Anorganik.Jakarta:Penerbit Buku Kedokteran
Hendayana, Sumar, dkk. 1994. Kimia Analitik Instrumen. Semarang : IKIP Semarang Press.
http://www.Apa itu titrasi_Kimia analisa.htm. Diakses pada 12 Oktober 2014.
http://www.Beberapa Pertimbangan Praktis _ Chem-Is-Try.Org _ Situs Kimia Indonesia _htm. Diakses pada 12 Oktober 2014.
http://www.Dasar Analisis Tablet Aspirin dengan Metode Titrasi Konduktometri _ BLoG kiTa.htm. Diakses pada 12 Oktober 2014
http://www.dodychemist.blogspot.com. metode titrasi konduktometri. Diakses pada 12 Oktober 2014
http://www.yayachemistry.blogspot.com. penerapam titrasi konduktometri. Diakses pada 12 Oktober 2014
Khopkar. 2007. Konsep Dasar Kimia Analitik. Jakarta: UI-Perss
Rivai, H. 1995. Asas Pemeriksaan Kimia. Jakarta : Penerbit Universitas Indonesia Soebagio dkk. 2005. Kimia Analitik II. Malang : Penerbit Universitas Negeri Malang Wardhana,Wisnu Arya. 2007. Teknologi Nuklir.Yogyakarta:Andi Press