PENETAPAN KADAR HASIL UJI DISOLUSI KAPSUL
KLORAMFENIKOL MENGGUNAKAN METODE
SPEKTROFOTOMETRI ULTRA VIOLET
TUGAS AKHIR
Oleh:
ARIF DIPA PATAR SIHITE
NIM 142410019
PROGRAM STUDI DIPLOMA III
ANALIS FARMASI DAN MAKANAN
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
ii
PENGESAHAN TUGAS AKHIR
PENETAPAN KADAR HASIL UJI DISOLUSI KAPSUL
KLORAMFENIKOL MENGGUNAKAN METODE
SPEKTOFOTOMETRI ULTRAVIOLET
Diajukan untuk memenuhi salah satu syarat memperoleh Gelar Ahli Madya pada Program Studi Diploma III Analis Farmasi dan Makanan
Fakultas FarmasiUniversitas Sumatera Utara
Oleh:
ARIF DIPA PATAR SIHITE NIM 142410019
Medan, 25 Oktober 2017 Disetujui Oleh:
Pembimbing,
Yade Metri Permata, S.Farm., M.Si., Apt. NIDT 198704282017042001
Disahkan Oleh: Dekan,
Prof. Dr. Masfria. M.S.. Apt NIP 195707231986012001
iii
KATA PENGANTAR
Puji syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas segala berkat dan karunia-Nya, sehingga penulis dapat menyusun dan menyelesaikan Tugas Akhir berjudul Penetapan Kadar Hasil Uji Disolusi Kapsul Kloramfenikol Menggunakan Metode Spektrofotometri Ultra Violet. Tugas Akhir ini disusun sebagai salah satu syarat untuk dapat menyelesaikan pendidikan Program Studi Diploma III Analis Farmasi dan Makanan di Fakultas Farmasi Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar-besarnya kepada Ibu Prof. Dr. Masfria, M.S., Apt., sebagai Dekan Fakultas Farmasi Universitas Sumatera Utara Medan. Ucapan terima kasih juga disampaikan kepada Ibu Yade Metri Permata, S.Farm., M.Si., Apt., sebagai Dosen Pembimbing Tugas Akhir yang telah memberikan bimbingan dan pengarahan kepada penulis hingga Tugas Akhir ini selesai.
Dengan segala ketulusan hati penulis juga menyampaikan penghargaan yang sebesar-besarnya kepada kedua orang tua penulis yaitu ayahanda tercinta Drs. Thomson Sihite, dan ibunda Yenny Tobing, S.Pd., serta abang-abangku tercinta yang telah mencurahkan perhatian serta memberikan dukungan baik moril maupun materil dan segenap doa kepada penulis sehingga penulis dapat menyelesaikan tugas akhir ini.
Penulis menyadari sepenuhnya bahwa tanpa bantuan dari berbagai pihak, penulis tidak akan dapat menyelesaikan Tugas Akhir ini sebagaimana mestinya. Penulis mengucapkan terima kasih kepada Bapak Popi Patilaya, S.Si.,M.Sc., Apt., sebagai Ketua Program Studi Diploma III Analis Farmasi dan Makanan Fakultas
iv
Farmasi Universitas Sumatera Utara Medan.Bapak Drs. Zulfadli, Apt., sebagai pembimbing laporan yang telah membimbing dan memberikan saran serta petunjuk selama pelaksanaan Praktek Kerja Lapangan (PKL) di PT. Kimia Farma (Persero) Tbk. Plant Medan.Bapak dan Ibu dosen staf pengajar Fakultas Farmasi Universitas Sumatera Utara Medan atas semua ilmu, didikan dan bimbingan kepada penulis selama di Perguruan Tinggi ini. Teman–teman PKL yang saling mendukung dan saling membantu selama PKL hingga selesainya Tugas Akhir ini.Buat Gieni Elnita Lumbantobing, terima kasih buat segala dukungan dan motivasinya serta masukan dalam penyusunan Tugas Akhir ini serta pihak-pihak yang telah ikut membantu penulis namun tidak tercantum namanya.
Penulis menyadari sepenuhnya bahwa Tugas Akhir ini masih terdapat kekurangan, serta dalam penulisan maupun penyajian dalam tulisan ini masih jauh dari kesempurnaan, oleh karena itu dengan segala kerendahan hati penulis menerima serta mengharapkan saran dan kritik yang sifatnya membangun demi kesempurnaan Tugas Akhir ini.
Akhir kata, penulis sangat berharap semoga Tugas Akhir ini dapat memberikan manfaat kepada semua pihak yang memerlukan. Amin
Medan, 25 Oktober 2017 Penulis,
Arif Dipa Patar Sihite NIM. 142410019
v
SURAT PERNYATAAN ORISINALITAS
Saya yang bertanda tangan di bawah ini:
Nama :Arif Dipa Patar Sihite Nomor Induk Mahasiswa : 142410019
Program Studi : D III Analis Farmasi dan Makanan
Judul Tugas Akhir : Penetapan Kadar Hasil Uji Disolusi Kapsul KloramfenikolMenggunakanMetode
Spektrofotometri Ultraviolet
dengan ini menyatakan bahwa tugas akhir ini ditulis berdasarkan data dari hasil pekerjaan yang saya lakukan sendiri, dan belum pernah diajukan oleh orang lain untuk memperoleh gelar ahli madya di perguruan tinggi lain, dan bukan plagiat karena kutipan yang ditulis telah menyebutkan atau mencantumkan sumbernya di dalam daftar pustaka.
Apabila dikemudian hari ada pengaduan dari pihak lain karena di dalam tugas akhir ini ditemukan plagiat karena kesalahan saya sendiri, maka saya bersedia menerima sanksi apapun oleh Program Studi Diploma III Analis Farmasi dan Makanan Fakultas Farmasi Universitas Sumatera Utara, dan bukan menjadi tanggung jawab pembimbing.
Demikian surat pernyataan ini saya buat dengan sebenarnya untuk dapat digunakan jika diperlukan sebagaimana mestinya.
Medan, 25 Oktober 2017 Yang Menyatakan,
Arif Dipa Patar Sihite NIM 142410019
Materai Rp 6.000
vi DAFTAR ISI
Halaman
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
SURAT PERNYATAAN ORISINALITAS ... v
DAFTAR ISI ... vi
DAFTAR GAMBAR ... viii
DAFTAR TABEL ... ix
DAFTAR LAMPIRAN ... x
ABSTRAK ... xi
BAB I PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan dan Manfaat ... 2
BAB II TINJAUAN PUSTAKA 2.1 Obat ... 3
2.2 Kapsul ... 4
2.3 Formulasi Kapsul ... 4
2.3.1 Kapsul gelatin keras ... 4
2.3.2 Kapsul gelatin lunak ... 6
2.4 Syarat-syarat Kapsul ... 7
2.5 Antibiotik ... 8
2.6 Kloramfenikol ... 10
2.7 Uji Disolusi ... 11
vii
2.8.1 Definisi spektrofotometri UV ... 13
2.8.2 Instrumen ... 14
BAB III METODOLOGI PERCOBAAN 3.1Tempat dan waktu percobaan ... 15
3.2 Alat-alat ... 15
3.3 Bahan-bahan ... 15
3.4 Prosedur Percobaan ... 15
3.4.1 Media disolusi ... 15
3.4.2 Larutan baku ... 16
3.4.3 Uji disolusi sampel uji ... 16
3.4.4 Penetapan kadar secara spektrofotometri UV... 16
3.4.5 Perhitungan ... 17
BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil ... 18
4.2 Pembahasan ... 18
BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 19
5.2 Saran ... 19
viii
DAFTAR GAMBAR
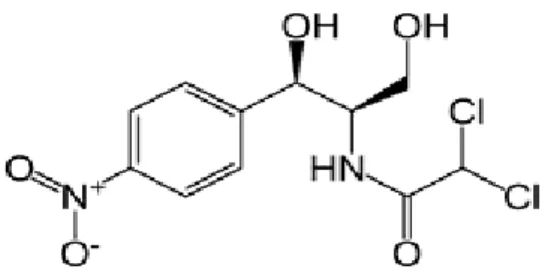
Gambar Halaman 2.1. Struktur Bangun Kloramfenikol ... 10
ix
DAFTAR TABEL
Tabel Halaman 2.1. Perbedaan dalam Persen Bobot Isi Kapsul ... 7 4.1. Hasil Uji Disolusi ... 18
x
DAFTAR LAMPIRAN
Lampiran Halaman
1. Hasil Uji Disolusi ... 21
2. Perhitungan Uji Disolusi Kapsul Kloramfenikol ... 22
3. Absorbansi Larutan Baku ... 23
xi
PENETAPAN KADAR HASIL UJI DISOLUSI KAPSUL KLORAMFENIKOL MENGGUNAKAN METODE
SPEKTROFOTOMETRI ULTRA VIOLET
ABSTRAK
Latar Belakang:Pemeriksaan kadar zat aktif merupakan persyaratan yang harus dipenuhi untuk menjamin kualitas obat. Begitu juga pada obat kloramfenikol. Kloramfenikol merupakan suatu antibiotik broad spectrum. Pemeriksaan kadar zat aktif dilakukan dengan analisis spektrofotometri karena cukup teliti dan sangat cocok digunakan pada kadar yang rendah.
Tujuan: Tujuan penelitian ini adalah untuk mengetahui apakah kapsul kloramfenikol yang diproduksi oleh PT. Kimia Farma (Persero) Tbk. Plant Medan memenuhi persyaratan kadar hasil uji disolusi kapsul kloramfenikol menggunakan metode spektrofotometri ultraviolet sesuai dengan yang ditetapkan oleh Farmakope Indonesia Edisi V.
Metode:Uji disolusi dilakukan terhadap 6 kapsul Kloramfenikol 250 mg dengan metode keranjang pada media 900 ml HCl 0,1 N, suhu 37±0,50C dengan laju kecepatan 100 rpm selama 30 menit. Zat yang larut, ditetapkan kadarnya dengan metode Spektrofotometri Ultraviolet pada panjang gelombang 278 nm.
Hasil:Hasil uji disolusi terhadap 6 buah kapsul kloramfenikol 250 mg diperoleh kadar zat terlarut yaitu : 100,37%, 100,05%, 100,73%, 111,01%, 97,05%, dan 96,93%, dengan kadar rata-rata 101,027%.
Kesimpulan:Kadar kloramfenikol yang diperoleh sesuai dengan batas yang ditetapkan dalam Farmakope Indonesia Edisi V, dimana kadar tidak kurang dari 90% dan tidak lebih dari 120% dari jumlah yang tertera pada etiket.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Obat adalah zat aktif berasal dari nabati, hewani, kimiawi alam maupun sintetis dalam dosis atau kadar tertentu dapat dipergunakan untuk preventif (profilaksis), rehabilitasi, terapi, diagnosis terhadap suatu keadaan penyakit pada manusia maupun hewan. Oleh karena itu muncul sediaan pil, tablet, kapsul, sirup, suspensi, supositoria, salap dan lain-lain (Admar, 2004).
Kapsul adalah bentuk sediaan obat terbungkus cangkang kapsul keras atau lunak. Cangkang kapsul dibuat dari gelatin dengan atau tanpa zat tambahan lain. Cangkang dapat pula dibuat dari metilselulosa atau bahan lain yang cocok (Anief, 1994).
Menurut Farmakope Indonesia edisi IV uji disolusi digunakan untuk menentukan kesesuaian dengan persyaratan disolusi yang tertera dalam masing– masing monografi untuk sediaan tablet dan kapsul, kecuali pada etiket dinyatakan bahwa tablet harus dikunyah. Persyaratan disolusi tidak berlaku untuk kapsul gelatin lunak kecuali bisa dinyatakan dalam masing masing monografi (Ditjen POM,1995).
Analisis Spektrofotometri cukup teliti, cepat dan sangat cocok untuk digunakan pada kadar yang sangat rendah. Senyawa yang dianalisis harus mempunyai gugus kromofor, misalnya gugus fenil atau unit aromatik lain. Spektrum serapan masing–masing senyawa diukur dari lebih kurang 350-400 nm
2
turun sampai 240 nm, pada panjang gelombang dibawahnya oktanol mulai mempunyai serapan (Sardjoko, 1993).
Pada pembuatan obat, pemeriksaan kadar zat aktif merupakan persyaratan yang harus dipenuhi untuk menjamin kualitas sediaan obat. Sediaan obat yang berkualitas baik akan menunjang tercapainya efek terapetik yang diharapkan. Prosedur pengujian dan penetapan kadar pengujian diberikan untuk menetapkan kesesuaian dengan persyaratan kadar, mutu dan kemurnian yang tertera pada Farmakope (Ditjen POM, 1995).
Kapsul kloramfenikol mengandung kloramfenikol, C11H12Cl2N2O5, tidak
kurang dari 90% dan tidak lebih dari 120% dari jumlah yang tertera pada etiket. Penelitian ini dilakukan dengan mengukur serapan filtrat larutan uji, jika perlu encerkan dengan media disolusi dan serapan larutan baku kloramfenikol BPFI dalam media yang sama pada panjang gelombang serapan maksimum lebih kurang 278 nm (Ditjen POM, 1995).
1.2 Tujuan dan Manfaat
Adapun tujuan penulis melakukan penelitian ini adalah untuk menentukan kadar kapsul kloramfenikol menggunakan metode spektrofotometri ultraviolet.
Manfaat yang diperoleh dari uji disolusi dan penetapan kadar pada kapsul kloramfenikol adalah agar dapat mengetahui zat aktif terlarut dan kadar yang terdapat dalam kapsul kloramfenikol apakah memenuhi syarat Farmakope Indonesia edisi V sehingga obat tersebut bermanfaat, aman untuk dikonsumsi, dan tidak menyebabkan toksik.
3 BAB II
TINJAUAN PUSTAKA
2.1 Obat
Ada beberapa pengertian obat menurut beberapa referensi yaitu:
1. Dalam buku “Obat-Obat Penting khasiat, penggunaan dan, efek-efek sampingnya”, Drs. Tan Hoan Tjay dan Drs. Kirana Rahardja menyebutkan bahwa Obat merupakan semua zat baik kimiawi, hewani, maupun nabati yang dalam dosis layak dapat menyembuhkan, meringankan atau mencegah penyakit berikut gejalanya (Tjay dan Rahardja, 2007).
2. Howard C. Ansel menyebutkan dalam buku “Pengantar Bentuk Sediaan Farmasi” bahwa Obat sering disebut obat modern ialah suatu bahan yang dimaksudkan untuk digunakan dalam menetapkan diagnosis, mencegah, mengurangkan, menghilangkan, menyembuhkan penyakit atau gejala penyakit, luka atau kelainan badaniah dan rokhaniah pada manusia atau hewan, memperelok badan atau bagian badan manusia (Ansel, 1989).
3. Mohammad Anief menyebutkan dalam buku “Prinsip Umum dan Dasar Farmakologi” Definisi obat ialah suatu zat yang digunakan untuk diagnosis, yang bersifat sebagai obat apabila tepat digunakan dalam pengobatan suatu penyakit dengan dosis dan waktu yang tepat. Jadi bila digunakan salah dalam pengobatan atau dengan keliwat dosis akan menimbulkan keracunan. Bila dosisinya lebih kecil kita tidak memperoleh penyembuhan(Anief, 1995).
4 2.2Kapsul
Kapsul dapat didefinisikan sebagai bentuk sediaan padat, dimana satu
macam bahan obat atau lebih dan/atau bahan inert lainnya yang dimasukkan ke dalam cangkang atau wadah kecil yang umumnya dibuat dari gelatin yang sesuai. Tergantung pada formulasinya kapsul dari gelatin bisa lunak dan bisa juga keras. Kebanyakan kapsul–kapsul yang diedarkan di pasaran adalah kapsul yang semuanya dapat ditelan oleh pasien, untuk keuntungan dalam pengobatan. Begitu pula, kapsul dapat dibuat untuk disisipkan ke dalam rektum sehingga obat dilepaskan dan diabsorpsi di tempat tersebut, atau isi kapsul dapat dipindahkan dari cangkang gelatin dan digunakan sebagai pengukur yang dini dari obat–obat bentuk serbuk (Ansel, 1989).
Menurut Farmokope Indonesia edisi IV kapsul adalah sediaan padat yang terdiri dari obat dalam cangkang keras atau lunak yang dapat larut. Cangkang umumnya terbuat dari gelatin tetapi dapat juga terbuat dari pati atau bahan lain yang sesuai (Ditjen POM, 1995).
2.3Formulasi Kapsul
2.3.1Kapsul gelatin keras
Kapsul gelatin yang keras merupakan jenis yang digunakan oleh ahli farmasi masyarakat dalam menggabungkan obat–obat secara mendadak dan di lingkungan para pembuat sediaan farmasi dalam memproduksi kapsul umumnya. Cangkang kapsul kosong dibuat dari campuran gelatin, gula dan air, jernih tidak berwana dan pada dasarnya tidak mempunyai rasa. Gelatin dihasilkan dari hidrolisis sebagian dari kolagen yang diperoleh dari kulit, jaringan ikat putih dan
5
tulang binatang–binatang. Dalam perdagangan didapat gelatin dalam bentuk serbuk halus, serbuk kasar, parutan, serpihan-serpihan atau lembaran-lembaran (Ansel, 1989).
Gelatin bersifat stabil di udara bila dalam keadaan kering, akan tetapi mudah mengalami peruraian oleh mikroba bila menjadi lembab atau bila disimpan dalam larutan berair. Oleh karena itu kapsul gelatin yang lunak, mengandung lebih banyak uap air daripada kapsul keras, pada pembuatannya ditambahkan bahan pengawet untuk mencegah timbulnya jamur dalam cangkang kapsul. Biasanya kapsul keras gelatin mengandung uap air antara 9-12% (Ansel, 1989).
Persiapan pengisian kapsul gelatin keras dapat dibagi dalam tahapan-tahapan sebagai berikut:
1. Persiapan dan pengembangan formulasi serta pemilihan ukuran kapsul. 2. Pengisian cangkang kapsul
3. Pembersihan dan pemolesan kapsul yang telah terisi (Ansel, 1989).
Umumnya kapsul gelatin keras dipakai untuk menampung isi antara sekitar 65 mg-1 gram bahan serbuk, termasuk bahan obat dan bahan pengencer lain yang diperlukan. Agar kapsul dapat diisi secara penuh biasanya dipakai kapsul dengan ukuran terkecil, biasanya bahan yang dibutuhkan paling sedikit 65 mg. Bila dosis obat atau jumlah obat yang akan dimasukkan tidak memenuhi untuk mengisi volume kapsul, maka diperlukan penambahan bahan pengisi yang cocok dalam jumlah yang tepat pada bahan obat yang akan diberikan dalam satu kapsul cukup besar untuk mengisi penuh kapsul, bahan pengisi tidak dibutuhkan. Laktosa biasanya dipakai sebagai bahan pengisi dalam pengisian kapsul (Ansel, 1989).
6 2.3.2. Kapsul gelatin lunak
Kapsul gelatin lunak dibuat dari gelatin dimana gliserin atau alkohol polivalen dan sorbitol ditambahkan supaya gelatin bersifat elastis seperti plastik. Kapsul-kapsul ini yang mungkin bentuknya membujur seperti elips atau seperti bola yang dapat digunakan untuk diisi cairan, suspensi, bahan berbentuk pasta atau serbuk kering. Biasanya pada pembuatan kapsul ini, mengisi dan menyegelnya dilakukan secara berkesinambungan dengan suatu mesin khusus. Kapsul lunak yang kosong dibuat dan diberi segel dalam keadaan kedap udara (untuk mencegah kempis dan saling melekat satu dengan yang lainnya), untuk pengisian kapsul akan dilakukan kemudian, tapi cara ini jarang terjadi (Ansel, 1989).
Manufaktur kapsul gelatin lunak dan pengisian berlangsung dalam satu operasi berkesinambungan. Jadi, ada 2 formulasi yang harus dikembangkan, yaitu formulasi cangkang gelatin lunak dan formulasi isi/kandungan. Formulasi kandungan kapsul lunak untuk setiap produk dikembangkan secara individual untuk memenuhi spesifikasi dan tujuan penggunaan akhir dari produk. Cangkang kapsul lunak mengandung sejumlah air. Kalau air tertarik oleh isi (formulasi kandungan), maka cangkang akan pecah (getas). Formulasi kandungan dapat mengandung air dalam jumlah terbatas (Agoes, 2008).
7 2.4 Syarat – Syarat Kapsul
1. Keseragaman Bobot
Menurut FI. III, keseragaman bobot dibagi menjadi dua kelompok, yaitu: a. Kapsul berisi obat kering
Timbang 20 kapsul, timbang lagi satu persatu, keluarkan isi semua kapsul, timbang seluruh bagian cangkang kapsul. Hitung bobot isi kapsul dan bobot rata-rata tiap isi kapsul. Perbedaan dalam persen bobot isi tiap kapsul terhadap bobot rata-rata tiap isi kapsul tidak boleh lebih dari dua kapsul yang penyimpangannya lebih besar dari harga yang ditetapkan oleh kolom A dan tidak satu kapsul pun yang penyimpangannya melebihi yang ditetapkan oleh kolom B.
Menurut (Ditjen POM, 1979), perbedaan dalam persen bobot isi kapsul dapat dilihat pada tabel 2.1.
Tabel 2.1. Perbedaan dalam persenbobot isi kapsul
Bobot rata–rata kapsul
Perbedaan bobot isi kapsul dalam %
A B
120 mg atau lebih 10% 20%
Lebih dari 120 mg 7,5% 15%
b. Kapsul berisi obat cair atau pasta
Timbang 10 kapsul, timbang lagi satu persatu. Keluarkan isi semua kapsul, cuci cangkang kapsul dengan eter. Buang cairan cucian, biarkan hingga tidak berbau eter, timbang seluruh bagian cangkang kapsul. Hitung bobot isi kapsul dan bobot rata-rata tiap isi kapsul. Perbedaan dalam persen bobot isi tiap kapsul terhadap bobot rata-rata tiap isi kapsul tidak lebih dari 7,5%(Ditjen POM, 1979). 2. Waktu Hancur
Uji waktu hancur digunakan untuk menguji kapsul keras maupun kapsul lunak. Waktu hancur ditentukan untuk mengetahui waktuyang diperlukan oleh
8
kapsul yang bersangkutan untuk hancur menjadi butiran-butiran bebas yang tidak terikat oleh satu bentuk(Ditjen POM, 1979).
3. Keseragaman Sediaan
Terdiri atas keseragaman bobot untuk kapsul keras dan keseragaman kandungan untuk kapsul lunak(Ditjen POM, 1979).
4. Uji Disolusi
Uji ini digunakan untuk menentukan kesesuaian dengan persyaratan disolusi yang tertera dalam masing-masing monografi. Persyaratan disolusi tidak berlaku untuk kapsul gelatin lunak kecuali bila dinyatakan dalam masing-masing monografi (Ditjen POM, 1979).
2.5Antibiotik
Antibiotik adalah metabolit mikroba yang dalam keadaan sangat encer dapat menghambat pertumbuhan mikroorganisme. Terdapat banyak zat antimikroba, termasuk antideptik yang disintesis secara kimia, tetapi karena secara kimia tidak bertalian dengan produk mikroba, senyawa-senyawa tersebut tidak tepat dinamakan antibiotik. Zat antimikroba yang diproduksi oleh mikroorganisme disebut toksin, lisin, mikoin, dan zat bakteriostatik atau bakteriolitik (Foye, 1996).
Keberhasilan yang berkesinambungan dalam menemukan antibiotik baru sebagian besar disebabkan oleh penyempurnaan metodologinya. Beberapa metode yang lebih penting meliputi: (1)Metode difusi agar dan penentuan biologis lainnya, yang memungkinkan pemeriksaan cuplikan dari fermentasi dan dari sumber lainnya tanpa perlu disterilkan terlebih dahulu, (2) Metode biak bahwa permukaan (Submerged culture) untuk menumbuhkan mikroorganisme aerobik,
9
yang memungkinkan produksi industri dalam skala besar; (3) Kromatografi kertas saring, kromatografi lapis tipis, ionoforesis kertas, dan spektrometri massa untuk mencapai kemurnian dan mengidentifikasi antibiotik; (4) Percobaan yang dibakukan dalam menginfeksikan binatang percobaan, yang memungkinkan pembandingan langsung zat baru dengan zat yang lama yang telah dievaluasi dalam binatang percobaan laboratorium dan pada manusia (Foye, 1996).
Antibiotik dicirikan oleh kerja yang selektif terhadap mikroorganisme. Beberapa terutama mempengaruhi bakteri gram-positif, lainnya menghambat bakteri gram-negatif dan beberapa lainnya menghambat jamur dan ragi atau protozoa tertentu. Antibiotik yang menghambat hanya satu golongan mikroorganisme disebut antibiotik spektrum-sempit. Beberapa antibiotik menghambat bakteri gram positif maupun gram negatif, dan antibiotik yang juga mempengaruhi organisme intrasel seperti misalnya psitakosis, limfogranuloma, atau rickettsiae, dinamakan antibiotik spektrum-luas (Foye, 1996).
Antibiotik yang disebutkan dalam pustaka ilmiah saat ini hanya 0,3% yang digunakan dalam pengobatan ataupun pertanian. Hampir semua produk sintesis mikroba dibuat dengan melakukan pengubahan senyawa kimia pada antibiotik yang diproduksi mikroba sehingga menghasilkan senyawa turunan dengan sifat-sifat tambahan yang berguna. Contoh produk sintesis mikroba yaitu penisilin semisintetik, sefalosporin, tetrasiklin, amikasin, klindamisin, rifampisin dan dihidrostreptomisin. Kloramfenikol dan pironitrin sajalah yang merupakan antibiotik dengan kegunaan kemoterapi yang pada saat sekarang diproduksi secara besar-besaran yang seluruhnya dengan sintesis kimia (Foye, 1996).
10 2.6 Kloramfenikol
Menurut Ditjen POM (1979), sifat fisika dan kimia kloramfenikol yaitu: a. Struktur bangun kloramfenikol
Gambar 2.1. Struktur bangun kloramfenikol
b. Nama kimia : D-treo-(-)-2,2-Dikloro-N-[β-hidroksi-α-
(hidrosimetil)-p-nitrofenetil]asetamida [56-75-7] c. Rumus molekul : C11H12Cl2N2O5
d. Berat molekul : 323,13
e. Pemerian : Hablur halus berbentuk jarum atau lempeng memanjang; putih hingga putih kelabu atau putih kekuningan; larutan praktis netral terhadap lakmus P, stabil dalam larutan netral atau larutan agak asam.
f. Kelarutan : Sukar larut dalam air; mudah larut dalam etanol, dalam propilen glikol, dalam aseton dan dalam etil asetat. g. Persyaratan : Kapsul Kloramfenikol mengandung kloramfenikol
C11H12Cl2N2O5, tidak kurang dari 90,0% dan tidak lebih
dari 120,0% dari jumlah yang tertera pada etiket. h. Indikasi : Sebagai antibiotik.
Sedangkan menurut Cahyadi (2006), kloramfenikol memiliki rumus kimia C11H12C12N2O5, dikenal dengan
11
Komposisi dan bentuk kloramfenikol memiliki berat molekul 323,14 dengan Karbon 40,88%, Hidrogen 3,74%, Klorida 21,95%, Nitrogen 8,67%, dan Oksigen 24,76%. Memiliki titik lebur 150,5-151,5°C, dapat tersublimasi pada tekanan hampa tinggi, larut dalam air pada suhu 25°C, sangat larut dalam metanol, ethanol, butanol dan etilasetataseton. Agak larut dalam eter. Tidak larut dalam benzene, petroleum eter dan minyak sayur (Cahyadi, 2006).
2.7 Uji Disolusi
Uji Disolusi didefenisikan sebagai proses suatu zat padat masuk ke dalam pelarut menghasilkan suatu larutan. Secara sederhana, disolusi adalah proses zat padat melarut. Secara prinsip, proses ini dikendalikan oleh afinitas antara zat padat dan pelarut (Ansel, 1989). Secara singkat, menurut Ansel, alat untuk menguji karakteristik disolusi dan sediaan padat kapsul atau tablet terdiri dari: 1. Motor pengaduk dengan kecepatan yang dapat diubah,
2. Keranjang baja stainless berbentuk silinder atau dayung untuk ditempelkan keujung batang pengaduk,
3. Bejana dari gelas, atau bahan lain yang inert dan transparan dengan volume 1000 ml, bertutup sesuai dengan di tengah-tengahnya ada tempat untuk menempelkan pengaduk dan ada lubang tempat masuk pada 3 tempat, dua untuk memindahkan contoh dan satu untuk menempatkan termometer,
4. Penangas air yang sesuai untuk menjaga temperatur pada media disolusi (seperti yang dicantumkan dalam masing-masing monografi) ditempatkan dalam bejana dan biarkan mencapai temperatur 37°C±0,5°C. Kemudian satu tablet atau satu kapsul yang diuji dicelupkan ke dalam bejana atau ditempatkan
12
dalam keranjang dan pengaduk diputar dengan kecepatan seperti yang ditetapkan dalam monografi. Pada waktu-waktu tertentu contoh dari mesin diambil untuk analisis kimia dari bagian obat yang terlarut. Tablet atau kapsul harus memenuhi persyaratan seperti yang tertera dalam monografi untuk kecepatan disolusi.
Menurut Ditjen POM (1979), ada dua metode alat uji disolusi sesuai dengan yang tertera dalam masing-masing monografi:
a. Alat 1 (Tipe Keranjang)
Alat terdiri dari wadah bertutup yang terbuat dari kaca, suatu motor, suatu batang logam yang digerakkan oleh motor dan wadah disolusi (keranjang) berbentuk silinder dengan dasar setengah bola, tinggi 160 mm-175 mm, diameter 98 mm−106 mm dan kapasitas nominal 1000 ml. Batang logam berada pada posisi sedemikian sehingga sumbunya tidak lebih dari 2 mm pada setiap titik dari sumbu vertikal wadah dan berputar dengan halus dan tanpa goyangan. Sebuah tablet diletakkan dalam keranjang saringan kawat kecil yang diikatkan pada bagian bawah batang logam yang digerakkan oleh motor yang kecepatannya dapat diatur. Wadah dicelupkan sebagian di dalam suatu tangas air yang sesuai sehingga dapat mempertahankan suhu dalam wadah pada 37°C±0,5°C selama pengujian dan menjaga agar gerakan air halus dan tetap. Pada bagian atas wadah ujungnya melebar, untuk mencegah penguapan digunakan suatu penutup yang pas.
b. Alat 2 (Tipe Dayung)
Alat ini sama dengan alat 1, bedanya pada alat ini digunakan dayung yang terdiri dari daun dan batang logam sebagai pengaduk. Daun melewati diameter batang sehingga dasar daun dan batang rata. Dayung memenuhi spesifikasi
13
dengan jarak 25 mm ±2 mm antara daun dan bagian dasar wadah yang dipertahankan selama pengujian berlangsung. Sediaan obat dibiarkan tenggelam ke bagian dasar wadah sebelum dayung mulai berputar. Gulungan kawat berbentuk spiral dapat digunakan untuk mencegah mengapungnya sediaan.
2.8 Spektrofotometri UV
2.8.1 Definisi spektrofotometri UV
Spektrofotometer sesuai dengan namanya adalah alat yang terdiri dari spektrometer dan fotometer. Spektrometer menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditransmisikan atau yang diabsorpsi. Jadi, spektrofotometer digunakan untuk mengukur energi secara relatif jika energi tersebut ditransmisikan, direfleksikan atau diemisikan sebagai fungsi dari panjang gelombang. Kelebihan spektrofotometer dibandingkan fotometer adalah panjang gelombang dari sinar putih dapat lebih terseleksi dan ini diperoleh dengan alat penguat seperti prisma ataupun celah optis (Gandjar dan Rohman, 2007).
Metode spektrofotometri UV-Vis adalah pengukuran intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel. Sinar ultraviolet dan cahaya tampak memiliki energi yang cukup untuk mempromosikan elektron pada kulit terluar ke tingkat energi yang lebih tinggi. Spektrofotometri UV-Vis biasanya digunakan untuk molekul organik di dalam larutan. Spektrumnya mempunyai daerah yang lebar dan sedikit informasi yang bisa didapatkan dari spektrum ini, tetapi spektrum ini sangat berguna untuk pengukuran secara kuantitatif. Sinar ultraviolet berada pada panjang gelombang 200-400 nm,
14
sedangkan visible berada pada panjang gelombang 400-800 nm (Dachriyanus, 2004).
2.8.2 Instrumen
Komponen-komponen suatu spektrofotometer meliputi sebagai berikut: a. Sumber cahaya
Lampu deuterium digunakan untuk daerah UV pada panjang gelombang dari 190-350 nm, sementara lampu halogen kuarsa atau lampu tungsten digunakan untuk daerah visible (pada panjang gelombang antara 350-900 nm) (Gandjar dan Rohman, 2007).
b. Monokromator
Digunakan untuk mendispersikan sinar kedalam komponen-komponen panjang gelombangnya yang selanjutnya akan dipilih oleh celah (slit). Monokromator berputar sedemikian rupa sehingga kisaran panjang gelombang dilewatkan pada sampel sebagai scan instrumen melewati spektrum (Gandjar dan Rohman, 2007).
c. Optik-optik
Dapat didesain untuk memecah sumber sinar, sehingga sumber sinar melewati 2 kompartemen, dan sebagaimana dalam spektrofotometer berkas ganda (double beam), suatu larutan blanko dapat digunakan dalam suatu kompartemen untuk mengkoreksi pembacaan atau spektrum sampel. Yang paling sering digunakan sebagai blanko dalam spektrofotometri adalah semua pelarut yang digunakan untuk melarutkan sampel atau pereaksi (Gandjar dan Rohman, 2007).
15 BAB III
METODOLOGI
3.1 Tempat dan Waktu Percobaan
Percobaan ini dilakukan di Ruang Laboratorium yang terdapat di industri PT. Kimia Farma (Persero) Tbk. Plant Medan Jalan Raya Tanjung Morawa Km. 9 pada bulan Februari 2017.
3.2 Alat - alat
Alat-alat yang digunakan adalah alat-alat gelas ukur 25 ml, pipet tetes, beaker glass 100 ml. Pipet volum 2 ml, labu tentukur 100 ml, Dissolution Testermerk Hanson type Vision G2 Elite 8 (AL-04-0035), Spektrofotemetri UV-Vismerk Agilent.
3.3 Bahan – bahan
Bahan-bahan yang digunakan adalah kapsul kloramfenikol 250 mg,baku kloramfenikol, akuades dan HCl 0,1N.
3.4 Prosedur Percobaan
3.4.1 Media disolusi
Pembuatan media disolusi, yaitu HCl 0,1 N adalah dipipet sebanyak 8,5 ml larutan HCl (p), dimasukkan larutan HCl ke dalam labu tentukur 1000 ml berisi akuades secara perlahan, dicukupkan dengan akuades sampai garis tanda, kemudian dihomogenkan.
16 3.4.2 Larutan baku
Pembuatan larutan baku, yaitu baku kloramfenikol adalah ditimbang seksama baku kloramfenikol sebanyak 69,44 mg kemudian dimasukkan ke dalam labu tentukur 100 ml.Dilarutkan dengan HCl 0,1 N sampai garis tanda dan disaring.Dibuang 5 ml filtrat pertama, dan ditampung filtrat selanjutnya.Dipipet 2 ml filtrat ke dalam labu tentukur 100 ml, diencerkan dengan HCl0,1 N sampai garis tanda. Dihomogenkan kemudian diukur serapan larutan baku dengan spektrofotometer UV pada panjang gelombang 278 nm, menggunakan HCl 0,1 N sebagai blanko.
3.4.3 Uji disolusi sampel uji
Ditimbang dan dicatat bobot 6 kapsul kloramfenikol kemudian dimasukkan media disolusi 900 ml HCl 0,1 N ke dalam masing-masingwadah disolusi, dipasang alat dengan pengaduk bentuk keranjang (alat 1).Dipanaskan media hingga suhu 37°C±0,5°C dengan menekan tombol “heater”. Kemudian dimasukkan kapsul ke dalam masing-masing wadah setelah suhu sesuai dengan laju kecepatan 100 rpm dan tunggu selama 30 menit.Setelah 30 menit dipipet 30 ml larutan dan dimasukkan ke dalam beaker glass. Kemudian dipipet sebanyak 5 ml larutan dari beaker glass dimasukkan ke dalam labu tentukur 100 ml dan diencerkan dengan larutan HCl 0,1 N sampai garis tanda.Diukur serapan masing-masing larutan uji dengan spektrofotometer UV pada panjang gelombang 278 nm. 3.4.4 Penetapan Kadar secara Spektrofotometri UV
Dihidupkan power/on pada alat spektrofotometer.Dibuka software spektrofotometri dan ditekan angka panjang gelombang.Dibuka tempat kuvet, masukkan larutan blanko pada kuvet 1.Dimasukkan juga larutan standar pada
17
kuvet 2, tutup. Catat absorbansinya (lihat pada printer).Untuk mengukur absorbansinya pada larutan uji dilakukan cara yang sama, dimana larutan blanko pada posisi tetap di kuvet 1 dan larutan uji pada kuvet 2.
3.4.5 Perhitungan
Perhitungan kadar zat terlarut kapsul kloramfenikol dilakukan dengan rumus: 𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾 = 𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴 𝑥𝑥 𝐵𝐵𝐴𝐴𝐴𝐴 𝑥𝑥 𝐵𝐵𝐴𝐴𝐴𝐴 300250 𝑥𝑥 1800500 𝑥𝑥 𝐾𝐾𝐴𝐴𝐴𝐴
Ket :
Asp = Absorbansi Sampel Ast = Absorbansi Standar
Bsp = Bobot Kloramfenikol dalam sampel yang ditimbang (mg) Bst = Bobot Standar Kloramfenikol yang ditimbang (mg) Ksp = Kadar Standar Kloramfenikol
18 BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
Berdasarkan penetapan kadar hasil uji disolusi kapsul kloramfenikol secara spektrofotometri UV, diperoleh hasil sebagai berikut:
Tabel 4.1. Hasil Uji Disolusi
No. Berat Kapsul (mg) Absorbansi Larutan
Uji (Asp) Kadar Zat Terlarut (%)
1. 314,0 0,42420 100,37 2. 301,0 0,40534 100,05 3. 307,9 0,41747 100,73 4. 287,0 0,42885 111,01 5. 308,6 0,40315 97,05 6. 299,9 0,39127 96,93
Hasil Uji Disolusi dapat dilihat pada lampiran 1. Perhitungan ujidisolusi kapsul kloramfenikol dapat dilihat pada lampiran 2. Absorbansi larutan baku dan larutan uji dapat dilihat pada lampiran 3 dan 4.
4.2 Pembahasan
Dari penetapan kadar hasil uji disolusi kapsul kloramfenikol secara spektrofotometri UV yang dilakukan diperoleh kadar zat terlarut yaitu: 100,37%, 100,05%, 100,73%, 111,01%, 97,05%, 96,93%. Kadar tersebut sesuai dengan batas yang ditetapkan Farmakope Indonesia Edisi V, dimana jumlah ke 6 kapsul yang diuji memenuhi kriteria penerimaan hasil uji disolusi, yaitu tidak satupun kadar yang diperoleh kurang dari (Q + 5%) yaitu (85% + 5% = 90%). Dari data diatas dinyatakan bahwa penetapan kadar kapsul kloramfenikol secara spektrofotometri UV memenuhi persyaratan.
19 BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Hasil penetapan kadar hasil uji disolusi kapsul kloramfenikol menggunakan metode spektrofotometri UV telah memenuhi persyaratan uji disolusi sesuai dengan yang ditetapkan oleh Farmakope Indonesia Edisi V.
5.2 Saran
Hendaknya kualitas dan persyaratan mutu obat seperti kapsul kloramfenikol dapat dipertahankan serta memakai metode penetapan kadar yang lain yaitu menggunakan metode Kromatografi Cair Kinerja Tinggi (KCKT) yang sesuai dengan Farmakope Indonesia Edisi IV 1995.
20
DAFTAR PUSTAKA
Admar, J. (2004). Perihal Obat Dengan Berbagai Bentuk Sediaannya. Medan: Usu Press. hal. 2.
Agoes,G. (2008). Pengembangan Sediaan Farmasi. Bandung: ITB University Press. hal. 330.
Anief, M. (1994). Farmasetika. Yogyakarta: Gadjah Mada University Press. hal. 105.
Anief, M. (1995). Prinsip Umum Dan Dasar Farmakologi. Yogyakarta: Gadjah Mada University Press. hal. 3.
Ansel,H.C. (1989). Pengantar Bentuk Sediaan Farmasi. Cetakan Pertama. Jakarta: Penerbit Universitas Indonesia (UI-Press). hal. 244, 246, 247. Cahyadi, W. (2006). Analisis Dan Aspek Kesehatan Bahan Tambahan Pangan.
Jakarta: PT Bumi Aksara. hal. 155.
Dachriyanus, (2004). Analisis Struktur Senyawa Organik Secara Spektroskopi. Padang: Andalas University Press. hal. 1.
Diten POM. (1979). Farmakope Indonesia Edisi III. Jakarta: Departemen Kesehatan. hal. 422, 423.
Diten POM. (1995). Farmakope IndonesiaEdisi IV. Jakarta: Departemen Kesehatan. hal. 4,189, 190, 1084, 1085.
Foye, W. O. (1996). Prinsip-Prinsip Kimia Medisinal Jilid II. Yogyakarta: Gadjah Mada University Press.hal. 1515-1518.
Gandjar dan Rohman, A. (2007). Kimia Farmasi. Yogyakarta: Pustaka Pelajar. hal. 261-262.
Sardjoko. (1993). Rancangan Obat. Cetakan Pertama. Yogyakarta: Gadjah Mada University Press. hal. 162.
Tjay,T.H, dan Rahardja,K. (2007). Obat-obat Penting. Jakarta: Gramedia. hal 312-314.
21 Lampiran 1. Hasil Uji Disolusi
Nama Produk : Kloramfenikol
Sediaan : Kapsul
Cara Penetepan : Spektrofometri Medium Disolusi : HCL 0,01 N Volume Medium : 900 ml Kecepatan Putaran : 100 rpm Basket/Pedal : Basket Waktu Penetapan : 30 Menit Metode P. Kadar : FI. V
Zat Pembanding : Kloramfenikol 100, 291% Faktor Pengenceran : 2 x 900 / 5 x 100 = 3,6
Dosis : 300/250 = 1,2
No Bsp (mg) Asp Kadar Zat Terlarut
Perhitungan Syarat S1 Bst =
69,44
Asp =
0,40494 dalam mg dalam %
1 314,0 0,42420 250,926 100,37% Kadar Zat Telarut
rata – rata = 101,027% Kadar Zat Terlarut minimal = 96,93% Kadar Zat Terlarut maksimal = 111,01% Tiap unit sediaan tidak kurang dari Q + 5% (Q=80%)= 80%+5% = 85% 2 301,0 0,40534 250,125 100,05% 3 307,9 0,41747 251,837 100,73% 4 287,0 0,42885 277,542 111,01% 5 308,6 0,40315 242,647 97,05% 6 299,9 0,39127 242,329 96,93%
22
Lampiran 2. Perhitungan Uji Disolusi Kapsul Kloramfenikol
𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾 = 𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴𝐴 𝑥𝑥 𝐵𝐵𝐴𝐴𝐴𝐴 𝑥𝑥 𝐵𝐵𝐴𝐴𝐴𝐴 300250 𝑥𝑥 1800500 𝑥𝑥 𝐾𝐾𝐴𝐴𝐴𝐴
Ket :
Asp = Absorbansi Sampel Ast = Absorbansi Standar
Bsp = Bobot Kloramfenikol dalam sampel yang ditimbang (mg) Bst = Bobot Standar Kloramfenikol yang ditimbang (mg) Ksp = Kadar Standar Kloramfenikol
Ast Asp Bsp 1 0,40494 1 0,4242 314,0 2 0,40534 301,0 3 0,41747 307,9 4 0,42885 287,0 5 0,40315 308,6 6 0,39127 299,9 Ast = 0,405 Bst = 69,44 Ksp = 100,291% 1. 𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾 = 0,4242 0,40494 𝑥𝑥 69,44 314,0 𝑥𝑥 300 250 𝑥𝑥 1800 500 𝑥𝑥 100,291% = 100,37% 2. 𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾 = 0,40534 0,40494 𝑥𝑥 69,44 301,0 𝑥𝑥 300 250 𝑥𝑥 1800 500 𝑥𝑥 100,291% = 100,05% 3. 𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾 = 0,41747 0,40494 𝑥𝑥 69,44 307,9 𝑥𝑥 300 250 𝑥𝑥 1800 500 𝑥𝑥 100,291% = 100,73% 4. 𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾 = 0,42885 0,40494 𝑥𝑥 69,44 287,0 𝑥𝑥 300 250 𝑥𝑥 1800 500 𝑥𝑥 100,291% = 111,01% 5. 𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾 = 0,40315 0,40494 𝑥𝑥 69,44 308,6 𝑥𝑥 300 250 𝑥𝑥 1800 500 𝑥𝑥 100,291% = 97,05% 6. 𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾𝐾 = 0,39127 0,40494 𝑥𝑥 69,44 299,9 𝑥𝑥 300 250 𝑥𝑥 1800 500 𝑥𝑥 100,291% = 96,93%
Syarat = Tiap unit sediaan tidak kurang dari Q + 5% Q = 80% Hasil = Tiap unit sediaan tidak kurang dari 85%
23 Lampiran 4. Absorbansi Larutan Uji