UJI DISOLUSI KAPSUL PIROKSIKAM SECARA
SPEKTROFOTOMETRI UV
TUGAS AKHIR
OLEH:
DEWI HARDIAH NIM 122410111
PROGRAM STUDI DIPLOMA III
ANALIS FARMASI DAN MAKANAN
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KATA PENGANTAR
Alhamdulillahirobbil’alamin, puji dan syukur kehadirat Allah SWT., yang
telah memberi rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan
perkuliahan yang diakhiri dengan penulisan tugas akhir dengan judul Uji Disolusi
Kapsul Piroksikam Secara Spektrofotometri UV.
Penulisan tugas akhir ini merupakan salah satu persyaratan untuk
menyelesaikan pendidikan Program Studi Diploma III Analis Farmasi dan
Makanan Fakultas Farmasi Universitas Sumatera Utara. Tugas akhir ini disusun
berdasarkan apa yang penulis lakukan pada Praktek Kerja Lapangan (PKL) di
Balai Besar Pengawas Obat dan Makanan (BBPOM) di Medan.
Selama menyusun tugas akhir ini, penulis banyak mendapat bantuan dan
bimbingan dari berbagai pihak, untuk itu penulis mengucapkan terima kasih yang
sebesar-besarnya kepada:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas
Farmasi USU.
2. Bapak Prof. Dr. Jansen Silalahi, M.App.Sc., Apt., selaku Ketua
Program Studi Diploma III Analis Farmasi dan Makanan Fakultas
Farmasi USU.
3. Ibu T. Ismanelly Hanum,S.Si.,M.Si., Apt., selaku dosen pembimbing
yang telah membimbing dan mengarahkan penulis dalam penyusunan
tugas akhir.
4. Bapak Drs. M. Alibata Harahap, Apt., M.Kes., selaku Kepala Balai
5. Ibu Lambok Okta SR, S.Si., M.Kes., Apt., selaku Manajer Mutu di
Balai Besar POM (BBPOM) di Medan, yang memberikan izin tempat
pelaksanaan Praktek Kerja Lapangan.
6. Ibu Lucy Rahmadesi, S.Farm., Apt., selaku Koordinator Pembimbing
Praktek Kerja Lapangan (PKL) beserta seluruh staf laboratorium Balai
Besar POM (BBPOM) di Medan.
7. Bapak dan Ibu dosen beserta seluruh staf Fakultas Farmasi USU.
Ayahanda dan Ibunda, adik penulis serta seluruh teman-teman mahasiswa
dan mahasiswi Program Studi Diploma III Analis Farmasi dan Makanan angkatan
2012 yang telah memberikan doa restu, motivasi dan dorongan baik moril
maupun materil sehingga tugas akhir ini dapat diselesaikan.
Penulis menyadari bahwa tulisan ini tidak luput dari kekurangan. Sangat
diharapkan kritik dan saran yang bersifat membangun kesempurnaan tulisan ini.
Akhirnya penulis berharap semoga tugas akhir ini bermanfaat bagi kita semua dan
semoga Allah SWT memberikan rahmat dan berkah-Nya atas bantuan yang telah
diberikan kepada penulis. Amin.
Medan, April 2015 Penulis,
Dewi Hardiah
DAFTAR ISI
BAB II TINJAUAN PUSTAKA 2.1 Pengertian Obat ... 3
2.6 Piroksikam ... 9
3.5.4 Penetapan Kadar Secara Spektrofotometri UV ... 18
3.6 Perhitungan... 19
BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil ... 21
BAB V KESIMPULAN DAN SARAN
5.1 Kesimpulan... 22
5.2 Saran ... 22
DAFTAR TABEL
Halaman
Tabel 2.1 Tabel Penerimaan Hasil Uji Disolusi ... 14
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Data Uji Disolusi dan Perhitungan Kadar ... 23
Lampiran 2. Gambar Alat Uji Disolusi ... 25
SPEKTROFOTOMETRI UV
Abstrak
Kapsul piroksikam adalah derivat-benzothianin yang berkhasiat sebagai analgetik, antipiretik, antiradang kuat dan bekerja lama. Kapsul piroksikam harus melalui serangkaian pengujian untuk menentukan kualitas kapsul tersebut. Salah satunya adalah uji disolusi. Tujuan pengujian ini adalah untuk mengetahui apakah kapsul merek Licofel yang mengandung 20 mg piroksikam memenuhi persyaratan uji disolusi sesuai dengan yang ditetapkan oleh Farmakope Indonesia Edisi IV.
Sampel terdiri dari 6 kapsul yang diambil dari satu bets. Uji disolusi dilakukan dengan menggunakan alat tipe 1 (metode keranjang) dan penetapan kadar zat terlarut dilakukan dengan menggunakan metode spektrofotometri UV sesuai dengan prosedur dan alat spektrofotometer UV-Vis yang ada di Balai Besar Pengawasan Obat dan Makanan.
Hasil pengujian menunjukkan bahwa kadar zat terlarut dari ke-6 kapsul, yaitu 98,09 %,105,36 %, 104,74 %, 101,88 %, 104,70 %, 100,01 % sesuai dengan batas yang ditetapkan dalam Farmakope Indonesia, dimana jumlah ke-6 kapsul yang diuji pada tahap 1 (S1) memenuhi kriteria penerimaan hasil uji disolusi, yaitu tidak satupun kadar yang diperoleh kurang dari ketentuan (Q + 5%) yakni (75% + 5% = 80%).
SPEKTROFOTOMETRI UV
Abstrak
Kapsul piroksikam adalah derivat-benzothianin yang berkhasiat sebagai analgetik, antipiretik, antiradang kuat dan bekerja lama. Kapsul piroksikam harus melalui serangkaian pengujian untuk menentukan kualitas kapsul tersebut. Salah satunya adalah uji disolusi. Tujuan pengujian ini adalah untuk mengetahui apakah kapsul merek Licofel yang mengandung 20 mg piroksikam memenuhi persyaratan uji disolusi sesuai dengan yang ditetapkan oleh Farmakope Indonesia Edisi IV.
Sampel terdiri dari 6 kapsul yang diambil dari satu bets. Uji disolusi dilakukan dengan menggunakan alat tipe 1 (metode keranjang) dan penetapan kadar zat terlarut dilakukan dengan menggunakan metode spektrofotometri UV sesuai dengan prosedur dan alat spektrofotometer UV-Vis yang ada di Balai Besar Pengawasan Obat dan Makanan.
Hasil pengujian menunjukkan bahwa kadar zat terlarut dari ke-6 kapsul, yaitu 98,09 %,105,36 %, 104,74 %, 101,88 %, 104,70 %, 100,01 % sesuai dengan batas yang ditetapkan dalam Farmakope Indonesia, dimana jumlah ke-6 kapsul yang diuji pada tahap 1 (S1) memenuhi kriteria penerimaan hasil uji disolusi, yaitu tidak satupun kadar yang diperoleh kurang dari ketentuan (Q + 5%) yakni (75% + 5% = 80%).
BAB I
PENDAHULUAN
1.1Latar Belakang
Menurut Farmakope Indonesia kapsul adalah bentuk sediaan obat
terbungkus cangkang kapsul, keras atau lunak. Cangkang kapsul dibuat dari
gelatin atau tanpa zat tambahan lain (Depkes RI,1984).
Kapsul dapat didefenisikan sebagai bentuk sediaan padat, dimana satu
macam bahan obat atau lebih dan atau bahan inert lainnya yang dimasukkan
kedalam cangkang atau wadah kecil yang umumnya dibuat dari gelatin yang
sesuai. Tergantung pada formulasinya kapsul dari gelatin bisa lunak dan juga bisa
keras. Kebanyakan kapsul – kapsul yang diedarkan di pasaran adalah kapsul yang
semuanya dapat ditelan oleh pasien, untuk keuntungan dalam pengobatan. Begitu
pula, kapsul dapat untuk disisipkan ke dalam rektum sehingga obat dilepaskan dan
diabsorpsi di tempat tersebut, atau isi kapsul dapat dipindahkan dari cangkang
gelatin dan digunakan sebagai pengukur yang dini dari obat – obat bentuk serbuk
(Ansel, 1989).
Disolusi adalah proses suatu zat solid memasuki pelarut untuk
menghasilkan suatu larutan. Disolusi secaara singkat didefinisikan sebagai proses
suatu solid melarut (Siregar, 2010).
Spektrofotometer UV-Vis adalah pengukuran panjang gelombang dan
intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel. Sinar
ultraviolet dan cahaya tampak memiliki energi yang cukup untuk mempromosikan
Spektroskopi UV-Vis biasanya digunakan untuk molekul dan ion
anorganik atau kompleks di dalam larutan. Spektrum UV-Vis mempunyai bentuk
yang lebar dan hanya sedikit informasi tentang struktur yang bisa didapatkan dari
spektrum ini. Tetapi spektrum ini sangat berguna untuk pengukuran secara
kuantitatif. Sinar ultraviolet berada pada panjang gelombang 200-400 nm
sedangkan sinar tampak berada pada panjang gelombang 400-800 nm
(Dachriyanus, 2004).
1.2Tujuan
Untuk menentukan apakah kapsul piroksikam merek Licofel® memenuhi
persyaratan uji disolusi sesuai dengan yang ditetapkan oleh Farmakope Indonesia.
1.3 Manfaat
Uji disolusi bermanfaat untuk memberikan informasi kepada masyarakat
mengenai apakah kapsul piroksikam merek Licofel® memenuhi persyaratan
Farmakope Indonesiaatau tidak sehingga produk tersebut layak untuk
BAB II
TINJAUAN PUSTAKA
2.1 Pengertian Obat
Obat sering disebut obat modern ialah suatu bahan yang dimaksudkan
untuk digunakan dalam menetapkan diagnosa, mencegah, mengurangkan,
menghilangkan, menyembuhkan penyakit atau gejala penyakit, luka atau kelainan
badaniah dan rohaniah pada manusia atau hewan, memperelok badan atau bagian
badan manusia (Anief,1997).
2.2 Pengertian Kapsul
Kapsul dapat didefenisikan sebagai bentuk sediaan padat, dimana satu
macam bahan obat atau lebih dan atau bahan inert lainnya yang dimasukkan ke
dalam cangkang atau wadah kecil yang umumnya dibuat dari gelatin yang sesuai.
Tergantung pada formulasinya kapsul dari gelatin bisa lunak dan juga bisa keras.
Kebanyakan kapsul – kapsul yang diedarkan di pasaran adalah kapsul yang
semuanya dapat ditelan oleh pasien, untuk keuntungan dalam pengobatan. Begitu
pula, kapsul dapat untuk disisipkan ke dalam rektum sehingga obat dilepaskan dan
diabsorpsi di tempat tersebut, atau isi kapsul dapat dipindahkan dari cangkang
gelatin dan digunakan sebagai pengukur yang dini dari obat – obat bentuk serbuk.
(Ansel,1989).
2.3 Macam-macam Kapsul
2.3.1 Kapsul gelatin yang keras
Kapsul gelatin yang keras merupakan jenis yang digunakan oleh ahli
lingkungan para pembuat sediaan farmasi dalam memproduksi kapsul umumnya.
Cangkang kapsul kosong dibuat dari campuran gelatin, gula dan air jernih tidak
berwarna dan pada dasarnya tidak mempunyai rasa (Ansel, 1989).
Gelatin, USP, dihasilkan dari hidrolisis sebagian dari kolagen yang
diperoleh dari kulit, jaringan ikat putih dan tulang binatang-binatang. Dalam
perdagangan didapat gelatin dalam bentuk serbuk halus, serbuk kasar, parutan,
serpihan-serpihan atau lembaran-lembaran (Ansel, 1989).
Gelatin bersifat stabil di udara bila dalam keadaan kering, akan tetapi
mudah mengalami peruraian oleh mikroba bila menjadi lembab atau bila disimpan
dalam larutan berair. Oleh karena itu kapsul gelatin yang lunak, mengandung
lebih banyak uap air daripada kapsul keras, pada pembuatannya ditambahkan
bahan pengawet untuk mencegah timbulnya jamur dalam cangkang kapsul.
Biasanya kapsul keras gelatin mengandung uap air antara 9-12% (Ansel, 1989).
Bilamana disimpan dalam lingkungan dengan kelembapan yang tinggi,
penambahan uap air akan diabsorbsi oleh kapsul dan kapsul keras ini akan rusak
dari bentuk kekerasannya. Sebaliknya dalam lingkungan udara yang sangat
kering, sebagian dari uap air yang terdapat dalam kapsul gelatin mungkin akan
hilang, dan kapsul ini menjadi rapuh serta mungkin akan remuk bila dipegang
(Ansel, 1989).
Karena uap air bisa diabsorbsi atau dilepaskan oleh kapsul gelatin,
tergantung pada keadaan lingkungan, maka merupakan perlindungan fisik
sederhana bila memasukkan bahan higroskopis atau yang mudah mencair, bila
hal yang tidak lazim, kapsul dari bahan yang mudah dipengaruhi kelembapan
dikemas dalam wadah yang mengandung kantung “zat pengering“, untuk
mencegah kapsul mengabsorbsi uap air dari udara. Dengan atau tanpa “zat
pengering” seperti itu, kapsul umunya harus disimpan dalam suasana dengan
kelembapan yang rendah (Ansel, 1989).
2.3.2 Kapsul gelatin lunak
Kapsul gelatin lunak dibuat dari gelatin dimana gliserin atau alkohol
polivalen dan sorbitol ditambahkan supaya gelatin bersifat elastis seperti plastik.
Kapsul-kapsul ini yang mungkin bentuknya membujur seperti elips atau seperti
bola dapat digunakan untuk diisi cairan, suspensi, bahan berbentuk pasta atau
serbuk kering. Biasanya pada pembuatan kapsul ini, mengisi dan menyegelnya
dilakukan secara berkesinambungan dengan suatu mesin khusus. Kapsul lunak
yang kosong dibuat dan diberi segel dalam keadaan kedap udara (untuk
mencegah kempis dam saling melekat satu dengan lainnya). Untuk pengisian
kapsul akan dilakukan kemudian, tapi cara ini jarang dilakukan (Ansel, 1989).
Kapsul gelatin lunak menjadi bermanfaat, bila diperlukan langsung disegel
begitu obat masuk ke dalam kapsul. Kapsul menjadi sangat penting bila diisi
dengan obat-obat cair atau larutan obat begitu juga obat dari bahan – bahan yang
mudah menguap atau obat yang mudah mencair bila terkena udara. Untuk
obat-obat ini lebih sesuai menggunakan kapsul lunak daripada kapsul keras.
Kapsul lunak bentuknya bagus dan lebih mudah ditelan oleh pasien.
Tetapi, membuatnya tidak mudah kecuali dalam industri skala besar dan
2.4 Syarat – syarat kapsul
1. Keseragaman Bobot
Menurut FI. III, dibagi menjadi dua kelompok , yaitu :
Kapsul berisi obat kering
Timbang 20 kapsul, timbang lagi satu persatu, keluarkan isi semua kapsul,
timbang seluruh bagian cangkang kapsul. Hitung bobot isi kapsul dan bobot
rata-rata tiap isi kapsul. Perbedaan dalam persen bobot isi tiap kapsul terhadap bobot
rata-rata tiap isi kapsul tidak boleh lebih dari dua kapsul yang penyimpangannya
lebih besar dari harga yang ditetapkan oleh kolom A dan tidak satu kapsul pun
yang penyimpangannya melebihi yang ditetapkan oleh kolom B.
Bobot rata-rata kapsul
Perbedaan bobot isi kapsul dalam %
A B
Kapsul berisi obat cair atau pasta
Timbang 10 kapsul, timbang lagi satu persatu. Keluarkan isi semua kapsul, cuci
cangkang kapsul dengan eter. Buang cairan cucian, biarkan hingga tidak berbau
eter, timbang seluruh bagian cangkang kapsul. Hitung bobot isi kapsul dan bobot
rata-rata tiap isi kapsul. Perbedaan dalam persen bobot isi tiap kapsul terhadap
2. Waktu Hancur
Uji waktu hancur digunakan untuk menguji kapsul keras maupun kapsul
lunak. Waktu hancur ditentukan untuk mengetahui waktu yang diperlukan oleh
kapsul yang bersangkutan untuk hancur menjadi butiran-butiran bebas yang tidak
terikat oleh satu bentuk.
3. Keseragaman Sediaan
Terdiri dari keragaman bobot untuk kapsul keras dan keseragaman kandungan
untuk kapsul lunak.
4. Uji Disolusi
Uji ini digunakan untuk menentukan kesesuaian dengan persyaratan disolusi
yang tertera dalam masing – masing monografi. Persyaratan disolusi tidak berlaku
untuk kapsul gelatin lunak kecuali bila dinyatakan dalam masing – masing
monografi (Depkes RI,1984).
2.5 Analgetika
Analgetika atau obat penghilang nyeri adalah zat-zat yang mengurangi
atau menghalau rasa nyeri tanpa menghilangkan kesadaran (perbedaan dengan
anestetika umum) (Tjay, 2007).
Rasa sakit ialah suatu fenomena subjektif yang amat dipengaruhi oleh
penyebabnya, jenisnya dan individu tertentu. Rasa sakit ini merupakan sensasi
yang timbul oleh karena stimulus yang berasal dari gangguan atau kerusakan
jaringan. Jadi rasa sakit ini penting untuk melindungi tubuh, oleh karena dengan
adanya rasa sakit maka kita akan berusaha untuk menghindarkan ataupun
2.5.1 Penggolongan obat analgetika
Atas dasar kerja farmakologisnya, analgetika dibagi dalam dua kelompok
besar, yakni :
a. Analgetika perifer (non-narkotik), yang terdiri dari obat-obat yang tidak bersifat
narkotik dan tidak bekerja sentral. Analgetika antiradang termasuk kelompok ini
b. Analgetika narkotik khusus digunakan untuk menghalau rasa nyeri hebat,
seperti pada fractura dan kanker (Tjay, 2007).
Analgetika Non Narkotika yaitu obat – obat yang dapat menghilangkan
rasa sakit/nyeri somatis. Obat – obat yang termasuk analgetika non
narkotika :
I. Golongan Salisilat
II. Golongan Para – aminofenol
III. Golongan Pirazolon
IV. Golongan lain, misalnya : - Indomethacin
- Mefanamic acid
- Preparat – preparat campuran.
Analgetika narkotik ini merupakan bahan – bahan yang dapat
menimbulkan analgesia yang amat kuat dan dapat menimbulkan
kecanduan. Pada umumnya bahan –bahan ini didapati dari opium
sehingga sering juga disebut opiate – analgesic. Obat – obat yang
termasuk analgetik narkotik :
I. Opium
III. Methadone dan turunannya (Anwar,1973).
2.6 Piroksikam
Menurut Ditjen POM (1995), sifat fisika dan kimia piroksikam adalah
sebagai berikut:
4-Hidroksi-2-metil-N-2- piridil-2H-1,2- benzotiazin-3-karboksamida 1,1- dioksida
[36322-90-4]
Piroksikam mengandung tidak kurang dari 97,0% dan tidak lebih dari 103,0%
Berat Molekul : 331,35
Rumus Molekul : C15H13N3O4S
Pemerian : Serbuk hampir putih atau coklat terang atau kuning terang,
tidak berbau. Bentuk monohidrat berwarna kuning.
Kelarutan : Sangat sukar larut dalam air, dalam asam-asam encer dan
sebagian besar pelarut organik, sukar larut dalam etanol dan
dalam larutan alkali mengandung air.
2.6.1 Indikasi
Menghilangkan rasa sakit, radang, dan gangguan muskuloskeletal akut
2.7 Uji Disolusi
Uji disolusi merupakan suatu prosedur pengendalian mutu tetap dalam
praktik Cara Pembuatan Obat yang Baik (CPOB). Uji disolusi merupakan suatu
indikator sederhana dan tidak mahal untuk ketetapan fisik produk. Jika suatu bets
sangat berbeda dari yang lain dalam karakteristik disolusinya, atau jika waktu
disolusi bets produk menunjukkan kecenderungan tetap menaik atau menurun, hal
tersebut diduga suatu peringatan pasti bahwa beberapa faktor dalam bahan baku,
formulasi atau proses berada di luar kendali (Siregar, 2010).
2.7.1 Alat uji disolusi
Alat uji disolusi berfungsi melepaskan dan melarutkan zat aktif dari
sediaannya. Pada dasarnya alat ini berfungsi mengekstraksi zat aktif dari
sediaannya dalam satuan waktu di bawah antar permukaan cairan solid, suhu, dan
komposisi media yang dibakukan (Siregar, 2010).
Pada prinsipnya, alat uji disolusi terdiri atas bejana dan tutup, yang
berfungsi sebagai wadah yang mendisolusi zat aktif; pengaduk, motor pemutar
pengaduk; termometer; penangas air yang dilengkapi dengan thermostat (Siregar,
2010).
2.7.2 Prosedur pengujian Disolusi
Pada tiap pengujian, dimasukkan sejumlah volume media disolusi (seperti
yang tertera dalam masing-masing monografi) ke dalam wadah, pasang alat dan
dibiarkan media disolusi mencapai temperatur 37oC. Satu tablet atau kapsul
dicelupkan dalam keranjang atau dibiarkan tenggelam ke bagian dasar wadah,
monografi. Pada interval waktu yang ditetapkan dari media diambil cuplikan pada
daerah pertengahan antara permukaan media disolusi dan bagian atas dari
keranjang berputar atau daun dari alat dayung tidak kurang 1 cm dari dinding
wadah. Lakukan penetapan seperti yang tertera dalam masing – masing monografi
(Depkes RI, 1995).
Menurut Ditjen POM (1995), ada dua tipe alat uji disolusi sesuai dengan
yang tertera dalam masing-masing monografi:
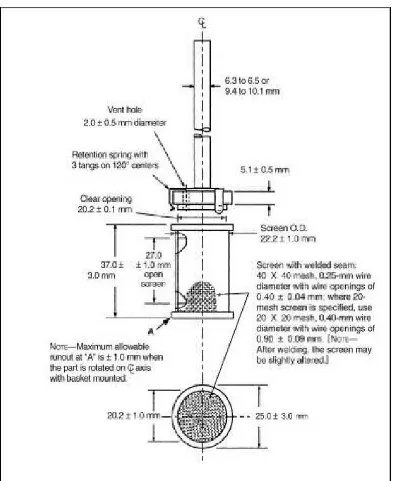
a. Alat 1 (Tipe Keranjang)
Alat terdiri dari wadah bertutup yang terbuat dari kaca, suatu motor, suatu
batang logam yang digerakkan oleh motor dan wadah disolusi (keranjang)
berbentuk silinder dengan dasar setengah bola, tinggi 160 mm−175 mm,
diameter 98 mm−106 mm dan kapasitas nominal 1000 ml. Batang logam
berada pada posisi sedemikian sehingga sumbunya tidak lebih dari 2 mm
pada setiap titik dari sumbu vertikal wadah dan berputar dengan halus dan
tanpa goyangan. Sebuah tablet diletakkan dalam keranjang saringan kawat
kecil yang diikatkan pada bagian bawah batang logam yang digerakkan
oleh motor yang kecepatannya dapat diatur. Wadah dicelupkan sebagian di
dalam suatu tangas air yang sesuai sehingga dapat mempertahankan suhu
dalam wadah pada 37o ± 0,5oC selama pengujian dan menjaga agar
gerakan air halus dan tetap. Pada bagian atas wadah ujungnya melebar,
b. Alat 2 (Tipe Dayung)
Alat ini sama dengan alat 1, bedanya pada alat ini digunakan dayung
yang terdiri dari daun dan batang logam sebagai pengaduk. Daun melewati
diameter batang sehingga dasar daun dan batang rata. Dayung memenuhi
spesifikasi dengan jarak 25 mm ± 2 mm antara daun dan bagian dasar
wadah yang dipertahankan selama pengujian berlangsung. Sediaan obat
dibiarkan tenggelam ke bagian dasar wadah sebelum dayung mulai
berputar. Gulungan kawat berbentuk spiral dapat digunakan untuk
mencegah mengapungnya sediaan.
2.7.3 Metode Uji Disolusi
Banyak metode untuk menetapkan laju disolusi zat aktif dari sediaanya.
Antara lain yaitu metode keranjang dan dayung.
1. Metode Keranjang
Metode ini pada mulanya diusulkan oleh Pernaworski (1968) dan
dimodifikasi menjadi metode resmi pertama yang diadopsi oleh USP
XVIII dan NF XIII pada tahun 1971.
Metode basket berputar telah digunakan lebih dar 30 tahun dalam
pengujian yan gluas untuk ssemua jenis bentuk sediaan.
Metode basket menunkukkan suatu upaya membatasi posisi bentuk
sediaan untuk memberikan kemungkinan maksimum suatu
antarpermukaan solid-cairan yang tetap. Metode ini mempunyai beberapa
keterbatasan, yaitu kecenderungan zat bergerak menyumbat kasa basket,
yang kurang memadai ketika partikel meninggalkan basket dan
mengapung dalam media, dan kesulitan konstruksi jika diupayakan
metode yang diotomatisasi.
2. Metode Dayung
Pada mulanya dikembangkan oleh Poole (1969), kemudian dimodifikasi
melului karya ilmuwan di National Center for Drug Analysis (NCDA),
FDA di St. Louis (Mo). Metode ini pada dasarnya terdiri atas batang dan
daun pengaduk yang merupakan dayung berputar dengan dimensi tertentu
sesuai dengan radius bagian dalam labu dengan dasar bundar. Metode ini
mengatasi banyak keterbatasan basket berputar, tetapi mensyaratkan
presisi yang eksterm dalam geometri dayung, labu, dan perlakuan variasi
yang tidak dapat diterima dalam data disolusi berikutnya bahkan
perubahan yang sangat kecil dalam penempatan (orientasi) dayung.
Metode ini sangat baik untuk sistem otomatis (Siregar, 2010).
2.7.4 Faktor-faktor yang mempengaruhi disolusi
Dengan menganalisa parameter-parameter persamaan Noyes dan Withney,
maka faktor-faktor itu antara lain :
1. Pengaruh ukuran partikel
Kecepatan disolusi berbanding lurus dengan luas permukaan zat aktif.
2. Pengaruh kelarutan zat aktif
Kecepatan disolusi berbanding lurus dengan perbedaan Cs – C. Jadi,
makin besar kelarutan zat aktif makin besar kecepatan disolusi (Soewarni,
2.7.5 Formulasi medium disolusi
Idealnya, medium disolusi diformulasi sedekat mungkin dengan pH in vivo
yang diantisipasi. Sebagai contoh, medium disolusi yang didasarkan pada 0,1 N
HCl digunakan untuk menurunkan pH mendekati pH lambung. Hal ini disebabkan
pH lambung manusia berada di sekitar nilai 1-3. Cairan disolusi lambung dapat
pula digunakan. Makanan dapat meningkatkan pH lambung sampai 3-5.
Beberapa cairan disolusi farmakope berada pada pH netral, walaupun
dalam kenyataannya apabila tablet ditelan akan berada/mencapai pH rendah
lambung. Penggunaan surfaktan dan enzim dapat dipakai sebagai perkiraan kasar
cairan intestinal walaupun surfaktan ditambahkan untuk menigkatkan kelarutan
obat secara solubilitas miselar (Agoes, 2008).
2.7.6 Kriteria Penerimaan Hasil Uji Disolusi
Farmakope Indonesia Ed. IV menyatakan, kecuali dinyatakan lain dalam
masing-masing monografi, persyaratan dipenuhi bila jumlah zat aktif yang terlarut
dari sediaan yang diuji sesuai dengan tabel penerimaan (Siregar, 2010).
Tabel 2.1 Tabel Penerimaan Hasil Uji Disolusi
Tahap Jumlah Sediaan
yang diuji Kriteria Penerimaan
S1 6 Tiap unit sediaan tidak kurang dari Q + 5%
S2 6
Harga Q adalah jumlah zat aktif yang terlarut, seperti yang tertera dalam
masing-masing monografi, dinyatakan dalam persen dari jumlah yang tertera pada
etiket. Angka 5% dan 15% adalah persen dari jumlah yang tertera pada etiket
sehingga mempunyai arti yang sama dengan Q. Kecuali ditetapkan lain dalam
masing-masing monografi, persyaratan umum untuk penetapan satu titik tunggal
ialah terdisolusi 75% dalam 45 menit dengan menggunakan Alat 1 pada 100 rpm
atau Alat 2 pada 50 rpm (Siregar, 2010).
2.8 Spektrofotometri UV
Spektrofotometer UV-Vis adalah pengukuran panjang gelombang dan
intensitas sinar ultraviolet dan cahaya tampak yang diabsorbsi oleh sampel. Sinar
ultraviolet dan cahaya tampak memiliki energi yang cukup untuk mempromosikan
elektron pada kulit terluar ke tingkat energi yang lebih tinggi (Dachriyanus,2004).
Interaksi antara radiasi dan materi merupakan hal yang sangat menarik.
Kebanyakan molekul obat menyerap radiasi dalam daerah ultraviolet spektrum
tersebut, meskipun sebagian diwarnai sehingga menyerap radiasi dalam daerah
visibel, misalnya suatu zat berwarna biru menyerap radiasi pada daerah merah
spektrum tersebut. Serapan radiasi UV/visibel terjadi melalui eksitasi
elektron-elektron di dalam struktur molekular menjadi keadaan energi yang lebih tinggi.
S3 12
Radiasi di daerah UV/visibel diserap melalui eksitasi elektron-elektron
yang terlibat dalam ikatan-ikatan antara atom-atom pembentuk molekul sehingga
awan elektron menahan atom-atom bersama-sama mendistribusikan kembali
atom-atom itu sendiri dan orbital yang ditempati oleh elektron-elektron pengikat
tidak lagi bertimpang tindih.
Radiasi UV panjang gelombang pendek < 150 nm ( >8,3 eV) dapat
menyebabkan putusnya ikatan paling kuat di dalam molekul organik sehingga
sangat membahayakan organisme hidup. Yang lebih menarik perhatian para analis
adalah ikatan-ikatan yang lebih lemah di dalam molekul karena ikatan tersebut
dapat dieksitasi dengan radiasi UV panjang gelombang yang lebih panjang > 200
nm ( > 6,2 eV), yang terdapat pada panjang gelombang yang lebih panjang
daripada daerah di tempat udara dan pelarut – pelarut umum mengabsorbsi
(Watson, 2005).
Analisis spektrofotometri cukup teliti, cepat dan sangat cocok untuk
digunakan pada kadar yang kecil. Senyawa yang dianalisis harus mempunyai
gugus kromofor. Pengamatan spektrum bermanfaat, karena dapat membandingkan
BAB III
METODOLOGI
3.1 Tempat dan waktu pengujian
Pengujian uji disolusi kapsul piroksikam 20 mg dilakukan di Laboratorium
Napza, Balai Besar Pengawas Obat dan Makanan (BBPOM) di Medan Jalan
Willem Iskandar, Pasar V Barat I No. 2 Medan pada tanggal 16 Februari 2015.
3.2 Alat-alat
Alat yang digunakan adalah alat disolusi, beaker glass, corong, erlenmeyer,
gelas ukur, labu tentukur 100 ml dan 25 ml, pipet volum, spuit, vial.
3.3 Sampel
Sampel yang digunakan adalah Licofel® yang berasal dari pabrik Berlico
Mulia Farma.
3.4 Bahan
Bahan yang digunakan adalah HCl 0,1 N dan akuades.
3.5 Prosedur
3.5.1 Pembuatan Pereaksi
a. Larutkan 14,0 g natrium klorida (p) dalam 49 ml asam klorida (p).
b. Ditambahkan aquadest secukupnya hingga 6000 ml.
c. Larutan mempunyai pH lebih kurang 1,2.
d. Dimasukkan masing-masing 900 ml ke dalam vessel dissolusi.
e. Ditunggu hingga suhu 37o C.
3.5.2 Uji Disolusi Sampel
a. Ditimbang masing-masing 6 kapsul piroksikam, dicatat hasilnya.
b. Disiapkan alat, pastikan alat siap pakai.
c. Dimasukkan 900 ml media disolusi, dipasang alat dengan pengaduk
bentuk keranjang.
d. Dimasukkan 6 kapsul piroksikam 20 mg ke dalam masing-masing wadah
secara serentak. Segera jalankan alat pada suhu 37oC ± 0,5oC dengan laju
kecepatan 100 rpm dan tunggu selama 45 menit.
e. Dipasang spuit pada alat disolusi.
f. Pada menit ke 40 bilas spuit sebanyak 5 ml dengan media disolusi, lalu
dimenit ke 45 diambil dengan spuit media disolusi sebanyak 20 ml
dimasukkan ke dalam erlenmeyer.
g. Dipipet masing-masing 3 ml filtrat dimasukkan ke dalam labu tentukur 10
ml, lalu dicukupkan sampai garis tanda (Depkes RI,1995).
3.5.3 Baku Pembanding
a. Ditimbang 10,232 mg baku pembanding, masukkan dalam labu 100 ml.
b. Dilarutkan dengan media disolusi, dicukupkan hingga 100 ml.
c. Dipipet 4 ml masukkan ke dalam labu 100 ml, dicukupkan dengan media
disolusi.
3.5.4 Penetapan Kadar Secara Spektrofotometri UV
Tahapan kerja penetapan kadar yang dilakukan adalah sebagai berikut:
a. Hidupkan alat spektofotometer ultra violet (UV).
b. Klik program spektofotometer ultra violet (UV) yang terdapat di
c. Klik menu Quantification, masukkan panjang gelombang maksimum (273
nm) serta jarak batas atas dan batas bawah panjang gelombang (200 nm
dan 400 nm).
d. Masukkan akuades (blanko) ke dalam kuvet.
e. Letakkan kuvet di tempat pengukuran.
f. Klik blank, lalu spektrum keluar.
g. Masukkan larutan A (Larutan baku pembanding) ke dalam kuvet.
h. Letakkan kuvet di tempat pengukuran.
i. Klik standard, keluar 1 absorbansi di dalam tabel, klik 3 kali sehingga
diperoleh 3 buah absorbansi. Dalam perhitungan kadar yang digunakan
adalah nilai absorbansi yang terdapat di tengah.
j. Masukkan larutan B (Larutan uji) ke dalam kuvet.
k. Letakkan kuvet di tempat pengukuran.
l. Klik sampel, keluar 1 buah absorbansi di dalam tabel, klik 2 kali sehingga
diperoleh 2 absorbansi untuk masing-masing sampel. Dalam perhitungan
kadar, yang digunakan sebagai Au (Absorbansi larutan uji) adalah nilai
absorbansi yang mendekati nilai absorbansi larutan baku.
3.6 Perhitungan
Perhitungan kadar zat terlarut kapsul piroksikam dapat dilakukan dengan
menggunakan rumus:
a. Faktor perkalian (Fk)
FK = �� ��������
�������� � 100%
Fu = faktor pengenceran uji
Bb = bobot baku
Kb = kemurnian baku
Fb = faktor pengenceran baku
Ab = absorbansi baku
Kc = keterangan etiket
b. % Zat aktif terlarut (Dx)
% Dx = Fk x Au
Keterangan : Fk = faktor perkalian
BAB IV
HASIL DAN PEMBAHASAN
4.1Hasil
Berdasarkan uji disolusi kapsul piroksikam 20 mg yang dilakukan,
diperoleh hasil sebagai berikut:
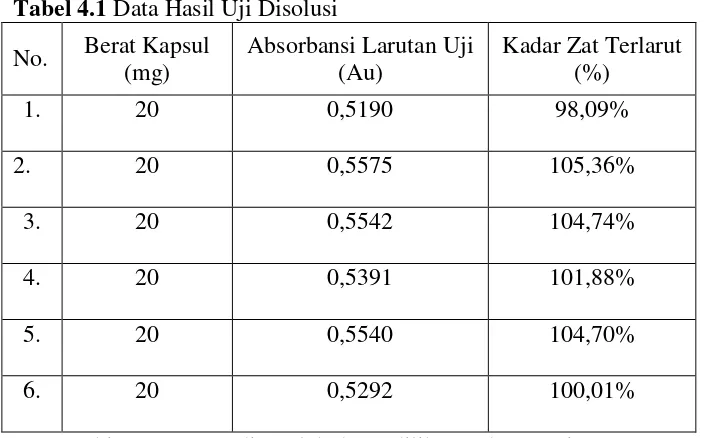
Tabel 4.1 Data Hasil Uji Disolusi
No. Berat Kapsul
Cara perhitungan yang diperoleh dapat dilihat pada Lampiran 1.
4.2Pembahasan
Dari hasil uji disolusi kapsul piroksikam yang dilakukan diperoleh kadar
zat terlarut, yaitu 98,09 %,105,36 %, 104,74 %, 101,88 %, 104,70 %, 100,01 %.
Kadar tersebut sesuai dengan batas yang ditetapkan dalam Farmakope Indonesia,
dimana jumlah ke-6 kapsul yang diuji pada tahap 1 (S1) memenuhi kriteria
penerimaan hasil uji disolusi, yaitu tidak satupun kadar yang diperoleh kurang
dari (Q + 5%) yaitu (75% + 5%= 80%). Dari data di atas dinyatakan bahwa kapsul
BAB V
KESIMPULAN DAN SARAN
5.1Kesimpulan
Dari hasil uji disolusi yang dilakukan, maka dapat disimpulkan bahwa kapsul
piroksikam 20 mg merek Licofel® telah memenuhi persyaratan uji disolusi sesuai
dengan yang ditetapkan oleh Farmakope Indonesia Edisi IV. Dimana persyaratan
uji disolusi tiap unit sediaan tidak satupun kadar kurang dari ketentuan (Q + 5%)
yaitu (75% + 5%= 80%). Berarti hasil uji disolusi memenuhi persyaratan.
5.2Saran
Disarankan kepada penguji selanjutnya untuk melakukan uji disolusi dengan
metode yang lain dan dengan sampel yang berbeda. Hal tersebut sangat
dibutuhkan untuk mengetahui layak atau tidaknya suatu produk untuk dikonsumsi
DAFTAR PUSTAKA
Agoes,G. (2008). Pengembangan Sediaan Farmasi. Bandung : ITB University Press. Hal. 381
Anief, M. (2006). Ilmu Meracik Obat. Yogyakarta : Gajah Mada University Press. Hal. 13
Ansel, H.C. (1989). Pengantar Bentuk Sediaan Farmasi. Cetakan Pertama. Jakarta: Penerbit Universitas Indonesia (UI-Press). Hal. 244, 246, 247.
Dachriyanus, (2004). Analisis Struktur Senyawa Organik Secara Spektroskopi. Padang: Andalas University Press. Hal. 1.
Depkes RI. (1979). Farmakope Indonesia. Edisi III. Jakarta: Departemen Kesehatan. Hal. 4, 422, 423, 1084, 1085.
Depkes RI. (1995). Farmakope Indonesia. Edisi IV. Jakarta: Departemen Kesehatan. Hal. 4, 422, 423, 1084, 1085.
Sardjoko. (1993). Rancangan Obat. Cetakan Pertama. Yogyakarta: Gadjah Mada University Press. Hal. 162.
Sartono. (1993). Apa Yang Sebaiknya Anda Ketahui Tentang Obat-Obat Bebas dan Bebas Terbatas. Cetakan Pertama. Jakarta: Gramedia Pustaka Utama. Hal. 36, 37.
Siregar, C.J.P. (2010). Teknologi Farmasi Sediaan Tablet. Dasar-Dasar Praktis. Jakarta: Penerbit Buku Kedokteran EGC. Hal 84 – 86, 90, 96.
Tjay,T.H, dan Rahardja,K. (2007). Obat-obat Penting. Jakarta: Gramedia. Hal 312-314.
Lampiran 1.
Data Uji Disolusi dan Perhitungan Kadar
Nama sediaan : Licofel
Zat berkhasiat : 20 mg piroksikam tiap kapsul
No. Bets :
Media Disolusi : 900 ml HCl 0,1 N
Tipe Alat : Tipe 1 keranjang
Waktu : 45 menit
Kecepatan Rotasi : 100 rpm
Panjang Gelombang : ± 273 nm
Persyaratan (Q) : Harus larut tidak kurang dari 75% dari jumlah yang
tertera pada etiket
Bobot Baku (Bb) : 10,232 mg
Faktor Pengenceran Larutan Baku (Fb) : 2500 ml
Faktor Pengenceran Larutan Uji (Fu) : 3,33 ml
Kandungan Gliseril Guaiakolat pada etiket (Ke) : 20 mg
Absorbansi Larutan Baku (Ab) : 0,3165
Lanjutan Lampiran 1
Perhitungan:
a. Faktor perkalian (Fk)
FK = �� ��������
�������� � 100%
Keterangan : V = volume tabung vessel disolusi
Fu = faktor pengenceran uji
Bb = bobot baku
Kb = kemurnian baku
Fb = faktor pengenceran baku
Ab = absorbansi baku
Kc = keterangan etiket
b. % Zat aktif terlarut (Dx)
% Dx = Fk x Au
Keterangan : Fk = faktor perkalian
Au = absorbansi uji
Lampiran 2.
Gambar Alat Uji Disolusi