LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI BADAN PENGAWAS OBAT DAN MAKANAN
DEPUTI I BIDANG PENGAWASAN PRODUK TERAPETIK
DAN NARKOTIKA, PSIKOTROPIKA, DAN ZAT ADIKTIF
JALAN PERCETAKAN NEGARA NO. 23 JAKARTA PUSAT
PERIODE 1 - 24 APRIL 2014
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
ALWI SEMAR LOPUTRA, S. Farm.
1306343340
ANGKATAN LXXVIII
FAKULTAS FARMASI PROGRAM PROFESI APOTEKER
UNIVERSITAS INDONESIA
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI BADAN PENGAWAS OBAT DAN MAKANAN
DEPUTI I BIDANG PENGAWASAN PRODUK TERAPETIK
DAN NARKOTIKA, PSIKOTROPIKA, DAN ZAT ADIKTIF
JALAN PERCETAKAN NEGARA NO. 23 JAKARTA PUSAT
PERIODE 1-24 APRIL 2014
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
Diajukan sebagai salah satu syarat untuk memperoleh gelar profesi apoteker
ALWI SEMAR LOPUTRA, S.Farm.
1306343340
ANGKATAN LXXVIII
FAKULTAS FARMASI PROGRAM PROFESI APOTEKER
UNIVERSITAS INDONESIA JUNI 2014
Segala puji syukur kehadirat Tuhan yang Maha Esa, karena rahmat dan karunia-Nya penulis dapat menyusun dan menyelesaikan laporan Praktek Kerja Profesi Apoteker (PKPA) di Badan POM khususnya di Direktorat Pengawasan Distribusi Produk Terapetik dan Perbekalan Kesehatan Rumah Tangga, yang telah berlangsung mulai tanggal 1 sampai 24 April 2014 sebagai salah satu syarat untuk memperoleh gelar Apoteker pada Program Pendidikan Profesi Apoteker di Universitas Indonesia.
Pada kesempatan ini, penulis ingin mengucapkan terima kasih secara khusus kepada Ibu Dra. Warta Br. Ginting, Apt. selaku pembimbing PKPA di Badan POM khususnya di Direktorat Distribusi PT dan PKRT dan Kepala Seksi Analisis Risiko PT dan PKRT serta Bapak Harmita, Apt. selaku pembimbing PKPA dari Fakultas Farmasi Universitas Indonesia yang telah berkenan meluangkan waktunya untuk memberikan bimbingan dan pengarahan selama PKPA.
Penulis juga ingin mengucapkan terima kasih kepada:
1. Bapak Dr. Mahdi Jufri, M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas Indonesia.
2. Bapak Dr. Hayun, Apt. M.Si, selaku Ketua Program Pendidikan Profesi Apoteker Fakultas Farmasi Universitas Indonesia.
3. Dr. Roy A. Sparringa, M. App. Sc selaku Kepala Badan POM, yang telah memberikan kesempatan kepada penulis untuk melakukan PKPA di Badan POM.
4. Panitia Pelaksanaan PKPA di Badan POM.
5. Dra. Ratna Irawati, Apt., M.Kes. selaku Direktur Pengawasan Distribusi PT dan PKRT atas kesempatan yang diberikan kepada penulis untuk melaksanakan PKPA di Direktorat Pengawasan Distribusi PT dan PKRT. 6. Dra. Eka Purnamasari, Apt., MKM selaku Kepala Sub Direktorat Inspeksi
dan Sertifikasi Sarana Distribusi PT dan PKRT, Dra. Yulia Purwarini, Apt., M.Epid. selaku Kepala Sub Direktorat Pengawasan Promosi dan Penandaan
7. Teti Hartati, S.Si., Apt. selaku Kepala Seksi Inspeksi Sarana Distribusi PT dan PKRT, Murti Komaladewi, S.Si., Apt. selaku Kepala Seksi Sertifikasi Sarana Distribusi PT dan PKRT, Priharika Septyowati, S.Si., Apt., MKM. Selaku Kepala Seksi Penanggulangan Produk Ilegal, drg. Indah Ratnasari selaku Kepala Seksi Pengawasan Promosi PT dan PKRT, Dra. Erliza, Apt. selaku Kepala Seksi Pengawasan Penandaan PT dan PKRT, Dra. Umma Latifah, Apt. selaku Kepala Seksi Tata Operasional, Megrina Dian Agustin, dan S.Si., Apt. selaku Kepala Seksi Surveilan PT dan PKRT.
8. Seluruh staff Direktorat Pengawasan Distribusi PT dan PKRT yang telah membimbing dan memberikan ilmu kepada penulis selama pelaksanaan PKPA.
9. Bapak dan Ibu staf pengajar beserta segenap karyawan Fakultas Farmasi Universitas Indonesia.
10. Rekan-rekan Program Profesi Apoteker Universitas Indonesia angkatan LXXVIII atas kebersamaan dan dukungan selama menempuh pendidikan. 11. Semua pihak yang tidak dapat disebutkan satu persatu yang telah membantu
secara langsung maupun tidak langsung dalam penulisan laporan ini.
Penulis menyadari bahwa dalam pembuatan laporan ini masih terdapat banyak kekurangan dan kesalahan. Oleh karena itu, kami sangat mengharapkan kritik dan saran yang bersifat membangun. Akhir kata, kami berharap semoga pengetahuan dan pengalaman yang telah diperoleh selama PKPA ini dapat bermanfaat.
Penulis 2014
Nama : Alwi Semar Loputra Program Studi : Profesi Apoteker
Judul : Laporan Praktek Kerja Profesi Apoteker Di Badan Pengawas Obat dan Makanan Deputi I Bidang Pengawasan Produk Terapetik dan Narkotika, Psikotropika, dan Zat Adiktif Jalan Percetakan Negara No. 23 Jakarta Pusat Periode 1 - 24 April 2014
Praktek Kerja Profesi Apoteker di Badan Pengawas Obat dan Makanan bertujuan agar mahasiswa program profesi apoteker dapat (1) Meningkatkan pemahaman tentang peran dan tanggung jawab apoteker di dalam lembaga pemerintahan, (2) Membekali calon Apoteker agar memiliki wawasan, pengetahuan, keterampilan dan pengalaman praktis untuk melakukan pekerjaan kefarmasian di lembaga pemerintahan, dan (3) Meningkatkan dan melatih keterampilan komunikasi dan interaksi dengan rekan sejawat. Selain itu, pembuatan tugas khusus bertujuan agar mahasiswa program profesi apoteker dapat (1) Menelusuri penyebab peredaran obat palsu di Indonesia berdasarkan aspek distribusi, (2) Mengetahui dan memahami penerapan Cara Distribusi Obat yang Baik, khususnya dalam rantai distribusi obat, dan (3) Memahami peran dan tanggung jawab apoteker dalam pendistribusian obat.
Kata kunci : praktek kerja profesi apoteker, Badan Pengawas Obat dan Makanan, Cara Distribusi Obat yang Baik, apoteker, rantai distribusi obat, penyimpanan obat, obat palsu. xvi+ 90 halaman : 2 gambar, 6 lampiran
Name : Alwi Semar Loputra
Study Program : Apothecary Professional Program
Title : Report of Apothecary Internship at National Agency Drug and Food Control Deputy I of Therapeutic and Narcotic, Psychotropic, and Addictive Compound Product Percetakan Negara Street No. 23 Central Jakarta 1 - 24 April 2014 Period
Pharmacist Internship at National Agency Drug and Food Control aims to apothecary professional program student can get the information about (1) Improve understanding about roles and responsibilities of an apothecary at government institution, (2) To prepare the pharmacist trainee in order to have a knowledge, soft skill and practical experience to do the pharmacy’s job at government institution, and (3) To improve and training communication and interaction skills with colleagues. Moreover, special assignment was made in order to apothecary professional program student can get the information about (1) To explore the cause of counterfeit drugs distribution in Indonesia based in distribution aspect, (2) To know and understand about Good Distribution Practice, especially in drug distribution chain supply, and (3) To understand about roles and responsibilities of apothecary in drug distribution.
Keywords : apothecary professional program, National Agency Drug and Food Control, Good Distribution Practice, apothecary, drug distribution chain supply, drug logistic, drug
counterfeit.
xvi+ 90 pages : 2 pictures, 6 appendix Bibliography : 18 (2001-2013)
HALAMAN JUDUL ... i
SURAT PERNYATAAN BEBAS PLAGIARISME ... ii
HALAMAN PERNYATAAN ORISINALITAS ...iii
HALAMAN PENGESAHAN ... v
KATA PENGANTAR ... v
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS ... vii
ABSTRAK ...viii
ABSTRACT ... ix
DAFTAR ISI ... x
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ...xiii
1. PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan ... 2
2. TINJAUAN UMUM 2.1 Gambaran Umum Badan POM RI ... 4
2.2 Visi dan Misi Badan POM ... 4
2.2.1 Visi ... 4
2.2.2 Misi ... 4
2.3 Tugas dan Fungsi Badan POM ... 5
2.4 Kewenangan Badan POM ... 5
2.5 Budaya Organisasi Badan POM ... 6
2.6 Struktur Organisasi Badan POM ... 6
2.7 Prinsip Dasar Sistem Pengawasan Obat dan Makanan Badan POM (SisPOM) ... 12
2.8 Kerangka Konsep SisPOM ... 12
2.9 Kebijakan Strategis Badan POM ... 13
2.10 Target Kinerja Badan POM ... 14
3. TINJAUAN KHUSUS 3.1 Struktur Organisasi ... 16
3.2 Tugas Pokok dan Fungsi ... 16
3.3 Sub Direktorat Inspeksi dan Sertifikasi Distribusi PT dan PKRT ... 17
3.3.1 Seksi Inspeksi Sarana Distribusi PT dan PKRT ... 18
3.3.2 Seksi Sertifikasi Sarana Distribusi PT dan PKRT ... 18
3.3.3 Seksi Penanggulangan Produk Ilegal ... 18
3.4 Sub Direktorat Pengawasan Promosi dan Penandaan PT dan PKRT ... 18
3.4.1 Seksi Pengawasan Promosi PT dan PKRT ... 19
3.4.2 Seksi Pengawasan Penandaan PT dan PKRT ... 19
3.4.3 Seksi Tata Operasional ... 20
3.5 Sub Direktorat Surveilan dan Analisis Risiko PT dan PKRT ... 20
4. HASIL DAN PEMBAHASAN
4.1 Sub Direktorat Inspeksi dan Sertifikasi Distribusi PT dan PKRT ... 22 4.2 Sub Direktorat Pengawasan Promosi dan Penandaan PT dan PKRT ... 26 4.3 Sub Direktorat Surveilan dan Analisis Risiko PT dan PKRT ... 27 5. PENUTUP
5.1 Kesimpulan ... 33 5.2 Saran ... 34 DAFTAR ACUAN ... 35
Lampiran 1. Struktur organisasi Badan POM RI ... 37 Lampiran 2. Struktur organisasi Direktorat Pengawasan Distribusi PT dan
PKRT ... 38 Lampiran 3. Form pelaporan efek samping obat ... 39
1.1 Latar Belakang
Indonesia merupakan salah satu negara berkembang yang terus menerus berusaha untuk memajukan kesejahteraan masyarakat melalui pembangunan yang menyeluruh, terarah dan terpadu di segala bidang, salah satunya adalah di bidang kesehatan. Tujuan utama pembangunan di bidang kesehatan adalah tercapainya derajat kesehatan yang optimal bagi masyarakat Indonesia dengan menyediakan obat-obatan yang bermutu tinggi dengan harga yang relatif terjangkau bagi masyarakat luas sehingga pada akhirnya dapat memberikan pelayanan kesehatan yang maksimal bagi masyarakat Indonesia.
Untuk melindungi konsumen dari kompetisi industri dalam penyediaan produk, maka pemerintah Indonesia harus memiliki Sistem Pengawasan Obat dan Makanan (SisPOM) yang efektif dan efisien yang mampu mendeteksi, mencegah, dan mengawasi produk-produk obat dan makanan termasuk untuk melindungi keamanan, keselamatan, dan kesehatan konsumen baik di dalam maupun di luar negeri. Berdasarkan Keputusan Presiden Republik Indonesia No.103 tahun 2001, dibentuklah Badan Pengawas Obat dan Makanan Republik Indonesia (Badan POM RI) sebagai institusi pemerintah yang secara resmi mengawasi obat dan makanan di Indonesia. Badan POM ditetapkan sebagai Lembaga Pemerintah Non Kementerian (LPNK) yang bertanggung jawab kepada Presiden dan dikoordinasi oleh Menteri Kesehatan.
Peranan Badan POM RI haruslah menyeluruh terhadap berbagai produk yang dapat mempengaruhi atau membahayakan konsumen. Untuk memudahkan dalam pelaksanaan fungsinya terdapat tiga kedeputian, yaitu Deputi Bidang Pengawasan Produk Terapetik dan NAPZA (Deputi I); Deputi Bidang Pengawasan Obat Tradisional, Kosmetik dan Produk Komplemen (Deputi II); dan Deputi Bidang Pengawasan Keamanan Pangan dan Bahan Berbahaya (Deputi III). Sebagai institusi yang melakukan pengawasan di bidang obat dan makanan, Badan POM RI memerlukan sumber daya manusia yang tepat dan sesuai dengan fungsinya. Terkait fungsi pengawasan terhadap
produk kesehatan terrmasuk obat, maka dibutuhkan sumber daya manusia yang memahami tentang ilmu kefarmasian, yaitu apoteker. Disini Apoteker berperan sebagai tenaga kesehatan yang memiliki dasar pengetahuan di bidang obat dan makanan, serta diharapkan memberikan kontribusi yang positif bagi perkembangan industri obat dan makanan khususnya. Sebagai salah satu bentuk tanggung jawab sosial kepada masyarakat, apoteker dapat berperan dalam hal penyusunan kebijakan atau regulasi serta pelaksanaan pengawasan terhadap produk-produk kesehatan yang beredar di masyarakat. Hal tersebut dilakukan untuk melindungi masyarakat dari produk-produk kesehatan yang tidak memenuhi syarat.
Menyadari pentingnya hal tersebut, maka Program Profesi Apoteker bekerja sama dengan Badan POM RI menyelenggarakan Praktek Kerja Profesi Apoteker (PKPA) yang diikuti oleh mahasiswa Program Profesi Apoteker yang berasal dari Universitas Indonesia (UI), Institut Teknologi Bandung (ITB), Universitas Padjajaran (UNPAD), Universitas Pancasila (UP), Institut Sains dan Teknologi Nasional (ISTN), dan Universitas Muhammadiyah Prof. DR. Hamka (UHAMKA). Pada Praktek Kerja Profesi Apoteker (PKPA) ini, penulis mendapat tugas untuk mengamati langsung dan mempelajari kegiatan di Direktorat Pengawasan Distribusi Produk Terapetik dan PKRT, yang berada di bawah Deputi I Bidang Pengawasan Produk Terapetik dan Narkotik, Psikotropika dan Zat Adiktif di Badan POM RI.
Kegiatan PKPA ini dilaksanakan di Badan POM RI pada tanggal 1 - 24 April 2014. Dengan demikian diharapkan mahasiswa calon apoteker mampu memahami dan menerapkan ilmu yang telah didapatkan setelah pelaksanaan PKPA.
1.2 Tujuan
Tujuan dari Praktek Kerja Profesi Apoteker di Badan POM RI bagi mahasiswa program profesi apoteker adalah:
a. Meningkatkan pemahaman tentang peran, fungsi dan tanggung jawab apoteker di dalam lembaga pemerintahan.
b. Membekali calon Apoteker agar memiliki wawasan, pengetahuan, keterampilan dan pengalaman praktis untuk melakukan pekerjaan kefarmasian di lembaga pemerintahan.
c. Meningkatkan dan melatih keterampilan komunikasi dan interaksi dengan rekan sejawat.
d. Memberi kesempatan kepada calon apoteker untuk melihat dan mempelajari strategi dan kegiatan-kegiatan yang dapat dilakukan dalam rangka menjalankan tugas di pemerintahan.
e. Peserta PKPA dapat memahami dan menjelaskan peran dan fungsi Balai Besar atau Balai Pengawas Obat dan Makanan.
f. Peserta PKPA dapat memahami dan menjelaskan kegiatan Direktorat Pengawasan Distribusi Produk Terapetik (PT) dan Perbekalan Kesehatan Rumah Tangga (PKRT) Badan Pengawas Obat dan Makanan Jakarta.
TINJAUAN UMUM
2.1 Gambaran Umum Badan POM RI
Berdasarkan Keputusan Presiden no. 103 tahun 2001, Badan pengawas Obat dan Makanan (Badan POM) ditetapkan sebagai lembaga Pemerintah Non Departemen (LPND) yang bertanggung jawab kepada presiden dan di koordinasikan dengan Menteri Kesehatan dan Kesejahteraan Sosial. Badan POM mempunyai kewajiban untuk melaksanakan tugas pemerintahan dibidang pengawasan obat dan makanan sesuai dengan ketentuan perundang-undangan yang berlaku. Selanjutnya terjadi perubahan sesuai dengan Peraturan Presiden Republik Indonesia no. 64 tahun 2005 yang menyatakan Badan POM berkoordinasi dengan Menteri Kesehatan. Selanjutnya, LPND berubah menjadi Lembaga Pemerintah Non Kementerian (LPNK) berdasarkan UU RI No.39 tahun 2008. Struktur organisasi Badan POM dapat dilihat pada lampiran 1. Badan POM telah memperoleh sertifikat ISO 9001; 2008 yang merupakan standar Internasional yang mengatur menajemen mutu (Quality manajemen System).
2.2 Visi dan Misi Badan POM
2.2.1 Visi
Badan POM memiliki visi menjadi institusi terpercaya yang diakui secara internasional di bidang pengawasan obat dan makanan untuk melindungi kesehatan masyarakat.
2.2.2 Misi
a. Melakukan pengawasan Pre market dan Post Market berstandar Internasional.
b. Menerapkan sistem manajemen mutu secara konsisten.
c. Mengoptimalkan kemitraan dengan pemangku kepentingan di berbagai lini. d. Memberdayakan masyarakat agar mampu melindungi diri dari obat dan
makanan yang berisiko terhadap kesehatan.
2.3 Tugas dan Fungsi Badan POM
Tugas Badan POM adalah melaksanakan tugas pemerintah di bidang pengawasan obat dan makanan sesuai dengan ketentuan perundang-undangan yang berlaku. Dalam melaksanakan tugasnya tersebut, Badan POM menyelenggarakan fungsi sebagai berikut :
a. Pengkajian dan penyusunan kebijakan Nasional di bidang pengawasan obat dan makanan.
b. Pelaksanaan kebijakan tertentu di bidang pengawasan obat dan makanan. c. Koordinasi kegiatan fungsional dalam pelaksanaan tugas Badan POM. d. Pemerintah memberikan bimbingan dan pembinaan terhadap kegiatan instansi
Pemerintah di bidang Pengawasan Obat dan Makanan.
e. Penyelenggaraan, pembinaan dan pelayanan administrasi umum di bidang perencanaan umum, ketatausahaan, organisasi dan tatalaksana kepegawaian, keuangan, kearsipan, persandian, perlengkapan dan rumah tangga.
2.4 Kewenangan Badan POM
Dalam menyelenggarakan fungsinya, Badan POM memiliki kewenangan sebagai berikut :
a. Penyusunan rencana nasional secara makro di bidang pengawasan obat dan makanan.
b. Perumusan kebijakan di bidang pengawasan obat dan makanan untuk mendukung pembangunan secara makro.
c. Penetapan sistem informasi di bidang pengawasan obat dan makanan.
d. Penetapan persyaratan penggunaan bahan tambahan (zat adiktif) tertentu untuk makanan dan penetapan pedoman pengawasan peredaran obat dan makanan.
e. Pemberian izin dan pengawasan peredaran obat serta pengawasan industri farmasi.
f. Penetapan pedoman penggunaan, konversi, pengembangan, dan pengawasan obat tradisional.
2.5 Budaya Organisasi Badan POM
Budaya organisasi merupakan nilai-nilai luhur yang diyakini serta harus di hayati dan diamalkan oleh seluruh anggota organisasi dalam melaksanakan tugasnya. Agar Badan Pengawas Obat dan Makanan menjadi organisasi yang efektif dan efisien, budaya organisasi Badan POM dikembangkan dengan nilai-nilai dasar sebagai berikut:
a. Profesionalisme (professionalism)
Menegakkan profesionalisme dengan integritas, objektivitas, ketekunan dan komitmen yang tinggi.
b. Kredibilitas (credibility)
Memiliki kredibilitas yang diakui oleh masyarakat luas, nasional dan internasional.
c. Kecepatan (speed)
Cepat dan tanggap dalam bertindak mengatasi masalah. d. Kerjasama (team work)
Mengutamakan kerjasama tim. e. Inovatif (Inovative)
Mampu melakukan pembaharuan sesuai ilmu pengetahuan dan teknologi terkini.
2.6. Struktur Organisasi Badan POM
Berdasarkan Keputusan Presiden No. 103 tahun 2001 yang kemudian diubah dengan Peraturan Presiden No. 64 tahun 2005, Badan POM ditetapkan sebagai Lembaga Pemerintah Non Kementerian (LPNK) yang dibentuk untuk melaksanakan tugas kepemerintahan tertentu dari presiden dan bertanggung jawab kepada presiden dan dikoordinasikan dengan Menteri Kesehatan. Badan POM dikepalai oleh pejabat setingkat menteri.
Secara struktural komponen Badan POM terdiri atas Kepala; Sekretariat Utama; tiga Deputi, yaitu Deputi I yang bertanggung jawab dalam Bidang Pengawasan Produk Terapetik dan NAPZA, Deputi II yang bertanggung jawab dalam Bidang Pengawasan Obat Tradisional, Kosmetik dan Produk Komplemen, serta Deputi III yang bertanggung jawab dalam Bidang Pengawasan Keamanan
Pangan dan Bahan Berbahaya; serta memiliki empat pusat, yaitu Pusat Pengujian Obat dan Makanan Nasional, Pusat Penyidikan Obat dan Makanan, Pusat Riset Obat dan Makanan, dan Pusat Informasi Obat dan Makanan. Bagan lengkap struktur organisasi Badan POM RI dapat dilihat pada Lampiran 1.
a. Kepala Badan POM
Organisasi Badan POM dipimpin oleh seorang kepala yang bertugas :
1. Memimpin Badan POM sesuai dengan ketentuan peraturan perundang-undangan.
2. Menyiapkan kebijakan nasional dan kebijakan umum sesuai dengan tugas Badan POM.
3. Menetapkan kebijakan teknis pelaksanaan tugas Badan POM yang menjadi tanggung jawabnya.
4. Membina dan melaksanakan kerja sama dengan instansi dan organisasi yang lain.
b. Sekretariat Utama
Sekretariat Utama bertugas melaksanakan koordinasi perencanaan strategis dan organisasi, pengembangan pegawai, pengelolaan keuangan, bantuan hukum, hubungan masyarakat dan kerjasama internasional, serta akses masyarakat terhadap Badan POM melalui Unit Layanan Pengaduan Konsumen (ULPK) yang menerima dan menindaklanjuti berbagai pengaduan dari masyarakat di bidang obat dan makanan. Di samping itu, dilakukan pembinaan administratif beberapa pusat yang ada di lingkungan Badan POM dan unit-unit pelaksana teknis yang tersebar di seluruh Indonesia. Sekretariat Utama terdiri atas:
1. Biro Perencanaan dan Keuangan 2. Biro Kerjasama Luar Negeri
3. Biro Hukum dan Hubungan Masyarakat 4. Biro Umum
Dalam melaksanakan tugasnya, Sekretariat Utama menyelenggarakan fungsi:
a. Pengkoordinasian, sinkronisasi dan integrasi perencanaan, penganggaran, penyusunan pelaporan, pengembangan pegawai termasuk pendidikan dan pelatihan serta perumusan kebijakan teknis di lingkungan Badan POM. b. Pengkoordinasian, sinkronisasi dan integrasi penyusunan peraturan
perundang-undangan, kerjasama luar negeri, hubungan antar lembaga kemasyarakatan dan bantuan hukum, terkait dengan tugas Badan POM. c. Pembinaan dan pelayanan administrasi ketatausahaan, organisasi dan tata
laksana, kepegawaian, keuangan, kearsipan, dan perlengkapan rumah tangga.
d. Pembinaan dan pengendalian terhadap pelaksanaan kegiatan pusat-pusat dan unit-unit pelaksana teknis di lingkungan Badan POM.
e. Pelaksana tugas lain yang ditetapkan oleh kepala, sesuai dengan bidang tugasnya.
Sekretariat Utama Badan POM secara administrasi membina pelaksanaan tugas sehari-hari dari Pusat Pengujian Obat dan Makanan Nasional, Pusat Penyidikan Obat dan Makanan, Pusat Riset Obat dan Makanan dan Pusat Informasi Obat dan Makanan.
c. Deputi Bidang Pengawasan Produk Terapetik dan NAPZA
Deputi Bidang Pengawasan Produk Terapetik dan Narkotika, Psikotropika, dan Zat Adiktif (NAPZA) mempunyai tugas melaksanakan perumusan kebijakan di bidang Pengawasan Produk Terapetik, Narkotika, Psikotropika, dan Zat Adiktif (NAPZA).
Deputi Bidang Pengawasan Produk Terapetik dan NAPZA, terdiri dari Direktorat Penilaian Obat dan Produk Biologi; Direktorat Pengawasan Produksi Produk Terapetik dan PKRT; Direktorat Standardisasi Produk Terapetik dan PKRT; Direktorat Pengawasan Distribusi Produk Terapetik dan PKRT; dan Direktorat Pengawasan Narkotika, Psikotropika dan Zat Adiktif.
d. Deputi Bidang Pengawasan Obat Tradisional, Kosmetik dan Produk Komplemen
Deputi Bidang Pengawasan Obat Tradisional, Kosmetik dan Produk Komplemen memiliki tugas, yaitu melaksanakan perumusan kebijakan di bidang Pengawasan Obat Tradisional, Kosmetik dan Produk Komplemen. Deputi ini terdiri dari Direktorat Penilaian Obat Tradisional, Suplemen Makanan dan Kosmetik; Direktorat Standardisasi Obat Tradisional, Kosmetik dan Produk Komplemen; Direktorat Inspeksi dan Sertifikasi Obat Tradisional, Kosmetik dan Produk Komplemen; dan Direktorat Obat Asli Indonesia. e. Deputi Bidang Pengawasan Keamanan Pangan dan Bahan Berbahaya
Deputi Bidang Pengawasan Keamanan Pangan dan Bahan Berbahaya mempunyai tugas, yaitu melaksanakan perumusan kebijakan di bidang pengawasan keamanan pangan dan bahan berbahaya. Deputi ini terdiri dari Direktorat Penilaian Keamanan Pangan; Direktorat Standardisasi Produk Pangan; Direktorat Inspeksi dan Sertifikasi Pangan; Direktorat Surveilan dan Penyuluhan Keamanan Pangan; dan Direktorat Pengawasan Produk dan Bahan Berbahaya.
f. Inspektorat
Inspektorat dipimpin oleh inspektur yang berada di bawah dan bertanggung jawab kepada Kepala Badan POM. Dalam pelaksanaan tugas sehari-hari, Inspektorat dibina oleh Sekretariat Utama. Inspektorat bertugas melaksanakan pengawasan fungsional di lingkungan Badan POM. Inspektorat terdiri dari Kelompok Jabatan Fungsional dan Sub Bagian Tata Usaha.
g. Pusat Pengujian Obat dan Makanan Nasional
Pusat Pengujian Obat dan Makanan Nasional (PPOMN) adalah unsur pelaksana tugas Badan POM yang berada di bawah dan bertanggung jawab kepada Kepala Badan POM. Dalam pelaksanaan tugas sehari-hari secara teknis dibina oleh Deputi dan secara administrasi dibina oleh Sekretariat Utama. PPOMN dipimpin oleh seorang Kepala dan mempunyai tugas melaksanakan pemeriksaan secara laboratorium, pengujian dan penilaian mutu produk terapetik, narkotika, psikotropika dan zat adiktif lain, alat
kesehatan, obat tradisional, kosmetik, produk komplemen, pangan dan bahan berbahaya sesuai dengan peraturan perundang-undangan yang berlaku, serta melaksanakan pembinaan mutu laboratorium pengawasan obat dan makanan.
PPOMN terdiri dari Bidang Produk Terapetik dan Bahan Berbahaya; Bidang Obat Tradisional, Kosmetik dan Produk komplemen; Bidang Pangan; Bidang Produk Biologi; Bidang Mikrobiologi; Kelompok Jabatan Fungsional; dan Sub Bagian Tata Usaha.
h. Pusat Penyidikan Obat dan Makanan
Pusat Penyidikan Obat dan Makanan (PPOM) adalah unsur pelaksana tugas Badan POM yang berada di bawah dan bertanggung jawab kepada Kepala Badan POM. Dalam pelaksanaan tugas sehari-hari secara teknis dibina oleh Deputi dan secara administrasi dibina oleh Sekretariat Utama. PPOM dipimpin oleh seorang Kepala dan mempunyai tugas untuk melaksanakan kegiatan penyelidikan dan penyidikan terhadap perbuatan melawan hukum di bidang produk terapetik, narkotika, psikotropika dan zat adiktif, obat tradisional, kosmetik dan produk komplemen, makanan serta produk sejenis lainnya.
PPOM terdiri dari Bidang Penyidikan Produk Terapetik dan Obat Tradisional; Bidang Penyidikan Makanan Bidang Penyidikan Narkotika dan Psikotropika; Kelompok Jabatan Fungsional; dan Sub Bagian Tata Usaha. i. Pusat Riset Obat dan Makanan
Pusat Riset Obat dan Makanan (PROM) adalah unsur pelaksana tugas Badan POM yang berada di bawah dan bertanggung jawab kepada Kepala Badan POM. Dalam pelaksanaan tugas sehari-hari secara teknis dibina oleh Deputi dan secara administrasi dibina oleh Sekretariat Utama. PROM dipimpin oleh seorang Kepala dan mempunyai tugas melaksanakan kegiatan di bidang riset toksikologi, keamanan pangan, dan produk terapetik.
PROM terdiri dari tiga bidang yaitu: Bidang Toksikologi; Bidang Keamanan Pangan; Bidang Produk Terapetik; Kelompok Jabatan Fungsional; dan Sub Bagian Tata Usaha.
j. Pusat Informasi Obat dan Makanan
Pusat Informasi Obat dan Makanan (PIOM) adalah unsur pelaksana tugas Badan POM yang berada di bawah dan bertanggung jawab kepada Kepala Badan POM. Dalam pelaksanaan tugas sehari-hari secara teknis dibina oleh Deputi dan secara administrasi dibina oleh Sekretariat Utama. PIOM dipimpin oleh seorang Kepala. PIOM mempunyai tugas melaksanakan kegiatan di bidang pelayanan informasi obat, informasi keracunan, dan teknologi informasi.
PIOM terdiri dari Bidang Informasi Obat; Bidang Informasi Keracunan; Bidang Teknologi Informasi; Kelompok Jabatan Fungsional; dan Sub Bagian Tata Usaha.
k. Unit Pelaksana Teknis
Organisasi Unit Pelaksana Teknis Badan POM yang merupakan unit organisasi yang melaksanakan tugas dan fungsi pengawasan obat dan makanan di wilayah kerjanya, diatur dengan Keputusan Kepala Badan POM setelah mendapat persetujuan tertulis dari Menteri yang bertanggung jawab di bidang pendayagunaan aparatur negara. Unit pelaksana teknis berada di bawah dan bertanggung jawab kepada Kepala Badan, dalam pelaksanaan tugas secara teknis dibina oleh para Deputi dan secara administrasi dibina oleh Sekretaris Utama Badan. Unit pelaksana teknis dipimpin oleh seorang Kepala.
l. Kelompok Jabatan Fungsional
Kelompok Jabatan Fungsional bertugas melakukan kegiatan sesuai dengan jabatan fungsional masing-masing berdasarkan peraturan perundang-undangan yang berlaku. Kelompok Jabatan Fungsional terdiri dari berbagai jabatan fungsional Pengawas Obat dan Makanan, Penyidik Pegawai Negeri Sipil dan jabatan fungsional lain sesuai dengan bidang keahliannya.
2.7 Prinsip Dasar Sistem Pengawasan Obat dan Makanan Badan POM (SisPOM)
Badan POM RI dalam melakukan pengawasan baik secara pre market maupun post market memiliki sistem pengawasan tersendiri, yaitu SisPOM. Prinsip dasar sistem Pengawasan Obat dan Makanan (SisPOM) tersebut adalah : a. Tindakan pengamanan cepat, tepat, akurat dan profesional.
b. Tindakan dilakukan berdasarkan atas tingkat risiko dan berbasis bukti-bukti ilmiah.
c. Lingkup pengawasan bersifat menyeluruh dan mencakup seluruh siklus proses.
d. Berskala nasional/lintas provinsi dengan jaringan kerja internasional. e. Otoritas yang menunjang penegakan supremasi hukum.
f. Memiliki jaringan laboratorium nasional yang kohesif dan kuat yang berkolaborasi dengan jaringan global.
g. Memiliki jaringan sistem informasi keamanan dan mutu produk.
2.8 Kerangka Konsep SisPOM
Pengawasan obat dan makanan memiliki aspek permasalahan berdimensi luas dan kompleks. Oleh karena itu, diperlukan sistem pengawasan yang komprehensif, semenjak awal proses suatu produk hingga produk tersebut beredar ditengah masyarakat. Untuk menekan sekecil mungkin resiko yang bisa terjadi, dilakukan SisPOM tiga lapis, yakni :
a. Sub-Sistem Pengawasan Produsen
Sistem pengawasan internal oleh produsen melalui pelaksanaan cara produksi obat yang baik (CPOB) atau good manufacturing practices (GMP) agar setiap bentuk penyimpangan dari standar mutu dapat dideteksi sejak awal. Secara hukum produsen bertanggung jawab atas keamanan produk yang dihasilkannya. Apabila terjadi penyimpangan dan pelanggaran terhadap standar yang telah ditetapkan maka produsen di kenakan sangsi, baik administratif maupun pro-justisia.
b. Sub-Sistem Pengawasan Konsumen
Sistem pengawasan oleh konsumen sendiri melalui peningkatan kesadaran dan peningkatan pengetahuan mengenai kualitas produk yang digunakannya dan cara-cara penggunaan produk yang rasional. Pengawasan oleh masyarakat sendiri sangat penting dilakukan karena pada akhirnya masyarakatlah yang mengambil keputusan untuk membeli dan menggunakan suatu produk. Konsumen dengan kesadaran dan tingkat pengetahuan yang tinggi terhadap mutu dan kegunaan suatu produk, di satu sisi dapat membentengi dirinya sendiri terhadap penggunaan produk-produk yang tidak memenuhi syarat dan tidak dibutuhkan sedang pada sisi yang lain akan mendorong produsen untuk ekstra hati-hati dalam menjaga kualitasnya. c. Sub-Sistem Pengawasan Pemerintah/Badan POM
Sistem pengawasan oleh pemerintah melalui pengaturan dan standardisasi, penilaian keamanan, khasiat dan mutu produk sebelum diijinkan beredar di Indonesia, Inspeksi, pengujian sampel dan pengujian laboratorium produk yang beredar serta peringatan kepada publik yang didukung penegakan hukum. Untuk meningkatkan kesadaran dan pengetahuan masyarakat konsumen terhadap mutu, khasiat dan keamanan produk maka pemerintah juga melaksanakan kegiatan komunikasi, informasi dan edukasi.
2.9 Kebijakan Strategis Badan POM
Memenuhi tantangan perubahan lingkungan strategis yang kompleks dan dinamis, Badan POM mewujudkan visi dan misinya melalui dua kebijakan strategis, yaitu pemantapan infrastruktur dan revitalisasi program Badan POM. a. Pemantapan Infrastruktur Badan POM
Agar mampu melaksanakan tugas dan fungsinya secara efektif dan efisien, serta memiliki kemampuan beradaptasi dan berinovasi sesuai dengan kebutuhan lingkungan yang berubah dengan cepat, perlu dilakukan transformasi mendasar, mencakup antara lain:
1. Mental model dan sistem berpikir sumber daya manusia. 2. Sistem operasi yang terkendali.
3. Struktur pengambilan keputusan yang mampu menciptakan akuntabilitas publik.
4. Peraturan perundang-undangan sesuai dengan tuntutan perkembangan. b. Revitalisasi Program Badan POM
Kebijakan revitalisasi Badan POM diarahkan terutama pada kegiatan prioritas yang memiliki efek sinergi dan daya ungkit yang besar terhadap tujuan perlindungan masyarakat luas, mencakup antara lain:
1. Evaluasi mutu, keamanan dan khasiat produk berisiko oleh tenaga ahli berdasarkan bukti-bukti ilmiah.
2. Standardisasi mutu produk untuk melindungi konsumen sekaligus meningkatkan daya saing menghadapi era pasar bebas.
3. Pelaksanaan cara-cara produksi dan distribusi yang baik sebagai built in control.
4. Operasi pemeriksaan dan penyidikan terhadap produksi, distribusi dan peredaran narkotik, psikotropik dan prekursor serta produk-produk ilegal. 5. Monitoring iklan dengan melibatkan peran aktif masyarakat dan
organisasi profesi.
6. Komunikasi, informasi dan edukasi kepada masyarakat untuk meningkatkan kesadaran dan pengetahuan terhadap mutu, khasiat dan keamanan produk.
7. Bimbingan teknis terutama kepada industri kecil menengah yang berfokus pada peningkatan kualitas produk.
2.10 Target Kinerja Badan POM
Target kinerja dari Badan POM yaitu:
a. Terkendalinya penyaluran produk terapetik dan NAPZA.
b. Terkendalinya mutu, keamanan dan khasiat/kemanfaatan produk obat dan makanan termasuk klaim pada label dan iklan di peredaran.
c. Tercegahnya resiko penggunaan bahan kimia berbahaya sebagai akibat pengelolaan yang tidak memenuhi persyaratan.
e. Peningkatan kapasitas organisasi yang didukung dengan kompetensi dan keterampilan personil yang memadai.
f. Terwujudnya komunikasi yang efektif dan saling menghargai antar sesama dan pihak terkait.
TINJAUAN KHUSUS
3.1 Struktur Organisasi
Direktorat Pengawasan Distribusi Produk Terapetik (PT) dan Perbekalan Kesehatan Rumah Tangga (PKRT) berada di dalam Deputi I Bidang Pengawasan Produk Terapetik dan Narkotika, Psikotoprika, dan Zat Adiktif. Direktorat Pengawasan Distribusi PT dan PKRT membawahi 3 Sub Direktorat, yaitu:
a. Sub Direktorat Inspeksi dan Sertifikasi Distribusi PT dan PKRT. b. Sub Direktorat Pengawasan Promosi dan Penandaan PT dan PKRT. c. Sub Direktorat Surveilan dan Analisis Risiko PT dan PKRT.
3.2 Tugas Pokok dan Fungsi
Berdasarkan Keputusan Kepala Badan POM RI Nomor: HK.00.05.21.4231 Tahun 2004 Tentang Perubahan Atas Keputusan Kepala Badan Pengawas Obat Dan Makanan Nomor 02001/SK/KBPOM Tahun 2001 Tentang Organisasi dan tata kerja Badan Pengawas Obat dan Makanan Pasal 130, bahwa Direktorat Pengawasan Distribusi PT dan PKRT mempunyai tugas penyiapan perumusan kebijakan teknis, dan penyusunan pedoman, standar, kriteria dan prosedur, serta pelaksanaan pengendalian, bimbingan teknis dan evaluasi di bidang pengawasan distribusi PT dan PKRT.
Adapun fungsi Direktorat Pengawasan Distribusi PT dan PKRT sebagai berikut :
a. Penyusunan rencana dan program pengawasan distribusi PT dan PKRT. b. Koordinasi kegiatan fungsional pelaksanaan kebijakan teknis di bidang
pengawasan distribusi PT dan PKRT.
c. Pelaksanaan penyiapan bahan perumusan kebijakan teknis, dan penyusunan pedoman, standar, kriteria dan prosedur, serta pelaksanaan inspeksi dan sertifikasi distribusi PT dan PKRT.
d. Pelaksanaan penyiapan bahan perumusan kebijakan teknis, dan penyusunan pedoman, standar, kriteria dan prosedur, serta pelaksanaan pengawasan promosi dan penandaan PT dan PKRT.
e. Pelaksanaan penyiapan bahan perumusan kebijakan teknis, dan penyusunan pedoman, standar, kriteria dan prosedur, serta pelaksanaan surveilan dan analisis risiko PT dan PKRT.
f. Evaluasi dan penyusunan laporan pengawasan distribusi PT dan PKRT. g. Pelaksanaan urusan tata operasional di lingkungan Direktorat.
3.3 Sub Direktorat Inspeksi dan Sertifikasi Distribusi PT dan PKRT Sub Direktorat Inspeksi dan Sertifikasi Distribusi PT dan PKRT mempunyai tugas melaksanakan penyiapan bahan perumusan kebijakan teknis, dan penyusunan pedoman, standar, kriteria dan prosedur serta pelaksanaan inspeksi dan sertifikasi distribusi PT dan PKRT, dan penanggulangan produk ilegal.
Dalam melaksanakan tugas, Sub Direktorat Inspeksi dan Sertifikasi Distribusi PT dan PKRT menyelenggarakan fungsi :
a. Penyusunan rencana dan program inspeksi dan sertifikasi sarana distribusi PT dan PKRT.
b. Pelaksanaan penyiapan bahan perumusan kebijakan teknis, dan penyusunan pedoman, standar, kriteria dan prosedur, serta pelaksanaan inspeksi sarana distribusi PT dan PKRT dan penanggulangan produk ilegal.
c. Pelaksanaan penyiapan bahan perumusan kebijakan teknis, dan penyusunan pedoman, standar, kriteria dan prosedur, serta pelaksanaan sertifikasi sarana distribusi PT dan PKRT.
d. Pelaksanaan penyiapan bahan perumusan kebijakan teknis, dan penyusunan pedoman, standar, kriteria dan prosedur, serta pelaksanaan penanggulangan produk ilegal.
e. Evaluasi dan penyusunan laporan inspeksi dan sertifikasi sarana distribusi PT dan PKRT, dan penanggulangan produk ilegal.
Sub Direktorat Inspeksi dan Sertifikasi Distribusi PT dan PKRT terdiri dari :
a. Seksi Inspeksi Sarana Distribusi PT dan PKRT; b. Seksi Sertifikasi Sarana Distribusi PT dan PKRT; c. Seksi Penanggulangan Produk Ilegal.
3.3.1 Seksi Inspeksi Sarana Distribusi PT dan PKRT
Seksi Inspeksi Sarana Distribusi PT dan PKRT mempunyai tugas melakukan penyiapan bahan perumusan kebijakan teknis, dan penyusunan rencana dan program, pedoman, standar, kriteria dan prosedur, evaluasi dan laporan di bidang inspeksi sarana distribusi PT dan PKRT. Contoh kegiatan yang dilakukan oleh Seksi Inspeksi Sarana Distribusi PT dan PKRT adalah melakukan Audit Pedagang Besar Farmasi (PBF).
3.3.2 Seksi Sertifikasi Sarana Distribusi PT dan PKRT
Seksi Sertifikasi Sarana Distribusi PT dan PKRT mempunyai tugas melakukan penyiapan bahan perumusan kebijakan teknis, dan penyusunan rencana dan program, pedoman, standar, kriteria dan prosedur, evaluasi dan laporan di bidang sertifikasi sarana distribusi produk terapetik. Contoh kegiatan yang dilakukan oleh Seksi Sertifikasi Sarana Distribusi PT dan PKRT adalah menerbitkan sertifikat CDOB untuk PBF yang mengajukan permohonan sertifikasi.
3.3.3 Seksi Penanggulangan Produk Ilegal
Seksi Penanggulangan Produk Ilegal mempunyai tugas melakukan penyiapan bahan perumusan kebijakan teknis, dan penyusunan rencana dan program, pedoman, standar, kriteria dan prosedur, evaluasi dan laporan di bidang penanggulangan produk ilegal.
3.4 Sub Direktorat Pengawasan Promosi dan Penandaan PT dan PKRT
Subdirektorat Pengawasan Promosi dan Penandaan PT dan PKRT mempunyai tugas melaksanakan penyiapan bahan perumusan kebijakan teknis, dan penyusunan pedoman, standar, kriteria dan prosedur serta pelaksanaan pengawasan promosi dan penandaan PT dan PKRT.
Dalam melaksanakan tugas, Sub Direktorat Pengawasan Promosi dan Penandaan PT dan PKRT menyelenggarakan fungsi :
a. Penyusunan rencana dan program pengawasan promosi dan penandaan PT dan PKRT.
b. Pelaksanaan penyiapan bahan perumusan kebijakan teknis, dan penyusunan pedoman, standar, kriteria dan prosedur, serta pelaksanaan pengawasan promosi PT dan PKRT.
c. Pelaksanaan penyiapan bahan perumusan kebijakan teknis, dan penyusunan pedoman, standar, kriteria dan prosedur, serta pelaksanaan pengawasan penandaan PT dan PKRT.
d. Evaluasi dan penyusunan laporan pengawasan promosi dan penandaan PT dan PKRT.
e. Pelaksanaan urusan tata operasional di lingkungan Direktorat.
Contoh kegiatan yang dilakukan oleh Sub Direktorat Pengawasan Promosi dan Penandaan PT dan PKRT adalah melakukan pre-audit dan post-audit terhadap iklan produk terapetik yang beredar serta mengawasi promosi produk terapetik tertentu di dalam jurnal ilmiah dan mengawasi label serta brosur produk terapetik. Sub Direktorat Pengawasan Promosi dan Penandaan PT dan PKRT terdiri dari :
a. Seksi Pengawasan Promosi PT dan PKRT; b. Seksi Pengawasan Penandaan PT dan PKRT; c. Seksi Tata Operasional.
3.4.1 Seksi Pengawasan Promosi PT dan PKRT
Seksi Pengawasan Promosi PT dan PKRT mempunyai tugas melakukan penyiapan bahan perumusan kebijakan teknis, serta penyusunan rencana dan program, pedoman, standar, kriteria dan prosedur, evaluasi dan laporan di bidang pengawasan promosi PT dan PKRT.
3.4.2 Seksi Pengawasan Penandaan PT dan PKRT
Seksi Pengawasan Penandaan PT dan PKRT mempunyai tugas melakukan penyiapan bahan perumusan kebijakan teknis, serta penyusunan rencana dan program, pedoman, standar, kriteria dan prosedur, evaluasi dan laporan di bidang pengawasan penandaan PT dan PKRT.
3.4.3 Seksi Tata Operasional
Seksi Tata Operasional mempunyai tugas melaksanakan tata operasional di lingkungan Direktorat.
3.5 Sub Direktorat Surveilan dan Analisis Risiko PT dan PKRT
Subdirektorat Surveilan dan Analisis Risiko PT dan PKRT mempunyai tugas melaksanakan penyiapan bahan perumusan kebijakan teknis, dan penyusunan pedoman, standar, kriteria dan prosedur serta pelaksanaan surveilan dan analisis risiko PT dan PKRT.
Dalam melaksanakan tugas, Sub Direktorat Surveilan dan Analisis Risiko PT dan PKRT menyelenggarakan fungsi :
a. Penyusunan rencana dan program surveilan dan analisis risiko PT dan PKRT. b. Pelaksanaan penyiapan bahan perumusan kebijakan teknis, dan penyusunan pedoman, standar, kriteria dan prosedur, serta pelaksanaan surveilan PT dan PKRT.
c. Pelaksanaan penyiapan bahan perumusan kebijakan teknis, dan penyusunan pedoman, standar, kriteria dan prosedur, serta pelaksanaan analisis risiko PT dan PKRT.
d. Evaluasi dan penyusunan laporan surveilan dan analisis risiko PT dan PKRT. Contoh kegiatan Sub Direktorat adalah melakukan monitoring efek samping obat (MESO) dan juga melakukan analisa dan evaluasi terhadap laporan efek samping obat yang diterima serta menentukan tindak lanjut terhadap laporan tersebut. Sub Direktorat Surveilan dan Analisis Risiko PT dan PKRT terdiri dari :
a. Seksi Surveilan PT dan PKRT; b. Seksi Analisis Risiko PT dan PKRT. 3.5.1 Seksi Surveilan PT dan PKRT
Seksi Surveilan PT dan PKRT mempunyai tugas melakukan penyiapan bahan perumusan kebijakan teknis, dan penyusunan rencana dan program, pedoman, standar, kriteria dan prosedur, evaluasi dan laporan di bidang surveilan PT dan PKRT.
3.5.2 Seksi Analisis Risiko PT dan PKRT
Seksi Analisis Risiko PT dan PKRT mempunyai tugas melakukan penyiapan bahan perumusan kebijakan teknis, dan penyusunan rencana dan program, pedoman, standar, kriteria dan prosedur, evaluasi dan laporan di bidang analisis risiko PT dan PKRT.
HASIL DAN PEMBAHASAN
Badan Pengawas Obat dan Makanan Republik Indonesia (Badan POM RI) ditetapkan sebagai Lembaga Pemerintah Non Kementerian berdasarkan Peraturan Presiden No. 64 tahun 2005 tentang perubahan keenam atas Keputusan Presiden No. 103 tahun 2001 tentang kedudukan, tugas, fungsi, kewenangan, susunan organisasi, dan tata kerja Lembaga Pemerintah Non Departemen. Badan POM sebagai Lembaga Pemerintah Non Kementrian (LPNK) adalah lembaga yang dibentuk untuk melaksanakan tugas pemerintahan di bidang pengawasan obat dan makanan sesuai ketentuan peraturan perundang-undangan yang berlaku. Kedudukan Badan POM dan pertanggung jawabannya berada langsung di bawah presiden serta memiliki garis koordinasi dengan Menteri Kesehatan.
Pada kegiatan Praktek Kerja Profesi Apoteker (PKPA) di badan POM ini, mahasiswa peserta terbagi menjadi 17 kelompok, dimana penulis termasuk dalam kelompok empat yang akan melaksanakan kegiatan PKPA di Direktorat Pengawasan Distribusi PT dan PKRT, Deputi I, Badan POM RI.
Direktorat Pengawasan Distribusi PT dan PKRT terbagi menjadi tiga Sub Direktorat dan memiliki delapan seksi. Pertama, Sub Direktorat Inspeksi dan Sertifikasi Distribusi PT dan PKRT yang terdiri dari tiga seksi, yaitu Seksi Inspeksi Sarana Distribusi PT dan PKRT, Seksi Sertifikasi Sarana Distribusi PT dan PKRT, serta Seksi Penanggulangan Produk Ilegal. Kedua, Sub Direktorat Surveilan dan Analisis Risiko PT dan PKRT yang terdiri dari dua seksi, yaitu Seksi Surveilan PT dan PKRT dan Seksi Analisis Risiko PT dan PKRT. Ketiga, Sub Direktorat Pengawasan Promosi dan Penandaan PT dan PKRT yang terdiri dari tiga seksi, yaitu Seksi Pengawasan Promosi PT dan PKRT, Seksi Pengawasan Penandaan PT dan PKRT dan Seksi Tata Operasional.
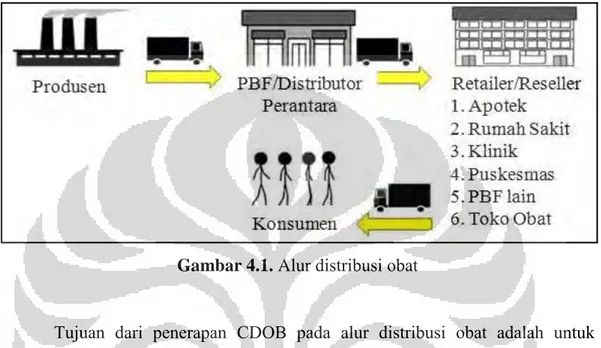
4.1 Sub Direktorat Inspeksi dan Sertifikasi Distribusi PT dan PKRT Pada Sub Direktorat Inspeksi dan Sertifikasi Distribusi PT dan PKRT, dilakukan pengawasan terhadap alur distribusi obat yang berlandaskan pada pedoman Cara Distribusi Obat yang Baik (CDOB). Objek yang diawasi
pendistribusian produk obatnya, meliputi industri farmasi, Perusahaan Besar Farmasi (PBF), fasilitas pelayanan kefarmasian (apotek, rumah sakit, klinik, puskesmas, toko obat, serta PBF lainnya), konsumen, dan kendaraan penghantaran produk obat.
Gambar 4.1. Alur distribusi obat
Tujuan dari penerapan CDOB pada alur distribusi obat adalah untuk memastikan dan mempertahankan mutu obat sepanjang alur distribusi atau penyalurannya sesuai persyaratan dan tujuan penggunaannya. Manfaat yang diperoleh dari penerapan CDOB tersebut, yaitu (1) penyebaran obat dapat terkoordinasikan dengan baik sehingga obat dapat digunakan ketika dibutuhkan, (2) terlaksananya pengamanan lalu lintas dan penggunaan obat tepat sampai kepada pihak yang membutuhkan secara sah untuk melindungi masyarakat dari kesalahan penggunaan atau penyalahgunaan obat, (3) keabsahan dan mutu obat terjamin sehingga obat yang sampai ke tangan konsumen adalah obat yang efektif, aman dan dapat digunakan sesuai dengan tujuan penggunaannya, serta (4) penyimpanan obat aman dan sesuai kondisi yang dipersyaratkan termasuk selama tranportasi untuk menjamin mutu obat tetap dalam keadaan baik..
Seksi Inspeksi Sarana Distribusi PT dan PKRT melakukan pengawasan peredaran produk terapetik, meliputi pemeriksaan keabsahan pengadaan, penyimpanan, dan penyaluran produk serta penyelidikan yang berkaitan dengan pelanggaran yang diduga sebagai tindak pidana kepada setiap sarana distribusi
dan sarana pelayanan obat dengan tujuan menjamin produk terapetik diedarkan melalui alur distribusi yang benar.
Seksi Inspeksi Sarana Distribusi PT dan PKRT melakukan inspeksi berupa inspeksi rutin yang dilakukan pada saat terdapat kasus penyalahgunaan obat dan/atau bahan baku obat ataupun tidak. Inspeksi rutin dilakukan terhadap apotek, PBF, dan rumah sakit. Contoh pelanggaran yang dilakukan, misalnya sebuah PBF yang tidak memiliki SOP (Standard Operational Procedure) dalam pengadaan, penyimpanan, dan penjualan barang dimana hal ini sangat penting dalam menjamin mutu obat dan/atau bahan baku obat agar tetap terjaga dengan baik. Pelaksanaan inspeksi dilakukan oleh tim inspeksi yang mendapat surat tugas untuk melakukan inspeksi. Inspeksi ini juga dapat dilakukan secara gabungan dengan direktorat lain sesuai dengan kasus yang terjadi (inspeksi audit komprehensif), misalnya diketahui adanya distribusi obat psikotropika ke toko obat, maka inspeksi dilakukan secara gabungan dengan direktorat pengawasan NAPZA. Setelah melakukan inspeksi, tim inspeksi membuat berita acara pemeriksaan untuk kemudian dilaporkan. Apabila ditemukan adanya pelanggaran, maka Badan POM akan memberi sanksi berupa peringatan (P), peringatan keras (PK), penghentian sementara kegiatan (PSK), penghentian kegiatan (PKe), dan rekomendasi pencabutan izin (Rek. PI) dimana untuk pencabutan izin hanya bisa dilakukan oleh Dinas Kesehatan.
Seksi Sertifikasi Sarana Distribusi PT dan PKRT menangani proses penerbitan surat keterangan impor (SKI) untuk obat, bahan baku obat, dan bahan baku pembanding. Dasar hukum terhadap pengawasan importasi tersebut adalah UU No. 36 tahun 2009 tentang Kesehatan; Peraturan Kepala Badan POM No. 27 tentang Pengawasan Pemasukan Obat dan dan Makanan ke dalam Wilayah Indonesia; dan Peraturan Kepala Badan POM No. 28 tentang Pengawasan Pemasukan Obat, Bahan Obat Tradisional, Bahan Suplemen Kesehatan, dan Bahan Pangan ke dalam Wilayah Indonesia. Bahan Baku Obat dan/atau obat yang akan masuk ke Indonesia harus sudah memiliki izin edar. Pihak pengimpor harus membawa notifikasi persetujuan dari Badan POM untuk dapat mengambil obat jadi atau bahan baku obat impor di Bea Cukai. Untuk mendapatkan SKI ini, pengimpor harus datang ke Badan POM dan menyerahkan dokumen yang
diperlukan kepada Seksi Sertifikasi PT dan PKRT. Dokumen yang diperlukan untuk bahan baku obat adalah Certificate of Analysis (CoA), Invoice dan Air Way Bill (AWB)/Bill of Leading (BOL), untuk obat jadi impor kelengkapan dokumentasinya sama seperti bahan baku obat hanya saja ditambah dengan Nomor Izin Edar (NIE), Certificate Pharmaceutical Product (CPP) dan khusus untuk vaksin melampirkan Certificate Batch Release. Jika berkas permohonan lengkap, Surat Keterangan Impor diberikan dalam waktu 1 (satu) hari kerja. Tetapi sejak diberlakukannya sistem NSW (National Single Window), pengimpor tidak lagi harus datang ke Badan POM, tetapi mereka dapat melakukan registrasi secara online melalui situs e-bpom dengan mengisi formulir yang terdapat pada program ini dan meng-upload dokumen-dokumen yang diperlukan. Kemudian seksi Sertifikasi PT dan PKRT akan memeriksa dokumen-dokumen tersebut. Apabila semua persyaratan telah lengkap, surat keterangan impor akan dikirimkan secara online kepada importir dan bea cukai. Bila masih ada syarat yang belum terpenuhi, seksi Sertifikasi PT dan PKRT akan mengirim balik dokumen-dokumen tersebut dan memberitahukan kekurangan-kekurangan yang perlu ditambahkan importir.
Seksi Penanggulangan Produk Ilegal bertanggung jawab dalam melakukan pengawasan terhadap produk ilegal. Hal ini bertujuan untuk melindungi masyarakat dari peredaran obat ilegal yang tidak memenuhi standar khasiat, keamanan dan mutu. Informasi akan adanya produk-produk yang ilegal bersumber dari laporan temuan Balai Besar POM, sampling/under cover buy, industri farmasi serta laporan dari masyarakat. Dengan adanya informasi tersebut Direktorat Pengawasan Distribusi PT dan PKRT melakukan kegiatan evaluasi, yaitu melakukan konfirmasi produk kepada Direktorat Penilaian Obat dan Produk Biologi, melaksanakan klarifikasi kepada industri farmasi obat asli dan uji laboratorium yang dilaksanakan oleh PPOMN untuk diuji mutunya. Dari kegiatan evaluasi yang dilaksanakan tersebut dapat diketahui keaslian dari suatu produk dan jika ternyata produk tersebut positif palsu maka dilakukan penyidikan lebih lanjut oleh Pusdik Badan POM dan public warning agar masyarakat lebih waspada dengan peredaran produk palsu tesebut.
4.2 Sub Direktorat Pengawasan Promosi dan Penandaan PT dan PKRT
Sub Direktorat Pengawasan Promosi dan Penandaan PT dan PKRT merupakan Sub Direktorat yang melaksanakan pengawasan post market produk bagian penandaan dan promosi.
Seksi Pengawasan Promosi PT dan PKRT melaksanakan pengawasan promosi sebelum dan setelah media promosi tersebut beredar. Pengawasan promosi sebelum beredar dilakukan terhadap obat bebas dan obat bebas terbatas dan pengawasan promosi setelah beredar dilakukan terhadap obat bebas, obat bebas terbatas, dan obat keras.
Sebelum melakukan promosi obat bebas dan obat bebas terbatas, industri farmasi mengajukan permohonan persetujuan rancangan iklan kepada Badan POM. Pemohon harus mengajukan surat permohonan kemudian mengisi formulir pendaftaran iklan, melakukan pembayaran SPB, dan menyerahkan berkas permohonan rancangan. Berkas permohonan rancangan terdiri dari dokumen administratif dan dokumen teknis. Dokumen administratif berisi surat permohonan dan bukti pembanyaran PNBP beserta SPB. Sedangkan dokumen teknis berisi fotokopi lembar persetujuan izin edar, rancangan iklan, dan fotokopi data dukung iklan untuk klaim tertentu bila diperlukan. Rancangan iklan yang diajukan berupa gambar dan tulisan untuk media cetak termasuk poster, stiker, dan spanduk, script untuk media radio dan story board untuk media televisi. Setelah pengumpulan, rancangan iklan dievaluasi lalu dirapatkan bersama Tim Ahli dan Penilai iklan obat. Rapat kemudian menghasilkan rekomendasi perbaikan, persetujuan, atau penolakan iklan yang diajukan. Iklan yang diajukan harus sesuai dengan peraturan dan perundang-undangan yang berlaku serta harus memenuhi kriteria objektif, lengkap, dan tidak menyesatkan sehingga masyarakat terlindung dari penggunaan obat yang tidak tepat dan rasional. Untuk itu diperlukan pengawasan iklan setelah tayang agar memastikan iklan yang beredar di masyarakat tetap sesuai dengan ketentuan dan rancangan yang sudah disetujui.
Khusus obat keras, promosi hanya diperbolehkan kepada profesi kesehatan dan dimuat dalam majalah cetak ilmiah kedokteran dan farmasi. Pengawasan iklan obat setelah beredar dilakukan oleh Balai Besar POM, Balai POM, dan Badan POM. Bila terdapat iklan yang tidak sesuai ketentuan, Balai Besar/Balai POM
yang melakukan pengawasan di lapangan akan melaporkannya ke Badan POM untuk kemudian ditindak lanjuti. Laporan dari masyarakat mengenai iklan obat juga dapat dijadikan data untuk pengawasan iklan. Sanksi yang diberikan kepada industri farmasi terkait iklan yang tidak sesuai ketentuan secara bertahap adalah peringatan, peringatan keras, lalu pembatalan izin edar obat.
Seksi Pengawasan Penandaan PT dan PKRT melaksanakan pengawasan penandaan obat bebas, obat bebas terbatas, dan obat keras yang sudah beredar. Penandaan yang dimaksud berupa etiket, brosur, strip/blister, kemasan sekunder, dan ampul/vial.
Evaluasi penandaan meliputi evaluasi penandaan obat siap edar yang diterima dari Direktorat Penilaian Obat dan Produk Biologi, laporan pengawasan penandaan obat dari Balai Besar/Balai POM, dan laporan dari masyarakat terkait penandaan yang tidak memenuhi ketentuan. Evaluasi kemasan obat di pasaran dilakukan terhadap kemasan siap edar yang dikirimkan industri farmasi kepada Direktorat Penilaian Obat dan Produk Biologi yang kemudian diteruskan ke Direktorat Pengawasan Distribusi PT dan PKRT. Kemasan obat dievaluasi kesesuaiannya dengan rancangan penandaan yang sudah disetujui dalam persetujuan izin edar. Jika kemasan tidak sesuai dengan rancangan yang telah disetujui maka Badan POM akan menindaklanjuti dengan memberikan sanksi administratif secara bertahap berupa surat peringatan, peringatan keras, dan pembatalan izin edar serta sanksi lain yang sesuai dengan peraturan perundang-undangan yang berlaku kepada industri farmasi pemilik nomor izin edar produk. Setelah mendapat surat peringatan, industri farmasi dihasurkan melakukan corrective and preventive action (CAPA) terhadap kesalahan kemasan. Implementasi CAPA tersebut akan dipantau dan dievaluasi oleh Badan POM serta Balai Besar/Balai POM.
4.3 Sub Direktorat Surveilan dan Analisis Risiko PT dan PKRT
Sub Direktorat Surveilan dan Analisis resiko PT dan PKRT merupakan sub direktorat yang melaksanakan fungsi pengawasan post market dalam kaitannya dengan aspek keamanan obat yang beredar.
Pengawasan post market untuk menjaga keamanan obat dilakukan berdasarkan Permenkes Nomor 1010 Tahun 2008 yang menjelaskan bahwa harus dilakukan evaluasi kembali terhadap obat yang telah beredar dengan risiko efek samping yang lebih besar dibandingkan dengan efektifitasnya. Menurut Permenkes Nomor 1799 tahun 2010 tentang Industri Farmasi menjelaskan bahwa industri farmasi wajib melakukan farmakovigilans, yaitu apabila industri farmasi menemukan bahwa obat dan/atau bahan obat hasil produksinya yang tidak memenuhi standar dan/atau persyaratan keamanan, khasiat/kemanfaatan dan mutu maka industri farmasi wajib melaporkan hal tersebut kepada kepala Badan. Karena efek obat dapat berbeda untuk setiap individu, dimana beberapa faktor dapat turut berpengaruh, seperti faktor genetik, ras, usia, dan lainnya. Untuk itu perlu dipantau keamanan penggunaannya pada populasi atau masyarakat luas.
Surveilan/pemantauan keamanan produk terapetik dilakukan melalui program Monitoring Efek Samping Obat (MESO) yang bertujuan untuk mendeteksi sedini mungkin setiap kemungkinan timbulnya efek obat yang tidak diinginkan untuk mencegah kejadian serupa terjadi lebih luas, serta untuk memperoleh informasi baru mengenai efek samping obat (ESO) yang belum pernah terjadi sebelumnya, tingkat kegawatan serta frekuensi kejadiannya, sehingga dapat segera dilakukan tindak lanjut regulatori yang diperlukan.
Dalam penyelenggaraan MESO, Badan POM Indonesia bekerja sama dengan pusat MESO Internasional, yaitu WHO Collaborating Centre for International Drug Monitoring yang berpusat di Uppsala, Swedia untuk melaporkan kejadian ESO, mengolah dan meneliti semua data dari seluruh dunia dan secara teratur saling memberikan informasi terkait dengan aspek keamanan obat.
Tenaga kesehatan akan melaporkan ESO melalui Form kuning dan industri farmasi dengan Form CIOM. Laporan ESO yang diterima akan dilakukan validitas
laporan untuk melihat kelengkapan dari laporan tersebut. Apabila laporan belum lengkap, maka perlu diminta tambahan data sedangkan untuk laporan yang sudah lengkap akan di evaluasi validitas efek samping obat dan analisa kausalitas (caussality assessment) oleh seksi Analisis Risiko. Dimana Analisa kausalitas dilaksanakan bersama tim ahli. Seksi analisis risiko juga malakukan kajian
terhadap isu keamanan obat secara global yang berasal dari negara lain atau jurnal, review keamanan obat yang terpublikasi, seperti European Medicines Agency (EMA), The US Food and Drug Administration (FDA), Australian Therapeutic Goods Administration (TGA) dan Health Canada, dan bila diperlukan dilakukan rapat pengkajian bersama tim ahli yang bertujuan untuk mengetahui informasi mengenai efek samping obat yang belum diketahui/diidentifikasi sebelumnya.
Untuk meningkatkan partisipasi aktif pelaporan ESO oleh tenaga kesehatan, Badan POM menerbitkan ‟Buletin MESO” yang memuat tentang pembahasan laporan ESO dan informasi lain yang terkait dengan ESO. Buletin MESO diterbitkan secara berkala 2 (dua) kali dalam setahun, yaitu pada bulan Juni dan bulan November. Manfaat bagi tenaga kesehatan yang turut berpartisipasi dalam program MESO, antara lain berupa pertukaran informasi keamanan obat yang dapat dimanfaatkan dalam pemilihan pengobatan ataupun akses untuk informasi yang lebih rinci.
Dalam menangani pelaporan tentang ESO dari tenaga kesehatan, sub direktorat Surveilan dan Analisis risiko harus melalui tahapan sebagai berikut : 1. Formulir kuning (Form kuning) dikirim bersama buletin meso atau tanpa
buletin meso ke tenaga kesehatan untuk diisi efek samping obat yang terjadi dimasyarakat/konsumen.
2. Laporan/form kuning yang dikirim oleh tenaga kesehatan/pelapor diterima dan dilakukan evaluasi dengan memeriksa kelengkapan data, apabila data yang dikirm masih belum lengkap, maka data tersebut akan dikirim kembali kepada pelapor untuk dilengkapi.
3. Data nama pelapor, alamat pelapor dan Efek Samping Obat (ESO) yang dilaporkan dicatat dalam buku dokumentasi pelapor; kemudian form kuning tersebut diberi nomor sesuai dengan urutan nomor didalam buku dokumentasi tersebut.
4. Semua laporan yang sudah diterima oleh Badan POM akan diberikan surat pemberitahuan penerimaan dalam waktu kurang dari 7 hari kerja (surat ucapan terima kasih) .
5. Data dari form kuning diterjemahkan ke dalam kode-kode yang telah ditetapkan oleh WHO dan hasil dari penerjemahan tersebut dituliskan kembali di form WHO.
6. Laporan yang telah terkumpul dibawa ke panitia MESO Nasional. Panitia MESO Nasional terdiri dari ahli-ahli farmakologi, psikolog, dan dokter spesialis baik dokter yang menangani penyakit tersebut maupun dokter yang terkait atas efek samping yang ditimbulkan obat tersebut dan apoteker.
7. Panitia MESO nasional mengundang komisi penilai obat jadi untuk bersama-sama dengan pusat MESO/Farmakovigilans Nasional menganalisa laporan-laporan tersebut dan menentukan apakah Efek Samping Obat yang di laporkan cukup berarti dalam hal tingkat kegawatannya serta menentukan tindak lanjut dari obat tersebut.
8. Hasil analisa tersebut kemudian dilaporkan ke Pusat MESO Internasional WHO di Uppsala, Swedia untuk di evaluasi dan dianalisa kembali. Pelaporan dilakukan dengan mengisi formulir di program/software WHO Collaborating Centre For Internasional Drug Monitoring dan dikirim melalui fasilitas e-mail.
9. Kemudian dilakukan dokumentasi dengan cara mengisi kartu obat dan kartu ESO. Kartu obat berfungsi untuk merekapitulasi Efek Samping Obat (ESO) yang terjadi dari 1 jenis obat, sedangkan kartu ESO berfungsi untuk merekapitulasi obat-obat yang menyebabkan terjadinya satu jenis ESO. Form kuning dan form WHO yang telah dianalisa di simpan didalam map gantung.
Pelaporan yang dilakukan oleh industri sesuai dengan Peraturan Kepala Badan Pengawas Obat dan Makanan Republik Indonesia Nomor HK.03.1.23.12.11.10690 Tahun 2011 Tentang Penerapan Farmakovigilans Bagi industri farmasi terdiri atas :
1. Pelaporan Spontan Kejadian Tidak Diinginkan (Spontaneous Adverse Events Reporting)
Pelaporan spontan dilakukan oleh industri farmasi berdasarkan laporan tertulis atau lisan yang diperoleh dari berbagai sumber yang dapat dipertanggungjawabkan, namun bukan dalam rangka pemantauan yang direncanakan atau bagian dari suatu penelitian. Kejadian tidak diinginkan
tersebut dapat berupa kejadian serius dan non-serius. Kejadian serius meliputi kematian, keadaan yang mengancam jiwa, pasien yang memerlukan perawatan rumah sakit, perpanjangan waktu rumah sakit, cacat permanen, dan kejadian medis penting lainnya.
2. Pelaporan Berkala Pasca Pemasaran (Periodic Safety Update Report (PSUR)) Pelaporan berkala pasca pemasaran merupakan kegiatan pemantauan dan pelaporan aspek keamanan obat yang dilakukan oleh industri farmasi terhadap obat yang diedarkan. PSUR dilaporkan setiap 6 (enam) bulan untuk 2 (dua) tahun pertama, dan setiap tahun untuk 3 (tiga) tahun berikutnya setelah disetujui beredar di Indonesia.
3. Pelaporan Studi Keamanan Pasca Pemasaran
Pelaporan studi keamanan pasca pemasaran harus dilakukan oleh industri farmasi pemegang izin edar untuk Obat yang dalam persetujuan izin edarnya dipersyaratkan untuk dilakukan studi tersebut atau obat tertentu yang telah beredar dan dipersyaratkan untuk dilakukan studi dalam rangka perencanaan manajemen risiko, berdasarkan pengkajian risiko-manfaat dan/atau rekomendasi tim ahli terkait. Dimana industri farmasi pemegang izin edar obat harus melaporkan hasil studi tersebut kepada Badan POM.
4. Pelaporan Publikasi/Literatur Ilmiah
Industri farmasi harus sesegera mungkin melaporkan informasi keamanan obat yang mempengaruhi profil manfaat-risiko yang dimuat dalam publikasi atau literatur ilmiah kepada Badan POM, dengan melampirkan publikasi/literatur ilmiah yang dimaksud.
5. Pelaporan Tindak Lanjut Regulatori Badan Otoritas Negara Lain
Industri farmasi harus segera melaporkan semua informasi tindak lanjut regulatori negara lain terkait dengan aspek keamanan mutakhir, seperti pembekuan atau pembatalan izin edar, serta penarikan obat dari pasaran yang dilakukan oleh badan otoritas negara lain. Pelaporan awal dilakukan dalam waktu 24 jam setelah informasi diterima, paling lambat pada hari kerja berikutnya.
6. Pelaporan Tindak Lanjut Pemegang Izin Edar di Negara Lain
Industri farmasi di Indonesia harus segera melaporkan semua tindak lanjut yang dilakukan oleh pemegang izin edar obat di negara lain sehubungan dengan aspek keamanan, seperti penarikan obat dari peredaran. Dimana Pelaporan ini dilakukan dalam waktu 24 (dua puluh empat) jam setelah informasi diterima, paling lambat pada hari kerja berikutnya.
7. Pelaporan Pelaksanaan Perencanaan Manajemen Risiko
Pelaporan hasil pelaksanaan kegiatan terkait perencanaan manajemen risiko oleh industri farmasi sesuai dengan ketentuan yang ditetapkan.
Dari hasil pengkajian tentang aspek keamanan obat dari Indonesia atau informasi ESO internasional dapat digunakan untuk mempertimbangkan suatu tindak lanjut regulatori berupa pembatasan indikasi, pembatasan dosis, pembatasan distribusi, perubahan labeling, pembekuan izin edar dan penarikan produk, serta penarikan izin edar dan penarikan obat/produk dari peredaran, untuk menjamin perlindungan keamanan masyarakat/konsumen.
5.1 Kesimpulan
Setelah mengikuti praktek kerja Profesi Apoteker di Direktorat Pengawasan Distribusi Produk Terapetik dan Perbekalan Kesehatan Rumah Tangga, penulis dapat menyimpulkan bahwa:
a) Badan POM merupakan Lembaga Pemerintahan Non Kementerian yang berfungsi melaksanakan pengawasan terhadap kualitas, keamanan, dan khasiat obat dan makanan sebelum beredar (Pre market) maupun setelah beredar (Post market) di masyarakat.
b) Kegiatan Direktorat Pengawasan Distribusi Produk Terapetik (PT) dan Perbekalan Kesehatan Rumah tangga (PKRT), meliputi pengawasan sarana distribusi berlandaskan pada pedoman Cara Distribusi Obat yang Baik (CDOB), melakukan perizinan sarana distribusi, penanggulangan produk ilegal, melakukan Monitoring Efek Samping Obat (MESO) yang beredar, penyampaian informasi kepada tenaga kesehatan dalam rangka meningkatkan kewaspadaan terhadap keamanan obat serta pengawasan terhadap promosi dan penandaan produk terapetik (PT).
c) Peran dan fungsi Sub Direktorat Inspeksi dan Sertifikasi Distribusi PT dan PKRT Badan POM RI adalah melaksanakan pengawasan terhadap sarana distribusi, berkerjasama dengan Dinas Kesehatan dalam melakukan sertifikasi terhadap sarana distribusi, serta melakukan pengawasan terhadap impor bahan baku obat dan obat jadi serta penanggulanggan produk ilegal.
d) Peran dan fungsi Sub Direktorat Promosi dan Penandaan PT dan PKRT Badan POM RI adalah melakukan pengawasan terhadap segala bentuk promosi dan penandaan pada produk.
e) Peran dan fungsi Sub Direktorat Surveilan dan Analisa Risiko PT dan PKRT Badan POM RI adalah pemantauan efek samping produk terapetik yang beredar, penyampaian informasi kepada tenaga kesehatan dalam rangka meningkatkan kepedulian terhadap keamanan obat, serta pengkajian terhadap
kejadian efek samping obat dari berbagai negara sebagai dasar dalam pengambilan kebijakan di Indonesia.
5.2 Saran
Adapun masukan yang dapat penulis sampaikan kepada direktorat Pengawasan Distribusi Produk Terapetik dan Perbekalan Kesehatan Rumah Tangga, antara lain :
a) Kegiatan sampling lebih sering dilakukan, baik ke sarana distribusi maupun sarana pelayanan untuk lebih meningkatkan pengawasan terhadap peredaran produk yang tidak memenuhi syarat mmaupun obat palsu.
b) Meningkatkan sosialisasi mengenai CDOB kepada pelaku usaha di bidang distribusi Produk Terapetik.
c) Meningkatkan sosialisasi mengenai MESO kepada setiap Pusat Pelayanan Kesehatan serta sosialisasi mengenai cara mengisi form pelaporan MESO (form kuning) kepada tenaga kesehatan.
d) Membuat sistem pengarsipan yang lebih efektif dan efisien serta memudahkan pegawai untuk mencari dokumen, jika memungkinkan pengarsipan dokumen sebaiknya juga menggunakan sistem terkomputerisasi. e) Dapat mengoptimalkan sumber daya manusia dan teknologi yang ada untuk