Bab
8
Partikel Materi
Peta Konsep
Partikel Materi
Perhatikan gambar molekul senyawa (lihat Gambar 8.1). Molekul senyawa tersebut disusun oleh atom-atom dari unsur yang berbeda. Molekul senyawa dan atom merupakan partikel materi. Apa yang dimaksud dengan partikel materi? Apa saja yang termasuk partikel materi? Bagaimanakah penerapannya dalam kehidupan sehari-hari? Kamu dapat menemukan jawabannya setelah mempelajari bab ini.
Setelah mempelajari bab ini, kamu diharapkan dapat mendeskripsikan pengertian partikel materi, mendeskripsikan konsep atom, ion, dan molekul, menyebutkan produk kimia sehari-hari yang berhubungan dengan konsep atom, ion, dan molekul, serta membandingkan molekul unsur dan molekul senyawa. Gambar 8.1 Molekul senyawa Sumber: Encarta 2005 jenisnya Atom Ion Molekul bermuatan listrik bergabung menjadi
Partikel materi adalah bagian terkecil dari suatu materi yang memiliki sifat materi itu. Dengan kata lain, partikel materi akan memiliki sifat yang sama dengan materi tersebut. Partikel materi tersebut dapat berbentuk atom, ion, atau molekul. Ayo cermati uraian berikut ini.
A. Atom
Apabila sebuah kapur tulis dipotong-potong secara terus menerus sampai bagian yang terkecil, apa yang akan terjadi? Dapatkah kapur itu dipotong terus-menerus? Semua materi dapat dibagi-bagi sampai pada bagian yang terkecil dari zat tersebut sehingga tidak bisa dibagi-bagi lagi. Menurut Aristoteles, pembagian materi bersifat kontinu. Suatu materi dapat dibagi menjadi bagian yang lebih kecil secara terus menerus tanpa ada batasnya. Sedangkan, Democritus berpendapat bahwa pembagian materi sifatnya diskontinu. Artinya, jika suatu materi dibagi secara terus menerus, maka akan diperoleh bagian yang terkecil dan tidak dapat dibagi lagi. Bagian itulah yang disebut dengan atom.
Atom adalah bagian terkecil dari suatu unsur. Perhatikan Gambar 8.2. Pada gambar diperlihatkan gambaran kasar tentang atom yang disimpulkan para ahli. Keadaan atom sesungguhnya sangat sukar untuk diungkapkan dalam bentuk gambar.
Pada 2500 tahun yang lalu, para ilmuan Yunani Kuno menyatakan bahwa materi terdiri dari bagian-bagian yang sangat kecil, disebut atom. Kata atom berasal dari kata
atomos yang berarti tidak dapat dibagi-bagi lagi. Pendapat
ini dikembangkan oleh Democritus dan dapat bertahan lama sekali, walaupun para ilmuan pada zaman itu belum bisa menjelaskan peristiwa-peristiwa perubahan zat yang terjadi di alam.
Istilah atom pertama kali diajukan oleh Anaxagoras. Democritus hanya mengungkapkan bahwa atom sangat kecil sehingga tidak dapat dibagi-bagi lagi. Pendapat tentang atom disempurnakan oleh John Dalton pada 1803. John Dalton (1766 - 1844) menyusun teori tentang atom yang lebih lengkap, yaitu sebagai berikut:
a) Materi terdiri atas sejumlah partikel yang sangat kecil dan tidak dapat dipecah-pecah lagi. Partikel inilah yang dinamakan atom.
b) Atom-atom dalam suatu unsur identik dalam segala hal atau mempunyai sifat dan massa yang sama dengan
Gambar 8.2 Model atom Inti atom
Awan elektron di seputar inti atom
S
ahabatku, IlmuwanDemocritus adalah seorang filosofi dari Yunani yang mengembangkan teori atom secara umum. Ia dilahirkan di Abdera, Thrace. Ia menulis secara ekstensif, tetapi hanya fragmen dari pekerjaannya
H
H H
C
C C
Atom unsur H memiliki kesamaan dalam segala hal (sifat dan massa) dengan atom unsur H yang lainnya, tetapi atom unsur H berbeda dengan atom unsur C. c) Atom dapat bergabung dengan atom lain membentuk
suatu senyawa dengan perbandingan tertentu yang nilainya bulat dan sederhana.
Perhatikan gambar berikut ini!
H O H
Atom H bergabung dengan atom O membentuk suatu senyawa. Perbandingan atom H dengan atom O dalam senyawa tersebut adalah 2 : 1.
Sebuah atom dapat dituliskan dalam lambang tertentu. Aturan penulisan lambang sebuah atom adalah sebagai berikut:
Gambar 8.3 Atom-atom unsur H berbeda dengan atom-atom unsur C
Gambar 8.4 Atom-atom H bergabung dengan atom-atom O membentuk senyawa H2O
unsur tersebut, tetapi berbeda dengan atom-atom unsur lain.
Perhatikan gambar berikut ini!
A
Z
X
X = Lambang unsur yang disusun oleh atom A = Nomor massa atom
Z = Nomor atom
Nomor massa atom (A) menyatakan jumlah proton dan neutron di dalam inti atom, sedangkan nomor atom (Z) menyatakan jumlah proton di dalam inti atom. Nomor atom juga menyatakan jumlah elektron yang beredar mengelilingi inti atom. Bila jumlah neutron dalam inti dilambangkan dengan N, maka:
A = Z + N
A = Nomor Massa Atom = Proton + Neutron
Z = Nomor atom = Jumlah Proton = Jumlah Elektron
yang tertinggal. Menurut teorinya, atom berarti segala sesuatu yang tidak dapat dilihat, partikel unsur yang tidak dapat dimusnahkan (atoma,
“indivisibles”),
bergerak dengan bebas dan tidak terbatas di dalam suatu ruang kosong. Walaupun atom memiliki unsur penyusun yang sama, mereka berbeda dalam keadaan, ukuran, massa, urutan, dan posisi.
Pikirkanlah
Mengapa atom dapat bergabung dengan atom yang lainnya membentuk suatu senyawa dengan perbandingan tertentu yang nilainya bulat? Dapatkah kamu menjelaskannya? Coba kamu diskusikan dengan guru atau teman sebangkumu tentang hal tersebut!
Atom memiliki sifat yang netral. Oleh karena itu, jumlah proton harus sama dengan jumlah elektron. Dengan demikian, nomor atom menunjukkan pula jumlah elektron yang ada dalam atom itu.
Nomor atom = Jumlah proton dalam inti atom = Jumlah elektron dalam inti atom
Sebagai contoh, atom karbon memiliki nomor massa 12 dan nomor atom 6. Tentukan:
a. aturan penulisan dari atom karbon tersebut b. jumlah proton
c. jumlah elektron d. jumlah neutron
Jawab:
a. Aturan penulisan dari atom karbon adalah C karena atom karbon memiliki nomor massa (A) = 12 dan nomor atom (Z) = 6.
b. Jumlah proton (Z) = 6. c. Jumlah elektron (Z) = 6.
d. Jumlah neutron = nomor massa (A) – nomor atom (Z) = 12 – 6 = 6
12 6
I
nfoNomor massa atom menunjukkan jumlah proton dan neutron di dalam inti atom, sedangkan nomor atom menunjukkan jumlah elektron yang beredar mengelilingi inti atom.
1. Apa yang dimaksud dengan atom? Jelaskan!
2. Jelaskan teori yang disusun oleh Dalton mengenai atom! 3. Isilah titik-titik pada tabel berikut!
M
enguji Diri
4. Lambang suatu unsur yang disusun oleh atom adalah Cd. Atom tersebut memiliki nomor atom 48 dan nomor massa 113. Tuliskan lambang atom tersebut! Lambang Sc S Cl Jumlah Proton ... ... ... Jumlah Neutron ... ... ... Jumlah Elektron ... ... ... 33 16 35 17 45 21
B. Ion
Seperti yang telah diuraikan sebelumnya bahwa ion merupakan salah satu partikel penyusun materi. Ion merupakan atom atau gabungan beberapa atom yang mempunyai muatan listrik positif atau negatif. Atom atau kumpulan atom yang memiliki muatan listrik positif disebut ion positif atau kation. Sedangkan, yang bermuatan listrik negatif disebut ion negatif atau anion.
Beberapa contoh kation dan anion dapat kamu lihat pada tabel berikut ini.
Kation (ion positif) dan anion (ion negatif) dapat bergabung membentuk senyawa ion yang disebut senyawa ionik. Senyawa ionik dapat menghantarkan listrik. Contoh yang paling sederhana adalah senyawa natrium klorida atau garam dapur yang terdiri dari ion Na+ dan ion Cl-. Ion Na+
dan ion Cl- akan tarik-menarik membentuk suatu senyawa
NaCl (garam dapur) karena terdiri dari dua buah muatan listrik yang berlawanan. Untuk menguraikan senyawa NaCl ini menjadi unsur-unsur pembentuknya dapat dilakukan dengan cara mengalirkan arus listrik ke dalam lelehan natrium klorida (NaCl) sehingga NaCl ini akan terurai menjadi ion Na+ dan ion Cl-.
Tabel 8.1 Beberapa Kation dan Anion
Kation Nama Anion Nama
Na+ Ion natrium Cl– Ion klorida
Mg2+ Ion magnesium O2- Ion oksida
Al3+ Ion aluminium S2- Ion sulfida
H+ Ion hidrogen I- Ion iodida
K+ Ion kalium CO
32- Ion karbonat
NaCl Na+ +
Cl-Natrium Klorida Natrium + Klor (Senyawa Ionik) (Ion Natrium) (Ion Klorida)
Pikirkanlah
Apakah setiap
senyawa dapat terurai menjadi kation dan anion? Kemukakan pendapatmu!
I
nfoMolekul senyawa adalah partikel terkecil dari suatu senyawa yang masih memiliki sifat yang sama dengan senyawa itu.
C. Molekul
Umumnya, partikel unsur logam berbentuk atom. Logam besi terdiri atas atom-atom besi. Logam tembaga terdiri atas atom-atom tembaga. Begitu juga dengan emas. Lalu, berbentuk apakah partikel-partikel senyawa? Partikel-partikel senyawa terdiri atas molekul-molekul senyawa itu.
Molekul senyawa adalah partikel terkecil dari suatu senyawa yang masih memiliki sifat yang sama dengan senyawa itu. Molekul senyawa dapat dibentuk dari penggabungan atom unsur-unsur yang sama (molekul unsur) ataupun atom unsur-unsur yang berbeda (molekul senyawa).
1. Molekul Unsur
Molekul unsur merupakan molekul yang terbentuk dari hasil penggabungan atom-atom unsur yang sama atau sejenis. Sebagai contoh, gas O2 (oksigen) yang ada di udara adalah unsur yang partikelnya berupa molekul. Molekul oksigen dibentuk oleh dua atom oksigen (lihat Gambar 8.5).
Molekul yang terbentuk dari dua atom disebut molekul dwiatom, misalnya Nitrogen (N2). Sedangkan, atom yang terbentuk dari tiga atom atau lebih disebut molekul poliatomik. Sebagai contoh, molekul yang dibentuk oleh tiga atom disebut molekul triatom, misalnya Ozon (O3). Molekul yang terdiri atas empat atom disebut molekul tetraatom, misalnya posfor (P4).
1. Apa yang dimaksud dengan ion, kation, anion, dan senyawa ionik? 2. Bagaimanakah proses terbentuknya suatu materi dari kation dan anion? 3. Bagaimana cara menguraikan NaCl menjadi ion-ion Na+ dan ion-ion Cl-?
Jelaskan!
M
enguji Diri
Gambar 8.5 Molekul oksigen
Gambar 8.6
Susunan atom molekul dwiatom, triatom, dan tetraatom
Triatom
2. Molekul Senyawa
Molekul senyawa adalah molekul yang terbentuk dari hasil penggabungan atom unsur-unsur yang berbeda. Contoh molekul senyawa yang sering kita jumpai dalam kehidupan sehari-hari adalah air (H2O). H2O merupakan hasil penggabungan dua atom H dan satu atom O. Di sini kita bisa lihat bahwa atom H berbeda dengan atom O. Gambar 8.7
Molekul air Aktivitas Siswa
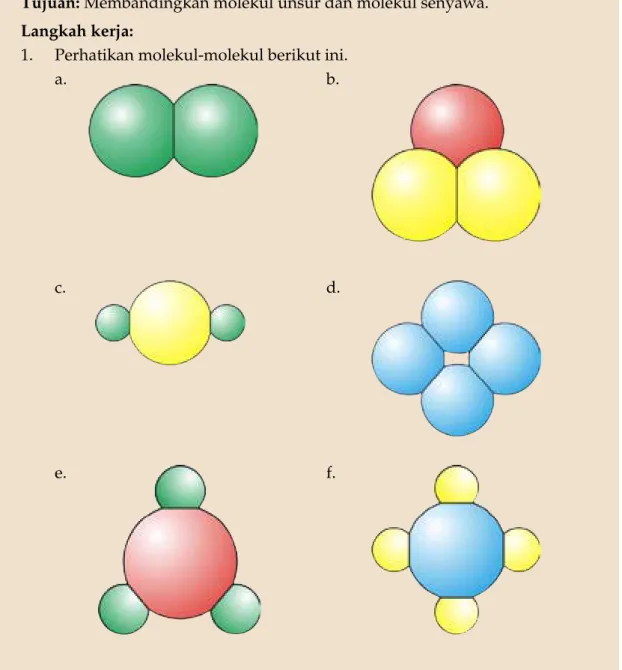
Tujuan: Membandingkan molekul unsur dan molekul senyawa. Langkah kerja:
1. Perhatikan molekul-molekul berikut ini.
a. b.
c. d.
g. h.
i. j.
2. Bandingkan molekul yang satu dengan yang lainnya, kemudian kelompokkan menjadi molekul unsur dan molekul senyawa.
Pertanyaan:
1. Apa ciri-ciri molekul unsur? 2. Apa ciri-ciri molekul senyawa?
3. Apakah molekul unsur sama dengan molekul senyawa?
1. Apa yang dimaksud dengan molekul? 2. Jelaskan istilah berikut ini!
a. molekul diatomik b. molekul poliatomik c. molekul triatomik d. molekul tetraatomik
3. Apa perbedaan antara molekul unsur dengan molekul senyawa? Berikan contohnya masing-masing!
M
enguji Diri
Kelompok Gambar
Molekul unsur Molekul senyawa
D. Konsep Atom, Ion, dan Molekul dalam
Produk Kimia Sehari-Hari
Dalam kehidupan sehari-hari, kamu dapat menemukan konsep atom, ion, dan molekul. Berikut ini adalah produk kimia yang mengandung konsep atom, ion, dan molekul. 1. Jam Atomik
Jam atomik diluncurkan oleh NIST Amerika Serikat pada 29 Desember 1999. Jam atomik ini mengukur emisi cahaya yang dipancarkan oleh atom cesium yang jatuh pada rongga gelombang mikro.
2. Garam Dapur dan Gula Pasir
Pada garam dapur terdapat atom Na dan Cl. Atom Na dan Cl ini berubah menjai ion Na+ dan Cl– sehingga
dapat bergabung membentuk garam (NaCl). Begitu juga dengan gula pasir yang mengandung aom C, H, dan O. Atom-atom C, H, dan O bergabung membentuk molekul gula (C6H12O6). Gambar 8.8 Jam atomik menggunakan atom cesium Sumber: Encarta 2005 3. Minuman Isotonik
Setelah berolahraga, kamu akan kehilangan cukup banyak ion-ion. Oleh karena itu, kamu harus segera meminum minuman isotonik untuk menggantikan ion-ion tubuh yang hilang tersebut. Produk minuman isotonik merupakan contoh produk yang mengandung ion dan menerapkan konsep ion di dalamnya. Contoh ion yang terdapat dalam minuman isotonik adalah ion Ca2+ dan Fe3+.
Molekul garam Molekul gula
Sumber:
Encarta 2005
Gambar 8.9
Molekul garam disusun oleh atom Na dan Cl, sedangkan molekul gula disusun oleh atom C, H, dan O
Carilah produk kimia lain yang mengandung konsep atom, ion, dan molekul! Jelaskan manfaatnya bagi kehidupan sehari-hari!
K
ilasan Materi
• Atom adalah bagian terkecil dari suatu unsur.
• Democritus berpendapat bahwa materi terdiri dari atas bagian-bagian yang sangat kecil dan tidak dapat dibagi-bagi lagi yang disebut atom.
• Teori atom John Dalton (1766 - 1844) adalah:
a. Materi terdiri atas sejumlah partikel yang sangat kecil dan tidak dapat dipecah-pecah lagi.
b. Atom-atom dalam suatu unsur identik dalam segala hal atau mempunyai sifat dan massa yang sama dengan unsur tersebut, tetapi berbeda dengan atom-atom unsur lain.
c. Atom dapat bergabung dengan atom lain membentuk suatu senyawa dengan perbandingan tertentu yang nilainya bulat dan sederhana. • Aturan penulisan lambang sebuah atom adalah sebagai berikut:
• Nomor massa atom (A) menyatakan jumlah proton dan neutron di dalam inti atom, sedangkan nomor atom (Z) menyatakan jumlah proton di dalam inti atom.
• Ion positif atau kation adalah atom atau kumpulan atom yang memiliki muatan listrik positif.
• Ion negatif atau anion adalah atom atau kumpulan atom yang bermuatan listrik negatif.
• Molekul unsur merupakan molekul yang terbentuk dari hasil penggabungan atom unsur-unsur yang sama atau sejenis.
• Molekul senyawa adalah molekul yang terbentuk dari hasil penggabungan atom unsur-unsur yang berbeda.
A
X
X = Lambang unsur yang disusun oleh atom A = Nomor massa atomZ = Nomor atom Z
Setelah kamu mempelajari jenis-jenis partikel materi, coba kamu jelaskan kembali jenis-jenis partikel materi dan perbedaannya! Manfaat apa yang kamu peroleh setelah mempelajari materi pada bab ini?
5. Partikel materi yang memiliki muatan listrik positif atau negatif adalah .... a. atom c. kation b. ion d. anion
6. Jika senyawa KCl dilarutkan ke dalam air maka akan terurai menjadi ion K+ dan ion Cl-. Dalam hal ini, ion
Cl- disebut ....
a. kation c. atom b. anion d. molekul 7. Molekul unsur dibentuk oleh ....
a. ion-ion sejenis b. atom-atom sejenis
c. ion-ion yang tidak sejenis d. atom-atom yang tidak sejenis 8. Bagian terkecil dari gas H2 adalah
....
a. atom b. ion c. molekul d. kation
9. Yang merupakan molekul dwiatomik adalah ....
a. CO2 b. O2 c. H2O d. NO3
10. Gambar yang menunjukkan molekul senyawa adalah ....
a. c.
b. d.
1. Bagian terkecil dari suatu unsur adalah ....
a. atom b. molekul c. anion d. kation
2. Pernyataan yang benar tentang postulat atom Dalton adalah .... a. atom dapat dipecahkan lagi
dengan reaksi kimia biasa b. atom dapat diciptakan atau
dimusnahkan
c. atom-atom tidak dapat bergabung membentuk suatu senyawa d. atom-atom yang ada di alam
tidak identik dalam segala hal 3. Pernyataan yang salah mengenai
nomor atom adalah ....
a. nomor massa atom dikurangi banyak-nya neutron dalam inti atom
b. banyaknya elektron dalam inti atom
c. banyaknya proton dalam inti atom
d. banyaknya neutron dalam inti atom
4. Sebuah atom memiliki lambang S. Pernyataan yang benar untuk atom tersebut adalah .... a. nomor atom 32 b. nomor massa 16 c. banyaknya proton 16 d. banyaknya neutron 16 33 16
A. Pilihlah jawaban yang paling tepat!
1. Apakah setiap materi memiliki partikel terkecil? Dapatkah kamu menentukan partikel terkecil dari suatu materi? Jelaskan!
2. Jelaskan perbedaan antara atom, ion, dan molekul! Di mana kamu dapat menemukan atom, ion, atau molekul?
3. Jelaskan hubungan konsep atom, ion, dan molekul dengan produk kimia sehari-hari? Diskusikan dengan teman sebangkumu!
B. Jawablah pertanyaan-pertanyaan di bawah ini!
1. Jelaskan perbedaan antara atom, ion, dan molekul!
2. Jelaskan perbedaan antara anion dan kation! Kemudian, berikan masing-masing lima buah contoh anion dan kation!
3. Isilah titik-titik pada tabel di bawah ini! Kerjakanlah di buku tugasmu!
4. Atom Mg memiliki proton sebanyak 12 dan neutron 12. Tentukanlah nomor atom dan nomor massa dari atom Mg! Tuliskan lambang untuk atom Mg!
5. Apa yang dimaksud dengan molekul dwiatomik, triatomik, dan tetraatomik? Jelaskan dan berikan contohnya!
Lambang F In Fe Jumlah Proton ... ... 26 Jumlah Neutron ... 64 ... Jumlah Elektron ... 49 ...
Nomor Atom
... ... ...Nomor Massa
... ... ... ... ... 56... 19 9Bab
9
Bahan Kimia
Rumah Tangga
Peta Konsep Bahan Kimia Rumah TanggaDetergen merupakan salah satu contoh bahan kimia yang sering digunakan dalam kehidupan sehari-hari. Selain detergen, bahan kimia apalagi yang sering digunakan dalam kehidupan sehari-hari? Apa kegunaan dan efek samping bahan kimia tersebut? Kamu dapat menemukan jawabannya setelah mempelajari bab ini.
Setelah mempelajari bab ini, kamu diharapkan dapat menyebutkan bahan kimia yang sering digunakan dalam kehidupan sehari-hari, mendeskripsikan kegunaan dan efek samping bahan kimia tersebut, serta mencari informasi kegunaan dan efek samping bahan kimia.
Gambar 9.1 Detergen Sumber: Encarta 2005 terdiri dari Pembersih Pemutih Pewangi Pewangi