TINJAUAN PUSTAKA
Polisakarida Mengandung Mannan
Dinding sel tanaman mengandung 38-50% selulosa, 15-25% lignin, 23-32% sebagai hemiselulosa (Puls dan Schuseil 1993). Polisakarida mannan adalah biopolimer kompleks yang berhubungan dengan dinding sel tanaman dimana mannan terikat bersama dengan selulosa dan lignin (de Vires 2003).
Polisakarida adalah polimer monosakarida yang bergabung dengan ikatan glikosidik dan klasifikasinya berdasarkan struktur: jenis monosakarida, posisi ikatan glikosidik, komfigurasi ikatan glikosidik α dan β serta ada tidaknya
substituen non karbohidrat. Dalam pengelompokan polisakarida bukan pati (Non Starch Polysaccharides), terdiri atas 3 kelompok besar yakni selulosa, polimer
non selulosa, dan pektic polisakarida. Polimer non selulosa ini terdiri dari arabinoxylan, glukan, mannan, araban, galaktan dan xyloglukan. Komponen polisakarida bukan pati antara lain hemiselulosa, dimana dalam bahan akan menghalangi proses penyerapan karbohidrat, asam amino dan mineral dalam usus yang mempunyai efek penghalang (protective box effect) (Vranjes dan Wenk 1995). Polisakarida bukan pati pada hewan non ruminansia termasuk unggas mempunyai aktivitas anti nutrisi yang mempunyai pengaruh menekan pencernaan dan penyerapan serat serta menyebabkan kotoran menjadi basah.
Mannan merupakan polimer mannopyranosil yang berhubungan dari satu ke yang lain oleh ikatan (1-4)- β-D-Manp (Buckeridge et al. 2000). Struktur mannan dapat dilihat pada Gambar 1.
Gambar 1 Polimer mannopyranosil (Buckeridge et al. 2000)
Galaktomannan memiliki rantai utama linier berupa ikatan (1-4)- β-D-Manp sebagai rantai utama dan mempunyai rantai sisi α-D-galp dengan ikatan (1→6) (Buckeridge et al. 2000). Adapun struktur galaktomannan dapat dilihat pada Gambar 2.
Gambar 2 Gambaran struktur locust bean galaktomannan (Buckeridge et al. 2000) Glukomannan merupakan polimer dengan rantai utama terdiri dari D-glukosa dan D-mannosa terikat bersama-sama dengan ikatan β-(1,4). Polisakarida ini diperkirakan terdiri dari 60% D-mannosa dan 40% D-glukosa (Li et al. 2005). Unit mannosa yang berulang dengan subtitusi glukosa pada rantai utama dan mengandung beberapa group acetyl. Pada beberapa spesies tanaman mengandung rantai pendek 11-16 molekul heksosa berikatan pada rantai sisi ikatan β-(1,6) atau β-(1,3) (Ratcliffe et al. 2005). Adapun struktur glukomannan dapat dilihat pada Gambar 3.
Gambar 3 Gambaran struktur glukomannan (Li et al. 2005; Ratcliffe et al. 2005) Galakto-glukomannan, rantai utama polisakarida ini terdiri dari ikatan (1-4)-β-D-Manp diselang-selingi dengan unit glukosa. Molekul D-galaktosa berikatan pada mannosa dengan ikatan α-(1,6). Beberapa studi ikatan β-(1,2) telah diamati (Sims et al. 1997). Pada rantai utama, mannosa dan glukosa kadang-kadang terdapat ikatan group acetyl pada C2 atau C3. Adapun struktur galakto-glukomannan dapat dilihat pada Gambar 4.
Gambar 4 Struktur galakto-glukomannan (Schr der et al. 2001)
Polisakarida mannan termasuk ke dalam polisakarida non selulosa, dengan tipe struktur utama mannan, galaktomannan dan glukomannan. Mannan ini
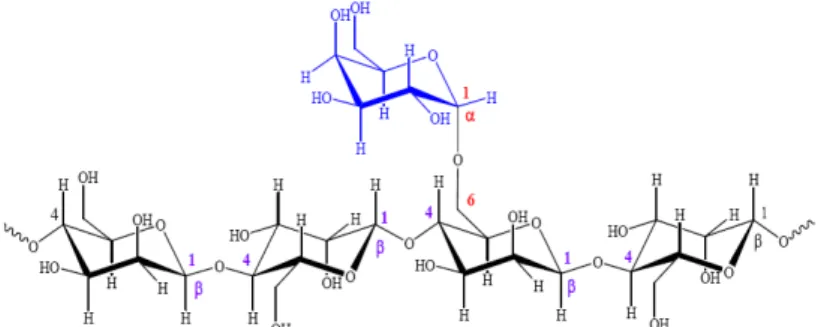
terdapat pada fraksi hemiselulosa dari biomass bungkil inti sawit (BIS) (Daud dan Jarvis 1992). Selanjutnya dilaporkan bahwa total dinding sel terbanyak dari BIS adalah mannosa sebesar 56.4%. Adapun secara lengkap komponen dinding sel dari bungkil inti sawit dapat dilihat pada Tabel 1.
Tabel 1 Persentase komponen gula netral pada bungkil inti sawit (BIS) Komponen gula netral Persentase dari dinding sel (%)
Mannosa 56.4 ± 7.0
Selulosa 11.6 ± 0.7
Xylosa 3.7 ± 0.1
Galaktosa 1.4 ± 0.2
Total 73.1 ± 7.2
Sumber : Daud dan Jarvis (1992).
Dusterhoft et al. (1992) melaporkan struktur kimia BIS berupa ikatan mannosa sebanyak 78%, selulosa 12%, arabinoxylans dan (4-O-methyl)-glucuronoxylans masing-masing 3%.
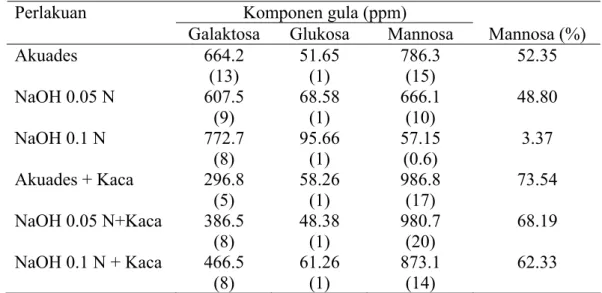
Tafsin (2007) melaporkan bahwa kandungan total gula yang dihasilkan dari setiap 100 g BIS berkisar antara 1 218-3 168 mg, jumlah mannosa yang dihasilkan dari total mannan yang ada dalam BIS berkisar 0.15-7.58%. Selanjutnya dilaporkan bahwa komponen gula polisakarida dari BIS tersusun atas glukosa, galaktosa dan mannosa. Komponen gula dominan berupa galaktomannan dengan rasio antara galaktosa dan mannosa mencapai 1:3. Adapun komponen gula dominan yang terdeteksi dengan HPLC disajikan pada Tabel 2.
Tabel 2 Pengaruh cara ekstraksi terhadap kandungan dan rasio komponen gula yang dideteksi dengan HPLC yang dilengkapi Carbohydrate column
Komponen gula (ppm) Perlakuan
Galaktosa Glukosa Mannosa Mannosa (%) Akuades 664.2 (13) 51.65 (1) 786.3 (15) 52.35 NaOH 0.05 N 607.5 (9) 68.58 (1) 666.1 (10) 48.80 NaOH 0.1 N 772.7 (8) 95.66 (1) 57.15 (0.6) 3.37 Akuades + Kaca 296.8 (5) 58.26 (1) 986.8 (17) 73.54 NaOH 0.05 N+Kaca 386.5 (8) 48.38 (1) 980.7 (20) 68.19 NaOH 0.1 N + Kaca 466.5 (8) 61.26 (1) 873.1 (14) 62.33 keterangan : angka dalam kurung menunjukkan rasio komponen gula terhadap glukosa Sumber : Tafsin (2007).
Yokomizo (2005) menggunakan enzim mannanase terhadap BIS, jumlah mannosa yang diperoleh berkisar antara 12.5-19.9% dari total mannan yang ada pada BIS yang diperoleh dengan waktu reaksi selama 24-72 jam. Selanjutnya Jaelani (2007) melaporkan bahwa pengolahan secara biologis seperti fermentasi dengan menggunakan Trichoderma reesei juga mampu memperbaiki nilai nutrisi BIS.
Peranan Mannan untuk Meningkatkan Sistem Kekebalan Tubuh
Komponen gula mannosa dari MOS mempengaruhi sistem kekebalan dengan jalan merangsang sekresi protein pengikat mannosa, dan dikenal dengan istilah mannosa binding lectin (MBL). MBL disintesa di hati dan disekresikan ke dalam serum sebagai komponen dengan fase respon yang bersifat akut. MBL dapat berikatan dengan karbohidrat dari dinding sel bakteri, ragi atau virus (Janeway et al. 2005).
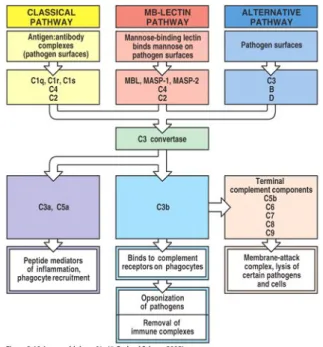
Laursen dan Nielsen (2000) menjelaskan bahwa ada tiga jalur aktivasi komplemen yaitu; jalur komplemen klasik diaktifkan melalui kompleks imun, jalur lektin diaktifkan oleh karbohidrat dari permukaan sel mikroba. Jalur alternatif diaktifkan oleh beragam campuran dan permukaan sel yang terkait dengan pengaturan dan pembentukan C3 convertase. Adapun gambaran aktivasi sistem komplemen dilihat pada Gambar 5.
Khusus pada aktivasi komplemen melalui jalur lektin dimediasi oleh mannosa
binding lectin (MBL) yang merupakan reseptor spesifik dari karbohidrat mikroba.
Jalur ini meliputi MBL protein, MASP-1, MASP-2, C4, dan C2. MBL berasosiasi dengan serin protease (MASP) bersama-sama membentuk C3 konvertase, dari pragmen C3 membentuk C3b. C3b berikatan dengan permukaan patogen dan ikatan-ikatan reseptor yang dikenal dengan pagositosis. C3b dapat juga berkombinasi dengan protein-protein pada permukaan patogen dan dari kompleks lapisan permukaan luar. Kompleks MBL dan fungsi protease sama dengan kompleks C1 dari komplemen klasik (Janeway et al. 2005).
Devegowda et al. (1994) menyebutkan bahwa MOS diturunkan dari dinding sel ragi Saccharomyces cerevisiae dan mempunyai derajat antigenitas yang tinggi yang disebabkan adanya komponen mannan dan glukan. Mannanoligosakarida (MOS) digunakan sebagai prebiotik, namun penggunaannya tidak secara selektif meningkatkan beberapa jenis bakteri yang menguntungkan. Perannya lebih sebagai pengikat dan memindahkan bakteri patogen dari saluran pencernaan dan merangsang sistem imunitas (Spring et al. 2000). Selanjutnya Turner et al. (2000) menunjukkan adanya efek yang menguntungkan dari MOS terhadap kesehatan pada saluran pencernaan dan sistem kekebalan. Pada ternak kalkun ternyata penggunaan MOS akan meningkatkan level plasma IgG dan konsentrasi IgA pada cairan empedu.
Penelitian Swanson et al. (2002) yang dilakukan terhadap anjing menunjukkan hasil yang serupa. Pemberian MOS menunjukkan kandungan limfosit yang lebih tinggi dibandingkan dengan kontrol. Selanjutnya ketika perlakuan ini dikombinasikan dengan fruktooligosakarida (FOS) ternyata secara signifikan kandungan IgA lebih tinggi dibandingkan dengan kontrol. Kesimpulan umum penelitian ini yaitu suplementasi FOS dan MOS mempunyai efek yang menguntungkan terhadap kesehatan kolon dan status kekebalan dari anjing.
Lyons (1996) melaporkan penggunaan MOS pada tingkat 1-2 kg/ton pakan akan memperbaiki kekebalan yang ditunjukkan dengan meningkatnya level Ig (Imunoglobulin) dan menigkatkan aktivitas fagosit. Selain itu juga mempunyai fungsi untuk mengikat bahan patogen pada saluran pencernaan (seperti E. coli dan
Tafsin (2007) melaporkan bahwa penggunaan polisakarida mannan (PM) dari BIS 1 000; 3 000; 4 000 ppm dalam ransum ayam titer antibodi terhadap IBD nyata lebih tinggi dibanding kontrol, namun tidak berpengaruh terhadap titer ND.
Sistem Kekebalan Tubuh
Secara garis besar kekebalan yang diperoleh hewan dapat terjadi secara alami dan buatan. Kekebalan secara alami mencakup penghalang secara fisik dan fisiologis yang mencegah masuknya agen infeksi seperti kulit, saliva, asam lambung, dan anti bakteri seperti lysozim. Kekebalan alami yang terjadi pada jaringan dan sirkulasi diperantarai sel efektor yang disebut fagosit dan sel “natural killer (NK)”. Selain itu ada juga komplemen darah yang mendukung fagositosis dan melisiskan patogen. Kekebalan secara buatan biasanya diperoleh secara aktif melalui infeksi alami atau dengan vaksinasi. Kekebalannya akan berkembang setelah beberapa hari atau minggu setelah pemaparan dan diperantarai oleh limfosit (Decker 2000).
Secara umum sistem kekebalan pada unggas tidak jauh berbeda dengan sistem kekebalan manusia maupun mamalia lainnya. Unggas mempunyai dua organ limfoid primer yaitu timus dan bursa fabricius. Stimulasi antigenik menginduksi respons imun yang dilakukan sistem seluler secara bersama-sama diperankan oleh makrofag, limfosit B dan limfosit T. Makrofag memproses antigen dan menyerahkannya kepada limfosit. Limfosit B yang berperan sebagai mediator imunitas humoral, yang mengalami transformasi menjadi sel plasma dan memproduksi antibodi. Limfosit T mengambil peran pada imunitas seluler dan mengalami diferensiasi fungsi yang berbeda sebagai subpopulasi (Sharma 1991). Limfosit berperan dalam respon imun spesifik karena setiap individu limfosit dewasa memiliki sisi ikatan khusus sebagai varian dari prototipe reseptor antigen. Reseptor antigen pada limfosit B adalah bagian membran yang berikatan dengan antibodi yang disekresikan setelah limfosit B yang mengalami diferensiasi menjadi sel fungsional, yaitu sel plasma yang disebut juga sebagai membran imunoglobulin. Reseptor antigen pada limfosit T bekerja mendeteksi bagian protein asing atau patogen asing yang masuk sel inang (Janeway et al. 2001).
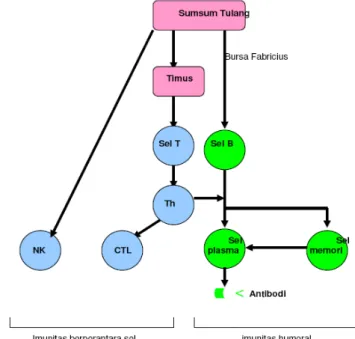
Mekanisme kerja sistem imun disajikan pada Gambar 6 (Cann 1997 diacu dalam: Samsi 2007).
Gambar 6 Mekanisme secara umum sistem imun (Cann 1997 diacu dalam: Samsi 2007)
Sel limfosit B berasal dari sumsum tulang belakang dan mengalami pendewasaan pada jaringan ekivalen bursa. Jumlah sel limfosit B dalam keadaan normal berkisar antara 10 dan 15%. Setiap limfosit B memiliki 105 B cell
receptor (BCR), dan setiap BCR memiliki dua tempat pengikatan yang identik.
Antigen yang umum bagi sel B adalah protein yang memiliki struktur tiga dimensi. BCR dan antibodi mengikat antigen dalam bentuk aslinya. Hal ini membedakan antara sel B dan sel T, yang mengikat antigen yang sudah terproses dalam sel (Kresno 1996).
Limfosit dapat membentuk beratus-ratus jenis antibodi sensitif yang berbeda-beda, sifatnya spesifik untuk suatu antigen khusus dan tiap jenisnya dapat berganda mencapai jumlah yang sangat besar apabila digertak oleh antigen spesifik yang jumlahnya cukup (Frandson 1996). Sebelum terpapar dengan antigen yang spesifik, klon limfosit B tetap dalam keadaan dormant di dalam jaringan limfoid. Limfosit B berproliferasi menghasilkan sel plasma dan sel B
memori. Selanjutnya sel plasma akan menghasilkan antibodi sebagai sistem
Antibodi bekerja melalui dua cara yang berbeda untuk mempertahankan tubuh terhadap agen penyebab penyakit yaitu; 1) dengan cara langsung menginaktivasi agen penyebab penyakit, atau 2) dengan mengaktifkan sistem komplemen yang kemudian akan menghancurkan agen penyakit tersebut (Guyton 1995). Antibodi tidak dapat menembus sel, sehingga antibodi hanya akan bisa bekerja selama antigen berada di luar sel (Malole 1988).
Jajaran ketiga sel limfoid adalah natural killer cells (sel NK) yang tidak memiliki reseptor antigen spesifik dan merupakan bagian dari sistem imun nonspesifik. Sel ini beredar di dalam darah sebagai limfosit besar yang khusus memiliki granula spesifik yang memiliki kemampuan mengenal dan membunuh sel abnormal, seperti sel tumor dan sel yang terinfeksi virus. Sel NK berperan penting dalam imunitas nonspesifik pada patogen intraseluler (Janeway et al. 2001).
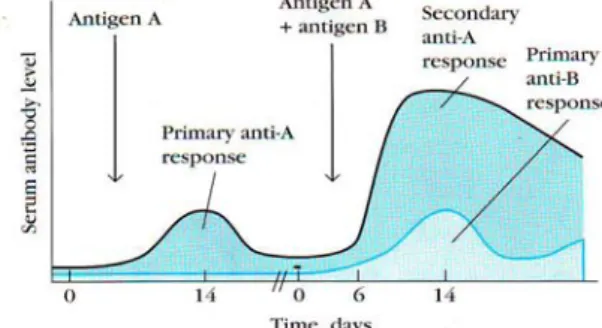
Kuby (2007) memberikan gambaran respon kebal primer dan sekunder terhadap antigen yang diukur dari tingkat antibodi di dalam serum (respon humoral) dapat dilihat pada Gambar 7. Ketika hewan disuntikkan dengan
Gambar 7 Perjalanan waktu respon kebal primer dan sekunder terhadap antigen (Kuby 2007).
antigen A memperlihatkan respon antibodi primer di dalam serum yang rendah dan waktunya singkat puncaknya kira-kira 10-17 hari, penyuntikan dengan antigen yang sama (antigen A) ditambah antigen B menghasilkan respon sekunder yang mulai meningkat pada hari ke-7 dan bertahan lama (bulan atau tahun) daripada respon primer pada tikus.
Pada umumya uji respon imun humoral banyak dilakukan dengan penetapan kadar imunoglobulin dalam serum seperti IgG, IgA dan IgM, sedangkan kadar IgD tidak bermakna dalam menentukan kompetensi imunogenik (Kresno 1996).
Sistem Kekebalan umum dari Mukosa
Permukaan mukosa terdapat di sepanjang rongga internal yang meliputi rongga hidung, rongga mulut, saluran pernapasan, saluran pencernaan (gastrointestinal tract=GI tract), dan saluran genital. Kurang lebih 80% dari permukaan mukosa menyelubungi saluran pencernaan (Kiyono 1997).
Permukaan mukosa yang dilindungi oleh sistem kekebalan lokal yang berfungsi terpisah dari sistem kekebalan sistemik. Mekanisme pertahanan mukosa tersebut terdiri atas rintangan fisik dan seluler, termasuk garis epitel yang hubungannya dengan lapisan lendir mukosa. Sistem imun pada permukaan mukosa disebut dengan MALT (mucosal associated lymphoid tissue). Pada prinsipnya struktur jaringan kerja immunologik pada permukaan mukosa bagian luar (MALT) terdiri atas gut associated lymphoid tissue (GALT), bronchus
associated lymphoid tissue (BALT), nasopharyngeal lymphoid tissue (NALT), larynx lymphoid tissue (LALT), dan genitourinary lymphoid tissue (GULT) (Ogra et al. 2001; Bar-Shira dan Friedman 2005). MALT membentuk suatu sistem
hubungan sekretori dimana sel limfosit yang teraktivasi oleh antigen, terutama yang memproduksi IgA dan IgE, akan bersirkulasi pada seluruh permukaan mukosa membentuk sistem imun mukosal (Roitt dan Delves 2001). Mekanisme respon imun mukosal ini akan terjadi jika antigen masuk melalui jalur mulut. Respon imun yang paling umum terjadi adalah respon mukosal yaitu peningkatan jumlah sel pensekresi IgA dan IgA sekretori (Perdigon et al. 1995).
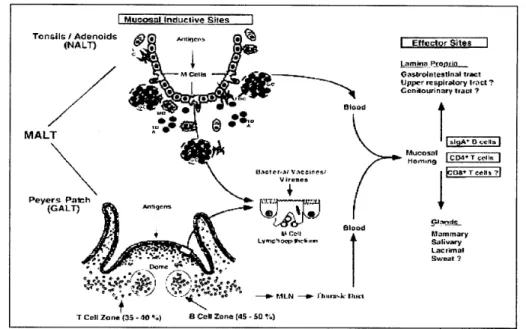
Induksi kekebalan mukosa dimulai ketika antigen kontak atau berhubungan dengan sel limfoid dalam atau di bawah epitelium (Mayhofer 1994). Hal ini dapat terjadi ketika virus menginfeksi atau membunuh sel epitel, antigen dapat menyebrangi epitel intact melalui sel epitel khusus untuk membawa antigen (specialized antigen-transporting epithelial cells) yang disebut sel M (microfold). Sel-sel M ini terlibat dalam proses pengambilan, transportasi, memproses dan presentasi antigen mikroba (Neutra et al. 1996). Selanjutnya dijelaskan bahwa interaksi sel epitel dengan limfosit T dan B menginduksi sel epitel untuk berdiferensiasi menjadi sel-sel M secara in vitro. Sel-sel M (Gambar 8) berada dalam tempat induksi mukosa (mucosal inductive sites) pada saluran pencernaan dan pernafasan atas, terutam dalam Payer’ patches dan NALT, tonsil dan adenoid.
Sel M diduga mempunyai peran penting dalam pengolahan antigen dan kemungkinan induksi kekebalan mukosa yang antigen spesifik di tempat efektor
Gambar 8 Sel-sel M dan induksi kekebalan mukosa (Van Ginkel et al. 2000) mukosa (mucosal effector sites). Kekebalan pada permukaan mukosa terutama terdiri atas CD4+ sel, secretory Imunoglobulin A (S-IgA), dan T lymphocytes yang bersifat antigen spesifik sitotoksik atau cytotoxic T lymphocytes (CTLs) (Van Ginkel et al. 2000).
Imunoglobulin A plasma pada umumnya dijumpai dalam bentuk monomerik, berbeda dengan IgA sekretori (sIgA) ada dalam bentuk dimer atau polimer yang banyak dijumpai pada sekresi permukaan mukosa (Salminen et al. 1998). IgA sekretori berbentuk dimer yang dihubungkan dengan sebuah rantai J (sistein kaya polipeptida) dan mengandung komponen sekretori (Roitt dan Delves 2001; Kindt et al. 2007). IgA monomer adalah molekul 7S dengan BM 160 000 dalton, IgA dimer adalah molekul 11S BM 320 000 dalton dan IgA sekretori adalah molekul 11.4S BM 390 000 dalton (Tizard 1982). Komponen sekretori diduga bertindak sebagai reseptor IgA untuk menembus epitel mukosa dengan cara endositosis dan melindungi molekul IgA terhadap enzim proteolitik (Kresno 1996).
Walaupun pengukuran IgA pada serum sedikit merefleksikan respon imun mukosa (Erickson dan Hubbard 2000). Namun demikian IgA serum dapat merefleksikan respon imun humoral secara keseluruhan karena IgA juga
merupakan produk dari sistem imun humoral dan jumlahnya terbanyak ketiga dalam serum ayam setelah IgG dan IgM (Tizard 1982). Selanjutnya dijelaskan bahwa tingkat perkiraan IgA pada ayam yaitu; dalam serum 50 mg/100 ml, sekresi air liur 20 mg/100 ml, sekresi air mata 15 mg/100 ml dan sekresi hidung belum diketahui.
Imunoglobulin A tidak bakterisidal, tidak terikat pada makrofag atau memperkuat fagositosis dan mengikat komplemen hanya dengan jalur alternatif. Tetapi IgA mempunyai aktifitas netralisasi dan juga menetralkan beberapa enzim virus dan bakteri. Cara kerjanya yang paling penting adalah mencegah perlekatan bakteri dan virus ke permukaan epitel. Menjaga permukaan mukosa dari antigen karena tahan terhadap proteolisis intraluminal dan tidak menimbulkan respon inflamasi (Tizard 1982; Salminen et al. 1998).
Spector (1993) menjelaskan bahwa virus terkadang dapat dihilangkan diluar sel pada membran mukosa atau dalam aliran darah, sebelum kolonisasi sel utama terjadi. Garis pertahanan pertama terhadap virus ialah interferon dan IgA sekretori dari sel epitel yang reaktif terhadap antigen virus yang dihasilkan oleh imunisasi atau infeksi sebelumnya, akan melenyapkan virus dengan bantuan komplemen teraktifkan.
Adjuvan
Dalam beberapa keadaan, seperti vaksinasi dianggap perlu untuk meningkatkan reaksi kebal atau memperkuat imunogenisitas vaksin mati atau toxoid. Bahan yang dapat melakukan hal itu disebut adjuvan. Berbagai macam senyawa telah digunakan walaupun banyak hal cara kerjanya tidak jelas. Adjuvan yang paling sederhana adalah senyawa yang berfungsi untuk memperlambat pengeluaran antigen (Tizard 1982). Selanjutnya dijelaskan adjuvan dengan bahan baku minyak biasanya tidak cocok digunakan pada hewan yang diperuntukkan untuk konsumsi manusia karena minyak dapat merembes ke bidang farsial dan merusak daging. Adjuvan Freud lengkap sangat tidak dapat diterima pada hewan pangan, tidak saja karena minyak mineral, tetapi juga mikobakteri di dalam adjuvan akan mengakibatkan hewan tuberkuli positif selain itu dapat bersifat karsinogenik.
Berdasarkan penemuan Pietersz et al. (2008) yang menyatakan hubungan antara komposisi vaksin yang terdiri dari karbohidrat yang merupakan polimer dari mannosa yang dicampur dengan antigen virus influenza inaktif yang diberikan pada tikus secara intranasal menunjukkan hasil peningkatan titer HI lebih tinggi dibandingkan pemberian antigen H5N1 sendiri ( HI titer 80 vs 40) 12 hari setelah vaksinasi pertama.
Mannan, sebuah polimannosa atau polisakarida dari dinding sel ragi, dimana penambahan dan dikonjugasikan saliva manusia (menekan antigen kanker) telah digunakan pada tikus untuk menginduksi respon imun (Apostolopoulos et al. 1995). Imunisasi intraperitoneal didalam merangsang imunitas seluler juga memperlihatkan produksi sitotoksik limfosit T (CTLs) dan beberapa prekursor, Th1 cytokines IFN-γ dan IL-12. Telah dicobakan pada lebih dari 100 ekor tikus, dan mannan tidak memperlihatkan efek toksik atau autoimmun (Karanikas et al. 1997). Reseptor yang terikat mannosa telah diidentifikasi pada makrofag dan sel dendrit. Penambahan mannan memperlihatkan respon produksi IL-12 pada makrofag, dan juga merangsang sel T, dan mempercepat antigen jalur class I untuk produksi cytotoxic sel T pada tikus (Apostolopoulos et al. 2000).
Penyakit Avian Influenza (AI)
Kejadian Penyakit Avian Influenza dan Penularannya
Virus AI di Indonesia telah ditemukan sejak September 2003, kasus avian influenza di Indonesia mencapai puncaknya pada bulan Januari-Februari 2004. Wabah AI gelombang ke dua di Indonesia sekitar akhir bulan Oktober 2004-Maret 2005 (Dharmayanti et al. 2005a).
Penyakit AI menyebabkan kematian yang tinggi pada ayam komersial petelur di Indonesia (6.2 juta ekor). Kerugian lain yang ditimbulkan adalah psikologis masyarakat, yang secara nyata mengimbas perekonomian negara, khususnya yang berkaitan dengan unggas dan produk-produk asal unggas. Unggas yang terserang pada umumnya adalah ayam petelur, ayam pedaging, bebek dan puyuh (Soejoedono dan Handharyani 2005). Virus HPAI menyebabkan penyakit yang sistemik dengan kematian yang cepat pada ayam dan kalkun, biasanya mendekati hampir 100%. Semua isolat highly pathogenic avian influenza (HPAI)
adalah subtipe H5 atau H7, tetapi tidak semua subtipe H5 atau H7 menyebabkan HPAI (Suarez et al. 2004).
Kejadian AI pada unggas dari tahun 2003 sampai tahun 2007 dan penyebarannya di Indonesia disajikan pada Tabel 3.
Tabel 3 Jumlah unggas yang dilaporkan terserang AI dan penyebarannya di Indonesia
Tahun Jumlah unggas yang dilaporkan terserang AI (dalam ribuan ekor)
Jumlah Propinsi yang dinyatakan terjangkit AI 2003 4 123.791 9 2004 5 327.393 17 2005 643.622 25 2006 1 333.327 30 2007 84.729* 31**
Keterangan : Sumber data UPP-AI Departemen Pertanian (Laporan Dinas) (diacu dalam: Jatmiko 2007)
*Data sampai 9 maret 2007 (Deptan). **Data sampai 27 Juli 2007 (Komnas FBPI).
Penularan virus AI dapat terjadi secara langsung dan tidak langsung. Virus AI dapat menyebar dengan cepat diantara populasi unggas, penularan dapat dipengaruhi oleh banyak faktor yaitu, strain virus, strain unggas dan faktor lingkungan. Sumber penularan virus AI adalah ekskreta yang berasal dari hidung, konjuntiva, dan kloaka unggas yang terinfeksi ke lingkungan karena virus bereplikasi di dalam saluran pernafasan, pencernaan, ginjal, dan organ reproduksi. Penularan virus AI juga dapat terjadi secara oral melalui pakan dan air minum yang tercemar oleh virus AI (Swayne dan Suarez 2000; Soejoedono dan Handharyani 2005).
Virus Avian Influenza pada Unggas Air
Unggas air terutama yang termasuk dalam orde Aseriformis (bebek dan angsa) dan Caridiformis (burung camar dan burung-burung pantai) merupakan inang alami dari virus influenza A. Beberapa spesies unggas domestik seperti ayam, kalkun, puyuh dan merak rentan terhadap infeksi dari virus AI. Virus influenza A biasanya tidak menimbulkan penyakit pada inang alami, dimana pada hewan tersebut virus ini berada dalam keadaan seimbang dan tidak menimbulkan penyakit (Webster et al. 1992; Fouchier 2003). Virus bereplikasi di gastrointestinal itik, sehingga shedding virus bersama feses ditransmisikan ke unggas atau mamalia lain melalui fecal-oral (Sturm-Ramirez et al. 2004; CDC
2005). Secara periodik virus influenza disebarkan ke inang lain, termasuk mamalia, dan menyebabkan infeksi yang sifatnya sementara dan kadang-kadang menimbulkan kematian. Itik dianggap sebagai sumber virus H5N1 pada outbreak di Cina tahun 2000-2004 (Li et al. 2005). Outbreak H5N1 di Hongkong tahun 2001 juga berasal dari reservoir itik dan angsa yang mengalami reassortment dengan virus AI lainnya sehingga muncul virus yang bersifat patogen pada unggas darat (Sturm-Ramirez 2004). Strain patogenik H5N1 hanya menyebabkan gejala klinis ringan pada itik, tetapi secara “silently” dapat mempropagasi virus pada unggas lain (Sturm-Ramirez 2005).
Gambaran Klinis Penyakit Avian Influenza (AI)
Gambaran klinis penyakit AI pada unggas bervariasi serta gejalanya sering tidak spesifik, oleh karena itu tidak mungkin untuk menegakkan diagnosis hanya berdasarkan gambaran klinis. Virus berkembang selama beberapa hari, tergantung pada karakteristik isolat, dosis inokulum, spesies dan usia unggas. Unggas yang menderita AI dapat mengeluarkan virus dalam jumlah besar di kotorannya. Virus tersebut dapat bertahan hidup di air sampai 4 hari pada suhu 22oC dan lebih dari 30 hari pada suhu 0oC. Di dalam feses unggas dan dalam tubuh unggas yang sakit, virus dapat bertahan lebih lama, tetapi akan mati pada pemanasan 60oC selama 30 menit (Soejoedono & Handharyani 2005).
Gejala klinis infeksi AI berpatogenesis rendah tidak terlalu jelas, seperti bulu-bulu kusut, produksi telur secara perlahan menurun, penurunan berat badan disertai gangguan pernapasan ringan (Capua & Mutinelli 2001). Beberapa strain berpatogenesis rendah misalnya strain H2N9 dari garis Asia virus ini telah beradaptasi sehingga menghasilkan replikasi yang efisien dalam unggas, dan menimbulkan gejala klinis yang nyata serta mengakibatkan kematian secara signifikan. Infeksi virus AI yang patogenitasnya tinggi, menimbulkan penyakit yang ditandai dengan serangan mendadak dan gejala hebat serta kematian mendekati 100% dalam jangka waktu 48 jam (Swayne & Suarez 2000). Penyebaran virus dalam kelompok unggas tergantung bentuk pemeliharaannya. Pada kelompok unggas yang dilepas di tempat kotor dan terjadi hubungan langsung serta pencampuran dengan hewan lain, penyebaran infeksi berlangsung
lebih cepat daripada yang dipelihara dalam kandang. Namun masih diperlukan beberapa hari untuk terjadinya penularan yang sempurna (Capua et al. 2000).
Infeksi virus pada peternakan unggas skala besar, terjadinya penurunan konsumsi air dan makanan yang drastis dalam waktu singkat. Hal ini dapat menjadi tanda akan adanya penyakit sistemik. Pada ayam petelur, terhentinya produksi telur sangat nyata. Secara individual ayam yang terkena penyakit HPAI sering hanya menunjukkan apatis dan imobilitas. Pembengkakan nampak pada daerah kepala yang tidak ditumbuhi bulu, terjadi sianosis pada jengger, gelambir dan kaki, diare dengan kotoran berwarna kehijauan, dan susah bernafas, dapat dijumpai meskipun tidak selalu (inkonsisten). Pada ayam petelur, awalnya telur yang dihasilkan berkulit lembek, tetapi kemudian produksi telur berhenti secara cepat sejalan dengan perkembangan penyakit (Elbers et al. 2005). Gejala sistem saraf termasuk tremaor, tortikolis, dan ataxia mendominasi gambaran klinis pada spesies yang begitu rentan seperti bebek, angsa, serta burung onta.
Vaksinasi Avian Influenza (AI)
Pelaksanaan pencegahan, pengendalian dan pemberantasan penyakit dilakukan dengan melaksanakan 9 (sembilan) strategi penanggulangan avian influenza yang terdiri atas; (1) Peningkatan keamanan dari penularan (biosekuriti); (2) Vaksinasi; (3) Pemusnahan terbatas (depopulasi) di daerah tertular; (4) Pengendalian lalu lintas unggas, produk unggas dan limbah peternakan unggas; (5) Surveilans dan penelusuran (tracing back); (6) Pengisian kandang kembali (restocking); (7) Pemusnahan menyeluruh (stamping-out) di daerah tertular baru; (8) Peningkatan kesadaran masyarakat (public awareness); (9) Monitoring dan evaluasi (Departemen Komunikasi dan Informatika Badan Informasi Publik 2005).
Kejadian AI kemudian menurun sejalan dengan mulai dilakukannya kebijakan pemerintah melakukan vaksinasi AI pada unggas sebagai salah satu alat untuk mengendalikan penyakit ini (Dharmayanti et al. 2005a). Dalam pelaksanaanya, strategi vaksinasi harus dipandang sebagai alat dalam usaha pengendalian yang komprehensif yang mencakup biosekuriti, edukasi, diagnostik dan surveilans, serta eliminasi virus pada hewan yang terinfeksi (FKH IPB 2007).
Vaksinasi diperlukan dalam penanganan AI karena akan melindungi gejala klinis dan mortalitas disebabkan virus highly pathogenic avian influenza (HPAI). Dengan vaksinasi akan mengurangi populasi yang rentan, mengurangi pencemaran/shedding virus di lokasi peternakan dan tujuan utamanya adalah mencegah kerugian ekonomi (Machdum 2008).
Zarkasie (2007) menjelaskan bahwa vaksin H5N1 buatan lokal diproduksi pada tahun 2003. Vaksin ini tak melalui proses reverse genetic yang memperhatikan tingkat patogenitas virus. Padahal virus H5N1 tercatat amat patogen yang pembuatan antigennya tidak bisa dilakukan dengan cara biasa. Akibatnya vaksin tidak memiliki kompatibilitas (keampuhan) seratus persen membasmi virus. Penggunaan vaksin H5N2 dinilai tidak tepat. Dari tinjauan molekuler, struktur RNA virus H5N2 berbeda dengan H5N1.
Pernyataan Malole (1988) bahwa titer antibodi protektif akan mengalami penurunan yang disebabkan oleh adanya waktu paruh antibodi. Antibodi dengan titer yang tinggi bersifat protektif terhadap adanya infeksi lapangan. Rahardjo (2004) menjelaskan bahwa berdasarkan standar OIE, 3 minggu setelah vaksinasi minimal terbentuk antibodi setinggi 24. Selanjutnya Darminto (2006) menyatakan bahwa pemeriksaan serologis dapat dilakukan untuk mengetahui adanya pembentukan antibodi terhadap virus AI yang dapat diamati pada hari ke-7 sampai hari ke-14 pasca infeksi. Seekor ayam yang dinyatakan kebal terhadap penyakit AI jika memiliki titer antibodi HI serendah-rendahnya 4 (log 2).
Peningkatan antibodi sebagai tanda keberhasilan suatu program vaksinasi. Selain itu kunci keberhasilan vaksinasi ditentukan oleh penggunaan vaksin yang berkualitas tinggi dan harus diberikan terlebih dahulu sebelum terjadinya infeksi oleh agen infeksi lapang dan memberikan perlindungan kolektif pada semua ayam (Machdum 2008).