commit to user
IDENTIFIKASI BAKTERI PENGHASIL FITASE BERDASARKAN
GEN 16S rRNA DAN KARAKTERISASI FITASE
DARI KAWAH SIKIDANG DIENG
TESIS
Disusun untuk memenuhi sebagian persyaratan memcapai derajat Magister
Program Studi Biosain
Oleh
Evy Novita Sari
S 901008007
PROGRAM PASCASARJANA
UNIVERSITAS SEBELAS MARET
SURAKARTA
commit to user
commit to user
commit to user
iv
PERNYATAAN ORISINALITAS DAN PUBLIKASI TESIS
1. Saya menyatakan dengan sebenar-benarnya bahwa Tesis yang berjudul “Identifikasi
Bakteri Penghasil Fitase Berdasarkan Gen 16S rRNA dan Karakterisasi Fitase dari
Kawah Sikidang Dieng” ini adalah karya saya sendiri dan tidak terdapat karya ilmiah
yang pernah diajukan oleh orang lain untuk memperoleh gelar akademik serta tidak
terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain,
kecuali yang secara tertulis dikutip dalam naskah ini dan disebutkan dalam sumber
kutipan dan daftar pustaka. Apabila ternyata di dalam naskah Tesis ini dapat
dibuktikan terdapat unsur-unsur jiplakan, saya bersedia Tesis beserta gelar
MAGISTER saya dibatalkan serta diproses sesuai dengan peraturan
perundang-undangan yang berlaku (UU No. 20 tahun 2003, pasal 25 ayat 2 dan pasal 70).
2. Tesis ini merupakan hak milik Prodi Biosain PPs UNS. Publikasi sebagian atau
keseluruhan isi Tesis pada jurnal atau forum ilmiah lain harus seijin Ketua Prodi
Biosain PPs UNS dan minimal satu kali publikasi menyertakan tim pembimbing
sebagai author. Apabila dalam waktu sekurang-kurangnya satu semester (6 bulan
sejak pengesahan Tesis) saya tidak melakukan publikasi dari sebagian atau
keseluruhan Tesis ini maka Prodi Biosain PPs UNS berhak mempublikasikannya
pada jurnal ilmiah yang diterbitkan oleh Prodi Biosain PPs UNS dan atau media
ilmiah lain yang ditunjuk.. Apabila saya melakukan pelanggaran dari ketentuan
publikasi ini, saya bersedia mendapatkan sanksi akademik yang berlaku.
commit to user
v
IDENTIFIKASI BAKTERI PENGHASIL FITASE BERDASARKAN
GEN 16S rRNA DAN KARAKTERISASI FITASE
DARI KAWAH SIKIDANG DIENG
Evy Novita Sari, Sajidan, Sugiyarto
Program Pascasarjana Biosain Universitas Sebelas Maret
Surakarta
Abstrak
Asam fitat merupakan bentuk utama penyimpanan fosfat di dalam bahan makanan yang tidak dapat dihidrolisis dalam saluran pencernaan hewan monogastrik, yang berasosiasi dengan protein dan garam mineral membentuk senyawa kompleks yang tidak larut sehingga menghambat penyerapan fosfat, protein dan mineral di dalam tubuh. Fitase atau mio inositol heksakisfosfat fosfohidrolase adalah enzim yang dapat menghidrolisis ikatan fosfoester pada asam fitat, menghasilkan inositol, fosfat anorganik, protein dan mineral, sehingga fosfat, protein dan mineral mudah diserap oleh usus, dapat meningkatkan kualitas nutrisi dan mengurangi polusi fosfat. Tujuan dari penelitian ini yaitu: 1). Menguji adanya bakteri dengan aktivitas fitase pada air dan lumpur kawah Sikidang Dieng. 2). Mengidentifikasi bakteri penghasil fitase tersebut berdasarkan morfologi dan gen 16S rRNA. 3). Mengkarakterisasi ekstrak kasar fitase yang diperoleh dari hasil isolat terpilih.
Bakteri diisolasi dari sampel air dan lumpur kawah Sikidang Dieng, kemudian diseleksi dalam media Luria bertani + fitat + bekatul. Aktivitas fitase diukur dengan spektrofotometer dengan kalibrasi KH2PO4. Tiga isolat bakteri
dengan aktivitas fitase terbesar diidentifikasi berdasarkan morfologi dan gen 16S rRNA, sedangkan fitase yang dihasilkannya dikarakterisasi lebih lanjut meliputi suhu optimum, pH optimum, stabilitas suhu dan pH, dan pengaruh ion logam terhadap aktivitas fitase.
Hasil penelitian diperoleh 3 isolat yang memiliki aktivitas fitase tertinggi yaitu Bacillus cereus EN 10, Bacillus cereus EN 16, dan Bacillus sp EN 6 dengan aktivitas fitase sebesar 0,32893 U/ml, 0,324953 U/ml, dan 0,32182 U/ml. Fitase dari ketiga bakteri tersebut memiliki suhu optimum 60ºC, 50ºC, dan 60º; dan memiliki pH optimum 4, 6, dan 6. Aktivitas fitase mengalami peningkatan karena penambahan ion Ca2+ dan Mg2+, dan mengalami penurunan karena penambahan ion Fe2+ dan Zn2+.
commit to user
vi
IDENTIFICATION OF BACTERIAL PHYTASE BASED ON 16S rRNA GENE
AND CHARACTERIZATION OF THE PHYTASE
FROM SIKIDANG CRATER DIENG
Evy Novita Sari, Sajidan, Sugiyarto
Bioscience Postgraduate Program
Sebelas Maret University Surakarta
Abstract
Phytic acid is the major storage form of phosphate in the food that can not be hydrolyzed in the gastrointestinal tract, which are associated with protein and its salt makes an insoluble complex compounds that inhibit the absorption of protein and minerals in the body. Phytase or myo inositol hexakisphosphate phosphohydrolase is an enzyme which hydrolyze the bond of phosphoester on phytic acid, produces inositol, inorganic phosphate, protein and mineral so that inorganic phosphate, protein and mineral can easily absorbed by intestine, increase the nutritional quality and reduse phosphate pollution. The aims of this research were: 1). To test the existence of bacteria that have phytase activity in the water and mud of Sikidang crater Dieng. 2). To identify the bacterial phytase based on 16S rRNA gene. 3). To characterize the crude extract of phytase from selected isolate of bacteria.
The bacteria were isolated from the water and the mud sample of Sikidang Dieng crater, then screening in Luria bertani media + phytate + bran medium. Phytase activity was measured by using a spectrophotometer with KH2PO4
calibration. Three isolates which have the highest phytase activity were identified based on 16S rRNA gene, and the crude extract of phytase were characterized further, using the optimum temperature, optimum pH, temperature and pH stability, and the effect of metal ion to the phytase activity.
The results showed that three isolates which have the highest phytase activity were Bacillus cereus EN 10, Bacillus cereus EN 16, and Bacillus sp EN 6 with phytase activity 0,32893 U/ml, 0,324953 U/ml, and 0,32182 U/ml respectively. The optimum temperature of phytase from that bacteria were 60ºC, 50ºC, and 60º; while the optimum pH were 4, 6, and 6. The phytase activity increased due to the adding of Ca2+ and Mg2+ ions, and decreased because of adding Fe2+ and Zn2+ ions.
commit to user
vii
MOTTO
Pertolongan, kemudahan dari Allah bisa datang tanpa diduga, dengan cara
yang tidak disangka pula. (EN)
Secuil pengetahuan itu mahal harganya, tidak hanya dibayar dengan materi
ataupun pemikiran, tapi juga dengan pengorbanan waktu. (EN)
commit to user
viii
HALAMAN PERSEMBAHAN
Kupersembahkan karya ini untuk:
Ibu Suprihati, Bapak Darsono, Andy, beserta keluarga besar.
Suamiku tercinta, Irka Ariaska.
Yang tersayang ”Cwety & Dedek”.
Ibu Suminah dan Bapak Sukamto, beserta keluarga besar.
commit to user
ix
KATA PENGANTAR
Dengan memanjatkan puji syukur kehadirat Allah SWT, atas limpahan
rahmat dan hidayahNya sehingga penulis dapat menyelesaikan tesis yang
berjudul: “Identifikasi Bakteri Penghasil Fitase Berdasarkan Gen 16S rRNA dan
Karakterisasi Fitase dari Kawah Sikidang Dieng”. Di dalam tulisan ini disajikan
bahasan mengenai bakteri penghasil fitase yang diidentifikasi secara morfologi
dan molekuler, dan karakterisasi fitase yang meliputi: optimalisasi suhu,
optimalisasi pH, stabilitas suhu dan pH, serta pengaruh ion logam terhadap
aktivitas fitase.
Nilai penting dari penelitian ini adalah untuk memberikan informasi
mengenai sumber enzim fitase yang berasal dari mikroorganisme kawah Sikidang
Dieng. Penemuan bakteri penghasil fitase yang dari kawah Sikidang Dieng dapat
menambah koleksi keanekaragaman bakteri penghasil fitase dari area yang
berbeda. Karakterisasi fitase pada penelitian ini diharapkan dapat dijadikan
sebagai referensi untuk mengembangkan enzim fitase agar dapat menghasilkan
fitase yang optimal dan dapat diaplikasikan di bidang industri.
Penulis menyadari bahwa tulisan ini masih banyak kekurangan dan jauh
dari sempurna. Atas kekurangan dan keterbatasan, penulis mengharapkan saran
yang membangun agar tulisan ini dapat bermanfaat bagi yang membutuhkan.
Surakarta, Desember 2012
commit to user
x
UCAPAN TERIMA KASIH
Dalam proses penyusunan tesis ini, penulis banyak memperoleh bantuan
dari berbagai pihak, sehingga kesulitan-kesulitan yang timbul dapat teratasi.
Dengan segala kerendahan hati, penulis mengucapkan terimakasih kepada semua
pihak yang telah memberi bimbingan dan bantuan kepada penulis sehingga tesis
ini dapat diselesaikan. Penulis mengucapkan terima kasih kepada :
1. Prof. Dr. Ravik Karsidi, M.S selaku rektor UNS Surakarta yang telah
memberikan izin studi di UNS.
2. Prof. Dr. Ir. Ahmad Yunus, M.S selaku Direktur Program Pascasarjana UNS
Surakarta yang telah memberikan izin studi di program Biosain Pascasarjana
UNS.
3. Prof. Dr. rer.nat. Sajidan, M.Si selaku dosen pembimbing I yang telah
memberikan banyak bimbingan dan bantuan kepada penulis sampai tesis ini
dapat terselesaikan dengan baik.
4. Prof. Dr. Sugiyarto, M.Si selaku Kaprodi Biosain sekaligus sebagai
pembimbing II yang telah memberikan bimbingan dalam penulisan tesis.
5. Dr. Ari Susilowati, M.Si selaku sekretaris Prodi Biosain sekaligus tim penguji
tesis yang juga telah memberikan bimbingan kepada penulis.
6. Prof. Drs. Suranto, M.Sc, Ph.D selaku tim penguji tesis yang juga telah
memberikan bimbingan kepada penulis.
7. Semua dosen di Prodi Biosain yang telah memberikan banyak ilmu kepada
commit to user
xi
8. Ibu Suprihati, bapak Darsono, Rizky Andi Purnomo, dan keluarga besar yang
telah menemani penulis sampling ke Dieng, memberikan banyak motivasi
dan segala kemudahan bagi penulis selama menyelesaikan studi di Biosain.
9. Irka Ariaska, S.Pd, suami penulis yang telah memberikan banyak motivasi,
dukungan, selalu setia menemani dan mendampingi dengan sabar selama
penulis menyelesaikan studi dan tesis ini.
10.Ibu Suminah, bapak Sukamto, mbak Inra nawang Esti, mas Apri Harlian
Rudarto, dan dek Yuni, yang telah memberikan motivasi dan memfasilitasi
penulis untuk menyelesaikan tesis.
11.Bapak Drs. Slamet Santosa, M.Si yang telah memberikan dukungan dan doa
kepada penulis.
12.Teman-teman Biosain 2010: mb Dian Kurniawati, mb Dina Rakhmanita
Hanum, mb Emet (Erma Musbita Tyastuti), mb Etis (Eti Setioningsih), mb
Adis (Dwianna Oktasari), Hesti Nurlaeli, Qiqi (Nur Rifki Fahriyati), mz
Anugrah Adi Santoso, pak Tedianto, pak Hariyadi Siswanto, pak Paryanto,
dan mz Triyadi. Terima kasih atas kebersamaan selama kuliah S2 di Biosain
yang sangat mengesankan.
13.Eti Setioningsih, S.Si, Dian Kurniawati, S.Si, Dina Rakhmanita Hanum, S.Si,
Wahyu Susilowati, dan Sri Winarseh, sebagai teman sejati yang menemami
lemburan di Laboratorium Biologi MIPA.
14.Iffah Nadya dan mas Rosyid yang telah membantu dalam administrasi di
Biosain.
15.Rita Wulandari, M.Si yang telah memperkenalkan tentang fitase dan
commit to user
xii
16.Imah, Fian, Astuti, Nita, Ika, Roila, Novieta, dkk (tim khusus P.Bio angkatan
2009), terima kasih atas dukungannya.
17.Andri Surya Destantri, S.Pd, thanx for all.
18.Laboran di Lab Biologi FKIP, mbak Tri yang telah membantu menyediakan
alat dan bahan selama melakukan penelitian di Lab Biologi FKIP.
19.Laboran di Lab Biologi MIPA yang telah membantu menyediakan alat, bahan,
serta mengajari penggunaan alat di Lab Biologi MIPA.
20.Semua pihak yang turut membantu baik secara langsung maupun tidak
commit to user
xiii
DAFTAR ISI
HALAMAN JUDUL………... i
HALAMAN PENGESAHAN PEMBIMBING……… ii
HALAMAN PENGESAHAN PENGUJI………. iii
PERNYATAAN ORISINALITAS DAN PUBLIKASI TESIS……….... iv
commit to user
A. Bakteri dari kawah Sikidang Dieng……… 27
commit to user
xv
B. Bakteri penghasil fitase………...
C. Aktivitas Fitase………...
D. Karakterisasi Fitase……….
1. Pertumbuhan bakteri terhadap aktivitas fitase.……….
2. Optimalisasi suhu fitase………
3. Optimalisasi pH fitase………...
4. Stabilitas suhu dan pH fitase……….
5. Pengaruh ion logam terhadap aktivitas fitase………
commit to user
xvi
DAFTAR GAMBAR
Gambar 1. Struktur asam fitat A menurut Neuberg, dan B menurut Anderson, (Tran, 2010).
4
Gambar 2. Hidrolisis asam fitat oleh fitase menurut Yao et al., (2011) 7 Gambar 3. Hidrolisis asam fitat oleh fitase menurut Kusumadjaja et al.,
(2009)
7
Gambar 4. Struktur fitase HAP dari Klebsiella sp ASR1 (Bohm et al., 2010).
9
Gambar 5. Struktur fitase BPP dari Bacillus subtilis (Zeng et al., 2011) 10 Gambar 6. Struktur fitase PAP dari kacang merah (Phaseolus vulgaris)
(Feder et al., 2012).
11
Gambar 7. Klasifikasi fitase berdasarkan analisis sekuens dan biokimia fitase menurut Oh (2004).
12
Gambar 8. Klasifikasi fitase menurut Sajidan (2004) berdasarkan kontruksi pohon filogenetik dari fitase HAP.
13
Gambar 9. Diagram kerangka pemikiran 16
Gambar 10. Peta lokasi kawah Sikidang Dieng 17
Gambar 11. Peta lokasi pengambilan sampel pada kawah Sikidang Dieng hasil foto satelit (X).
18
Gambar 12. Insert lokasi pengambilan sampel air dan lumpur kawah Sikidang Dieng.
18
Gambar 13. Koloni bakteri yang tumbuh pada media LB padat. 27 Gambar 14. Perbandingan warna kuning pada reaksi pengujian fitase. a.
adalah larutan kontrol, sedangkan b, c, dan d adalah larutan uji.
29
Gambar 15. Diagram batang hasil uji aktivitas fitase dari 28 isolat bakteri.
30
Gambar 16. Diagram batang hasil uji aktivitas fitase dari isolat EN 10, EN 16, dan EN 6.
31
Gambar 17. Kurva pertumbuhan bakteri terhadap aktivitas fitase dari isolat EN 10, EN 16, dan EN 6.
32
Gambar 18. Kurva optimalisasi suhu dari isolat EN 6, EN 10, dan EN 16. 34 Gambar 19. Kurva optimaalisasi pH dari isolat EN 6, EN 10, dan EN 16. 35 Gambar 20. Kurva aktivitas fitase pada suhu dan pH optimum fitase dari
isolat EN 6, EN 10, dan EN 16 yang diinkubasi sampai dengan 6 jam.
37
Gambar 21. Kurva persentase aktivitas relatif Fitase pada suhu dan pH optimum fitase dari isolat EN 6, EN 10, dan EN 16 yang diinkubasi sampai dengan 6 jam.
38
Gambar 22. Histogram pengaruh beberapa ion logam terhadap aktivitas fitase dari isolat EN 6, EN 10, dan EN 16.
commit to user
xvii
Gambar 23. Struktur yang menunjukkan pengikatan ion logam dengan gugus fosfat pada molekul asam fitat menurut Tran (2010)
40
Gambar 24. Morfologi dari koloni isolat EN 10 (24.a), koloni isolat EN 16 (24.b) dan EN 6 (24.c).
41
Gambar 25. Gambar morfologi sel bakteri dengan perbesaran mikroskop 10x10. Morfologi sel bakteri dari isolat EN 10 (25.a), EN 16 (25.b) dan EN 6 (25.c).
41
Gambar 26. Gel elektroforesis gen 16S rRNA dari isolat EN 6, EN 10, dan EN 16 yang diamplifikasi dengan menggunakan primer 27f dan 765r. amiloliquefasciens AP-17 (no. akses JQ740157.1), dan B. subtilis strain CF92 (no. akses HQ127622.1).
48
Gambar 28. Pohon filogenetik berbasis gen 16S rRNA dari B. cereus EN 10, B. cereus EN 16, Bacillus sp. EN 6 dengan beberapa jenis Bacillus lain dan Pantoea agglomerans.
commit to user
xviii
DAFTAR LAMPIRAN
Lampiran 1 Kurva standar KH2PO4 61
Lampiran 2 Uji aktivitas fitase dari 28 isolat 62 Lampiran 3 Uji aktivitas fitase dari 3 isolat tertinggi 64 Lampiran 4 Data absorbansi pertumbuhan bakteri dari isolat EN 6, EN
10, dan EN 16.
65
Lampiran 5 Data absorbansi Optimalisasi suhu dari isolat EN 6, EN 10, dan EN 16.
66
Lampiran 6 Data absorbansi Optimalisasi pH dari isolat EN 6, EN 10, dan EN 16.
68
Lampiran 7 Data Stabilitas Fitase dari isolat EN 6, EN 10, dan EN 16. 70 Lampiran 8 Data absorbansi pengaruh ion logam dari isolat EN 6, EN
10, dan EN 16.
72
Lampiran 9 Gel elektroforesis hasil ekstraksi DNA 73 Lampiran 10 Hasil Sekuens dari isolat EN 6, EN 10, dan EN 16. 74 Lampiran 11 Sekuens dari gen bank NCBI yang di alingment 75
Lampiran 12 Foto dokumentasi alat 77
commit to user BAB I
PENDAHULUAN
A. Latar Belakang
Asam fitat merupakan bentuk utama penyimpanan fosfat di dalam tanaman
biji-bijian, sereal dan leguminose, yang digunakan dalam bahan makanan manusia
maupun makanan ternak. Asam fitat tidak dapat dihidrolisis dalam saluran
pencernaan hewan monogastrik, dan asam fitat tersebut akan berasosiasi dengan
garamnya membentuk senyawa kompleks yang tidak larut sehingga menghambat
penyerapan mineral di dalam tubuh. Kekurangan mineral di dalam tubuh dapat
menyebabkan gangguan metabolisme yang dapat menyebabkan berbagai jenis
penyakit.
Asam fitat yang tidak dapat dihidrolisis tersebut tidak dapat dicerna di
dalam saluran pencernaan sehingga akan diekskresikan melalui kotoran. Kotoran
yang mengandung gugus fosfat tersebut dapat mencemari tanah dan perairan di
sekitarnya. Untuk menanggulangi masalah pencemaran tersebut, biasanya pada
pakan ternak ditambah dengan enzim fitase.
Fitase atau myo inositol heksakisfosfat fosfohidrolase adalah enzim yang
dapat menghidrolisis ikatan fosfoester pada asam fitat, menghasilkan fosfat
anorganik dan ester fosfat. Fitase terdapat di dalam tumbuhan dan
mikroorganisme. Fitase dari mikroorganisme yang telah diteliti oleh para ahli
commit to user
(Irving et al., 1972) Bacillis subtilis (Kerouvo et al., 2000), Eschercia coli
(Greiner et al., 1993), dan Klebsiella pneumonia (Sajidan et al., 2004).
Fitase banyak dimanfaatkan dalam industri pangan dan pakan ternak.
Adanya fitase pada bahan pangan manusia akan memudahkan dalam pencernaan
asam fitat, sedangkan fitase pada bahan pakan ternak akan meningkatkan kualitas
nutrisi pakan ternak dan mengurangi polusi fosfat. Pemanfaatan fitase dalam
industri tersebut membutuhkan suhu tinggi dalam pengolahannya, sehingga
dibutuhkan enzim fitase yang dapat tahan terhadap suhu tinggi. Fitase yang dapat
tahan terhadap suhu tinggi dapat diperoleh dari mikroorganisme yang dapat hidup
di daerah dengan suhu tinggi pula. Mikroorganisme tersebut hidup pada suhu
45-80ºC (Vieille dan Zeikus, 2001). Mikroorganisme tahan panas dapat diperoleh
pada sumber air panas atau kawah gunung berapi.
Kawah Sikidang Dieng merupakan salah satu sumber air panas dengan
suhu antara 60-80ºC. Oleh karena itu, pada penelitian ini mengambil air kawah
Sikidang Dieng untuk diidentifikasi bakteri yang dapat menghasilkan fitase, dan
dikarakterisasi fitase yang dihasilkannya, dengan harapan diperoleh fitase yang
memiliki stabilitas pada suhu tinggi sehingga enzim tersebut dapat dimanfaatkan
commit to user
B. Rumusan Masalah
1. Apakah terdapat bakteri dengan aktivitas fitase pada air dan lumpur kawah
Sikidang Dieng?
2. Bagaimana identitas bakteri penghasil fitase tersebut berdasarkan gen 16S
rRNA?
3. Bagaimana karakteristik ekstrak kasar fitase yang diperoleh dari hasil isolat
terpilih?
C. Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Menguji adanya bakteri dengan aktivitas fitase pada air dan lumpur kawah
Sikidang Dieng.
2. Mengidentifikasi bakteri penghasil fitase tersebut berdasarkan gen 16S rRNA.
3. Mengkarakterisasi ekstrak kasar fitase yang diperoleh dari hasil isolat terpilih.
D. Manfaat Penelitian
1. Menambah koleksi keanekaragaman bakteri dengan aktivitas fitase yang
berasal dari area yang berbeda.
2. Memberi sumbangan bagi kemajuan ilmu pengetahuan dan teknologi pada
umumnya dan bidang enzimologi pada khususnya.
3. Dengan mempelajari karakter ekstrak kasar fitase, diharapkan diperoleh
sumber fitase baru yang dapat dimanfaatkan pada industri pangan dan
commit to user BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Asam fitat
Asam fitat atau myo-inositol hexakisphosphate merupakan bentuk utama
penyimpanan unsur fosfor yang terdapat pada tanaman biji-bijian, serealia,
leguminose, dan oilseed (Kerovuo et al., 2000). Asam fitat secara struktural adalah
suatu cincin myo-inositol yang mengikat penuh 6 fosfat disekeliling cincin
(Cosgrove, 1980). Rantai C dikelilingi oleh 6 atom fosfat yang berikatan dengan
oksigen dan hidrogen (Gambar 1).
Gambar 1. Struktur asam fitat A menurut Neuberg, dan B menurut Anderson, (Tran, 2010)
Wyss et al. (1999) mengungkapkan dua aspek yang sangat penting dari
asam fitat dalam konteks nutrisi manusia dan nutrisi ternak yaitu: 1). Kelompok
hewan monogastrik memiliki tingkat degradasi enzim fitase yang rendah pada
saluran pencernaannya, dan asam fitat tidak dapat diserap sendiri oleh tubuhnya,
sehingga dalam makanan ternak perlu ditambah dengan asupan fosfat anorganik
commit to user
antinutrisi, bentuknya yang kompleks dengan protein dan berbagai macam ion
logam, sehingga dapat menurunkan ketersediaan nutrisi makanan.
Lain halnya dengan Cosgrove dan Irving (1980) yang menyatakan peranan
fitat pada biji-bijian sebagai berikut: 1) sebagai sumber fosfor; 2) untuk
penyimpanan energi; 3) sebagai kompetitor adenosine trifosfat selama biosintesis
phytin ketika metabolisme biji terhambat dan terjadi dormansi; 4) sebagai
pengerah kation divalent yang diperlukan untuk mengontrol proses seluler dan
dilepaskan selama perkecambahan pada tanaman penghasil fitase; 5) sebagai
regulator ketersediaan fosfat anorganik pada biji.
Dilihat dari sudut pandang tanaman, fitat penting untuk pertumbuhan biji
dan turut berperan dalam meningkatkan hasil panen. Namun jika dilihat dari sudut
pandang hewan, fitat merupakan komponen anti nutrisi. (Thompson, 1993).
Adanya asam fitat menyebabkan beberapa mineral dan protein menjadi tidak terlarut
sehingga tidak dapat diserap oleh usus manusia dan hewan monogastrik (Liu et al.,
2005).
Asam fitat yang dikenal sebagai faktor anti nutrisi dapat terhidrolisis oleh
fitase sehingga dapat meningkatkan ketersediaan berbagai nutrisi. Hal ini
mengarahkan pada pengurangan kinerja asam fitat ketika terdapat penambahan
dikalsium fosfat pada pakan ternak, sehingga banyak fosfor yang dikeluarkan oleh
hewan ternak yang menuju aliran air, yang dapat menciptakan masalah
lingkungan yaitu eutrofikasi pada perairan (Maenz dan Classen, 1998).
Asam fitat juga memiliki banyak manfaat bagi kesehatan, Tran (2010)
commit to user
sehingga dapat menghambat terjadinya radikal bebas dan kanker. Dua puluh
persen fosfor dari bentuk asam fitat telah digunakan sebagai antioksidan dan dapat
menjadi agen protektif dalam makanan manusia (Lima-Filho et al., 2004). Namun,
asam fitat atau garam fitat merupakan inhibitor bagi enzim-enzim pencernaan
seperti α-amilase, lipase, pepsin, tripsin, maupun kimotripsin. Pengaruh inhibisi
asam fitat atau garam fitat semakin kuat, seiring dengan meningkatnya
konsentrasi fitat maupun bertambahnya gugus fosfat yang terikat pada
mio-inositol (Kusumadjaja, 2009).
2. Fitase
Fitase atau myo-inositol hexakisphosphate phosphohydrolase (EC.3. 1.3.8)
pertama kali ditemukan oleh Suzuki (1907) dalam dalam penelitiannya tentang
hidrolisis bekatul, Tran (2010). The Enzyme Nomenclature Committee of the
International Union of Biochemistry menggolongkan dua tipe fitase yaitu:
3-phytase (EC 3.1.3.8) dan 6-3-phytase (EC 3.1.3.26). Klasifikasi ini berdasarkan
pada gugus fosfat pertama yang berikatan dengan enzim. 3-phytase (EC 3.1.3.8)
terdapat pada mikroorganisme, sedangkan 6-phytase (EC 3.1.3.26) terdapat pada
tanaman (Kerovuo et al., 2000).
Fitase pada umumnya digunakan sebagai bahan tambahan pada makanan
ternak untuk meningkatkan kualitas nutrisi bahan pangan dan produk pakan yang
mengandung fosfat, dengan cara mereduksi asam fitat. Menurut Yao et al., (2011)
asam fitat memiliki ikatan yang kompleks dengan pati, protein, dan mineral lain
commit to user
penambahan fitase akan menghidrolisis asam fitat menjadi 1 molekul inositol, 6
molekul fosfat anorganik, ion Ca2+, Zn2+ dan protein (Gambar 2), sehingga fosfat
dan mineral yang terikat dapat dilepaskan dan dimanfaatkan oleh tubuh. Lain
halnya dengan Kusumadjaja et al., (2009) yang menyatakan bahwa hidrolisis
asam fitat oleh fitase, dengan media perantara air akan menghasilkan mio inositol
dan fosfat anorganik (Gambar 3).
Gambar 2. Hidrolisis asam fitat oleh fitase menurut Yao et al., (2011)
Gambar 3. Hidrolisis asam fitat oleh fitase menurut Kusumadjaja et al., (2009)
Penambahan fitase pada bahan pakan ternak dapat mengurangi tingkat
polusi fosfat, yang ditunjukkan dengan berkurangnya kandungan fosfat pada hasil
ekskresi ternak sampai 50% (Konietzny dan Greiner, 2004). Meskipun ada
commit to user
ternak, namun fosfor fitat jarang ada pada manusia dan hewan monogastrik karena
enzim pada ususnya tertekan oleh tingginya tingkat asam fitat, kalsium,
magnesium dan fosfat anorganik pada makanan. Penambahan dikalsium fosfat
pada suplemen pakan kemungkinan akan meningkatkan aktivitas fitase (Davies et
al., 1970).
Berdasarkan aktivitas sisi geometri dan mekanisme katalisis, fitase
digolongkan menjadi 3 yaitu: histidin acid phosphatase (HAP), ß-propeller
phytase (BPP) dan purple acid phosphatase (PAP). Sedangkan berdasarkan pH
optimum katalisis, fitase dapat digolongkan menjadi fitase asam, netral, dan
alkalin.
Histidine acid phytase (HAP) merupakan kelompok enzim yang paling
banyak dipelajari. Anggotanya terdiri dari prokaryota (fitase appA dari
Escherichia coli) dan eukaryota (phyA dan phyB dari Aspergillus sp., fitase HAP
yang berasal dari yeast dan tanaman). Semua fitase HAP memiliki bentuk umum
sisi aktif RHGXRXP pada ujung akhir-N dan bentuk HD pada ujung akhir-C pada
sekuens DNAnya, sehingga dapat menimbulkan terjadinya dua tahap mekanisme
pada hidrolisis phosphomonoester (Mullaney et al., 2003). PhyK yaitu fitase yang
berasal dari bakteri Klebsiella sp. ASR1 juga merupakan subfamily dari fitase
HAP yang memiliki sisi aktif RHGXRXP dan bentuk HD pada sekuensnya
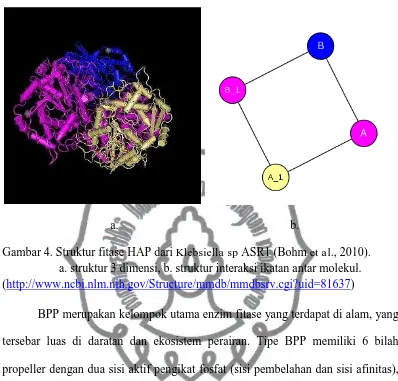
(Sajidan et al., 2004). Struktur fitase HAP dari Klebsiella sp ASR1 (Gambar 4)
terdiri dari 4 molekul 3-fitase(A, A_1, B, B_1) yang masing-masing dapat
berikatan dengan 10 molekul yaitu: 5 molekul Na+, 1 molekul Mg2+ dan 4
commit to user
a. b.
Gambar 4. Struktur fitase HAP dari Klebsiella sp ASR1 (Bohm et al., 2010). a. struktur 3 dimensi, b. struktur interaksi ikatan antar molekul. (http://www.ncbi.nlm.nih.gov/Structure/mmdb/mmdbsrv.cgi?uid=81637)
BPP merupakan kelompok utama enzim fitase yang terdapat di alam, yang
tersebar luas di daratan dan ekosistem perairan. Tipe BPP memiliki 6 bilah
propeller dengan dua sisi aktif pengikat fosfat (sisi pembelahan dan sisi afinitas),
dan 6 sisi aktif pengikatan ion kalsium (3 diantaranya adalah sisi aktif pengikatan
yang memiliki afinitas tinggi terhadap stabilitas enzim, dan 3 lainnya yang
memiliki afinitas rendah terhadap aktivitas enzim) (Kim et al., 2010). Salah satu
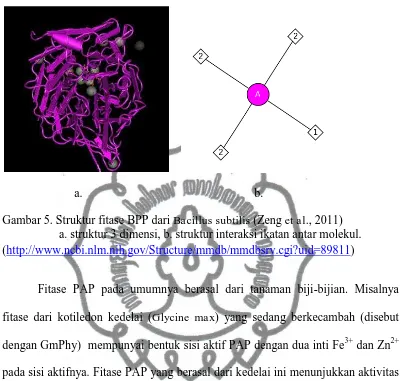
contoh dari kelompok fitase BPP adalah fitase dari Bacillus subtilis, strukturnya
dibuat oleh Zeng et al., (2011) (Gambar 5). Molekul fitase BPP dari Bacillus
subtilis (A) berikatan dengan 2 jenis molekul yaitu: nomor 1 berikatan dengan 1
molekul D-myoinositol-hexasulphate dan nomor 2 berikatan dengan 11 ion
commit to user
a. b.
Gambar 5. Struktur fitase BPP dari Bacillus subtilis (Zeng et al., 2011) a. struktur 3 dimensi, b. struktur interaksi ikatan antar molekul. (http://www.ncbi.nlm.nih.gov/Structure/mmdb/mmdbsrv.cgi?uid=89811)
Fitase PAP pada umumnya berasal dari tanaman biji-bijian. Misalnya
fitase dari kotiledon kedelai (Glycine max) yang sedang berkecambah (disebut
dengan GmPhy) mempunyai bentuk sisi aktif PAP dengan dua inti Fe3+ dan Zn2+
pada sisi aktifnya. Fitase PAP yang berasal dari kedelai ini menunjukkan aktivitas
signifikan terhadap asam fitat (Mullaney et al., 2003) Fitase dari Klebsiella
terrigena and K. Aerogenes belum dikarakterisasikan, namun fitase dari Klebsiella
tersebut dilaporkan menjadi monomer 3-fitase, yang memiliki dua bentuk
rangkaian. Bentuk yang besar berukuran 700kDa dan yang kecil berukuran
10-13kDa, dengan rentang pH optimum 4,5-5,2, dan merupakan bentuk terkecil yang
diketahui sebagai fraksi protein yang menunjukkan aktivitas fitase (Hegeman dan
Grabau, 2001).
Fitase PAP selain dari kedelai juga berasal dari kacang merah (Phaseolus
commit to user
memiliki ikatan yang sangat kompleks, dapat dijelaskan sebagai berikut: A dan D
adalah molekul PAP yang berikatan satu sama lain dan juga berikatan dengan 6
macam molekul yang lain yang berjumlah 33 ion/molekul. Nomor 1 adalah ikatan
dengan 2 ion Zn2+, nomor 2 adalah ikatan dengan 2 ion Fe2+, nomor 3 adalah
ikatan dengan 2 Gliserol, nomor 4 adalah ikatan dengan 2 OLV, nomor 5 adalah
ikatan dengan 10 ion sulfat, dan nomor 6 adalah ikatan dengan 13 molekul
N-acetil-D-Glucosamin, 1 ion asetat, dan 1 molekul 1,2-Ethanediol.
a. b.
Gambar 6. Struktur fitase PAP dari kacang merah (Phaseolus vulgaris) (Feder et al., 2012)
a. struktur 3 dimensi, b. struktur interaksi ikatan antar molekul. (http://www.ncbi.nlm.nih.gov/Structure/mmdb/mmdbsrv.cgi?uid=103041)
Fitase (EC 3.1.3.8; myo-inositol hexakisphosphate phosphohydrolase)
merupakan kelompok enzim phosphatase yang mampu menghidrolisis asam fitat
menjadi monophosphate anorganik, myo-inositol phosphate rendah (lower
myo-inositol phosphate), dan myo-inositol bebas (Kerovuo et al., 2000; Quan et al.,
2002). Enzim ini dapat dihasilkan oleh mikroorganisme (bakteri, jamur, yeast),
commit to user
bakteri yang dapat menghasilkan enzim fitase yang dapat mendegradasi fitat
ekstraseluler, berasal dari genus Bacillus dan Enterobacter.
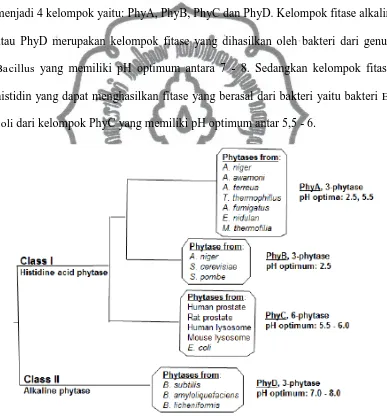
Oh et al. (2004) membuat klasifikasi fitase berdasarkan analisis sekuens
dan biokimia fitase (Gambar 7). Fitase dikelompokkan menjadi dua kelas yaitu
fitase alkalin dan fitase histidin, yang kemudian masih dapat dikelompokkan lagi
menjadi 4 kelompok yaitu: PhyA, PhyB, PhyC dan PhyD. Kelompok fitase alkalin
atau PhyD merupakan kelompok fitase yang dihasilkan oleh bakteri dari genus
Bacillus yang memiliki pH optimum antara 7 - 8. Sedangkan kelompok fitase
histidin yang dapat menghasilkan fitase yang berasal dari bakteri yaitu bakteri E.
coli dari kelompok PhyC yang memiliki pH optimum antar 5,5 - 6.
commit to user
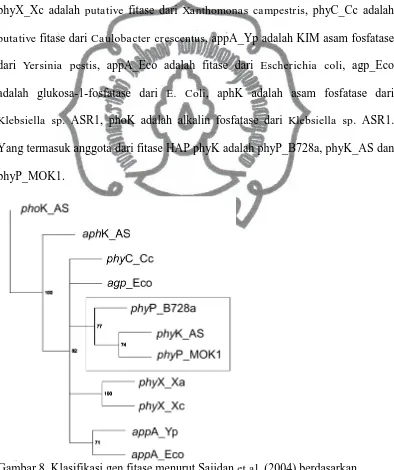
Sajidan et al. (2004) juga membuat klasifikasi fitase berdasarkan
konstruksi pohon filogenetik dari fitase HAP (Gambar 8). phyK_AS adalah
3-fitase dari Klebsiella sp. ASR1, phyP_MOK1 adalah putative fitase dari
Pseudomonas syringae, phyP_B728a adalah putative fitase dari Pseudomonas
syringae B728A, phyX_Xa adalah putative fitase dari Xanthomonas axonopodis,
phyX_Xc adalah putative fitase dari Xanthomonas campestris, phyC_Cc adalah
putative fitase dari Caulobacter crescentus, appA_Yp adalah KIM asam fosfatase
dari Yersinia pestis, appA_Eco adalah fitase dari Escherichia coli, agp_Eco
adalah glukosa-1-fosfatase dari E. Coli, aphK adalah asam fosfatase dari
Klebsiella sp. ASR1, phoK adalah alkalin fosfatase dari Klebsiella sp. ASR1.
Yang termasuk anggota dari fitase HAP phyK adalah phyP_B728a, phyK_AS dan
phyP_MOK1.
commit to user
3. Karakteristik Fitase
Bakteri tahan panas merupakan kelompok bakteri yang mampu tumbuh
pada suhu 45°C sampai 65°C (Brock, 1986). Suhu di atas 60°C di alam bagi
mikroorganisme terdapat pada daerah-daerah tertentu seperti daerah geotermal
dan kompos. Menurut Brock dan Madigan (1991) mikroba tahan panas memiliki
bebrapa keistimewaan diantaranya enzim dan protein yang dihasilkan bersifat
termostabil dan mampu berfungsi optimal pada suhu tinggi.
Kemampuan bakteri tahan panas untuk bertahan hidup di lingkungan
panas disebabkan bakteri tersebut mempunyai membran sel yang kaya akan asam
lemak jenuh dan membran ribosom yang juga tahan panas. Menurut Brock dan
Madigan (1991) organisme tahan panas merupakan organisme prokariot, karena
organisme eukariot tidak dapat bertahan hidup pada suhu tinggi.
Enzim fitase tahan panas yang memiliki efisiensi tinggi dalam katalitik,
memiliki prospek ekonomi yang besar karena suplement pada pakan ternak yang
mengandung fitase dapat meningkatkan ketersediaan fosfor dalam pakan tersebut.
Misalnya fitase yang berasal dari Aspergillus niger yang memiliki suhu optimum
60°C, dan fitase yang berasal dari Thermomyces lanuginosus yang memiliki suhu
optimum 69°C (Maheshwari et al., 2000).
Berat molekul fitase bakteri pada umumnya lebih kecil daripada berat
molekul fungi. Berat molekul bakteri berkisar antara 35-50kDa, sedangkan berat
molekul fitase fungi berkisar antara 65-70kDa. pH optimum fitase bervariasi
antara 2,2-8, fitase fungi memiliki pH optimum antara 4,5-5,6, Bacillus memiliki
commit to user
Temperatur optimum fitase bervariasi antara 45-77ºC (Kerouvo et al., 2000).
Sementara itu, Pasamontes et al., (1997) menyatakan bahwa enzim fitase dapat
menunjukkan aktivitasnya pada rentang pH 2,5-8, dengan pH optimum pada pH 4
dan 6-6,5.
Mikroba penghasil fitase dapat bekerja pada rentang suhu yang lebar yaitu
35-63ºC atau 95-114 ºF (Wodzinski dan Ullah, 1996). Sedangkan Vieille dan
Zeikus (2001) menyatakan bahwa organisme tahan panas dapat tumbuh dengan
optimal pada suhu 50-80ºC, tetapi enzim yang dihasilkan dari organisme tersebut
biasanya memiliki aktivitas optimum pada suhu 60-80ºC, sedangkan stabilitas
termal dan kestabilan aktivitas enzimnya pada suhu 70 ºC.
Fitase yang berasal dari Aspergillus fumigatus diketahui memiliki aktivitas
enzim yang tinggi, mencapai 90% pada suhu 100ºC selama 20 menit (Rodriguez
et al., 2000) atau 90ºC selama 120 menit (Pasamontes et al., 1997). Fitase dari
tiga bakteri yaitu: E. Coli, Pantoea agglomerans, Klebsiella pneunomia secara
berurutan memiliki pH optimum 4, 4,5 dan 5; dan suhu optimum 50-55oC,
commit to user
b. Kerangka Pemikiran
Asam fitat senyawa kompleks tidak larut menghambat penyerapan
fosfat, mineral dan protein fosfat dikeluarkan melalui kotoran
mencemari tanah & perairan.
Gambar 9. Diagram kerangka pemikiran.
Sumber fitase baru
Suhu optimum pH optimum
Stabilitas suhu & pH Pengaruh ion logam Pewarnaan gram
Gen 16S rRNA
Karakterisasi fitase Identifikasi bakteri
Bakteri penghasil fitase
Mikroorganisme kawah Sikidang Dieng Industri fitase suhu tinggi fitase termostabil
commit to user BAB III
METODE PENELITIAN
A. Waktu dan Tempat Penelitian
1. Waktu
Penelitian laboratorium dilaksanakan mulai bulan Oktober 2011 sampai
April 2012.
2. Tempat
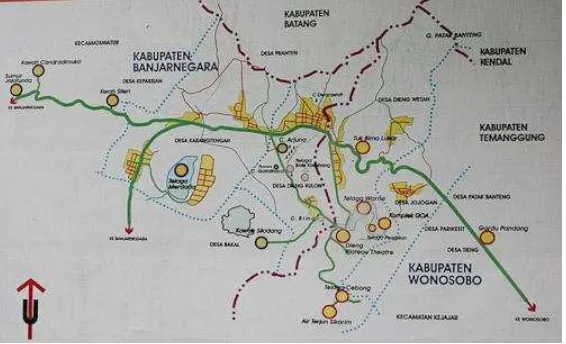
Sampel lumpur dan air diambil dari kawah Sikidang Dieng. Kawah
Sikidang Dieng terletak di dataran tinggi di kabupaten Banjarnegara (Gambar 10).
Suhu udara di sekitar lokasi sampling sekitar 11-18ºC, dengan tingkat keasaman
lumpur dan kawah yang sangat rendah yaitu pada pH 2. Sampel air kawah yang
diambil berasal dari kawah sedang dengan kedalaman 20-30 cm, dengan suhu
kawah antara 60-68ºC, sedangkan sampel lumpur yang diambil adalah lumpur
disekitar semburan kawah yang masih satu lokasi dengan pengambilan sampel air,
dengan jarak 0,5-1 m dari lokasi pengambilan sampel air (Gambar 11 & 12).
Gambar 10. Peta lokasi kawah Sikidang Dieng
commit to user
Gambar 11. Peta lokasi pengambilan sampel pada kawah Sikidang Dieng hasil foto satelit (X).
(http://maps.google.com/maps?f=q&source=s_q&hl=en&geocode=&authuser=0 &q=sikidang+dieng,+wonosobo&aq=&vps=1&sll=7.2208,108.825073&sspn=2.5 77462,5.410767&vpsrc=6&ie=UTF8&hq=sikidang&hnear=Dieng,+Kejajar,+Wo nosobo,+Central+Java,+Indonesia)
Gambar 12. Insert lokasi pengambilan sampel air dan lumpur kawah Sikidang Dieng. Tanda X merupakan lokasi pengambilan sampel.
Isolasi, kultur bakteri, dan karakterisasi dilaksanakan di Laboratorium
Mikrobiologi FKIP Biologi, Laboratorium Biologi FMIPA, dan UPT
Laboratorium Pusat MIPA Universitas Sebelas Maret Surakarta. Sedangkan
commit to user
B. Alat dan Bahan
1. Alat
Alat-alat yang digunakan terdiri dari: tabung reaksi, rak tabung reaksi,
cawan petri, gelas beker, gelas benda, jarum ose, pipet mikro (20l, 200l,
1000l), tip (20l, 200l, 1000l), ependorf (100l, 1,5ml), bunsen, autoklaf,
neraca, sentrifuge, vortex, sarung tangan, masker, inkubator, lemari es, Laminar
Air Flow Cabinet, Waterbath, Digital Mikroskop, PCR, Spektofotometer UV-VIS,
Elektroforesis DNA horizontal, Gel Doc, dan DNA sequencer.
2. Bahan
Bahan-bahan yang digunakan antara lain: tripton 1%, NaCl 1%, yeast
extract 0,5%, bacto agar 2%, glukosa 2,5%, Na-fitat 0,4%, bekatul 2,5%, aquades,
kristal violet, iodium, safranin, CaCl2, NH4NO3, KCl, MgSO4.7H2O, FeSO4.7H2O,
MnSO4.H2O, KH2PO4, Ammonium molibdat, Ammonium metavanadat, HNO3,
Natrium asetat, HCl, NaOH, alkohol 70%, isopropanol, agarosa, DNA kit
(Promega), buffer TBE, EDTA, lisozym, etidium bromida, loading dye, master
mix PCR (Gotaq green), ddH2O, marka DNA 1kb, primer forward 27f
(5’GAGAGTTTGATCCTGGCTCAG3’), dan primer reverse 765r
(5’CTGTTTGCTCCCCACGCTTTC 3’).
C. Jenis Penelitian
Penelitian yang dilakukan merupakan penelitian deskriptif eksploratif.
Sampel air dan lumpur diambil dari kawah Sikidang Dieng pada bulan Oktober
commit to user
D. Prosedur Penelitian
1. Pengayaan dan pemurnian mikroorganisme
Satu ml air sampel ditambahkan dengan 9 ml larutan fisiologis, dan
dilakukan pengenceran sampai diperoleh larutan dengan pengenceran 10-8. Untuk
sampel tanah, 1gr sampel tanah dilarutkan dalam 10 ml aquades ditambah larutan
fisiologis 1%, kemudian dilakukan pengenceran sampai diperoleh larutan dengan
pengenceran 10-8. Masing-masing seri pengenceran diambil 10 l dan
diinokulasikan pada media Luria Bertani (LB) padat yang terdiri dari: 1% tripton,
0,5% yeast, 1% NaCl, dan 2% bacto agar, yang diinkubasi selama 24 jam pada
suhu 37ºC. Koloni tunggal yang tumbuh pada media LB selanjutnya dimurnikan
dengan cara melakukan subkultur beberapa kali.
2. Seleksi bakteri penghasil fitase
Koloni tunggal yang diperoleh kemudian diinokulasikan pada media
seleksi padat yang terdiri dari 2,5% bekatul, 0,5% yeast, 1% NaCl, 0,25% glukosa,
dan 2% bacto agar. Bakteri diinkubasi pada suhu 37ºC selama 24 jam. Bakteri
yang dapat tumbuh pada media tersebut berarti memiliki kemampuan aktivitas
fitase karena bakteri tersebut mampu menghidrolisis fitat pada bekatul.
Penggunaan bekatul sebagai bahan dalam media seleksi mengacu pada penelitian
Rosmimik et al., (1998), bahwa Bacillus coagulans EI.4.4 yang menghasilkan
fitase mampu menghidrolisis fitat pada bekatul. Bakteri kemudian di subkulturkan
commit to user
3. Penentuan aktivitas fitase
Satu ml kultur hasil seleksi pada LB cair kemudian disentrifus dengan
kecepatan 4000 rpm selama 5 menit. Supernatan yang diperoleh kemudian
ditentukan aktivitas fitasenya. Penentuan aktivitas fitase dilakukan dengan metode
Sajidan (2002), yaitu dengan 150l filtrat enzim + 750l substrat (0,4% Na-fitat
dalam 0,82% larutan Na-asetat pada pH 5) yang diinkubasi pada suhu 37ºC
selama 1 jam. Kemudian reaksi dihentikan dengan penambahan 2400l larutan
stop yang terdiri dari larutan Amonium molibdat (2,352 g Ammonium molibdat +
2 ml HNO3 + 100 ml aquades), HNO3, aquades, dan 10% Amonium metavanadat
dengan perbandingan 1,5 : 1 : 2 : 1,5. Absorbansi diukur dengan menggunakan
spektrofotometer UV-VIS pada panjang gelombang 415 nm.
Dari data absorbansi tersebut kemudian dihitung besarnya aktivitas relatif,
yaitu: ��= OD X−OD kontrol
OD�−�� �� x 100%
dimana: ODx = absorbansi sampel uji
ODα = absorbansi tertinggi
Penentuan uji aktivitas fitase dilakukan dengan mengukur kadar fosfat
yang dihasilkan selama terjadi reaksi enzimatis yaitu ekstrak kasar fitase yang
diinkubasikan selama 1 jam pada substrat yang mengandung natrium fitat dan
natrium asetat. Reaksi enzimatis kemudian dihentikan dengan menambahakan
larutan Stop asam vanadomolibdofosforik, kemudian diukur nilai absorbansinya
dan dikalibrasikan dengan larutan standar sehingga menghasilkan nilai aktivitas
fitase dalam satuan U/ml, yang berarti jumlah μmol PO4-3yang dilepas per menit
commit to user
memasukkan data nilai absorbansi terkoreksi (Lampiran 2-8) ke dalam persamaan
linear hasil dari kurva standar KH2PO4 (Lampiran 1).
Tiga isolat bakteri yang memiliki aktivitas fitase tertinggi kemudian
enzimnya dikarakterisasi lebih lanjut yang meliputi optimalisasi suhu fitase,
optimalisasi pH fitase, stabilitas suhu dan pH fitase, dan pengaruh ion logam
terhadap aktivitas fitase.
4. Karakterisasi ekstrak kasar fitase
Karakterisasi ekstrak kasar fitase meliputi penentuan suhu optimum fitase,
pH optimum fitase, stabilitas suhu dan pH fitase, dan pengaruh ion logam
terhadap aktivitas fitase. Penentuan suhu optimum fitase dilakukan dengan cara
menentukan aktivitas enzim pada rentang suhu 30-90 ºC, sedangkan penentuan
pH optimum fitase dilakukan dengan cara menentukan aktivitas enzim pada
rentang pH 3-9.
Penentuan stabilitas suhu fitase dilakukan dengan cara memanaskan enzim
pada suhu optimumnya pada selang waktu tertentu dan ditentukan aktivitasnya
sampai enzim tidak memperlihatkan aktivitas secara signifikan. Penentuan
stabilitas pH fitase dilakukan dengan cara melarutkan enzim dalam larutan buffer
dengan berbagai pH 3-9. Masing-masing reaksi diinkubasi pada suhu optimum
selama 1 jam. Kemudian dilakukan penentuan aktivitas enzim pada pH optimum
dan suhu optimum.
Penentuan pengaruuh ion logam terhadap aktivitas fitase dilakukan pada
commit to user
garam ZnCl2, FeCl2, MgCl2 dan CaCl2, masing-masing dengan konsentrasi 10-3M.
150l enzim + 750l substrat + 30l efektor logam diinkubasi pada suhu dan pH
optimum fitase selama 1 jam, kemudian ditentukan aktivitasnya.
5. Identifikasi isolat terpilih
Setelah diperoleh koloni tunggal, isolat bakteri yang memiliki aktivitas
fitase tertinggi selanjutnya diidentifikasi berdasarkan karakter morfologi dan
analisis gen 16S rRNA.
a. Pewarnaan gram
Gelas benda ditetesi dengan aquades, kemudian mengambil biakan
bakteri dengan jarum ose dan meletakkan diatas aquades, lalu difiksaasi
diatas nyala api bunsen. Setelah mengering kemudian ditetesi dengan 1 tetes
kristal violet dan dibiarkan selama 1 menit dan dibilas dengan aquades.
Ditetesi dengan 1 tetes iodin dan dibiarkan selama 30 detik kemudian dibilas
dengan alkohol. Ditetesi dengan 1 tetes safranin dan dibiarkan selama 30
detik kemudian dibilas dengan aquades. Bakteri diamati di bawah mikroskop.
Warna ungu pada sel menunjukkan bakteri gram positif, sedangkan warna
merah menunjukkan bakteri gram negatif.
b. Isolasi DNA bakteri
Isolat bakteri yang memiliki aktivitas fitase tertinggi ditumbuhkan
dalam medium LB cair, kemudian DNA diekstrak dengan menggunakan kit
commit to user
Tahapan ekstraksi DNA dimulai dari mensentrifuge 1ml kultur cair
dengan kecepatan 13.000 rpm selama 2 menit, kemudian supernatant
dipindahkan. Pelet ditambahkan dengan 480l larutan EDTA dan 120l
larutan lisis, kemudian dikocok. Menambahkan 60l Lisozym lalu
diinkubasikan pada suhu 37ºC selama 1 jam. Larutan disentrifuge dengan
kecepatan 13.000 rpm selama 2 menit, kemudian supernatant dibuang. Pellet
ditambahkan dengan 600l larutan lisis nukleus kemudian diinkubasikan
pada suhu 80ºC selama 5 menit, kemudian pindahkan ke suhu ruang.
Menambahkan 3l RNAase pada larutan, lalu dikocok dan diinkubasi pada
suhu 37ºC selama 1 jam. Menambahkan 200l larutan presipitasi protein,
divorteks selama 20 detik dengan kecepatan tinggi, kemudian diinkubasikan
pada es selama 5 menit. Larutan disentrifuge dengan kecepatan 13.000 rpm
selama 3 menit, supernatan dipindahkan ke tube baru yang telah berisi dengan
600l isopropanol, kocok sampai terlihat masa strand DNA. Sentrifuge
dengan kecepatan 13.000 rpm selama 2 menit. Buang supernatant, lalu
keringkan. Menambahakan 600l etanol 70%, kemudian dikocok dan
disentrifuge dengan kecepatan 13.000 rpm selama 2 menit. Kering anginkan
tube selama 15-60 menit, kemudian tambahkan 100l DNA rehydration.
Inkubasikan pada suhu 65ºC selama 1 jam, kocok secara berkala, dan yang
terakhir simpan DNA pada suhu 4ºC. Kualitas DNA diketahui melalui
spektofotometer, dan kemurnian DNA dicek melalui elektroforesis pada
commit to user
c. Amplifikasi DNA
Amplifikasi DNA dengan menggunakan PCR universal primer,
dengan primer forward 27f (5’ GAGAGTTTGATCCTGGCTCAG 3’), dan
primer reverse 765r (5’ CTGTTTGCTCCCCACGCTTTC 3’) (Sajidan, 2004).
Reaksi PCR terdiri dari 12,5 l master mix PCR (Gotaq green), 2l DNA,
0,5l primer f, 0,5 l primer r, dan 9,5 l ddH2O, sehingga total
volumenya adalah 25 l. Siklus PCR meliputi 3 tahap yaitu: denaturasi,
anneling, dan extention, dilakukan sebanyak 30 siklus. Denaturasi awal pada
suhu 94ºC selama 2 menit, dilanjut dengan 30 siklus dengan denaturasi pada
suhu 94ºC selama 1 menit, anneling pada suhu 58ºC selama 45 detik,
extention pada suhu 72ºC selama 90 detik, kemudian extra extention pada
suhu 72ºC selama 5 menit, yang terakhir disimpan pada suhu 4ºC. Pita DNA
hasil PCR diamati dengan agarose gel 1%, diletakkan pada marka 1kb,
kemudian dilakukan sequencing di Laboratorium 1st Base Singapura.
E. Analisis Data
Data yang diperoleh dari uji aktivitas fitase adalah jumlah kandungan
fosfat anorganik yang dihasilkan ketika terjadi rekasi enzimatis antara ekstrak
kasar fitase dengan substrat yang mengandung asam fitat. Satu unit aktivitas
enzim fitase didefinisikan sebagai jumlah enzim yang mengkatalisis reaksi yang
menghasilkan 1 mol fosfat organik per menit pada kondisi optimum. Penentuan
konsentrasi fosfat anorganik dilakukan dengan menggunakan ammonium
commit to user
spektrofotometer UV-VIS. Untuk pembuatan kurva kalibrasi digunakan larutan
KH2PO4 dengan konsentrasi 100–1000 ppm. Tiga isolat bakteri yang memiliki
aktivitas fitase terbesar kemudian diidentifikasi dan dikarakterisasi enzimnya
lebih lanjut.
Data karakterisasi enzim meliputi: suhu optimum fitase, pH optimum
fitase, stabilitas suhu dan pH fitase, dan pengaruh ion logam terhadap aktivitas
fitase dianalisis secara deskriptif kualitatif. Data yang diperoleh pada identifikasi
morfologi isolat terpilih berupa bentuk dan warna koloni, bentuk sel serta
pewarnaan gram juga dianalisis secara deskriptif kualitatif.
Tiga isolat bakteri dengan aktivitas fitase tertinggi dianalisis berdasarkan
gen penyandi 16S rRNA. Hasil sekuensing diperoleh susunan basa nukleotida
yang diolah dengan program Bio Edit dan Peak Trace untuk mendapatkan sekuens
alignment yang baik. Kemiripan sekuens DNA sampel dengan sekuens yang ada
di gen bank dicari dengan menggunakan program BLASTn NCBI
(www.ncbi.nlm.nih.gov/blast/Blast.cgi), penjajaran urutan basa nukleotida dari
beberapa sekuen menggunakan multiple sequen alignment dari program ClustalW
(www.genome.jp/tools/clustalw/) dan konstruksi pohon filogenetik dibuat dengan
commit to user BAB IV
HASIL DAN PEMBAHASAN
A. Bakteri dari kawah Sikidang Dieng
Isolasi dari sampel air diperoleh 104 koloni bakteri, sedangkan isolasi dari
sampel lumpur diperoleh 30 koloni bakteri. Isolat bakteri yang berasal dari sampel
lumpur memiliki morfologi yang setipe dengan isolat bakteri yang berasal dari
sampel air, hanya saja jumlah isolat bakteri yang diperoleh dari hasil isolasi lebih
banyak yang berasal dari sampel air. Ketersediaan oksigen di dalam air lebih besar
daripada di dalam lumpur, sehingga bakteri lebih cepat berkembangbiak di dalam
air. Oleh karenanya isolat bakteri lebih banyak ditemukan dalam sampel air
kawah daripada dalam sampel lumpur kawah.
Dilihat secara morfologi, ada tipe koloni bakteri yang memiliki permukaan
mengkilat dan tampak licin, permukaan tidak mengkilat, tepi rata halus, tepi
bergelombang, tepi bergerigi, koloni tebal, dan koloni tipis (Gambar 13). Dari 134
isolat bakteri tersebut kemudian dikelompokkan sementara berdasarkan bentuk
morfologi yang nampak, kemudian diambil beberapa isolat yang mewakili untuk
dilakukan seleksi fitase.
commit to user
B. Bakteri penghasil fitase
Media seleksi fitase menggunakan media LB padat dengan tambahan
bekatul sebagai pengganti tripton. Penambahan bekatul digunakan untuk memacu
pertumbuhan bakteri penghasil fitase. Bakteri yang dapat tumbuh pada media
skrening ini kemungkinan besar adalah bakteri yang dapat menghasilkan enzim
fitase karena bakteri tersebut mampu menghidrolisis fitat yang terkandung dalam
bekatul. Penggunaan bekatul sebagai bahan dalam media skrening mengacu pada
penelitian Rosmimik et al., (1998), bahwa Bacillus coagulans EI.4.4 mampu
menghasilkan fitase yang mampu menghidrolisis fitat pada bekatul. Aplikasi
fitase dalam mereduksi asam fitat akan meningkatkan nilai nutrisi dari bahan
pangan dan produk pakan yang mengandung fitat.
Pada tahap seleksi fitase diperoleh 28 isolat bakteri yang mampu
menghasilkan fitase, yang kemudian dilakukan uji aktivitas fitasenya. Dua puluh
delapan isolat bakteri tersebut terdiri dari 16 isolat bakteri yang berasal dari
sampel air kawah dan 12 isolat bakteri yang berasal dari sampel lumpur kawah.
Bentuk morfologi koloni bakteri dari sampel lumpur hampir sama dengan koloni
bakteri dari sampel air.
C. Aktivitas fitase
Terdapat perbedaan warna kuning pada reaksi pengujian aktivitas enzim
antara larutan kontrol dan larutan uji (Gambar 14). Larutan kontrol merupakan
larutan ekstrak kasar fitase tanpa pemberian substrat lalu ditambahkan dengan
larutan Stop. Sedangkan larutan ujinya adalah larutan ekstrak kasar fitase dengan
commit to user
larutan Stop. Larutan kontrol berwarna kuning terang, sedangkan larutan uji
berwarna kuning pekat. Warna kuning pekat terjadi karena adanya reaksi
vanadomolibdofosforik yang terbentuk dari ikatan fosfat dengan vanadat-molibdat.
Senyawa fosfat anorganik yang terdapat di dalam larutan uji dalam keadaan asam
akan bereaksi dengan reagen ammonium molibdat membentuk kompleks asam
molibdofosforik, kemudian direaksikan dengan reagen ammonium vanadat akan
terbentuk kompleks asam vanadomolibdofosforik yang berwarna kuning.
Gambar 14. Perbandingan warna kuning pada reaksi pengujian fitase. a. adalah larutan kontrol, sedangkan b, c, dan d adalah larutan uji.
Jumlah isolat bakteri yang di uji aktivitas enzimnya ada 28 isolat yang
terdiri dari 16 isolat yang berasal dari sampel air kawah (isolat EN 1 sampai EN
16) dan 12 isolat yang berasal dari sampel lumpur kawah (isolat EN 17 sampai
EN 28). Hasil keseluruhan uji aktivitas fitase dari 28 isolat bakteri menunjukkan
kisaran aktivitas fitase antara 0,30088 U/ml sampai dengan 0,3250933 U/ml
(Gambar 15, Lampiran 2). Aktivitas fitase dari isolat sampel air sedikit lebih
tinggi daripada isolat sampel lumpur. Aktivitas fitase dari isolat sampel air
commit to user
fitase dari isolat sampel lumpur berkisar antara 0,30088 U/ml sampai dengan
0,3232533 U/ml. Dua puluh delapan isolat tersebut kemudian diambil 5 besar
isolat yang memiliki aktivitas tertinggi untuk di uji ulang sehingga diperoleh 3
isolat bakteri yang memiliki aktivitas fitase yang terbesar.
Gambar 15. Diagram batang hasil uji aktivitas fitase dari 28 isolat bakteri. 0.3154033
0.285 0.29 0.295 0.3 0.305 0.31 0.315 0.32 0.325 0.33
commit to user
Uji aktivitas fitase akhirnya diperoleh 3 isolat bakteri yang dapat
menghasilkan enzim fitase tertinggi yaitu fitase dari isolat EN 10, EN 16, dan EN
6. Aktivitas fitase dari isolat EN 10 sebesar 0,32893 U/ml, aktivitas fitase dari
isolat EN 16 sebesar 0,324953 U/ml, dan aktivitas fitase dari isolat EN 6 sebesar
0,32182 U/ml (Gambar 16, Lampiran 3). Satu U = 1 μmol fosfat anorganik yang
dibebaskan pada kondisi optimum selama 1 menit.
Gambar 16. Diagram batang hasil uji aktivitas fitase dari isolat EN 10, EN 16, dan EN 6.
Aktivitas fitase dari ketiga isolat ini masih lebih tinggi daripada fitase
Bacillus cereus RW Sm A 0,1071 U/ml, fitase B. aryabhattai RW Sm C 0,102
U/ml, fitase B. cereus RW Sl 5 0,0874 U/ml (Wulandari, 2011), fitase Bacillus sp
AP-17 0,0296 U/ml (Kusumadjaja, 2009), fitase B. subtilis 0,044 U/ml (Shimizu,
1992), fitase B. subtilis HG 0,283 U/ml (Yuanita et al., 2010), dan fitase Bacillus
sp. KHU-10 0,2 U/ml (Choi et al., 2001), namun lebih rendah daripada fitase B.
cereus ASUIA260 1,160 U/ml (Shobirin et al., 2009). Artinya bahwa isolat EN 10,
EN 16 dan EN 6 memiliki kemampuan menghasilkan enzim fitase yang dapat
dimanfaatkan sebagai sumber penghasil enzim fitase yang baru.
0.32893 0.324953333
0.32182
commit to user
D. Karakterisasi Fitase
1. Pertumbuhan bakteri terhadap aktivitas fitase
Kurva pertumbuhan bakteri terhadap aktivitas fitase diperlukan untuk
mengetahui tingkat pertumbuhan optimum dari isolat bakteri agar dapat
menghasilkan fitase dengan aktivitas yang optimal. Dengan kata lain, menentukan
lama waktu inkubasi isolat bakteri EN 10, EN 16, dan EN 6 agar dapat
menghasilkan enzim fitase dalam jumlah yang terbesar. Waktu inkubasi ini yang
nantinya akan digunakan sebagai patokan untuk menginkubasi isolat bakteri yang
akan dikarakterisasi lebih lanjut, agar isolat bakteri tersebut menghasilkan
aktivitas enzim yang optimal. Pengaruh pertumbuhan bakteri terhadap aktivitas
fitase dilakukan dengan cara menguji aktivitas fitase dari ketiga isolat bakteri tiap
2 jam dimulai dari inkubasi bakteri pada jam ke-6. Hasil pengujian menunjukkan
bahwa ketiga isolat bakteri tersebut mencapai titik puncak aktivitas fitase pada
waktu inkubasi 20 jam (Gambar 17, Lampiran 4).
commit to user
Pertumbuhan bakteri membentuk suatu kurva sigmoid. Pada fase pertama
pertumbuhan berjalan lambat, kemudian terjadi pertumbuhan secara eksponensial
hingga pada saat tertentu terjadi pertumbuhan stasioner dan kemudian mengalami
penurunan pertumbuhan. Pada penelitian ini, pertumbuhan bakteri mencapai
puncak tertinggi menghasilkan fitase pada waktu inkubasi 20 jam, dan pada jam
inkubasi selebihnya akan mengalami penurunan aktivitas fitase. Setelah
mengetahui titik puncak pertumbuhan bakteri dalam menghasilkan fitase yang
optimal, selanjutnya pada pengujian karakteristik fitase dari 3 isolat tertinggi
mengambil biakan bakteri yang telah diinkubasi selama 20 jam agar menghasilkan
pengujian yang optimal pula.
2. Optimalisasi suhu fitase
Optimalisasi suhu fitase ditentukan dengan cara menginkubasi
substrat-enzim pada rentang suhu 37ºC, 40ºC, 50ºC, 60ºC, 70ºC, 80ºC, dan 90ºC. Fitase
yang dihasilkan dari isolat EN 10 dan EN 6 memiliki aktivitas terbesar pada suhu
60ºC, sedangkan fitase yang dihasilkan oleh isolat EN 16 memiliki aktivitas
terbesar pada suhu 50ºC. Inkubasi substrat-enzim yang melebihi suhu 60ºC akan
menyebabkan terjadinya penurunan aktivitas enzim dari ketiga isolat. Suhu
optimum untuk enzim fitase hasil dari isolat EN 10 dan EN 6 adalah 60ºC,
sedangkan suhu optimum untuk enzim fitase hasil dari isolat EN 16 adalah 50ºC
commit to user
Gambar 18. Kurva optimalisasi suhu fitase dari isolat EN 10, EN 16, dan EN 6.
Suhu optimum dari ketiga fitase ini lebih rendah bila dibandingkan dengan
fitase Bacillus sp. strain DS11 yang memiliki suhu optimum 70ºC (Kim et al.,
1998), dan fitase Bacillus sp AP-17 yang memiliki suhu optimum 75ºC
(Kusumadjaja, 2009); sama dengan fitase Bacillus sp KHU-10 dan fitase B.
subtilis CH92 yang memiliki suhu optimum 60ºC (Choi et al., 2001; Hong et al.,
2011); namun lebih tinggi bila dibandingkan dengan fitase B. cereus RW Sm A
yang memiliki suhu optimum 40ºC (Wulandari, 2010), dan fitase B. subtilis HG
yang memiliki suhu optimum 41ºC (Yuanita et al., 2010).
Inkubasi yang melebihi suhu optimum dari tiap enzim tersebut akan
mengakibatkan terjadinya penurunan aktivitas enzim. Hal ini terjadi karena
penigkatan suhu di atas suhu optimum akan menyebabkan terjadinya perubahan
konformasi enzim yang mengarah pada perubahan destruktif yang menyebabkan
putusnya ikatan yang mempertahankan struktur sekunder dan tersier sehingga
commit to user
terjadi kerusakan pada molekul enzim, sehingga enzim mengalami denaturasi dan
kehilangan aktivitas katalitiknya sehingga aktivitas enzim fitase turun.
3. Optimalisasi pH fitase
Optimalisasi pH fitase ditentukan dengan cara memanaskan enzim pada
beberapa substrat yang memiliki pH dengan rentang 3-9. Fitase hasil dari isolat
EN 10 menghasilkan aktivitas yang optimal pada pH 4, sedangkan fitase hasil dari
isolat EN 16 dan EN 6 menghasilkan aktivitas yang optimal pada pH 6 (Gambar
19, Lampiran 6).
Gambar 19. Kurva optimaalisasi pH fitase dari isolat EN 10, EN 16, dan EN 6.
Hasil ini berbeda dengan yang dinyatakan oleh Keruovo (2000) bahwa pH
optimum untuk bakteri penghasil fitase, khususnya yang berasal dari kelompok
Bacillus mamiliki pH optimum antara 6,5 sampai 7,5. Fitase B. subtilis HG memiliki pH optimum antara 6,5–7 (Yuanita et al., 2010), fitase Bacillus sp
KHU-10 memiliki pH optimum antara 6-8 (Choi et al., 2001), sedangkan fitase B.
amyloliquefaciens DS11 memiliki pH optimum antara 7-8 (Kim et al., 1998). pH
commit to user
sangat berpengaruh terhadap aktivitas enzim karena perubahan pH dapat
menyebabkan perubahan muatan pada residu asam amino, terutama yang
menyusun pusat aktif enzim, sehingga akan berpengaruh pula terhadap
konformasi enzim, daya katalitik, dan efisiensi pengikatan substrat-enzim (Nelson
dan Cox, 2000).
Pada pH di bawah dan di atas kondisi optimum memiliki aktivitas yang
rendah disebabkan karena bagian sisi aktif yang mengandung gugus fungsi dan
konformasi atau struktur tiga dimensi enzim berada dalam kondisi kurang mantap
sehingga aktivitas katalitiknya rendah. Hal ini disebabkan karena adanya
penggantian gugus pada residu asam amino sehingga menyebabkan aktivitas
enzim turun. Perubahan pH menyebabkan ionisasi pada struktur primer dan
struktur sekunder protein, juga menyebabkan perubahan interaksi antara satu asam
amino dengan asam amino lainnya yang bertanggung jawab dalam pembentukkan
struktur tiga dimensi enzim (Marlinda, 2001). Trudy dan James (1999)
menyatakan bahwa sisi aktif dan struktur tiga dimensi enzim menentukan aktivitas
katalitik enzim. Denaturasi protein akan menyebabkan hilangnya aktivitas enzim.
4. Stabilitas suhu dan pH fitase
Fitase dari ketiga isolat bakteri diinkubasikan pada suhu dan pH optimum
dari masing-masing fitase, kemudian dipanaskan selama rentang waktu tertentu
untuk mengetahui stabilitas enzim ketika dipanaskan. Pada awal inkubasi,
commit to user
kemudian akan mengalami penurunan aktivitas seiring dengan lamanya waktu
pemanasan enzim (Gambar 20, Lampiran 7).
Gambar 20. Kurva aktivitas fitase pada suhu dan pH optimum fitase dari isolat EN 10, EN 16, dan EN 6 yang diinkubasi sampai dengan 6 jam.
Setelah mencapai aktivitas optimum, fitase dari ketiga isolat akan
mengalami penurunan aktivitas. Fitase hasil dari isolat EN 10 mengalami
penurunan aktivitas menjadi 88,98% setelah dipanaskan selama 1 jam dan
aktivitasnya menjadi 36,83% setelah dipanaskan selama 5 jam. Fitase hasil dari
isolat EN 16 mengalami penurunan aktivitas menjadi 83,08% setelah dipanaskan
selama 1 jam dan aktivitasnya menjadi 29,11% setelah dipanaskan selama 5 jam.
Fitase hasil dari isolat EN 6 mengalami penurunan aktivitas menjadi 89,84%
setelah dipanaskan selama 1 jam dan aktivitasnya menjadi 27,80% setelah
commit to user
Gambar 21. Kurva persentase aktivitas relatif fitase pada suhu dan pH optimum fitase dari isolat EN 10, EN 16, dan EN 6 yang diinkubasi sampai dengan 6 jam.
Fitase Bacillus sp KHU-10 memiliki stabilitas enzim pada suhu 60°C, dan
mengalami penurunan aktivitas fitase sebesar 95% setelah diinkubasi selama 10
menit (Choi et al., 2001). Sedangkan aktivitas fitase dari B. subtilis CF 92
mengalami penurunan hingga tersisa 40% setelah diinkubasi pada suhu 80°C
selama 30 menit (Hong et al., 2011).
5. Pengaruh ion logam terhadap aktivitas fitase
Fitase hasil dari isolat EN 10, EN 16, dan EN 6 mengalami peningkatan
aktivitas karena adanya penambahan ion Ca2+. Ion Mg2+ juga dapat meningkatkan
aktivitas fitase, namun peningkatanya lebih sedikit bila dibandingkan dengan ion
Ca2+. Penambahan ion Zn2+ dapat menurunkan aktivitas fitase dari ketiga isolat,
namun penambahan ion Fe2+ hanya dapat menurunkan aktivitas fitase pada isolat
commit to user
Gambar 22. Histogram pengaruh beberapa ion logam terhadap aktivitas fitase dari isolat EN 10, EN 16, dan EN 6.
Penambahan ion Mn2+ dan Ca2+ dapat meningkatkan aktivitas fitase,
sedangkan penambahan ion Fe2+ atau Fe3+ tidak dapat meningkatkan aktivitas
fitase (Syahbirin, 2000). Kation lain yang diketahui mengaktifkan enzim ialah Na+,
K+, Rb+, Cs+, Mg2+, Zn2+, Cr2+, Cu2+, Fe2+, Co2+, Ni2+, dan Al2+. Ion tersebut dapat
mengaktitkan enzim karena beberapa perubahan mekanis, antara lain: adanya
bagian yang utuh pada sisi aktif, bentuk ikatan rantai antara enzim dan substrat,
perubahan konstanta keseimbangan pada reaksi, perubahan muatan permukaan
pada protein enzim, digantinya hambatan pada reaksi yang hilang, digantinya
ion-ion logam yang tidak efektif dari sisi aktif atau substrat, dan keseimbangan
konformasi dan kurang aktif diganti menjadi lebih aktif (Richardson dalam
Thontowi, 2001). Namun tidak selalu ion-ion tersebut memberikan pengaruh
peningkatan terhadap aktivitas enzim, karena ada beberapa ion tersebut dapat
memberikan pengaruh penurunan terhadap organisme tertentu. Misalnya fitase
commit to user
yang berasal dari Enterobacter sp 4, dihambat oleh adanya ion Zn2+, Ba2+, Cu2+
dan Al3+(Yoon et al., 1996). Sedangkan fitase yang berasal dari E. nidulans dan
Aspergillus terrus dihambat oleh ion Cu2+ (Wyss et al., 1999). Letak pengikatan
ion logam pada asam fitat digambarkan oleh Tran (2010) bahwa ion logam dapat
berinteraksi dengan –OH- dari gugus fosfat yang sama atau berlainan dalam
molekul asam fitat. Mereka juga dapat berinteraksi dengan –OH- pada gugus
fosfat molekul asam fitat yang lainnya (Gambar 23).
Gambar 23. Struktur yang menunjukkan pengikatan ion logam dengan gugus fosfat pada molekul asam fitat menurut Tran (2010).
E. Pengamatan Morfologi
Morfologi dari koloni bakteri isolat EN 10 yaitu: berwarna putih susu,
tebal, dengan permukaan yang tidak mengkilat, tepi koloni bulat halus. Koloni
bakteri isolat EN 16 juga berwarna putih susu, tebal, dengan permukaan yang