BAB 2
TINJAUAN PUSTAKA
2.1. Tumbuhan Mawar Merah (Rosa hybrida)
Rosa hybridatermasuk dalam Famili Rosaceae, sering di juluki Prince of
flowerkarena keindahan bentuk dan warnanya, serta baunya yang harum dan
memikat (Widyawan, 1994). Di Indonesia dikenal dengan nama Bunga Mawar.
Famili Rosaceae meliputi berbagai macam Mawar dengan berbagai macam bentuk
dan warna bunga, serta bau wangi khas. Tanaman Mawar bisa berupa herba tegak,
merayap, atau memanjat. Mempunyai percabangan banyak, berduri tempel. Daun
majemuk, menyirip ganjil, anak daun 5 - 7 jarang 3, bentuk helaian anak daun
bulat telur - lonjong, ujung- meruncing, tepi daun bergerigi (Suryowinoto, 1997).
Berikut sistematika tumbuhan mawar merah.
Kingdom : Plantae
Divisi : Spermatophyta
Class : Dicotyledonae
Ordo : Rosanales
Famili : Rosaceae
Genus : Rosa
Spesies : Rosa hybrida.
Nama Lokal : Mawar Merah
Tanaman bunga Mawar adalah tanaman yang menghasilkan biji.
Pohonnya memiliki batang yang berkayu. Tanaman ini juga memiliki sistem akar
tunggang, kemudian batangnya memiliki kambium yang dapat menyebabkan
batang membesar (Manganti, 2015).Jumlah varietas mawar yang ada saat ini
diperkirakan mencapai 5.000 macam, namun hanya sekitar 300-400 varietas saja
Bunga Mawar dapat tumbuh di dataran rendah hingga dataran tinggi.
Tetapi untuk mawar tertentu seperti Mawar teh hibrida hanya menyukai dataran
tinggi sebab bunganya akan tumbuh dengan sempurna, baik bentuk, ukuran,
warna, maupun baunya (Soekartiwi, 1996).
2.1.1 Penggolongan bunga mawar
Tim Direktorat Bina Produksi Hortikultura (1998) mencatat bahwa ada sembilan
kelompok utama varietas mawar, yaitu:
1. Hybrid tea : Jenis bunga potong yang bertangkai panjang dengan bunga
tunggal di ujungnya sehingga tampak megah dan cantik.
2. Floribunda : Jenis bunga potong dan tanaman taman yang bunganya cukup
besar dengan warna bervariasi dan tangkai tegak panjang.
3. Grandiflora : Bunganya berukuran raksasa dengan diameter dapat mencapai
7,5-12,5 cm.
4. Climbing rose : Diameter bunga berkisar antara 5-15 cm dan tumbuh
merunduk karena beratnya cabang serta tersusun dalam tandan yang jarang.
Kelompok mawar ini pertumbuhannya sangat lamban dibandingkan kelompok
lain dan rata-rata baru dapat berbunga setelah umurnya lebih dari dua tahun.
5. Polyantha : Jenis mawar taman dengan warna bunga yang sangat beraneka
ragam, bunganya kecil dengan garis tengah sekitar 5 cm dan di dekat pucuk
cabangnya terdapat banyak ranting yang masing-masing memiliki sekuntum
bunga.
6. Hybrid perpetual : Jenis mawar yang diameter bunganya sangat lebar (15 cm)
7. Mawar tea : Merupakan nenek moyang mawar di Asia dengan ukuran bunga
kecil.
8. Mawar tua : Disebut juga mawar kuno, dan aromanya sangat wangi.
9. Special purpose : Mawar yang dibedakan atas tiga golongan, yaitu mawar
pohon, mawar perdu, dan mawar mini.
2.1.2 Manfaat Bunga Tumbuhan Mawar Merah (Rosa Hybrida)
Tidak hanya sebagai hiasan, bunga mawar juga ternyata bisa dimakan untuk
dijadikan obat. Aroma dan rendaman air bunga mawar mampu meredakan stres,
mengatasi nyeri saat haid, dan membantu menjaga kesehatan kulit. Karena air
mawar mengandung astringent yang bersifat menghilangkan racun (Khaerani,
2014). Bunga Mawar juga memiliki efek farmakologis diantaranya melancarkan
sirkulasi darah, menormalkan anti radang, menghilangkan bengkak dan menetralisir
racun. Bunga dan akar dalam kondisi segar dapat dimanfaatkan untuk mengobati
beberapa penyakit seperti batuk darah dan campak (Hariana, 2005). Dalam buku
Tanaman Obat Untuk Mengobati Jantung Koroner dan Menyembuhkan Stroke
bunga Mawar juga memiliki khasiat menghilangkan bau mulut dan mengobati
stroke.
2.2 Senyawa Flavonoida
Senyawa flavonoida diturunkan dari unit C6-C3 (fenil propana) yang bersumber
dari asam sikimat (via fenilalanin) dan unit C6 yang diturunkan dari jalur
poliketida. Fragmen poliketida ini disusun dari tiga molekul malonil-KoA yang
bergabung dengan unit C6-C3 (sebagai KoA tioester) untuk membentuk unit awal
triketida. Oleh karena itu, flavonoid yang berasal dari biosintesis gabungan terdiri
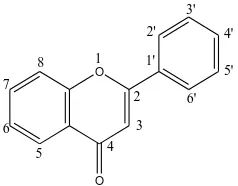
Struktur dan sistem penomoran untuk turunan senyawa flavonoid dapat dilihat
pada gambar 2.1 yang di bawah ini :
Gambar 2.1. Senyawa Flavonoida (Robinson, 1995).
Flavonoida umumnya terdapat pada tumbuhan sebagai glikosida. Gugusan
gula bersenyawa pada satu atau lebih gugus hidroksil fenolik. Gugusan hidroksil
selalu terdapat pada karbon no. 5 dan no. 7 pada cinicin A. Pada cincin B gugusan
hidroksil atau alkoksil terdapat pada karbon no. 3 dan no. 4 ( Sirait, 2007).
Adapun struktur dari flavonoida adalah struktur yang mempunyai dua
cincin aromatik yang dihubungkan dengan tiga karbon yang membentuk suatu
cincin yang terdapat gugus eter (C-O-C) dan satu karbonil (C=O) yang
dinotasikan cincin C. Kedua cincin aromatik ini dinotasikan cincin A dan B. Pada
cincin A dan B ada dijumpai atau terdapat substituent hidroksil (OH) atau
metoksi, juga gugus gula yang bentuk C-glikosida atau O-glikosida. Tapi ada juga
senyawa flavonoida tanpa adanya gugus C=O yang disebut senyawa flavan
(Ikan, 1969).
Istilah flavonoida dikenakan pada suatu golongan besar senyawa yang
yang berasal dari kelompok senyawa yang paling umum yaitu flavon.Suatu
jembatan oksigen terdapat diantara cincinA dalam kedudukan orto dan atom
karbon benzil yang terletak di sebelah cincin B membentuk cincin darri tipe
4-piron. Senyawa heterosiklik ini pada tingkat oksidasi yang berbeda terdapat dalam
kebanyakan tumbuhan. Flavon adalah bentuk yang mempunyai cincin C dengan
tingkat oksidasi yang paling rendah dan dianggap sebagai struktur induk dalam
nomenklatur kelompok senyawa ini (Manito, 1992).
Flavonoida mengandung sistem aromatik yang terkonjugasi dan karena itu
menunjukkan pita serapan kuat pada daerah spektrum UV dan spektrum tampak.
Akhirnya flavonoida umumnya terdapat dalam tumbuhan, terikat pad agula
sebagai glikosida dan aglikon flavonoida yang mana pun mungkin saja terdapat
dalam satu tumbuhan dalam beberapa bentuk kombinasi glikosida. Flavonoid
terdapat dalam semua tumbuhan berpembuluh, tetapi beberapa kelas lebih tersebar
daripada yang lainnya: flavor dan flavonol terdapat disemesta, sedangkan
isoflavon dan biflavon hanya terdapat pada beberapa suku tumbuhan (Harborne,
1996).
Tidak ada benda yang begitu menyolok seperti flavonoida yang
memberikan kontribusi keindahan dan kesemarakan pada bunga dan buah-buahan
di alam. Flavin memberikan warna kuning atau jingga, antosianin memberikan
warna merah, ungu, atau biru. Secara biologis, flavonoida memainkan peranan
penting dalam kaitan penyerbukan pada tanaman oleh serangga. Sejumlah
flavonoida mempunyai rasa pahit hingga dapat bersifat menolak sejenis ulat
tertentu (Sastrohamidjojo, 1996). Flavonoida tertentu juga mempengaruhi rasa
makanan secara signifikan; misalnya beberapa tanaman memiliki rasa pahit dan
kesat seperti flavanon naringin, pada kulit grapefruit (C. paradisi).
Dalam tubuh manusia, flavonoida dapat berguna untuk mengobati
gangguan sirkulasi perifer, menurunkan tekanan darah dan meningkatkan
aquaresis. Banyak juga obat-obat mengandung flavonoid yang dipasarkan
diberbagai negara sebagai obat anti-inflamasi, antispasmodik, antialergi dan
antivirus. (Heinrich et al, 2005). Manfaat lain lain flavonoida adalah melindungi
struktur sel, meningkatkan efektivitas vitamin C, antiinflamasi, mencegah keropos
tulang dan sebagai anti bioktik (Muhammad, 2011). Senyawa flavonoid diduga
sangat bermanfaat dalam makanan karena, berupa senyawa fenolik, senyawa ini
yang bersifat antioksidan kuat. Oleh karena itu, makanan kaya flavonoid dianggap
penting untuk mengobati penyakit-penyakit, seperti kanker dan penyakit jantung
(yang dapat memburuk akibat oksidasi lipoprotein densitas-rendah) (Heinrich et
2.2.1. Klasifikasi Senyawa Flavonoida
Dalam tumbuhan, flavonoid terdapat dalam berbagai bentuk struktur. Keragaman
struktur flavonoid ini disebabkan karena perbedaan tahap modifikasi lanjutan dari
struktur dasar flavonoid, antara lain:
1. Flavonoid O-glikosida.
Flavonoid biasanya terdapat sebagai flavonoid O-glikosida, pada senyawa
tersebut satu gugus hidroksi flavonoid (atau lebih) terikat pada satu gula
(atau lebih) dengan ikatan hemiasetal yang tak tahan asam. Pengaruh
glikosilasi meyebabkan flavonoid menjadi kurang reaktif dan lebih mudah
larut dalam air (cairan). Glukosa merupakan gula yang paling umum
terlibat, walaupun galaktosa, ramnosa, xilosa, dan arabinosa sering juga
terdapat. Salah satu kelompok senyawa flavonoida-o-glikosida
ditunjukkan pada gambar 2.2 di bawah ini:
O
O
OH
OH O
O
OH
ROH2C
HO HO
Gambar 2.2(R=H) Apigenin 7-O-β-D-glukopiranosida
(R=OCOCH3) Apigenin 7-O-β-D-(6”-O-asetil) glukopiranosida
2. Flavonoid C-glikosida.
Gula dapat juga terikat pada atom karbon flavonoid dan dalam hal ini gula
tersebut terikat langsung pada inti benzena dengan suatu ikatan
karbon-karbon. Glikosida yang demikian disebut C-glikosida. Sekarang gula yang
terikat pada atom C hanya ditemukan pada atom C nomor 6 dan 8 dalam
inti flavonoid. Jenis gula yang terlibat ternyata jauh lebih sedikit
ketimbang jenis gula pada O-glikosida. Jenis aglikon flavonoid yang
terlibat pun sangat terbatas. Salah satu kelompok senyawa flavonoida
flavanon, dan flavonol kadang-kadang terdapat dalam bentuk C-glikosida,
hanya flavon C-glikosida yang paling lazim ditemukan.
O
Gambar 2.3Apigenin 8-C-β-D-glukopiranosida (Viteksin)
3. Flavonoid Sulfat
Gabungan flavonoid lain yang mudah larut dalam air yang mungkin
ditemukan hanya flavonoid sulfat. Senyawa ini mengandung satu ion
sulfat atau lebih, yang terikat pada hidroksil fenol atau gula.
4. Biflavonoid
Biflavonod adalah flavonoid dimer, walau pun prosianidin dimer (satuan
dasarnya katekin) biasanya tidak dimasukkan ke dalam golongan ini.
Flavonoid yang biasanya terlibat adalah flavon dan flavanon yang secara biosintesis mempunyai pola oksigenasi yang sederhana 5,7,4’ (atau kadang-kadang 5,7,3’,4’) dan ikatan antar-flavonoid berupa ikatan
karbon-karbon atau kadang-kadang ikatan eter. Biflavonoid jarang ditemukan
sebagai glikosida, dan penyebarannya terbatas, terdapat terutama pada
gimnospermae. Salah satu senyawa kelompok biflavonoid dapat dilihat
pada gambar 2.4 di bawah ini:
5. Aglikon flavonoid yang aktif-optik
Aglikon flavonoid mempunyai atom karbon asimetrik dan dengan
demikian menunjukkan keaktifan optik (yaitu memutar cahaya
terpolarisasi-datar). Yang termasuk dalam golongan flavonid ini ialah
flavanon, dihidroflavonol, katekin, pterokarpan, rotenoid, dan beberapa
biflavonoid (Markham, 1988).
Senyawa flavonoid dapat dikelompokkan berdasarkan tahanan oksidasi dan
keragaman lain pada rantai C3 :
1. Flavon
Flavon berbeda dengan flavonol karena pada flavon tak terdapat
penyulihan 3-hidroksi. Hal ini mempengaruhi serapan UV-nya, gerakan
kromatografinya, serta reaksi warnanya, dan karena itu flavon dapat
dibedakan dari flavonol. Flavon terdapat juga sebagai glikosida tetapi
lebih sedikit daripada jenis glikosida pada flavonol. Jenis yang paling
umum ialah 7-glukosida, contohnya luteolin 7-glukosida. Struktur
senyawa Flavon dapat dilihat pada gambar 2.5 di bawah ini:
O
O
A C
B
Gambar 2.5 Flavon (Robinson, 1995).
2. Flavonol
Flavonol sangat tersebar luas di dalam tumbuhan, baik sebagai kopigmen
antosianin dalam daun bunga maupun dalam daun tumbuhan tinggi. Dalam
tumbuhan terdapat banyak sekali glikosida flavonol. Sampai saat ini yang
Adapun struktur senyawa Flavonol dapat dilihat pada gambar 2.6 di bawah
ini :
Gambar 2.6 Flavonol (Robinson, 1995).
3. Isoflavon
Isoflavon merupakan senyawa yang tidak begitu mencolok, tetapi senyawa
ini penting sebagai fitoaleksin (senyawa pelindung) dalam tumbuhan
untuk pertahanan terhadap penyakit. Adapun struktur senyawa Isoflavon
ditunjukkan pada gambar 2.7. Isoflavon menunjukkan aktivitas sebagai
estrogenik, insektisida, dan antifungi
O
O
A C
B
Gambar 2.7 Isoflavon (Robinson, 1995).
4. Flavanon
Flavanon adalah senyawa tanwarna yang tak dapat dideteksi pada
pemeriksaan kromatografi kecuali bila menggunakan penyemprot
kromogen. Uji warna yang penting dalam larutan alkohol ialah reduksi
dengan serbuk Mg dan HCl pekat. Struktur senyawa Flavanon dapat
dilihat pada gambar di bawah ini :
O
O
A C
B
Gambar 2.8 Flavanon (Robinson, 1995).
O
O
OH
A C
5. Flavanonol
Flavanonol (atau dihidroflavonol) barangkali merupakan flavonoid yang
paling kurang dikenal, dan tidak dapat diketahui apakah senyawa ini
terdapat sebagai glikosida. Senyawa ini stabil dalam asam klorida panas
tetapi terurai oleh udara adapun struktur senyawa Flavanonol dapat dilihat
pada gambar 2.9 dibawah ini :
O
O
OH A C
B
Gambar 2.9 Flavanonol (Harborne, 1987).
6. Antosianin
Antosianin adalah pigmen daun bunga merah sampai biru yang biasa,
banyaknya sampai 30% bobot kering dalam beberapa bunga. Antosianin
terdapat juga dalam bagian lain tumbuhan tinggi kecuali fungus. Struktur
senyawa Antosianin dapat dilihat pada gambar di bawah ini :
O
OH A C
B +
Gambar 2.10 Antosianin (Harborne, 1987).
7. Katekin
Katekin dan proantosianidin adalah dua golongan senyawa yang
mempunyai banyak kesamaan. Semuanya senyawa tanpa warna, terdapat
pada seluruh dunia tumbuhan tetapi terutama dalam tumbuhan berkayu
O
8. Leukoantosianidin
Merupakan monomer flavan 3,4-diol, leukoantosianidin jarang terdapat
sebagai glikosida, namun beberapa bentuk glikosida yang dikenal adalah
apiferol, dan peltoginol. Struktur senyawa Leukoantosianidin dapat dilihat
pada gambar 2.12 di bawah ini :
O
OH
HO OH
OH OH
A C
B HO
Gambar 2.12 Leukoantosianidin (Harborne, 1987).
9. Kalkon
Khalkon adalah pigmen fenol kuning yang berwarna coklat tua dengan
sinar UV bila dikromatografi kertas. Aglikon khalkon dapat dibedakan
dari glikosidanya karena hanya pigmen dalam bentuk glikosida yang dapat
bergerak pada kromatografi kertas dalam pengembang air, adapun struktur
senyawa Kalkon dapat dilihat pada gambar 2.13 di bawah ini :
A O
B
Gambar 2.13 Kalkon (Harborne, 1987).
10.Auron
Seperti kalkon, senyawa ini tampak pada kromatogram kertas berupa
bercak kuning. Dengan sinar UV akan tampak berbeda, warna auron
berubah menjadi merah jingga bila diuapi ammonia. Struktur senyawa
Auron dapat dilihat pada gambar 2.14 di bawah ini:
O
O
CH
A B
2.2.2 Sifat Kelarutan Senyawa Flavonoida
Aglikon flavonoida adalah polifenol dan karena itu mempunyai sifat kimia seperti
fenol yaitu bersifat agak asam sehingga dapat larut dalam basa. Tetapi bila
didiamkan dalam larutan basa dan disamping itu terdapat banyak oksigen maka
akan banyak yang terurai. Karena mempunyai sejumlah gugus hidroksil yang tak
tersulih atau suatu gula, flavonoida merupakan senyawa polar maka umumnya
flavonoida larut dalam pelarut polar seperti etanol (EtOH), metanol (MeOH),
butanol (BuOH), aseton, dimetilsulfoksida (DMSO), dimetilformamida (DMF),
air dan lain-lain. Adanya gula yang terikat pada flavonoida cenderung
menyebabkan flavonoida lebih mudah larut dalam air(Markham, 1988).
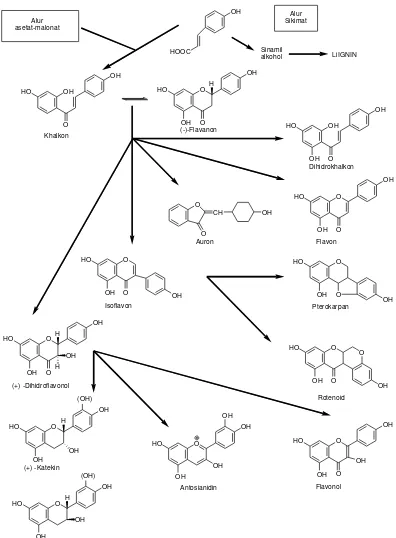
2.2.3 Biosintesa Flavonoid
Kerangka C15 yang dihasilkan, telah mempunyai substituen oksigen tertentu,
kebanyakan sebagai gugus hidroksil pada kedudukan yang sesuai, sehubungan
dengan pembentukan cincin A (jalur poliketida) dan dengan cincin B yang berasal
dari sikimat (fenilalanina---asam sikimat). Setelah terjadi berbagai perubahan
enzimatik dari ketiga atom karbon sentral dari kerangka 1,3-diaril propana dapat
mempunyai berbagai gugus fungsional, misalnya hidroksil, ikatan rangkap,
karbonil dan sebagainya. Biosintesa hubungan antara jenis monomer flavonoida
dari alur asetat-malonat dan alur sikimat dapat dilihat pada gambar 2.15 di bawah
HOOC
Gambar 2.15 Biosintesa hubungan antara jenis monomer flavonoida dari alur
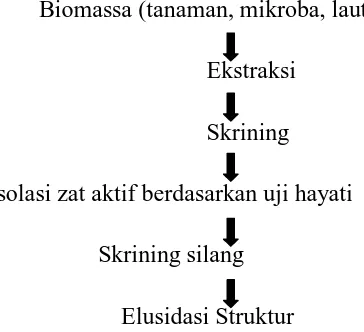
2.3 Teknik Pemisahan
Teknik pemisahan memiliki tujuan untuk memisahkan komponen yang akan
ditentukan berada dalam keadaan murni, tidak tercampur dengan
komponen-komponen lainnya. Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya
perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran
yang akan dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada
perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa
yang termasuk dalam satu golongan. Diagram teknik pemisahan dapat
dilihat pada gambar 2,16 di bawah ini:
Biomassa (tanaman, mikroba, laut)
Ekstraksi
Skrining
Isolasi zat aktif berdasarkan uji hayati
Skrining silang
Elusidasi Struktur
Gambar 2.16 Diagram Teknik Pemisahan (Muldja, 1995).
2.3.1 Ekstraksi
Sampel yang berasal dari tanaman setelah diidentifikasi, kemudian digolongkan
menjadi spesies dan famili, sampel kemudian dikumpulkan dari bagian arialnya
(daun, batang, kulit kayu pada batang, kulit batang, dan akar). Sampel ini
kemudian dikeringkan dengan cara diangin-anginkan untuk menghindari
Jika telah dikeringkan, biomassa kemudian digiling menjadi
partikel-partikel kecil menggunakan blender atau penggilingan. Proses penggilingan ini
penting karena ektraksi efektif pada partikel kecil, dikarenakan memiliki luas
permukaan yang lebih besar.Pemilihan pelarut ekstraksi sangat penting. Jika
tanaman diteliti dari sudut pandang etnobotani, ektraksi harus mengikuti
pemakaiannya secara tradisional. Kegagalan mengekstraksi biomassa dapat
menyebabkan kehilangan akses untuk mendapatkan zat aktif.
Terdapat sejumlah metode ekstraksi, yang paling sederhana adalah
ekstraksi dingin (dalam labu besar berisi biomassa), dengan cara ini bahan kering
hasil gilingan diekstraksi pada suhu kamar secara berturut-turut dengan pelarut
yang kepolarannya makin tinggi. Keuntungan utama cara ini adalah merupakan
metode ekstraksi yang mudah karena ekstrak tidak dipanaskan sehingga
kemungkinan kecil bahan alam terurai.
Penggunaan pelarut dengan peningkatan kepolaran secara berurutan
memungkinkan pemisahan bahan alam berdasarkan kelarutannya (dan
polaritasnya) dalam ektraksi. Hal ini sangat mempermudah proses isolasi.
Ekstraksi dingin memungkinkan banyak senyawa terekstraksi, meskipun beberapa
senyawa memiliki kelarutan terbatas dalam pelarut ekstraksi pada suhu kamar
(Heinrich et al, 2009).
Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif
terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan ekstrak pekat,
biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator
(Harborne, 1996).
2.3.2 Partisi
Metode pemisahan yang mungkin paling sederhana adalah partisi, yang banyak
digunakan sebagai tahap awal pemurnian ekstrak. Partisi menggunakan dua
pelarut tak bercampur yang ditambahkan kedalam ekstrak tersebut, hal ini dapat
dilakukan secara terus menerus dengan menggunakan dua pelarut yang tak
bercampur yang kepolarannya meningkat. Partisi biasanya dilakukan melalui dua
1. Air/petroleum eter ringan (heksana) untuk menghasilkan fraksi nonpolar di
lapisan organik
2. Air/diklorometan atau air/kloroform atau air/etil asetat untuk membuat
fraksi agak polar di lapisan organik. Ini merupakan metode pemisahan
yang mudah dan mengandalkan kelarutan bahan alam dan bukan interaksi
fisik dengan medium lain (Heinrich et al, 2009).
2.3.3 Hidrolisis
Prosedur yang digunakan untuk hidrolisis asam dari flavonoid glikosida adalah,
sebanyak 2 mg sampel flavonoid glikosida dicampur dengan asam klorida 6%
sebanyak 5 ml dengan jumlah metanol yang sangat sedikit pada sampel untuk
membuat proses hidrolisis menjadi sempurna. Larutan dipanaskan selama 45
menit lalu didinginkan, kemudian ekstrak sepenuhnya dilarutkan dengan eter.
Penguapan dari larutan akan mengendapkan ramnosa dan glukosa. Lapisan eter,
setelah dikeringkan dengan menggunakan natrium sulfat akan didapatkan aglikon
flavonoid setelah diuapkan (Mabry et al, 1970).
2.3.4 Kromatografi
Kromatografi pertama kali dikembangkan oleh seorang ahli botani Rusia Michael
Tswett pada tahun 1903 untuk memisahkan pigmen berwarna dalam tanaman
dengan cara perkolasi ekstrak petroleum eter dalam kolom gelas yang berisi
kalsium karbonat (CaCO3). Kromatografi merupakan suatu teknik pemisahan
yang menggunakan fase diam (stationary phase) dan fase gerak (mobile phase).
Teknik kromatografi telah berkembang dan telah digunakan untuk memisahkan
dan mengkuantifikasi berbagai macam komponen yang kompleks, baik komponen
organik maupun komponen anorganik.
Kromatografi dapat dibedakan atas berbagai macam tergantung pada
pengelompokkannya. Berdasarkan pada mekanisme pemisahannya, kromatografi
dibedakan menjadi: kromatografi adsorbsi, kromatografi partisi, kromatografi
Berdasarkan pada alat yang digunakan, kromatografi dapat dibagi atas:
kromatografi kertas, kromatografi lapis tipis (disebut juga kromatografi planar),
kromatografi cair kinerja tinggi, dan kromatogtrafi gas. Bentuk kromatografi yang
paling awal adalah kromatografi kolom yang digunakan untuk pemisahan sampel
dalam jumlah yang besar.
Pemisahan pada kromatografi planar pada umumnya dihentikan sebelum
semua fase gerak melewati seluruh permukaan fase diam. Solut pada kedua
kromatografi ini dikarakterisasi dengan jarak migrasi solut terhadap jarak ujung
fase geraknya. Nilai faktor retardasi solut (Rf) dapat dihitung dengan
menggunakan perbandingan dalam persamaan:
Rf= arak yang ditempuh fase gerak arak yang ditempuh solut
Nilai maksimum Rf adalah 1 dan ini dicapai ketika solut mempunyai
perbandingan distribusi (D) dan faktor retensi sama dengan 0 yang berarti solut
bermigrasi dengan kecepatan yang sama dengan fase gerak. Nilai minimum Rf
adalah 0 dan ini teramati jika solut tertahan pada posisi titik awal di permukaan
fase diam.
Proses Sorpsi
Sorpsi merupakan proses pemindahan solut dari fase gerak ke fase diam,
sementara itu proses sebaliknya (pemindahan solut dari fase diam ke fase gerak)
disebut dengan desorpsi. Kedua proses ini (sorpsi dan desorpsi) terjadi secara
terus menerus selama pemisahan kromatografi karenanya sistem kromatografi
berada dalam keadaan kesetimbangan dinamis. Solut akan terdistribusi diantara
dua fase yang bersesuaian dengan perbandingan distribusinya (D) untuk menjaga
keadaan kesetimbangan ini. Ada 4 jenis mekanisme sorpsi dasar dan umumnya 2
atau lebih mekanisme ini terlibat dalam satu jenis kromatografi. Keempat jenis
Adsorben
Silika gel merupakan jenis adsorben (fase diam) yang penggunaannya paling luas.
Permukaan silika gel terdiri atas gugus Si-O-Si dan gugus silanol (Si-OH). Gugus
silanol bersifat sedikit asam dan polar karenanya gugus ini mampu membentuk
ikatan hidrogen dengan solut-solut yang agak polar sampai sangat polar.
Adanya air dari atmosfer yang diserap oleh permukaan silika gel mampu
mendeaktifkan permukaan silika gel karena air akan menutup sisi aktif silika gel.
Hal seperti ini dapat diatasi dengan memanaskan pada suhu 1050C, meskipun
demikian reprodusibilitasnya sulit dicapai kecuali jika suhu dan kelembapan
benar-benar dijaga secara hati-hati. Semakin polar solut maka akan semakin
tertahan kuat ke dalam adsorben silika gel ini. Berikut merupakan kepolaran dari
beberapa adsorben menurut Gandjar dkk (2007) yang disajikan pada tabel 2.1
berikut:
Tabel 2.1 Daftar Adsorben pada Kromatografi
No Nama Adsorben Sifat Adsorben
1 Alumina Paling polar
Paling non polar
2 Karbon aktif
3 Silika gel
4 Selulosa
5 Resin-resin polimerik (stiren/difenil benzen)
2.3.4.1 Kromatografi Lapis Tipis
Teknik kromatografi lapis tipis (KLT) sangat bermanfaat untuk analisis obat dan
bahan lain dalam laboratorium karena hanya memerlukan peralatan sederhana,
waktu cukup singkat (15-60 menit), dan jumlah zat yang diperiksa cukup kecil
(kira-kira 0,01 g senyawa murni atau 0,1 g simplisia) (Harmita, 2009).
KLT pada penelitian flavonoid ialah sebagai cara analisis cepat yang
memerlukan bahan yang sangat sedikit. Menurut pengalaman pengarang, KLT
a. Mencari pelarut untuk kromatografi kolom
b. Analisis fraksi yang diperoleh dari kromatografi kolom
c. Isolasi flavonoid murni skala kecil
d. Identifikasi flavonoid secara ko-kromatografi (Markham, 1988)
Kromatografi lapis tipis merupakan metode fisikokimia yang didasarkan atas
penyerapan, partisi (pembagian), atau gabungannya. Lapisan pemisah tipis yang
terdiri atas butir penyerap atau penyangga dilapiskan pada lempeng kaca, logam
dan lain-lain. Untuk mendapatkan kondisi jenuh dalam bejana kromatografi,
dinding bejana dilapisi dengan lembaran kertas saring, fase gerak dituang kedalam
bejana sehingga kertas saring basah dan dalam bejana terdapat fase gerak setinggi
5-10 mm. Bejana ditutup dan dibiarkan selama satu jam pada suhu 20-25 oC.
(Harmita, 2009).
2.3.4.2 Kromatografi Kolom
Kolom kromatografi atau tabung untuk pengaliran karena gaya tarik bumi
(gravitasi) atau sistem bertekanan rendah biasanya terbuat dari kaca yang
dilengkapi keran jenis tertentu pada bagian bawahnya untuk mengatur aliran
pelarut. Ukuran keseluruhan kolom sungguh beragam, tetapi biasanya panjangnya
sekurang-kurangnya 10 kali garis tengah dalamnya dan mungkin saja sampai 100
kalinya. Ukuran kolom dan banyaknya penjerap yang dipakai ditentukan oleh
bobot campuran sampel yang akan dipisahkan.
Untuk pemisahan normal, bobot sampel biasanya 30:1 ternyata memadai
jika pemisahan tidak terlalu sukar. Ukuran partikel penjerap pada kolom biasanya
lebih besar daripada untuk KLT. Walau pun banyak jenis penjerap telah dipakai
untuk kolom, alumina dan silika gel adalah penjerap yang paling berguna dan
mudah didapat.Fraksi kolom yang mengandung senyawa yang sama (diperiksa
dengan KLT) atau tampaknya berasal dari satu puncak (memakai pendeteksian
sinambung) digabungkan, dan pelarutnya diuapkan, lebih baik dengan tekanan
rendah. Jika pelarut dan penjerap murni. Maka fraksi-fraksi pun murni (Gritter et
2.3.4.3 Kromatografi Lapis Tipis Preparatif
Sebagian besar pemakaian kromatografi lapis tipis preparatif hanya dalam jumlah
miligram. Kromatografi lapis tipis preparatif bersama-sama dengan kromatografi
kolom terbuka, dijumpai sebagian besar dalam isolasi bahan alam. Penjerap yang
paling umum digunakan adalah silika gel dan dipakai untuk pemisahan campuran
senyawa lipofil maupun campuran senyawa hidrofil. Ukuran partikel dan porinya
kurang lebih sama dengan ukuran tingkat KLT.
Cuplikan sebanyak 10-100 mg dapat dipisahkan pada lapisan silika gel
atau aluminium oksida 20 x 20 cm yang tebalnya 1 mm. Pengembangan plat
KLTP biasanya dilakukan dalam bejana kaca yang dapat menampung beberapa
plat. Bejana dijaga tetap jenuh dengan pelarut pengembang dengan bantuan
sehelai kertas saring yang tercelup ke dalam pengembang.
Kebanyakan penjerap KLTP mengandung indikator fluorosensi yang
membantu mendeteksi kedudukan pita yang terpisah sepanjang senyawa yang
dipisahkan menyerap sinar UV. Pita yang kedudukannya telah diketahui dikerok
dari plat dengan spatula atau pengerok berbentuk tabung. Senyawa harus
diekstraksi dari penjerap dengan pelarut yang paling kurang polar yang mungkin
(sekitar 5 ml pelarut untuk 1 g penjerap). Harus diperhatikan bahwa semakin lama
senyawa berkontak dengan penjerap makin besar kemungkinan penguraian
(Hostettmann et al, 1995)
2.4.Teknik Spektroskopi
Teknik spektroskopi adalah salah satu teknik analisis kimia-fisika yang
mengamati tentang interaksi atom atau molekul dengan radiasi elektomagnetik.
Ada dua macam instrumen pada teknik spektroskopi yaitu spektrometer dan
spektrofotometer. Instrumen yang memakai monokromator celah tetap pada
bidang fokus disebut sebagai spektrometer. Apabila spektrometer tersebut
dilengkapi dengan detektor yang bersifat fotoelektrik maka disebut
Interaksi atom atau molekul dapat memiliki berbagai jenis energi, antara
lain sebagai berikut.
1. Energi rotasi (energi putaran). Energi ini disebabkan oleh perputaran molekul
pada pusat gaya berat molekul tersebut.
2. Energi vibrasi (energi getaran). Energi ini disebabkan oleh perpindahan
periodik atom-atom molekul tersebut dari posisi keseimbangan.
3. Energi elektronik. Energi ini disebabkan elektron-elektron yang berhubungan
dengan masing-masing atom atau ikatan selalu dalam keadaan bergerak.
4. Energi Translasi. Energi translansi adalah energi kinetik atom atau molekul
yang dimiliki untuk bergerak dari satu tempat ke tempat lain
E
translansi< E
rotasi< E
vibrasi< E
elektronik(Harmita.2009)
2.4.1 Spektroskopi Ultraviolet (UV-Vis)
Serapan molekul di dalam daerah ultraviolet dan terlihat dari spektrum bergantung
pada struktur ultraelektronik dari molekul. Penyerapan sejumlah energi,
menghasilkan percepatan dari elektron dalam orbital tingkat dasar ke orbital
yangberenergi lebih tinggi di dalam keadaan tereksitasi (Silverstein,1986).
Senyawa polifenol memiliki dua karakteristik pita penyerapan Ultraviolet
dengan maksimal jarak 240 sampai 285 nm dan 300 sampai 550 nm. Berbagai
macam golongan flavonoid dapat dikenali dari spektrum UV mereka
masing-masing, karakteristik spektra UV dari masing-masing flavonoid yang
mengandung jumlah dari golongan hidroksil aglikon, pola substituen glikosida,
Spektrum flavonoid biasanya ditentukan dalam larutan dengan pelarut
metanol (MeOH, AR atau yang setara) atau etanol (EtOH), meski perlu diingat
bahwa spektrum yang dihasilkan dalam etanol kurang memuaskan sehingga pada
umumnya pelarut metanol yang digunakan untuk menentukan serapan pita yang
dihasilkan. Perubahan penyulihan pada cincin A cenderung tercerminkan pada
serapan pita II, sedangkan perubahan penyulihan pada cincin B dan C cenderung
lebih jelas tercermin pada serapan pita I (Markham, 1988).
Ciri spektrum khas jenis flavonoid utama dengan pola oksigenasi yang setara
disajikan pada tabel 2.2 dibawah ini :
Tabel 2.2 Rentangan Serapan Spektrum UV-Visible golongan Flavonoida
No. Pita II (nm) Pita I (nm) Jenis Flavonoida
1. 250-280 310-350 Flavon
2. 250-280 330-360 Flavonol (3-OH tersubstitusi)
3. 250-280 350-385 Flavonol (3-OH bebas)
4. 245-274 310-330 bahu Isoflavon
5. 275-295 300-330 bahu Flavanon dan dihidroflavonol
6. 230-270
(kekuatan rendah) 340-390 Khalkon
7.
230-270
(kekuatan rendah)
380-430 Auron
8. 270-280 465-560 Antosianidin dan antosianin
2.4.2 Spektroskopi Inframerah (FT-IR)
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi
getaran (vibrasi) yang berlainan. Inti-inti atom yang terikat oleh ikatan kovalen
mengalami getaran (vibrasi) atau osilasi (oscillation) dengan cara serupa dengan
Bila molekul menyerap radiasi inframerah, energi yang diserap
menyebabkan kenaikan dalam amplitudo getaran atom-atom yang terikat itu. Jadi
molekul ini berada dalam keadaan vibrasi tereksitasi , energi yang diserap ini akan
dibuang dalam bentuk panas bila molekul itu kembali ke keadaan dasar. Panjang
gelombang eksak dari absorpsi oleh suatu tipe ikatan, bergantung pada macam
getaran dari ikatan tersebut. Oleh karena itu, tipe ikatan yang berlainan (H,
C-C, C=O, C=C-C, O-H, dan sebagainya) menyerap radiasi inframerah pada panjang
gelombang yang berlainan. Dengan demikian spektrometri inframerah dapat
digunakan untuk mengidentifikasi adanya gugus fungsi dalam suatu molekul.
Banyaknya energi yang diserap juga beraneka ragam dari ikatan ke ikatan. Ini
disebabkan sebagian oleh perubahan dalam momen dipol (µ≠0) pada saat energi
diserap. Ikatan nonpolar (seperti C-H atau C-C) menyebabkan absorpsi lemah,
sedangkan ikatan polar (seperti misalnya O-H, N-H, dan C=O) menunjukkan
absorpsi yang lebih kuat.
Suatu ikatan dalam sebuah molekul dapat mengalami berbagai vibrasi
molekul. Secara umum terdapat dua tipe vibrasi molekul:
1. Streching (vibrasi regang/ulur): vibrasi sepanjang ikatan sehingga terjadi
perpanjangan atau pemendekan ikatan.
2. Bending (vibrasi lentur/tekuk): vibrasi yang disebabkan oleh sudut ikatan
sehingga terjadi pembesaran atau pengecilan sudut ikatan.
Oleh karena itu suatu ikatan tertentu dapat menyerap energi lebih dari satu
panjang gelombang. Contohnya, ikatan O-H menyerap energi pada frekuensi 3330
cm-1, energi pada panjang gelombang ini menyebabkan kenaikan vibrasi regang
ikatan O-H itu.
Suatu ikatan O-H itu juga menyerap pada kira-kira 1250 cm-1, energi pada
panjang gelombang ini menyebabkan kenaikan vibrasi lentur. Tipe vibrasi yang
2.4.3 Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR)
Setelah spektroskopi inframerah, spektroskopi resonansi magnetik inti (NMR)
adalah yang metode yang paling penting digunakan dalam kimia organik. Dalam
spektroskopi inframerah mengandung infromasi mengenai adanya gugus fungsi
pada molekul, sedangkan spektroskopi NMR memberikan informasi mengenai
jumlah dari masing-masing hidrogen.
Kemampuan terhebat resonansi inti magnetik timbul karena tidak semua
proton dalam molekul memiliki resonansi yang identik pada frekuensi yang sama.
Hal ini sesuai dengan fakta bahwa berbagai macam proton dalam molekul
dikelilingi oleh elektron dan memiliki sedikit perbedaan dalam lingkungan
elektronik dari satu dan yang lainnya. Proton akan terlindungi oleh elektron yang
mengelilingi mereka. Dalam daerah magnetik, peredaran elektron valensi dari
daerah penghasil proton yang bertentangan dengan daerah magnetik yang berlaku. Pergeseran kimia dalam unit δ ditunjukkan dalam jumlah resonansi proton yang bergeser dari TMS dalam bagian per juta (ppm) dari frekuensi dasar spektroskopi
δ=frekuensi spektrometer dalam M pergeseran dalam
Unsur dasar dari spektrometer nmr adalah ilustrasi skematis. Sampel
dilarutkan dalam pelarut yang tidak memiliki proton (biasanya CCl4) dan dalam
jumlah yang kecil dari TMS yang ditambahkan sebagai pusat referensi internal.
Semua proton dalam molekul yang identik dalam lingkungan kimia akan
memiliki pergerseran kimia yang sama. Dengan demikian, semua proton dari
TMS atau semua proton dalam benzena, siklopentana, atau aseton memiliki nilai resonansi yang berdekatan pada nilai δ. Masing-masing komponen akan memiliki penyerapan yang tunggal dalam spektrum nmr. Proton ini dikatakan sama secara
kimia. Pada kenyataannya, spektrum tidak dapat hanya dibedakan dari berapa
banyak tipe proton yang berbeda pada molekul tersebut, tetapi dapat
memperlihatkan berapa banyak jenis perbedaan yang ada dalam molekul tersebut.
Dalam spektrum nmr, daerah dibawah masing-masing peak adalah proporsional
Tidak semua inti 1H membalikkan spinnya tepat sama dengan frekuensi
radio karena inti-inti tersebut mungkin berbeda dalam lingkungan kimianya atau
bahkan lingkungan elektroniknya. Kondisi ini menyebabkan adanya pergeseran
kimia. Kebanyakan senyawa organik memiliki puncak bawah medan (dimedan rendah) dari TMS/senyawa standar dan diberi δ positif. Nilai δ= 1,00 berarti bahwa puncak muncul 1 ppm dibawah medan dari puncak TMS. Cara umum
untuk menetapkan puncak ialah dengan membandingkan pergeseran kimia dengan
proton yang serupa dalam senyawa standar yang diketahui. Sebagai contoh,
Benzena memiliki enam hidrogen ekuivalen dan menunjukkan satu puncak pada
spektrumnya pada δ = 7,24. Senyawa aromatik lain juga menunjukkan puncak
didaerah ini. Hal ini menunjukkan bahwa kebanyakan hidrogen cincin aromatik akan memiliki pergeseran kimia pada sekitar δ = 7. Demikian pula kebanyakan hidrogen CH3-Ar muncul pada δ = 2,2-2,5. Pergeseran kimia dari inti 1H pada
berbagai lingkungan kimia telah ditetapkan dengan mengukur spektrum NMR 1H
dari sejumlah besar senyawa dengan relatif sederhana yang diketahui