i
LAPORAN AKHIR
PENELITIAN FUNDAMENTAL
MEMPELAJARI KARAKTERISTIK SENYAWA N-ASETIL
GLUKOSAMIN PADA PROSES HIDROLISIS KITIN MENGGUNAKAN
ENZIM KITINASE DARI Pseudomonas sp TNH 54
Tahun ke 1 dari rencana 2 tahun
Oleh :
Ketua : Dr. Nuniek Herdyastuti, M.Si (NIDN 0010117004) Anggota : Dr. Sari Edi Cahyaningrum, M.Si (NIDN : 0029127002)
UNIVERSITAS NEGERI SURABAYA
Nopember, 2015
iii MEMPELAJARI KARAKTERISTIK SENYAWA N-ASETIL GLUKOSAMIN PADA
PROSES HIDROLISIS KITIN MENGGUNAKAN ENZIM KITINASE DARI Pseudomonas Sp TNH 54
Abstrak Oleh :
Nuniek Herdyastuti dan Sari Edi Cahyaningrum
N-Asetil glukosamin merupakan senyawa turunan kitin yang dapat diperoleh secara enzimatis dari substratnya kitin jenis amorf. Kitin jenis amorf merupakan kitin yang telah dimodifikasi dengan penambahan Sodium dodecyl sulphate (SDS) diketahui mempunyai aktifitas tinggi terhadap enzim kitinase. Seanyawa N-Asetil glukosamin sangat potensial untuk digunakan dalam industri karena mempunyai banyak aplikasi yang signifikan dan mempunyai efisiensi tinggi. Penelitian ini bertujuan untuk mengetahui pengaruh konsentrasi substrat, enzim dan waktu inkubasi terhadap pola kinetika pebentukan N-asetilglukosamin serta pengaruh pelarut terhadap kemurnian N-Asetil glukosamin. Metode yang digunakan untuk menentukan N-Asetil glukosamin dengan menggunakan HPLC, dan pemurnian dilakukan dengan variasi pelarut. Hasil optimasi menunjukkan bahwa konsentrasi substrat 1,2% dapat menghasilkan 94,8% N-Asetil glukosamin, dengan konsentrasi enzim 0,1 U/mL dan waktu inkubasi selama 8 jam. Berdasarkan pola pemetaan berganda menunjukkan bahwa kinetika reaksi enzimatis mengikuti orde dua dengan nilai KM sebesar 8,33 mg/mL dan Vmaks
52,6 mg/mL jam. Hasil pemurnian dengan variasi pelarut asetonitril dengan aseton, metanol dan etanol dapat menunjukkan pemisahan yang cukup bagus sehingga diperoleh puncak N-Asetil glukosamin sesuai dengan standar pada waktu retensi sekitar 3,1 – 3,3 menit
Kata kunci : Kitin, kitinase, N-Asetil glukosamin
iv STUDYING TO THE CARACTERISTIF OF N-ACETYL GLUCOSAMINE IN
CHITIN HYDROLYSIS PROCESS WITH CHITYNASE ENZYME FROM Pseudomonas Sp TNH54
Abstract
By :
Nuniek Herdyastuti and Sari Edi Cahyaningrum
N-Acetyl Glucosamine is a compound chitin derivative which can be obtained enzymatis from substrate amorphous chitin types. Amorphous chitin is a kind of that has been modified by the addition of sodium dodecyl sulphate (SDS) are known to have high activity of the enzyme chitinase. N-Acetyl glucosamine potential for use in industry because it has many significant applications and has high efficiency. This study aims to determine the effect of substrate concentration, enzyme and incubation time for kinetic patterns to forming of N-acetylglucosamine and solvent effect on the purity of the N-Acetyl glucosamine. The method used to determine the N-acetyl glucosamine by using HPLC, and purification is done by varying the solvent. Optimization results show that 1.2% concentration of the substrate can produce 94.8% of N-acetyl glucosamine on the enzyme concentration of 0.1 U/mL and the incubation time for 8 hours. Based on the pattern of double-reciprocal plot showed that the kinetics of enzymatic reaction followed a second order with the KM value of 8.33 mg / mL and a Vmax of 52.6 mg / mL h. The results of purification with acetonitrile with solvent variations of the acetone, methanol and ethanol can show a good separation to obtain the peak of N-Acetyl glucosamine in accordance with the standards at a retention time of about 3.1 to 3.3 minutes
v PRAKATA
Dengan mengucap syukur kehadlirat Allah s.w.t, atas segala Rahmad dan Kemurahan-Nya penulis dapat menyeleaikan penelitian dengan laporan akhir yang berjudul “Mempelajari karakteristik senyawa N-asetil glukosamin pada proses hidrolisis kitin menggunakan enzim kitinase dari Pseudomonas Sp TNH 54”. Penelitian ini dibagi dalam dua tahapan, yaitu pada tahap pertama (Tahun – 1) melakukan isolasi, optimasi, dan pemurnian N-Asetil glukosamin yang selanjutnya dilanjutkan pada tahap kedua (Tahun – 2) untuk penentuan rendemen serta penentuan pemurnian terbaik dan karakterisasi N-Asetil glukosamin.
Penelitian ini memperoleh dana dari Proyek Peningkatan Kualitas Sumber Daya Manusia Direktorat Pembinaan Penelitian Dan Pengabdian Kepada Masyarakat Dirjen Dikti Kemendikbud Tahun Anggaran 2015 melalui program penelitian Fundamental. Untuk itu kami mengucapkan terima kasih kepada : Ketua DP2M, Rektor UNESA, Ketua Lembaga Penelitian dan Pengabdian UNESA, Ketua Jurusan Kimia UNESA, Mahasiswa Kimia yang telah membantu penelitian ini. Harapan kami semoga penelitian ini dapat membawa manfaat bagi peneliti sendiri khususnya dan dapat memberikan informasi bagi rekan-rekan peneliti lainnya.
Surabaya, Nopember 2015
vi DAFTAR ISI Halaman HALAMAN JUDUL i LEMBAR PENGESAHAN ... ii ABSTRAK ... iii ABSTRACT ... iv PRAKATA ... v DAFTAR ISI ... vi
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... x
RINGKASAN ... xi
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Kitin ... 5
2.2 Struktur Kitin ... 6
2.3 Senyawa turunan kitin ... 7
2.4 Manfaat Kitin ... 9
2.5 Penelitian terkait kitinase ... 11
2.6 Ekstraksi mengunakan pelarut ... 12
BAB III TUJUAN DAN MANFAAT PENELITIAN ... 15
BAB IV METODE PENELITIAN BAB V HASIL PENELITIAN 5.1 Pembuatan kitin jenis amorf 5.2 Optimasi produksi N-Asetil glukosamin 5.3 Pemurnian N-Asetil glukosamin BAB VI SIMPULAN DAN SARAN ... ... ... ... ... ... 16 22 22 23 35 43 DAFTAR PUSTAKA ... 44 LAMPIRAN ... 47
vii DAFTAR TABEL
Tabel Halaman
2.1 Sifat-sifat pelarut umum ... 13 5.1 Penentuan Jumlah N-asetil glukosamin
berdasarkan variasi konsentrasi substrat ... 27 5.2 Penentuan Jumlah N-asetil glukosamin
viii DAFTAR GAMBAR
Gambar Halaman
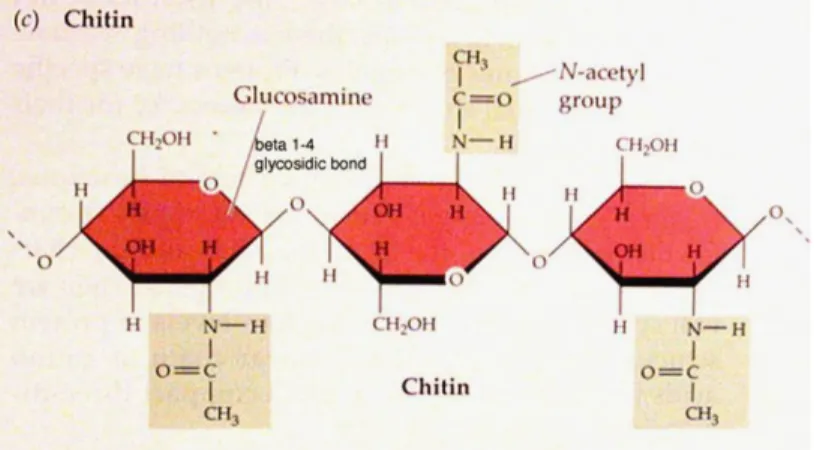
2.1 Senyawa kitin yang terdiri dari N-Asetil-glukosamin dihubungkan oleh ikatan β, 1-4 glikosida
... 6
2.2 Jalur degradasi kitin oleh kitinase ... 8
4.1 Kerangka Operasional Penelitian ... 17
5.1 Kitin jenis amorf ... 22
5.2 Hasil analisis penentuan kurva standar N-asetil glukosamin pada konsentrasi 0,8 mg/mL dengan HPLC ... 23
5.3 Kurva standar N-Asetil glukosamin ... 24
5.4 Hasil analisis HPLC pada penentuan konsentrasi optimum untuk konsentrasi kitin1,6 – 2,4% ... 25
5.5 5.6 5.7 Hasil analisis HPLC pada penentuan konsentrasi optimum untuk konsentrasi kitin 0,4 – 1,2% Persentase N-Asetil glukosamin pada masing-masing substrat Penentuan KM dan Vmaks dengan Persamaan Lineweaver – Burk ... ... ... 26 27 28 5.8 Hasil analisis HPLC pada penentuan waktu inkubasi optimum untuk waktu 0 – 2 jam ... 30
5.9 Hasil analisis HPLC pada penentuan waktu inkubasi optimum untuk waktu 4 – 24 jam ... 31
5.10 Persentase N-Asetil glukosamin pada variasi waktu inkubasi ... 33
5.11 Persentase N-Asetil glukosamin pada variasi konsentrasi enzim ... 34
5.12 Hasil analisis bagian filtrat pada tahap pemurnian ... 35
5.13 Hasil analisis bagian endapan pada tahap pemurnian untuk aseton, etanol, dan asetonitril ... 36
5.14 Hasil analisis bagian endapan pada tahap pemurnian untuk metanol ... 37
5.15 Hasil N-Asetil glukosamin pada pemurnian bertahap untuk NAG standar, filtrat pada tahap akhir, endapan pada tahap akhir dan filtrat pada asetonitril ... 38
5.16 Hasil analisis bagian endapan pada bagian filtrat pertama ... 39 5.17 Hasil pemurnian N-Asetil glukosamin tahap
ix aseton, etanol, dan asetonitril ... 40 5.18 Hasil pemurnian N-Asetil glukosamin tahap
ketiga dengan variasi pelarut menggunakan
x DAFTAR LAMPIRAN
Lampiran Halaman
1 Penentuan kurva standar N-Asetil glukosamin (HPLC) ... 47 2 3 4 5 6 7 8 9 10 11 12
Perhitungan persentase N-asetil glukosamin pada optimasi konsentrasi substrat
Hasil penentuan optimasi konsentrasi substrat dengan HPLC
Penentuan KM dan Vmaks dari
transformasi persamaan Michaelis-Menten ke Lineweaver-Burk Perhitungan persentase N-asetil glukosamin pada optimasi waktu inkubasi
Hasil penentuan optimasi waktu inkubasi dengan HPLC
Kurva standar N-asetil glukosamin (Spektrofotometer uv-vis)
Perhitungan N-asetil glukosamin pada optimasi konsentrasi enzim
Bagan tahapan pemurnian N-asetil glukosamin
Hasil analisis pemurnian dengan variasi pelarut
Biodata peneliti
Publikasi di Seminar Nasional Kimia
... ... ... ... ... ... ... ... ... ... ... 48 50 56 57 59 66 67 69 70 73 92
xi RINGKASAN
Kitin banyak tersebar di alam seperti pada jamur, alga, nematoda, arthropoda,
mollusca, hewan dan tumbuhan,arakhnida, dinding sel jamur, exoskeletons serangga,
cangkang krustasea dan bagian dari invertebrata, juga ditemukan sebagai polimer ekstraseluler dari beberapa mikroba. (Guo, 2004). Bentuk kitin yang rapat dan kompak karena bentuk - yang mempunyai rantai antipararel dan menstabilkan bentuk polimorfiknya secara alami sehingga menyebabkan kitin tidak larut dalam pelarutnya (Majtán, 2007). Berdasarkan hasil yang diperoleh pada penelitian penelitian sebelumnya menunjukkan bahwa kitin yang telah dimodifikasi dengan penambahan sodium dodecyl sulphate (SDS) menunjukkan aktivitas yang lebih tinggi terhadap kitinase dibandingkan kitin serbuk. Hal ini dikarenakan perbedaan kristalinitas kitin amorf dengan kitin serbuk, dimana kitin jenis amorf lebih terbuka dibanding kitin serbuk (Herdyastuti, 2015).
Kitin dapat didegradasi secara enzimatis dengan kitinase menghasilkan monomernya N-Asetil glukosamin atau 2-asetamido-2-deoksi-D-glukosa (GlcNAc) adalah gula amino sederhana yang berpolimerisasi membentuk ikatan β-1,4. Monosakarida amino tersebut mempunyai rumus molekul C8H15NO6, dan berat molekulnya adalah 221,2. Secara umum
GlcNAc merupakan serbuk berwarna putih dan sedikit manis, mempunyai titik leleh pada 221° C mempunyai kelarutan 25 % dalam air , serta 1 % larutan air tidak berwarna dan jelas (Chen and Liu, 2010). N-Asetil glukosamin merupakan suatu nutrien, metabolit senyawa antara dan diperlukan pada fungsi sel. Senyawa monomernya yaitu N-asetil D-glukosamin dan D-glukosamin merupakan kandidat food supplement, serta pengobatan pada penderita
osteoarthritis (Illankovan et al., 2005). suplemen makanan dan untuk pengembangan terapi
karena karakteristik yang unik. Hasil uji toksisitas mengungkapkan bahwa GlcNAc tidak beracun, aman bagi tubuh dan lebih lanjut menunjukkan bahwa 54% dari glukosamin yang diberikan akan diekskresikan ke dalam urin dalam satu hari.
Berdasarkan hal tersebut menunjukkan bahwa GlcNAc sangat potensial untuk digunakan dalam industri karena mempunyai banyak aplikasi yang signifikan dan mempunyai efisiensi tinggi. Untuk mendapatkan GlcNAc maka perlu dilakukan isolasi dari kitin secara enzimatis, pemurnian dan karakterisasi. Penelitian pada Tahun – 1 ini bertujuan untuk melakukan optimasi terhadap variasi konsentrasi enzim, substrat dan waktu inkubasi sehingga dapat diketahui pola kinetikanya. Serta melakukan pemurnian terhadap variasi beberapa pelarut berdasarkan sifat kepolarannya yaitu aseton, etanol, metanol dan asetonitril.
xii Tahap isolasi N-Asetil glukosamin dilakukan secara enzimatis dengan menggunakan kitin jenis amorf sebagai substrat. Metode yang digunakan untuk menganalisis N-Asetil glukosamin adalah dengan menggunakan HPLC dan penentuan konsentrasinya dengan berdasarkan kurva standar N-Asetil glukosamin. Adapun penentuan aktivitas kitinase menggunakan metode Monreal and Reese yang didasarkan pada pelepasan N-Asetil glukosamin dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 540 nm. Optimasi pembentukan N-Asetil glukosamin dilakukan terhadap variasi konsentrasi substrat, konsentrasi enzim dan waktu inkubasi. Pada tahap pemurnian dilakukan dengan cara ekstraksi menggunakan variasi pelarut aseton, etanol, metanol dan asetonitril.
Hasil yang diperoleh dari tahap optimasi variasi konsentrasi substrat 0,4 – 2,4 mg/mL menunjukkan bahwa konsentrasi substrat 1,2 mg/mL dapat menghasilkan N-Asetil glukosamin tertinggi yaitu 22,8 mg/mL atau 94,8 %. Berdasarkan pemetaan kebalikan-ganda diperoleh harga KM sebesar 8,33 mg/mL dan Vmaks 52,6 mg/mL jam atau 0,88 mg/mL Menit,
reaksi enzimatis tersebut mengikuti pola kinetika reaksi orde dua. Penentuan waktu inkubasi optimum selama 0 – 24 jam menunjukkan bahwa, jumlah N-Asetil glukosamin yang tertinggi yaitu sebesar 10,95 mg/mL atau 45,6 % dihasilkan saat enzim kitinase dan kitin jenis amorf diinteraksikan selama 8 jam. Menurut Widyastuti (2007), senyawa kitooligosakarida dan N-asetilglukosamin hasil hidrolisis kitin oleh kitinase pada konsentrasi yang tinggi akan dapat menyebabkan inhibisi umpan balik karena kelebihan N-asetilglukosamin sebagai produk akhirnya. Penelitian lain menyebutkan bahwa kitinase dapat dihambat secara kompetitif oleh beberapa senyawa seperti alosamidin dan beberapa senyawa selain gula yang terdapat di dalamnya (Peter, 2005). Jumlah N-Asetil glukosamin menunjukkan kenaikan dengan semakin tingginya konsentrasi enzim kitinase, dimana konsentrasi enzim 0,1 U/mL dapat menghasilkan sekitar 0,454 mg/mL atau 1,89 % N-Asetil glukosamin dengan konsentrasi kitin 1,2 % diikubasi selama 8 jam. Pemurnian yang dilakukan dengan menggunakan pelarut aseton, metanol, etanol, dan asetonitril yang divariasi dengan pelarut asetonitril memberikan hasil yang bagus dengan pola yang hampir sama dengan diperolehnya puncak yang sesuai dengan N-Asetil glukosamin standar dengan waktu retensi sekitar 3,1 – 3,3 menit. Belum dilakukan perhitungan rendemen dari masing-masing pemurnian untuk menentukan pelarut manakah yang dapat menghasilkan rendemen tertinggi.
1 BAB I
PENDAHULUAN
1.1 Latar Belakang
Kitin merupakan polimer yang sangat melimpah di alam dan menempati urutan kedua setelah selulosa. Kitin banyak tersebar di alam seperti pada jamur, alga, nematoda,
arthropoda, mollusca, hewan dan tumbuhan,arakhnida, dinding sel jamur, exoskeletons
serangga, cangkang krustasea dan bagian dari invertebrata, juga ditemukan sebagai polimer ekstraseluler dari beberapa mikroba. (Guo, 2004). Jumlah kitin yang dapat dihasilkan per tahunnya dalam biosfer sangat banyak sekali. Pada tahun 1993 diperkirakan dunia dapat memperoleh kembali kitin dari invertebrata laut sebanyak 37.000 ton dan meningkat menjadi 80.000 ton pada tahun 2000 (Ogawa, 2002). Kitin ditemukan sebagai dua allomorphs, yaitu α - kitin dan β - kitin. α - kitin mempunyai jumlah yang paling berlimpah dan banyak terdapat dalam udang dan kepiting kerang. β - kitin ditemukan dalam tinta cumi-cumi dan secara komersial lebih mahal. Sampai saat ini, tidak mungkin untuk mendapatkan β - kitin baik dari hasil isolasi atau biosintesis sevara in vitro.
Berdasarkan hasil yang diperoleh pada penelitian penelitian sebelumnya menunjukkan bahwa kitin yang telah dimodifikasi dengan penambahan beberapa pereaksi menunjukkan aktivitas yang lebih tinggi dibandingkan kitin serbuk. Bentuk kitin yang rapat dan kompak karena bentuk - yang mempunyai rantai antipararel dan menstabilkan bentuk polimorfiknya secara alami sehingga menyebabkan kitin tidak larut dalam pelarutnya (Majtán, 2007). Substrat kitin jenis amorf menunjukkan aktivitas paling tinggi setelah kitin jenis koloidal. Modifikasi kitin dengan menggunakan detergen SDS menyebabkan penggembungan pada struktur kitin sehingga menyebabkan perubahan
2 pada sifat fisik kitin serbuk. Hal ini dikarenakan perbedaan kristalinitas kitin amorf dengan kitin serbuk, dimana kitin jenis amorf lebih terbuka dan lebih amorf dibanding kitin serbuk (Herdyastuti, 2013).
Kitin merupakan bentuk linier polisakarida yang dibentuk dari ikatan -1,4 residu N-asetil-glukosamin. Dengan demikian kitin secara kimiawi adalah suatu polimer golongan polisakarida yang tersusun atas 2-asetamido-2-deoksi-D-glukosa membentuk ikatan -1,4. Monomer senyawa ini merupakan disakarida dari N-asetil-D-glukosamin yang disebut kitobiosa. Ikatan pada molekul tersebut membentuk fibra yang linier (Majtán, 2007). N-Asetil glukosamin atau 2-asetamido-2-deoksi-D-glukosa (GlcNAc) adalah gula amino sederhana yaitu suatu monosakarida yang mempunyai gugus amino pada bagian strukturnya. GlcNAc merupakan turunan monosakarida glukosa dan didistribusikan secara luas di seluruh dunia. GlcNAc berpolimerisasi linear dengan ( 1,4) -β yang merupakan unit monomer dari polimer kitin. Monosakarida amino tersebut mempunyai rumus molekul C8H15NO6, dan berat molekulnya adalah 221,2. Secara umum
GlcNAc merupakan serbuk berwarna putih dan sedikit manis, mempunyai titik leleh pada 221° C mempunyai kelarutan 25 % dalam air , serta 1 % larutan air tidak berwarna dan jelas (Chen and Liu, 2010).
N-Asetil glukosamin merupakan suatu nutrien, metabolit senyawa antara dan diperlukan pada fungsi sel. Senyawa monomernya yaitu N-asetil glukosamin dan D-glukosamin merupakan kandidat food supplement, serta pengobatan pada penderita
osteoarthritis (Illankovan et al., 2005). Penelitian medis yang melibatkan
N-asetilglukosamin menunjukkan potensi pada berbagai pengobatan penyakit autoimun dengan menggunakan turunan glukosa. Turunan glukosa berpartisipasi dalam berbagai fungsi tubuh, dan banyak yang percaya glukosamin bahwa dengan atau tanpa kondroitin, dapat meredakan rasa tidak nyaman dan peradangan pada orang yang menderita arthritis.
3 Kehadiran N-asetilglukosamin di kelenjar timus tampaknya juga dapat mencegah pembentukan dan pertumbuhan sel-sel abnormal timus (T-sel), yang berkontribusi terhadap gangguan autoimun (Chang and Fu, 2000). Pusat penelitian Irvine, Universitas California menyebutkan bahwa adanya supplement N-asetil glukosamin (GlcNAc) dalam makanan, lebih efektif daripada glukosamin yang dapat mengurangi kelainan dalam glikosilasi protein dalam sel dan menghambat inflammatory demyelination pada mencit. Hal ini membuka kemungkinan untuk melakukan terapi metabolic dengan N-asetil glukosamin untuk mencegah penyakit pada system pusat syaraf, Multiple sclerosis (MS) yang dalam waktu dekat dapat menyebabkan inflamasi dan dalam jangka panjang menyebabkan neurodegeneration (Demetriou, 2005). Baru-baru ini juga telah dilakukan penelitian bahwa GlcNAc dan derivatnya telah digunakan dalam suplemen makanan dan untuk pengembangan terapi karena karakteristik yang unik. Hasil uji toksisitas mengungkapkan bahwa GlcNAc tidak beracun, aman bagi tubuh dan lebih lanjut menunjukkan bahwa 54% dari glukosamin yang diberikan akan diekskresikan ke dalam urin dalam satu hari.
Berdasarkan hal tersebut menunjukkan bahwa GlcNAc sangat potensial untuk digunakan dalam industri karena mempunyai banyak aplikasi yang signifikan dan mempunyai efisiensi tinggi. Setiap tahun, sekitar 100 miliar ton kitin diproduksi di alam membuat kitin sumber daya biomassa yang cocok untuk produksi GlcNAc melalui proses yang didasarkan pada hidrolisis kitin (Chen et al, 2010). GlcNAc dapat diperoleh dengan cara hidrolisis secara kimia atau degradasi secara enzimatis dari senyawa kitin menggunakan enzim kitinase. Degradasi kitin secara enzimatis telah banyak dilakukan karena merupakan metode yang sederhana, cepat dan reproducible untuk menghasilkan senyawa turunan kitin atau kitin oligosakarida (Krokeide, 2007). Untuk mendapatkan GlcNAc maka perlu dilakukan isolasi dari kitin secara enzimatis, pemurnian dan
4 karakterisasi. Penelitian yang direncanakan dilakukan selama dua tahun ini dibagi dalam tahapan isolasi, optimasi, dan pemurnian N-Asetil glukosamin pada tahun pertama serta perhitungan rendemen terbanyak dari masing-masing pemurnian dan karakterisasi N-Asetil glukosamin pada tahun kedua. Isolasi N-N-Asetil glukosamin dihasilkan dari proses degradasi enzimatis dengan enzim kitinase dari Pseudomonas sp TNH54. Optimasi N-Asetil glukosamin dilakukan terhadap variasi konsentrasi enzim, substrat dan waktu inkubasi sehingga dapat diketahui pola kinetikanya. Pemurnian N-Asetil glukosamin yang telah dioptimasi dilakukan terhadap variasi beberapa pelarut berdasarkan sifat kepolarannya, sehingga dapat diperoleh N-Asetil glukosamin yang murni dan akan dibandingkan dengan N-Asetil glukosamin standar yang dijual secara komersial.
1.2 Rumusan Masalah
Berdasarkan pernyataan diatas maka dapat dirumuskan permasalahan, yaitu :
a. Berapakah konsentrasi substrat, konsentrasi enzim, dan waktu inkubasi optimum yang diperlukan terhadap pembentukan N-asetil glukosamin serta bagaimana pola kinetika pembentukan N-asetil glukosamin ?
b. Bagaimanakah hasil pemurnian N-Asetil glukosamin dengan menggunakan jenis pelarut yang divariasi yaitu aseton, etanol, metanol dan asetonitril ?
c. Berapakah rendemen N-Asetil glukosamin yang dihasilkan dari pemurnian pada kondisi optimum?
5 BAB II
TINJAUAN PUSTAKA
2.1 Kitin
Kitin merupakan salah satu polimer alami yang cukup melimpah dan merupakan biopolimer terbanyak kedua di alam setelah selulosa. Kitin terdistribusi luas di lingkungan biosfer seperti pada kulit crustaceae (kepiting, udang dan lobster), ubur-ubur dan juga ditemukan dalam nematode.. Polimer ini ditemukan sebagai komponen komponen struktural
exosceleton insekta, penyusun dinding sel jamur, yeast dan alga sekitar 3 – 60 % (tergantung
pada tipe jamur), binatang ataupun tumbuhan. Kitin juga dapat ditemukan dalam lapisan usus, trakea, sayap penutup dan bagian-bagian lain dari tubuh hewan tingkat rendah. Kandungan kitin tertinggi mencapai 85 % ditemukan pada Arthropoda (Folders et al., 2001). Dalam Firdaus (2009), Focher menyatakan bahwa, kulit udang mengandung protein (25 – 40 %), kalsium karbonat (45 – 50 %), dan kitin (15 – 20 %), tetapi besarnya kandungan komponen tersebut tergantung pada jenis udangnya. Adapun kulit kepiting mengandung protein (15,60 – 23,90 %), kalsium karbonat (53,70 – 78,40 %), dan kitin (18,70 – 32,20 %), hal ini juga tergantung pada jenis kepiting dan tempat hidupnya. Kandungan kitin dalam kulit udang lebih sedikit dibandingkan kandungan kulit kepiting, tetapi kulit udang lebih mudah diperoleh dan tersedia dalam jumlah yang cukup banyak sebagai limbah.
Pada binatang, kitin merupakan struktur yang rigid pada eksoskeleton. Hal ini dikarenakan pada rantai polimer N-asetil-glukosamin terdapat ikatan hidrogen antar molekul membentuk mikrofibril menghasilkan struktur yang stabil dan rigid, tidak larut dalam air sehingga dapat mengkristal (Frandberg, 1997). Seperti halnya pada jamur, kitin yang ditemukan dalam tanaman juga mendukung dinding selnya. Kitin dapat terbentuk dari proses
6 re-kristalisasi larutan, biosintesis in-vitro atau reaksi polimerisasi secara enzimatis (Rinaudo, 2006)
2.2 Struktur kitin
Kitin merupakan bentuk linier polisakarida yang dibentuk dari ikatan -1,4 residu N-asetil-glukosamin (Nathalie, 2006). Dengan demikian kitin secara kimiawi adalah suatu polimer golongan polisakarida yang tersusun atas 2-asetamido-2-deoksi-D-glukosa membentuk ikatan -1,4. Monomer senyawa ini merupakan disakarida dari N-setil-D-glukosamin yang disebut kitobiosa dengan struktur seperti pada Gambar 2.1. Ikatan pada molekul tersebut membentuk fibra yang linier. Rantainya dapat membentuk kristal karena adanya ikatan hidrogen intramolekul dan membentuk mikrofibril yang panjang menghasilkan struktur yang rigid dan stabil (Gooday, 1990). Dalam Yurnaliza (2002), Richard menyatakan kitin berbentuk padat, amorf, tidak berwarna, tidak larut dalam air, asam encer, alkohol dan semua pelarut organik tetapi kitin dapat larut dalam fluoroalkohol dan asam mineral pekat.
Gambar 2.1. Senyawa kitin yang terdiri dari N-Asetil-glukosamin dihubungkan oleh ikatan β, 1-4 glikosida
7 Kitin, kitosan dan selulosa mengalami biodegradasi dengan mekanisme hampir serupa yaitu dengan melibatkan kompleks enzim seperti tampak pada Gambar 2.2. Kitin dapat didegradasi melalui dua jalur utama, pertama degradasi oleh induksi kitinase pada ikatan -1,4-glikosidik prosesnya ditentukan oleh mekanisme kitinolitik. Kedua polimer mengalami deasetilasi pertama dan selanjutnya dihidrolisis oleh kitosanase (Gooday,1990).
Kitin mempunyai dua bentuk allomorph, tergantung dari sumbernya, yaitu bentuk α dan β yang dapat dibedakan berdasarkan spektroskopi inframerah dan NMR serta difraksi sinar – X. Bentuk allomorph ketiga adalah kitin – γ, tetapi berdasarkan analisis strukturnya merupakan bagian dari kedua allomorph di atas. Kitin – α lebih banyak ditemukan di alam karena bentuk polimorfik yang paling stabil dengan struktur yang rapat padat, mempunyai rantai anti paralel dan mempunyai ikatan hidrogen yang kuat. Kitin-α banyak ditemukan pada golongan crustaceae seperti kepiting, lobster dan sebagainya. Bentuk kitin – β jarang ditemukan, terdapat pada golongan moluska, mempunyai struktur paralel tertutup dengan interaksi intramolekul yang lebih lemah tetapi sedikit lebih stabil dibandingkan kitin – α, dan mempunyai kelarutan tertinggi dibandingkan dua bentuk lainnya. Bentuk ketiga adalah kitin – γ merupakan gabungan dari struktur kitin α dan β. Struktur kitin – α yang menyebabkan kitin tidak larut dalam pelarut, sedangkan kitin-β dapat membentuk swollen di dalam air sehingga dapat larut seperti dalam asam format (Coutiño et al., 2006 ; Majt´an et al., 2007).
2.3 Senyawa Turunan Kitin
Turunan kitin terpenting adalah kitosan (Gambar 2) yang diperoleh dari deasetilasi parsial kitin pada kondisi basa (NaOH) atau hidrolisis enzimatis dengan adanya kitin deasetilase. Transformasi kitin menjadi kitosan dilakukan dengan tahap deasetilasi dengan basa berkonsentrasi tinggi. Gugus asetil yang masih berikatan dengan kitin menyebabkan kitin bersifat inert terhadap berbagai pelarut sehingga sulit dilarutkan. Hal ini berbeda dengan
8 kitosan yang merupakan senyawa turunan dari kitin yang telah melepaskan gugus asetilnya (Firdaus, 2009). Kitosan mempunyai bentuk polimer yang sama dengan kitin. Kedua polimer tersebut dibedakan berdasarkan kandungan nitrogennya, polimer tersebut disebut kitin bila kandungan nitrogennya kurang dari 7% dan bila kandungan nitrogennya lebih dari 7% disebut kitosan. Kedua senyawa tersebut dapat ditemukan di alam dan istilah kitosan sekarang lebih sering digunakan untuk menunjuk kitin yang dihilangkan gugus asetilnya secara artifisial (Suhardi,1992).
Gambar 2.2. Jalur degradasi enzimatis dari kitin dan kitosan membentuk monomer-monomernya
Morfologi semi-kristal kitin, kitosan diperoleh dengan reaksi bentuk padatan yang mempunyai distribusi gugus asetil heterogen sepanjang rantainya. Ditambahkan bahwa kitin – β reaktifitas deasetilasinya lebih tinggi daripada kitin – α. Pada proses re-asetilasi sampai 51%, pada kitin dengan deasetilasi tinggi dengan penambahan asetat anhidrida dapat menghasilkan senyawa turunan yang larut di air, sedangkan produk heterogen yang diperoleh dari deasetilasi parsial kitin hanya dapat larut atau sedikit larut pada kondisi asam.
Kitosan Kitin Oligomer Kitin deastilase Kitosan Oligomer N-Asetil Glukosamin Glukosamin Kitinase Kitosanase Deasetilase Β-D-glukosaminidase Kitin
9 Hasil pengukuran NMR menunjukkan bahwa distribusi gugus asetil adalah random untuk mencapai kelarutan tertinggi di air sekitar 50 % asetilasi. Toffey et al. (1999) juga telah melakukan proses re-asetilasi yang merubah kitosan dari larutan asam asetat menjadi kitin dengan pemansan. Selain kitosan, senyawa lain turunan kitin adalah carboxymethylchitin
(CM-chitin), merupakan polimer anion yang larut di air. CM-chitin dikerjakan sama seperti
selulosa ; kitin diperlakukan dengan asam monokloroasetat dengan adanya NaOH pekat. Tipe yang sama pada modifikasi kimia (esterifikasi dan eterifikasi) untuk selulosa yang dilakukan untuk mendapatkan C-6 dan C-3 pada gugus –OH dari kitin (Rinaudo, et al., 2000). Kitin dapat digunakan untuk campuran polimer alam atau sintetik ; dapat digunakan sebagai senyawa selulosa crosslinked (seperti epikloridin, glutaraldehid, dll.). Kitin secara parsial dapat didegradasi dengan asam untuk mendapatkan senyawa oligokitin. Senyawa-senyawa oligomer, seperti halnya turunan dari kitosan dikenal karena bioaktivitasnya sebagai anti-tumor, bakterisida dan anti jamur, menumbuhkan kitinase dan mengendalikan pertumbuhan tanaman. Senyawa-senyawa tersebut digunakan untuk menguji aktivitas lisozim, dapat digunakan sebagai active starting blocks pada protein dan lemak untuk memperoleh senyawa analog glikoprotein dan glikolipid. Metode turunan selulosa juga digunakan untuk menyiapkan hidroksipropilkitin (untuk tetes air mata), fluorinasi kitin,
Nand O-sulfated chitin, (dietilamino) etilkitin, fosforil kitin, merkapto-kitin dan kitin karbamat.
2.4 Manfaat kitin
Kitin dan kitosan mempunyai sifat yang khas dan dapat dimanfaatkan dalam berbagai bidang dan industri. Kitin dan senyawa-senyawa turunannya mendapat perhatian besar para ahli karena sifat-sifat fungsionalnya yang khas. Sifat potensial yang dimiliki kitin memungkinkan pemanfaatannya dalam berbagai bidang seperti biokimia, obat-obatan,
10 farmakologi, enzimologi, mikrobiologi, pertanian, pangan dan gizi serta industri-industri yang menjadikan biopolimer ini sangat berharga.
Kitin mempunyai toksisitas rendah dan bersifat inert dalam gastrointestinal mamalia ;
biodegradable, dengan adanya kitinase yang terdistribusi luas di alam dan ditemukan dalam
bakteri, jamur dan tanaman, serta sistem pencernaan beberapa binatang. Kitinase dilibatkan dalam sistem pertahanan bakteri. Lisozim dari putih telur, pohon kurma dan pohon papaya, dapat memecah kitin dan dinding sel bakteri. Sashiva et al., (1990) menunjukkan bahwa derajat deasetilasi sangat penting pada proses hidrolisis kitin. Kitin juga digunakan untuk menyiapkan kolom kromatografi afinitas untuk mengisolasi senyawa lektin dan menentukan strukturnya (Datta, et al., 1984). Kitin dan 6-O-karboksimetil-kitin mengaktivasi peritoneal
in vivo makrofaga, menekan pertumbuhan sel tumor dalam mencit, dan menstimulasi
non-spesifik host resisten yang menginfeksi Escherichia Coli. Kitin juga mempercepat penyembuhan luka (Hudson and Jenkin, 2003). Kitin secara luas digunakan untuk imobilisasi enzim dan sel ; imobilisasi enzim diaplikasikan pada industri makanan seperti minuman sari buah, dan proses pembuatan susu saat ditambahkan enzim amylase – α dan β yang digabung dengan kitin (Krajewska, et al., 2004). Kitin banyak diaplikasikan sebagai biosensor dalam makanan karena kitin bersifat biodegradable, tidak toksik, secara fisiologis tidak mudah bereaksi, bersifat anti-bakteri, hydrophilicity, mudah membentuk gel dan mempunyai afinitas terhadap protein. Material kitin juga dapat digunakan untuk treatment pada pollutant industri yang dapat menyerap kompleks perak tiosulfat dan aktinida (Songkroah, et al., 2004). Kitin dapat dibuat bentuk film dan serat dengan penambahan larutan NaOH 14 %, bersifat
non-allergic, menghilangkan bau, anti-bakteri dan dapat menjaga kelembaban (Yoshino, et al.,1992). Regerasi turunan serat kitin digunakan sebagai pengikat dalam proses pembuatan
kertas dengan penambahan 10% n-isobutil-kitin sehingga dapat memecah kekuatan kertas (Kobayashi, et al., 1982). Selain itu kitin dalam bentuk film dan serat juga digunakan dalam
11 bidang kesehatan dan farmasi untuk pembalut luka dan pembuatan obat (Yusof, et al., 2003). Aplikasi lainnya dalam hidroksiapatit – kitin – kitosan material komposit pengisi – tulang, yaitu bentuk yang dapat mengeraskan sediri pasta untuk regenarasi jaringan dalam treatment cacat tulang (Ito, et al., 1998). CM-kitin secara selektif dimodifikasi sebagai obat anti tumor (Ouchi, et al., 1992). Sebagai contoh, 5-fluorourasil ditengarai mempunyai aktivitas anti tumor dan senyawa analog D-glukosa yaitu muramil-L-alanil-isoglutamin, yang bertanggung jawab untuk aktivitas immuno- adjuvant dapat digabung dengan CM-chitin menggunakan pembatas spesifik dan membentuk ikatan ester. Oligomer kitin telah dinyatakan sebagai obat anti-kanker dan oligomer dengan DP ¼ 5 aktif dalam mengontrol proses fotosintesis pada jagung dan kedelai (Khan, et al., 1992)
2.5 Penelitian Terkait Kitinase
Penelitian ini merupakan kelanjutan dari penelitian sebelumnya terkait dengan enzim kitinase. Penelitian diawali dengan eksplorasi bakteri kitinolitik dari tanah sawah untuk memperoleh bakteri penghasil kitinase dengan aktivitas tertinggi yang sebagaian telah didanai oleh DP2M melalui Hibah bersaing tahun 2008 – 2009. Enzim kitinase telah dikarakterisasi berdasarkan suhu, pH, pengaruh ion logam, konsentrasi substrat dan zimogram (Herdyastuti, 2011). Bakteri kitinolitik dengan aktivitas tertinggi telah ditentukan spesiesnya berdasarkan gen 16S-rRNA sebagai Pseudomonas sp TNH 54 dengan kemiripan 98% terhadap Pseudomonas sp (Herdyastuti, 2012). Penelitian kemudian dilanjutkan dengan mempelajari pengaruh bentuk substrat kitin yang telah divariasi yaitu kitin serbuk, jenis koloidal, bead, SF dan amorf yang telah didanai oleh Ditlitabmas DIKTI melalui Hibah Fundamental tahun 2012 dan 2013. Hasil penelitian menunjukkan bahwa kitin jenis amorf dan koloidal menunjukkan sebagai substrat yang tepat pada kitinase.
Proses hidrolisis kitin dengan kitinase dapat menghasilkan senyawa turunan kitin (oligosakarida) bahkan sampai dengan monomer pembentuknya yaitu N-Asetil glukosamin.
12 Pada penelitian ini akan dikaji bagaimanakah karakteristik N-Asetil glukosamin yang dihasilkan dari hidrolisis kitinase terhadap kitin yang telah dimurnikan melalui tahap pemurnian dengan menggunakan beberapa pelarut yang selanjutnya akan dibandingkan dengan N-Asetil glukosamin komersial. Pada penelitian ini juga akan dikaji jumlah N-Asetil glukosamin yang dapat diperoleh melalui tahap optimasi.
2.6 Ekstraksi menggunakan pelarut
Sebagian besar reaksi kimia secara luas dilakukan di dalam larutan. Larutan terdiri dari pelarut (solvent) dan zat terlarut (solute). Pelarut (solvent) pada umumnya adalah zat yang berada pada larutan dalam jumlah yang besar, sedangkan zat lainnya dianggap sebagai zat terlarut (solute). Pelarut memenuhi beberapa fungsi dalam reaksi kimia, dimana pelarut melarutkan reaktan dan reagen agar keduanya bercampur, sehingga hal ini akan memudahkan penggabungan antara reaktan dan reagen yang seharusnya terjadi agar dapat merubah reaktan menjadi produk. Pelarut juga bertindak sebagai kontrol suhu, salah satunya untuk meningkatkan energi dari tubrukan partikel sehingga partikel-partikel tersebut dapat bereaksi lebih cepat, atau untuk menyerap panas yang dihasilkan selama reaksi eksotermik.
Pada umumnya pelarut yang baik mempunyai kriteria sebagai berikut : (1) pelarut harus tidak reaktif (inert) terhadap kondisi reaksi, (2) pelarut harus dapat melarutkan reaktan dan reagen, (3) p//elarut harus memiliki titik didih yang tepat dan (4) Pelarut harus mudah dihilangkan pada saat akhir dari reaksi. Kriteria kedua adalah dengan menggunakan prinsip
like dissolves like, dimana reaktan yang nonpolar akan larut dalam pelarut nonpolar
sedangkan reaktan yang polar akan larut pada pelarut polar. Selain itu terdapat tiga ukuran yang dapat menunjukkan kepolaran dari suatu pelarut yaitu : (a) momen dipole, (b) konstanta dielektrik, (c) kelarutannya dengan air. Molekul dari pelarut dengan momen dipol yang besar dan konsanta dielektrik yang tinggi termasuk polar. Sedangkan molekul dari pelarut yang
13 memilki momen dipol yang kecil dan konstanta dielektrik rendah diklasifikasikan sebagai nonpolar. Sedangkan secara operasional, pelarut yang larut dengan air termasuk polar, sedangkan pelarut yang tidak larut dalam air termasuk nonpolar.
Berdasarkan kepolaran pelarut, maka para ahli kimia mengklasifikasikan pelarut ke dalam tiga kategori yaitu : (a) Pelarut Protik Polar, Protik menunjukkan atom hidrogen yang menyerang atom elektronegatif yang dalam hal ini adalah oksigen. Dengan kata lain pelarut protik polar adalah senyawa yang memiliki rumus umum ROH. Contoh dari pelarut protik polar ini adalah air H2O, metanol CH3OH, dan asam asetat (CH3COOH). (b) Pelarut
Aprotik Dipolar, Aprotik menunjukkan molekul yang tidak mengandung ikatan O-H. Pelarut dalam kategori ini, semuanya memiliki ikatan yang memilki ikata dipol besar. Biasanya ikatannya merupakan ikatan ganda antara karbon dengan oksigen atau nitorgen. Contoh dari pelarut yang termasuk kategori ini adalah aseton [(CH3)2C=O] dan etil asetat
(CH3CO2CH2CH3). (c) Pelarut Nonpolar, merupakan senyawa yang memilki konstanta
dielektrik yang rendah dan tidak larut dalam air. Contoh pelarut dari kategori ini adalah benzena (C6H6), karbon tetraklorida (CCl4) dan dietil eter (CH3CH2OCH2CH3). Beberapa
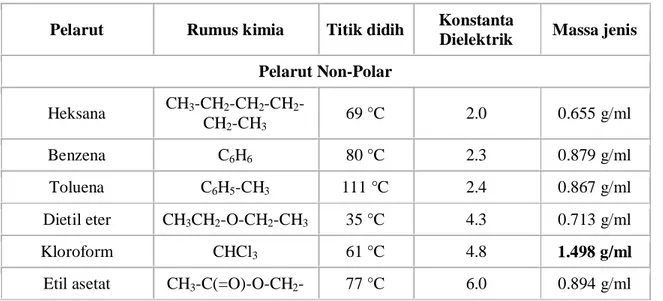
pelarut berdasarkan sifat kepolarannya seperti pada Tabel 2.1
Tabel 2.1 Sifat-sifat pelarut umum
Pelarut Rumus kimia Titik didih Konstanta
Dielektrik Massa jenis Pelarut Non-Polar Heksana CH3-CH2-CH2-CH2 -CH2-CH3 69 °C 2.0 0.655 g/ml Benzena C6H6 80 °C 2.3 0.879 g/ml Toluena C6H5-CH3 111 °C 2.4 0.867 g/ml
Dietil eter CH3CH2-O-CH2-CH3 35 °C 4.3 0.713 g/ml
Kloroform CHCl3 61 °C 4.8 1.498 g/ml
14 CH3
Pelarut Polar Aprotic 1,4-Dioksana -CH2-CH2-O-CH2 -CH2-O- 101 °C 2.3 1.033 g/ml Tetrahidrofuran (THF) -CH2-CH2-O-CH2 -CH2- 66 °C 7.5 0.886 g/ml Diklorometana (DCM) CH2Cl2 40 °C 9.1 1.326 g/ml Asetona CH3-C(=O)-CH3 56 °C 21 0.786 g/ml Asetonitril (MeCN) CH3-C≡N 82 °C 37 0.786 g/ml Dimetilformamida (DMF) H-C(=O)N(CH3)2 153 °C 38 0.944 g/ml Dimetil sulfoksida (DMSO) CH3-S(=O)-CH3 189 °C 47 1.092 g/ml
Pelarut Polar Protic
Asam asetat CH3-C(=O)OH 118 °C 6.2 1.049 g/ml
n-Butanol CH3-CH2-CH2-CH2
-OH 118 °C 18 0.810 g/ml
Isopropanol (IPA) CH3-CH(-OH)-CH3 82 °C 18 0.785 g/ml
n-Propanol CH3-CH2-CH2-OH 97 °C 20 0.803 g/ml
Etanol CH3-CH2-OH 79 °C 30 0.789 g/ml
Metanol CH3-OH 65 °C 33 0.791 g/ml
Asam format H-C(=O)OH 100 °C 58 1.21 g/ml
15 BAB III
TUJUAN DAN MANFAAT PENELITIAN
3.1 Tujuan
Penelitian pada Tahun – 1 ini bertujuan untuk :
a. Melakukan optimasi konsentrasi substrat, konsentrasi enzim, dan waktu inkubasi untuk menghasilkan senyawa turunan kitin (N-Asetil glukosamin) sebagai hasil degradasi enzimatis dari kitin jenis amorf
b. Melakukan pemurnian N-Asetil glukosamin sebagai hasil degradasi enzimatis dari kitin jenis amorf berdasarkan sifat kepolaran dengan menggunakan variasi pelarut
c. Menentukan persentase hasil N-Asetil glukosamin hasil pemurnian pada kondisi optimum d. Publikasi hasil-hasil penelitian dalam suatu konferensi dan jurnal baik pada skala
Nasional maupun Internasional
3.2 Manfaat Penelitian
Beberapa manfaat yang diharapkan dari penelitian ini adalah :
a. Memberikan informasi tentang mekanisme hidrolisis kitin secara enzimatis dengan menggunakan kitinase menghasilkan seyawa turunan kitin (N-Asetil glukosamin)
b. Mempelajari karakteristik sifat fisik dan kimia senyawa N-Asetil glukosamin hasil hidrolisis kitin secara enzimatis yang telah dimurnikan debandingkan dengan (N-Asetil glukosamin)komersial
c. Menganalisis jumlah N-Asetil glukosamin yang dihasilkan berdasarkan kondisi optimasi konsentrasi substrat dan enzim serta waktu inkubasi pada sejumlah kitin tertentu
d. Memperoleh senyawa turunan kitin (GlcNAc) dari hasil degradasi kitin untuk dikembangkan di industri khusunya industri Farmasi sebagai obat anti inflamasi
16 BAB IV
METODE PENELITIAN
4.1 Rancangan Penelitian
Penelitian ini adalah penelitian eksperimen 4.2 Sasaran Penelitian
Sasaran dalam penelitian ini adalah kitin, adapun sampel penelitian ini adalah sebagian dari populasi yang diambil secara acak
4.3 Waktu Penelitian
Penelitian ini direncanakan selama 8 bulan, yang dilaksanakan dimulai bulan Maret sampai bulan Oktober 2015.
4.4 Tempat Penelitian
Kegiatan penelitian ini dilakukan di laboratorium Biokimia dan Instrumen Jurusan Kimia serta laboratorium IPA Terpadu FMIPA UNESA.
4.5 Kerangka Operasional Penelitian
Penelitian ini merupakan penelitian Tahun – 1 dari dua tahun yang direncanakan, dan secara garis besar kerangka operasional dapat dilihat pada Gambar 4.1. Tahap pertama yang dilakukan adalah membuat kitin jenis amorf sebagai substrat dan induser untuk produksi enzim kitinase. Tahap kedua adalah optimasi konsentrasi substrat, konsentrasi enzim dan waktu inkubasi terhadap pembentukan N-Asetil glukosamin. Tahap ketiga melakukan pemurnian dengan menggunakan variasi pelarut berdasarkan sifat kepolarannya yang akan dianalisis dengan HPLC. Tahap keempat adalah menentukan rendemen atau persentase hasil N-Asetil glukosamin yang telah dimurnikan pada kondisi optimum.
17 Gambar 4.1. Kerangka operasional Penelitian
Pseudomonas sp
TNH54
Ekstrak Enzim Kitinase
KITIN Kitin jenis amorf
N-Asetil glukosamin
Konsentrasi enzim, waktu inkubasi, dan konsentrasi
substrat
Analisis gugus fungsi dengan IR PEMURNIAN
OPTIMASI
Sifat fisik : warna, kelarutan, titik leleh
Penentuan BM dengan GC – MS N-Asetil glukosamin murni TAHUN KE-I TAHUN KE-II Variasi konsentrasi substrat Rendemen N-Asetil glukosamin Ekstraksi dg pelarut polar
Analisis dengan KLT, HPLC Variasi konsentrasi enzim Variasi waktu inkubasi
18 4.6 Variabel Penelitian
Variabel pada penelitian ini adalah : A. Pengaruh konsentrasi substrat
Variabel bebas : konsentrasi substrat
Variabel kontrol : konsentrasi enzim, waktu inkubasi, pH, suhu Variabel terikat : konsentrasi N-Asetil glukosamin
B. Pengaruh konsentrasi enzim Variabel bebas : konsentrasi enzim
Variabel kontrol : konsentrasi substrat, waktu inkubasi, pH, suhu Variabel terikat : konsentrasi N-Asetil glukosamin
C. Pengaruh waktu inkubasi
Variabel bebas : waktu inkubasi
Variabel kontrol : konsentrasi enzim, konsentrasi substrat, pH, suhu Variabel terikat : konsentrasi N-Asetil glukosamin
4.7 Bahan dan Alat Bahan
Bahan-bahan yang dipergunakan pada penelitian ini adalah sebagai berikut : 1. Kitin dari cangkang udang (Rongsheng, Cina)
2. Pseudomonas sp TNH54 hasil isolasi dari tanah pertanian yang telah dikarakterisasi 3. Bahan-bahan kimia yang diperoleh di pasaran komersial dengan kemurnian p.a antara lain
: HCl, NaOH, NaCl, 3,5-dinitro salisiclyc acid (SIGMA), Na3C6H5O7.2H2O, N-Asetil
glukosamin (SIGMA), pepton, yeast extract, agar (Oxoid), Etanol 95%, Metanol, Aseton, Asetonitril (untuk HPLC).
Alat
Peralatan yang dipergunakan pada penelitian ini disamping peralatan gelas standar, digunakan pula peralatan khusus seperti : shaker, sentrifugasi dingin, autoclave, Spektrofotometer UV-vis (Shimadzu 1800), HPLC (Hewlet Packard, Series 1050)
19 4.8 Prosedur Penelitian
Prosedur Penelitian
Pembuatan kitin jenis amorf
10 g kitin (dari cangkang udang) dilarutkan dalam campuran larutan NaOH 40% dan 0,2% SDS (yang sudah didinginkan pada suhu 4C). Larutan di-swell selama 1 jam pada suhu 4C. Matriks slurry kitin disimpan selama 1 malam pada suhu -20C, kemudian dinetralkan dengan HCl 6 N. Selanjutnya difiltrasi, dan dicuci dengan urutan pelarut etanol, air, etanol, dan aseton. Hasilnya Dikeringkan dengan oven, diperoleh kitin bentuk amorf.
Produksi enzim kitinase
Enzim diproduksi dari koloni tunggal dari bakteri Pseudomonas sp TNH54 ditumbuhkan pada 100 mL media screening cair yang mengandung 0,4% kitin jenis amorf pada suhu kamar dengan pengocokan 120 rpm selama 20 jam. Kultur cair kemudian disentrifugasi pada 8000xg selama 15 menit suhu 4C. Supernatan yang diperoleh merupakan ekstrak kasar kitinase.
Aktivitas Enzim
Aktivitas enzim kitinase ditentukan berdasarkan pelepasan N-Asetilglukosamin dengan menggunakan metode yang dijelaskan oleh Monreal dan Reese (1969). Satu unit aktivitas didefinisikan sebagai jumlah mikromol N-Asetil glukosamin yang dilepaskan dalam 1 jam. Aktivitas enzim ditentukan dengan menggunakan persamaan :
Unit/mL enzim = (jumlah NAG yg dilepaskan)(2,5) (2)(1)(0,5)
Keterangan :
2,5 = volume reaksi mula-mula dari uji
2 = faktor konversi untuk mengkonversi 2 jam ke 1 jam sebagai definisi per unit 1 = volume (dalam mL) supernatan (dalam penentuan kolorimetri)
0,5 = volume (dalam mL) enzim yang digunakan NAG = N-Asetil glukosamin
20 Pengaruh Pelarut pada Pemurnian N-Asetil glukosamin
N-asetil glukosamin yang diperoleh dari hidrolisis kitin ditambahakan pelarut (aseton atau metanol atau etanol atau asetonitril). Campuran tersebut dipisahkan dan endapan yang diperoleh kemudian di keringkan dalam oven suhu 50C dan diuji dengan HPLC. Untuk menentukan berat keringnya dihitung dengan menggunakan persamaan :
Berat kering (%) =
Uji N-Asetil glukosamin
Sebanyak 2 mL larutan kitin 1,25 % (b/v) dilarutkan dalam 200 mM buffer kalium fosfat diaduk dengan pengaduk magnet dan ditambahkan 0,5 mL larutan enzim. Inkubasi selama 2 jam pada suhu kamar. Setelah 2 jam tempatkan tabung ke dalam air mendidih selama 5 menit dan didinginkan pada suhu kamar. Suspensi disentrifugasi selama 10 menit pada kecepatan 4000 rpm dan supernatan yang diperoleh ditentukan dengan HPLC (HP 1050) pada kolom Waters; menggunakan detector UV 210 nm ; kecepatan 1 mL/mnt ; injeksi 0,1 mL
4.9 Analisis Data
N-Asetil glukosamin (GlcNAc) yang diperoleh dari degradasi enzimatis kitin dengan menggunakan enzim kitinase diuji dengan HPLC dan dianalisis secara deskriptif berdasarkan Rf dan dibandingkan dengan Rf GlcNAc standar. Optimasi terhadap konsentrasi substrat, konsentrasi enzim dan waktu inkubasi juga dianalisis secara deskriptif berdasarkan jumlah N-Asetil glukosamin tertinggi. Penentuan konsentrasi substrat, konsentrasi enzim dan waktu inkubasi optimum ditentukan berdasarkan perhitungan yang selanjutnya dibuat grafik antara
Berat kering N-Asetil glukosamin Berat kering kitin
21 variabel tersebut dengan kandungan GlcNAc. Kadar GlcNAc tertinggi menunjukkan kondisi optimum dari masing-masing variabel.
Pada tahap pemurnian dengan menggunakan beberapa pelarut dengan tingkat kepolaran yang berbeda seperti etanol, metanol, aseton dan asetonitril. Hasil pemurnian diuji menggunakan HPLC dengan membandingkan puncak yang muncul terhadap GlcNAc standar.
22 BAB V
HASIL DAN PEMBAHASAN
Penelitian ini bertujuan untuk mempelajari karakteristik senyawa N-asetil glukosamin yang diperoleh dari hasil degaradsi enzimatis dengan kitinase. Produksi N-asetil glukosamin dilakukan melalui tahapan optimasi terhadap konsentrasi substrat, konsentrasi enzim dan waktu inkubasi. Hasil yang diperoleh selanjutnya dimurnikan dengan menggunakan beberapa pelarut polar : asetonitril, etanol, metanol dan aseton. Hasil pemurnian tersebut akan menentukan jumlah rendemen N-Asetil glukosamin yang dihasilkan dari hidrolisis kitin jenis amorf.
5.1 Pembuatan kitin jenis amorf
Kitin yang diperoleh dari cangkang udang digunakan sebagai substrat untuk menghasilkan senyawa N-asetil glukosamin. Kitin dibuat dalam bentuk amorf dengan penambahan sodium dodecyl sulphate (SDS). Warna kitin amorf tidak berbeda dari kitin awal tetapi teksturnya lebih halus dan ringan seperti pada Gambar 5.1, dan diperoleh rendemen sekitar 50 % dari total kitin yang digunakan.
23 Kitin jenis amorf dipilih sebagai substrat dikarenakan menunjukkan aktivitas yang lebih baik terhadap kitinase dibandingkan kitin serbuk maupun kitin koloidal. Proses penggembungan pada kitin menyebabkan ukuran pori menjadi lebih besar dan mudah mengembang pada medium air, sehingga menyebabkan interaksi enzim dengan substrat semakin mudah dibandingkan pada bentuk kitin serbuk yang lebih kompak (Herdyastuti et al, 2015).
5.2 Optimasi produksi N-Asetil glukosamin
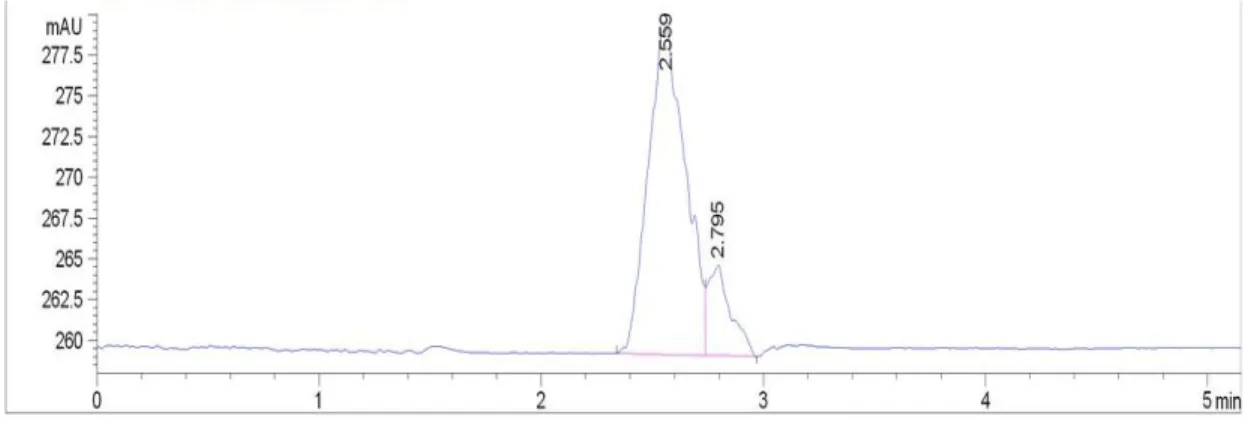
Optimasi dilakukan untuk menentukan kondisi terbaik pada pembentukan senyawa N-asetil glukosamin dari kitin jemis amorf secara enzimatis. Hasil produksi N-asetil glukosamin ditentukan dengan menggunakan HPLC dengan menggunakan N-asetil glukosamin sebagai standar. Penentuan kurva standar N-asetil glukosamin dengan HPLC ditentukan berdasarkan waktu retensi seperti terlihat pada Gambar 5.2. Puncak N-Asetil glukosamin standar pada waktu retensi sekitar 2,6 menit, dan terlihat masih ada puncak yang lain meskipun sangat kecil. Hal ini dimungkinkan bahwa masih ada pengotor pada senyawa tersebut atau terjadi hidrolisis. Puncak tersebut muncul apabila konsentrasi N-Asetil glukosamin kecil, tetapi apabila konsentrasi N-Asetil glukosamin tinggi maka puncak tersebut hilang.
Gambar 5.2 Hasil analisis penentuan kurva standar N-asetil glukosamin pada konsentrasi 0,8 mg/mL dengan HPLC
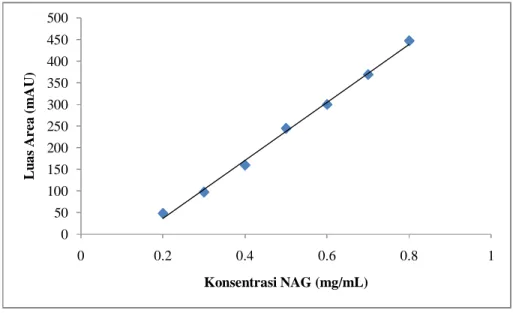
24 Hasil penentuan N-Asetil glukosamin selanjutnya dibuat grafik antara konsentrasi N-asetil glukosamin dan luas area seperti pada Gambar 5.3 (hasil selengkapnya pada Lampiran 1). Berdasarkan kurva standar tersebut diperoleh persamaan garis Y= 670,5X – 97,03 dengan regresi linier 99,6%. Persamaan tersebut selanjutnya akan dipergunakan untuk menentukan konsentrasi N-Asetil glukosamin dari sampel berdasarkan pengukuran luas areanya.
Gambar 5.3 Kurva standar N-Asetil glukosamin
5.2.1 Penentuan konsentrasi substrat optimum
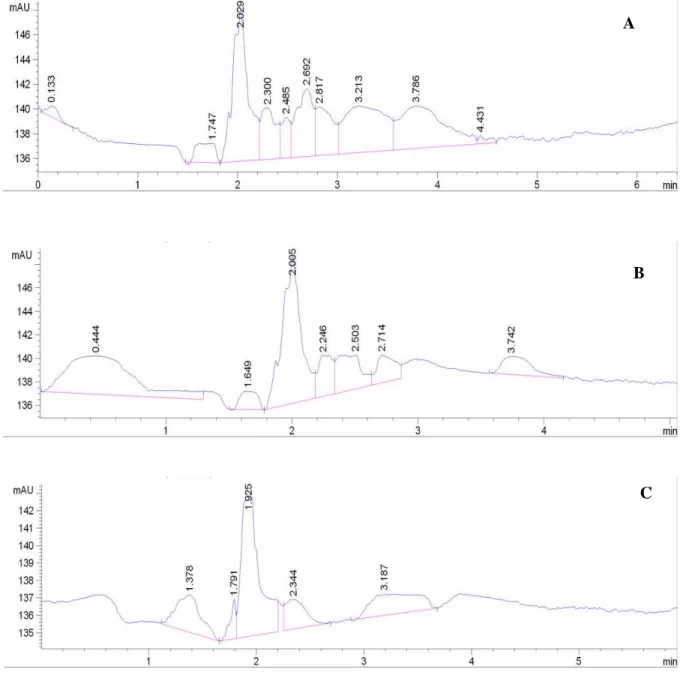
Hasil degradasi kitin jenis amorf secara enzimatis maupun non enzimatis akan menghasilkan senyawa N-Asetil glukosamin. Pembentukan N-asetil glukosamin secara enzimatis dengan menggunakan enzim kitinase dari Pseudomonas sp TNH54 memerlukan optimasi kondisi seperti konsentrasi enzim, konsentrasi substrat dan waktu inkubasi. Penentuan konsentrasi substrat optimum dilakukan dengan melakukan variasi konsentrasi kitin jenis amorf yaitu 0,4 ; 0,8 ; 1,2 ; 1,6 ; 2,0 dan 2,4 % dan masing-masing menunjukkan hasil seperti pada Gambar 5.4 dan 5.5 (hasil selengkapnya di Lampiran 3). Masing-masing konsentrasi menghasilkan puncak yang cukup banyak, hal ini menunjukkan bahwa di dalam sampel tersebut banyak sekali terdapat senyawa lain disamping N-Asetil glukosamin. Apabila
0 50 100 150 200 250 300 350 400 450 500 0 0.2 0.4 0.6 0.8 1 L u a s A r e a ( m A U ) Konsentrasi NAG (mg/mL)
25 diamati pada masing-masing konsentrasi memberikan puncak yang selalu muncul pada di sekitar waktu retensi 2 menit. Apabila dibandingkan dengan waktu retensi dari N-Asetil glukosamin standar maka dapat disimpulkan bahwa puncak yang muncul pada waktu retensi tersebut merupakan N-Asetil glukosamin. Pergeseran waktu retensi tersebut disebabkan karena banyaknya sampel selain N-Asetil glukosamin.
Gambar 5.4 Hasil analisis HPLC pada penentuan konsentrasi optimum untuk konsentrasi kitin 2,4 % (A) ; 2,0 % (B) dan 1,6 % (C)
A
B
26 Gambar 5.5 Hasil analisis HPLC pada penentuan konsentrasi optimum
untuk konsentrasi kitin 1,2 % (D) ; 0,8 % (E) dan 0,4 % (F)
D
E
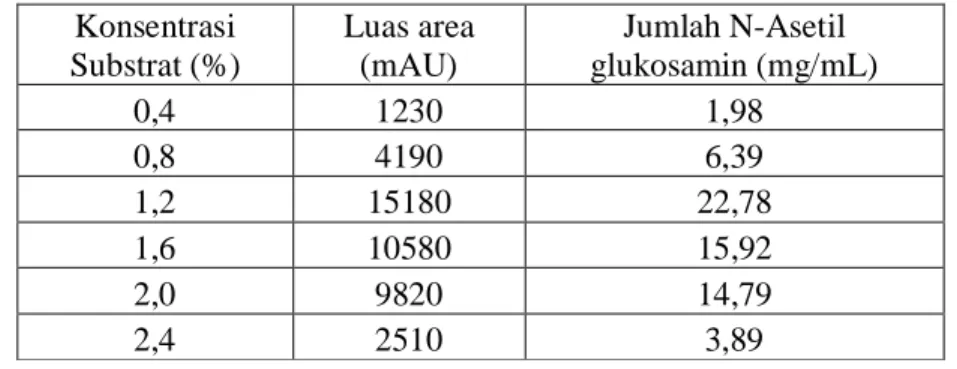
27 Masing-masing luas area selanjutnya ditentukan jumlah N-asetil glukosamin menggunakan persamaan Y= 670,5X – 97,03 pada kurva standar dan diperoleh hasil seperti pada Tabel 5.1 (perhitungan selengkapnya di Lampiran 2)
Tabel 5.1 Penentuan Jumlah N-asetil glukosamin berdasarkan variasi konsentrasi substrat Konsentrasi Substrat (%) Luas area (mAU) Jumlah N-Asetil glukosamin (mg/mL) 0,4 1230 1,98 0,8 4190 6,39 1,2 15180 22,78 1,6 10580 15,92 2,0 9820 14,79 2,4 2510 3,89
Hasil yang diperoleh pada Tabel 5.1 tersebut apabila dinyatakan dalam persentase N-Asetil glukosamin yang dihasilkan dalam masing-masing substrat maka diperoleh grafik seperti pada Gambar 5.6
Gambar 5.6 Persentase N-Asetil glukosamin pada masing-masing substrat
Jumlah N-Asetil glukosamin pada masing-masing substrat yang tertinggi dihasilkan pada konsentrasi substrat 1,2 % yaitu sebesar 22,8 mg/mL atau 94,8 %. Kandungan N-Asetil
0 10 20 30 40 50 60 70 80 90 100 0 0.5 1 1.5 2 2.5 3 J u m la h N A G ( % ) Konsentrasi Substrat (%)
28 glukosamin semakin menurun setelah melewati konsentrasi 1,2 %. Dikatakan bahwa konsentrasi substrat dapat mempengaruhi kecepatan reaksi yang dikatalisis oleh suatu enzim. Berdasarkan persamaan Michaelis – Menten, semakin bertambahnya konsentrasi substrat akan menyebabkan kecepatan reaksi semakin bertambah sampai pada kecepatan yang mendekati kecepatan maksimum (Nelson, 2003).
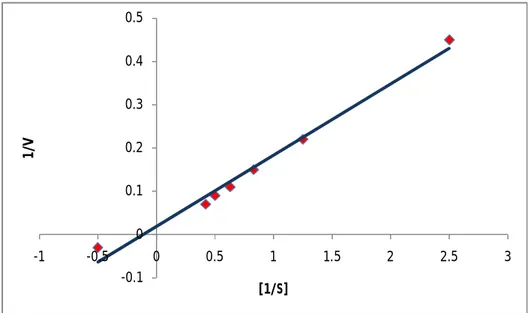
Berdasarkan grafik pada Gambar 5.6 terlihat bahwa enzim mengikuti pola dari persamaan Michaelis – Menten. Untuk menentukan pola kinetika dari reaksi tersebut maka dapat digunakan metode “pemetaan kebalikan berganda” sehingga dapat menentukan secara tepat harga KM dan Vmaks. Metode tersebut dapat dilakukan dengan menggunakan
transformasi aljabar dari persamaan Michaelis-Menten, sehingga diperoleh persamaan Lineweaver-Burk (Gambar 5.7) yang menghubungkan parameter 1/V terhadap 1/[S] (Hasil lengkapnya di Lampiran 4).
Gambar 5.7 Penentuan KM dan Vmaks dengan Persamaan Lineweaver – Burk
Harga KM merupakan unsur kunci dalam persamaan Michaelis-Menten yang bersifat khas bagi enzim tertentu, dengan substrat spesifik pada kondisi pH dan suhu tertentu. KM sangat penting dan bersifat karakteristik yang bermanfaat tidak hanya sebagai dasar untuk
-0.1 0 0.1 0.2 0.3 0.4 0.5 -1 -0.5 0 0.5 1 1.5 2 2.5 3 1/ V [1/S]
29 menjelaskan penjabaran secara matematika tentang kinetika enzim tetapi juga untuk menguji secara kuantitatif aktivitas enzim dalam jaringan dan pemurnian enzim. Selain itu harga KM juga berguna untuk menganalisis beberapa mekanisme pengendalian enzim. Berdasarkan pemetaan kebalikan-ganda diperoleh harga KM sebesar 8,33 mg/mL dan Vmaks 52,6 mg/mL
jam atau 0,88 mg/mL Menit.
Beberapa penelitian yang terkait dengan penentuan konsentrasi substrat diantaranya Jamialahmadi et al (2011) menyebutkan bahwa reaksi enzimatis dengan menggunakan substrat kitin koloidal 100 mg/mL dapat menghasilkan N-Asetil glukosamin 21,5 %. Penelitian lain menunjukkan bahwa kitinase dari Trichoderma harzianum dapat mendegradasi kitin dengan konsentrasi 17,5 mg/mL yang menghasilkan 77% N-Asetil glukosamin (Das et al., 2012). Rameshaiah et al (2014) memperoleh 0,32 g/L N-Asetil glukosamin dengan konsentrasi kitin 15 g/L. Farag et al (2014) menyebutkan bahwa kitinase yang diperoleh dari Aspergillus terrus dapat menghasilkan produk meksimum dengan menggunakan konsentrasi substrat kitin powder 2 % , pH 5, suhu 30C dan pengocokan selama 5 hari. Bervariasinya nilai N-Asetil glukosamin yang dihasilkan sangat dipengaruhi oleh aktivitas kitinase yang digunakan yang diperoleh dari berbagai sumber yang berbeda. Semakin tinggi aktivitasnya maka jumlah produk yang dihasilkan juga semakin tinggi.
5.2.2 Penentuan waktu inkubasi optimum
Setelah diperoleh konsentrasi optimum selanjutnya dilakukan penentuan waktu inkubasi optimum dengan menggunakan konsentrasi kitin 1,2 %. Variasi waktu inkubasi yang digunakan adalah 0, 1, 2, 4, 6, 8 dan 24 jam hasilnya seperti terlihat pada Gambar 5.7 (hasil selengkapnya di Lampiran 6). Waktu inkubasi sangat menentukan jumlah produk yang dihasilkan, hal ini memberikan waktu terbaik untuk interaksi enzim dengan substrat. Seperti halnya pada optimasi konsentrasi substrat, penentuan waktu inkubasi dilakukan berdasarkan
30 munculnya puncak pada waktu retensi di sekitar 2 – 3 menit yang akan dibandingkan dengan N-Asetil glukosamin standar.
Gambar 5.8 Hasil analisis HPLC pada penentuan waktu inkubasi optimum untuk waktu 0 jam (A) ; 1 jam (B) dan 2 jam (C)
B
C A
31 Gambar 5.9 Hasil analisis HPLC pada penentuan waktu inkubasi optimum
untuk waktu 4 jam (D) ; 6 jam (E) ; 8 jam (F) ; dan 24 jam (G)
D
E
F
32 Dengan menggunakan kurva standar, maka diperoleh kadar N-asetil glukosamin seperti pada Tabel 5.2 (perhitungan selengkapnya di Lampiran 5).
Tabel 5.2 Penentuan Jumlah N-asetil glukosamin berdasarkan variasi waktu inkubasi
Hasil yang diperoleh pada Tabel 5.2 tersebut apabila dinyatakan dalam persentase N-Asetil glukosamin yang dihasilkan dengan konsentrasi substrat 1,2 % pada berbagai waktu inkubasi maka diperoleh grafik seperti pada Gambar 5.9
Jumlah N-Asetil glukosamin yang tertinggi pada variasi waktu inkubasi dihasilkan saat enzim kitinase dan kitin jenis amorf dengan waktu 8 jam yaitu sebesar 10,95 mg/mL atau 45,6 %. Kitin dan kitosan adalah senyawa-senyawa yang tidak larut dalam air sehingga hal ini juga merupakan kendala bagi enzim sehingga memerlukan waktu lama untuk mendegradasinya (Coutiño et al, 2006). Jumlah N-Asetil glukosamin ternyata semakin menurun setelah setelah dilakukan inkubasi sampai 24 jam. Penurunan jumlah
N-asetilglukosamin kemungkinan dikarenakan enzim mengalami denaturasi selama reaksi
berlangsung atau terjadi penghambatan saat proses pembentukan N-asetilglukosamin (Jamialahmadi et al, 2011). Menurut Widyastuti (2007), senyawa kitooligosakarida dan N-asetilglukosamin hasil hidrolisis kitin oleh kitinase pada konsentrasi yang tinggi akan dapat menyebabkan inhibisi umpan balik karena kelebihan N-asetilglukosamin sebagai produk akhirnya. Penelitian lain menyebutkan bahwa kitinase dapat dihambat secara kompetitif oleh
Waktu Inkubasi (Jam) Luas area (mAU) Jumlah NAG (mg/mL) 0 214,7 0,46 1 681 1,16 2 813 1,36 4 3203 4,92 6 7087 10,71 8 7244 10,95 24 5472 8,31
33 beberapa senyawa seperti alosamidin dan beberapa senyawa selain gula yang terdapat di dalamnya (Peter, 2005).
Gambar 5.10 Persentase N-Asetil glukosamin pada variasi waktu inkubasi dengan konsentrasi kitin jenis amorf 1,2%
Beberapa penelitian yang mempelajari tentang pengaruh waktu inkubasi terhadap pembentukan N-Asetil glukosamin diantaranya adalah : pembentukan N-Asetil glukosamin sebanyak 1,3 g/L diperoleh dari substrat kitin setelah diinkubasi dengan kitinase dari
Trichoderma harzianum selama 113,17 jam (Rameshaiah et al, 2014). Penelitian lain
menyebutkan bahwa produksi N-Asetil glukosamin dari kitin koloidal dengan enzim kitinase dari Aeromonas sp PTCC 1691 menghasilkan sekitar 40% setelah diinkubasi selama 24 jam (Jamialahmadi, 2011). Produksi N-Asetil glukosamin sebanyak 2,375 mg/mL secara enzimatis dari kitin koloidal dengan menggunakan kitinase dari Aspergillus sp 501 yang diinkubasi selama 4 hari (Widhyastuti, 2010).
5.2.3 Penentuan konsentrasi enzim optimum
Konsentrasi enzim merupakan salah satu faktor yang mempengaruhi aktivitas enzim, dimana semakin tinggi konsentrasi enzim maka aktivitasnya juga semakin meningkat.
0 5 10 15 20 25 30 35 40 45 50 0 2 4 6 8 10 12 14 16 18 20 22 24 J u m la h N A G ( % )
34 Kenaikan aktivitas enzim berbanding lurus dengan produk yang dihasilkan, hal ini berarti bahwa kenaikan N-Asetil glukosamin ditunjukkan dengan kenaikan aktivitas kitinase. Berdasarkan variasi konsentrasi enzim ditentukan konsentrasi N-Asetil glukosamin seperti Gambar 5.10 (perhitungan selengkapnya di Lampiran 7 dan 8).
Gambar 5.11 Persentase N-Asetil glukosamin pada variasi konsentrasi enzim yang diinkubasi selama 8 jam dengan konsentrasi kitin jenis amorf 1,2%
Jumlah N-Asetil glukosamin menunjukkan kenaikan dengan semakin tingginya konsentrasi enzim kitinase, dimana konsentrasi enzim 0,1 U/mL dapat menghasilkan sekitar 0,454 mg/mL atau 1,89 % N-Asetil glukosamin dengan konsentrasi kitin 1,2 % diikubasi selama 8 jam.
Beberapa penelitian lain yang terkait dengan pengaruh konsentrasi enzim kitinase telah banyak dilakukan diantaranya adalah : El-Sayed et al (2000) menyebutkan bahwa kitinase dari daun tanaman tingkat tinggi Beta Bulgaris pada konsentrasi 40 g protein dapat menghasilkan sekitar 55 ng N-Asetil glukosamin. Penelitian lain menyebutkan bahwa
1 1.2 1.4 1.6 1.8 2 0 0.02 0.04 0.06 0.08 0.1 0.12 J u m la h N A G ( % )
35 kitinase yang diperoleh dari sejenis insekta Balanus Amphitrite dengan konsentrasi 4U/mL dapat menghasilkan sekitar 0,4 g/mL N-Asetil glukosamin ((Khandeparker et al, 2013).
5.3 Pemurnian N-Asetil glukosamin
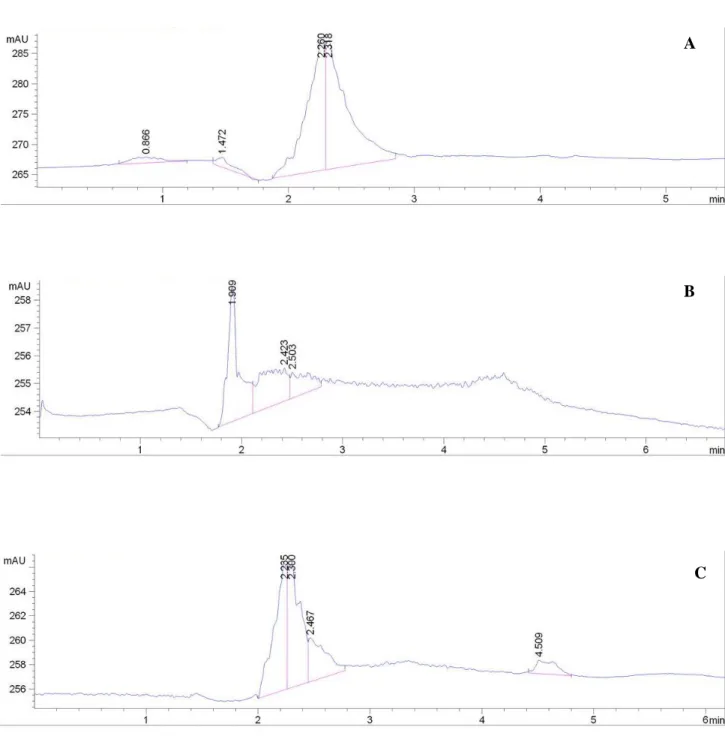
Hasil degradasi secara enzimatis kitin jenis amorf untuk membentuk N-Asetil glukosamin masih menunjukkan adanya senyawa yang lain pada kromatogram HPLC. Untuk memperoleh N-Asetil glukosamin dengan tingkat kemurnian yang tinggi, maka perlu dilakukan pemurnian. Pada penelitian ini akan dilakukan pemurnian dengan menggunakan beberapa pelarut dengan tingkat kepolaran yang berbeda. Pelarut yang digunakan untuk pemurnian N-Asetil glukosamin berdasarkan urutan kepolaran adalah : aseton, etanol, metanol dan asetonitril.
Produksi N-Asetil gllukosamin dilakukan pada kondisi optimum, yaitu pada konsentrasi substrat 1,2 % , konsentrasi enzim sekitar 1 U/mL dan waktu inkubasi 8 jam. Hasil yang diperoleh pada filtrat selanjutnyaa masing-masing dimurnikan dengan menambahkan pelarut metanol, etanol, aseton, dan asetonitril. Setelah ditambahkan pelarut tersebut masing-masing filtrat membentuk endapan, dan diduga pada endapan tersebut diduga salah satunya merupakan N-Asetil glukosamin. Hal ini telah dibuktikan setelah dilakukan pengujian terhadap filtrat tidak menunjukkan adanya puncak dari N-Asetil glukosamin (Gambar 5.11).
36 Adapun endapan yang diperoleh tersebut selanjutnya dilarutkan dengan aquades untuk dianalisis kandungan N-Asetil glukosamin seperti pada Gambar 5.12 – 5.14. Hasil yang diperoleh menunjukkan bahwa masih terdapat banyak sekali senyawa-senyawa yang lain, sehingga perlu dilakukan pemurnian lebih lanjut dengan melakukan variasi pelarut.
Gambar 5.13 Hasil analisis bagian endapan pada tahap pemurnian untuk aseton (A), etanol (B), dan asetonitril (C)
C B A
37 Gambar 5.14 Hasil analisis bagian endapan pada tahap pemurnian untuk metanol Selanjutnya dilakukan pemurnian dengan variasi pelarut dengan asetonitril sebagai pelarut utamanya, hal ini dikarenakan asetonitril mempunyai kepolaran yang lebih tinggi dan dapat menunjukkan puncak N-Asetil glukosamin lebih baik dibandingkan pelarut yang lain. Hasil pemurnian dengan menggunakan metanol yang dilanjutkan dengan asetonitril pada masing-masing tahapan seperti pada Gambar 5.15 (Tahapan pemurnian bertingkat selengkapnya seperti pada Lampiran 9). Filtrat yang ditambahkan dengan metanol membentuk endapan dan filtrat. Endapan yang diperoleh diduga mengandung N-Asetil glukosamin selanjutnya di larutkan dengan aquades dan semua endapan larut sempurna kemudian ditambahkan kembali asetonitril. Hal ini bertujuan untuk memisahkan kembali N-Asetil glukosamin dengan pelarut yang lebih polar. Setelah ditambahkan asetonitril ternyata diperoleh kembali endapan dan filtrat yang terdiri dari dua lapisan, dimana lapisan bawah diperkirakan merupakan asetonitril yang hanya sedikit atau bahkan tidak mengandung N-Asetil glukosamin (Gambar 5.15 D). Lapisan atas merupakan air selanjutnya ditambahkan kembali asetonitril dan membentuk endapan dan filtrat yang masih mengandung N-Asetil glukosamin dalam air (Gambar 5.15B). Endapan yang terbentuk selanjutnya dilarutkan aquades dan ditambahkan asetonitril tetapi sudah tidak membentuk endapan. Diperkirakan pada larutan tersebut diperoleh N-Asetil glukosamin yang tinggi seperti ditunjukkan pada Gambar 5.15C (hasil selengkapnya di Lampiran 10).
38 Gambar 5.15 Hasil N-Asetil glukosamin pada pemurnian bertahap untuk NAG standar (A),
filtrat pada tahap akhir (B), endapan pada tahap akhir (C) dan filtrat pada asetonitril (D) A
D C B
39 Pemurnian dengan metanol yang dilanjutkan dengan asetonitril memberikan hasil yang lebih baik dibandingkan dengan pemurnian sebelumnya yang ditunjukkan dengan adanya puncak dengan waktu retensi yang sama dengan waktu retensi N-Asetil glukosamin standar (Gambar 5.15 A,B dan C). N-Asetil glukosamin standar menunjukkan dua puncak, dimungkinkan adanya senyawa lain dikarenakan N-Asetil glukosamin yang terhidrolisis dalam selang waktu tertentu. Pada bagian B dan C muncul puncak lain pada waktu retensi sekitar 2,7 menit diperkirakan puncak tersebut merupakan oligomer dari N-Asetil glukosamin yang terdegradasi dari kitin. Hal yang sama juga dikemukakan oleh Sashiwa et al (2002) yang menyebutkan bahwa degradasi polimer kitin secara enzimatis dengan endokitinase secara perlahan akan dihasilkan oligosakarida dan selanjutnya dengan eksokitinase akan dihasilkan N-Asetil glukosamin. Penelitian yang lain juga menunjukkan bahwa pola degradasi hidrolisis kitin memberikan kromatogram dari oligomer N-Asetil glukosamin selain monomernya (Chang et al, 2000).
Pemurnian terhadap N-Asetil glukosamin juga telah dilakukan dengan pelarut aseton, asetonitril dan etanol yang kemudian dilanjutkan dengan asetonitril. Dilakukan tahapan yang sama seperti halnya pada pemurnian di atas, filtrat pertama setelah ditambahkan pertama kali dengan pelarut diperoleh puncak-puncak yang masih sangat banyak seperti pada Gambar 5.16.
40 Salah satu dari puncak yang mempunyai luas area tertinggi tersebut dimungkinkan bukan merupakan Asetil glukosamin dikarenakan waktu retensinya lebih jauh dari N-Asetil glukosamin standar. Filtrat pada tahap kedua dari masing-masing pelarut memberikan pola yang hampir sama seperti pada Gambar 5.17 tetapi masih terdapat puncak-puncak yang lainnya.
Gambar 5.17 Hasil pemurnian N-Asetil glukosamin tahap kedua dengan variasi pelarut menggunakan aseton (A), etanol (B), dan asetonitril (C)
C B A
41 Puncak yang muncul sangat banyak di pemurnian tahap kedua (Gambar 5.16) sudah banyak yang hilang setelah dilakukan pemurnian kembali dengan variasi pelarut menggunakan asetonitril (Gambar 5.18).
Gambar 5.18 Hasil pemurnian N-Asetil glukosamin tahap ketiga dengan variasi pelarut menggunakan aseton (A), etanol (B), dan asetonitril (C)