INTISARI
Brokoli (Brassica oleracea var. italica) merupakan tumbuhan yang dimanfaatkan oleh masyarakat sebagai sayuran. Alil isotiosianat diketahui bersifat antikanker karena dapat menghambat pertumbuhan sel kanker serta menginduksi apoptosis. Brokoli mengandung alil isotiosianat dalam konsentrasi yang tinggi. Suatu senyawa antikanker memiliki toksisitas tertentu sehingga dapat membunuh sel kanker. Maka dari itu, perlu dilakukan uji Brine Shrimp Lethality Test (BST) untuk mengetahui efek toksik fraksi air brokoli yang dinyatakan oleh LC50.
Penelitian ini termasuk penelitian eksperimental murni dengan rancangan penelitian post test only control group design. Pengujian efek toksik brokoli dibuat dalam bentuk fraksi air, karena alil isotiosianat memiliki kelarutan dalam air. Fraksi air diperoleh dengan cara brokoli dibuat jus dengan penambahan air kemudian disaring. Hasil penyaringan tersebut ditambah dengan pelarut kloroform untuk mengambil senyawa yang tidak larut air, kedua pelarut kemudian dipisahkan sehingga didapatkan fraksi air dan fraksi kloroform. Fraksi air dibuat seri konsentrasi 320; 580; 1000; 1900; dan 3400 µg/ml. Hewan uji yang digunakan adalah 10 larva Artemia salina LEACH (artemia) dengan replikasi lima kali dan dibandingkan dengan kontrol negatif untuk tiap-tiap seri konsentrasi. Data diperoleh dengan menghitung jumlah artemia yang mati setelah 24 jam perlakuan. Nilai LC50 dihitung dengan metode analisis probit. Nilai LC50 < 1000
µg/ml dinyatakan memiliki efek toksik.
Hasil uji toksisitas dengan metode (BST) diperoleh nilai LC50 untuk fraksi
air adalah 631 µg/ml. Dari hasil tersebut maka fraksi air memiliki efek toksik terhadap larva artemia. Setelah dilakukan uji kualitatif dengan Kromatografi Lapis Tipis (KLT), dapat diketahui bahwa dalam fraksi air brokoli terkandung senyawa kimia alil isotiosianat.
Kata kunci : Brassica oleracea var. italica, uji Brine Shrimp Lethality Test (BST), fraksi air, LC50, Kromatografi Lapis Tipis (KLT), dan alil
isotiosianat.
ABSTRACT
Broccoli (Brassica oleracea var. italica) is a kind of vegetable. Alyl Isothiocyanates is an anticancer that can supress the growth of cancer cells also induce apoptosis. Broccoli contain of alyl isothiocyanates in high concentration. Anticancer compound have certain toxicity that can kill cancer cell. Therefore, it is necessary to do Brine Shrimp Lethality Test (BST) to know the toxic effect of water fraction from broccoli stated by LC50.
This research was the pure experimental with post test only control group design. The broccoli’s toxic effect test was made in the form of water fraction based on solubility from alyl isothiocyanates. Water fractions were obtained by juiceing and filtering the broccoli, and then it was added by chloroform to remove the compound that do not have solubility in water. It was separated to get water fraction and chloroform fraction. Water fraction was made concentration series 320; 580; 1000; 1900; dan 3400 µg/ml. The animal testee that was used are 10 Artemia salina LEACH (artemia) larvae with 5 times of replication and it is compared with negative control for each concentration series. Datas are obtained by counting the amount of dead artemia after 24 hours. The value of LC50 is
counted by probit analysis method. The value of LC50 < 1000 µg/ml has toxic
effect.
The result toxicity test from BST show LC50 from water fraction was 631
µg/ml. The result shows that water fraction has toxic effect on artemia larvae. The qualitatif test with Thin Layer Chromatography (TLC) shows that water fraction of broccoli contain alyl isothiocyanates.
Key words : Brassica oleracea var. italica, Brine Shrimp Lethality Test (BST), water fraction, LC50, Thin Layer Chromatography (TLC), and alyl
isothiocyanates.
UJI BRINE SHRIMP LETHALITY TEST (BST) FRAKSI AIR BROKOLI (Brassica oleracea var. italica)
BESERTA PROFIL KROMATOGRAFI LAPIS TIPIS (KLT)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh : Sinta Kiranawati NIM : 028114070
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2007
Ia membaringkan aku di padang yang berumput hijau,
Ia membimbing aku ke air yang tenang;
Ia menyegarkan jiwaku.
Ia menuntun aku di jalan yang benar
oleh karena nama-Nya.
Mazmur 23:2-3
Orang yang paling sempurna
bukanlah orang dengan otak yang sempurna
melainkan orang yang dapat mempergunakan
sebaik-baiknya dari bagian otaknya
yang kurang sempurna
* Aristoteles *
Kupersembahkan skripsi ini untuk :
Bapak & Ibuku tercinta sebagai tanda hormat dan baktiku
Kakak-kakakku (Mas Aji, Mba Dewi, dan Mba Ika)
Almamaterku
PRAKATA
Puji dan syukur penulis haturkan kepada Bapa Yang Maha Kasih atas limpahan karunia dan kasih yang diberikannya selama proses penelitian dan penyusunan skripsi yang berjudul Uji Brine Shrimp Lethality Test (BST) Fraksi Air Brokoli (Brassica oleracea var. italica) beserta Profil Kromatografi Lapis Tipis (KLT) sehingga dapat terselesaikan dengan baik. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi (S.Farm.) dari Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
Selama pelaksanaan penelitian hingga terselesaikannya penyusunan skripsi ini, penulis tidak dapat lepas dari bantuan berbagai pihak. Oleh sebab itu, pada kesempatan ini penulis mengucapkan terima kasih kepada:
1. Rita Suhadi, M.Si., Apt., selaku Dekan Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
2. Yohanes Dwiatmaka, M.Si., selaku dosen pembimbing yang dengan penuh kesabaran dan ketulusan memberikan petunjuk, saran dan perhatian selama pelaksanaan penelitian dan penyusunan skripsi ini.
3. dr. Luciana Kuswibawati, M.Kes., selaku dosen penguji yang telah bersedia menguji, memberikan saran dan masukan yang sangat berguna dalam penyelesaian skripsi ini.
4. Christine Patramurti, M.Si., Apt., selaku dosen penguji yang telah bersedia menguji, memberikan saran dan masukan yang sangat berguna dalam penyelesaian skripsi ini.
5. Sri Hartati Yuliani, M.Si., Apt., selaku dosen pembimbing akademik yang telah membantu selama proses perkuliahan.
6. Segenap dosen dan karyawan yang telah membantu selama penyelesaian skripsi ini.
7. Bapak dan ibuku tercinta atas segala kasih, kesabaran, perhatian, semangat dan doa yang telah dicurahkan kepadaku.
8. Kakak-kakak terbaikku (Mas Aji, Mba Dewi, dan Mba Ika) atas dukungan, perhatian, bantuan, kasih dan doanya.
9. Danang Eka Saputra atas ketulusan hati, kasih, kesabaran, bantuan dan keceriaan yang selalu menghiasi hari-hariku.
10. Pak Lik Gendro beserta keluarga atas bantuannya mencari tanaman brokoli serta dukungan dan doanya.
11. Ayu dan Prima atas kebersamaan kita dalam suka dan duka selama penelitian, dan yang selalu memberiku semangat, perhatian dan bantuan.
12. Fifi, Yuni, Kristin, Wira, Titin, Rosa dan Devi ’03 atas bantuan dan kebersamaan selama penelitian di laboratorium.
13. Lena yang telah membantuku selama penelitian menggunakan larva udang, Ulin, Lia ’03, Puri, Asti, Wenny, Tjun Liong, Didit, Peter, Beni, Yinni, Rika, Lian, Elay, dan Devi atas bantuan yang sangat berharga.
14. Teman-teman kelompok C atas kekompakan, keceriaan, dan kerjasamanya, serta teman-teman angkatan 2002 atas kebersamaannya.
15. Mas Wagiran, Mas Sigit, Mas Andri, Pak Mukmin, Mas Parlan, dan Mas Kunto, atas bantuan yang sangat berguna selama proses penelitian di laboratorium.
16. Teman-teman “Kost Mawar”: Alin dan Mina atas persahabatan, perhatian dan bantuannya, Ica dan Mba Yessy atas dukungannya, Yogi, Agnes, Ika, Mei, Mba Virgin, Raras, Tina, Anas, Ana, Nana, Diah, Cici, Ani, Sisil, Ferry, Ata, Evrin, dan Putri atas keceriaan dan kebersamaannya.
Dengan segala kerendahan hati, penulis menyadari bahwa skripsi ini masih jauh dari sempurna, oleh karena itu, penulis mengharapkan kritik dan saran yang bersifat membangun. Akhir kata, penulis berharap skripsi ini dapat bermanfaat bagi pembaca dan perkembangan ilmu pengetahuan.
Penulis
INTISARI
Brokoli (Brassica oleracea var. italica) merupakan tumbuhan yang dimanfaatkan oleh masyarakat sebagai sayuran. Alil isotiosianat diketahui bersifat antikanker karena dapat menghambat pertumbuhan sel kanker serta menginduksi apoptosis. Brokoli mengandung alil isotiosianat dalam konsentrasi yang tinggi. Suatu senyawa antikanker memiliki toksisitas tertentu sehingga dapat membunuh sel kanker. Maka dari itu, perlu dilakukan uji Brine Shrimp Lethality Test (BST) untuk mengetahui efek toksik fraksi air brokoli yang dinyatakan oleh LC50.
Penelitian ini termasuk penelitian eksperimental murni dengan rancangan penelitian post test only control group design. Pengujian efek toksik brokoli dibuat dalam bentuk fraksi air, karena alil isotiosianat memiliki kelarutan dalam air. Fraksi air diperoleh dengan cara brokoli dibuat jus dengan penambahan air kemudian disaring. Hasil penyaringan tersebut ditambah dengan pelarut kloroform untuk mengambil senyawa yang tidak larut air, kedua pelarut kemudian dipisahkan sehingga didapatkan fraksi air dan fraksi kloroform. Fraksi air dibuat seri konsentrasi 320; 580; 1000; 1900; dan 3400 µg/ml. Hewan uji yang digunakan adalah 10 larva Artemia salina LEACH (artemia) dengan replikasi lima kali dan dibandingkan dengan kontrol negatif untuk tiap-tiap seri konsentrasi. Data diperoleh dengan menghitung jumlah artemia yang mati setelah 24 jam perlakuan. Nilai LC50 dihitung dengan metode analisis probit. Nilai LC50 < 1000
µg/ml dinyatakan memiliki efek toksik.
Hasil uji toksisitas dengan metode (BST) diperoleh nilai LC50 untuk fraksi
air adalah 631 µg/ml. Dari hasil tersebut maka fraksi air memiliki efek toksik terhadap larva artemia. Setelah dilakukan uji kualitatif dengan Kromatografi Lapis Tipis (KLT), dapat diketahui bahwa dalam fraksi air brokoli terkandung senyawa kimia alil isotiosianat.
Kata kunci : Brassica oleracea var. italica, uji Brine Shrimp Lethality Test (BST), fraksi air, LC50, Kromatografi Lapis Tipis (KLT), dan alil
isotiosianat.
ABSTRACT
Broccoli (Brassica oleracea var. italica) is a kind of vegetable. Alyl Isothiocyanates is an anticancer that can supress the growth of cancer cells also induce apoptosis. Broccoli contain of alyl isothiocyanates in high concentration. Anticancer compound have certain toxicity that can kill cancer cell. Therefore, it is necessary to do Brine Shrimp Lethality Test (BST) to know the toxic effect of water fraction from broccoli stated by LC50.
This research was the pure experimental with post test only control group design. The broccoli’s toxic effect test was made in the form of water fraction based on solubility from alyl isothiocyanates. Water fractions were obtained by juiceing and filtering the broccoli, and then it was added by chloroform to remove the compound that do not have solubility in water. It was separated to get water fraction and chloroform fraction. Water fraction was made concentration series 320; 580; 1000; 1900; dan 3400 µg/ml. The animal testee that was used are 10 Artemia salina LEACH (artemia) larvae with 5 times of replication and it is compared with negative control for each concentration series. Datas are obtained by counting the amount of dead artemia after 24 hours. The value of LC50 is
counted by probit analysis method. The value of LC50 < 1000 µg/ml has toxic
effect.
The result toxicity test from BST show LC50 from water fraction was 631
µg/ml. The result shows that water fraction has toxic effect on artemia larvae. The qualitatif test with Thin Layer Chromatography (TLC) shows that water fraction of broccoli contain alyl isothiocyanates.
Key words : Brassica oleracea var. italica, Brine Shrimp Lethality Test (BST), water fraction, LC50, Thin Layer Chromatography (TLC), and alyl
isothiocyanates.
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PRAKATA... v
PERNYATAAN KEASLIAN KARYA ... viii
INTISARI ... ix
ABSTRACT... x
DAFTAR ISI... xi
DAFTAR TABEL... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN... xvii
BAB I. PENDAHULUAN... 1
A. Latar Belakang ... 1
1. Perumusan masalah... 2
2. Keaslian Penelitian... 3
3. Manfaat Penelitian ... 3
B. Tujuan Penelitian... 3
BAB II. PENELAAHAN PUSTAKA ... 4
A. Brokoli ... 4
1. Keterangan Botani ... 4
2. Morfologi dan Habitat Tanaman Brokoli... 4
3. Kandungan Kimia ... 5
4. Khasiat dan Kegunaan ... 7
B. Artemia... 8
1. Keterangan Zoologi ... 8
2. Tahap Perkembangan Larva Artemia ... 8
3. Perkembangbiakan dan Siklus Hidup Artemia ... 10
4. Cara Makan Artemia... 11
5. Lingkungan Hidup Artemia ... 12
C. Brine Shrimp Lethality Test (BST) ... 13
1. Pengertian BST ... 13
2. Penggunaan Artemia salina LEACH pada Metode BST ... 13
D. Kanker ... 16
1. Pengertian Kanker... 16
2. Karsinogenesis ... 17
E. Apoptosis ... 18
F. Siklus Sel ... 20
G. Toksisitas ... 21
H. Kromatografi Lapis Tipis (KLT) ... 21
I. Landasan Teori ... 22
J. Hipotesis ... 23
BAB III. METODOLOGI PENELITIAN ... 24
A. Jenis dan Rancangan Penelitian ... 24
B. Variabel Penelitian dan Definisi Operasional ... 24
1. Variabel Penelitian... 24
2. Definisi Operasional ... 24
C. Bahan Penelitian... 25
D. Alat Penelitian... 26
E. Tata Cara Penelitian ... 26
1. Determinasi Tanaman ... 26
2. Pengumpulan Bahan dan Penyarian... 27
3. Pembuatan Air Laut Buatan... 27
4. Penetasan Siste Artemia... 28
5. Penentuan Nilai LC50 dengan Metode BST ... 28
6. Identifikasi Alil Isotiosianat dengan Metode Kromatografi Lapis Tipis (KLT) ... 30
F. Analisis Hasil... 31
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN... 32
A. Determinasi Tanaman ... 32
B. Pengumpulan Bahan... 32
C. Pembuatan Fraksi Air Brokoli... 33
D. Pembuatan Air Laut Buatan ... 33
E. Penetasan Siste Artemia ... 34
F. Penentuan Nilai LC50 dengan Metode BST... 36
G. Uji Kualitatif Fraksi Air dengan Metode KLT ... 44
BAB V. KESIMPULAN DAN SARAN ... 50
A. Kesimpulan ... 50
B. Saran... 50
DAFTAR PUSTAKA ... 51
LAMPIRAN... 54
BIOGRAFI PENULIS ... 67
DAFTAR TABEL
Halaman Tabel I. Komposisi Bahan Untuk Pembuatan Air Laut Buatan
(ALB) ... 28 Tabel II Persentase Kematian Larva Artemia pada Berbagai
Konsentrasi Fraksi Air ... 41 Tabel III. Hasil uji KLT fraksi air brokoli untuk pemeriksaan alil
isotiosianat dengan fase diam silika gel GF254 dan fase
gerak n-butanol, n-propanol, asam asetat glasial, air
(30:10:10:10, v/v)... 49
DAFTAR GAMBAR
Halaman
Gambar 1. Hidrolisis Glukosinolat oleh Enzim Mirosinase
membentuk Aglikon Alil Isotiosianat ... 6
Gambar 2. Struktur Kimia Alil Isotiosianat ... 6
Gambar 3. Perubahan Bentuk Burayak... 9
Gambar 4. Bagian-Bagian Tubuh Artemia Dewasa... 10
Gambar 5. Siklus Hidup Artemia Biseksual ... 11
Gambar 6. Mekanisme Apoptosis... 18
Gambar 7. Siklus Sel ... 20
Gambar 8. Mekanisme aktivitas isotiosianat dalam mematikan sel ... 39
Gambar 9. Kurva Hubungan Nilai Probit versus Log Konsentrasi Fraksi Air ... 42
Gambar 10. Kromatogram Fraksi Air Brokoli untuk Pemeriksaan Senyawa Alil Isotiosianat ... 45
Gambar 11. Reaksi antara Alil Isotiosianat dengan Ninhidrin ... 48
Gambar 12. Tanaman Brokoli (Brassica oleracea var. italica)... 55
Gambar 13. Brokoli ... 55
Gambar 14. Larva Artemia salina LEACH ... 56
Gambar 15. Bak Penetasan untuk Larva Artemia salina LEACH... 56
Gambar 16. Kromatografi Lapis Tipis Fraksi Air dari Brokoli untuk Pemeriksaan Alil Isotiosianat ... 57
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat Determinasi ... 54 Lampiran 2. Foto Penelitian ... 55 Lampiran 3. Cara Pembuatan Pereaksi Semprot Ninhidrin ... 57 Lampiran 4. Cara Pembuatan Ekstrak Alii sativi Bulbus dalam
Pelarut Metanol sebagai Pembanding pada Uji KLT
Senyawa Alil Isotiosianat ... 58 Lampiran 5. Perhitungan untuk Membuat Larutan Stok Fraksi Air... 58 Lampiran 6. Perhitungan untuk Membuat Variasai Konsentrasi
Larutan Sampel dari Fraksi Air... 59 Lampiran 7. Data Kematian Larva Artemia salina Leach pada
Kontrol Metanol dari Fraksi Air Setelah 24 jam ... 61 Lampiran 8. Data Kematian Larva Artemia salina Leach Karena
Pengaruh Fraksi Air Setelah 24 jam ... 62 Lampiran 9. Perhitungan Persentase Kematian Larva Artemia pada
Fraksi Air Menggunakan Rumus Abbot ... 62 Lampiran 10. Perhitungan Data Statistik Fraksi Air Menggunakan
Analisis Probit... 63
BAB I PENDAHULUAN
A. Latar Belakang
Kanker dianggap sebagai penyebab kematian kedua setelah penyakit kardiovaskuler (Dipiro et al., 1997). Penanganan kanker hingga saat ini yang tersedia pada umumnya adalah operasi, terapi radiasi, kemoterapi, terapi hormon, dan terapi imun (Anonim, 2005). Namun pengobatan dengan metode tersebut dapat memberikan efek samping yang merugikan. Maka dari itu, pengobatan tradisional dari bahan alam mulai dicari dan digunakan.
Sayuran selain digunakan sebagai bahan makanan, ternyata juga dapat digunakan sebagai obat tradisional yaitu untuk mencegah atau mengobati penyakit kanker. Tanaman brokoli (Brassica oleracea var. italica) mengandung glukosinolat dalam konsentrasi tinggi (Misiewicz, Skupinska, and Guttman, 2003). Ketika jaringan tanaman dihancurkan, glukosinolat yang terdapat dalam vakuola sel akan dilepaskan dan dihidrolisis oleh enzim mirosinase yang terdapat dalam sitoplasma (Krul et al., 2002). Enzim mirosinase akan melepaskan glukosa, sehingga dihasilkan aglikon dari glukosinolat yang memiliki aktivitas sebagai antikanker salah satunya adalah alil isotiosianat. Alil isotiosianat memiliki kelarutan dalam air (Anonim, 2001), oleh karena itu fraksi air dari brokoli mengandung senyawa alil isotiosianat.
apoptosis (Xiao et al., 2003). Hal ini yang menyebabkan brokoli dapat dikatakan sebagai salah satu jenis sayuran yang memiliki aktivitas antikanker.
Suatu senyawa yang bersifat antikanker akan memiliki toksisitas tertentu sehingga dapat digunakan untuk membunuh sel-sel kanker (Katzung, 2004). Oleh karena itu, toksisitas dari senyawa alil isotiosianat perlu diketahui. Pencarian obat tradisional yang mengandung senyawa antikanker dari tanaman, dapat dilakukan dengan cara skrining uji toksisitas menggunakan hewan uji Artemia salina LEACH dengan metode Brine Shrimp Lethality Test (BST) (Meyer et al., 1982). Prinsip metode ini yaitu uji toksisitas akut terhadap larva artemia dengan penentuan nilai LCB50B setelah perlakuan 24 jam. Artemia dalam uji ini digunakan
karena memiliki kesamaan sistem enzim dengan mamalia, misalnya DNA-dependent RNA polymerase, dan ouabaine sensitive NaP
+ (Solis, Wright, Anderson, Gupta, and Phillipson, 1993).
Dari latar belakang diatas, maka penggunaan brokoli sebagai obat antikanker perlu diketahui toksisitasnya dengan metode BST. Toksisitas brokoli dapat diketahui dengan menguji efek toksik fraksi air brokoli yang dinyatakan dengan nilai LCB50B (Lethal Concentration 50). LCB50B merupakan konsentrasi suatu
larutan yang dapat menyebabkan kematian 50% hewan uji. Jika nilai LCB50B < 1000
µg/ml maka suatu larutan senyawa dikatakan memiliki efek toksik (Meyer et al., 1982), sehingga diharapkan senyawa tersebut bersifat sitotoksik.
1. Perumusan masalah
b. Bagaimana profil Kromatograi Lapis Tipis senyawa alil isotiosianat yang terdapat dalam fraksi air brokoli?
2. Keaslian penelitian
Dari hasil penelusuran pustaka yang telah dilakukan, belum pernah dilakukan penelitian mengenai uji BST tanaman brokoli.
3. Manfaat penelitian a. Manfaat teoritis
Penelitian ini diharapkan dapat memberikan informasi yang berguna bagi perkembangan ilmu pengetahuan khususnya dalam bidang farmasi mengenai besarnya efek toksik brokoli terhadap larva artemia dengan metode BST.
b. Manfaat praktis
Penelitian ini diharapkan dapat memberikan informasi tambahan bagi masyarakat mengenai khasiat brokoli selain sebagai bahan makanan juga dapat digunakan untuk mencegah ataupun mengobati penyakit kanker.
B. Tujuan Penelitian
1. Mengetahui apakah fraksi air brokoli bersifat toksik terhadap larva artemia dan seberapa besar efek toksiknya yang dinyatakan dengan nilai LCB50.B
BAB II
PENELAAHAN PUSTAKA
A. Brokoli 1. Keterangan botani
Berdasarkan klasifikasinya (Mills, 2001), brokoli termasuk ke dalam varietas Brassica oleracea var. italica, serta anggota dari famili Cruciferaceae. Brokoli memiliki nama asing broccoli (Inggris), dengan nama simplisia Brassicae oleraceae (brokoli).
2. Morfologi dan habitat tanaman brokoli
Brokoli memiliki tangkai daun agak panjang dan helai daun berlekuk-lekuk memanjang. Massa bunga brokoli (curd) tersusun secara kompak membentuk bulatan bewarna hijau tua atau hijau kebiru-biruan, dengan diameter antara 15 - 20 cm atau lebih. Pada kondisi lingkungan yang sesuai, massa bunga brokoli dapat tumbuh memanjang menjadi tangkai bunga yang penuh dengan kuntum bunga. Tiap bunga terdiri atas empat helai daun kelopak (calyx), empat helai daun mahkota bunga (corolla), enam benang sari yang komposisinya empat memanjang dan dua pendek. Bakal buah terbagi dua ruang, dan setiap ruang berisi bakal biji (Rukmana, 1995).
Pemanenan brokoli dapat dilakukan setelah umurnya mencapai 60 - 90 hari sejak ditanam, sebelum bunganya mekar, dan sewaktu massa bunganya masih berwarna hijau. Jika bunganya telah mekar, tangkai bunganya akan memanjang dan keluarlah kuntum-kuntum bunga berwarna kuning. Brokoli tidak tahan dengan pemasakan yang terlalu lama, selain itu pemanasan terlalu lama akan mengurangi khasiat brokoli (Dalimartha, 2000).
3. Kandungan kimia
Tanaman yang termasuk dalam genus Brassica memiliki kandungan lemak yang sedikit sehingga rendah energi, selain itu tanaman ini merupakan sumber vitamin, mineral, dan serat yang berguna dalam mencegah penyakit kanker. Tanaman ini juga mengandung sejumlah besar senyawa aktif, dimana beberapa diantaranya dapat digunakan untuk melawan kanker. Senyawa aktif ini meliputi glukosinolat, isotiosianat, karotenoid, kumarin, ditioltion, flavonoid, indol, fenol, dan terpen (Nestle, 1997).
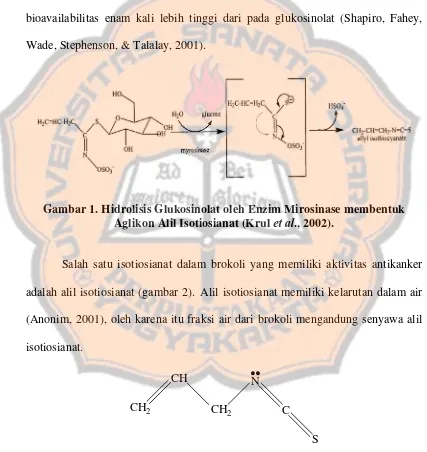
Tanaman brokoli (Brassica oleracea var. italica) mengandung glukosinolat dalam konsentrasi tinggi (Misiewicz, Skupinska, and Guttman, 2003). Ketika jaringan tanaman dihancurkan, glukosinolat yang terdapat dalam vakuola sel akan dilepaskan dan dihidrolisis oleh enzim mirosinase yang terdapat dalam sitoplasma (Krul et al., 2002).
usus. Glukosinolat dihidrolisis oleh Bacteroides thetaiotaomicron yang terdapat di dalam tubuh manusia membentuk alil isotiosianat (TKrulT et al., 2002).
Ilmuwan dari Johns Hopkins University School of Medicine menyatakan bahwa glukosinolat tidak memiliki sifat sebagai antikanker sedangkan isotiosianat bersifat antikanker (Surjadi, 2005). Selain itu, metabolisme isotiosianat memiliki bioavailabilitas enam kali lebih tinggi dari pada glukosinolat (Shapiro, Fahey, Wade, Stephenson, & Talalay, 2001).
Gambar 1. Hidrolisis Glukosinolat oleh Enzim Mirosinase membentuk Aglikon Alil Isotiosianat (TKrulT et al., 2002).
Salah satu isotiosianat dalam brokoli yang memiliki aktivitas antikanker adalah alil isotiosianat (gambar 2). Alil isotiosianat memiliki kelarutan dalam air (Anonim, 2001), oleh karena itu fraksi air dari brokoli mengandung senyawa alil isotiosianat.
N
C
S CH
CH2 CH2
4. Khasiat dan kegunaan
Brokoli akan mempercepat proses penyembuhan setelah sakit berat serta dapat digunakan untuk mencegah dan menghambat perkembangan sel kanker (Dalimartha, 2000).
Alil isotiosianat dapat menghambat proliferasi sel kanker, aktivitas antiproliferasi alil isotiosianat dalam melawan sel kanker disebabkan oleh karena kemampuannya dalam menahan sel pada fase M serta dapat menginduksi apoptosis (Xiao et al., 2003).
Isotiosianat dapat menghambat aktifitas NaP +
P
& KP +
P
-ATPase (Breier et al., 1995). Isotiosianat banyak mendapat perhatian karena aktivitasnya sebagai antikanker. Sebagai senyawa antikanker isotiosianat memiliki kemampuan untuk mematikan sel kanker, hal ini dapat dilihat dari aktivitasnya dalam menginduksi apoptosis dan menghentikan pertumbuhan sel pada fase S (sintesis DNA) dan fase M (mitosis) dalam siklus hidup sel (Li Tang et al., 2006). Isotiosianat yang merupakan hasil hidrolisis dari senyawa glukosinolat dapat menginduksi p53, dimana p53 merupakan tumor suppressor gene atau gen penekan tumor yang dapat menyebabkan terjadinya apoptosis (Pappa et al., 2006).
Aktivitas p53 dalam menghentikan siklus hidup sel terjadi pada fase GB1B.
Ketika terjadi kerusakan DNA, p53 akan menginduksi p21 untuk berikatan dan menginaktivasi cdk2 (cyclin-dependent kinase 2 yang berperan penting dalam tahap transisi fase GB1B/S), sehingga proses transisi dari fase GB1B ke fase S menjadi
DNA yang efektif, p53 akan memerintahkan sel untuk menjalani program bunuh diri atau apoptosis (Best, 2006).
B. Artemia 1. Keterangan zoologi
Artemia termasuk spesies Artemia salina LEACH yang merupakan anggota dari famili Artemiidae. Artemia biasa disebut juga dengan udang renik air asin dan memiliki nama asing brine shrimp. Artemia hidup dalam air laut yang berkadar garam tinggi (Mudjiman, 1989).
2. Tahap perkembangan larva artemia a. Telur
Istilah untuk telur artemia adalah siste, yaitu telur yang telah berkembang lebih lanjut menjadi embrio dan kemudian diselubungi oleh cangkang yang tebal dan kuat. Cangkang ini berguna untuk melindungi embrio terhadap pengaruh kekeringan, benturan keras, sinar ultra violet, dan mempermudah pengapungan (Mudjiman, 1989).
b. Burayak
Burayak tingkat I dinamakan instar I, tingkat II instar II, demikian seterusnya sampai instar XV dan menjadi artemia dewasa (Mudjiman, 1989).
Burayak yang baru saja menetas masih dalam tingkatan instar I. Bentuknya bulat lonjong dengan panjang sekitar 400 µm dan beratnya 15 µg. Warnanya kemerah-merahan karena masih banyak mengandung makanan cadangan. Oleh karena itu, mereka belum memerlukan makanan (Mudjiman, 1989).
Sekitar 24 jam setelah menetas, burayak akan berubah menjadi instar II. Lebih lama lagi akan berubah menjadi instar III. Pada tingkatan instar II, burayak sudah mempunyai mulut, saluran pencernaan, dan dubur. Oleh karena itu, mereka mulai mencari makanan. Bersamaan dengan itu, cadangan makanannya sudah mulai habis. Pengumpulan makanannya mereka lakukan dengan menggerak-gerakkan antena II-nya. Antena II tersebut juga berguna untuk bergerak. Tubuh instar II dan instar III sudah lebih panjang dari instar I (Mudjiman, 1989).
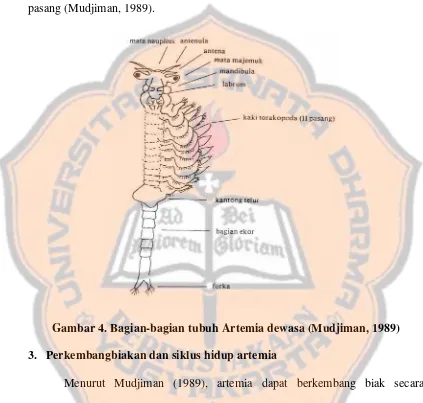
c.Artemia dewasa
Artemia dewasa bentuknya telah sempurna, dengan ukuran panjang sekitar 1 cm dan beratnya 10 mg. Torakopodanya yang sudah lengkap sebanyak 11 pasang (Mudjiman, 1989).
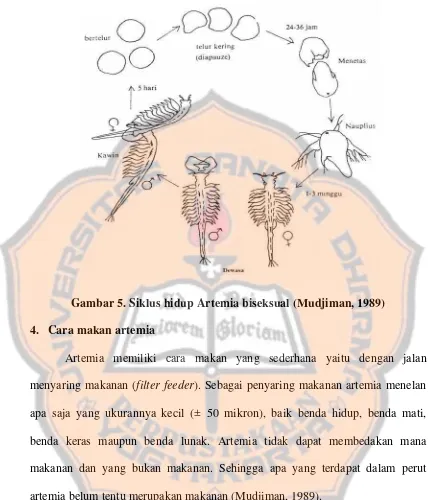
Gambar 4. Bagian-bagian tubuh Artemia dewasa (Mudjiman, 1989) 3. Perkembangbiakan dan siklus hidup artemia
Gambar 5. Siklus hidup Artemia biseksual (Mudjiman, 1989) 4. Cara makan artemia
Artemia memiliki cara makan yang sederhana yaitu dengan jalan menyaring makanan (filter feeder). Sebagai penyaring makanan artemia menelan apa saja yang ukurannya kecil (± 50 mikron), baik benda hidup, benda mati, benda keras maupun benda lunak. Artemia tidak dapat membedakan mana makanan dan yang bukan makanan. Sehingga apa yang terdapat dalam perut artemia belum tentu merupakan makanan (Mudjiman, 1989).
5. Lingkungan hidup artemia a. Suhu
Artemia tidak dapat bertahan hidup pada suhu kurang dari 6ºC atau lebih dari 35ºC. Namun, hal ini tergantung pada ras dan kebiasaan tempat hidupnya, untuk pertumbuhan artemia sebaiknya berkisar antara 25 - 30ºC (Mudjiman, 1989).
b. Kadar garam
Kadar garam memberikan pengaruh terhadap proses pertumbuhan siste. Pertumbuhan siste ternyata membutuhkan air yang kadar garamnya rendah yaitu berkisar antara 5 - 7 permil. Batas ini berlainan untuk tiap jenis artemia. Apabila kadar garam terlalu tinggi, maka siste tidak akan menetas karena tekanan osmosis di luar siste lebih tinggi, sehingga siste tidak dapat menyerap air yang cukup untuk proses metabolismenya (Mudjiman, 1989).
c. Oksigen terlarut
Artemia dapat menyesuaikan diri terhadap perubahan kadar oksigen terlarut. Pada kadar garam yang hanya 1 ppm (bagian per juta), artemia masih dapat bertahan. Sebaliknya, mereka pun dapat hidup pada kejenuhan oksigen lebih dari 150 persen (Mudjiman, 1989).
d. Asam basa (pH)
Siste banyak yang tidak menetas atau waktu penetasannya menjadi lebih panjang (Mudjiman, 1989).
C. Brine Shrimp Lethality Test (BST) 1. Pengertian BST
BST merupakan metode pengujian toksisitas suatu senyawa menggunakan hewan uji larva artemia. Prinsip metode ini adalah uji toksisitas akut terhadap larva artemia dengan penentuan nilai LCB50B setelah perlakuan 24 jam.
Metode BST sebenarnya tidak spesifik untuk antitumor namun metode BST memiliki manfaat untuk memonitor aktivitas sitotoksik senyawa dalam waktu yang singkat dan biaya yang cukup murah jika dibandingkan dengan pengujian sitotoksisitas dengan biakan sel kanker. Beberapa keuntungan lain dari metode BST yaitu peralatan yang digunakan sederhana dan tidak memerlukan kondisi yang steril, serta jumlah sampel yang dibutuhkan tidak terlalu banyak (Meyer et al., 1982).
2. Penggunaan Artemia salina LEACH pada metode BST
Artemia salina Leach digunakan untuk pengujian senyawa aktif biologis karena artemia mempunyai kesamaan dengan sistem enzim mamalia, misalnya tipe DNA-dependent RNA polymerase, dan ouabaine sensitive NaP
+
P
dan KP
+
P
Jenis molekul RNA yang dimaksud yaitu RNA messenger (mRNA) yang akan membawa pesan genetika dari DNA kebagian-bagian pensintesis protein dari sel tersebut. Pesan genetik yang dibawa oleh mRNA akan ditafsirkan oleh tRNA pada tahap translasi di dalam sitoplasma, tRNA juga akan mentransfer asam amino dari sitoplasma ke ribosom (Campbell, Recee, and Mitchell, 2002).
Tiap molekul tRNA akan menghubungkan kodon mRNA tertentu dengan asam amino tertentu, kemudian asam amino spesifik tersebut akan dibawa ke ujung rantai polipeptida yang sedang tumbuh di ribosom. Polipeptida akan dihubungkan dengan asam amino oleh ikatan peptida, rRNA berfungsi untuk mengkatalisis proses pembentukan ikatan peptida. Selama proses dan sesudah sintesisnya, suatu rantai polipeptida mulai menggulung dan melipat secara spontan membentuk protein fungsional dengan konformasi yang spesifik (Campbell et al., 2002).
Di dalam sel terdapat mekanisme transport ion NaP + mengontrol keseimbangan antara keluar dan masuknya ion NaP
+ diperlukan suatu protein membran plasma yang terdapat dalam jumlah yang cukup banyak pada neuron yang disebut pompa natrium-kalium (Corwin, 1996).
NaP
ATPase ditemukan dalam semua bagian tubuh manusia. NaP +
P
/KP +
P
ATPase mengkatalisis hidrolisis ATP ke ADP serta menggunakan tenaga untuk mengeluarkan 3 NaP ATP yang dihidrolisis, aktivitas NaP
+
P
/KP +
P
Pada hewan, pemeliharaan tekanan dan volume sel yang normal tergantung atas pompa NaP
+ sel menuruni perbedaan konsentrasinya, serta air akan mengikuti sepanjang perbedaan osmotik yang diciptakan sehingga menyebabkan sel membengkak (Ganong, 1995). Sel yang membengkak selanjutnya bisa mengalami lisis sehingga sel tersebut mati.
Artemia cukup akurat digunakan sebagai model sel kanker, hal ini telah dibuktikan melalui penelitian yang dilakukan oleh Carballo et al. Penelitian ini bertujuan untuk melihat sensitivitas larva artemia dalam mendeteksi aktivitas sitotoksik suatu ekstrak isopropanolik dari 14 jenis invertebrata laut dan 6 jenis makroalga. Sensitivitas larva artemia dibandingkan dengan sel kanker paru-paru dan sel kanker kolon.
Hasil penelitian tersebut menunjukkan bahwa ekstrak yang memiliki aktivitas sitotoksik yang cukup tinggi bahkan dapat mematikan sel kanker juga dapat memberikan efek yang sama pada larva artemia. Aktivitasnya yaitu dapat menghambat proses penetasan larva serta menyebabkan kematian larva dengan nilai persen kematian yang cukup tinggi. Salah satu contohnya yaitu ekstrak dari Pacifigorgia adamsii memiliki aktivitas sitotoksik 127% GI (growth inhibition) terhadap sel kanker paru-paru dan 86% GI terhadap sel kanker kolon, ekstrak ini dapat menghambat penetasan larva artemia sebesar 76% dan memberikan persen kematian yang cukup tinggi yaitu sebesar 68% (Carballo et al., 2002).
berumur 48 jam karena pada umur ini larva memiliki sensitivitas maksimal terhadap ekstrak yang memiliki aktivitas sitotoksik (Carballo et al., 2002).
Disamping artemia memiliki persamaan dengan mamalia, alasan lain digunakan artemia yaitu karena mudah didapatkan dan harganya murah serta tahan lama bila disimpan dalam bentuk telur kering. Namun, penggunaan hewan uji artemia juga memiliki kelemahan yaitu ketidakmampuan artemia mendeteksi senyawa yang dalam aktivitas fisiologisnya memerlukan aktivasi di dalam sel tubuh mamalia, misalnya senyawa 6-merkaptopurin (Solis et al., 1993).
D. Kanker 1. Pengertian kanker
Kanker dianggap sebagai penyebab kematian kedua setelah penyakit kardiovaskuler. Kanker dapat ditandai dengan pertumbuhan sel yang tidak terkontrol, kerusakan jaringan setempat dan sekitarnya, serta kanker dapat menyebar luas (Dipiro et al., 1997).
Dalam keadaan normal sel hanya akan membelah diri bila tubuh membutuhkan, misalnya ada sel-sel yang perlu diganti karena mati atau rusak. Sedangkan sel kanker akan membelah meskipun tidak diperlukan, sehingga terjadi sel-sel baru yang berlebihan. Sel-sel baru mempunyai sifat seperti induknya yang sakit yaitu sel-sel yang tidak mempunyai daya atur (Kuswibawati, 2000).
Biasanya apabila dilakukan pembedahan akan sembuh total. Tumor dikatakan ganas apabila menginvasi dan merusak organ tubuh lainnya yang masih sehat, serta akan mengalami metastasis (Anonim, 2005).
2. Karsinogenesis
Kanker atau neoplasma terbentuk dari sel yang mengalami perubahan mekanisme normal dalam mengontrol pertumbuhan dan proliferasi. Mekanisme terbentuknya kanker meliputi beberapa tahap yaitu
a. inisiasi
Tahap pemaparan substansi karsinogenik terhadap sel normal yang menyebabkan kerusakan genetik, apabila tidak diperbaiki akan menyebabkan mutasi seluler bersifat irreversibel.
b. promosi
Zat karsinogen atau faktor lain akan mengubah lingkungannya menjadi berpotensi untuk tumbuhnya sel mutasi dari pada sel normal. Perbedaan antara promosi dengan inisiasi yaitu pada tahap promosi bersifat reversibel. Hal ini yang menyebabkan kemoprevensi dapat dilakukan, diantaranya dengan perubahan gaya hidup dan diet.
c. progresi
E. Apoptosis
Apoptosis berbeda dengan nekrosis, nekrosis yaitu kematian sel yang terjadi karena kerusakan sel secara akut sedangkan apoptosis yaitu suatu program kematian sel. Apoptosis merupakan suatu proses biologi normal. Sebagai contoh pada saat pembentukan jari tangan dan jari kaki embrio, sel diantara jari-jari perlu melakukan proses apoptosis sehingga jari-jari bisa terpisah (Anonim, 2006).
Proses apoptosis masih kontroversial dan tidak mudah untuk mendefinisikannya. Apoptosis ditandai dengan kondensasi kromatin, penyusutan sitoplasma, dilatasi retikulum endoplasmik, dan pembengkakan membran. Sel yang telah mati akan difagositosis oleh makrofag (Henkart, 1999).
Berdasarkan hasil studi (Henkart, 1999), yang menstimuli proses apoptosis adalah kerusakan DNA. Apabila siklus sel mendeteksi ada DNA yang rusak di dalam sel, maka tumor suppressor gen yang disebut p53 akan menghentikan sel untuk membelah diri, hingga kerusakan DNA sudah diperbaiki. Apabila sel tidak dapat memperbaiki DNA yang rusak, p53 memerintahkan sel untuk menjalani program bunuh diri (progammed cell death atau apoptosis). Programmed cell death adalah bagian yang normal dari kehidupan sel, dan dikontrol secara ketat oleh banyak gen terutama oleh p53 (Anonim, 2005).
Tumor suppressor gen berfungsi sebagai pengatur pertumbuhan sel, apabila diaktifkan maka akan menghentikan siklus pembelahan sel, sehingga dapat mencegah pembelahan sel selanjutnya (Anonim, 2005). Di dalam sel kanker terdapat satu atau beberapa mutasi yang menghambat p53 menjalani tugasnya, sehingga p53 membiarkan sel melanjutkan pembelahan diri walaupun terdapat DNA yang rusak (Anonim, 2005). Apabila terjadi gangguan pada pengaturan p53 dapat merusak jalur apoptosis sehingga memungkinkan terbentuknya tumor (Anonim, 2007).
F. Siklus Sel
Gambar 7. Siklus Sel (Best, 2006)
Siklus sel dapat dibagi menjadi empat fase yaitu fase M, fase GB1B, fase S,
dan fase GB2B. Siklus sel dimulai dari fase M yang merupakan fase mitosis dimana
sel akan mengalami pembelahan. Fase GB1B merupakan growth phase yang pertama,
pada fase ini terjadi sintesis protein dan pertumbuhan sel untuk memperoleh ukuran sel yang normal sebelum membelah menjadi dua secara mitosis. Fase S merupakan fase terjadinya sintesis DNA (replikasi DNA) dalam persiapan pembelahan sel. Fase GB2B ditandai dengan perbaikan DNA yang rusak pada saat
replikasi DNA, dan terjadi persiapan untuk mitosis selanjutnya. Pada akhir fase GB1B, terdapat fase GB0B yang merupakan fase istirahat dalam siklus sel (Best, 2006).
G. Toksisitas
Toksisitas merupakan kemampuan suatu zat menyebabkan kerusakan (Katzung, 1989). Ketoksikan akut adalah derajat efek toksik sesuatu senyawa yang terjadi dalam waktu singkat setelah pemberiannya dalam dosis tunggal. Batasan waktu singkat disini adalah rentang waktu selama 24 jam setelah pemberian senyawa. Tujuan utama uji ketoksikan akut adalah untuk menetapkan potensi ketoksikan akut yang berupa tolok ukur ketoksikan kuantitatif (LDB50B/LCB50B) dan tolok ukur ketoksikan kualitatif (gejala klinis, wujud, dan
mekanisme efek toksik).
Dalam metode BST, yang ditetapkan adalah tolok ukur ketoksikan kuantitatif yaitu LCB50B. LCB50B (Lethal Concentration 50) merupakan konsentrasi
yang dapat menyebabkan kematian lima puluh persen hewan uji. Menurut Meyer et al. (1982), apabila harga LCB50B < 1000 µg/ml maka senyawa tersebut dapat
dikatakan bersifat toksik.
H. Kromatografi Lapis Tipis (KLT)
pengembang yang cocok. Pemisahan terjadi selama perambatan kapiler (pengembangan) (Stahl, 1973).
KLT dapat dipakai dengan dua tujuan, yaitu yang pertama dapat dipakai sebagai metode untuk mencapai hasil kualitatif, kuantitatif, atau preparatif. Sedangkan yang kedua dapat dipakai untuk menjajaki sistem pelarut dan sistem penyangga yang sesuai dengan sifat senyawa (Gritter, Bobbitt, & Schwarting, 1991). Metode ini memiliki beberapa keuntungan, yaitu hanya memerlukan perlengkapan yang sedikit, menggunakan waktu yang singkat untuk menyelesaikan analisis, memerlukan jumlah cuplikan yang sangat sedikit, hasil palsu yang disebabkan oleh komponen sekunder tidak mungkin terjadi, dan penanganannya sederhana (Stahl, 1973).
I. Landasan Teori
Brokoli (Brassica oleracea var. Italica) merupakan salah satu jenis sayuran yang memiliki aktivitas antikanker. Hal ini disebabkan antara lain oleh adanya alil isotiosianat dalam tanaman brokoli, alil isotiosianat bersifat sebagai antikanker karena dapat menginduksi jalur apoptosis serta dapat menghentikan pertumbuhan sel pada fase M dalam siklus hidup sel.
Metode BST digunakan untuk pengujian toksisitas akut senyawa yang memiliki aktivitas sebagai antikanker menggunakan hewan uji larva artemia. Larva artemia digunakan karena memiliki kesamaan sistem enzim dengan mamalia, misalnya tipe DNA-dependent RNA polymerase, dan ouabaine sensitive NaP
memiliki sensitivitas maksimal terhadap ekstrak yang memiliki aktivitas sitotoksik. Hubungan antara isotiosianat dengan kedua sistem enzim ini yaitu isotiosianat dapat menghambat aktifitas NaP
+
P
/ KP +
P
-ATPase.
Aktivitas alil isotiosianat dalam menginduksi apoptosis dan menghentikan siklus hidup sel, menyebabkan brokoli sangat mungkin bersifat toksik terhadap larva artemia. Oleh karena itu, dalam uji BST senyawa antikanker dalam brokoli dapat teramati dengan menghitung jumlah kematian larva artemia. Selanjutnya dapat dianalisis untuk mengetahui nilai LCB50B.
J. Hipotesis
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksperimental murni dengan menggunakan rancangan post test only control group design.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel penelitian
a. Variabel bebas
Variasi konsentrasi fraksi air yaitu 320; 580; 1000; 1900; dan 3400 µg/ml. b. Variabel tergantung
Jumlah kematian larva artemia akibat pemberian fraksi air brokoli dengan variasi konsentrasi.
c. Variabel pengacau terkendali
1) Subyek uji, meliputi umur larva atemia yaitu 48 jam.
2) Lingkungan tempat percobaan, yang meliputi cahaya untuk mempercepat proses penetasan larva artemia yaitu dengan sinar lampu 5 watt, pH air laut buatan antara 8 - 9, kadar garam 5 permil, dan komposisi air laut buatan.
2. Definisi operasional
b. Brokoli yang digunakan adalah bagian massa bunga brokoli (curd), massa bunga terdiri dari bakal bunga yang belum mekar, tersusun atas lebih dari 5.000 kuntum bunga dengan tangkai pendek.
c. Larva artemia yang digunakan sebagai hewan uji pada metode BST yaitu larva yang telah berumur 48 jam.
d. Larva artemia dikatakan mati jika larva tidak lagi memperlihatkan gerakan. e. Fraksi air merupakan bagian dari sari brokoli dalam pelarut air setelah
dipisahkan dari fraksi kloroform.
C. Bahan Penelitian 1. Bahan tanaman
Brokoli yang digunakan dalam penelitian ini merupakan tanaman budidaya dan diperoleh dari Ketep, Muntilan, Jawa Tengah pada bulan Februari 2006.
2. Bahan untuk BST
a. Telur artemia (Artemia, Viper)
b. Ragi sebagai makanan bagi larva artemia. c. Air laut buatan yang berkadar garam 5 permil. 3. Bahan untuk pembuatan air laut buatan (ALB)
NaCl, MgSOB4B, MgClB2B, CaClB2B, KCl, NaHCOB3B, dan aquadest yang diperoleh
dari laboratorium. 4. Bahan untuk KLT
Silika gel GFB254B (MERCK), n-butanol, n-propanol, asam asetat glasial, air,
D. Alat Penelitian 1. Alat untuk penyarian dan pengeringan
Vacuum rotary evaporator (Janke & Kunkel RV 05-ST), waterbath (Memmert), blender (National), labu takar (Pyrex), Beakerglass (Pyrex), corong pisah (Pyrex), gelas ukur (Pyrex), corong, batang pengaduk, kain, dan cawan porselen.
2. Alat untuk BST
Neraca analitik (Mettler Toledo AB 204), pipet volume 5 ml (Pyrex), mikropipet (Socorex), bak penetasan artemia (lokal), lampu 5 watt (Dop), aerator, pipet tetes, dan flakon.
3. Alat untuk ALB
Gelas ukur (Pyrex), Beakerglass (Pyrex), labu takar 1 liter (Pyrex), pengaduk, sendok, dan pH meter.
4. Alat untuk uji KLT
Pipa kapiler, lempeng kaca, gelas ukur, bejana kromatografi, atomizer, kertas saring, Oven (Memmert), lampu UV 254 nm dan UV 365 nm.
E. Tata Cara Penelitian 1. Determinasi tanaman
2. Pengumpulan bahan dan penyarian
Pemanenan brokoli dilakukan pada saat massa bunga sudah mencapai ukuran maksimal dan telah padat, tetapi kuncup bunganya belum mekar. Umur panen berkisar antara 60 - 90 hari setelah tanam, tergantung pada varietas tanaman.
Brokoli yang telah dikumpulkan dicuci menggunakan air mengalir dan dirajang kecil-kecil untuk dibuat jus, kemudian sebanyak 500 gram brokoli dimasukkan ke dalam blender dan ditambah 100 ml aquadest. Setelah dibuat jus, dilanjutkan dengan proses pemerasan dan penyaringan untuk memperoleh fraksi air. Fraksi air ini ditambah dengan kloroform kemudian dipisahkan menggunakan corong pisah, sehingga diperoleh fraksi air dan fraksi kloroform. Namun fraksi kloroform tidak digunakan. Fraksi air yang diperoleh, dipekatkan menggunakan vacum rotary evaporator kemudian diuapkan untuk mendapatkan fraksi kental. 3. Pembuatan air laut buatan
Tabel I. Komposisi Bahan Untuk Pembuatan Air Laut Buatan (ALB) (Mudjiman, 1989)
No. Nama Bahan Jumlah (gram)
1. Natrium klorida (NaCl) 5
2. Magnesium sulfat (MgSOB4B) 1,3
3. Magnesium klorida (MgClB2B) 1,0
4. Kalsium klorida (CaClB2B) 0,3
5. Kalium klorida (KCl) 0,2 6. Natrium hidrokarbonat
(NaHCOB3B)
2,0
7. Aquadest sampai 1 liter
4. Penetasan siste artemia
Siste artemia ditetaskan dengan media air laut buatan berkadar garam 5 permil. Artemia ditetaskan dalam bak penetasan artemia yang terdiri dari dua ruangan tidak sama besar yang disekat menjadi dua bagian, bagian terang dan bagian gelap, dengan lubang pada sekat 1 cm. Bagian gelap merupakan tempat siste artemia ditaburkan dan berukuran lebih kecil dari pada bagian terang. Bagian terang diberi penerangan lampu listrik. Siste menetas setelah kira-kira 24 - 36 jam, kemudian menjadi larva. Larva yang aktif akan bergerak menuju tempat yang terang melalui lubang pada sekat. Larva yang telah berumur 48 jam dan aktif inilah yang akan digunakan untuk uji BST.
5. Penentuan nilai LCB50B dengan metode BST
a. Pembuatan larutan stok
sebagai larutan A. Sedangkan larutan B dibuat dengan mengambil 1 ml dari larutan A dan dilarutkan dalam 10 ml metanol. Untuk membuat seri kadar, diambil 50 µl dari larutan B, 500 µl dari larutan B, dan 500 µl dari larutan A, sehingga didapatkan kadar 10, 100, dan 1000 µg/ml. Kontrol fraksi air yang digunakan yaitu metanol (Meyer et al., 1982).
Seri konsentrasi larutan stok dan kontrol yang telah diperoleh diuapkan diatas waterbath hingga kering, kemudian ditambah dengan air laut buatan yang telah diaerasi sebanyak 3 ml. Larva artemia yang telah berumur 48 jam (cirinya sudah berwarna kecoklatan) diambil secara random dan dimasukkan ke dalam flakon. Tambahkan air laut buatan hingga volume tepat 5 ml. Sebagai makanan larva artemia, ke dalam tiap-tiap flakon diberi satu tetes suspensi ragi (3 mg ragi dalam 5 ml air laut buatan). Flakon dijaga agar selalu mendapat penerangan. Setelah 24 jam, jumlah larva artemia yang mati dihitung untuk mengetahui besarnya nilai persen kematian. Pengulangan dilakukan sebanyak tiga kali.
b. Pembuatan larutan sampel
6. Identifikasi alil isotiosianat dengan metode KLT
Ekstrak kental fraksi air ditimbang sebanyak 50 mg dilarutkan dengan metanol p.a. hingga 10 ml, sehingga konsentrasi fraksi air 5 µg/µl. Dengan menggunakan pipet kapiler 5 µl, larutan tersebut ditotolkan pada plat KLT sebanyak 6 kali. Sebagai pembanding digunakan ekstrak bawang putih (Alii sativi Bulbus) dalam pelarut metanol. Cara membuat larutan pembanding yaitu dengan menimbang bawang putih sebanyak 1 gram kemudian direbus dalam 50 ml metanol selama 5 menit dan diamkan selama 1 jam dengan sekali-kali digojog. Bagian yang bening diambil, selanjutnya diuapkan hingga 5 ml. Plat KLT dimasukkan dalam bejana yang berisi fase gerak lalu dikembangkan sampai jarak rambat 10 cm, kemudian diangkat dan dikeringkan. Setelah itu dilakukan deteksi untuk memastikan letak dan warna bercak sampel serta pembandingnya. Deteksi dilakukan dengan menggunakan pereaksi ninhidrin yang disemprotkan pada plat KLT, kemudian dipanaskan pada suhu 110ºC selama 5 menit. Setelah itu diamati bercak yang timbul secara visible (secara langsung).
Fase diam : silika gel GFB254B (MERCK)
Fase gerak : n-butanol : n-propanol : asam asetat glasial : air (30:10:10:10, P
v
P
/BvB)
Pembanding : ekstrak bawang putih dalam pelarut metanol Deteksi : pereaksi ninhidrin
F. Analisis Hasil
Persentase kematian larva udang dapat diketahui dengan menggunakan rumus Abbot, hal ini dikarenakan pada kontrol terdapat kematian larva artemia.
% Kematian terkoreksi = x 100
kontrol pada kematian Persen
-100
kontrol pada kematian Persen
-teramati kematian Persen
(Kumar, Prasad, & Singh, 2005) Data persentase kematian larva artemia yang diperoleh selanjutnya dianalisis menggunakan probit untuk menentukan nilai LCB50B. Penentuan nilai LCB50B
dan perhitungan statistik dilakukan dengan menggunakan program statistik SPSS 10.00. Dalam uji BST suatu ekstrak dikatakan bersifat toksik apabila memiliki nilai LCB50B < 1000 µg/ml (Meyer et al., 1982). Adanya kandungan alil isotiosianat
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN
A. Determinasi Tanaman
Determinasi tanaman dilakukan untuk memastikan bahwa tanaman yang digunakan untuk penelitian adalah benar brokoli. Proses determinasi dilakukan dengan cara membandingkan habitus tanaman (yang terdiri dari akar, daun, curd, dan bunga) dengan kunci determinasi menurut Mills (2001).
Berdasarkan hasil determinasi tersebut maka dapat disimpulkan bahwa tanaman brokoli yang digunakan dalam penelitian ini memiliki nama botani Brassica oleracea var. italica.
B. Pengumpulan Bahan
C. Pembuatan Fraksi Air Brokoli
Brokoli dicuci dengan air mengalir untuk membersihkannya dari kotoran yang menempel, dan dirajang kecil-kecil untuk mempermudah pembuatan jus. Aquadest yang ditambahkan pada saat pembuatan jus dimaksudkan untuk mengambil senyawa yang larut dalam air, terutama adalah alil isotiosianat. Alil isotiosianat memiliki kelarutan yang cukup baik dalam air sehingga dibuat fraksi air yang diharapkan dapat menarik semua senyawa alil isotiosianat yang terdapat dalam brokoli. Pelarut kloroform ditambahkan untuk memisahkan senyawa-senyawa yang tidak dapat larut dalam pelarut air.
D. Pembuatan Air Laut Buatan
Siste artemia dapat menetas dengan baik pada lingkungan yang berkadar garam berkisar antara 5 - 7 permil, yang artinya dalam 1 ml aquadest mengandung 5 – 7 mg natrium klorida, sehingga air laut buatan yang dibuat juga harus memenuhi batas tersebut.
Selain kadar garam 5 permil, agar proses penetasan siste artemia baik maka perlu juga diperhatikan pH dari air laut buatan yang sebaiknya berkisar antara 8 - 9. Hal ini dikarenakan terjadinya pemecahan cangkang siste yang keras itu dibantu oleh kegiatan enzim. Kegiatan enzim tersebut memerlukan pH lebih dari 8 (antara 8 – 9), sehingga sebelum air laut buatan digunakan harus diperhatikan pH-nya menggunakan pH meter.
E. Penetasan Siste Artemia
Siste merupakan telur yang telah berkembang lebih lanjut menjadi embrio dan kemudian diselubungi oleh cangkang yang tebal dan kuat. Cangkang ini berguna untuk melindungi embrio terhadap pengaruh kekeringan, benturan keras, sinar ultra violet, dan mempermudah pengapungan. Oleh karena itu, siste sangat tahan menghadapi keadaan lingkungan yang buruk.
Untuk menetaskan siste artemia yang telah kering (kadar air kurang dari 10%) yang embrionya dalam keadaan diapauze (metabolisme terhenti sementara), perlu dilakukan perendaman. Siste direndam dalam air tawar selama kurang lebih 1 jam. Sesuai penjelasan Mudjiman (1989), saat larva direndam terjadi proses penyerapan air ke dalam siste yang berlangsung secara hiperosmotik, yaitu adanya tekanan osmosis di dalam telur yang lebih tinggi dari pada di luarnya. Selama satu jam siste akan menggembung dan diperkirakan kadar airnya telah mencapai lebih dari 65% sehingga metabolismenya telah aktif kembali.
meningkatkan kadar oksigen yang terkandung dalam air laut buatan yang berkadar garam 5 permil, sehingga siste dapat menetas dengan baik.
Siste yang telah ditiriskan dipindah ke dalam bak penetasan yang berisi air laut buatan. Bak penetasan terdiri dari dua bagian yaitu bagian gelap dan bagian terang yang dipisahkan oleh sebuah sekat yang bercelah. Bagian yang gelap ditutup dengan kaca yang berwarna gelap, sedangkan bagian terang ditutup dengan kaca bening agar cahaya lampu masih dapat masuk. Siste dimasukkan dalam bagian yang gelap, siste dapat menetas dalam waktu 24 – 36 jam. Setelah larva menetas, larva akan berpindah dari tempat yang gelap menuju tempat yang terang. Ini dikarenakan artemia memiliki sifat fototropik positif atau bergerak menuju ke arah cahaya.
Larva yang telah menetas dan berumur 48 jam diambil dengan memakai pipet tetes, kemudian dipindahkan ke dalam suatu tempat yang juga berisi air laut buatan berkadar garam 5 permil dan telah diaerasi. Hal ini dilakukan untuk mempertahankan kondisi larva yang telah berumur 48 jam serta untuk memudahkan pengambilan larva yang akan digunakan sebagai hewan percobaan. Larva artemia yang digunakan berumur 48 jam karena pada umur ini larva memiliki sensitivitas maksimal terhadap ekstrak yang memiliki aktivitas sitotoksik (Carballo et al., 2002).
sempurna sehingga mudah mati bukan karena senyawa toksik tapi karena tidak dapat beradaptasi denngan lingkungannya, sehingga kurang tepat digunakan sebagai hewan uji. Larva yang berumur 48 jam sebenarnya juga telah terselubungi membran namun masih sangat tipis, sehingga masih dapat ditembus oleh senyawa antikanker. Selain itu, larva yang berumur 48 jam berada pada tahap instar II dimana pada tahap ini larva sudah mulai memiliki saluran pencernaan. Senyawa antikanker dapat memasuki tubuh larva artemia melalui 2 cara yaitu menembus kulit dan melalui saluran pencernaan.
F. Penentuan Nilai LCB50B dengan Metode BST
Isotiosianat yang terdapat dalam brokoli merupakan senyawa kimia yang memiliki aktivitas antikanker. Menurut Katzung (2004) senyawa antikanker pada umumnya memiliki toksisitas tertentu. Untuk melihat toksisitas dari senyawa ini digunakan metode BST yang merupakan skrining awal terhadap senyawa antikanker. Metode ini menggunakan organisme uji berupa larva artemia.
Larva artemia ini digunakan karena memiliki kesamaan dengan sistem enzim pada mamalia, beberapa enzim itu antara lain tipe DNA-dependent RNA polymerase, dan ouabaine sensitive NaP
+
P
& KP
+
P
Alil isotiosianat merupakan salah satu senyawa yang termasuk dalam golongan isotiosianat, sehingga memiliki kesamaan aktivitas sebagai antikanker dengan isotiosianat secara umum. Breier et al. (1995) menyatakan bahwa isotiosianat dapat menghambat aktifitas enzim NaP
+ isotiosianat berpengaruh besar pada tempat ikatan ATP dari molekul enzim. NaP
-ATPase ditemukan dalam semua bagian badan mamalia, fungsi enzim ini yaitu untuk mengkatalisis hidrolisis ATP (adenosin trifosfatase) menjadi ADP (adenosin difosfat) serta menggunakan tenaga dari ATP untuk mengeluarkan 3 NaP
ke dalam sel. Penghambatan ikatan ATP oleh isotiosianat dapat mengganggu transport aktif pompa natrium dan kalium, karena apabila ATP tidak terbentuk maka tidak ada tenaga untuk menggerakkan pompa ion tersebut.
Isotiosianat memiliki kemampuan dalam menghentikan siklus hidup sel yaitu pada fase S (sintesis DNA) dan fase M (mitosis) dalam siklus hidup sel. Hal ini disebabkan oleh karena isotiosianat akan mengacaukan gelendong mitotik dalam proses mitosis sehingga pembelahan sel tidak dapat terjadi (Li Tang et al., 2006). Apabila siklus hidup sel berhenti, maka sel tidak dapat hidup sehingga diharapkan sel kanker yang dihentikan siklus hidupnya mengalami kematian.
akan menginduksi p53 yang merupakan protein penekan tumor sehingga p53 dapat memerintahkan sel untuk melakukan program bunuh diri.
Aktivitas p53 dalam menghentikan siklus hidup sel terjadi pada fase GB1B.
Ketika terjadi kerusakan DNA, p53 akan menginduksi p21 untuk berikatan dan menginaktivasi cdk2 (cyclin-dependent kinase 2) yang berperan penting dalam tahap transisi fase GB1B/S, sehingga proses transisi dari fase GB1B ke fase S menjadi
terhambat hingga terjadi perbaikan DNA. Namun apabila tidak terjadi perbaikan DNA yang efektif, p53 akan memerintahkan sel untuk menjalani program bunuh diri atau apoptosis (Best, 2006).
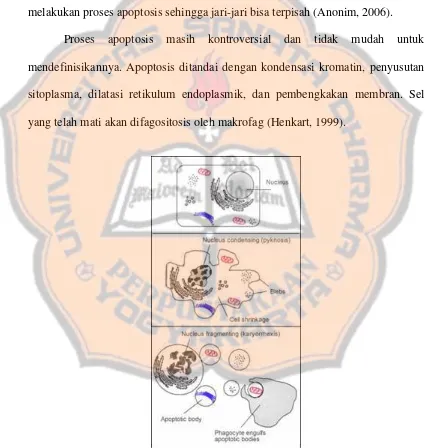
Menurut Best (2006), untuk mematikan sel, p53 menginduksi transkripsi beberapa gen yang meliputi apaf-1 (apoptosis protease-activating factor) dan protein BAX. Protein BAX terdapat pada mitokondria, dimana BAX akan melepaskan sitokrom c. Apaf-1 dan sitokrom c dapat membentuk caspase-9 yang menyebabkan terjadinya apoptosis (gambar 8).
Isotiosianat menginduksi p53
merusak gelendong mitotik induksi p21 apaf-1 BAX
apaf 1 sitokrom c menghambat fase M inaktivasi cdk2
mengambat fase GB1B/S caspase-9
menghentikan siklus sel apoptosis
SEL MATI
Gambar 8. Mekanisme aktivitas isotiosianat dalam mematikan sel
Isotiosianat diketahui dapat menyebabkan kematian sel, agar dapat mematikan sel maka isotiosianat harus dapat masuk ke dalam tubuh larva artemia melalui kulit larva yang belum terselubungi oleh karapak. Larva yang digunakan adalah larva yang berusia 48 jam dan termasuk pada tahap instar II, pada tahap ini larva belum terselubungi karapak. Isotiosianat dapat masuk dalam tubuh larva melalui mekanisme difusi pasif, dimana molekul-molekul isotiosianat akan bergerak melewati membran semipermeabel. Pada proses ini, molekul bergerak dari sisi yang kadarnya lebih tinggi menuju ke sisi lain yang kadarnya lebih rendah.
tersebut, juga dibutuhkan kontrol negatif yang tidak berisi sampel. Kontrol ini berfungsi untuk mengetahui bahwa larva artemia yang mati tidak disebabkan oleh pelarut yang digunakan, namun kematian larva artemia tersebut disebabkan oleh zat aktif yang terkandung dalam fraksi air.
Pelarut metanol diuapkan sehingga yang tersisa hanya fraksi kental saja yang berisi zat aktif. Dalam pembuatan seri konsentrasi fraksi air, digunakan pelarut metanol untuk mempercepat melarutnya fraksi air dalam bentuk kental dan mempercepat pula proses penguapan, karena jika tetap menggunakan air maka dibutuhkan waktu yang cukup lama. Pelarut metanol dipilih karena alil isotiosianat dalam brokoli selain larut dalam air juga memiliki kelarutan dalam metanol. Jadi alil isotiosianat masih tetap ada dalam pelarut metanol. Pelarut metanol juga digunakan sebagai kontrol negatif.
Pada saat pengambilan larva dapat terlihat larva yang masih sangat muda (baru menetas) dan yang sudah berumur 48 jam. Untuk membedakannya, larva yang telah berumur 48 jam akan berwarna agak kecoklatan sedangkan yang masih terlalu muda berwarna putih tipis. Maka larva yang diambil adalah larva artemia yang berwarna agak kecoklatan.
dalam timbunan makanan (Mudjiman, 1989) sehingga pemberian makanan untuk larva artemia cukup dengan satu tetes suspensi ragi.
Dalam menentukan nilai LCB50B dengan metode BST, waktu yang
dibutuhkan untuk menghitung jumlah kematian larva yaitu 24 jam. Maka setelah 24 jam dihitung persentase kematian pada tiap konsentrasi dan kontrol, larva dikatakan hidup apabila masih terlihat ada pergerakan. Berdasarkan data kematian larva artemia pada kontrol metanol dan sampel fraksi air brokoli (Lampiran 7 dan 8), dapat digunakan untuk menghitung besarnya persentase kematian larva artemia menggunakan rumus Abbot. Digunakan rumus Abbot karena pada kontrol masih terdapat kematian larva artemia. Dari hasil perhitungan (Lampiran 9), dapat diperoleh data persentase kematian (Tabel II).
Tabel II. Persentase Kematian Larva Artemia pada Berbagai Konsentrasi Fraksi Air
Persentase kematian yang diperoleh dari fraksi air ini memenuhi rentang yang diharapkan yaitu 20 - 80%. Dari data (tabel II), terlihat bahwa semakin tinggi konsentrasi larutan yang digunakan, maka makin besar pula persentase kematiannya.
dalam penentuan nilai LCB50B karena analisis probit dapat mengamati efek yang
terjadi dari suatu konsentrasi, selain itu dapat memberikan nilai regresi yang menghasilkan garis linear sehingga memudahkan dalam penentuan nilai LCB50B.
Pada analisis probit, konsentrasi sampel ditransformasikan menjadi log konsentrasi dan persen kematian dicari nilai probitnya. Konsentrasi sampel yang telah ditransformasikan ke dalam logaritma ditetapkan sebagai variabel tetap (absis). Sedangkan nilai probit dari setiap persentase kematian ditetapkan sebagai variabel terikat (ordinat).
Analisis probit ini dilakukan dengan menggunakan program SPSS. Setelah dianalisis dengan analisis probit, maka diperoleh persamaan garis linear untuk fraksi air yaitu y = 1,34939 x – 3,77872 (Gambar 9) dan dapat diketahui bahwa nilai LCB50B yang dihasilkan adalah 631 µg/ml (Lampiran 10).
Probit Transformed Responses
Dari kurva (gambar 9), dapat terlihat adanya hubungan antara konsentrasi dengan efek, dimana semakin tinggi konsentrasi larutan yang digunakan maka jumlah kematian larva artemia juga semakin meningkat. Hal ini digambarkan dalam kurva dengan semakin tinggi konsentrasi, makin tinggi pula nilai probit. Menurut Supranto (1986), dalam hal dua variabel Y dan X, koefisien determinasi Rsq digunakan untuk mengukur tingkat ketepatan dari regresi linier sederhana yaitu merupakan persentase sumbangan X terhadap variasi Y, sehingga dalam praktek Rsq lebih penting dari pada r.
Makin dekat Rsq dengan satu, makin tepat garis regresinya. Dari hasil analisis diperoleh nilai Rsq sebesar 0,9435. Nilai tersebut sudah mendekati satu sehingga dapat digunakan sebagai suatu kriteria untuk mengukur cocok tidaknya suatu garis regresi, dan selanjutnya digunakan untuk memperkirakan variabel terikat Y.
Meskipun nilai Rsq dianggap lebih penting dari pada r, namun nilai r masih dapat digunakan untuk memastikan kelinieritasan garis dengan cara membandingkan nilai r yang diperoleh dengan nilai r tabel. Apabila nilai r yang diperoleh lebih besar dari pada nilai r tabel, maka kurva tersebut dapat dikatakan linier. Nilai r pada fraksi air adalah 0,971 sedangkan nlai r tabel adalah 0,878. Dari data tersebut, dapat dikatakan bahwa kurva hubungan nilai probit versus log konsentrasi dari fraksi air brokoli adalah linier.
Dalam uji BST suatu ekstrak dikatakan bersifat toksik terhadap larva artemia apabila memiliki nilai LCB50B < 1000 µg/ml (Meyer et al., 1982). Dari hasil
demikian fraksi air brokoli dikatakan bersifat toksik sehingga diharapkan dapat memberikan efek sitotoksik terhadap sel kanker.
G. Uji Kualitatif Fraksi Air dengan Metode KLT
Identifikasi senyawa yang terkandung dalam brokoli dilakukan dengan uji KLT (Kromatografi Lapis Tipis). Uji KLT dilakukan dengan pembanding ekstrak bawang putih (Alii sativi Bulbus) dalam pelarut metanol. Bawang putih digunakan sebagai pembanding karena salah satu senyawa yang terkandung di dalamnya sama dengan brokoli yaitu alil isotiosianat. Oleh karena itu, profil KLT dari ekstrak bawang putih yang dihasilkan dapat digunakan sebagai pembanding untuk senyawa alil isotiosianat dalam brokoli.
Dalam uji kualitatif digunakan fase diam silika gel GFB254B. Silika gel GFB254B
merupakan silika gel yang mengandung gypsum (CaSOB4B) yang berfungsi sebagai
perekat agar silika gel lebih terikat pada lempeng pendukungnya, dan mengandung indikator fluoresensi yang dapat berfluoresensi pada panjang gelombang 254 nm. Sampel dan pembanding yang telah ditotolkan pada pelat KLT kemudian dideteksi secara langsung (visible).
warna dan Rf antara sampel dan pembanding yang diperoleh maka dapat diperkirakan bahwa senyawa tersebut adalah benar merupakan alil isotiosianat. Reaksi yang terjadi antara alil isotiosianat dengan pereaksi ninhidrin dapat dejelaskan pada gambar 11.
A B
Gambar 10. Kromatogram fraksi air brokoli untuk pemeriksaan senyawa alil isotiosianat
Keterangan :
Jarak pengembangan 10 cm.
Fase diam : Silika gel GFB254B (MERCK)
Fase gerak : n-butanol : n-propanol : asam asetat glasial : air (30:10:10:10, P
v
P
/BvB)
O
Tabel III. Hasil uji KLT fraksi air brokoli untuk pemeriksaan senyawa alil isotiosianat dengan fase diam silika gel GFB254B dan fase gerak
n-butanol : n-propanol : asam asetat glasial : air (30:10:10:10, P
v
Dari Gambar 10 dan Tabel III dapat terlihat 5 bercak yang muncul setelah proses pengembangan menggunakan fase gerak n–butanol, n–propanol, asam asetat glasial, dan air. Bercak yang muncul cukup banyak karena senyawa isotiosianat dan senyawa yang mengandung sulfur dalam brokoli maupun bawang putih bukan hanya alil isotiosianat saja namun masih ada beberapa senyawa lainnya. Dalam brokoli juga terdapat benzil isotiosianat, fenil isotiosianat, sulforafan, erusin, organosulfida, dan iberin, dalam bawang putih juga terdapat benzil isotiosianat, dialil sulfida, dan alil metil trisulfida.
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
1. Fraksi air brokoli memiliki efek toksik terhadap larva Artemia salina LEACH dengan nilai LCB50 Bsebesar 631 µg/ml.
2. Hasil KLT menunjukkan bahwa dalam fraksi air brokoli terkandung senyawa alil isotiosianat.
B. Saran
DAFTAR PUSTAKA
Anonim, 2001, The Merck Index, 13P th
P
edition, 312-313, Merck & Co., INC., New York.
Anonim, 2007, Apoptosis, HThttp://en.wikipedia.org/wiki/ApoptosisTH. Diakses pada
28 Januari 2007.
Balmer, C., and Valley, A.W., 1997, Basic Principles of Cancer Treatment and Cancer Chemotherapy in Dipiro, J.T., Talbert, R.L., Yee, G.C., Matzke, G.R., Wells, B.G., and Posey, L.M., (Eds.), Pharmacotherapy A Pathophysiologic Approach, third edition, 2403-2408, Appleton & Lange, Stamford.
Best, B., 2006, Cancer Death -- Causes & Prevention, HThttp://www.benbest.com/
health/cancer.htmlTH. Diakses pada 6 Desember 2006.
Breier, A., Ziegelhoffer, A., Stankovicova, T., Docolomansky,P., Gemeiner, P., and Vrbanova, A., 1995, Inhibition of (Na/K)-ATPase by electrophilic substances: functional implications, HThttp://www.ncbi.nlm.nih.gov/entrez/
query.fcgi?cmd=Retrieve&db=PubMed&list_uids=7494549&dopt=AbstractTH
Diakses pada 7 Maret 2007.
Campbell, N.A., Recee, J.B., and Mitchell, L.G., 2002, BIOLOGY, diterjemahkan oleh Rahayu Lestari, Edisi 5, Jilid 1, 322-328, Penerbit Erlangga, Jakarta. Chaulk, J. and Park, J., 2002, Artemia salina : The Common Brine Shrimp as A
Useful Biological Indicator, Environmental Science 1000, 1-5.
Corwin, J.E., 1996, Handbook of Pathophysiology, diterjemahkan oleh Brahm U. Pendit, 206, Penerbit Buku Kedokteran EGC, Jakarta.
Dalimartha, S., 2000, Atlas Tumbuhan Obat Indonesia, jilid 2, 25-27, Trubus Agriwidya, Jakarta.
Ganong, W.F., 1995, Buku Ajar Fisiologi Kedokteran, diterjemahkan oleh dr. Petrus Andrianto, Edisi 14, 27-29, Penerbit Buku Kedokteran EGC, Jakarta. Gollman, B., 2001, Phytopia’s Top 10, HThttp://www.phytopia.com/oldsite/
top10.htmTH. Diakses pada 8 Februari 2007.