KARBON TETRAKLORIDA (CCl
4)
SKRIPSI
Oleh :
RONY INDRAYANA
K 100 040 234
FAKULTAS FARMASI
UNIVERSITAS MUHAMMADIYAH SURAKARTA
SURAKARTA
i
SKRIPSI
Diajukan untuk memenuhi salah satu syarat mencapai
Derajat Sarjana Farmasi (S.Farm.) pada Fakultas Farmasi
Universitas Muhammadiyah Surakarta
di Surakarta
Oleh:
RONY INDRAYANA K 100040234
FAKULTAS FARMASI
UNIVERSITAS MUHAMMADIYAH SURAKARTA
SURAKARTA
ii
EFEK ANTIOKSIDAN EKSTRAK ETANOL 70% DAUN SALAM (Syzygium polyanthum [Wight.] Walp.) PADA SERUM DARAH TIKUS PUTIH JANTAN GALUR WISTAR YANG DIINDUKSI KARBON TETRAKLORIDA (CCl4)
Oleh :
RONY INDRAYANA K 100 040 234
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Muhammadiyah Surakarta
Pada tanggal : Juli 2008
Mengetahui Fakultas Farmasi
Universitas Muhammadiyah Surakarta Dekan,
Dra. Nurul Mutmainah, M.Si., Apt.
Pembimbing Utama, Pembimbing Pendamping,
Nurcahyanti W, M. Biomed., Apt. Rima Munawaroh, S.Si., Apt.
Penguji :
1. dr. Em Sutrisna, M. Kes. ____________
2. Wahyu Utami, M.Si., Apt. ___________
3. Nurcahyanti W, M. Biomed., Apt. ____________
iii
Bukankah Kami telah melapangkan dadamu?
Dan Kami telah menghilangkan bebanmu
Yang memberatkan punggungmu
Dan Kami tinggikan derajatmu
Karena sesungguhnya sesudah kesulitan itu ada kemudahan
Sesungguhnya sesudah kesulitan itu ada kemudahan
Maka apabila kamu telah selesai (dari suatu urusan),
kerjakanlah urusan yang lain dengan sungguh-sungguh
Dan kepada Tuhanmulah hendaknya kamu berharap.
(QS. Al-Insyirah : 1-8)
Sebuah persembahan terindah untuk: Ibu dan Bapak tercinta Sebagai ungkapan rasa terimakasih dan sembah baktiku untukmu
iv
yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu Perguruan
Tinggi, dan sepanjang pengetahuan saya juga tidak terdapat karya atau pendapat
yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu
dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, Juli 2008
Peneliti
v Assalaamu’alaikum wr. wb.
Alhamdulillah, puji syukur kehadirat Allah SWT Yang Maha Bijaksana atas
rahmat dan hidayah-Nya berupa kemampuan berfikir serta kekuatan bekerja
sehingga penulis dapat menyelesaikan skripsi berjudul Efek Antioksidan Ekstrak
Etanol 70% Daun Salam (Syzygium polyanthum [Wight.] Walp.) pada Serum Darah
Tikus Putih Jantan Galur Wistar yang Diinduksi Karbon Tetraklorida (CCl4)
.
Skripsiini disusun untuk memenuhi salah satu syarat mencapai gelar Sarjana Farmasi
Fakultas Farmasi Universitas Muhammadiyah Surakarta.
Keberhasilan dalam penyusunan skripsi ini tidak lepas dari dukungan serta
bantuan semua pihak. Pada kesempatan ini, penulis dengan penuh rasa hormat ingin
mengucapkan terima kasih kepada pihak-pihak yang telah ikut membantu jalannya
penelitian.
1. Dra. Nurul Mutmainah, M.Si., Apt., selaku Dekan Fakultas Farmasi Universitas
Muhammadiyah Surakarta.
2. Nurcahyanti Wahyuningtyas, M.Biomed., Apt., selaku dosen pembimbing utama,
atas keikhlasan dan kesabaran dalam membimbing, dorongan semangat serta
nasehatnya.
3. Rima Munawaroh, S.Si., Apt., selaku dosen pembimbing pendamping, atas
kesabaran, bantuan, dan arahan yang telah diberikan selama ini.
4. dr. Em Sutrisna, M.Kes., selaku dosen penguji I, atas kesabaran, bantuan, dan
vi penelitian.
7. Bapak dan Ibu yang telah membiayai dan selalu mendoakan penulis sampai
sekarang ini.
8. Handoko dan Wijayanti yang selalu menjadi teman seperjuangan dalam
penelitian ini.
9. Sahabat-sahabatku tercinta yang telah mau menampungku di rumah kontrakan
“Embrio”, Jamal, Arek, Fajri, Bang Pandi, Ucup, Gloyor, Mochin, Kesit Topan,
Gedang, Asep serta para pengunjung “Embrio”, Fay, Bledug, Enthong, Rinta,
Mey, Putri dan semua teman-teman yang tidak bisa disebutkan semuanya, terima
kasih telah memberikan semangat dan dukungan sehingga penulis dapat
menyelesaikan penelitian ini.
Penulis berusaha melakukan yang terbaik dalam penyusunan skripsi ini
namun sebagai manusia tidak lepas dari kekurangan. Karena itu, penulis mohon maaf
atas segala kekurangan yang ada. Semoga skripsi ini bermanfaat bagi pembaca
khususnya mahasiswa dan dapat dikembangkan secara luas kepada masyarakat.
Wassalamu’alaikum wr. wb.
Surakarta, Juli 2008
Penulis
vii
HALAMAN JUDUL... i
HALAMAN PENGESAHAN... ii
HALAMAN PERSEMBAHAN ... iii
HALAMAN DEKLARASI... iv
KATA PENGANTAR ... v
DAFTAR ISI ... vii
DAFTAR GAMBAR ... x
DAFTAR TABEL ... xi
DAFTAR LAMPIRAN ... xii
INTISARI... xiii
BAB I. PENDAHULUAN ... 1
A. Latar Belakang Masalah ... 1
B. Perumusan Masalah ... 4
C. Tujuan Penelitian ... 4
D. Tinjauan Pustaka ... 4
1. Tanaman Salam (Syzygium polyanthum [Wight.] Walp.) ... 4
2. Radikal bebas ... 6
3. Karbon tetraklorida ... 8
4. Antioksidan ... 11
viii
B. Definisi Operasional Penelitian ... 19
C. Bahan dan Alat ... 20
1. Bahan-bahan yang digunakan ... 20
2. Alat-alat yang digunakan ... 20
D. Jalannya Penelitian ... 21
1. Determinasi tanaman salam ... 21
2. Penyiapan bahan ... 21
3. Pembuatan ekstrak daun salam ... 21
4. Pembuatan sediaan ekstrak etanol daun salam ... 22
5. Penetapan dosis karbon tetraklorida ... 22
6. Pembuatan larutan karbon tetraklorida (CCl4) 11,2 % (v/v) . 22 7. Perhitungan dosis ekstrak daun salam ... 22
8. Penelitian pendahuluan ... 23
9. Perlakuan hewan uji ... 27
10. Pembuatan serum ... 29
11. Penetapan kadar MDA ... 29
12. Pengukuran kadar MDA ... 29
E. Cara Analisis……….31
BAB III. HASIL DAN PEMBAHASAN ... 32
ix
A. Kesimpulan ... 49
B. Saran ... 49
DAFTAR PUSTAKA ... 50
x
Gambar 1. Mekanisme Peroksidasi PUFA ... 10
Gambar 2. Mekanisme Reaksi Antara TBA dan MDA ... 11
Gambar 3. Skema Pembuatan Ekstrak etanol 70% Daun Salam ... 22
Gambar 4. Skema Orientasi Waktu Pemberian Toksik ... 25
Gambar 5. Skema Orientasi Waktu Optimal Pemberian Ekstrak Etanol 70% Daun Salam ... 26
Gambar 6. Skema Uji Efek Antioksidan Ekstrak Etanol 70% Daun Salam (Syzygium polyanthum [Wight.] Walp.) Dosis Tunggal pada Tikus Putih Jantan ... 28
Gambar 7. Skema Uji Efek Antioksidan Ekstrak Etanol 70% Daun Salam (Syzygium polyanthum [Wight.] Walp.) Dosis Berulang pada Tikus Putih Jantan ... 29
Gambar 8. Grafik Data Kadar MDA Darah pada Model Toksik ... 33
xi
Halaman
Tabel 1. Kurva Baku MDA ... 30
Tabel 2. Data Optimasi Waktu Pemberian Ekstrak 1,25 g/KgBB... 34
Tabel 3. Data Penurunan Kadar MDA pada Serum Darah Tikus Setelah Perlakuan dengan Dosis Tunggal ... 38
Tabel 4. Data Penurunan Kadar MDA pada Serum Darah Tikus Setelah Perlakuan dengan Dosis Berulang ... 39
Tabel 5. Hasil Uji Mann-Whitney Data Selisih Kadar MDA ... 42
Tabel 6. Persentase Penurunan Kadar MDA Setelah Diberi Ekstrak Dosis Tunggal ... 45
Tabel 7. Persentase Penurunan Kadar MDA Setelah Diberi Ekstrak Dosis Berulang ... 46
xii
Lampiran 1. Surat Keterangan Tikus Putih Jantan Galur Wistar ... 54
Lampiran 2. Surat Keterangan Hasil Determinasi Tanaman Salam (Syzygium polyanthum [Wight] Walp.) ... 55
Lampiran 3. Volume Pemberian Sediaan Uji ... 58
Lampiran 4. Perhitungan Kadar MDA ... 60
Lampiran 5. Hasil Uji Pendahuluan ... 63
Lampiran 6. Data Kurva Baku ... 64
Lampiran 7. Analisis Data Optimasi Waktu Pembentukan Toksik ... 72
Lampiran 8. Uji Distribusi Normal dan Homogenitas Data Kadar MDA pada Optimasi Pemberian Ekstrak ... 73
Lampiran 9. Uji One Way Anava Data Kadar MDA pada Optimasi Pemberian Ekstrak Hasil Transformasi dalam Bentuk Log... ... 74
Lampiran 10.Uji Distribusi Normal Data Kadar MDA dan Kuadrat Kadar MDA Dosis Tunggal dan Dosis Berulang... ... 75
Lampiran 11.Uji Kruskal-Wallis dan Mann-Whitney Data Kadar MDA Dosis Tunggal dan Dosis Berulang Efek Antioksidan Ekstrak Etanol 70 % Daun Salam ... 76
Lampiran 12.Hasil Uji Statistik Data Persentase Penurunan Kadar MDA ... 84
xiii
mengetahui efek antioksidan ekstrak etanol 70% daun salam pada serum darah tikus putih jantan galur Wistar yang diinduksi karbon tetraklorida (CCl4).
Penelitian ini merupakan penelitian eksperimental semu dengan rancangan penelitian acak lengkap pola searah dengan menggunakan 35 ekor tikus putih jantan dibagi menjadi 7 kelompok. Kelompok I (kontrol normal) diberi paraffin cair p.o 25,0 ml/KgBB. Kelompok II (kontrol toksik) diberi karbon tetraklorida 11,2 % (v/v) dengan volume pemberian 2,8 ml/KgBB p.o. Kelompok III (kontrol negatif) diberi CMC Na 0,5% p.o. Kelompok IV, V dan VI diberi ekstrak etanol 70% daun salam dengan variasi dosis berturut-turut 1,25 g/kgBB, 2,5 g/kgBB dan 5,0 g/kgBB secara peroral. Kelompok VII diberi perlakuan dengan ekstrak etanol 70% daun salam dosis 5,0 g/KgBB. Kelompok III-VI dibuat toksik dengan diinduksi karbon tetraklorida 2,8 ml/kgBB secara peroral bersamaan dengan pemberian masing-masing sediaan uji. Efek antioksidan diukur berdasar penurunan kadar malonaldehid (MDA) berupa penurunan absorbansi komplek MDA-TBA (thiobarbituric acid) yang dibaca pada panjang gelombang 520 nm.
Hasil uji statistik Mann-Whitney dengan taraf kepercayaan 95% menunjukkan bahwa sediaan ekstrak etanol 70% daun salam dosis 2,5 g/KgBB dan 5,0 g/KgBB pada pemberian dosis tunggal mempunyai efek antioksidan pada serum darah tikus putih jantan galur Wistar yang diinduksi karbon tetraklorida dosis 2,8 ml/KgBB. Ekstrak etanol 70% daun salam dosis 1,25 g/KgBB, 2,5 g/KgBB dan 5,0 g/KgBB pada pemberian dosis berulang juga memiliki efek antioksidan dengan besar yang sama (p > 0,05) pada serum darah tikus putih jantan galur Wistar yang diinduksi karbon tetraklorida dosis 2,8 ml/KgBB.
1
A. Latar Belakang Masalah
Dunia kesehatan saat ini semakin menaruh perhatian terhadap radikal bebas.
Hal ini dikarenakan semakin banyak bukti ilmiah yang mengindikasikan bahwa
radikal bebas dapat menyebabkan kerusakan DNA yang dapat menimbulkan
berbagai penyakit seperti diabetes dan kanker. Kerusakan DNA ini juga
menyebabkan gangguan sistem respon imun dan inflamasi jaringan (Desmarchelier
et al, 2005).
Radikal bebas merupakan molekul atau atom apa saja yang tidak stabil karena
memiliki satu atau lebih elektron yang tidak berpasangan. Radikal bebas ini
berbahaya karena amat reaktif mencari pasangan elektronnya. Radikal bebas yang
terbentuk dalam tubuh akan menghasilkan radikal bebas yang baru melalui reaksi
berantai yang akhirnya jumlahnya terus bertambah. Selanjutnya menyerang sel-sel
tubuh sehingga akan terjadi kerusakan jaringan (Sibuea, 2004). Tubuh secara
terus-menerus membentuk radikal oksigen dan spesies reaktif lainnya, terutama dihasilkan
oleh netrofil, makrofag dan sistem xantin oksidase (Khlifi et al, 2005). Radikal bebas
ini dibentuk melalui mekanisme metabolisme normal (Desmarchelier et al, 2005).
Senyawa radikal bebas tersebut timbul akibat berbagai proses kimia kompleks dalam
tubuh, berupa hasil sampingan dari proses oksidasi atau pembakaran sel yang
berlangsung pada waktu bernapas, metabolisme sel, olahraga yang berlebihan,
bermotor, asap rokok, bahan pencemar, dan radiasi matahari atau radiasi kosmis
(Karyadi, 1997). Makanan tertentu seperti makanan cepat saji (fastfood), makanan
kemasan, makanan kalengan juga berpotensi meninggalkan racun dalam tubuh
karena kandungan lemak, pengawet serta sumber radikal bebas (Sibuea, 2004).
Tubuh memerlukan antioksidan yang dapat membantu melindungi tubuh dari
serangan radikal bebas dengan meredam dampak negatif senyawa ini. Vitamin C dan
vitamin E telah digunakan secara luas sebagai antioksidan karena lebih aman dan
efek samping yang ditimbulkan lebih kecil dibandingkan antioksidan sintetik.
Antioksidan sintetik seperti BHA (butil hidroksi anisol) dan BHT (butil hidroksi
toluen) memiliki aktivitas antioksidan yang lebih tinggi dibandingkan vitamin C dan
vitamin E (Han et al., 2004), tetapi antioksidan sintesis ini dapat menimbulkan
karsinogenesis (Kikuzaki et al., 2002). Antioksidan dari tumbuhan dapat
menghalangi kerusakan oksidatif melalui reduksi dengan radikal bebas, membentuk
kelat dengan senyawa logam katalitik, dan menangkap oksigen (Khlifi et al, 2005).
Oleh karena itu diperlukan eksplorasi antioksidan alami untuk mendapatkan
antioksidan dengan tingkat keamanan dan aktivitas yang tinggi.
Daun salam (Syzygium polyanthum [Wight.] Walp.) mengandung minyak
atsiri (sitral dan eugenol), tanin dan flavonoid (Dalimartha, 2003). Komponen
fenolik yang terdapat dalam tumbuhan memiliki kemampuan mereduksi yang
berperan penting dalam menyerap dan menetralkan radikal bebas, dan dekomposisi
peroksid (Javanmardi, 2003).
Secara empiris daun salam digunakan oleh masyarakat untuk pengobatan
(Dalimartha, 2003). Alasan pemilihan daun salam karena pada penelitian
sebelumnya menyatakan bahwa ekstrak etanol daun salam dapat menurunkan kadar
glukosa darah, meningkatnya kadar glukosa dalam darah disebabkan oleh kerusakan
pankreas sehingga tidak dapat menghasilkan insulin, kerusakan pankreas ini dapat
disebabkan oleh senyawa radikal bebas yang merusak sel-sel pada pankreas sehingga
tidak dapat berfungsi (Studiawan, 2004). Alasan lain, daun salam (Syzygium
polyanthum ) merupakan tanaman satu genus dengan daun dewandaru (Eugenia
uniflora dengan sinonim Syzygium uniflora) yang menurut penelitian daun
dewandaru memiliki aktivitas sebagai antioksidan secara in vitro, dengan mekanisme
kerja menangkap radikal bebas. Hasil penelitian tersebut menunjukkan aktivitas
penangkap radikal pada ekstrak etanol, etil asetat dan kloroform dengan nilai IC50
berturut-turut 8,87; 12,01; dan 53,30 µg/ml (Utami dkk, 2005). Penelitian lain juga
menyatakan bahwa daun dewandaru (Eugenia uniflora Linn.) memiliki aktivitas
menangkap radikal bebas dengan nilai IC50 ekstrak heksana, kloroform, etil asetat
dan air masing-masing 13,0; 21,4; 1,3; dan 7,0 µg/ml (Velaquez et al., 2003).
Penelitian lain menyatakan infusa daun salam (Syzygium polyantha Wight.)
mempunyai aktivitas menurunkan kadar asam urat darah pada mencit putih jantan
yang diinduksi dengan potasium oxonat dosis 300 mg/kgBB. Infusadaun salam dosis
1,25g/kgBB, 2,5 g/kgBB dan 5,0 g/kgBB mampu menurunkan kadar asam urat darah
mencit jantan berturut-turut sebesar 54,30%, 76,22% dan 76,54%. Kemungkinan
kandungan flavonoid dari daun salam dapat menurunkan kadar asam urat dalam serum
menghambat kerja enzim xantin oksidase sehingga pembentukan asam urat terhambat
(Ariyanti, 2003).
Oleh sebab itu, perlu dibuktikan apakah daun salam yang satu genus dengan
daun dewandaru juga memiliki efek sebagai antioksidan, dibuktikan dengan efek
antioksidan daun salam terhadap CCl4 yang merupakan penyebab kerusakan sel.
B. Perumusan Masalah
Permasalahan yang ingin dipecahkan dalam penelitian ini adalah:
Apakah ekstrak daun salam (Syzygium polyanthum [Wight.] Walp.) pada dosis
tunggal dan berulang mempunyai aktivitas sebagai antioksidan secara in vivo pada
serum darah tikus putih jantan galur Wistar yang diinduksi karbon tetraklorida
(CCl4)?
C. Tujuan Penelitian
1. Membuktikan adanya efek antioksidan ekstrak etanol 70% daun salam dosis tunggal pada serum darah tikus putih jantan galur Wistar yang diinduksi dengan
karbon tetraklorida.
2. Membuktikan adanya efek antioksidan ekstrak etanol 70% daun salam dosis berulang pada serum darah tikus putih jantan galur Wistar yang diinduksi dengan
karbon tetraklorida.
a. Sistematika tanaman
Divisio : Spermatophyta
Subdivisio : Angiospermae
Class : Dicotyledoneae
Ordo : Myrtales
Familia : Myrtaceae
Genus : Syzygium
Species : Syzygium polyanthum (Wight) Walp.
(Backer and Van Den Brink, 1965).
b. Sinonim
Sinonim dari Syzygium polyanthum (Wight) Walp. adalah Eugenia polyantha
Wight., Eugenia lucidula Miq.(Tjitrosoepomo, 2002).
c. Nama daerah
Meselanagan, ubar serai (Melayu), gowok (Sunda), manting, salam (Jawa),
salam (Madura) (Dalimartha, 2003).
d. Morfologi tanaman
Salam tumbuh liar di hutan dan pegunungan, atau ditanam di pekarangan atau
disekitar rumah. Tanaman ini dapat ditemukan di dataran rendah sampai 1400 m dpl.
Salam merupakan pohon dengan tinggi mencapai 25 m, batang bulat,
permukaan licin, bertajuk rimbun dan berakar tunggang. Daun tunggal, letak
berhadapan, panjang tangkai daun 0,5-1 cm. Helaian daun berbentuk lonjong sampai
elips atau bundar telur sungsang, ujung meruncing pangkal runcing, tepi rata,
berwarna hijau muda, panjang 5-15 cm, lebar 3-8 cm, jika diremas berbau harum.
Bunga majemuk yang tersusun dalam malai yang keluar dari ujung ranting, berwarna
putih, baunya harum. Buahnya buah buni, bulat, diameter 8-9 mm, buah muda
berwarna hijau, setelah masak menjadi merah gelap, rasanya agak sepat. Biji bulat,
diameter sekitar 1 cm, berwarna coklat (Tjitrosoepomo, 2002).
e. Kandungan kimia
Daun salam mengandung saponin, triterpen, flavonoid, tanin, dan alkaloid.
Minyak atsiri dalam daun salam terdiri dari seskuiterpen, lakton dan fenol
(Soedarsono et al., 2002).
f. Manfaat tanaman
Secara empiris daun salam digunakan untuk obat pada penyakit diabetes,
jantung koroner, hipertensi, sakit maag dan diare (Dalimartha, 2003).
2. Radikal Bebas
a. Pengertian radikal bebas
Radikal bebas adalah atom atau gugus apa saja yang memiliki satu/lebih
elektron yang tidak berpasangan yang dapat bertindak sebagai akseptor elektron
(Zimmerman, 1978). Karena jumlah elektron ganjil, maka tidak semua elektron
dapat berpasangan. Suatu radikal bebas tidak bermuatan positif/negatif, maka spesi
semacam ini sangat reaktif karena adanya elektron tidak berpasangan (Fessenden and
Fessenden, 1986).
b. Sumber radikal bebas
Sumber radikal bebas dapat berasal dari dalam tubuh (endogenus) yang
karbohidrat dan lemak yang kita konsumsi. Radikal bebas dapat pula diperoleh dari
luar tubuh (eksogenus) yang berasal dari polusi udara, asap kendaraan bermotor, asap
rokok, berbagai bahan kimia, makanan yang terlalu hangus (carbonated) dan lain
sebagainya. Beberapa contoh radikal bebas antara lain: anion superoksida (2O2•),
radikal hidroksil (OH•), nitrit oksida (NO•), hidrogen peroksida (H2O2) dan
sebagainya (Windono dkk, 2000). Radikal bebas yang terbentuk di dalam tubuh akan
merusak beberapa target seperti lemak, protein, karbohidrat dan DNA (Halliwel et
al., 1995).
Anion superoksida adalah salah satu jenis radikal bebas. Radikal ini sering
terbentuk di dalam reaksi oksidasi sel (agen oksidasi). Radikal superoksid dapat
memproduksi jenis radikal bebas lainnya (Wang et al., 2003).
c. Mekanisme pembentukan radikal bebas
Reaksi pembentukan radikal bebas merupakan mekanisme biokimia tubuh
normal yang terjadi melalui reaksi yang langsung memutuskan ikatan atau melalui
transfer elektron (Halliwel and Gutridge, 2000). Radikal bebas lazimnya hanya
bersifat perantara yang bisa dengan cepat diubah menjadi substansi yang tidak lagi
membahayakan bagi tubuh. Namun, apabila radikal bebas bertemu dengan enzim
atau asam lemak tak jenuh ganda, maka merupakan awal dari kerusakan sel. Radikal
mampu menarik atom hidrogen dari suatu molekul disekitarnya. Pengaruh radiasi
ionisasi terhadap materi biologi akan menghasilkan radikal bebas hidroksil dan
radikal bebas lainnya, seperti radikal hidrogen yang siap berinteraksi dengan
Reaksi oksidasi lipid berlangsung dalam tiga tahap, yang pertama adalah
inisiasi yang mana suatu radikal lipid terbentuk dari molekul lipid menurut reaksi
RH→R●+H●. Pengurangan atom hidrogen oleh spesies reaktif seperti radikal hidroksil berperan dalam inisiasi oksidasi lipid.
Setelah inisiasi, reaksi propagasi (perambatan) terjadi yang mana dalam
reaksi propagasi ini radikal lipid diubah menjadi radikal lipid yang berbeda. Reaksi
ini umumnya melibatkan pengurangan atom hidrogen dari molekul lipid atau
penambahan atom oksigen pada radikal alkil.
R● + O₂→ ROO●
ROO● + RH → ROOH + R●
Tahap terakhir adalah reaksi terminasi. Dalam reaksi ini radikal bebas bergabung
untuk membentuk molekul dengan elektron berpasangan.
ROO● + ROO●→ ROOR + O2
ROO● + R●→ ROOR R● + R●→ RR
Prekusor molekular untuk memulai proses tersebut umumnya merupakan
produk hidroperoksida, sehingga peroksidasi lipid menyebabkan reaksi rantai dengan
berbagai efek yang potensial merusak sel-sel tubuh (Pokorni et al., 2001).
3. Karbon Tetraklorida
Karbon tetraklorida (CCl4) adalah cairan yang mudah terbakar, jernih, tidak
berwarna, sifat pelarutnya sama dengan kloroform. Dapat bercampur dengan alkohol,
eter, benzen dan pelarut organik lainnya, tetapi praktis tidak larut dalam air. Harus
Pertama kali dibuat tahun 1849 dan digunakan untuk anestesi, shampo kering
dan obat cacing. Namun kegunaan dalam rumah tangga telah ditinggalkan karena
toksisitasnya yang hebat dan hanya digunakan untuk industri, ilmu pengetahuan, dan
penggunaan non rumah tangga (Klassen, 2001).
Ingesti CCl4 secara oral dengan mudah diabsorbsi dari traktus
gastrointestinal, berlangsung secara lambat dan tidak mudah diramalkan. Absorbsi
ini mengalami peningkatan jika bersamaan dengan ingesti lemak dan alkohol (Fauci
et al., 1998). CCl4 dihimpun secara besar-besaran dalam lemak tubuh, hati, dan
sumsum tulang belakang. Pada hewan percobaan, penghirupan CCl4 diekskresikan
dalam 2-3 bulan, sekitar setengahnya hilang karena penguapan dan sisanya
dikeluarkan sebagai urea dan metabolit lain dalam urin dan feces (Klassen, 2001).
CCl4 diaktifkan oleh enzim sitokrom P-450 menjadi radikal bebas yang
reaktivitasnya tinggi. Pertama, CCl4 diubah menjadi bentuk radikal triklorometil
(CCl3•) dan kemudian menjadi radikal triklorometil peroksi (CCl3O2•) yang sangat
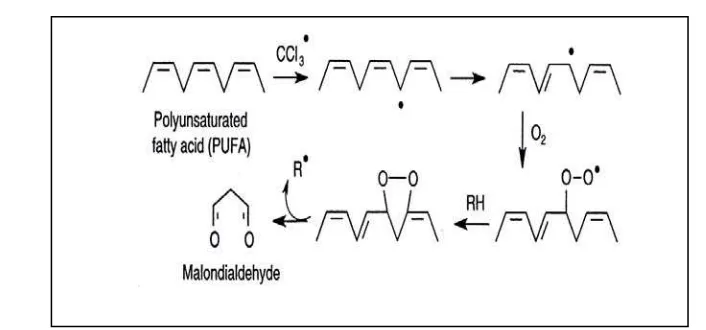
reaktif. Radikal ini dapat mengakibatkan peroksidasi PUFA (poly unsaturated fatty
acid) yang terdapat pada membran sel, sehingga menyebabkan kerusakan pada sel
(Hodgson and Levi, 2002). Produk utama dari peroksidasi PUFA diproduksi melalui
mekanisme radikal bebas. Proses ini diawali dengan inisiasi yang meliputi
pengambilan atom H dari PUFA oleh oksigen bebas yang terdapat pada CCl3O2•.
Stabilitas bentuk dari produk awal ini ditentukan oleh energi disosiasi ikatan antara
C-H. Ikatan ganda metilen pada PUFA lebih mudah teroksidasi daripada ikatan pada
monosaturated fatty acid. Reaksi selanjutnya adalah propagasi antara pentadienil
bereaksi dengan PUFA yang lain sehingga menghasilkan produk radikal baru.
Langkah selanjutnya adalah reaksi terminasi, yaitu kombinasi dua radikal menjadi
suatu produk non radikal. Mekanisme peroksidasi PUFA dapat dilihat pada gambar
1.
Gambar 1. Mekanisme Peroksidasi PUFA (Hodgson and Levi, 2002)
Peroksidasi PUFA tidak berhenti sampai disini, menurut penelitian masih ada
metabolit sekunder yang dihasilkan setelah peroksidasi PUFA. Salah satunya adalah
malondialdehyde (malonaldehyde, propanedial, MDA) yang merupakan hasil akhir
dari peroksidasi asam arakidonat dan beberapa PUFA yang lain (Josephy, 1997).
Pengukuran kinetika peroksidasi lipid secara in vitro dapat dilakukan dengan
mengukur berapa banyak oksigen yang dibutuhkan. Ada beberapa metode yang
dapat digunakan, salah satunya TBA (Thiobarbituric acid) reactivity test, yang dapat
dilakukan baik secara in vivo maupun in vitro. Tes ini didasarkan pada reaksi
kondensasi antara satu molekul MDA dengan dua molekul TBA pada kondisi asam.
Hasilnya adalah pigmen berwarna merah yang dapat diukur pada panjang gelombang
yang TBA 4. A a. P reakt men kard b. P perta 1) A s
g terjadi (
A dapat dil
Gambar Antioksid Pengertia Antiok tif/spesies cegah pen diovaskule Penggolon Tubuh ahanan ter Antioksid superoksid (Josephy, lihat pada
r 2. Meka
dan an antioks
ksidan me
s nitrogen
nyakit-pen
er, dan pen
ngan anti h memilik
rsebut dik
an prime
da dismut
1997). M
a gambar 2
anisme R sidan erupakan n reaktif nyakit yan nuaan (Ha ioksidan ki sistem kelompokk er, (antiok
tase (SOD
Mekanisme 2. Reaksi ant senyawa dan juga ng dihubu alliwell, B pertahana kan menja ksidan en D), katalas e pemben tara TBA yang da
radikal b
ungkan de
B. and Gut
an interna
adi 3 golo
ndogen/an
se dan glu
ntukan kom
A dan MD
apat meng bebas seh engan radi tteridge, J al terhada ongan: ntioksidan utation pe mpleks an DA (Josep
ghambat s
hingga an ikal bebas J.M.C, 20 ap radikal n enzimat eroksidase ntara MD phy, 1997) spesies ok ntioksidan
s seperti k
00).
l bebas. S
tis). Cont
e.
ini mampu menekan atau menghambat pembentukan radikal bebas dengan cara
memutus reaksi berantai dan mengubahnya menjadi produk lebih stabil. Reaksi
ini disebut sebagai chain-breaking-antioxidant.
2) Antioksidan sekunder (antioksidan eksogen atau antioksidan non enzimatis).
Contoh antioksidan sekunder ialah vitamin E, vitamin C, β-karoten, isoflavon, asam urat, bilirubin, dan albumin. Senyawa-senyawa ini dikenal sebagai
penangkap radikal bebas (scavenger free radical).
3) Antioksidan tersier, misalnya enzim DNA-repair dan metionin sulfoksida
reduktase yang berperan dalam perbaikan biomolekul yang dirusak oleh radikal
bebas (Winarsi, 2005).
Senyawa antioksidan sintesis seperti butil hidroksi anisol (BHA) dan butil
hidroksi toluen (BHT) bukan merupakan solusi untuk kontrol positif yang baik,
sebab pada pemaparan yang lama diketahui dapat mempengaruhi genetika sel-sel
tubuh (Poormorad et al., 2006).
c. Sumber antioksidan
Antioksidan sangat beragam jenisnya. Berdasarkan sumbernya antioksidan
dibagi dalam dua kelompok, yaitu antioksidan sintetik (antioksidan yang diperoleh
dari hasil sintesa reaksi kimia) dan antioksidan alami (antioksidan hasil ekstraksi
bahan alami).
1) Antioksidan sintetik
Diantara beberapa contoh antioksidan sintetik yang diijinkan untuk makanan,
ada lima antioksidan yang penggunaannya meluas dan menyebar di seluruh dunia,
hidroksi quinon (TBHQ) dan tokoferol. Antioksidan tersebut merupakan antioksidan
alami yang telah diproduksi secara sintesis untuk tujuan komersial (Pokorni et al.,
2001).
2) Antioksidan alami
Antioksidan alami di dalam makanan dapat berasal dari:
a) Senyawa antioksidan yang sudah ada dari satu atau dua komponen makanan
b) Senyawa antioksidan yang terbentuk dari reaksi-reaksi selama proses
pengolahan
c) Senyawa antioksidan yang diisolasi dari sumber alami dan ditambahkan ke
makanan.
Kebanyakan senyawa antioksidan yang diisolasi dari sumber alami adalah berasal
dari tumbuhan. Kingdom tumbuhan, Angiosperm memiliki kira-kira 200.000 sampai
300.000 spesies dan dari jumlah ini kurang lebih 400 spesies yang telah dikenal
dapat menjadi bahan pangan manusia. Isolasi antioksidan alami telah dilakukan dari
tumbuhan yang dapat dimakan, tetapi tidak selalu dari bagian yang dapat dimakan.
Antioksidan alami terbesar di beberapa bagian tanaman, seperti pada kayu, kulit
kayu, akar, daun, buah, biji, dan serbuk sari (Pokorni et al., 2001).
Senyawa antioksidan alami tumbuhan umumnya adalah senyawa fenolik atau
polifenolik yang dapat berupa golongan flavonoid, turunan asam sinamat, kumarin,
tokoferol dan asam-asam organik polifungsional. Golongan flavonoid yang memiliki
aktivitas antioksidan meliputi flavon, flavonol, isoflavon, kateksin, flavonol dan
klorogenat, dan lain-lain. Senyawa antioksidan polifenolik ini adalah multifungsional
dan dapat bereaksi sebagai:
a) Pereduksi
b) Penangkap radikal bebas
c) Pengkelat logam
d) Peredam terbentuknya singlet oksigen
Kira-kira 2% dari seluruh karbon yang difotosintesis oleh tumbuhan diubah menjadi
flavonoid atau senyawa yang berkaitan erat dengannya, sehingga flavonoid
merupakan salah satu golongan fenol alam terbesar. Lebih lanjut disebutkan bahwa
sebenarnya flavonoid terdapat dalam semua tumbuhan hijau, sehingga pastilah
ditemukan pula pada setiap telaah ekstrak tumbuhan. Kebanyakan dari golongan dan
senyawa yang berkaitan erat dengannya memiliki sifat-sifat antioksidan baik di
dalam lipida cair maupun dalam makanan berlipida (Pokorni et al., 2001).
d. Mekanisme kerja antioksidan
Oksidasi dapat dihambat oleh berbagai macam cara diantaranya mencegah
masuknya oksigen, penggunaan temperatur yang rendah, inaktivasi enzim yang
mengkatalis oksidasi, mengurangi tekanan oksigen dan penggunaan pengemas yang
sesuai. Cara lain untuk melindungi terhadap oksigen adalah dengan menggunakan
bahan tambahan spesifik yang dapat menghambat oksidasi yang secara tepat disebut
dengan penghambat oksidasi (oxidation inhibitor), tetapi baru-baru ini lebih sering
disebut antioksidan (Pokorni et al., 2001).
Penambahan antioksidan primer dengan konsentrasi rendah pada lipida dapat
tidak mempunyai cukup energi untuk dapat bereaksi dengan molekul lipida lain
membentuk radikal lipida baru.
Inisiasi : R● + AH → RH + A● Radikal lipida
Propagasi : ROO● + AH → ROOH + A●
Mekanisme yang paling penting adalah reaksi antara antioksidan dengan
radikal bebas (Gordon, 1990). Biasanya antioksidan bereaksi dengan radikal bebas
peroksil atau hidroksil yang terbentuk dari hidroperoksida yang berasal dari lipid.
Senyawa antioksidan lain dapat menstabilkan hidroperoksida menjadi senyawa non
radikal. Peruraian hidroperoksida dapat dikatalisis oleh logam berat akibatnya
senyawa-senyawa dapat mengkelat logam juga termasuk antioksidan. Beberapa
senyawa disebut sinergis karena senyawa tersebut dengan sendirinya tidak
mempunyai aktivitas antioksidan akan tetapi senyawa tersebut dapat meningkatkan
aktivitas antioksidan senyawa lain. Kelompok lain adalah senyawa-senyawa yang
mampu menguraikan hidroperoksida melalui jalur non radikal sehingga senyawa ini
dapat mengurangi kandungan radikal bebas (Pokorni et al., 2001).
5. Ekstraksi
Ekstraksi adalah penarikan zat pokok yang diinginkan dari bahan mentah obat
dan menggunakan pelarut yang dipilih dimana zat yang diinginkan dapat larut.
Bahan mentah obat yang berasal dari tumbuh-tumbuhan ataupun hewan tidak perlu
diproses lebih lanjut kecuali dikumpulkan atau dikeringkan. Tiap-tiap bahan mentah
obat disebut ekstrak, tidak mengandung hanya satu unsur saja tetapi berbagai unsur,
Ekstraksi atau penyarian merupakan peristiwa perpindahan masa zat aktif
yang semula berada dalam sel, ditarik oleh cairan penyari. Pada umumnya penyari
akan bertambah baik bila permukaan serbuk simplisia yang bersentuhan semakin
luas (Ansel, 1989).
Ekstrak adalah sediaan kering, kental atau cair yang dibuat dengan cara
menyari simplisia nabati atau hewani menurut cara yang cocok, diluar pengaruh
cahaya matahari langsung (Anonim, 1979). Ekstrak merupakan sediaan pekat yang
diperoleh dengan mengekstraksi zat aktif simplisia nabati dan hewani menggunakan
pelarut yang sesuai kemudian semua atau hampir semua pelarut diuapkan (Anonim,
1995).
Sistem pelarut yang digunakan dalam ekstraksi harus dipilih berdasarkan
kemampuannya dalam melarutkan jumlah yang maksimum dari zat aktif dan
seminimal mungkin bagi unsur yang tidak diinginkan (Ansel, 1989). Kriteria cairan
penyari yang baik haruslah memenuhi syarat antara lain:
a. Murah dan mudah diperoleh
b. Stabil secara fisika dan kimia
c. Bereaksi netral
d. Tidak mudah menguap dan tidak mudah terbakar
e. Selektif yaitu hanya menarik zat yang berkhasiat yang dikehendaki
f. Tidak mempengaruhi zat yang berkhasiat
g. Diperbolehkan oleh peraturan
Etanol 70% adalah campuran dua bahan pelarut yaitu etanol dan air dengan
kadar etanol 70% (v/v). Etanol tidak menyebabkan pembengkakan pada membran sel
dan memperbaiki stabilitas bahan obat terlarut. Keuntungan lainnya adalah sifatnya
yang mampu mengendapkan albumin dan menghambat kerja enzim. Etanol 70%
sangat efektif dalam menghasilkan jumlah bahan aktif yang optimal (Voight, 1984).
Maserasi (maserace = mengairi, melunakkan) adalah cara ekstraksi yang
paling sederhana. Bahan simplisia yang dihaluskan sesuai syarat-syarat farmakope
(umumnya terpotong-potong atau berupa serbuk kasar) disatukan dengan bahan
pengekstraksi. Selanjutnya rendaman tersebut disimpan terlindungi dari cahaya
langsung (mencegah reaksi yang dikatalisis cahaya atau perubahan warna) dan
dikocok kembali. Waktu maserasi pada umumnya 5 hari. Setelah waktu tersebut,
artinya keseimbangan antara bahan yang diekstraksi pada bagian dalam sel dengan
yang masuk dalam cairan telah tercapai. Dengan pengocokan dijamin keseimbangan
konsentrasi bahan ekstraksi lebih cepat dalam cairan. Keadaan diam selama maserasi
tidak memungkinkan terjadinya ekstraksi absolut. Semakin besar perbandingan
simplisia terhadap cairan pengekstraksi, akan semakin banyak yang diperoleh
(Voight, 1984).
Cairan penyari yang digunakan dapat berupa air, etanol, air-etanol atau
pelarut lain. Keuntungan cara penyarian dengan maserasi adalah cara pengerjaan dan
peralatan yang digunakan sederhana dan mudah diusahakan. Sedangkan kerugian
dari maserasi adalah pengerjaannya lama dan penyariannya kurang sempurna
Maserasi umumnya dilakukan dengan cara 10 bagian simplisia dengan
derajat halus yang cocok dimasukkan dalam bejana, kemudian dituangi dengan 75
bagian cairan penyari, ditutup dan dibiarkan selama 5 hari terlindung dari cahaya,
sambil berulang-ulang diaduk. Hasil penyarian dengan maserasi perlu dibiarkan
selama waktu tertentu. Waktu tersebut diperlukan untuk mengendapkan zat-zat yang
tidak diperlukan tetapi ikut terlarut dalam cairan penyari seperti malam dan lain-lain
(Anonim, 1986).
E. Keterangan Empiris
Diharapkan dari penelitian ini didapatkan data ilmiah tentang efek
antioksidan ekstrak etanol 70% daun salam (Syzygium polyanthum [Wight.] Walp.)
dosis tunggal dan dosis berulang pada tikus putih jantan galur Wistar yang diinduksi
19
BAB II
METODE PENELITIAN
A. Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental semu dengan rancangan
acak lengkap pola searah sebagai penelitian pendahuluan untuk mengetahui efek
antioksidan ekstrak etanol 70% daun salam.
B. Definisi Operasional Penelitian
Variabel dalam penelitian ini diklasifikasikan menjadi 3, yaitu :
1. Variabel bebas :
a. Konsentrasi ekstrak etanol 70% daun salam.
b. Dosis pemberian ekstrak etanol 70% daun salam.
2. Variabel tergantung :
Kadar MDA (malonaldehid) serum darah tikus putih jantan galur Wistar pada
jam ke-24 dan jam ke-48.
3. Variabel terkendali :
a. Tanaman Uji
Tanaman uji yang digunakan adalah daun salam yang sudah tua diperoleh
dari Desa Semail, Kelurahan Bangun Harjo, Kecamatan Sewon, Kabupaten
Bantul, D.I.Y.
Hewan uji yang digunakan adalah tikus putih jantan galur Wistar, umur 2-3
bulan, sehat dengan berat badan 100-200 gram.
c. Metode penyarian : maserasi.
d. Larutan penyari : etanol 70%.
e. Suhu pengeringan : 50oC–60oC.
C. Bahan dan Alat
1. Bahan yang digunakan :
a. Tanaman uji yang digunakan dalam penelitian adalah daun Salam yang sudah
tua, diperoleh dari Desa Semail, Kelurahan Bangun Harjo, Kecamatan Sewon,
Kabupaten Bantul, D.I.Y.
b. Hewan uji yang digunakan adalah tikus putih jantan galur Wistar dengan umur
2-3 bulan, sehat dengan berat badan 100-200 gram yang didapat dari Universitas
Muhammadiyah Surakarta.
c. Reagen yang digunakan adalah etanol 70%, karbon tetraklorida (CCl4), paraffin
cair, CMC Na 0,5%, 1, 1, 3, 3-tetrametoksipropan, aquadest, trichloro acetat
(TCA) dan thiobarbituric acid (TBA).
2. Alat yang digunakan :
Timbangan hewan (Ohaus), jarum peroral, spuit injeksi, holder tikus, ependorf,
sonifikator (Branson), spektrofotometer uv-vis (Shimadzu), mikropipet, kuvet,
penangas air, centrifuge, vortek, minispins (ependorf), mikropipet, timbangan
D. Jalannya Penelitian
1. Determinasi tanaman salam
Determinasi tanaman ini adalah untuk menetapkan kebenaran sampel
tanaman salam yang berkaitan dengan ciri-ciri makroskopis dengan mencocokkan
ciri-ciri morfologi tanaman terhadap pustaka. Tanaman ini dideterminasi di
laboratorium Fakultas Keguruan dan Ilmu Pendidikan Biologi Universitas
Muhammadiyah Surakarta.
2. Penyiapan bahan
Pengambilan daun salam dari Desa Semail, Kelurahan Bangun Harjo,
Kecamatan Sewon, Kabupaten Bantul, D.I.Y. Daun salam yang didapat dikeringkan
dengan cara dijemur di bawah sinar matahari dengan ditutup kain hitam. Kemudian
pengeringan dilanjutkan dengan oven 50oC - 60oC. Daun salam yang telah
dikeringkan diserbuk dengan cara diblender kemudian diayak dengan ayakan no.
100.
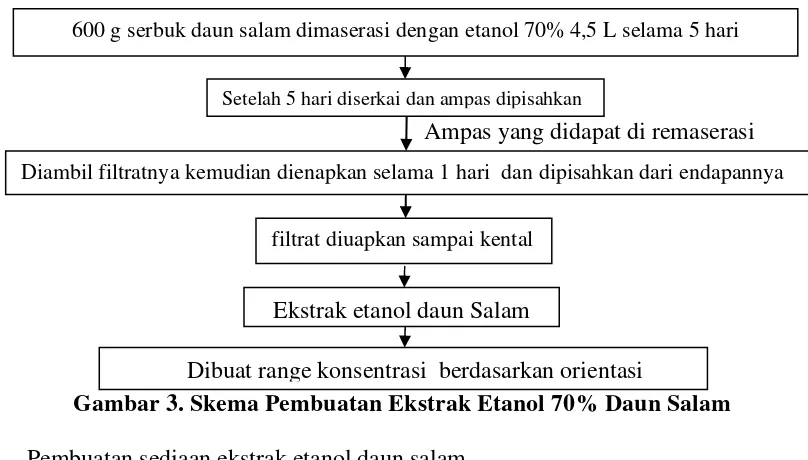
3. Pembuatan ekstrak daun salam
Pembuatan ekstrak etanol 70% daun salam menggunakan metode maserasi,
karena maserasi tidak memerlukan proses pemanasan sehingga dapat menghindari
rusaknya zat-zat dalam simplisia yang tidak tahan pemanasan. Kurang lebih 600
gram serbuk daun salam dimasukkan dalam panci kemudian diberi etanol 70%
sebanyak 7,5 kali serbuk daun salam (4,5 L). Kemudian diaduk-aduk, ditutup dan
didiamkan selama 5 hari ditempat terlindung cahaya, sambil berulang kali diaduk.
Setelah 5 hari filtrat diambil dengan cara disaring dengan kertas saring. Ampas yang
Ekstrak etanol daun Salam Setelah 5 hari diserkai dan ampas dipisahkan
Diambil filtratnya kemudian dienapkan selama 1 hari dan dipisahkan dari endapannya
filtrat diuapkan sampai kental
600 g serbuk daun salam dimaserasi dengan etanol 70% 4,5 L selama 5 hari
Dibuat range konsentrasi berdasarkan orientasi
memisahkan dari zat-zat yang mungkin masih terlarut seperti malam dan lain-lain.
Filtrat yang didapat diuapkan sampai menjadi ekstrak kental (Anonim, 1986). Secara
[image:36.612.118.522.188.418.2]skematis pembuatan ekstrak daun salam dapat dilihat pada gambar 3 dibawah ini.
Gambar 3. Skema Pembuatan Ekstrak Etanol 70% Daun Salam
4. Pembuatan sediaan ekstrak etanol daun salam
Ekstrak etanol 70% daun salam yang didapat dilarutkan dalam suspensi CMC
Na 0,5% sampai dosis yang diinginkan.
5. Penetapan dosis karbon tetraklorida (CCl4)
Pada penelitian ini dipilih dosis CCl4 (p.o) berdasarkan dosis toksiknya
terhadap tikus yaitu CCl4 konsentrasi 11,2% (v/v) dengan volume pemberian 2,8
ml/kgBB (Rosnalini, 1995).
6. Pembuatan larutan karbon tetraklorida (CCl4) 11,2% (v/v)
Sebanyak 11,2 ml CCl4 dilarutkan dalam parafin cair sampai 100 ml.
7. Perhitungan dosis ekstrak daun salam
Konsentrasi acuan (pada infusa) = 10% (b/v)
= 10 g/100 ml
Volume pemberian maksimal secara p.o pada tikus (200 g) = 10 ml
Volume pemberian = ½ x vol maksimal
= ½ x 10 ml = 5 ml
Dosis pemberian pada tikus (infusa) = 10 g/100 ml
= 0,5 g/5 ml
= 0,5 g/ 200 g BB
= 2,5 g/KgBB
Dosis ekstrak dihitung berdasarkan hasil perolehan rendemen (ekstrak kental)
Dari simplisia kering 600 g, diperoleh ekstrak kental 280,8 g, maka ekstrak
kental yang dihasilkan = 280,8 g/600 g x 100%
= 46,8%
Dosis ekstrak = 0,5 g x 46,8% = 0,234 g
= 0,234 g/ 200 g BB
= 234 mg/200 g BB = 1,17 g/KgBB
Setelah diperoleh dosis ekstrak kemudian diorientasikan pada tikus dan dibuat
menjadi peringkat dosis 1,25 g/KgBB, 2,5 g/KgBB, dan 5,0 g/KgBB.
8. Penelitian pendahuluan
a. Penetapan panjang gelombang maksimum
Sebanyak 2 ml aquadest ditambah 1 ml TCA 20% dan 2 ml TBA 0,67%
digunakan sebagai blanko. Sebagai standar digunakan 200 µl MDA baku ditambah
dengan aquadest sampai 2 ml kemudian ditambah 1 ml TCA 20% dan 2 ml TBA
0,67%. Larutan dicampur homogen dan dipanaskan pada air mendidih selama 10
menit, lalu didinginkan. Setelah dingin disentrifugasi pada 3000 rpm selama 10
spektrofotometer pada panjang gelombang 450-600 nm. Penentuan panjang
gelombang maksimum untuk menentukan panjang gelombang dengan serapan
tertinggi. Didapatkan panjang gelombang maksimum sebesar 520 nm.
b. Penentuan operating time (OT)
Sebanyak 2 ml aquadest ditambah 1 ml TCA 20% dan 2 ml TBA 0,67%
digunakan sebagai blanko. Sebagai standar digunakan 200 µl MDA baku ditambah
dengan aquadest sampai 2 ml kemudian ditambah 1 ml TCA 20% dan 2 ml TBA
0,67%. Larutan dicampur homogen dan dipanaskan pada air mendidih selama 10
menit, lalu didinginkan. Setelah dingin disentrifugasi pada 3000 rpm selama 10
menit. Supernatan berwarna merah muda diukur serapannya dengan
spektrofotometer uv-vis pada panjang gelombang 520 nm (berdasarkan panjang
gelombang MDA) dan dibaca pada menit ke 5, 10, 15, 20, 25, 30, 35, 40, 45, 50.
Penentuan operating time (OT) dimaksudkan untuk memperoleh waktu dengan
serapan yang paling stabil. Didapatkan operating time pada menit 30-35.
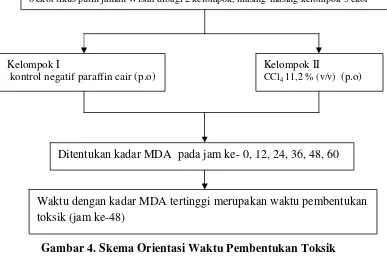
c. Penetapan waktu pembentukan toksik dari karbon tetraklorida (Gambar 4)
Pada penelitian ini dilakukan orientasi untuk menetapkan waktu pembentukan
toksik dari CCl4. Tikus sebanyak 6 ekor dibagi secara acak menjadi 2 kelompok,
masing-masing kelompok terdiri dari 3 tikus. Kelompok pertama diberi larutan
parafin cair sebagai kontrol negatif sedangkan kelompok kedua diberi perlakuan
dengan larutan CCl4 11,2 % (v/v) (p.o). Sebelum diberi perlakuan, tikus dipuasakan
terlebih dahulu selama ± 18 jam dengan tetap diberi air minum. Dilihat kadar MDA
perlakuan. Waktu dengan kadar MDA tertinggi merupakan waktu maksimal
[image:39.612.129.516.183.440.2]terbentuknya toksik, dan didapatkan hasilnya pada jam ke-48.
Gambar 4. Skema Orientasi Waktu Pembentukan Toksik
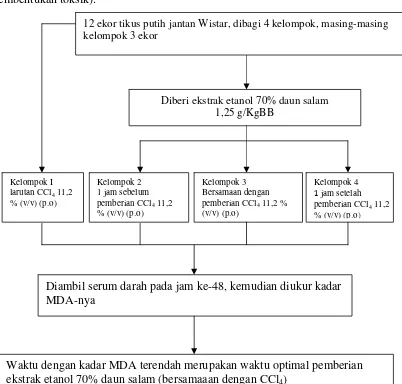
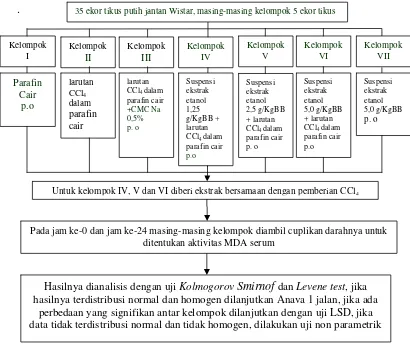
d. Optimasi waktu pemberian ekstrak etanol 70% daun salam (Gambar 5)
Pada penelitian ini dilakukan orientasi untuk menetapkan waktu optimal
pemberian ekstrak etanol 70% daun salam. Dua belas ekor tikus dibagi secara acak
menjadi 4 kelompok, masing-masing kelompok terdiri dari 3 tikus. Kelompok
pertama diberi larutan CCl4 11,2 % (v/v), kelompok kedua diberi ekstrak etanol 70%
daun salam dosis 1,25 g/KgBB 1 jam sebelum pemberian CCl4, kelompok ketiga
diberi ekstrak etanol daun salam bersamaan dengan pemberian larutan CCl4,
kelompok keempat diberi ekstrak etanol 70% daun salam 1 jam setelah pemberian
larutan CCl4. Pada jam ke-48 (hasil orientasi pembentukan toksik) diambil serum
darah kemudian dihitung kadar MDA-nya. Waktu dengan kadar MDA terendah 6 ekor tikus putih jantan Wistar dibagi 2 kelompok, masing-masing kelompok 3 ekor
Kelompok I
kontrol negatif paraffin cair (p.o)
Kelompok II
CCl4 11,2 % (v/v) (p.o)
Ditentukan kadar MDA pada jam ke- 0, 12, 24, 36, 48, 60
merupakan waktu optimal pemberian ekstrak etanol 70% daun salam, dan didapatkan
pada saat waktu bersamaan pemberian karbon tetraklorida.
e. Penetapan waktu pengambilan serum.
Waktu pengambilan serum darah didasarkan atas hasil orientasi. Pengambilan
serum darah pertama dilakukan pada jam ke-0, yaitu 1 jam sebelum waktu pemberian
ekstrak, kemudian diambil kembali serum darah kedua diambil sesaat sebelum
pemberian ekstrak kedua dan serum darah ketiga diambil pada jam ke-48 (waktu
[image:40.612.121.523.315.699.2]pembentukan toksik).
Gambar 5. Skema Orientasi Waktu Optimal Pemberian Ekstrak Etanol 70% Daun Salam
Kelompok I larutan CCl4 11,2
% (v/v) (p.o)
Diberi ekstrak etanol 70% daun salam 1,25 g/KgBB
Kelompok 2 1 jam sebelum pemberian CCl4 11,2
% (v/v) (p.o)
Kelompok 3 Bersamaan dengan pemberian CCl4 11,2 %
(v/v) (p.o)
Waktu dengan kadar MDA terendah merupakan waktu optimal pemberian ekstrak etanol 70% daun salam (bersamaaan dengan CCl4)
Diambil serum darah pada jam ke-48, kemudian diukur kadar MDA-nya
Kelompok 4 1 jam setelah pemberian CCl4 11,2
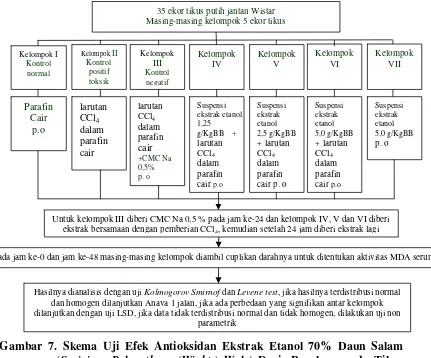
9. Perlakuan hewan uji
Hewan uji sebanyak 35 ekor dibagi menjadi 7 kelompok perlakuan. Setiap
perlakuan terdiri dari 5 ekor tikus. Sebelum percobaan dilakukan, tikus diadaptasikan
dengan kondisi laboratorium selama 7 hari untuk menghindari stress pada hewan uji
pada saat perlakuan. Satu hari sebelum perlakuan semua tikus dipuasakan kira-kira
18 jam, dengan tetap diberikan air minum. Hal ini dilakukan untuk menyamakan
kondisi hewan uji dan mengurangi pengaruh makanan yang diberikan terhadap
sediaan uji yang diberikan. Pembagian kelompok adalah sebagai berikut :
a. Dosis tunggal
Kelompok I : Diberi parafin cair sebagai kontrol normal (p.o)
Kelompok II : Diberi larutan CCl4 dalam parafin cair sebagai kontrol toksik
(p.o)
Kelompok III : Diberi larutan CCl4 dalam parafin cair + CMC Na 0,5 %
sebagai kontrol negatif (p.o)
Kelompok IV : Diberi suspensi ekstrak etanol daun Salam dosis 1,25 g/KgBB
+ larutan CCl4 dalam parafin cair(p.o)
Kelompok V : Diberi suspensi ekstrak etanol daun Salam dosis 2,5 g/KgBB +
larutan CCl4 dalam parafin cair(p.o)
Kelompok VI : Diberi suspensi ekstrak etanol daun Salam dosis 5,0 g/KgBB +
larutan CCl4 dalam parafin cair (p.o)
Kelompok VII : Diberi suspensi ekstrak etanol daun Salam dosis 5,0 g/KgBB
Hewan uji diambil darahnya pada jam ke-0 dan jam ke-24 untuk diukur kadar
MDA serumnya. Skema uji dapat dilihat pada gambar 6.
[image:42.612.132.542.167.525.2].
Gambar 6. Skema Uji Efek Antioksidan Ekstrak Etanol 70% Daun Salam (Syzigium Polyanthum (Wight.) Walp) Dosis Tunggal pada Tikus Putih Jantan Galur Wistar
b. Dosis berulang
Pada kelompok dengan perlakuan dosis berulang, hewan uji diberi perlakuan
sama seperti diatas, kemudian pada hari ke-2 (jam ke-24) diberi ekstrak lagi dengan
peringkat dosis sama seperti diatas. Pengambilan darah dilakukan pada jam ke-0 dan
jam ke-48, kemudian diukur kadar MDA serumnya. Hal tersebut dapat dilihat pada
gambar 7 berikut ini. Kelompok I Kelompok II Kelompok III Kelompok IV Kelompok V Parafin Cair p.o larutan CCl4 dalam parafin cair larutan CCl4 dalam
parafin cair +CMC Na 0,5% p. o Suspensi ekstrak etanol 1,25 g/KgBB +
larutan CCl4 dalam
parafin cair p.o Suspensi ekstrak etanol 2,5 g/KgBB + larutan CCl4 dalam
parafin cair p. o
Untuk kelompok IV, V dan VI diberi ekstrak bersamaan dengan pemberian CCl4
Kelompok VI Suspensi ekstrak etanol 5,0 g/KgBB + larutan CCl4 dalam
parafin cair p.o Kelompok VII Suspensi ekstrak etanol 5,0 g/KgBB p. o
Pada jam ke-0 dan jam ke-24 masing-masing kelompok diambil cuplikan darahnya untuk ditentukan aktivitas MDA serum
35 ekor tikus putih jantan Wistar, masing-masing kelompok 5 ekor tikus
Hasilnya dianalisis dengan uji Kolmogorov Smirnof dan Levene test, jika hasilnya terdistribusi normal dan homogen dilanjutkan Anava 1 jalan, jika ada
Gambar 7. Skema Uji Efek Antioksidan Ekstrak Etanol 70% Daun Salam (Syzigium Polyanthum (Wight.) Walp) Dosis Berulang pada Tikus Putih Jantan Galur Wistar
10. Pembuatan serum
Serum dibuat dengan cara menggores vena lateralis ekor tikus, darah yang
keluar ditampung dalam ependorf sebanyak 1 ml. Darah disentrifugasi 3000 rpm
selama 10 menit untuk mendapatkan serum yang akan digunakan dalam penetapan
kadar MDA plasma. (Apabila perlu serum dapat disimpan dalam temperatur -20oC
maksimal 1 bulan sampai dilakukan pemeriksaan tersebut).
11. Penetapan kadar MDA
Kadar MDA diukur pada serum darah menurut metode Wills (1987). Dua
ratus mikroliter serum ditambah aquades sampai 2 ml. Kemudian ditambahkan 1 ml
Kelompok I
Kontrol normal
Kelompok II Kontrol positif toksik Kelompok III Kontrol negatif Kelompok IV Kelompok V Parafin Cair p.o larutan CCl4 dalam parafin cair larutan CCl4 dalam parafin cair +CMC Na 0,5% p. o Suspensi ekstrak etanol 1,25 g/KgBB +
larutan CCl4 dalam parafin cairp.o Suspensi ekstrak etanol 2,5 g/KgBB +larutan CCl4 dalam parafin cair p. o
Untuk kelompok III diberi CMC Na 0,5 % pada jam ke-24 dan kelompok IV, V dan VI diberi ekstrak bersamaan dengan pemberian CCl4, kemudian setelah 24 jam diberi ekstrak lagi
Hasilnya dianalisis dengan uji Kolmogorov Smirnof dan Levene test, jika hasilnya terdistribusi normal dan homogen dilanjutkan Anava 1 jalan, jika ada perbedaan yang signifikan antar kelompok dilanjutkan dengan uji LSD, jika data tidak terdistribusi normal dan tidak homogen, dilakukan uji non
parametrik Kelompok VI Suspensi ekstrak etanol 5,0 g/KgBB +larutan CCl4 dalam parafin cair p.o
Kelompok VII Suspensi ekstrak etanol 5,0 g/KgBB p. o
Pada jam ke-0 dan jam ke-48 masing-masing kelompok diambil cuplikan darahnya untuk ditentukan aktivitas MDA serum
TCA 20% dan 2 ml TBA 0,67%. Larutan dicampur homogen dan dipanaskan pada
air mendidih selama 10 menit, lalu didinginkan. Setelah dingin disentrifugasi pada
3000 rpm selama 10 menit. Supernatan berwarna merah muda diukur serapannya
dengan spektrofotometer pada panjang gelombang 520 nm dan didiamkan selama 30
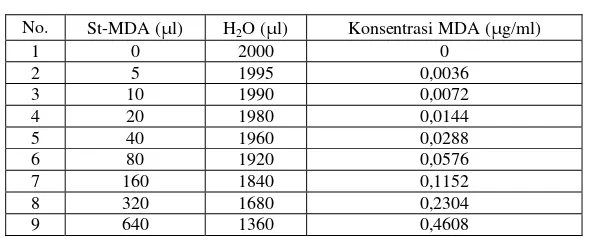
menit (OT). Kadar MDA dihitung menggunakan kurva baku MDA dengan
konsentrasi 0,00; 0,0036; 0,0072; 0,0144; 0,0288; 0,0576; 0,1152; 0,2304 dan 0,4608
μg/ml. Kurva baku selalu dibuat baru setiap pengukuran MDA.
12. Pengukuran kadar MDA
Derajad peroksidasi lipid dapat ditentukan dengan mengukur kadar
malonaldehid (MDA) dalam serum darah. Dasar pengukurannya adalah reaksi antara
MDA dengan TBA menghasilkan senyawa kompleks MDA-TBA berwarna merah
muda yang dapat diukur serapannya pada panjang gelombang 520 nm.
a. Penyiapan reagen:
TCA 20%: 20,0 g TCA dilarutkan dalam 100 ml aquadest.
TBA 0,67%: 0,67 g TBA dilarutkan dalam 100 ml aquadest.
b. Pembuatan larutan standar MDA (kurva baku MDA):
Standar MDA hasil hidrolisis 1, 1, 3, 3-tetrametoksipropan = 3,593 μg/ml.
[image:44.612.172.468.632.751.2]Perhitungan kadar MDA tersaji pada lampiran 4.
Tabel 1. Kurva baku MDA
No. St-MDA (μl) H2O (μl) Konsentrasi MDA (μg/ml)
1 0 2000 0
2 5 1995 0,0036
3 10 1990 0,0072
4 20 1980 0,0144
5 40 1960 0,0288
6 80 1920 0,0576
7 160 1840 0,1152
8 320 1680 0,2304
c. Menghitung persamaan regresi Y = a + bX, dimana Y adalah nilai serapan dan X
adalah konsentrasi standar.
Menghitung koefisien korelasi (r) dari data Y dan X.
a = (ΣY – bΣX) / n
b = (nΣXY – ΣXΣY) / n X2 – (ΣX)2
r = (nΣXY – ΣXΣY) /
√
{n
ΣX2 –(ΣX)2} {nΣY2 – (ΣY)2}kadar MDA dari sampel dihitung berdasar persamaan regresi yang diperoleh.
E. Cara Analisis
Data yang diperoleh dari penelitian berupa selisih kadar MDA dan persen
penurunan kadar MDA terhadap kontrol positif dalam darah pada jam ke-24 dan jam
ke-48. Data tersebut dianalisa distribusi normalnya menggunakan metode
Kolmogorov-Smirnov dan juga homogenitasnya dengan Levene test. Jika data
tersebut normal dan homogen, maka analisa dilanjutkan dengan ANAVA (Analisis of
Varian) dengan taraf kepercayaan 95%. Apabila hasilnya berbeda bermakna maka
analisa dilanjutkan dengan uji LSD dengan taraf kepercayaan 95% pula. Namun
apabila data tidak terdistribusi normal dan tidak homogen, data tersebut dianalisa
secara nonparametrik dengan metode Kruskall-Wallis dengan taraf kepercayaan 95%
dan apabila hasilnya berbeda bermakna dilanjutkan dengan uji berganda
Mann-Withney dengan taraf kepercayaan 95%.
% Penurunan Kadar MDA
32
A.Determinasi Tanaman
Determinasi tanaman dilakukan secara makroskopis yang dilakukan di
laboratorium Biologi FKIP Universitas Muhammadiyah Surakarta dengan
menggunakan literatur Flora of Java (Backer and Van Den Brink, 1965). Hasil
determinasi adalah sebagai berikut.
1b_2b_3b_4b_12b_13b_14b_17b_18b_19b_20b_21b_22b_23b_24b_25b_26b__27b
_799b_800b_801b_802a_803b_804b_805c_806b_807a_808c_809b_810b_811a_812
b_815b_816b_818b_820b_821b_822b_824b_825b_826b_829b_830b_831b_832b_8
33b_834a_835b_983b_984b_986b_991b_992b_993b_994b_995d_1036c_1038b___
_____________________________ Myrtaceae
1a_2b_3b_7b_8b_9b_10b______________ Syzygium
1b_7b_8b_11a_12b___________________ Syzygium polyanthum Wight
(Backer and Van Den Brink, 1965)
Dari hasil determinasi diatas dapat dipastikan bahwa tanaman yang digunakan
dalam penelitian adalah Syzygium polyanthum Wight.
B. Hasil Uji Pendahuluan
Uji pendahuluan yang pertama adalah penentuan panjang gelombang dengan
absorbansi tertinggi (lampiran 5). Dari percobaan tersebut didapatkan panjang
Uji pendahuluan yang kedua adalah penetapan operating time (OT).
Supernatan berwarna merah muda diukur serapannya dengan spektrofotometer
uv-vis pada panjang gelombang 520 nm (berdasarkan panjang gelombang maksimal
MDA) dan dibaca pada menit ke 5, 10, 15, 20, 25, 30, 35, 40, 45, 50. Operating time
yang diperoleh adalah pada menit ke 30-35 (lampiran 5). Penentuan operating time
(OT) dimaksudkan untuk memperoleh waktu dengan serapan yang paling stabil.
Uji pendahuluan yang ketiga dilakukan untuk mengetahui bagaimana model
toksik pada tikus putih jantan, yaitu dengan mencari waktu pembentukan toksik dari
karbon tetraklorida dalam menaikkan kadar MDA dari kondisi normal. Waktu
dengan kadar MDA tertinggi merupakan waktu pembentukan toksik. Hasil orientasi
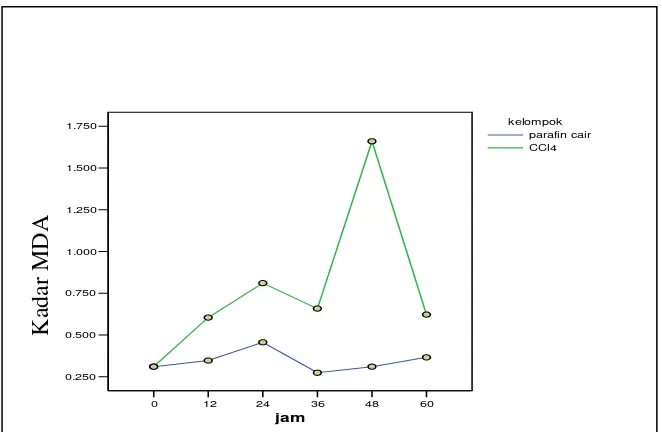
dosis setelah diinduksi dengan karbon tetraklorida 11,2 % (v/v) berupa data kadar
MDA dalam darah (µg/ml) yang diperoleh dari persamaan kurva baku Y = 1,365X +
0,004 dengan r = 0,996 (lampiran 6).
[image:47.612.153.484.460.676.2]
Gambar 8. Grafik Data Kadar MDA Darah pada Model Toksik
0 12 24 36 48 60
jam
0.250 0.500 0.750 1.000 1.250 1.500 1.750
Es
tima
ted
M
ar
gi
nal
M
ea
ns
kelompok parafin cair CCl4
Estimated Marginal Means of MDA
Kadar
M
Pada kelompok parafin cair hanya digunakan 1 hewan uji sehingga tidak
dapat dilakukan uji statistik, maka digunakan analasis deskriptif (gambar 8). Dari
hasil gambar terlihat bahwa setelah pemberian CCl4 terjadi peningkatan kadar MDA
dibanding pemberian dengan parafin cair .Dari gambar tersebut terlihat jelas
pembentukan toksik adalah jam ke-48, yaitu pada saat kadar MDA darah tertinggi.
Pada waktu tersebut sel-sel tubuh telah mengalami kerusakan oleh adanya radikal
bebas triklorometil peroksi (CCl3O2•) yang dapat menyebabkan peroksidasi lipid.
Uji pendahuluan yang keempat adalah penetapan waktu optimal pemberian
ekstrak. Dua belas ekor hewan uji dibagi menjadi 4 kelompok, masing-masing
kelompok 3 ekor hewan uji. Diberi perlakuan dengan CCl4 dosis toksik dan ekstrak
dengan waktu yang berbeda, kemudian diukur kadar MDA-nya. Waktu dengan kadar
MDA terendah merupakan waktu optimal pemberian ekstrak. Data optimasi waktu
pemberian ekstrak diperoleh dari persamaan kurva baku Y = 1,082X + 0,006 dengan
[image:48.612.178.462.530.746.2]r = 0,998 (lampiran 6) dapat dilihat pada tabel 2 di bawah ini.
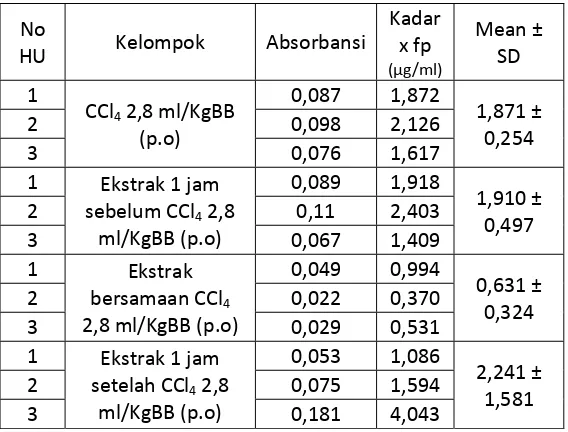
Tabel 2. Data Optimasi Waktu Pemberian Ekstrak (n=3)
No
HU Kelompok Absorbansi
Kadar x fp (µg/ml)
Mean ± SD
1
CCl4 2,8 ml/KgBB
(p.o)
0,087 1,872
1,871 ± 0,254
2 0,098 2,126
3 0,076 1,617
1 Ekstrak 1 jam sebelum CCl4 2,8
ml/KgBB (p.o)
0,089 1,918
1,910 ± 0,497
2 0,11 2,403
3 0,067 1,409
1 Ekstrak bersamaan CCl4
2,8 ml/KgBB (p.o)
0,049 0,994
0,631 ± 0,324
2 0,022 0,370
3 0,029 0,531
1 Ekstrak 1 jam setelah CCl4 2,8
ml/KgBB (p.o)
0,053 1,086
2,241 ± 1,581
2 0,075 1,594
Dari hasil orientasi tersebut diperoleh waktu pemberian ekstrak daun salam
yang paling optimal adalah bersamaan dengan waktu pemberian CCl4. Hal ini juga
dapat dilihat pada uji statistik t-test dengan taraf kepercayaan 95% menunjukkan
bahwa pada pemberian ekstrak bersamaan dengan CCl4 memberikan hasil kadar
MDA paling kecil dengan signifikan (p < 0,05). Hasil uji statistik selengkapnya
dapat dilihat pada lampiran 9.
Pada saat ekstrak daun salam diberikan bersamaan dengan CCl4, radikal
bebas yang dibentuk oleh CCl4 langsung ditangkap oleh komponen dari ekstrak
sehingga tidak begitu banyak menimbulkan kerusakan. Sedangkan ekstrak yang
diberikan 1 jam sebelum CCl4 tidak cukup untuk menangkap radikal bebas yang
terbentuk dari metabolisme CCl4. Ekstrak yang diberikan 1 jam setelah CCl4 juga
tidak mampu menurunkan kadar MDA, dimungkinkan karena pada saat CCl4
diberikan, dalam waktu 30 menit CCl4 sudah dapat merusak sel tubuh, jadi
pemberian ekstrak 1 jam setelah CCl4 tidak efektif sebab peroksidasi lipid sudah
terlanjur terjadi.
C. Hasil Uji Antioksidan Ekstrak Etanol 70% Daun Salam
Penelitian ini bertujuan untuk mengetahui efek antioksidan ekstrak etanol
70% daun salam dalam menurunkan kadar MDA dalam serum darah tikus putih
jantan galur Wistar yang telah diinduksi dengan karbon tetraklorida konsentrasi 11,2
% (v/v) dengan dosis 2,8ml/KgBB.
Pada penelitian ini digunakan hewan uji mamalia bukan primata yaitu tikus
biologis, maka peneliti melakukan pengendalian terhadap beberapa variabel antara
lain berat badan, umur, jenis kelamin, strain, serta makanan dan minuman yang
diberikan pada hewan uji. Tujuan dilakukannya pengendalian variasi biologis
tersebut adalah untuk memperkecil pengaruh variabel tersebut terhadap kadar MDA
dalam darah tikus. Pengendalian dilakukan dengan menggunakan hawan uji yang
kurang lebih sama variasi biologisnya yaitu diantaranya dengan berat badan sekitar
100-200 gram, umur 2-3 bulan, galur Wistar, jenis kelamin jantan dan diperlakukan
sama yaitu ditempatkan dalam kandang dengan jumlah tiap kandangnya sama dan
diberi makanan sama yaitu pellet dan sebelum diberi perlakuan, hewan uji
dipuasakan terlebih dahulu selama 18 jam dengan tetap diberi minum ad libidum.
Hal ini dilakukan agar kondisi hewan uji sama dan untuk mengurangi pengaruh
makanan yang dikonsumsi terhadap sediaan uji yang diberikan dalam penelitian.
Untuk mengurangi tingkat kestressan, hewan uji diadaptasikan dengan kondisi
laboratorium selama 7 hari.
Karbon tetraklorida digunakan sebagai kontrol toksik. CCl4 dapat diubah oleh
sitokrom P-450 menjadi metabolit reaktif yaitu triklorometil peroksi yang dapat
menyebabkan peroksidasi lipid sehingga mengakibatkan kerusakan sel-sel pada hati
dan juga sel-sel tubuh lainnya. MDA merupakan produk peroksidasi lipid, sehingga
jika terjadi kerusakan sel maka MDA ini akan terbentuk dan keluar dari sel masuk ke
peredaran darah. Peningkatan kadar MDA yang sangat tinggi menandakan telah
Kontrol normal yang digunakan dalam penelitian ini adalah parafin cair.
Parafin cair merupakan pelarut dari CCl4, sehingga dapat diketahui apakah parafin
berpengaruh pada pembentukan toksik.
Sediaan uji yang digunakan untuk menurunkan kadar MDA dalam penelitian ini
adalah ekstrak etanol 70% daun salam yang disari dengan metode maserasi dimana
metode ini merupakan metode yang sederhana dan cocok untuk menyari semua senyawa
yang terkandung dalam simplisia. Daun salam yang digunakan dalam penelitian ini
berupa daun yang kering. Senyawa kimia yang terkandung dalam tanaman salam adalah
minyak atsiri, tannin, polifenol dan flavonoid (Anonim, 1989). Kemungkinan flavonoid
inilah yang dapat menurunkan kadar MDA dalam serum darah tikus, karena flavonoid
mempunyai aktifitas sebagai antioksidan yang dapat menghambat kerja radikal bebas
sehingga kerusakan sel terhambat (Robinson, T., 1995). Sebagian besar flavonoid
mempunyai spektrum yang luas dalam aktivitas biokimia, tetapi tidak semua flavonoid
memiliki efek antioksidan. Flavonoid yang berefek sebagai antioksidan adalah flavonoid
yang memiliki struktur O-dihidroksi pada cincin B, ikatan rangkap pada atom C nomer 2
dan 3, dan gugus hidroksi pada posisi 3 dan 5 dalam cincin C dan A (Fuhrman dan
Aviram, 2007).
Pengukuran kadar MDA pada serum darah menurut metode Wills (1987).
Serum yang akan dianalisis ditambahkan aquadest sampai 2 ml direaksikan dengan
menggunakan 1 ml TCA dan 2 ml TBA 0,67%, kadar diukur dengan menggunakan
alat spektrofotometer uv-vis Shimadzu pada panjang gelombang 520 nm. Data kadar
MDA dalam serum tikus setelah diinduksi dengan karbon tetraklorida dan pemberian
Tabel 3. Data Penurunan Kadar MDA pada Serum Darah Tikus Setelah Perlakuan dengan Dosis Tunggal
Kelompok No HU
Kadar x fp (µg/ml) pada jam ke‐
Selisih jam ke‐ (0‐24) (µg/ml)
Mean ± SD (µg/ml)
0 24
Paraffin cair (p.o)
1 0,305 0,751 0,446
0,103 ± 0,291
2 0,047 0,376 0,329
3 0,188 0,305 0,117
4 0,493 0,282 ‐0,211
5 0,305 0,141 ‐0,164
Rata‐rata 0,268 0,371 0,103
CCl4 11,2 % (v/v) (p.o)
1 0,070 1,105 1,034
1,099 ± 0,103
2 0,235 1,221 0,986
3 0,164 1,415 1,250
4 0,329 1,473 1,144
5 0,258 1,337 1,079
Rata‐rata 0,211 1,310 1,099
CCl4 11,2 % (v/v) + CMC Na 0,5% (p.o)
1 1,094 1,786 0,692
1,009 ± 0,415
2 1,317 1,830 0,513
3 0,536 2,076 1,540
4 0,603 1,652 1,049
5 0,670 1,920 1,250
Rata‐rata 0,844 1,853 1,009
CCl4 11,2 % (v/v) + Ekstrak dosis 1,25
g/KgBB (p.o)
1 0,536 1,129 0,594
0,615 ± 0,147
2 0,737 1,110 0,373
3 0,491 1,168 0,677
4 0,446 1,207 0,761
5 0,558 1,227 0,669
Rata‐rata 0,554 1,168 0,615
CCl4 11,2 % (v/v) + Ekstrak dosis 2,5
g/KgBB (p.o)
1 0,516 0,495 ‐0,021
‐0,058 ± 0,264
2 0,598 0,268 ‐0,330
3 0,454 0,639 0,186
4 0,557 0,227 ‐0,330
5 0,454 0,660 0,206
Rata‐rata 0,516 0,458 ‐0,058
CCl4 11,2 % (v/v) + Ekstrak dosis 5,0
g/KgBB (p.o)
1 0,454 0,103 ‐0,351
‐0,318 ± 0,075
2 0,413 0,144 ‐0,268
3 0,578 0,144 ‐0,433
4 0,413 0,165 ‐0,248
5 0,474 0,186 ‐0,289
Rata‐rata 0,466 0,149 ‐0,318
Ekstrak dosis 5,0 g/KgBB (p.o)
1 0,608 0,098 ‐0,510
‐0,341 ± 0,138
2 0,549 0,078 ‐0,471
3 0,373 0,157 ‐0,216
4 0,471 0,216 ‐0,255
5 0,334 0,078 ‐0,255
Tabel 4. Data Penurunan Kadar MDA pada Serum Darah Tikus Setelah Perlakuan dengan Dosis Berulang
kelompok HU No
Kadar x fp (µg/ml) pada jam ke‐ Selisih jam ke‐(0‐48) (µg/ml) Mean ± SD (µg/ml) 0 48
Parafin cair (p.o)
1 0,305 0,164 ‐0,141
‐0,024 ± 0,261
2 0,047 0,423 0,376
3 0,188 0,235 0,047
4 0,493 0,164 ‐0,329
5 0,305 0,235 ‐0,070
Rata‐rata 0,268 0,244 ‐0,023
CCl4 2,8
ml/KgBB (p.o)
1 0,070 1,550 1,480
1,444 ± 0,200
2 0,235 1,744 1,509
3 0,164 1,880 1,716
4 0,329 1,512 1,183
5 0,258 1,589 1,331
Rata‐rata 0,211 1,655 1,444
CCl4 11,2 % (v/v) + CMC Na
0,5% (p.o)
1 1,094 2,054 0,960
1,237 ± 0,399
2 1,317 2,031 0,714
3 0,536 2,254 1,719
4 0,603 1,942 1,339
5 0,670 2,121 1,451
Rata‐rata 0,844 2,080 1,237
CCl4 11,2 % (v/v)
+ Ekstrak dosis
1,25 g/KgBB
(p.o)
1 0,536 0,545 0,009
‐0,036 ± 0,082
2 0,737 0,604 ‐0,133
3 0,491 0,565 0,074
4 0,446 0,350 ‐0,096
5 0,558 0,526 ‐0,032
Rata‐rata 0,554 0,518 ‐0,036
CCl4 11,2 % (v/v) + Ekstrak
dosis 2,5
g/KgBB (p.o)
1 0,516 0,248 ‐0,268
‐0,252 ± 0,74
2 0,598 0,413 ‐0,186
3 0,454 0,227 ‐0,227
4 0,557 0,186 ‐0,371
5 0,454 0,248 ‐0,206
Rata‐rata 0,516 0,264 ‐0,252
CCl4 11,2 % (v/v) + Ekstrak
dosis 5,0
g/KgBB (p.o)
1 0,454 0,433 ‐0,021
‐0,243 ± 0,165
2 0,413 0,186 ‐0,227
3 0,578 0,144 ‐0,433
4 0,413 0,248 ‐0,165
5 0,474 0,103 ‐0,371
Rata‐rata 0,466 0,223 ‐0,243
Ekstrak dosis
5,0 g/KgBB (p.o)
1 0,608 0,687 0,078
0,267 ± 0,520
2 0,549 0,628 0,078
3 0,373 1,511 1,138
4 0,471 0,235 ‐0,235
5 0,334 0,608 0,275
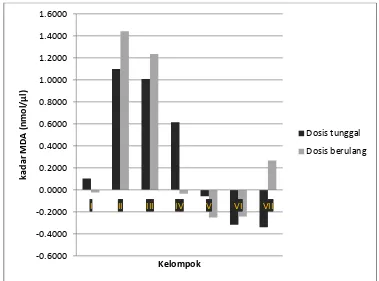
Gambar 9. Grafik Selisih Kadar MDA pada Jam ke-24 dan Jam ke-48 Setelah Pemberian Dosis Tunggal dan Dosis Berulang pada Setiap Kelompok
Keterangan :
Kelompok I : kontrol normal (parafin cair) per oral
Kelompak II : kontrol toksik (karbon tetraklorida 11,2 % (v/v)) per oral Kelompoki III : kontrol negatif (karbon tetraklorida 11,2 % (v/v) + CMC Na
0,5%) per oral
Kelompok IV : karbon tetraklorida 11,2 % (v/v) + ekstrak etanol 70% daun salam 1,25 g/KgBB per oral
Kelompok V : karbon tetraklorida 11,2 % (v/v) + ekstrak etanol 70% daun salam 2,5 g/KgBB peroral
Kelompok VI : karbon tetraklorida 11,2 % (v/v) + ekstrak etanol 70% daun salam 5 g/KgBB per oral
Kelompok VII : ekstrak etanol 70% daun salam 5 g/KgBB per oral
Pada tabel 3, tabel 4 dan gambar 9, jelas terlihat adanya kenaikan kadar MDA
setelah diinduksi dengan CCl4 11,2 % (v/v) dibanding dengan kontrol normal. Dari
tabel tersebut dapat pula dilihat adanya penurunan kadar MDA darah setelah
pemberian sediaan uji. Hal ini menunjukkan bahwa perlakuan dengan sediaan
‐0.6000 <