BAB II
TINJAUAN PUSTAKA
2.1 Diabetes Mellitus
DM merupakan suatu kelompok penyakit metabolik dengan karakteristik hiperglikemia yang terjadi karena kelainan sekresi insulin, kerja insulin atau kedua-duanya.1
2.1.1 Klasifikasi DM1
a. Tipe 1: Destruksi sel beta, umumnya menjurus ke defisiensi insulin absolut.
Autoimun Idiopatik
b. Tipe 2: Bervariasi, mulai yang dominan resistensi insulin disertai defisiensi insulin relatif sampai yang dominan defek sekresi insulin disertai resisten insulin.
c. Tipe lain: Defek genetik fungsi sel beta, defek genetik kerja insulin, penyakit eksokrin pankreas, endokrinopati, karena obat atau zat kimia, infeksi, sebab imunologi yang jarang, sindrom genetik lain yang berkaitan dengan DM.
d. Diabetes Mellitus Gestasional.
2.1.2 Diagnosis DM1
keluhan lain seperti; lemah badan, kesemutan, gatal, mata kabur, dan disfungsi ereksi pada pria, serta pruritus vulva pada wanita.
Kriteria Diagnosis DM;
Pemeriksaan glukosa plasma puasa ≥126 mg/dl. Puasa adalah kondisi tidak
ada asupan kalori minimal 8 jam, atau
Pemeriksaan glukosa plasma ≥200 mg/dl 2-jam setelah Tes Toleransi
Glukosa Oral (TTGO) dengan beban glukosa 75 gram, atau
Pemeriksaan glukosa plasma sewaktu ≥200 mg/dl dengan keluhan klasik,
atau
Pemeriksaan Hemoglobin A1C (HbA1c) ≥6,5% dengan menggunakan metode yang terstandarisasi oleh National Glycohaemoglobin Standarization Program (NGSP).
2.1.3 Penatalaksanaan DM1
Tujuan penatalaksanaan DM meliputi:
a. Tujuan jangka pendek: menghilangkan keluhan DM, memperbaiki kualitas hidup dan mengurangi risiko komplikasi akut.
b. Tujuan jangka panjang: mencegah dan menghambat progresivitas penyulit mikroangiopati dan makroangiopati.
c. Tujuan akhir pengelolaan adalah turunnya morbiditas dan mortalitas DM. Untuk mencapai tujuan tersebut perlu dilakukan pengendalian glukosa darah, tekanan darah, berat badan, dan profil lipid melalui pengelolaan pasien secara komprehensif.
Penatalaksanaan DM dimulai dengan menerapkan pola hidup sehat (terapi nutrisi medis dan aktivitas fisik) bersamaan dengan intervensi farmakologis dengan obat anti hiperglikemia secara oral dan/atau suntikan.
Langkah-langkah Penatalaksanaan DM yaitu; a. Edukasi
2.1.4. Metformin
Terapi farmakologis pada penderita DM diberikan bersamaan dengan pengaturan makan dan latihan jasmani (gaya hidup sehat). Terapi farmakologis terdiri dari obat oral dan bentuk suntikan.1 Ketika upaya perubahan gaya hidup saja tidak dapat mempertahankan tujuan glikemik maka Metformin sebagai monoterapi harus ditambahkan, kecuali ada kontraindikasi atau intoleransi. Metformin sudah terbukti akan efikasi dan keamanannya, murah, dan dapat mengurangi risiko kejadian kardiovaskular dan kematian.17
Metformin mempunyai efek utama mengurangi produksi glukosa hati (glukoneogenesis) dan memperbaiki ambilan glukosa dijaringan perifer. Metformin merupakan pilihan pertama pada sebagian besar kasus DM Tipe 2. Dosis Metformin diturunkan pada pasien dengan gangguan fungsi ginjal dengan glomerular filtration rate (GFR) 30-60 ml/menit/1,75m2). Metformin tidak boleh
diberikan pada beberapa keadaan seperti: GFR<30 ml/menit/1,73 m2, adanya gangguan hati berat, serta pasien-pasien dengan kecenderungan hipoksemia (misalnya penyakit serebrovaskular, sepsis, renjatan, Penyakit Paru Obstruktif Kronis (PPOK), gagal jantung New York Heart Association Functional Classification (NYHA FC) III-IV. Efek samping yang mungkin berupa gangguan
saluran pencernaan seperti halnya gejala dispepsia.1
2.2. Stres Oksidatif Pada Diabetes Mellitus
Stres oksidatif didefinisikan secara umum sebagai kelebihan pembentukan dan/atau tidak cukup penghapusan molekul yang sangat reaktif seperti reactive oxygen species (ROS) dan reactive nitrogen species (RNS). ROS termasuk radikal
bebas seperti superoksida (O2•-), hidroksil (OH•), peroksil (RO2•), hidroperoxil (HRO2•-) serta spesies nonradikal seperti hidrogen peroksida (H2O2) dan asam hidroklor (HOCl). RNS termasuk radikal bebas seperti nitrat oksida (NO•) dan nitrogen dioksida (NO2•-), Serta nonradikal seperti peroksinitrit (ONOO-), nitrit oksida (HNO2) dan peroksinitrat alkil (RONOO). 18
detoksifikasi sistem antioksidan seluler yang menyebabkan kerusakan biologis.19 Oksidan dihasilkan dari metabolisme intraseluler normal dalam mitokondria dan peroksisom, serta dari berbagai sistem enzim sitosol. Selain itu sejumlah agen eksternal dapat memicu produksi ROS. Sistem pertahanan antioksidan enzimatik dan nonenzimatik termasuk SOD, CAT dan GSH melawan dan mengatur keseluruhan tingkat ROS untuk mempertahankan homeostasis fisiologis. Menurunkan kadar ROS di bawah set point homeostatis dapat mengganggu peran fisiologis oksidan pada proliferasi seluler dan mekanisme pertahanan. Demikian pula, peningkatan ROS juga dapat merugikan dan menyebabkan kematian sel atau percepatan dalam penuaan dan penyakit yang berkaitan dengan usia (gambar 2.1).2
Sejumlah tertentu ROS diperlukan untuk proses metabolisme normal karena ROS memainkan berbagai peran regulasi dalam sel. ROS diproduksi oleh neutrofil dan makrofag selama proses pernapasan untuk eliminasi antigen, juga berfungsi untuk merangsang sinyal dari beberapa gen yang menyandikan faktor transkripsi, diferensiasi, dan pengembangan maupun merangsang adhesi sel-sel, pemberi sinyal pada sel, keterlibatan dalam vasoregulasi, proliferasi fibroblast, dan peningkatan ekspresi enzim antioksidan. Namun produksi ROS yang tidak terkendali atau berlebihan akan merusak.20 Stres oksidatif menggambarkan keberadaan produk yang disebut radikal bebas dan ROS yang terbentuk dalam kondisi fisiologis normal tetapi menjadi merusak ketika tidak dalam keadaan seimbang dengan sistem antioksidan. Ada bukti meyakinkan baik eksperimental dan klinis bahwa pembentukan ROS meningkat pada kedua jenis diabetes dan bahwa onset diabetes sangat erat kaitannya dengan stres oksidatif.21
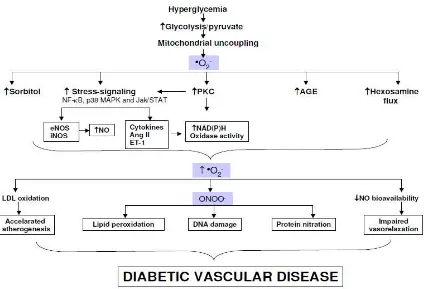
Beberapa mekanisme molekuler menjelaskan berbagai komplikasi diabetes yang diinduksi oleh keadaan hiperglikemia. Mekanisme yang paling banyak dipelajari meliputi peningkatan jalur poliol, aktivasi jalur diasilgliserol (DAG) / protein kinase C (PKC), peningkatan stres oksidatif, peningkatan pembentukan dan efek advanced glycation end products (AGE), dan peningkatan jalur hexosamine. Selain itu, perubahan dari sinyal transduksi yang disebabkan oleh hiperglikemia atau metabolit beracun menyebabkan disfungsi pembuluh darah dan saraf, seperti gangguan aliran darah, peningkatan laju apoptosis, hiperpermeabilitas dan akumulasi matriks ekstraselular pada pembuluh darah oleh perubahan ekspresi gen atau fungsi protein. Hiperglikemia juga dapat menghambat faktor pelindung endogen pada jaringan pembuluh darah, seperti insulin, vascular endothelial growth factor (VEGF), platelet derived growth factor (PDGF), dan activated protein C (APC), yang memainkan peran penting dalam mempertahankan homeostasis pembuluh darah dan menetralisir hiperglikemia yang menginduksi senyawa toksik termasuk stres oksidatif, AGE atau aktivasi nuclear factor-kB (NF-kB), sehingga dapat mencegah dan menunda perkembangan komplikasi diabetes.22
dan enzim, peningkatan peroksidasi lipid dan berkembangnya komplikasi diabetes mellitus.21 Stress oksidatif akibat kelainan metabolik pada diabetes akan menyebabkan kelebihan produksi superoksida mitokondria pada sel-sel endotel baik pada pembuluh darah besar dan kecil serta pada miokard. Stress oksidatif bertindak sebagai mediator resistensi insulin dan perkembangan intoleransi glukosa pada diabetes mellitus yang menyebabkan komplikasi aterosklerosis dan berkontribusi pada munculnya banyak komplikasi mikro dan makrovaskuler.20
Gambar 2.2. Pembentukan ROS dan Akibatnya pada Diabetes.
kinase C (PKC), yang juga meningkatkan produksi O2•-.18,19,21 Sumber enzimatik yang menghasilkan spesies reaktif pada diabetes termasuk nitric oxide synthase (NOS), Nicotinamide adenine dinucleotide phosphate hydrogen (NADPH) oxidase dan xantin oksidase. Rantai respirasi mitokondria adalah sumber lain pembentukan spesies reaktif nonenzimatik. Selama proses fosforilasi oksidatif, elektron ditransfer dari pembawa elektron Nicotinamide adenine dinucleotide hydrogen (NADH) dan flavin adenine dinucleotide hydrogen (FADH2) kepada oksigen yang menghasilkan adenosine triphosphate (ATP).18 Dalam kondisi normal O2•- segera dihilangkan oleh mekanisme pertahanan alami. Hiperglikemia persisten mengakibatkan jumlah glukosa yang masuk ke dalam sel tidak proporsional, sehingga influks glukosa ditingkatkan melalui glikolisis dan siklus asam trikarboksilat (TCA), yang mengakibatkan peningkatan transpor rantai elektron mitokondria, yang menghasilkan jumlah O2•- yang lebih besar, lebih dari SOD mitokondria yang dapat dismutasekan. Hal ini mengakibatkan ketidakseimbangan antara produksi ROS mitokondria dan degradasi ROS mitokondria, sehingga stres oksidatif terjadi. Bukti menunjukkan bahwa hiperglikemia menginduksi produksi O2•- mitokondria berlebihan, yang memainkan peran penting dalam menghasilkan spesies reaktif lain pada diabetes mellitus. (Gambar 2.2).18,23
2. 3. SOD (Superoxide Dismutase) Dan Diabetes Mellitus
Superoksida dismutase (SOD) adalah enzim yang berfungsi untuk mengkatalis konversi radikal superoksida (O2•-) menjadi oksigen (O2) dan hidrogen peroksida (H2O2). Berdasarkan kofaktor logam, SOD dapat diklasifikasikan ke dalam empat kelompok; besi-SOD (Fe-SOD), mangan-SOD (Mn-SOD), tembaga-seng-SOD (CuZn-SOD), dan nikel-SOD (Ni-SOD).24
pelindung dari MnSOD dengan menetralisir O2•- dalam sitosol dan yang bocor dari mitokondria. EC-SOD akan menetralisir O2•- pada bagian luar permukaan sel dan dalam matriks ekstraselular dan cairan. Selain melindungi permukaan sel namun juga menghilangkan O2•- dari pembuluh darah.26
ROS merupakan atom atau molekul kecil yang tidak memiliki pasangan elektron yang siap menerima elektron lain atau mentransfer elektron yang tidak berpasangannya ke molekul lain. ROS secara normal diproduksi dari metabolisme sel, namun perubahan dalam jumlah dan sifat ROS dilepaskan pada berbagai keadaan penyakit. Di antara ROS yang dihasilkan oleh sel-sel hidup, O2• -merupakan senyawa proinflamasi yang merusak sel. O2•- merusak sel endotel, meningkatkan permeabilitas mikrovaskuler dan mempromosikan migrasi neutrofil pada fokus inflammasi.25
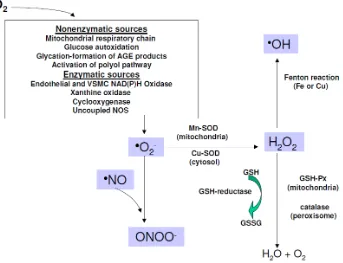
Konsentrasi ROS diatur oleh keseimbangan antara produksi dan eliminasi ROS oleh antioksidan. Keseimbangan yang tepat sangat penting untuk sel normal dan fungsi jaringan. ROS diproduksi pada banyak proses metabolisme termasuk respirasi mitokondria dan aktivitas enzim (sitokrom P-450, NADPH oksidase, myeloperoxidase, NO sintase, dan xanthine oxidase). Enzim antioksidan menangkap ROS yang ada dalam tubuh termasuk; SOD, glutation peroksidase, dan katalase. Selain itu, antioksidan larut air (glutation, vitamin C, dan asam urat) dan antioksidan larut lemak (vitamin E, karotenoid, dan bilirubin) sangat penting untuk melindungi membran sel dan lipoprotein plasma. SOD mengkatalis dismutasi O2•- menjadi O2 dan H2O2:25
O2•- + O2•- + 2H+ H2O2 + O2
lain yang penting adalah glutathione reduktase, yang menghasilkan glutathione yang digunakan sebagai donor hidrogen oleh glutation peroksidase selama eliminasi H2O2 (Gambar 2.3).4,18,25
Gambar 2.3. Pembentukan Superoksida dan Peran Antioksidan pada Diabetes.
dipastikan bahwa pada kontrol metabolik diabetes yang lebih buruk maka semakin tinggi frekuensi komplikasi lanjut yang terjadi. Stress oksidatif berperan dalam perkembangan komplikasi ini, dan diharapkan perubahan adaptif dapat diamati pada sistem pertahanan antioksidan. Perubahan ini akan menunjukkan perbedaan yang nyata pada kontrol metabolik yang berbeda dan tergantung pada lamanya waktu keadaan kontrol metabolik yang buruk.29
Penelitian yang dilakukan oleh Renuka P dan Naveen Cr (2014) menilai kadar SOD eritrosit dan NO pada penderita diabetes dan hubungannya dengan durasi lamanya diabetes mellitus mendapatkan bahwa SOD eritrosit dan serum NO meningkat signifikan pada pasien diabetes dibandingkan dengan kontrol yang sehat. Bila dibandingkan antara kelompok durasi diabetes >7 tahun ditemukan SOD menurun dan NO meningkat signifikan dibandingkan dengan durasi diabetes <7 tahun. 30 Hasil penelitian ini selaras dengan penelitian oleh Ahmed M A dkk (2016), yang selain menilai durasi lamanya penyakit (≤5tahun, 6-10 tahun, ≥10 tahun) juga kontrol glikemik pada diabetes, menyimpulkan bahwa diabetes dengan durasi yang lebih lama dan kontrol glikemik yang buruk berhubungan dengan penurunan SOD.5
diregulasi dalam menanggapi peningkatan stres oksidatif. Perpanjangan durasi penyakit dan aktivitas SOD yang menurun dapat dijelaskan oleh adanya paparan jangka panjang enzim terhadap konsentrasi glukosa yang tinggi mengarah pada peningkatan pembentukan SOD terglikasi, yang kurang aktif dibandingkan dengan enzim normal.30
Dalam suatu penelitian oleh Prechl J dkk (1997), menilai hubungan antara durasi diabetes dengan pengukuran variasi dari berbagai aktivitas antioksidan di dalam darah, ditemukan bahwa SOD eritrosit berkurang pada pasien yang telah menderita diabetes selama lebih dari 10 tahun dibandingkan yang belum, sementara Gpx darah dan aktivitas katalase eritrosit tidak berbeda.29
Penurunan SOD telah diamati pada eritrosit pasien diabetes dan jaringan dari hewan diabetes pada berbagai penelitian.32 Pada suatu studi case-control cross-sectional deskriptif oleh Nazeri dkk (2011) terhadap 80 pasien DM tipe 2
dan 74 sukarelawan sehat sebagai kelompok kontrol, dijumpai jumlah total kapasitas antioksidan, katalase dan aktivitas superoksida dismutase menurun secara bermakna pada kelompok diabetes dibandingkan dengan kelompok kontrol (p <0,05).33 Hal ini sesuai dengan dengan penelitian sebelumnya (M.E Rahbani-nobar dkk, 1999) yang menilai perubahan status enzim antioksidan yang dievaluasi pada sampel eritrosit yang diperoleh dari 125 pasien diabetes (tipe 1 dan 2) dan 120 subjek sehat sebagai kelompok kontrol (jenis kelamin dan umur disesuaikan) bahwa aktivitas SOD secara signifikan rendah pada kedua jenis diabetes.34 Sementara Farah J dkk (2013), Wan Ting Hsu dkk (2006) dan Kesavulu dkk (2000), mendapatkan bahwa tidak ada perbedaan yang signifikan ditemukan dalam aktivitas SOD antara kelompok diabetes dan kontrol.35-37
mengarah ke inaktivasi enzim ini. (3) Kehilangan dua factor; Zn2+ dan Cu2+. Hal ini selaras dengan temuan bahwa pada pasien diabetes, seperti pada orang sehat, ada korelasi yang erat antara penurunan aktivitas SOD dan hilangnya dua faktor yang, Zn2+ dan Cu2+.32
2.4. Prinsip Pemeriksaan SOD
Pada penelitian ini aktivitas SOD diukur pada sampel eritrosit menggunakan kit Ransel; Randox Laboratories Crumlin U.K, dimana peranan SOD adalah untuk mempercepat dismutasi radikal superoksida yang toksik (O2•-) yang diproduksi selama proses energi oksidatif menjadi hidrogen peroksida dan molekul oksigen. Metode ini menggunakan xanthine dan xanthine oxidase (XOD) untuk menghasilkan radikal superoksida yang bereaksi dengan 2-(4-iodophenyl)-3-(4-nitrofenol)-5-phenyltetrazolium klorida (I.N.T.) untuk membentuk pewarna
formazan merah. Aktivitas superoxide dismutase kemudian diukur dengan tingkat penghambatan reaksi ini. Satu unit SOD adalah yang menyebabkan 50% penghambatan dari laju pengurangan INT dalam kondisi pengujian tersebut.38
XOD
Xanthine Uric acid + O2• -O2•
-I.N.T. formazan dye atau
SOD
O2•- + O2•-+ 2H+ O2 + H2O2
Nilai rujukan normal SOD sesuai dengan nilai yang tertera pada kit yang dipakai pada penelitian ini yaitu 1102 - 1601 U/gHb, namun disarankan bahwa setiap laboratorium yang melakukan pemeriksaan membuat rentang referensi sendiri untuk mencerminkan usia, jenis kelamin, diet dan letak geografis penduduk.38
2.5. Punguntano Dan Antioksidan
bunga tanaman ini nampak berwarna merah (Gambar 2.4). Puguntano dahulu diletakkan dalam famili Scrophulariaceae sekarang diletakkan dalam famili Linderniaceae. Puguntano di Indonesia tersebar di daerah Sumatera, Jawa,
Kalimantan dan Maluku. Di beberapa daerah tanaman ini juga dikenal nama Tamah raheut (Sunda), Mempedu tanah, daun Kukurang (Maluku), dan Papaita (Ternate).8,39
Gambar 2.4. Tanaman Puguntano
(Huang, et al., 1999), saponin (Fang, et al., 2009), dan terpenoid (Wang, et al., 2006).8 Sementara Panal Sitorus dkk (2014) telah berhasil mengisolasi β -Sitosterol dari ekstrak n-hexane pada tanaman Puguntano, suatu kandungan yang diyakini sebagai salah satu efek antidiabetes dari tanaman ini, dan berhasil membuktikan pemberian ekstrak ini pada mencit selama 10 hari dapat menurunkan kadar gula darah sebesar 44.47 %.10 Senyawa flavonoid, tanin,
saponin, dan β-sitosterol dari berbagai jenis tanaman diketahui memiliki efek
sebagai antioksidan dari berbagai hasil penelitian sebelumnya.13-18
Tanaman Puguntano telah digunakan secara empiris dalam pengobatan diabetes mellitus, terutama oleh masyarakat Dairi Provinsi Sumatera Utara. Penelitian oleh Finni Harfina ddk (2012) secara observasi klinis membuktikan bahwa serbuk simplisia daun Puguntano mempunyai efek dalam menurunkan kadar gula darah pada pasien diabetes mellitus dengan dosis 2 g, 3 kali sehari selama 14 hari yang diberikan secara oral dalam bentuk seduhan.9
Senyawa cucurbitacin dalam glikosida yang terkandung pada serbuk simplisia Puguntano diduga memberikan efek penurunan kadar gula darah yaitu dengan merangsang sekresi insulin sehingga banyak produksi insulin yang dikeluarkan untuk mengontrol kadar gula darah menjadi normal. Selain itu, terdapat golongan
fitosterol dalam bentuk β-sitosterol yang juga berperan dalam merangsang
sensitifitas insulin, meningkatkan produksi insulin, dan sebagai antioksidan untuk mengurangi kerusakan yang terjadi pada sel-sel di Langerhans.9 Sementara saponin bertindak sebagai antioksidan dengan menangkap superoksida dan membentuk hidroksiperoksida yang mencegah kerusakan biomolekuler yang diakibatkan radikal bebas.40
antioksidan, mengurangi radikal α-tokoferol, mengurangi stres nitrosatif, menetralisir radikal superoksida, lipid peroksil, dan hidroksil.41-44 Terdapat hipotesis bagaimana flavonoid sebagai alternatif pengobatan diabetes mellitus antara lain dengan menurunkan aldose-reduktase, regenerasi sel pankreas, meningkatkan pelepasan insulin dan meningkatkan uptake ion Ca2+.45 Studi lain menyatakn bahwa flavonoid merupakan senyawa fenol dengan aktifitas biologi yang luas dan memiliki efek pada diabetes melalui inhibisinya pada enzim α-glukosidase atau pencegahan absorpsi glukosa dan atau memperbaiki toleransi glukosa.46
Tanin salah satu kelompok senyawa polifenol yang dikenal sebagai antioksidan dalam tanaman obat, makanan, dan buah-buahan yang dapat dimakan. Selain itu tanin juga bersifat kardioprotektif, anti-inflamasi, anti-karsinogenik dan anti-mutagenik. Efek perlindungan ini terkait dengan kapasitasnya untuk bertindak sebagai penangkap radikal bebas dan mengaktifkan enzim antioksidan sehingga dapat memperbaiki keadaan oksidatif patologis pada diabetes. Tanin meningkatkan penyerapan glukosa melalui mediator dari jalur signaling insulin seperti PI3K (phosphoinositide 3-kinase), aktivasi p38 MAPK (Mitogen-Activated Protein Kinase) dan translokasi GLUT-4 (Glucose transporter type 4). Tanin juga
menghambat adipogenesis dan meningkatkan aktivitas insulin sehingga menjadi obat yang potensial untuk pengobatan NIDDM (non-insulin dependent diabetes mellitus) Studi terbaru menunjukkan senyawa tanin dari sumber botani adalah
inhibitor alami α-amilase dan α-glukosidase. Dengan efek penghambatan yang kuat pada α-glukosidase tetapi efek penghambatan ringan pada α-amilase sehingga dapat digunakan sebagai langkah efektif untuk mencegah hiperglikemia postprandial dengan efek samping minimal yang secara signifikan menurunkan hiperglikemia postprandial setelah konsumsi diet karbohidrat campuran dan bisa menjadi strategi efektif dalam pengendalian diabetes tipe 2.47
2.6. Pembuatan Ekstrak Daun Puguntano
secukupnya sampai terdapat selapis cairan penyari di atas simplisia dan dibiarkan selama 24 jam. Cairan dibiarkan menetes dengan kecepatan 1 ml per menit, cairan penyari ditambahkan berulang-ulang sehingga selalu terdapat selapis cairan penyari di atas simplisia, perkolasi dihentikan sampai perkolat terakhir yang keluar tidak berwarna. Perkolat dipekatkan dengan menggunakan rotavapor, setelah diperoleh ekstrak kental, kemudian dikeringkan pada freeze dryer (Ditjen POM, 1986).
2.7. Pembuatan Sediaan Kapsul Ekstrak Daun Puguntano
Kapsul ekstrak daun Puguntano dibuat dengan dosis 100 mg dan kemudian dicampur dengan bahan pengisi sampai bobot kapsul 500 mg dan dimasukkan ke dalam kapsul.
Setiap kapsul mengandung:
R/ Ektrak daun Puguntano 100 mg Amylum manihot 5 % Amylum maydis 2,5 % Sakarum laktis qs Cara pembuatan:
Ekstrak kental daun Puguntano ditimbang lalu digerus sedikit demi sedikit dengan bahan pengisi dan bahan pengering/pegembang (amylum manihot, amylum maydis dan sakarum laktis) sehingga diperoleh massa yang kompak, kemudian dibuat granul dengan mengayak massa tersebut. Dikeringkan di lemari pengering selama 1 jam sehingga diperoleh granul kering. Diayak kembali dan dicampur dengan sakarum laktis sampai mencapai bobot yang sesuai. Kemudian dimasukkan ke dalam cangkang kapsul dengan bantuan alat pengisi kapsul.