BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Pirdot (Saurauia vulcani Korth.)
Pirdot merupakan tumbuhan yang hidup pada daerah basah seperti dekat air terjun, aliran sungai, jurang, gunung yang lembab, daerah hutan dan daerah yang berawan (mendung). Kebanyakan spesies hidup pada tanah yang berpasir, banyak humus, dan tanah liat. Tempat tumbuh tanaman ini pada ketinggian 3600 km di atas permukaan laut (Soejarto,1980).
Pirdot merupakan genus Saurauia dan keluarga Actinidiaceae. Sistematika tumbuhan ini dapat dilihat dari hasil identifikasi sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta Class : Dicotyledoneae Ordo : Ericales
Famili : Actinidiaceae Genus : Saurauia
Spesies : Saurauia vulcani Korth. Nama Lokal : Pirdot
(Herbarium Medanense).
2.2 Senyawa Organik Bahan Alam
Kimia bahan alam merupakan hasil perkembangan ilmu kimia organik yang mempelajari senyawa-senyawa kimia yang tergolong metabolit sekunder. Senyawa-senyawa tersebut banyak ditemukan pada sumber alam, baik berupa tumbuhan, hewan yang masih hidup maupun yang sudah mati. Senyawa-senyawa bahan alam ini diklasifikasikan berdasarkan empat kriteria yang berbeda yaitu: struktur kimia, keaktifan fisiologis, taksonomi dan biogenesis (Harborne, 1987).
1. Klasifikasi Berdasarkan Struktur Kimia
Klasifikasi ini adalah klasifikasi formal berdasarkan kerangka struktur molekul, yaitu: a. Senyawa lemak rantai terbuka atau alifatik, seperti asam-asam lemak,
gula-gula, dan hampir semua asam amino
b. Senyawa sikloalifatik atau alisiklik, seperti terpenoid, steroid, dan beberapa alkaloid
c. Senyawa benzenoid atau aromatik, seperti fenol dan kuinon.
d. Senyawa heterosiklik, seperti alkaloid, flavonoid, dan basa-basa nukleat.
2. Klasifikasi Berdasarkan Aktivitas Fisiologi
Biasanya pengembangan bahan alam didahului dengan pengamatan dan pengalaman empirik khasiat bahan alam tersebut untuk menyembuhkan penyakit tertentu. Oleh karena itu, salah satu cara penyelidikan bahan obat dari tumbuhan atau bahan alam lainnya adalah melalui ekstraksi dan penetapan khasiat farmakologi ekstrak, diikuti dengan isolasi komponen murni.
3. Klasifikasi Berdasarkan Taksonomi
Klasifikasi ini didasarkan pada pengkajian morfologi komparatif atau taksonomi tumbuhan. Walaupun beberapa metabolit selama ini diketahui spesifik pada tumbuhan tertentu, tetapi sekarang telah diketahui tersebar di dalam berbagai tumbuhan, misalnya alkaloid dan isoprenoiddapat diisolasi dari berbagai genus, spesies, suku, atau ordo. Bahkan di dalam satu spesies terdapat sejumlah komponen yang memiliki struktur dasar yang berkaitan.
mendorong berkembangnya suatu bidang baru yang disebut kemotaksonomi (chemotaxonomy) atau sistematik kimia (chemosystematic) yang mengarah ke pembagian kandungan tumbuhan berdasarkan taksa tumbuhan.
4. Klasifikasi Berdasarkan Biogenesis
Biogenesis dan biosintesis memiliki arti yang sama dan sering kali digunakan tanpa perbedaan. Namun, istilah biogenesis biasanya digunakan untuk reaksi pembentukan yang masih dalam taraf hipotesis, sedangkan jika reaksi tersebut telah dibuktikan secara eksperimen, digunakan istilah biosintesis(Nakanishi et al, 1974).
Diawali dengan teori aturan isoprena pada tahun 1930, yang menyatakan bahwa semua terpenoid dibentuk dari unit isoprena 5-C, dilanjutkan dengan teori poliketometilena untuk senyawa fenolik, yang merupakan saran pertama bagi biosintesis asetogenin (poliketida). Komponen pembangun utama untuk atom-atom karbon dan nitrogen di dalam semua senyawa bahan alam berasal dari 5 kelompok prekursor, yaitu:
a. asetil ko-A → unit 2C (MeCO-) → poliketida (asetogenin) malonil ko-A
b. asam sikimat → unit 6C-3C (6C-1C atau 6C-2C) → senyawa fenolik c. asam mevalonat → unit prenil → isoprenoid
( CH2=C-CH2-CH2-) Me
d. unit asam amino seperti fenilanalina, tirosina, ornitina, lisina, dan triptofan → alkaloid
e. 5-5’-deoksiadenilmetionina → unit 1C
2.3 Metabolit Sekunder
Metabolit sekuder adalah senyawa yang disintesis oleh mahkluk tumbuhan, mikrobia atau hewan melewati proses biosintesis yang digunakan untuk menunjang kehidupan namun tidak vital (jika tidak ada tidak mati) sebagaimana gula, asam amino dan asam lemak. Metabolit ini memiliki aktifitas farmakologi dan biologi (Saifudin,2014).
Pengelompokan senyawa kimia tanaman berdasarkan sifat khas yang dimiliknya (antara lain warna, rasa, bau, pH, kelarutan), merupakan hal penting sehingga sampai sekarang masih banyak dipakai. Berikut contoh pengelompokkan senyawa kimia tersebut:
1.Minyak Atsiri. Baunya khas dan dapat dipisahkan dari senyawa kimia tanaman lainnya, karena sukar larut dalam air dan dapat menguap bersama uap air.
2. Alkaloid. Senyawa yang bersifat basa dapat dipisahkan dari yang netral dan asam. Penyebab sifat basa sangat erat kaitannya dengan kerja farmakologi pada tubuh binatang dan manusia.
3. Zat Pahit. Berpedoman pada rasa pahit adalah suatu metode yang mudah untuk memisahkan senyawa kimia tanaman.
4. Zat warna. Jumlah zat warna dari tanaman diperkirakan ± 2000 jenis. Pigmen tanaman mempunyai struktur kimia yang berlainan, begitu juga sifat fisika, kelarutan, warna, fuoresensi, dan sebagainya
5. Tannin. Ditandai oleh sifatnya yang dapat mengendapkan protein dari larutan dengan membentuk senyawa yang tidak larut (Sirait, 2007).
2.4 Senyawa Flavonoida
Flavonoid adalah suatu senyawa yang terdiri dari C6-C3-C6.Flavonoid umumnya terdapat pada tumbuhan sebagai glikosida. Gugusan gula bersenyawa pada satu atau lebih grup hidroksil fenolik. Sistem penomoran untuk turunan senyawa flavonoid diberikan di bawah :
O
Gugus hidroksil selalu terdapat pada karbon nomor 5 dan nomor 7 pada cincin A. Pada cincin B gugus hidroksil terdapat pada karbon nomor 3 dan nomor 4 (Sirait, 2007).
Tumbuhan yang mengandung flavonoid banyak dipakai dalam pengobatan tradisional. Hal tersebut disebabkan flavonoid mempunyai berbagai macam aktivitas terhadap macam-macam organisme (Robinson,1995). Penelitian farmakologi terhadap senyawa flavonoid menunjukkan bahwa beberapa senyawa golongan flavonoid memperlihatkan aktivitas seperti antifungi, diuretik, antihistamin, antihipertensi, insektisida, bakterisida, antivirus dan menghambat kerja enzim (Geissman,1962).
Senyawa flavonoid juga berperan dalam memberikan banyak warna lain di alam, bahkan flavonoid yang tidak berwarna menyerap cahaya pada spektrum UV (karena banyak gugus kromofor) dan dapat dilihat oleh banyak serangga. Senyawa ini diduga memiliki manfaat ekologi yang besar di alam berkat warnanya sebagai penarik serangga dan burung untuk membantu penyerbukan tanaman (Heinrich et al, 2009).
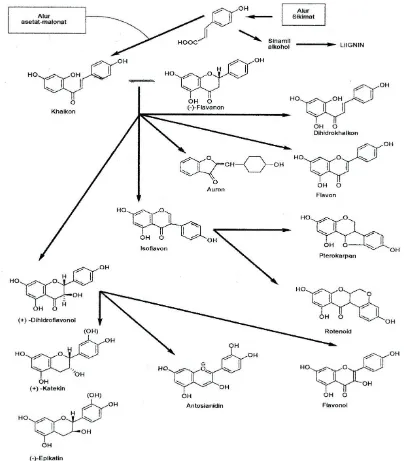
2.4.1 Biosintesis Flavonoida
polketida ini disusun dari tiga molekul malonil-KoA yang bergabung dengan unit C6-C3(sebagai Ko-A tioester) untuk membentuk unit awal triketida. Oleh karena itu, flavonoid yang berasal dari biosintesis gabungan terdiri atas unit-unit yang diturunkan dari asam sikimat dan jalur poliketida (Heinrich et al, 2009).
Semua varian flavonoida saling berkaitan karena alur biosintesis yang sama yang melalui alur sikimat dan alur-malonat. Flavonoida yang pertama kali terbentuk pada biosintesis adalah khalkon dan semua bentuk diturunkan darinya melalui berbagai alur. Modifikasi flavonoida lebih lanjut mungkin terjadi pada berbagai tahap dan menghasilkan: penambahan (atau pengurangan) hidroksilasi, metilasi gugus hidroksil atau inti flavonoida, metilenasi gugus orto-dihidroksil, dimerisasi (pembentukan biflavonoida), dan glikosilasi gugus hidroksil (pembentukan flavonoida O-glikosida) atau inti flavonoida (pembentukan flavonoida C-glikosida)(Markham, 1988).
2.4.2 Klasifikasi Senyawa Flavonoida
Dalam tumbuhan, flavonoid terdapat dalam berbagai bentuk struktur.Keragaman struktur flavonoid ini disebabkan karena perbedaan tahap modifikasi lanjutan dari struktur dasar flavonoid, antara lain:
1. Flavonoid O-glikosida.
Flavonoid biasanya terdapat sebagai flavonoid O-glikosida, pada senyawa tersebut satu gugus hidroksi flavonoid (atau lebih) terikat pada satu gula (atau lebih) dengan ikatan hemiasetal yang tak tahan asam. Pengaruh glikosilasi meyebabkan flavonoid menjadi kurang reaktif dan lebih mudah larut dalam air (cairan).
2. Flavonoid C-glikosida.
Gula dapat juga terikat pada atom karbon flavonoid dan dalam hal ini gula tersebut terikat langsung pada inti benzena dengan suatu ikatan karbon-karbon yang tahan asam. Glikosida yang demikian disebut C-glikosida. Sekarang gula yang terikat pada atom C hanya ditemukan pada atom C nomor 6 dan 8 dalam inti flavonoid. Jenis gula yang terlibat ternyata jauh lebih sedikit ketimbang jenis gula pada O-glikosida.
3. Flavonoid Sulfat
4. Biflavonoid
Biflavonoid adalah flavonoid dimer, walaupun prosianidin dimer biasanya tidak dimasukkan ke dalam golongan ini. Flavonoid yang biasanya terlibat adalah flavon dan flavanon yang secara biosintesis mempunyai pola oksigenasi yang sederhana 5,7,4’ atau kadang-kadang 5,7,3’,4’ dan ikatan antar flavonoid berupa ikatan karbon-karbon atau eter.
5. Aglikon flavonoid yang aktif-optik
Aglikon flavonoid mempunyai atom karbon asimetrik dan dengan demikian menunjukkan keaktifan optik. Yang termasuk dalam golongan flavonoid ini ialah flavanon, dihidroflavonol, katekin, pterokarpan, rotenoid, dan beberapa biflavonoid (Markham, 1988).
Menurut Robinson (1995) dan Baht (2005), flavonoid dapat dikelompokkan berdasarkan tahanan oksidasi dan keragaman lain pada rantai C3 :
1. Flavon
Flavon merupakan senyawa yang paling tersebar luas dari semua pigmen tumbuhan kuning. Mengandung cincin benzo-γ-pyrone dengan substitusi fenil pada posisi 2 dari cincin pyrone. Daya serap sinar UV pada struktur flavon terjadi pada 304-350 nm pada pita I dan 240-285 nm pada pita II.
2. Flavanon
Flavanon adalah turunan 2,3-dihdro dari flavon. Daya serap sinar UV pada struktur flavanon terjadi pada 310-340 nm pada pita I dan 270-295 nm pada pita II. Senyawa ini tidak berwarna atau hanya kuning sedikit.
3. Flavonol
Flavonol adalah turunan 3-hidroksi flavon dan dihidroflavonol.Daya serap sinar UV pada struktur flavanol terjadi pada 352-385nm pada pita I dan 240-285 nm pada pita II.Flavonol paling sering terdapat sebagai glikosida, biasanya 3-glikosida.
4. Isoflavon
Isoflavon mengandung cincin benzo-γ-pyron dengan substitusi fenil di posisi 3 dari cincin pyron dan isoflavonon.Daya serap sinar UV pada struktur isoflavon terjadi pada 300-340 nm pada pita I dan 245-270 nm pada pita II.
5. Flavanonol
Flavanonol (atau dihidroflavonol) adalah turunan 3-hidroksi dari flavonon.Daya serap sinar UV pada struktur dihidroflavonol terjadi pada 300-320 nm pada pita I dan 270-295 nm pada pita II.Flavanonol merupakan senyawa yang stabil dalam asam klorida panas tetapi terurai oleh udara.
6. Auron
Auron merupakan pigmen kuning emas yang terdapat dalam bunga tertentu.Auron memiliki kerangka 2-benziliden coumaranon atau 2-benziliden-3-(2H)-benzofuranon.Daya serap sinar UV pada struktur auron hanya terjadi pada 370-430 nm pada pita I.
O
OH
O
O
O
O
OH
O
O
7. Kalkon
Kalkon tidak mengandung cincin γ-pyron dan karenanya flavonoid memiliki rantai terbuka.Daya serap sinar UV pada struktur kalkon terjadi pada 340-390 nm pada pita I dan 220-270 nm pada pita II.Pengubahan kalkon menjadi flavanon terjadi dengan mudah dalam larutan asam dan reaksi kebalikannya dalam basa.
2.5Skrining Fitokimia
Banyak reagen yang dapat digunakan untuk mengetahui keberadaan dari flavonoid, meskipun beberapa juga akan bereaksi positif dengan senyawa polifenol. Reagen yang biasa digunakan adalah :
1. Shinoda Test, yaitu dengan menambahkan serbuk magnesium pada ekstrak sampel dan beberapa tetes HCl pekat, warna orange, pink, merah sampai ungu akan terjadi pada senyawa flavon, flavonol, turunan 2,3-dihidro dan xanton. Penggunaan zinc sebagai pengganti magnesium dapat dilakukan, dimana hanya flavanonol yang memberikan perubahan warna merah pekat sampaimagenta, flavanon dan flavonol akan memberi warna merah muda yang lemah sampai magenta (Sarker et al, 2006).
2. H2SO4(p), flavon dan flavonol akan memberikan perubahan larutan kuning pekat. Kalkon dan auron menghasilkan larutan berwarna merah atau merah kebiru-biruan. Flavanon memberikan warna orange sampai merah
(Sarker et al, 2006).
3. NaOH 10% , menghasilkan larutan biru violet
4. FeCl3 5% telah digunakan secara luas untuk mengidentifikasi senyawa fenol, tetapi tidak dapat digunakan untuk membedakan macam-macam golongan flavonoid. Pereaksi ini memberi warna kehijauan, warna biru, dan warna hitam-biru (Robinson, 1995).
2.6Teknik Pemisahan
Teknik pemisahan memiliki tujuan untuk memisahkan komponen yang akan ditentukan berada dalam keadaan murni, tidak tercampur dengan komponen-komponen lainnya. Ada 2 jenis teknik pemisahan:
1. Pemisahan kimia adalah suatu teknik pemisahan yang berdasarkan adanya perbedaan yang besar dari sifat-sifat fisika komponen dalam campuran yang akan dipisahkan.
2. Pemisahan fisika adalah suatu teknik pemisahan yang didasarkan pada perbedaan-perbedaan kecil dari sifat-sifat fisik antara senyawa-senyawa yang termasuk dalam satu golongan (Muldja, 1995).
Biomassa (tanaman, mikroba, laut)
Ekstraksi
Skrining
Isolasi zat aktif berdasarkan uji hayati
Skrining silang
Elusidasi Struktur
2.6.1 Ekstraksi
Ekstraksi merupakan suatu cara untuk mengambil atau menarik komponen kimia yang terkandung dalam sampel menggunakan pelarut yang sesuai. Ekstraksi yang benar dan tepat tergantung dari jenis senyawa, tekstur dan kandungan air bahan tumbuhan yang akan diekstraksi. Ektraksi serbuk kering jaringan tumbuhan dapat dilakukan secara maserasi, perkolasi, refluks atau sokhletasi dengan menggunakan pelarut yang tingkat kepolarannya berbeda-beda (Harbone, 1996).
Sampel yang berasal dari tanaman setelah diidentifikasi dan digolongkan menjadi spesies dan familinya, kemudian sampel dikeringkan dengan cara diangin-anginkan untuk menghindari penguraian komponen oleh udara atau mikroba.Jika telah dikeringkan, biomassa kemudian digiling menjadi partikel-partikel kecil menggunakan blender atau penggilingan. Proses penggilingan ini penting karena ektraksi efektif pada partikel kecil, dikarenakan memiliki luas permukaan yang lebih besar (Heinrich et al, 2009).
Maserasi adalah proses perendaman sampel untuk menarik komponen yang kita
inginkan, dengan kondisi dingin diskontinyu. Keuntungan dari maserasi adalah lebih
praktis, pelarut yang digunakan lebih sedikit dibandingkan perkolasi dan tidak
memerlukan pemanasan, sedangkan kekurangannya adalah waktu yang dibutuhkan lebih
lama. Ekstraksi dianggap selesai bila tetesan terakhir memberikan reaksi negatif
terhadap senyawa yang diekstraksi. Untuk mendapatkan larutan ekstrak pekat, biasanya pelarut ekstrak diuapkan dengan menggunakan alat rotari evaporator (Harborne, 1996).
2.6.2 Partisi
1. Air/petroleum eter ringan (heksana) untuk menghasilkan fraksi nonpolar di lapisan organik
2. Air/diklorometan atau air/kloroform atau air/etil asetat untuk membuat fraksi agak polar di lapisan organik. Ini merupakan metode pemisahan yang mudah dan mengandalkan kelarutan bahan alam dan bukan interaksi fisik dengan medium lain (Heinrich et al, 2009).
2.6.3 Hidrolisis
Hidrolisis glikosida flavonoid dapat dilakukan dengan tiga metode yaitu hidrolisis asam, hidrolisis basa dan hidrolisis dengan bantuan enzim. Waktu yang diperlukan untuk memutuskan suatu gula dari suatu flavonoid O-glikosida dengan hidrolisis asam tidak ditentukan hanya oleh kekuatan asam, tetapi juga oleh sifat gula dan oleh tempat gula itu terikat pada inti flavonoid.Cara baku menghidrolisis O-glikosida dengan hidrolisis asam adalah larutan glikosida flavonoid (1mg) dihidrolisis dengan 5 ml HCl 2N : MeOH (1:1) dalam labu alas bulat 25 ml dan dipanaskan pada penangas air selama 60 menit. Uapkan sampai kering dengan menggunakan rotarievaporator. Sisanya kemudian dilarutkan sempurna dalam sesedikit mungkin dengan pelarut MeOH : H2O (1:1) dan dikromatografi (kertas atau KLT-selulosa, 15% asam asetat) disamping bahan awal untuk menentukan apakah sudah terjadi hidrolisis(Markham, 1988).
2.6.4 Kromatografi
Kromatografi dapat dibedakan atas berbagai macam tergantung pada pengelompokkannya. Berdasarkan pada mekanisme pemisahannya, kromatografi dibedakan menjadi: kromatografi adsorbsi, kromatografi partisi, kromatografi pasangan ion, kromatografi penukar ion, kromatografi eksklusi ukuran. Berdasarkan pada alat yang digunakan, kromatografi dapat dibagi atas: kromatografi kertas, kromatografi lapis tipis (disebut juga kromatografi planar), kromatografi cair kinerja tinggi, dan kromatogtrafi gas. Bentuk kromatografi yang paling awal adalah kromatografi kolom yang digunakan untuk pemisahan sampel dalam jumlah yang besar.
Pemisahan pada kromatografi planar pada umumnya dihentikan sebelum semua fase gerak melewati seluruh permukaan fase diam. Solut pada kedua kromatografi ini dikarakterisasi dengan jarak migrasi solut terhadap jarak ujung fase geraknya. Nilai faktor retardasi solut (Rf) dapat dihitung dengan menggunakan perbandingan dalam persamaan:
Rf= Jarak yang ditempuh solut Jarak yang ditempuh fasa gerak
Nilai maksimum Rf adalah 1 dan ini dicapai ketika solut mempunyai perbandingan distribusi (D) dan faktor retensi sama dengan 0 yang berarti solut bermigrasi dengan kecepatan yang sama dengan fase gerak. Nilai minimum Rf adalah 0 dan ini teramati jika solut tertahan pada posisi titik awal di permukaan fasa diam.
Proses Sorpsi
Solut akan terdistribusi diantara dua fasa yang bersesuaian dengan perbandingan distribusinya (D) untuk menjaga keadaan kesetimbangan ini. Terdapat 4 jenis mekanisme sorpsi dasar dan umumnya 2 atau lebih mekanisme ini terlibat dalam satu jenis kromatografi. Keempat jenis tersebut adalah adsorpsi, partisi, pertukaran ion, dan eksklusi ukuran.
Adsorben
Silika gel adalah fasa diam yang paling sering digunakan untuk pemisahan produk alam. Silika gel memberikan area permukaan yang sangat luas. Rata-rata ukuran partikel silika gel yang digunakan adalah 40 – 200 μm dengan ukuran pori sebesar 40 hingga 300 Å (Cannel, 1998).
Silika gel sebagai bahan dasar adsorben dapat mengadsorpsi ion-ion logam atau polutan-polutan yang berbahaya, karena silika gel memiliki gugus fungsional silanol (Si-OH) dan siloksan (Si-O-Si) (Jal et al. 2004).Gugus silanol adalah pusat aktif yang bersifat sedikit asam dan polar karenanya gugus ini mampu membentuk ikatan hidrogen yang kuat dengan solut-solut yang agak polar sampai sangat polar.Silika gel membentuk ikatan hidrogen terutama dengan donor H seperti alkohol, fenol, amina, amida, dan asam karboksilat (Palleros, 2000).
Adanya air dari atmosfer yang diserap oleh permukaan silika gel mampu mendeaktifkan permukaan silika gel karena air akan menutup sisi aktif silika gel.Semakin polar solut maka akan semakin tertahan kuat ke dalam adsorben silika gel ini
Tabel 2.1 Daftar Adsorben pada Kromatografi Alumina
Karbon aktif (Charcoal) Silika gel
Magnesium silikat Selulosa
Resin-resin polimerik (stiren/difenil benzen)
(paling polar)
(Gandjar, 2007). 2.6.4.1 Kromatografi Lapis Tipis
Teknik ini dikembangkan tahun 1938 oleh Ismailoff dan Schraiber. Adsorben dilapiskan pada lempeng kaca yang bertindak sebagai fase diam. Fase bergerak akan merayap sepanjang fasa diam dan terbentuklah kromatogram. Metode ini sederhana, cepat dalam pemisahan dan sensitif. Kecepatan pemisahan tinggi dan mudah untuk memperoleh kembali senyawa-senyawa yang terpisahkan (Khopkar, 1990).
Adsorben yang paling sering digunakan adalah silika gel dan alumina. Beberapa mikroliter larutan sampel yang akan dianalisa ditotolkan pada plat sebagai titik kecil yang tunggal dengan menggunakan pipa mikrokapilaritas. Plat dikembangkan dengan meletakkannya didalam botol ataupun chamber pengembang yang berisi sejumlah kecil pelarut. Pelarut akan menaiki plat dengan adanya gaya kapilar, dan membawa senyawa dari sampel dengan itu. Senyawa yang berbeda dipisahkan dari dasarnya pada saat interaksi mereka dengan lapisan adsorben.
Plat KLT yang biasa digunakan adalah plat dengan ukuran pori silika 60 Å dan ketebalan lapisan 25 µm dalam penyangga poliester atau aluminium, beberapa dengan menggunakan atau tanpa menggunakan indikator fluorosensi yang sesuai untuk analisa cepat dari ekstrak kasar tanaman dan digunakan sebagai dasar dari langkah preparatif. Deteksi noda yang dihasilkan dapat menggunakan lampu ultraviolet ataupun dengan menyemprot dengan menggunakan reagen yang sesuai (Cseke et al, 2006).
2.6.4.2 Kromatografi Kolom
lebih cepat meninggalkan kolom bila molekul-molekul komponen tersebut berinteraksi secara lemah dengan fasa diam.
Kolom kromatografi untuk pengaliran karena gaya tarik bumi (gravitasi) atau sistem bertekanan rendah biasanya terbuat dari kaca yang dilengkapi keran jenis tertentu pada bagian bawahnya untuk mengatur aliran pelarut. Ukuran keseluruhan kolom sungguh beragam, tetapi biasanya panjangnya sekurang-kurangnya 10 kali garis tengah dalamnya dan mungkin saja sampai 100 kalinya. Ukuran kolom dan banyaknya penjerap yang dipakai ditentukan oleh bobot campuran sampel yang akan dipisahkan.
Untuk pemisahan normal, bobot sampel biasanya 30:1 ternyata memadai jika pemisahan tidak terlalu sukar, perbandingan dapat ditingkatkan hingga 50:1 untuk komponen yang susah dipisahkan. Ukuran partikel penjerap pada kolom biasanya lebih besar daripada untuk KLT.
Fraksi kolom yang mengandung senyawa yang sama (diperiksa dengan KLT) atau tampaknya berasal dari satu puncak (memakai pendeteksian sinambung) digabungkan, dan pelarutnya diuapkan, lebih baik dengan tekanan rendah. Jika pelarut dan penjerap murni. Maka fraksi-fraksi pun murni (Gritter, 1991).
2.6.4.3 KromatografiLapis Tipis Preparatif
Sebagian besar pemakaian kromatografi lapis tipis preparatif hanya dalam jumlah miligram. Penjerap yang paling umum digunakan adalah silika gel dan dipakai untuk pemisahan campuran senyawa lipofil maupun campuran senyawa hidrofil. Ukuran partikel dan porinya kurang lebih sama dengan ukuran tingkat KLT.
Kebanyakan penjerap KLTP mengandung indikator fluorosensi yang membantu mendeteksi kedudukan pita yang terpisah sepanjang senyawa yang dipisahkan menyerap sinar UV. Pita yang kedudukannya telah diketahui dikerok dari plat dengan spatula atau pengerok berbentuk tabung. Senyawa harus diekstraksi dari penjerap dengan pelarut yang paling kurang polar yang mungkin (sekitar 5 ml pelarut untuk 1 gr penjerap). Harus diperhatikan bahwa semakin lama senyawa berkontak dengan penjerap makin besar kemungkinan penguraian (Hostettmann, 1995).
2.7 Teknik Spektroskopi
Teknik spektroskopi adalah salah satu teknik analisis kimia-fisika yang mengamati tentang interaksi atom atau molekul dengan radiasi elektromagnetik. Ada dua macam instrumen pada teknik spektroskopi yaitu spektrometer dan spektrofotometer. Instrumen yang memakai monokromator celah tetap pada bidang focus disebut sebagai spektrometer. Apabila spektrometer tersebut dilengkapi dengan detektor yang bersifat fotoelektrik maka disebut spektrofotometer (Muldja, 1955).
2.7.1 Spektroskopi Ultraviolet (UV-Vis)
Saat ini penggunaan Spektroskopi UV-Visible paling sering digunakan dalam aplikasi untuk analisa kuantitatif, dan nilai dari metode ini dapat mengurangi perbandingan informasi yang banyak dari teknik spektroskopi yang lainnya seperti NMR dan MS.
Flavonoida mengandung sistem aromatik yang terkonjugasi karena itu menunjukkan spektrum ultraviolet dan spektrum tampak (Harborne, 1987).Spektrum flavonoid biasanya ditentukan dalam larutan dengan pelarut metanol (MeOH, AR atau yang setara) atau etanol (EtOH), meski perlu diingat bahwa spektrum yang dihasilkan dalam etanol kurang memuaskan.
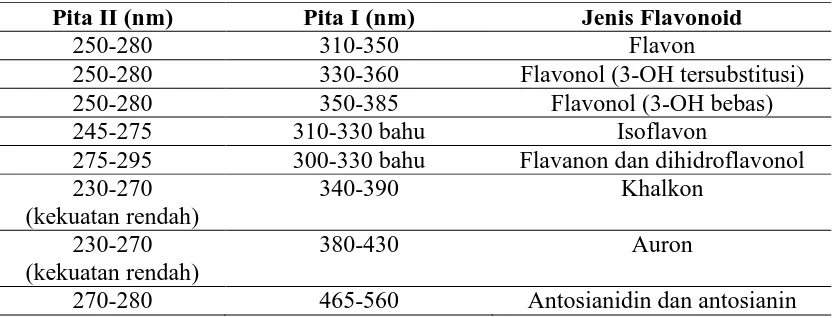
Ciri spektrum khas jenis flavonoid utama dengan pola oksigenasi yang setara disajikan pada tabel dibawah :
Tabel 2.2 Rentangan Serapan Spektrum UV-Visible golongan Flavonoida Pita II (nm) Pita I (nm) Jenis Flavonoid
250-280 310-350 Flavon
250-280 330-360 Flavonol (3-OH tersubstitusi)
250-280 350-385 Flavonol (3-OH bebas)
245-275 310-330 bahu Isoflavon
275-295 300-330 bahu Flavanon dan dihidroflavonol 230-270
(kekuatan rendah)
340-390 Khalkon
230-270 (kekuatan rendah)
380-430 Auron
270-280 465-560 Antosianidin dan antosianin
Perubahan penyulihan pada cincin A cenderung tercerminkan pada serapan pita II, sedangkan perubahan penyulihan pada cincin B dan C cenderung lebih jelas tercermin pada serapan pita I (Markham, 1988).
2.7.2 Spektroskopi Inframerah (FT-IR)
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi getaran yang berlainan. Pancaran inframerah yang kerapatannya kurang dari 100 cm-1
(panjang gelombang lebih daripada 100 μm) diserap oleh sebuah molekul organik dan
Bila molekul menyerap radiasi inframerah, energi yang diserap menyebabkan kenaikan dalam amplitudo getaran atom-atom yang terikat itu. Jadi molekul ini berada dalam keadaan vibrasi tereksitasi, energi yang diserap ini akan dibuang dalam bentuk panas bila molekul itu kembali ke keadaan dasar. Panjang gelombang eksak dari absorpsi oleh suatu tipe ikatan, bergantung pada macam getaran dari ikatan tersebut. Oleh karena itu, tipe ikatan yang berlainan (C-H, C-C, C=O, C=C, O-H, dan sebagainya) menyerap radiasi inframerah pada panjang gelombang yang berlainan. Dengan demikian spektrometri inframerah dapat digunakan untuk mengidentifikasi adanya gugus fungsi dalam suatu molekul. Banyaknya energi yang diserap juga beraneka ragam dari ikatan ke ikatan. Ini disebabkan sebagian oleh perubahan dalam
momen dipol (μ≠0) pada saat energi diserap. Ikatan nonpolar (seperti C-H atau C-C) menyebabkan absorpsi lemah, sedangkan ikatan polar (seperti misalnya O-H, N-H, dan C=O) menunjukkan absorpsi yang lebih kuat (Supratman, 2010).
Suatu ikatan dalam sebuah molekul dapat mengalami berbagai vibrasi molekul. Secara umum terdapat dua tipe vibrasi molekul:
1. Vibrasi Streching (regang/ulur): terjadi terus menerus perubahan jarak antara dua atom di didalam suatu molekul, sehingga terjadi perpanjangan atau pemendekan ikatan.
2. Vibrasi Bending (lentur/tekuk): terjadi perubahan sudut antara dua ikatan kimia, sehingga terjadi pembesaran atau pengecilan sudut ikatan (Noerdin, 1985).
2.7.3 Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR)
Spektrometer Resonansi Magnetik Inti (Nuclear Magnetic Resonance, NMR) merupakan alat yang berguna pada penentuan struktur molekul organik.Spektrum Resonansi Magnetik Inti memberikan informasi mengenai lingkungan kimia atom hidrogen, jumlah atom hidrogen dalam setiap lingkungan dan struktur gugusan yang berdekatan dengan setiap atom hidrogen (Cresswell, 1982).
Kemampuan terhebat resonansi inti magnetik timbul karena tidak semua proton dalam molekul memiliki resonansi yang identik pada frekuensi yang sama. Hal ini sesuai dengan fakta bahwa berbagai macam proton dalam molekul dikelilingi oleh elektron dan memiliki sedikit perbedaan dalam lingkungan elektronik dari satu dan yang lainnya.Pergeseran kimia dalam unit δ ditunjukkan dalam jumlah resonansi proton yang bergeser dari TMS dalam bagian per juta (ppm) dari frekuensi dasar spektroskopi.
δ= pergeseran dalam Hz
frekuensi spektrometer dalam MHz