LAPORAN RESMI PRAKTIKUM MIKROBIOLOGI
Disusun oleh : Kelompok IA
Deby F.I. Nadeak 23010112120007 Velayati Nurrahma 23010112120037 Wiwik Purwaningsih 23010112120042 Nila Duhita Nareswari 23010112120055
Heru Murtadho 23010112120056
JURUSAN S-1 PETERNAKAN
FAKULTAS PETERNAKAN DAN PERTANIAN UNIVERSITAS DIPONEGORO
SEMARANG 2013
Praktikum Mikrobiologi dilaksanakan pada hari Sabtu tanggal 11 Mei 2013 pukul 07.00-09.00 WIB dan hari Minggu tanggal 12 Mei 2013 pukul 07.00-09.00, di Laboratorium Fisiologi dan Biokimia Ternak, Fakultas Peternakan dan Pertanian, Universitas Diponegoro, Semarang.
Praktikum menggunakan alat yaitu timbangan, erlenmeyer, waterbath, beker glass, gelas ukur, pisau, kain saring, pH meter, oven, autoklaf, cawan petri, pipet hisap, tabung reaksi, penghisap, bunsen, kaca objek, loop, mikroskop. Bahan yang digunakan kentang, dextrose, agar, aquades, asam tartarat, kertas pembungkus, kapas, alkohol, alumunium foil, sampel yang akan dihitung yaitu kevir, medium, larutan gram (A, B, C, D), dan biakan bakteri. Sterilisasi Kering, menyumbat bagian pangkal pipet dengan kapas. Membungkus cawan petri dan pipet hisap dengan kertas pembungkus. Memasukkan ke dalam oven selama 1 jam pada suhu 170°C. Sterilisasi Basah, memasukkan erlenmeyer dan tabung reaksi tersebut ke dalam autoklaf dan menunggu hingga manometer serta termometer menunjukkan suhu 121°C dengan tekanan 2 atm selama 60 menit. Membuat medium PDA, mengiris kentang dengan ukuran kira-kira 1x1x1 cm. Menimbang kentang dengan tepat sebanyak 500 gram. Memasukkan kentang ke dalam beker glass, kemudian menambahkan 1000 ml aquades, menutup beker glass dengan aluminium foil serapat mungkin. Memanaskan dalam waterbath hingga mendidih selama 30 menit. Setelah dingin, kemudian melumat kentang hingga hancur. Mengambil filtrat kentang dengan cara menyaringnya menggunakan kain saring atau kapas yang bersih. Setelah filtrat terkumpul mengukur volumenya untuk membuat medium PDA dengan komposisi: 50 ml filtrat, 1,5 gram agar serta 1 gram dextrose. Metode pengenceran, mengencerkan 1 ml sampel ke dalam 9 ml aquades sampai 5 tingkat pengenceran. Cara menghitung koloni, menghitung koloni hanya pada cawan yang jumlah koloninya antara 30-300. Pewarnaan Gram, menggenangi objek dengan larutan gram A selama 1 menit. Menggenangi kembali objek dengan larutan gram B selama 2 menit. Membilas objek dengan larutan gram C, kemudian membilas kembali dengan aquades. Menggenangi objek dengan larutan gram D selama 30 detik.
Berdasarkan hasil percobaan diambil simpulan, praktikum metode hitungan cawan dengan menggunakan sampel kevir, jumlah bakteri yang dapat dihitung pada medium PDA menghasilkan jumlah koloni yang baik karena tidak kurang dari 30 dan tidak lebih dari 300. Pada pewarnaan bakteri gram negatif dengan bentuk bulat (coccus), sedangkan pada bakteri positif berbentuk batang (basil).
Kata Kunci : Sterilisasi, Pembuatan Medium, Pengenceran, Pewarnaan,
dan hidayah-Nya sehingga laporan praktikum Mikrobiologi ini dapat selesai tepat waktu.
Laporan ini disusun berdasarkan praktikum yang telah dilaksanakan, kemudian diaplikasikan dengan mata kuliah yang diajarkan dengan sumber yang penulis baca. Laporan praktikum ini berfungsi untuk mengembangkan pengetahuan praktikan terhadap apa yang sudah diajarkan di perkuliahan. Laporan ini diharapkan dapat berguna bagi penulis selaku praktikan dan pembaca pada umumnya.
Penulis mengucapkan terima kasih kepada ibu Dr. Dra. Turrini Yudiarti, M.Sc., selaku dosen koordinator praktikum Mikrobiologi, Primasta Adi P. selaku koordinator umum asisten, Kristiani Dina Pratiwi selaku asisten pembimbing, serta semua pihak yang telah membantu baik secara moril maupun materil dalam pelaksanaan dan pembuatan laporan praktikum ini.
Penulis mohon maaf jika terjadi kesalahan baik dari penulisan nama ataupun pengetikan. Kritik dan saran penulis harapkan demi penyempurnaan laporan ini.
Semarang, Mei 2013
DAFTAR ISI ... ii
DAFTAR TABEL ... iii
DAFTAR LAMPIRAN ... iv
BAB I PENDAHULUAN ... 1
BAB II TINJAUAN PUSTAKA ... 2
BAB III METODOLOGI ... 6
3.1. Materi ... 6
3.2. Metode ... 7
3.2.1. Sterilisasi ... 7
3.2.2. Medium dan Larutan Pengencer ... 8
3.2.3. Metode Hitungan Cawan ... 8
3.2.4. Pewarnaan Gram ... 9
BAB IV HASIL DAN PEMBAHASAN ... 11
4.1. Sterilisasi ... 11
4.2. Pembuatan Medium PDA ... 12
4.3. Metode Hitungan Cawan ... 13
4.4. Pewarnaan Gram ... 14
BAB IV SIMPULAN DAN SARAN ... 17
4.1. Simpulan ... 17
4.2. Saran . ... 17
DAFTAR PUSTAKA ... 18
1. Gambar Alat ... 19
2. Menjawab Pertanyaan Medium dan Larutan Pengencer ... 23
3. Menjawab Pertanyaan Sterilisasi ... 26
4. Menjawab Pertanyaan Metode Perhitungan Cawan ... 27
5. Menjawab Pertanyaan Pewarnaan Bakteri ... 28
Kelompok : IA (SATU)A
Jurusan : S1-PETERNAKAN
Fakultas : PETERNAKAN DAN PERTANIAN
Tanggal Pengesahan : Mei 2013
Menyetujui,
Mengetahui,
Koordinator Umum Mikrobiologi
Dr. Dra. Turrini Yudiarti, M.Sc., NIP. 195912021987032002 Koordinator Asisten Praktikum Mikrobiologi Primasta Adi P. 23010110110017 Asisten Pembimbing
Kristiani Dina Pratiwi 23010111130087
1. Gambar Pengamatan Bakteri Gram Positif Perbesaran 100x ... 14
BAB I
PENDAHULUAN
Mikrobiologi adalah suatu ilmu mengenai makhluk hidup yang mempunyai ukuran sedemikian kecilnya, sehingga setiap individu selnya tidak mungkin dapat dilihat langsung oleh mata. Di dalam bidang mikrobiologi terdapat beberapa aspek yang dipelajari, seperti mikroba, sterilisasi, medium dan sebagainya.
Sterilisasi dalam mikrobiologi merupakan proses penghilangan semua jenis mikroorganisme (protozoa, fungi, bakteri, mycoplasma dan virus) yang terdapat pada suatu benda. Medium adalah suatu bahan yang terdiri dari campuran nutrisi yang dipakai untuk menumbuhkan mikroorganisme. Metode hitung cawan adalah satu cara perhitungan bakteri adalah dengan menggunakan metode hitung cawan atau Standard Plate Count (SPC). Pewarnaan Gram bertingkat adalah suatu cara pewarnaan yang paling berguna yang dilakukan dalam bakteriologi.
Tujuan Praktikum Mikrobiologi adalah untuk mengetahui cara-cara mensterilkan alat dan bahan, mengetahui cara pembuatan medium dan larutan pengencer dengan komposisi yang tepat, mengetahui cara menghitung jumlah mikroba, mengetahui cara pewarnaan gram pada mikroba serta bentuk dan struktur mikroba yang terdapat dalam sampel. Manfaat Praktikum Mikrobiologi umum ini adalah agar dapat mengetahui proses pertumbuhan dan perkembangan mikroba dalam bahan pakan dimana mikroba mempunyai banyak hubungan dan peranan yang sangat penting dalam kehidupan makhluk hidup.
BAB II
TINJAUAN PUSTAKA
2.1. Sterilisasi
Sterilisasi adalah suatu proses yang menghancurkan semua bentuk kehidupan. Suatu benda yang steril dipandang dari sudut mikrobiologi, artinya bebas dari mikroorganisme hidup. Proses sterilisasi dapat dilakukan dengan uap
panas, larutan kimia, pemanasan kering atau metode gas (Adji et al., 2007). Suatu
benda atau substansi hanya dapat steril atau tidak steril, tidak akan pernah mungkin setengah steril atau hampir steril ( Pelczar and Chan, 1988).
2.1.1. Sterilisasi Kering
Ada dua metode sterilisasi panas kering yaitu dengan insinerasi, yaitu pembakaran dengan menggunakan api dari bunsen dengan temperatur sekitar 3500C, dan dengan udara panas oven yang lebih sederhana dan murah dengan temperatur sekitar 1600C sampai 1700C (Pratiwi, 2008). Alat-alat dari gelas
dimasukkan di dalam oven kering selama waktu dan pada temperatur 1600C
sampai 1700C, hal ini bergantung kepada banyak sedikitnya muatan yang
dimasukkan dalam oven (Dwijoseputro 2005).
2.1.2. Sterilisasi Basah
Autoklaf adalah suatu bejana yang dapat ditutup, yang diisi dengan tekanan tinggi, suhu di dalamnya dapat mencapai 1150C hingga 1250C dan
tekanan uapnya mencapai 2 hingga 4 atm (Adji et al., 2007). Tingkat sterilisasi panas basah digunakan untuk bahan yang sensitif panas untuk industri makanan berkisar pada temperatur 600C sampai 800C, pada peralatan dan cairan disterilkan
dengan pemanasan pada temperatur 1000C selama 5-10 menit (Pratiwi 2008).
2.2. Medium dan Larutan Pengencer
Dasar makanan yang paling baik bagi pemeliharaan mikroba ialah medium yang mengandung zat-zat organik seperti rebusan daging, sayur-sayuran, sisa makanan, atau ramuan-ramuan yang dibuat oleh manusia. Medium yang biasa digunakan yaitu kaldu cair dan kaldu agar (Dwidjoseputro, 2005). Jika sel mikroba yang masih hidup ditumbuhkan pada medium agar maka sel mikroba tersebut akan berkembang biak dan membentuk koloni yang nantinya dapat dilihat secara langsung dengan mata tanpa menggunakan mikroskop (Fardiaz, 1989)
2.2.1. Potato Dextroset Agar (PDA)
Untuk membuat biak padat pada larutan biak cair ditambahkan bahan pemadat yang memberi konsistensi seperti selai pada larutan air. Bahan pemadat yang ideal adalah agar (Schmidt, 1994). Jika sel mikroba yang masih hidup ditumbuhkan pada medium agar maka sel mikroba tersebut akan berkembang biak dan membentuk koloni yang nantinya dapat dilihat secara langsung dengan mata tanpa menggunakan mikroskop (Fardiaz, 1989)
2.3. Metode Hitungan Cawan (Total Plate Count)
Bahan pangan yang diperkirakan mengandung lebih dari 300 sel mikroba per ml, per gram, atau per cm. Bakteri yang ditumbuhkan pada medium agar di dalam cawan petri dan diinkubasi dikatakan menghasilkan jumlah yang terbaik adalah di antara 30 sampai 300 koloni (Fardiaz 1989). Di dalam suatu populasi bakteri tidak semua sel mampu hidup terus. Yang dianggap sebagai sel hidup ialah sel yang mampu membentuk koloni di dalam agar biak atau membentuk suspensi dalam larutan biak. Sel-sel yang mampu hidup terus yang dihitung dengan berbagai metode untuk menetapkan jumlah sel hidup (Schmidt, 1994).
2.3.1. Pengenceran
Pengenceran biasanya dilakukan secara desimal, yaitu 1 : 10, 1 : 100, 1 : 1000 dan seterusnya. Pengenceran secara desimal memudahkan dalam perhitungan jumlah koloni, sedangkan pengenceran yang bukan secara desimal misalnya 1 : 5, 1 : 25 dan seterusnya jarang dilakukan karena tidak praktis dalam penghitungannya. Larutan yang digunakan untuk pengenceran dapat berupa
larutan bufer fosfat, larutan garam fisiologi 0,85% atau larutan Ringer ( Fardiaz, 1989). Kesulitan dalam penggunaan teknik merode tuang ini bila jumlah
kandungan bakteri sangat tinggi dalam bahan yang akan diperiksa diperlukan pengenceran, selain itu agak sulit mengambil koloni yang tumbuh di bawah permukaan agar (Lay dan Sugyo, 1992).
2.3.2. Metode Tuang
Salah satu teknik yang dikembangkan Koch adalah metode agar tuang untuk mendapatkan koloni yang terpisah (Lay dan Sugyo, 1992). Dari pengenceran yang dikehendaki, sebanyak 1 ml atau 0,1 ml larutan sampel dipipet ke dalam cawan petri menggunakan pipet 1 ml atau 1,1 ml. Sebaiknya waktu antara dimulainya pengenceran sampai menuangkan ke dalam cawan petri tidak boleh lama dari 30 menit (Fardiaz, 1989)
2.4. Pewarnaan Gram
Pewarnaan gram dapat dibedakan menjadi gram positif dan gram negatif. Dimana gram positif berwarna biru dan gram negatif berwarna merah (Djauhari, 2006). Dalam pewarnaan gram, mula-mula sel bakteri diwarnai dengan zat warna basa yaitu violet kristal, diikuti perlakuan menggunakan suatu mordant yaitu larutan lugol. Sel kemudian dicuci dengan alkohol utnuk menghilangkan violet kristal. Setelah dicuci dengan air, kemudian diwarnai dengan safranin. Sel-sel yang tidak dapat melepaskan warna dan akan tetap berwarna seperti warna kristal violet yaitu biru-ungu disebut dengan bakteri gram positif, sedangkan sel-sel yang dapat melepaskan violet kristal dan mengikat safranin sehingga berwarna merah- merah muda disebut dengan bakteri gram negatif (Fardiaz, 1989). Pewarnaan bakteri dengan pewarnaan sederhana atau deferensial adalah untuk memilah bakteri menjadi gram positif dan gram negatif. Gram positif terlihat ungu, sedangkan gram negatif terlihat merah (Lay dan Sugyo, 1992).
BAB III
METODOLOGI
Praktikum Mikrobiologi dilaksanakan pada hari Sabtu tanggal 18 Mei 2013 pukul 10.00-13.00 WIB dengan materi Sterilisasi dan Medium serta Larutan Pengencer. Pada hari Minggu tanggal 19 Mei 2013 pukul 13.00-15.00 WIB dengan materi Metode Hitungan Cawan dan Pewarnaan Gram. Praktikum dilaksanakan di Laboratorium Fisiologi dan Biokimia Ternak Fakultas Peternakan dan Pertanian Universitas Diponegoro, Semarang.
3.1. Materi
Alat yang digunakan pada praktikum mikrobiologi adalah oven berfungsi untuk membantu mensterililasi alat-alat sebelum digunakan,Autoklaf untuk sterilisasi. Cawan petri berfungsi untuk tempat penumbuhan bakteri, pipet hisap dan penghisap berfungsi menghisap larutan, pipet tetes berfungsi untuk mengambil larutan atau cairan dalam jumlah kecil, erlenmeyer berfungsi untuk menampung larutan, bahan atau cairan, tabung reaksi berfungsi sebagai tempat larutan pengencer, timbangan elektrik berfungsi untuk menimbang bahan-bahan, gelas beker berfungsi menempatkan larutan, gelas ukur berfungsi untuk mengukur cairan atau larutan, pisau untuk memotong kentang, loop berfungsi untuk mengambil bahan biakan, bunsen berfungsi untuk memanaskan loop supaya tetap steril dan untuk fiksasi, pengaduk magnetik berfungsi untuk mengaduk larutan supaya homogen, kaca objek berfungsi sebagai tempat untuk meletakkan bakteri
sebelum dilihat dengan mikroskop, inkubator berfungsi sebagai tempat pembiakan bakteri dan disesuaikan dengan suhu optimal pertumbuhan bakteri, mikroskop sebagai alat bantu untuk melihat benda-benda kecil berupa biakan bakteri
Escherichia colli dan Lactobacillus asidiphidus. Bahan yang digunakan adalah
kertas pembungkus untuk membungkus alat-alat yang akan disterilisasi, kapas untuk menutup erlenmeyer dan tabung reaksi, aluminium foil untuk menutup gelas beker, alkohol, kentang, dekstrosa, agar, aquades, asam tartarat 10%, sampel berupa kefir, larutan gram A (ungu kristal), gram B (kristal iodium), gram C (etanol), dan gram D (safranin).
3.2. Metode
3.2.1. Sterilisasi
3.2.1.1. Sterilisasi Kering, menyiapkan pipet hisap dan cawan petri kemudian
membersihkannya menggunakan alkohol. Menyumbat bagian pangkal pipet dengan kapas. Membungkus cawan petri dan pipet hisap dengan kertas pembungkus. Memasukkan cawan petri dan pipet hisap ke dalam oven selama 1 jam pada suhu 170°C. Mengeluarkan pipet hisap dan cawan petri dari oven. Menunggu hingga dingin sebelum digunakan.
3.2.1.2. Sterilisasi Basah, memasukkan medium yang akan disterilkan ke dalam
erlenmeyer. Memasukkan aquades sebanyak 9 ml ke dalam tabung reaksi sebanyak 8 buah. Menutup rapat erlenmeyer dan tabung reaksi menggunakan kapas. Memasukkan erlenmeyer dan tabung reaksi tersebut ke dalam autoklaf,
kemudian menutup autoklaf dengan rapat. Menyalakan autoklaf dan menunggu hingga manometer serta termometer menunjukkan suhu 121°C dengan tekanan 2 atm selama 60 menit. Membuka katup pengaman dan membiarkan hingga autoklaf tidak lagi bertekanan (uap air keluar). Membuka autoklaf dan mengeluarkan mediumnya. Khusus untuk medium agar, untuk menurunkan suhunya dan menjaga agar tidak membeku maka memasukkan medium ke dalam inkubator bersuhu 55°C sebelum digunakan.
3.2.2. Medium dan Larutan Pengencer
Mengupas kentang dengan pisau tajam hingga bersih, kemudian membilas dengan air bersih. Mengiris kentang tersebut dengan ukuran kira-kira 1x1x1 cm. Menimbang kentang dengan tepat sebanyak 500 gram. Memasukkan kentang ke dalam beker glass, kemudian menambahkan 1000 ml aquades, menutup beker glass dengan aluminium foil serapat mungkin. Memanaskan dalam waterbath hingga mendidih selama 30 menit. Setelah dingin, kemudian melumat kentang hingga hancur. Mengambil filtrat kentang dengan cara menyaringnya menggunakan kain saring atau kapas yang bersih. Setelah filtrat terkumpul mengukur volumenya untuk membuat medium PDA dengan komposisi: 50 ml filtrat, 1,5 gram agar serta 1 gram dextrose.
3.2.3. Metode Hitungan Cawan
3.2.3.1. Metode pengenceran, menyiapkan tabung reaksi yang telah berisi
dengan pengenceran yang ditetapkan. Mengencerkan 1 ml sampel ke dalam 9 ml aquades sampai 8 tingkat pengenceran.
3.2.3.2. Cara menghitung koloni, metode yang digunakan pada penghitungan
jumlah koloni akan lebih mudah dan cepat jika pengenceran dilakukan secara desimal. Sebagai contoh misalnya penetapan jumlah koloni pada nuget. Pengenceran awal 1:10 dibuat dengan cara mengencerkan 1 ml ekstrak nuget ke dalam 9 ml larutan pengencer dengan pengenceran yang lebih tinggi misalnya sampai 10-5 tergantung pada mutu nugetnya. Semakin tinggi pengenceran yang harus dilakukan. Menghitung koloni hanya pada cawan yang jumlah koloninya antara 30-300. Menghitung sebagai satu koloni untuk beberapa koloni yang bergabung menjadi satu sehingga merupakan suatu kumpulan koloni besar yang jumlah koloninya diragukan. Menghitung deretan atau rantai koloni yang terlihat seperti suatu garis tebal sebagai satu koloni.
3.2.4. Pewarnaan Gram
Metode yang dilakukan dalam pewarnaan gram yaitu terlebih dahulu menyiapkan olesan bakteri pada kaca objek yang sebelumnya telah memfiksasi panas, kemudian menggenangi objek dengan larutan gram A selama 1 menit. Membuang sisa zat warna pada nampan. Membilas objek dengan aquades. Menggenangi kembali objek dengan larutan gram B selama 2 menit. Membuang sisa zat warna pada nampan, kemudian membilas objek dengan aquades. Membilas objek dengan larutan gram C, kemudian membilas kembali dengan aquades. Menggenangi objek dengan larutan gram D selama 30 detik. Membuang
sisa zat warna pada nampan, kemudian membilas objek dengan aquades. Membersihkan sisa aquades dengan tissue, kemudian mengamatinya dengan bantuan mikroskop.
BAB IV
HASIL DAN PEMBAHASAN
4.1. Sterilisasi
4.1.1. Sterilisasi Kering
Sterilisasi kering digunakan untuk mensterilisasikan alat-alat pecah belah dengan menggunakan oven. Penggunaan oven dalam sterilisasi kering selama 1 jam pada suhu 170°C. Suhu 170°C dipilih karena pada temperatur tersebut dimungkinkan mikroba tidak dapat hidup, sehingga alat benar-benar steril atau terbebas dari mikroba. Hal ini sesuai dengan pendapat Pratiwi (2008), yang menyatakan bahwa ada dua metode sterilisasi panas kering yaitu dengan insinerasi, yaitu pembakaran dengan menggunakan api dari bunsen dengan
temperatur sekitar 3500C, dan dengan udara panas oven yang lebih sederhana dan
murah dengan temperature sekitar 1600C sampai 1700C. Ditambahkan oleh
Dwijoseputro (2005), yang berpendapat bahwa alat-alat dari gelas dimasukkan di dalam oven kering selama waktu dan pada temperatur 1600C sampai 1700C, hal ini bergantung kepada banyak sedikitnya muatan yang dimasukkan dalam oven.
4.1.2. Sterilisasi Basah
Sterilisasi basah digunakan untuk mensterilisasi medium yang akan digunakan sebagai media biakan mikroba. Sterilisasi basah dilakukan dengan menggunakan autoklaf. Autoklaf merupakan alat yang dilengkapi dengan
manometer, termometer dan klep pengaman. Autoklaf digunakan dalam sterilisasi karena autoklaf tidak merusak bahan dan alat yang disterilisasi karena pemanasan dan tekanan. Hal ini sesuai dengan pendapat Adji et al., (2007), yang menyatakan bahwa autoklaf adalah suatu bejana yang dapat ditutup, yang diisi dengan tekanan
tinggi, suhu di dalamnya dapat mencapai 1150C hingga 1250C dan tekanan uapnya
mencapai 2 hingga 4 atm. Hal ini ditambahkan oleh Pratiwi (2008), yang berpendapat bahwa tingkat sterilisasi panas basah digunakan untuk bahan yang sensitif panas untuk industri makanan berkisar pada temperatur 600C sampai 800C, sedangkan pada peralatan dan cairan disterilkan dengan pemanasan pada temperature 1000C selama 5-10 menit.
4.2. Pembuatan Medium PDA
Potato Dextrose Agar (PDA) yang dihasilkan dalam praktikum
mikrobiologi ini berbentuk padat sehingga mikroorganisme dapat tumbuh dan berkembang. Medium PDA terdiri dari ekstrak kentang, dextrose, agar. Fungsi agar adalah untuk memadatkan medium sehingga saat sudah medium sudah padat mikroba dapat diamati. Hal ini sesuai dengan pendapat Schmidt (1994), yang menyatakan bahwa untuk membuat biak padat pada larutan biak cair ditambahkan bahan pemadat yang memberi konsistensi seperti selai pada larutan air. Bahan
pemadat yang ideal adalah agar.Hal tersebut diperkuat oleh Fardiaz (1989), yang
menyatakan bahwa jika sel mikroba yang masih hidup ditumbuhkan pada medium agar maka sel mikroba tersebut akan berkembang biak dan membentuk koloni
yang nantinya dapat dilihat secara langsung dengan mata tanpa menggunakan mikroskop.
4.3. Metode Penghitungan Cawan
Berdasarkan hasil praktikum metode perhitungan cawan pada sampel kefir diperoleh data sebagai berikut:
Tabel 1. Hasil Perhitungan Cawan dengan Sampel Kefir
Medium Pengenceran SPC (ml) 10-6 10-7 10-8 PDA 104 1,04 x 108 88 60 Sumber : Data Primer Praktikum Mikrobiologi, 2013
Berdasarkan pengamatan diketahui jumlah bakteri pada Potato Dextrose
Agar (PDA) sebanyak 1,04 x 108 yang merupakan rata-rata dari pengenceran 10-6 karena perbandingan pengenceran 10-6 dan 10-8 dan menghasilkan rata-rata lebih dari 2 yaitu 8,4. Dari hasil tersebut didapatkan hasil yang baik, ditandai dengan jumlah sel mikroba yang dapat dihitung antara 30 sampai 300 koloni, yaitu jumlah
bakteri dalam kefir adalah 20,33 x 108 CFU/gram. Hal ini sesuai dengan pendapat
Fardiaz (1989), yang menyatakan bahwa bahan pangan yang diperkirakan mengandung lebih dari 300 sel mikroba per ml, per gram, atau per cm. Bakteri yang ditumbuhkan pada medium agar di dalam cawan petri dan diinkubasi dikatakan menghasilkan jumlah yang terbaik adalah di antara 30 sampai 300 koloni. Ditambahkan oleh Schmidt (1994), yang berpendapat bahwa yang dianggap sebagai sel hidup ialah sel yang mampu membentuk koloni di dalam
agar biak atau membentuk suspensi dalam larutan biak. Sel-sel yang mampu hidup terus yang dihitung dengan berbagai metode untuk menetapkan jumlah sel hidup.
4.4. Pewarnaan Gram
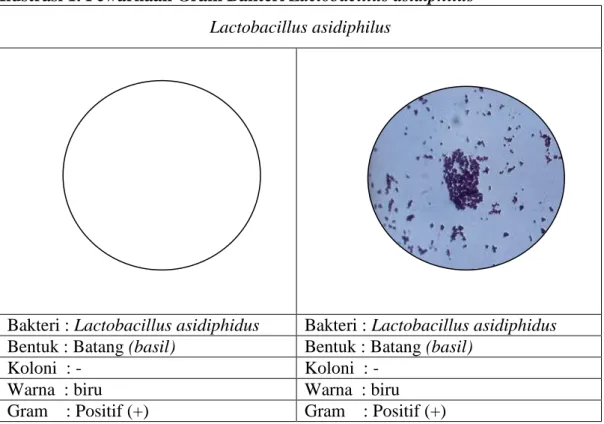
4.4.1. Lactobacillus asidiphilus
Berdasarkan hasil pengamatan terhadap pewarnaan gram yang dilakukan terhadap kultur padat Lactobacillus asidiphilus dengan perbesaran 100x, diperoleh hasil sebagai berikut :
Ilustrasi 1. Pewarnaan Gram Bakteri Lactobacillus asidiphilus Lactobacillus asidiphilus
Bakteri : Lactobacillus asidiphidus Bakteri : Lactobacillus asidiphidus
Bentuk : Batang (basil) Bentuk : Batang (basil)
Koloni : - Koloni : -
Warna : biru Warna : biru
Gram : Positif (+) Gram : Positif (+)
Sumber : Data Primer Praktikum Mikrobiologi, 2013.
Berdasarkan hasil praktikum pewarnaan gram pada Lactobacillus
asidiphidus tampak warna biru dengan bentuk basil atau batang. Pernyataan
tersebut membuktikan bahwa Lactobacillus asidiphidus termasuk bakteri gram positif . Gram positif tidak menunjukan perubahan warna setelah dicuci dengan alkohol dan diwarnai dengan safranin. Hal ini sesuai dengan pendapat Fardiaz (1986), yang menyatakan bahwa sel-sel yang tidak dapat melepaskan warna akan tetap berwarna seperti warna kristal violet yaitu biru-ungu. Hal ini ditambahkan oleh Lay dan Sugyo (1992), yang berpendapat bahwa pada bakteri gram positif, kompleks KV-I (Kristal Violet Yodium) terperangkap dalam dinding sel setelah perlakuan dengan ethanol. Hal ini disebabkan pori-pori pada lapisan peptidoglikan mengecil.
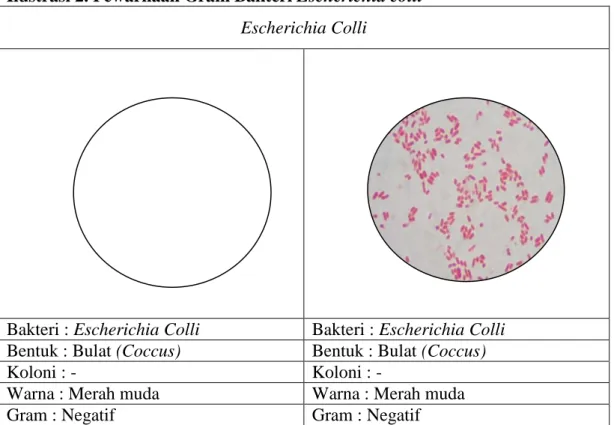
Ilustrasi 2. Pewarnaan Gram Bakteri Escherichia colli Escherichia Colli
Bakteri : Escherichia Colli Bakteri : Escherichia Colli
Bentuk : Bulat (Coccus) Bentuk : Bulat (Coccus)
Koloni : - Koloni : -
Warna : Merah muda Warna : Merah muda
Gram : Negatif Gram : Negatif
Sumber : Data Primer Praktikum Mikrobiologi, 2013. Sumber : www.google.co.id
Pewarnaan Gram pada Escherichia Colli didapatkan bentuk bulat dan warna merah muda. Pernyataan tersebut menunjukan bahwa Escherichia Colli termasuk bakteri gram negatif, yang dimana menunjukan perubahan warna menjadi merah muda setelah diwarnai safranin. Hal ini sesuai dengan pendapat Fardiaz (1989), yang menyatakan bahwa dalam pewarnaan gram mula-mula sel bakteri diwarnai dengan zat warna basa yaitu violet kristal. Sel-sel yang yang dapat melepaskan violet kristal dan mengikat safranin akan berwarna merah muda. Hal ini ditambahkan oleh Djauhari (2006), yang berpendapat bahwa dengan pewarnaan gram dapat dibedakan menjadi gram positif dan gram negatif. Dimana gram positif berwarna biru dan gram negatif berwana merah. Setiap bakteri terbagi dalam bakteri berbentuk bulat dan batang.
BAB V
SIMPULAN DAN SARAN
5.1. Kesimpulan
Berdasarkan hasil praktikum sterilisasi, sterilisasi dilakukan berdasarkan bentuk alat atau bahan yang akan disterilkan. Berdasarkan hasil praktikum medium dan larutan pengencer, pembuatannya harus dilakukan dalam kondisi yang benar-benar steril agar tidak terkontaminasi mikroorganisme yang lain. Berdasarkan hasil praktikum metode hitungan cawan, dengan menggunakan sampel kefir, jumlah bakteri yang dapat dihitung pada medium PDA menghasilkan jumlah koloni yang baik karena tidak kurang dari 30 dan tidak lebih dari 300. Berdasarkan hasil praktikum didapatkan hasil pada pewarnaan bakteri gram negatif dengan bentuk bulat (coccus), sedangkan pada bakteri positif berbentuk batang (basil). Metode pewarnaan Gram dapat diketahui bakteri
Lactobacillus asidiphilus yang berwarna biru merupakan bakteri gram positif,
sedangkan Escherichia colli yang berwarna merah muda merupakan bakteri gram negatif.
5.2. Saran
Ketika praktikum mikrobiologi sebaiknya ketersediaan alat harus dipersiapkan sebelum praktikum agar praktikan dapat melakukan praktikum dengan lancar dan lebih baik lagi, selain itu alat dan bahan harus benar-benar steril, jika tidak maka akan mendapat hasil yang kurang baik.
DAFTAR PUSTAKA
Adji, D. Zuliyanti dan Larashanty. 2007. Perbandingan Efektivitas Sterilisasi Alkohol 70%, Inframerah, Otoklaf dan Ozon terhadap Pertumbuhan Bakteri
Bacillus subtilis. J. Sain Vet. Vol. 25 No. 1. 17:24.
Djauhari, R. 2006. Identifikasi Potensi Bakteri Patogen pada Budidaya Ikan Betok (Anabas testudineus Bloch. Journal of Tropical Fisheries 1 (1). 71:79.
Dwidjoseputro, D. 2005. Dasar-Dasar Mikrobilogi. Djambatan, Jakarta.
Fardiaz, S. 1989. Analisis Mikrobiologi Pangan. Depdikbud Dikti Pusat Antar Universitas Pangan dan Gizi IPB Press, Bogor.
Lay, B. and Sugyo Hastowo. 1992. Mikrobiologi. Rajawali Press, Jakarta.
Pelczsar, M. J. dan E. C. S. Chan. 1988. Dasar-Dasar Mikrobiologi Jilid 2. UI-Press, Jakarta.
Pratiwi, S. 2008. Mikrobiologi Farmasi. Erlangga, Jakarta.
Schmidt, K. 1994. Mikrobiolgi Umum Edisi keenam. Gajah Mada University Press, Yogyakarta.
LAMPIRAN
Lampiran 1. Gambar Alat dan Fungsi
No. Gambar Fungsi
1.
Pipet hisap
Untuk mengambil larutan atau cairan dalam jumlah kecil.
3.
Untuk pemijaran jarum ose atau jarum inokulum sebagai pemindah biakan ke media baru.
4.
Autoklaf
Untuk mensterilisasi suatu benda
menggunakan uap bersuhu dan
bertekanan tinggi (1210C, 15 lbs) selama kurang lebih 15 menit.
5.
Erlenmeyer
Lampiran 1. (lanjutan)
6.
Mikroskop
Sebagai alat bantu untuk melihat bakteri.
7.
Cawan petri
Untuk tempat medium menumbuhan bakteri.
8.
Gelas ukur
Sebagai tempat larutan.
10.
Kaca objek
Sebagai tempat untuk meletakkan sesuatu sebelum di liat dengan mikroskop.
Lampiran 1. (lanjutan)
11.
Timbangan elektrik
Untuk menimbang bahan-bahan.
12.
Untuk mengaduk cairan Nutrient Agar dan Acidified Potato dextrose Agar.
14.
Kertas saring
Untuk menyaring filtrat yang akan digunakan.
15.
Alumunium foil
Untuk penutup saat mensterilkan sampel cair.
16.
Coloni counter
Untuk memudahkan penghitungan
Lampiran 1. (lanjutan)
17.
Inkubator
Untuk menginkubasi mikroba pada suhu yang terkontrol.
18.
Waterbath
Untuk memanaskan kentang sebagai medium APDA.
19. Untuk mengambil biakan bakteri
20.
Hand counter
Untuk membantu menghitung jumlah koloni bakteri
Lampiran 2. Menjawab Pertanyaan
A. Medium dan Larutan Pengencer
1. Jelaskan fungsi dari masing-masing komponen di bawah ini dalam medium : a. Pepton
b. Agar
c. Ekstrak sapi d. NaCl
Jawab :
a. Pepton berfungsi sebagai sumber utama nitrogen organic dari sumber nutris b. Agar berfungsi sebagai pemadat medium PDA
c. Ekstrak sapi berfungsi sebagai perangsang spermiasi pada sapi d. NaCl berfungsi sebagai media pendingin.
2. Jelaskan perbedaan masing-masing medium di bawah ini : a. Nutrien Agar
b. Potato Dextrose Agar c. Lactose Broth
d. Plate Count Agar
e. Brilliant Green Lactose Bile Broth Jawab :
a. Nutient Agar merupakan medium umum untuk uji air dan prosuk diary yang digunakan untuk pertumbuhan mayoritas dari mikroorganisme yang tidak selektif, dalam artian mikroorganisme heterotrof.
b. Potato Dextrose Agar merupakan medium mikroorganisme yang terbuat dari infus kentang dan dextrosenya atau gula jagung.
c. Lactose Broth merupakan medium yang digunakan untuk pendektesian bakteri coliform (Escherichia dan Enterobacter), sebagai preenrichment untuk Salmonella dan studi fermentasi laktosa bakteri secara umum.
d. Plate Count Agar merupakan media pertumbuhan umum yang digunakan untuk menila atau memantau pertumbuhan bakteri yang layak sampel.
e. Briliant Green Lactose Bile Broth merupakan medium yang digunakan untuk mendeteksi bakteri coliform dalam air, makanan, dan produk susu. 3. Sebut dan jelaskan klasifikasi medium!
Jawab :
a. Medium berdasarkan sifat fisik
Medium padat yaitu media yang mengandung agar 15% sehingga
setelah dingin media menjadi padat.
Medium setengah padat yaitu media yang mengandung agar 0,3-0,4%
sehingga menjadi sedikit kenyal, tidak padat, tidak begitu cair.
Medium cair yaitu media yang tidak mengandung agar, contohnya
adalah NB (Nutrient Broth), LB (Lactose Broth). b. Medium berdasarkan komposisi
Medium sintesis yaitu media yang komposisi zat kimianya diketahui jenis dan takarannya secara pasti, misalnya Glucose Agar, Mac Conkey Agar.
Medium semi sintesis yaitu media yang sebagian komposisinya diketahui secara pasti, misanya PDA (Potato Dextrose Agar) yang mengandung agar, dekstrosa dan ekstrak kentang.
Medium non sintesis yaitu media yang dibuat dengan komposisi yang
tidak dapat diketahui secara pasti dan biasanya langsung diekstrak dari bahan dasarnya, misalnya Tomato Juice Agar, Brain Heart Infusion Agar, Pancreatic Extract.
c. Medium berdasarkan tujuan
Media untuk isolasi: Media ini mengandung semua senyawa esensial untuk pertumbuhan mikroba, misalnya Nutrient Broth, Blood Agar.
Media selektif/penghambat: Media yang selain mengandung nutrisi
juga ditambah suatu zat tertentu sehingga media tersebut dapat menekan pertumbuhan mikroba lain dan merangsang pertumbuhan mikroba yang diinginkan. Contohnya adalah Salt broth yang ditambah NaCl 4% untuk membunuh Streptococcus agalactiae yang toleran terhadap garam.
Media diperkaya (enrichment): Media diperkaya adalah media yang
mengandung komponen dasar untuk pertumbuhan mikroba dan ditambah komponen kompleks seperti darah, serum, kuning telur. Misalnya Blood Tellurite Agar, Bile Agar, Serum Agar, dll.
Media untuk peremajaan kultur: Media umum atau spesifik yang
digunakan untuk peremajaan kultur.
Media ini digunakan untuk mendiagnosis atau menganalisis metabolisme suatu mikroba. Contohnya adalah Koser’s Citrate medium, yang digunakan untuk menguji kemampuan menggunakan asam sitrat sebagai sumber karbon.
Media untuk karakterisasi bakteri: Media yang digunakan untuk
mengetahui kemampuan spesifik suatu mikroba. Contohnya adalah
Nitrate Broth, Lactose Broth, Arginine Agar.
Media diferensial: Media ini bertujuan untuk mengidentifikasi mikroba
dari campurannya berdasar karakter spesifik yang ditunjukkan pada media diferensial, misalnya TSIA (Triple Sugar Iron Agar) yang mampu memilih Enterobacteria berdasarkan bentuk, warna, ukuran koloni dan perubahan warna media di sekeliling koloni.
B. Sterilisasi
1. Jelaskan perbedaan sterilisasi kering dan sterilisasi basah ! Jawab :
- Sterilisasi kering : suatu usaha untuk membebaskan alat-alat dari segala macam mikroba. Sterilisasi kering dilakukan dengan berbagai cara yaitu dengan pemijaran langsung serta dengan menggunakan oven.
- Sterilisasi basah : suatu usaha untuk membebaskan bahan-bahan dari segla macam mikroba. Biasanya sterilisasi basah menggunakan alat yaitu autoklaf dan Arnold Steam Sterilzer.
2. Jelaskan tujuan sterilisasi ! Jawab :
Untuk membebaskan alat-alat atau bahan-bahan dari segala macam mikroba
C. Metode Perhitungan Cawan
1. Bagaimana prosedur perhitungan total mikroba pada sempel susu bubuk
hingga pengenceran 10-5. Hitung pula kebutuhan alat dan bahan!
Jawab :
Alat : tabung reaksi, cawan petri, pipet, penghisap, erlenmeyer, bunsen
Bahan : sampel yang akan di hitung (bakteri/jamur/mikroba), medium
Prosedur : menyiapkan dan memberi label pengencer dan cawan petri steril
sesuai dengan pengenceran dan pemupukan yang ditetapkan. Melakukan pengenceran sampai tingkat pengenceran yang ditentukan (melakukan sampai tingkat pengenceran 10-5 pada bahan yang busuk). Melakukan pencawanan pada 4 tingkat pengenceran yang terakhir dan memasukkan pada cawan petri. 2. Laporkan ”Standard Plate Count” dari sampel di bawah ini:
Sampel Pengenceran SPC 10-2 10-3 10-4 10-5 Kaldu daging 280 262 45 28 3 1 - -
Susu segar TBUD
TBUD TBUD TBUD 708 782 158 302 Sosis TBUD 294 35 5 Dendeng 55 15 1 0 Jawab :
Laporan ”Standard Plate Count” Sampel Pengenceran SPC (cfu/ml) 10-2 10-3 10-4 10-5 Kaldu daging 280 262 45 28 3 1 - - 1,5 x 10 4
Susu segar TBUD
TBUD TBUD TBUD 708 782 158 302 2,3 x 10 7 Sosis TBUD 294 35 5 1,6 x 105 Dendeng 55 15 1 0 5,5 x 103
Kaldu daging : Rata-rata dari pengenceran 10-2 karena perbandingan
pengenceran 10-2 dan 10-3 adalah 1,3 (< 2)
SPC = 153 x 1/10-2
= 153 x 102 = 1,5 x 104 cfu/ml Susu segar : Rata-rata dari pengenceran 10-5 adalah 230
SPC = 230 x 1/10-5 = 230 x 105
= 2,3 x 107 cfu/ml
Sosis : Rata-rata dari pengenceran 10-3 karena perbandingan pengenceran
10-3 dan 10-4 adalah 1,2 (< 2) SPC = 164 x 1/10-3 = 164 x 103 = 1,6 x 105 cfu/ml Dendeng : SPC = 55 x 1/10-2 = 55 x 10-2 = 5,5 x 103 cfu/ml D. Pewarnaan Bakteri
Jawab : Gram positif :
Tidak mengalami dekolorisasi karena tetap mengikat warna ungu kristal
violet
Pada tahap akhir pengecatan tidak terwarnai safranin
Memiliki selapis dinding sel berupa peptidoglikan yang tebal
tampak merah jika waktu dekolorisasi terlalu lama
Gram negatif :
Mengalami dekolorisasi oleh alcohol
Pada tahap akhir pengecatan terwarnai menjadi merah oleh safranin
Memiliki 3 lapisan dinding sel
Tampak ungu bila waktu dekolorisasi terlalu pendek
2. Sebutkan jenis dan bentuk koloni bakteri yang termasuk patogen ! Jawab :
a. Bakteri penyebab penyakit pada manusia:
No. Nama bakteri Penyakit yang ditimbulkan
1. Salmonella typhosa Tifus
2. Shigella dysenteriae Disentri basiler
3. Vibrio comma Kolera
5. Diplococcus pneumoniae Pneumonia (radang paru-paru)
6. Mycobacterium tuberculosis TBC paru-paru
7. Clostridium tetani Tetanus
8. Neiseria meningitis Meningitis (radang selaput otak)
9. Neiseria gonorrhoeae Gonorrhaeae (kencing nanah)
10. Treponema pallidum Sifilis atau Lues atau raja singa
11. Mycobacterium leprae Lepra (kusta)
12. Treponema pertenue Puru atau patek
b. Bakteri penyebab penyakit pada hewan:
No. Nama bakteri Penyakit yang ditimbulkan
1. Brucella abortus Brucellosis pada sapi
2. Streptococcus agalactia Mastitis pada sapi (radang payudara)
3. Bacillus anthracis Antraks
4. Actinomyces bovis Bengkak rahang pada sapi
c. Bakteri penyebab penyakit pada tumbuhan:
No. Nama bakteri Penyakit yang ditimbulkan
1. Xanthomonas oryzae Menyerang pucuk batang padi
2. Xanthomonas campestris Menyerang tanaman kubis
3. Pseudomonas solanacaerum Penyakit layu pada famili
terung-terungan
Lampiran 6. Perhitungan Metode Cawan
Rata-rata pengenceran = 60 x 10-8/104 x 10-6
= 6000 x 10-6/104 x 10-6
= 57,6
Rata-rata dari pengenceran 10-6 karena perbandingan pengenceran 10-6 dan 10-8 adalah 57,6 (< 2)
SPC = 104 x 1/10-6
= 104 x 106 = 1,04 x 108