Laporan Praktikum Kimia Dasar Asidi Alkalimetri
Elvita Rahmani 1713511065 Kelompok 05
Kelas B
Program Studi Ilmu Kelautan Fakultas Kelautan dan Perikanan
A. Tujuan
Adapun tujuan dari dilakukannya praktikum asidi alkalimetri adalah sebagai berikut :
1. Untuk mengetahui cara pembuatan larutan dengan cara titrasi.
2. Untuk menentukan normalitas larutan baku primer dan larutan baku sekunder, dan kadar sampel.
B. Dasar Teori
Asidi diambil dari kata (acid) yaitu asam, dimana asam adalah senyawa yang jika dilarutkan dalam air menghasilkan ion hidrogen, sedangkan alkali adalah istilah basa yang berasal dari bahasa arab yang berarti abu, dimana basa adalah zat yang dapat menghasilkan ion hidroksida jika dilarutkan dalam air ( Priscilla, 2007).
Asidimetri adalah suatu analisis secara volumetrik, kadar suatu asam dalam larutan, dimana larutan standar (suatu asam) diteteskan, melalui buret kedalam larutan basa bebas dan larutan garam terhidrolisasi dari asam lemah dengan menggunakan indikator, analisis sebaliknya disebut alkalimetri, dimana larutan basa yang ditambahkan kedalam larutan asam (Fatih, 2008).
Indikator asam-basa merupakan zat yang dapat menunjukkan warna yang berbeda dalam larutan yang bersifat asam dan basa dimana indikator yang digunakan untuk mengukur pH suatu larutan dimana indikator PP (Phenolphtalein) digunakan pada titrasi dengan pH 8,0-9,5 dengan perubahan warna tidak berwarna menjadi merah muda (Priscilla, 2007).
dengan tepat disertai tambahan indikator (Agnestia, 2004). Proses standarisasi dikenal dengan proses penentuan konsentrasi suatu larutan yang dipastikan dengan tepat. Larutan yang telah distandarisasi dapat digunakan sebagai standar sekunder untuk mendapatkan konsentrasi dari bahan larut lainnya (Underwood, 2001). Analisis volumetri mengacu pada analisis kimia kuantitaif yang dilakukan dengan menetapkan volume suatu larutan yang konsentrasinya diketahui dengan tepat. Yang diperlukan untuk bereaksi secara kuantitatif dengan larutan dari zat yang akan ditetapkan bobot zatnya, dihitung volume larutan standar yang digunakan dan hukum-hukum stoikiometri yang diketahui (Didik, 2009). Pada titrasi asam-basa dikenal :
1. Titik ekivalen adalah suatu keadaan pada saat asam dan basa tepat bereaksi.
2. Titik akhir titrasi adalah suatu keadaan dimana titrasi harus dihentikan tepat pada saat indikator asam-basa menunjukan perubahan warna. (Priscilla, 2007).
C. Prosedur Percobaan
1. Alat dan Bahan
1.1 Alat
Adapun alat yang digunakan dalam praktikum asidi alkalimetri adalah sebagai berikut :
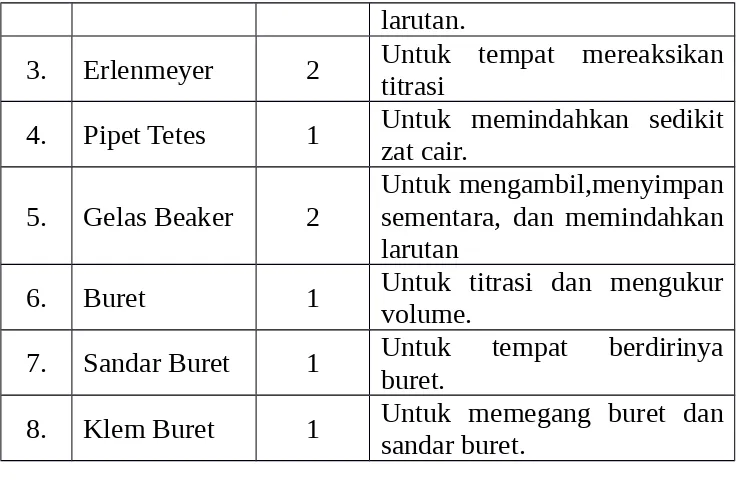
Tabel 5. Alat yang digunakan pada asidi alkalimetri
No. Nama Alat Jumlah Kegunaan
larutan.
3. Erlenmeyer 2 Untuk tempat mereaksikantitrasi 4. Pipet Tetes 1 Untuk memindahkan sedikitzat cair.
5. Gelas Beaker 2
Untuk mengambil,menyimpan sementara, dan memindahkan larutan
6. Buret 1 Untuk titrasi dan mengukurvolume. 7. Sandar Buret 1 Untuk tempat berdirinyaburet. 8. Klem Buret 1 Untuk memegang buret dansandar buret.
1.2 Bahan
Adapun bahan yang digunakan pada praktikum asidi alkalimetri adalah sebagai berikut :
Tabel 6. Bahan yang digunakan pada asidi alkalimetri
No. Nama Bahan Jumlah Kegunaan
1. Asam Oksalat 20 mL Sebagai larutan bakuprimer 2. Asam Asetat 20 mL Sebagai sampel
3. Phenolphtalein Secukupnya Sebagai indikator
4. NaOH Secukupnya Sebagai larutan bakusekunder 5. Aquades Secukupnya Sebagai pembersih danpengering
2. Cara Kerja
Adapun cara kerja yang digunakan pada praktikum asidi alkalimetri adalah sebagai berikut :
1. Dipipet 10 mL larutan baku primer asam oksalat dengan pipet ukur yang kering dan bersih, kemudian dimasukkan kedalam erlenmeyer.
2. Ditambahkan 2-3 tetes indikator phenolphtalein. 3. Dititrasi dengan larutan NaOH sampai terjadi perubahan warna dari tak berwarna menjadi merah muda.
4. Dicatat volume NaOH yang digunakan.
5. Diulangi pekerjaan diatas sebagai percobaan kedua.
6. Dihitung normalitas rata-rata NaOH sampai empat angka dibelakang koma.
b. Menentukan kadar sampel (asam asetat)
1. Dipipet 10 mL larutan sampel dengan pipet ukur yang kering dan bersih, kemudian dimasukkan kedalam erlenmeyer.
2. Ditambahkan 2-3 tetes indikator phenolphtalein. 3. Dititrasi dengan larutan NaOH sampai terjadi perubahan warna dari tak berwarna menjadi merah muda.
4. Dicatat volume NaOH yang digunakan.
5. Diulangi pekerjaan diatas sebagai percobaan kedua.
6. Dihitung kadar rata-rata sampel sampai dua angka dibelakang koma dalam satuan g/100 mL (%b’v).
D. Hasil Pengamatan
Adapun hasil pengamatan pada praktikum asidi alkalimetri adalah sebagai berikut :
1. Menentukan normalitas larutan baku primer asam oksalata
Volume : 10 mL
Normalitas : 10, 2138 N
2. Menentukan normalitas larutan baku sekunder (NaOH) Indikator : Phenolphtalein
Perubahan warna : Merah muda Normalitas rata-rata: 48, 8231 N 3. Pengamatan 1
Tabel 7. Data penentuan normalitas larutan sekunder NaOH Percobaan Volume Asam oksalat Volume NaOH
1 10 mL 10,5 mL
2 10 mL 10 mL
4. Menentukan kadar sampel ( CH3COOH) Indikator : Phenolphtalein Perubahan warna : Merah muda Kadar rata-rata : 1,08 g/100 mL
5. Pengamatan 2
Tabel 8. Data penentuan kadar sampel CH3COOH Percobaan Volume CH3COOH Volume NaOH
1 10 mL 19 mL
2 10 mL 17 mL
E. Perhitungan
Adapun perhitungan yang digunakan dalam praktikum asidi alkalimetri adalah sebagai berikut :
1. Menghitung normalitas asam oksalat N = gram x 1000 x a
mr V
6,4347 x 1000 x 2 = 10, 2138 N 126 10
Percobaan 1
N = gram x 1000 x a mr V
20,0056 x 1000 x 1 = 47, 6323 N 40 10,5
Percobaan 2
N = gram x 1000 x a mr V
20,0056 x 1000 x 1 = 50,014 N 40 10
Rata-rata normalitas NaOH =47,6323+50,014 = 48, 8231 N
2
3. Menghitung kadar sampel (CH3COOH) Percobaan 1
V CH3COOH x M CH3COOH = V NaOH x M NaOH 10 x M CH3COOH = 19 x 0,1
M CH3COOH = 0,19 M M CH3COOH = x 10 x %ƿ
Mr
0,19 = 1 x 10 x % = 1,14 g/100 mL 60
Percobaan 2
V CH3COOH x M CH3COOH = V NaOH x M NaOH 10 x M CH3COOH = 17 x 0,1
M CH3COOH = 0,17 M M CH3COOH = x 10 x %ƿ
Mr
Rata-rata kadar sampel CH3COOH = 1,14 + 1,02 = 1,08 g/100 mL
F. Pembahasan
Pada percobaan praktikum ini menggunakan metode analisis volumetri, yaitu menggunakan larutan standar yang telah diketahui konsentrasinya. Titrasi kali ini menggunakan metode asidi alkalimetri dimana pada percobaan pertama menggunakan metode asidimetri karena larutan standar sekunder menggunakan NaOH yang merupakan komponen basa distandarisasi dengan asam oksalat yang merupakan komponen asam sebagai larutan primer, sedangkan pada percobaan kedua menggunakan metode alkalimetri karena menentukan kadar asam asetat dengan larutan basa NaOH yang telah distandarisasi.
Dalam pembuatan larutan baku sekunder NaOH (metode asidimetri) dilakukan 2x percobaan. Percobaan pertama dan percobaan kedua sama-sama menggunakan larutan baku primer asam oksalat yang dicampur dengan indikator phenolphtalein yang dititrasi dengan NaOH yang diteteskan sedikit demi sedikit smpai tercapai titik akhir titrasi. Tetapi adapula perbedaannya yaitu volume NaOH yang diteteskan, perbedaan volume NaOH nya adalah 0,5 mL. Perbedaan ini disebabkan kurangnya ketelitian saat penetesan larutan NaOH kedalam larutan baku primer.
perbedaannya adalah 3 mL. Dalam kedua percobaan ini perlu dicari rata-ratanya.
G. Kesimpulan
Adapun kesimpulan dari praktikum asidi alkalimetri adalah sebagai berikut :
1. Titrasi merupakan cara penentuan konsentrasi suatu larutan dengan volume tertentu dengan menggunakan larutan yang sudah diketahui konsentrasinya dan mengukur volumenya secara pasti. 2. Normalitas larutan baku primer asam oksalat yang digunakan adalah 10, 2138 N. Sedangkan normalitas larutan baku sekunder pada percobaan pertama adalah 47, 6323 N, sedangkan pada percobaan kedua adalah 50,014 N, sehingga didapat normalitas larutan baku sekunder rata-rata adalah 48,8231. Dan hasil kadar sampel asetat pada percobaan pertama adalah 1,4 g/100 mL, pada percobaan kedua adalah 1,02 g/100 mL, sehingga didapat kadar rata rata adalah 1,08 g/100mL.
Daftar Pustaka
Day, R.A dan underwood, A.L. 2001. Analisis Kimia Kuantitas. Jakarta : Erlangga.
Fatih, Ahmad. 2008. Kamus Lengkap Kimia. Yogyakarta : Yogyakarta : Panji Pustaka
Retnowati, Priscilla.2007. Seribu pena kimia untuk SMA.MA kelas XI. Jakarta: Erlangga