BAB 1 PENDAHULUAN
1.1 Latar Belakang
Kimia analitik pada dasarnya menyangkut penentuan komposisi kimiawi suatu materi. Dahulu hal tersebut adalah tujuan utama seseorang ahli kimia analitik. Tetapi dalam kimia analitik modern, aspek-aspeknya juga meliputi identifikasi suatu zat, elusidusi struktur dan analisa kuantitatif komposisinya.
Titrasi iodometri dan iodimetri adalah salah satu metode titrasi yang didasarkan pada reaksi oksidasi reduksi. Metode ini lebih banyak digunakan dalam analisa jika dibandingkan dengan metode lain. Alasan dipilihnya metode ini karena perbandingan stoikometri yang sederhana pelaksanannya praktis dan tidak benyak masalah dan mudah.
Iodimetri adalah jika titrasi terhadap zat-zat reduktor dengan titrasi langsung dan tidak langsung. Dilakukan percobaan ini untuk menentukan kadar zat-zat oksidator secara langsung, seperti yang kadar terdapat dalam serbuk vitamin C.
Titrasi tidak langsung iodometri dilakukan terhadap zat-zat oksidator berupa garam-garam besi (III) dan tembaga sulfat dimana zat-zat oksidator ini direduksi dahulu dengan KI dan iodin dalam jumlah yang setara dan ditentukan kembali dengan larutan natrium tiosulfat baku. Titrasi Iodometri digunakan untuk menentukan kadar dari zat-zat uji yang bersifat reduktor dengan titrasi langsung, sedangkan untuk iodimetri adalah kebalikannya.
Dalam bidang farmasi metode ini digunakan untuk menentukan kadar zat-zat yang mengandung oksidator misalnya Cl2, Fe (III), Cu Asam Askorbat, Natrium Askorbat, Metampiron (Antalgin), Natrium Tiosulfat dan lain-lain.
1.2 Maksud Praktikum
Untuk mengetahui cara penetapan kadar asam askorbat dengan metode titrasi iodimetri dan mengetahui cara penetapan kadar kaffein dengan metode titrasi iodometri.
1.3 Tujuan Praktikum
Untuk menentukan kadar suatu asam askorbat dengan menggunakan titrasi iodimetri dengan menggunakan Larutan baku iodin sebagai titrannya dan menentukan kadar suatu kaffeinn dengan mennggunanakan titrasi iodometri dengan menggunakan larutan baku Na2S2O3 sebagai titrannya.
BAB 2 TINJAUAN PUSTAKA
2.1 Teori Umum
Titrasi-tirasi redoks berdasarkan pada perpindahan electron antara titran dengan anait. Jenis titrasi ini biasanya menggunakan potensiometri untuk mendeteksi titik akhir, meskipun demikian penggunaan indicator yang dapat berubah warnanya dengan adanya kelebihan titran juga sering digunakan. Titrasi yang melibatkan iodium dapat dilakukan dengan 2 cara, yaitu titrasi langsung (iodimetri) dan titrasi tidak langsung (iodometri) (Rohman, 2007).
Pada farmakope indonesia, titrasi iodimetri digunakan untuk menetapkan kadar asam askorbat, natrium tiosulfat, metampiron (antalgin), serta natrium tiosulfat dan sediaan injeksi. (Ibnu Gholib, 2007)
Larutan I2 digunakan untuk mengoksidasi reduktor secara
kuantitatif pada titik ekuivalennya. Namun, cara pertama ini jarang diterapkan karena I2 merupakan oksidator lemah, dan adanya
oksidator kuat akan memberikan reaksi samping dengan reduktor. Adanya reaksi samping ini mengakibatkan penyimangan hasil penetapan. (Mulyono, 2011)
Hal-hal yang harus diperhatikan dalam titrasi iodometri dan iodimetri: (Perdana, 2009)
1. oksigen error, terjadi jika dalam larutan asam, maka oksigen dari udara akan mengoksidasi iodide menjadi iod (kesalahan makin besar dengan meningkatnya asam)
2. reaksi iodometri dilakukan dalam suasana asam sedikit basa (pH <8)
3. larutan kanji yang sudah rusak akan memberikan warna violet
4. pemberian kanji terlalu awal akan menyebabakan iod
menguraikan amilum dan hasil peruraian menggangu perubahan warna pada titik akhir.
5. penambahan KI harus berlebih, karena I2 yang dihasilkan sukar
larut dalam air tetapi mudah larut dalam KI.
6. larutan Thiosulfat dalam suasana yang sangat asam dapat
menguraikan larutan thiosulfat menjadi belerang, pada suasana basa (pH>9) thio sulfat menjadi ion sulfat.
Kekurangan kanji sebagai indicator adalah: (Perdana, 2009)
1. kanji tidak larut dalam air dingin
2. suspensinya dalam air tidak stabil
3. bila penambahan kanji dilakukan pada awal titrasi dengan I2 akan membentuk kompleks Iod-amilum.jika dalam titrasi
menggunakan indicator kanji maka penambahan kanji dilakukan pada saat mendekati ttitik ekivalen.
Dalam proses titrasi iodo dan iodimetri sebaiknya menggunakan indicator larutan Natrium Amylumglikolat. Indicator ini dengan I2 tidsk akan membentuk kompleks Iod-amilum sehingga
dapt ditambahkan pada awal titrasi. (Perdana, 2009)
Larutan standar yang digunakan dalam kebanyakan proses iodometri adalah natrium thiosulfat. Garam ini biasanya berbentuk sebagai pentahidrat Na2S2O3.5H2O. Larutan tidak boleh distandarisasi dengan penimbangan secara langsung, tetapi harus distandarisasi dengan standar primer. Larutan natrium thiosulfat tidak stabil untuk waktu yang lama (Underwood, 2001)
Iodium hanya sedikit larut dalam air (0,00134 mol per liter pada 25oC), tetapi agak larut dalam larutan yang mengandung ion iodida.
pekat, yang ditimbang dengan teliti sebelum dan sesudah penembahan iodium. Akan tetapi biasanya larutan distandarisasikan terhadap suatu standar primer, As2O3 yang paling biasa digunakan
(Underwood, 2001).
Warna larutan 0,1 N iodium adalah cukup kuat sehingga iodium dapat bekerja sebagai indikatornya sendiri. Iodium juga memberi warna ungu atau merah lembayung yang kuat kepada pelarut-pelarut sebagai karbon tetraklorida atau kloroform dan kadang-kadang hal ini digunakan untuk mengetahui titik akhir titrasi. Akan tetapi lebih umum digunakan suatu larutan (dispersi koloidal) kanji, karena warna biru tua dari kompleks kanji-iodium dipakai untuk suatu uji sangat peka terhadap iodium. Kepekaan lebih besar dalam larutan yang sedikit asam daripada larutan netral dan lebih besar dengan adanya ion iodida (Underwood, 2001).
Reaksi-reaksi kimia yang melibatkan oksidasi-reduksi dipergunakan secara luas dalam analisa titrimetrik. Ion-ion dari berbagai unsur dapat hadir dalam kondisi oksidasi yang berbeda-beda, menghasilkan kemungkinan terjadi banyak reaksi redoks. Banyak dari reaksi-reaksi ini memenuhi syarat untuk digunakan dalam analisa titrimetrik, dan penerapan-penerapannya cukup banyak. (Underwood, 2002)
substansi yang cukup kuat sebagai unsur reduksi untuk titrasi langsung dengan iodin. Karena itu jumlah dari penentuan-penentuan iodimetrik adalah sedikit. Namun demikian, banyak agen pengoksidasi yang cukup kuat untuk bereaksi secara lengkap dengan ion iodida, dan aplikasi dari proses iodometrik cukup banyak. Kelebihan dari ion iodida ditambahkan kedalam agen pengoksidasi yang sedang ditentukan, membebaskan iodin, yang kemudian dititrasi dengan larutan natrium tiosulfat.(Underwood, 2002)
Iodin hanya larut sedikit dalam air (0,00134mol/liter pada 250C) namun larut cukup banyak dalam larutan-larutan yang mengandung ion iodida. Iodin membentuk kompleks triodida dengan iodida, I2 + I dengan konstanta kesetimbangan sekitar 710 pada 250C. suatu kelebihan kalium iodida ditambahkan untuk meningkatkan kelarutan dan untuk menurunkan keatsirian iodin. Biasanya sekitar 3 sampai 4% berat KI ditambahkan kedalam larutan 0,1 N, dan botol yang mengandung larutan ini disumbat dengan baik. (Underwood,2002)
Larutan-larutan iodin standar dapat buat melalui penimbangan langsung iodin murni dan pengenceran dalam sebuah labu volumetrik. Iodin akan dimurnikan oleh sublimasi dan ditambahkan ke dalam sebuah larutan KI yang terkonsentrasi, yang ditimbang secara akurat sebelum dan sesudah penambahan iodin. Namun demikian, biasanya larutan tersebut distandardisasi terhadap sebuah standar primer, As2O3 paling sering dipergunakan. (Underwood, 2002)
dari kanji lebih umum dipergunakan, karena warna biru gelap dari kompleks iodin-kanji bertindak sebagai suatu tes yang amat sensitif untuk iodin. Mekanisme pembentukan kompleks yang berwarna ini tidak diketahui, namun ada pemikiran bahwa molekul-molekul iodin tertahan di permukaan -amylose, suatu konstituen dari kanji. Larutan-larutan kanji dengan mudah didekomposisinya oleh bakteri, dan biasanya sebuah substansi, seperti asam borat, ditambahkan sebagai bahan pengawet. (Underwood, 2002)
Banyak agen pengoksidasi yang kuat dapat dianalisa dengan menambahkan kalium iodida berlebih dan mentitrasi iodin yang dibebaskan. Karena banyak agen pengoksidasi membutuhkan suatu larutan asam untuk bereaksi dengan iodin, natrium tiosulfat biasanya dipergunakan sebagai titrannya. (Underwood, 2002)
Penentuan-penentuan iodometrik: ada banyak aplikasi proses iodometrik dalam kimia analisis. Penentuan iodometrik tembaga banyak dipergunakan baik untuk bijih maupun paduannya. Metoda ini memberikan hasil-hasil yang sempurna dan lebih cepat daripada penentuan elektrolitik tembaga. Metoda klasik dari Winkler adalah sebuah metoda sensitif untuk menentukan oksigen yang dilarutkan dalam air. Ke dalam sampel air ditambahkan sejumlah berlebih garam mangan(II), natrium iodida, dan natrium hidroksida. (Underwood, 2002)
Pembuatan natrium thiosulfat dapat ditempuh dengan cara: (Underwood, 2002)
1. Melarutkan garam kristalnya pada aquades yang mendidih. 2. Menambahkan 3 tetes kloroform (CHCl3) atau 10 mg merkuri
klorida (HgCl2) dalam 1 liter larutan.
3. Larutan yang terjadi disimpan pada tempat yang tidak terkena cahaya matahari.
Biasanya air yang digunakan untuk menyiapkan larutan tiosulfat dididihkan agar steril, dan sering ditambahkan boraks atau natrium karbonat sebagai pengawet. Oksidasi tiosulfat oleh udara berlangsung lambat. Tetapi runutan tembaga yang kadang-kadang terdapat dalam air suling akan mengkatalis oksidasi oleh udara ini. Tiosulfat diuraikan dalam larutan asam dengan membentuk belerang sebagai endapan mirip susu. (Underwood, 2002)
S2O32- + 2H+ → H2S2O3 → H2SO3 + S
Tetapi reaksi itu lambat dan tak terjadi bila tiosulfat dititrasikan kedalam larutan iod yang asam, asal larutan diaduk dengan baik. Reaksi antara iod dan tiosulfat jauh lebih cepat dari pada reaksi penguraian. Iodin mengoksidasi tiosulfat menjadi ion tetrationat:
I2 + 2S2O32- → 2I- + S4O6
2-Reaksinya berjalan cepat, sampai selesai, dan tidak ada reaksi sampingan. Berat ekivalen dari Na2S2O3. 5H2O adalah berat molekulnya, 248,17. Tiosulfat teroksidasi secara parsial menjadi sulfat:
4I2 + S2O32- + 5H2O → 8I- + 2SO42- + 10H+
(Underwood, 2002)
Dalam larutan yang netral, atau sedikit alkalin, oksidasi menjadi sulfat tidak muncul, terutama jika iodin dipergunakan sebagai titran. Ada dua metode titrasi iodometri, yaitu: (Underwood, 2002)
Disebut juga sebagai iodimetri. Menurut cara ini suatu zat reduksi dititrasi secara langsung oleh iodium, misal pada titrasi Na2S2O3 oleh I2. 2Na2S2O3 + I2 → 2NaI + Na2S4O6 Indiator yang digunakan pada reaksi ini, yaitu larutan kanji. Apabila larutan thiosulfat ditambahkan pada larutan iodine, hasil akhirnya berupa perubahan penampakan dari tak berwarna menjadi berwarna biru. Tetapi apabila larutan iodine ditambahkan kedalam larutan thiosulfat maka hasil akhirnya berupa perubahan penampakan dari berwarna menjadi berwarna biru.
2. Secara tak langsung (iodometri)
Disebut juga sebagai iodometri.Dalam hal ini ion iodide sebagai pereduksi diubah menjadi iodium-iodium yang terbentuk dititrasi, dengan larutan standar Na2S2O3. Jadi cara iodometri digunakan untuk menentukan zat pengoksidasi, misal pada penentuan suatu zat oksidator ini (H2O2). Pada oksidator ini ditambahkan larutan KI dan asam hingga akan terbentuk iodium yang kemudian dititrasi dengan larutan.
Na2S2O3.H2O2 + 2HCl → I2 + 2KCl + 2H2O
dan sangat larut dalam pelarutan yang mengandung ion iodide. Iodium sedikit larut dalam air (0,00134 mol/liter pada 25 C).
(Underwood, 2002)
Berdasarkan reaksi I2 + I- → I3- dengan tetapan kesetimbangan pada 25 ºC. Larutan baku ion dapat langsung dibuat dari unsur murninya. Cara titrasi oksidasi reduksi yang dikenal ada dua: (Underwood, 2002)
1. Oksidimetri
2. Reduksimetri
Yaitu titrasi redoks dengan menggunakan larutan baku yang bersifat reduktor. Misal : Natrium dan Hidrogen Peroksida, Kalium dan amonium peroksidisulfat,natrium Bismutat (NaBiO3).
Ada dua proses metode titrasi iodometri, yaitu: (Underwood, 2002) 1. Proses-proses iodometrik langsung
Pada Iodometri langsung sering menggunakan zat pereduksi yang cukup kuat seperti tiosulfat, Arsen (III), Stibium (III), Antimon (II), Sulfida, sulfite, Timah (II), Ferasianida. Kekuatan reduksi yang dimiliki oleh beberapa dari substansi ini tergantung pada konsentrasi ion hidrogen, dan reaksi dengan iodin baru dapat dianalisis secara kuantitatif hanya bila kita melakukan penyesuaian pH yang repot. Dalam proses iodometri langsung ini reaksi antara iodium dan thiosulfat dapat berlangsung sempurna. Kelebihan ion Iodida yang ditambahkan pada pereaksi oksidasi yang ditentukan, dengan pembebasan iodium, kelebihan ini dapat dititrasi dengan Natrium Tiosulfat. Menurut cara ini suatu zat reduksi dititrasi secara langsung oleh iodium, misal pada titrasi Na2S2O3 oleh I2. 2Na2S2O3 + I2 → 2NaI + Na2S4O6 Indikator yang digunakan pada reaksi ini, yaitu larutan kanji. Apabila larutan thiosulfat ditambahkan pada larutan iodin, hasil akhirnya berupa perubahan penampakan dari tak berwarna menjadi berwarna biru. Tetapi apabila larutan iodine ditambahkan kedalam larutan thiosulfat maka hasil akhirnya berupa perubahan penampakan menjadi berwarna biru.
2. Proses-proses Tak Langsung atau Iodometrik
Na2S2O3. Jadi cara iodometri digunakan untuk menentukan zat pengoksidasi, misal pada penentuan suatu zat oksidator ini (H2O2). Pada oksidator ini ditambahkan larutan KI dan asam hingga akan terbentuk iodium yang kemudian dititrasi dengan larutan.
Na2S2O3. H2O2 + 2HCl → I2 + 2KCl + 2H2O.
Banyak agen pengoksidasi yang kuat dapat dianalisa dengan menambahkan kalium iodida berlebih dan menitrasi iodin yang dibebaskan. Karena banyak agen pengoksidasi membutuhkan suatu larutan asam untuk bereaksi dengan iodin, natrium tiosulfat biasanya dipergunakan sebagai titrannya, dalam keadaan pH 3-4. Titrasi dengan arsenik (III) (di atas) membutuhkan sebuah larutan yang sedikit alkalin. (Underwood, 2002)
2.2 Uraian Bahan
1. Air Suling (AQUADEST) (FI III : 96)
Nama resmi : AQUA DESTILLATA Nama lain : Air suling
RM : H2O
BM : 18,02
Struktur : H-O-H
Kelarutan : Larut dalam etanol dan gliserol
Pemerian : Cairan jernih, tidak berwarna, tidak berasa, tidak berbau.
Penyimpanan : Dalam wadah tertutup rapat Kegunaan : Sebagai pelarut
2. Iodium (FI III ,31)
Nama resmi : IODUM Nama lain : Iodum
RM : I
BM : 126,96
Kelarutan .
: larut dalam 3500 bagian air ,dalam 13 bagian etanol, dalam 80 bagian gliserol Pemerian : Keping atau butir, berat, mengkilap seperti logam, hitam kelabu dan bau khas
Penyimpanan : Dalam wadah tertutup rapat Kegunaan : Sebagai sampel
3. Natrium Tiosulfat (FI III,428)
Nama resmi : NATRI THIOSULFAS Nama lain : Natrium tiosulfat/hipo RM : Na2S2O3 .5H2O
BM : 248,17
Pemerian : Hablur besar tidak berwarna /serbuk hablur kasar. Dalam lembab meleleh basah, dalam hampa udara merapuh. Kelarutan : larut dalam 0,5 bagian air,praktis tidak
larut dalam etanol
Penyimpanan : Dalam wadah tertutup rapat. Kegunaan : Sebagai penitrasi
4. Asam Sulfat (FI III,58)
Nama resmi : ACIDUM SULFURICUM Nama lain : Asam sulfat
RM : H2SO4
Pemerian : Cairan kental seperti minyak, korosif, tidak berwarna jika ditambahkan dalam air menimbulkan panas.
Kelarutan :
-Kegunaan : Sebagai sampel
Penyimpanan : Dalam wadah tertutup rapat 5. VITAMIN C( FI III,47)
Nama resmi : ACIDUM ASCORBICUM Nama lain : Asam askorbat
RM : C6H8O6
BM : 176,13
Pemerian
:
Serbuk atau hablur,putih atau agak kuning,tidak berbau rasa asam, karena pengaruh cahaya jadi gelap.
Kelarutan
:
Mudah larut dalam air, sukar larut dalam etanol, praktis tidak larut dalam klorofom
Kegunaan : Sebagai bahan
Penyimpanan : Dalam wadah tertutup rapat. 6. NaCl (FI.Ed.III hal. 403).
Nama Resmi : NATRIUM CHLORIDUM Nama Lain : Natrium klorida
Berat Molekul : 32.04 g/mol Rumus Molekul : NaCl
Pemerian : Hablur bentuk kubus, tidak berwarna atau serbuk hablur putih; rasa asin. Kelarutan : Mudah larut dalam air; sedikit lebih
mudah larut dalam air mendidih; larut dalam gliserin; sukar larut dalam etanol Penyimpanan : Dalam Wadah Tertutup baik
Khasiat : Hemodialisis Kegunaan : Sebagai Sampel 7. Kafein (FI III, 175)
Nama Resmi : COFFEINUM Nama Lain : Kofeina
RM / BM : C8H10N4O2 /194,19
Kelarutan : Agak sukar larut dalam air dan dalam etanol (95%) P ; mudah larut dalam kloroform P; sukar larut dalam eter Penyimpanan : Dalam wadah tertutup baik
Kegunaan : Stimulan saraf pusat, kardiotonikum 8. Indikator Kanji (FI III, )
Nama resmi : AMYLUM MANIHOT Sinonim : Pati singkong
Pemerian : Serbuk halus, kadang-kadang berupa gumpalan kecil, putih, tidak berbau, tidak berasa.
Kelarutan : Praktis tidak larut dalam air dingin dan dalam etanol 95 % P
2.3 Prosedur Kerja
(Anonim, 2015 halaman 34 – 35)
1. Pembuatan Larutan Baku Na2S2O3 0,1 N
Timbang 13 gram Na2S2O3 dalam gelas arloji. Pindahka ke
dalam gelas piala 250 mL, larutkan dengan 50 mL air suling dan tambahkan 100 mg Na2CO3. Aduk dengan baik hingga
homogeny. Pindahkan larutan ke dalam labu ukur, encerkan dengan air suling bebas CO2 sampai volume larutan 500 mL.
simpan dalam botol yang tertutup dan beri etiket.
Pembakuan Larutan Baku Na2S2O3 0,1 N dengan KIO3
Timbang 0,891 g KIO3 kristal dengan teliti pada gelas arloji
yang telah ditimbang. Masukkan ke dalam Erlenmeyer 250 mL melalui corong. Bilas gelas arloji dan corong dengan air suling 25 mL dan masukan air suling ke dalam Erlenmeyer. Tambahkan 2 g KI yang bebas dari iodat dan 5 mL asam sulfat 2 N, titrasi dengan natrium tiosulfat yang akan ditentukan normalitasnya. Bila warna kuning iodium hampir hilang, hentikan titrasi dan tambahkan 4 mL indikator kanji. Teruskan titrasi sampai warna biru dari larutan tepat hilang .
Tiap mL Na2S2O3 0,1 N setara dengan 3,567 mg KIO3 2. Pembuatan Larutan Baku I2 0,1 N
Timbang dengan teliti 7 g I2 murni dalam botol timbang.
berisi 7 g I2 tadi. Aduk dengan baik sehingga semua larut.
Pindahkan dalam labu ukur, encerkan dengan air hingga volumenya menjadi 500 mL, sambil dikocok dengan baik hingga homogeny. Simpan dalam botol yang gelap dan beri etiket.
Pembakuan Larutan Baku I2 0,1 N
Timbang dengan teliti 15 mg As2O3 murni dalam botol
timbang yang talah ditimbang. Pindahkan ke dalam gelas piala 500 mL. larutkan dalam 20 mL NaOH 1 N dengan sedikit pemanasan. Encerkan dengan 40 mL air suling, tambahkan 2 tetes jingga metil dan tetesi asam klorida encer sampai warna larutan berubah dari kuning menjadi jingga. Tambahkan 2 g Natrium bikarbnat dan encerkan dengan 50 mL air suling. Tambahkan 3 mL larutaan kanji dan titrasi dengan laarutan iodium o,1 N sampai terjadi warna biru yang stabil.
Tiap mL I2 setara dengan 49,46 mg As2O3
3. Penetapan kadar zat dengan cara titrasi langsung dengan larutan iodin baku
Penetapan Kadar Antalgin
Timbang saksama 400 mg contoh, masukkan dalam labu 200 mL, larutkan dalam 5 mL air, titrasi dengan larutan iodin baku 0,1 N, pada larutan iodin, timbul warna merah pada larutan, yang lama-lama akan hilang sampai timbul warna kuning yang satabil.
Tiap mL larutan iodin 0,1 N setara dengan 16,67 mg antalgin.
4. Penetapan kadar zat dengan cara titrasi kembali larutan iodin yang berlebihan dengan larutan natrium tiosulfat Penetapan Kadar Kaffein
tambahkan 50 mL larutan iodin 0,1 N dan 20 mL larutan natrium klorida jenuh, kemudian cukupkan volumenya dengan air sampai 00 mL, kocok larutan dan biarkan selama 5 menit, saring dan titrasi dengan larutan baku natrium tiosulfat 0,1 N menggunakan indicator kanji.
Tiap mL larutan iodin 0,1 N setara dengan 5,3 mg kaffein.
5. Penetapan kadar zat dengan cara titrasi iodium yang dibebaskan dari kalium iodide dengan larutan natrium tiosulfat.
Penetapan Kadar Tembaga Sulfat
Timbang saksama 1 g tembaga sulfat, larutkan dalam 50 mL air, tambahkan 4 mL asam asetat dan 3 g kalium iodide. Titrasi iodin yang bebas dengan larutan natrium tiosulfat 0,1 N menggunakan indicator kanji.
BAB 3 METODE KERJA
3.1 Alat Praktikum
Adapun alat - alat yang digunakan dalam praktikum ini adalah adalah aluminium foil, batang pengaduk, bulk, buret, corong, erlenmeyer, gelas kimia 250 mL, gelas ukur 10 mL, kertas saring, pipet tetes, pipet skala, pipet volume 10 mL, spatula, dan statif.
3.2 Bahan Praktikum
Adapun bahan yang digunakan dalam praktikum ini adalah Aquadest, asam sulfat (H2SO4), Iodium (I2), indikator kanji, natrium
klorida (NaCl) , natrium tiosulfat (Na2S2O3), sampel asam askorbat,
sampel kaffein, dan tissue.
3.3 Cara Kerja
A. Penetapan kadar kaffein dengan metode iodometri menggunakan larutan standar natrium tiosulfat (N2S2O3).
1. Disiapkan alat dan bahan
2. Ditimbang 100 mg sampel uji kaffein menggunakan wadah gelas arloji.
3. Dipasang buret pada penyangga titrasi
4. Dimasukkan larutan standar natrium tiosulfat 0,998 N ke dalam buret lalu tutup dengan aluminium foil
5. Dimasukkan sampel uji kaffein yang sudah ditimbang ke dalam Erlenmeyer dengan menggunakan sendok tanduk 6. Dimasukkan 10 mL aquadest yang sudah diukur
7. Ditambahkan 2,5 mL asam sulfat (H2SO4) 10% ke dalam
Erlenmeyer
8. Ditambahkan 25 mL larutan iodin(I2) 0,1 N yang dipipet
mengggunakan pipet volume
9. Ditambahkan 10 mL natrium klorida (NaCl) yang sudah diukur menggunakan gelas ukur ke dalam Erlenmeyer 10. Ditutup dengan aluminium foil dan diamkan selama 5 menit 11. Disaring menggunakan kertas saring yang sudah
disediakan pada mulut corong ke dalam gelas kimia sebagai wadahnya
12. Dicuci Erlenmeyer,lalu pindahkan larutan zat uji yang sudah disaring kembali ke dalam Erlenmeyer.
13. Ditambahkan 3 tetes larutan indicator kanji
14. Dititrasi menggunakan larutan standar natrium tiosulfat sampai terjadi perubahan warna dari warna biru ke bening. B. Penetapan kadar asam askorbat dengan metode iodimetri
menggunakan larutan standar I2.
1. Disiapkan alat dan bahan
2. Ditimbang 100 mg asam askorbat dengan wadah cawan porselin
3. Dipasang buret ke statif
4. Dimasukan Larutan I2 ke dalam buret, lalu ditutup
alumunium foil
5. Dimasukan asam askorbat yang sudah ditimbang ke dalam erlenmeyer
6. Dimasukan 25 mL air bebas CO2 ke dalam labu ukur
7. Ditambahkan asam sulfat sebanyak 10 mL 8. Dititrasi dengan iodium 0,1 N
9. Diitambahkan indikator kanji
BAB 4 HASIL DAN PEMBAHASAN
4.1 Hasil Pengamatan
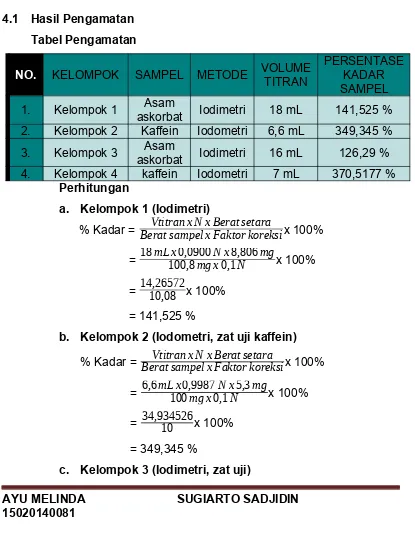
Tabel Pengamatan
NO. KELOMPOK SAMPEL METODE VOLUMETITRAN
PERSENTASE KADAR SAMPEL 1. Kelompok 1 askorbatAsam Iodimetri 18 mL 141,525 % 2. Kelompok 2 Kaffein Iodometri 6,6 mL 349,345 % 3. Kelompok 3 askorbatAsam Iodimetri 16 mL 126,29 % 4. Kelompok 4 kaffein Iodometri 7 mL 370,5177 %
Perhitungan
a. Kelompok 1 (Iodimetri)
% Kadar = Berat sampel x Faktor koreksiVtitran x N x Berat setara x 100%
= 18mL x100,80,0900mg xN x0,1N8,806mgx 100%
= 14,2657210,08 x 100%
= 141,525 %
b. Kelompok 2 (Iodometri, zat uji kaffein)
% Kadar = Berat sampel x Faktor koreksiVtitran x N x Berat setara x 100%
= 6,6mL x1000,9987mg x0,1N xN5,3mgx 100%
= 34,93452610 x 100%
= 349,345 %
% Kadar = Berat sampel x Faktor koreksiVtitran x N x Berat setara x 100%
= 16mL x100,40,09mg xN x0,18,806N mgx 100%
= 12,6810,04ox 100%
= 126,29 %
d. Kelompok 4 (iodometri, zat uji kaffein)
% Kadar = Berat sampel x Faktor koreksiVtitran x N x Berat setara x 100%
= 7mL x1000,9987mg xN x0,1N5,3mgx 100%
= 37,0517710 x 100%
4.2 Pembahasan
Titrasi secara iodimetri atau titrasi langsung adalah dimana zat pereduksi langsung dititrasi dengan larutan baku iodium, sedangkan titrasi secara iodometri adalah iodin di runah ke iodium, lalu iodium yang tebentuk dititrasi dengan larutan baku natrium tiosulfat. Titrasi iodometri digunakan untuk mengetahui zat oksidator, sedangkan pada titrasi iodimetri digunakan untuk mengetahui zat reduktor. Titrasi iodometri dan iodimetri ini adalah dua dari banyak metode titrasi pada titrasi redoks.
Titrasi redoks merupakan titrasi terhadap larutan analit berupa reduktor atau oksidator dengan titran berupa larutan dari zat standar oksidator atau reduktor. Prinsip yang digunakan dalam titrasi redoks adalah reaksi reduksi oksidasi atau dikenal denga reaksi redoks.
Iodimetri merupakan cara analisa volumetri untuk zat-zat reduktor, seperti natrium tiosulfat, arsenat, dengan menggunakan larutan baku iodin baku secara langsung, tetapi dapat juga langsung dengan cara penambahan larutan baku iodin baku berlebihan, dan kelebihan larutan iodin dititrasi kembali dengan larutan baku tiosulfat.
Iodometri adalah analisa titrimetric untuk zat zat reduktor seperti misalnya natrium tiosulfat, konjugat dengan mengunakan larutan iodimetri atau secara langsung.
2J-J 2+2e
Iodometri juga dapat dilakukan dengan cara penamnbahan larutan iodin, dan kelebihan iodi titrasi dibagi dengan larutan tiosulfat. Reaksinya:
J2+2Na2S2O3 2NaJ+Na2S4O6
Iodometri adalah analisa nitrimetri secara tidak langsung untuk zat-zat oksidator seperti garam besi (III), tembaga(II), dan zat-zat indikator ini direduksi lebih dulu dengan kalium iodida, dan iodi yang dihasilkan dalam jumlah yang setara ditentukan kembali larutan natrium tiosulfat baku, contohnya seperti tembaga (II) sulfat direaksikan dengan kalium iodide dengan reaksi sebagai berikut
2CuSO4+4KJ 2CuJ+J2K2SO4
Atau
KJ+HCl J2+H2+KCl
J2+2Na2S2O3 2NaJ+Na2S4O6
Pada percobaan ini, yang pertama dilakukan metode titrasi iodimetri oleh kelompok 1 dan 3. Dimana pada titrasi ini, sampel yang digunakan dalah asam askorbat. Penentuan kadar asam askorbat harus dilakukan dengan metode iodimetri karena asam askorbat lebih mudah teroksidasi.
Berat sampel yang digunakan adalah 100 mg, sample dilarutkan dengan air bebas CO2, ditambahkan 10 mL asam sulfat
kemudian dititrasi dengan iodiun 0,1 N dan ditambahkan indikator kanji.
akan bereaksi dengan hidroksida, setelah itu dilakukan titrasi dengan penambahan indikator kanji sebanyak 3 tetets. dan perubahan yang terbentuk dari warna bening ke coklat.
Adapun volume titran yang didapatkan oleh kelompok 1 dan 3 secara berurutan adalah 18 mL & 16 mL. Berdasarkan volume titran tersebut, persentase kadar yang dipeorleh oleh kelompok 1 dan 3 secara berurutan adala 141,525 % & 126,29 %.
Pada percobaan ini dapat dilakukan tanpa menggunakan indikator dari luar, karena larutan I2 sendiri berwarna sehingga akan
memberikan titik akhir berupa hilangnya endapan biru. Pada percobaan ini digunakan air bebas CO2, karena CO2 dapat
mengoksidasi Vitamin C sehingga titik akhir titrasi menjadi lebih dekat (volume I2 yang digunakan semakin sedikit). Pada percobaan
ini juga digunakan asam sulfat dan asam asetat, sebagai katalisator agar reaksioksidasi reduksi dapat berjalan lebih cepat.Pada titrasi iodometri titrasi harus dalam keadaan asam lemah atau nertal karena dalam keadaan alkali akan terbentuk iodat yang terbentuk dari ion hipoiodit yang merupakan reaksi mula-mulaantara iodin dan ion hidroksida.
Indikator kanji merupakan indikator yang sangat lazim digunakan, namun indikator kanji yangdigunakan harus selalu dalam keadaan segar dan baru karena larutan kanji mudah terurai oleh bakteri sehingga untuk membuat larutan indikator yang tahan lama hendaknya dilakukan sterilisasi atau penambahan suatu pengawet.
titrasi harus berlangsung dalam suasana asam, agar sampel tidak berekasi dengan hidroksida.
Selain itu, juga ditambhakan NaCl jenuh. Dimana alas an penambahan NaCl jenuh adalah untuk memisahkan sampel dari komponen – komponen lain atau zat campurannya. Pada metode iodometri ini, setelah dilakukan penambahan larutan iodium sampel didiamkan selama 5 menit. Hal ini bertujuan untuk membiarkan sampel mengendap, setelah terbentuk endapan barulah sampel disaring untuk memisahkannya dari endapannya. Hal ini dilakukan agar pada saat bereaksi dengan natrium tiosulfat beserta indikator kanji, warna dari sampel akan cepat berubah menjadi bening dan tidak terdapat lagi endapan – endapan.
Setelah disaring, barulah sampel dititrasi dengan larutan Natrium tiosulfat. Penggunaan larutan standar natrium tiosulfat (Na2S2O3) sebagai titrant didasarkan karena natrium tiosulfat
merupakan pereduksi yang baik yang akan bereaksi dengan analit yang bersifat oksidator dimana akan mengubah iodide menjadi iodium. Adapun perubahan warna yang terjadi adalah dari coklat ke bening. Adapun volume tittran yang didapatkan oleh kelompok 2 dan 4 secara berurutan adalah 6,6 mL dan 7 mL, dan berdasarkan volume titran tersebut persentase kadarnya adalah 349,345 % & 370,5177 %.
dititrasi atau setelah disaring adalah berwarna biru, tetapi warna yang terbentuk pada praktikum ini adalah warna coklat. Hal ini bisa saja disebabkan oleh kesalahan pada pembuatan indikator kanji, yang tidak bisa merubah warna larutan sampel menjadi biru.
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpualn
Berdasarkan hasil percobaan yang telah didapatkan, maka dapat diambil kesimpulan bahwa :
1. Kelompok 1 melakukan titrasi iodimetri dan memperoleh volume titran sebanyak 18 mL dan persentase kadar yang diperoleh adalah 141,525 %
2. Kelompok 2 melakukan titrasi iodometri dan memperoleh volume titran sebanyak 6,6 mL dan persentase kadar yang diperoleh adalah 349,345 %
3. Kelompok 3 melakukan titrasi iodimetri dan memperoleh volume titran sebanyak 16 mL dan persentase kadar yang diperoleh adalah 126,29 %
4. Kelompok 4 melakukan titrasi iodometri dan memperoleh volume titran sebanyak 7 mL dan persentase kadar yang diperoleh adalah 370,5177 %
5.2 Saran
DAFTAR PUSTAKA
Anonim, 2015, Penuntun Praktikum Kimia Organik, Fakultas Farmasi Universitas Muslim Indonesia : Makassar.
Day, R.A & Underwood, A.L., 2001, Analisis Kimia Kuantitatif, Erlangga:. Jakarta.
Day, R.A & Underwood, A.L., 2002, Analisis Kimia Kuantitatif, Erlangga:. Jakarta.
Ditjen POM, 1979, Farmakope Indonesia Edisi III, Jakarta : Depkes RI
Gholib, Ibnu, 2007, Kimia Farmasi Analisis, Pustaka pelajar: Yogyakarta.
Mulyono, 2011, Membuat Reagen Kimia, Bumi Aksara : Jakarta
LAMPIRAN
Skema Kerja
1. Iodimetri
Timbang saksama 100 mg asam askorbat
Masukkan 25 mL air bebas CO2 ke dalam Erlenmeyer
+ 10 mL asam sulfat (H2SO4)
+indicator kanji
Titrasi dengan iod 0,1 N (Bening-biru)
2. Iodometri
Timbang 100 mg
+ 10 mL air dan 5 mL asam sulfat 4N + larutan iodin 0,1 N dan 10 mL NaCl jenuh
Cukupkan volumenya dengan air sampai 100 mL
+ indicator kanji