Informasi Dokumen
- Penulis:
- Irvan Khairudin S.Si., Apt.
- Humaedi S.Si.
- Hilma Hendrayanti S.Si., Apt
- Sekolah: Sekolah Menengah Kejuruan Negeri 7 Bandung
- Mata Pelajaran: Kimia Farmasi
- Topik: Modul Praktikum Kimia Farmasi Analisis
- Tipe: modul praktikum
- Tahun: 2011-2012
- Kota: Bandung
Ringkasan Dokumen
I. PENDAHULUAN
Modul Praktikum Kimia Analisis Farmasi ini disusun untuk membantu siswa SMK dalam menguasai teknik analisis kualitatif dan kuantitatif. Tujuan utamanya adalah memberikan keterampilan dasar yang dapat diterapkan dalam kehidupan sehari-hari serta dalam industri farmasi. Dengan memahami dasar-dasar analisis, siswa diharapkan dapat melakukan praktikum dengan benar dan memahami konsep-konsep dasar yang mendasarinya.
II. POLA METODE PRAKTIKUM
Metode praktikum yang digunakan mengedepankan aplikasi konsep dalam praktik. Siswa dilatih untuk memahami tujuan dan alasan di balik setiap langkah praktikum, sehingga tidak hanya sekadar mengikuti prosedur. Hal ini bertujuan untuk membentuk pola pikir ilmiah yang mendalam, di mana siswa sebagai calon profesional di bidang farmasi dapat melaksanakan praktikum dengan penuh kesadaran dan kehati-hatian.
III. SISTEM PENILAIAN
Sistem penilaian praktikum mencakup berbagai aspek, mulai dari tes awal, jurnal praktikum, hingga penilaian laporan akhir. Alokasi nilai ditetapkan untuk memastikan bahwa siswa tidak hanya fokus pada hasil akhir, tetapi juga pada proses dan disiplin selama praktikum. Hal ini penting untuk membangun sikap profesional dalam laboratorium.
IV. TATA TERTIB PRAKTIKUM
Tata tertib praktikum mencakup berbagai ketentuan yang harus dipatuhi oleh siswa selama kegiatan praktikum. Hal ini bertujuan untuk menjaga keselamatan dan keamanan di laboratorium, serta menciptakan lingkungan belajar yang kondusif. Siswa diharapkan untuk bertanggung jawab atas perlengkapan yang digunakan dan menjaga kebersihan ruang praktikum.
V. KEAMANAN & KESELAMATAN KERJA LABORATORIUM
Keamanan dan keselamatan kerja di laboratorium adalah hal yang sangat penting. Siswa diajarkan untuk selalu menggunakan alat pelindung diri dan mengikuti prosedur keselamatan saat bekerja dengan bahan kimia. Pengetahuan tentang cara menangani kecelakaan dan risiko yang mungkin terjadi juga menjadi bagian dari pelatihan ini.
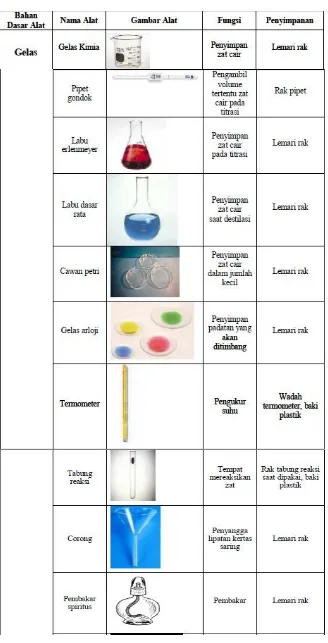
VI. BAB I PENGENALAN PERALATAN DAN BAHAN
Pada bagian ini, siswa diperkenalkan dengan berbagai peralatan dan bahan kimia yang umum digunakan dalam laboratorium. Tujuan praktikum ini adalah agar siswa dapat mengenali dan memahami fungsi serta cara penyimpanan alat dan bahan kimia. Pengetahuan ini penting untuk memastikan penggunaan yang tepat dan aman di laboratorium.
1.1. Tujuan Praktikum
Siswa diharapkan dapat menyebutkan alat-alat kimia dengan benar dan memahami karakteristik bahan kimia yang digunakan. Hal ini merupakan langkah awal yang penting untuk melanjutkan ke praktikum yang lebih kompleks.
1.2. Dasar Teori
Dasar teori mencakup pengenalan alat laboratorium, bahan kimia, dan simbol bahaya yang ada. Pengetahuan ini membantu siswa untuk memahami risiko yang terkait dengan setiap bahan dan alat yang digunakan dalam praktikum.
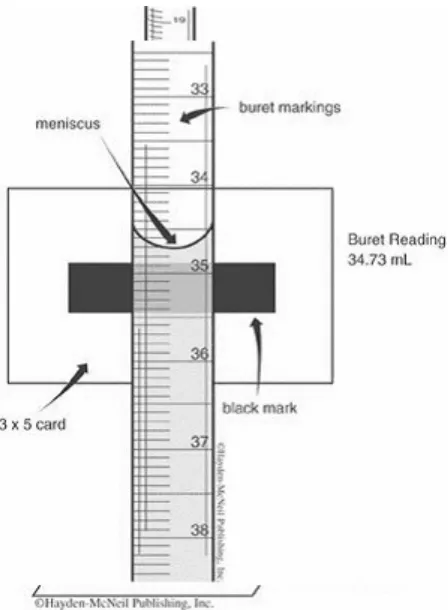
VII. BAB II PENGGUNAAN PERALATAN LABORATORIUM KIMIA
Bagian ini membahas teknik dasar dalam penggunaan alat laboratorium, termasuk cara memanaskan larutan, menyaring endapan, dan teknik titrasi. Siswa diajarkan untuk melakukan analisis kualitatif dan kuantitatif dengan benar, yang merupakan keterampilan penting dalam analisis kimia.
2.1. Tujuan Praktikum
Siswa diharapkan dapat menggunakan peralatan laboratorium dengan benar dan melaksanakan teknik dasar analisis kualitatif dan kuantitatif.
2.2. Dasar Teori
Dasar teori mencakup teknik-teknik dasar yang diperlukan untuk melakukan analisis, termasuk prosedur yang harus diikuti dan cara mengukur serta menimbang dengan tepat.
VIII. BAB III ORGANOLEPTIK DAN REAKSI KERING
Praktikum ini bertujuan untuk mengajarkan siswa tentang uji organoleptis dan reaksi kering sebagai metode identifikasi zat. Siswa belajar untuk menggunakan panca indra dalam mengenali karakteristik fisik zat serta melakukan pemanasan untuk mengamati perubahan yang terjadi.
3.1. TUJUAN
Siswa diharapkan dapat melakukan uji organoleptis dan reaksi kering dengan benar, yang merupakan bagian penting dalam identifikasi zat.
3.2. DASAR TEORI
Dasar teori menjelaskan tentang metode uji yang digunakan dalam analisis kimia, termasuk cara melakukan pengujian dengan aman dan efektif.
IX. BAB IV IDENTIFIKASI KATION
Siswa diajarkan untuk mengidentifikasi berbagai kation menggunakan reagensia tertentu. Praktikum ini penting untuk memahami reaksi kimia yang terjadi dan bagaimana kation dapat dipisahkan berdasarkan sifat-sifatnya.
4.1. TUJUAN
Siswa diharapkan dapat melakukan identifikasi kation dengan benar, yang merupakan keterampilan dasar dalam analisis kimia.
4.2. DASAR TEORI
Dasar teori menjelaskan tentang klasifikasi kation dan reaksi yang digunakan untuk mengidentifikasi mereka dalam analisis kimia.
X. BAB V ACIDIMETRI DAN ALKALIMETRI
Modul ini membahas tentang sifat asam dan basa serta teknik titrasi yang digunakan untuk menentukan konsentrasi larutan. Siswa diharapkan dapat memahami konsep dasar asidimetri dan alkalimetri serta aplikasinya dalam analisis kimia.
5.1. MENGENALI SIFAT ASAM DAN BASA SENYAWA
Siswa belajar untuk mengenali sifat-sifat asam dan basa serta cara melakukan titrasi untuk menentukan pH dan konsentrasi larutan.
XI. BAB VI JENIS-JENIS TITRASI
Bagian ini menjelaskan tentang berbagai jenis titrasi yang digunakan dalam analisis kimia, termasuk titrasi pengendapan dan titrasi redoks. Siswa diajarkan untuk memahami perbedaan antara jenis-jenis titrasi dan aplikasinya.
XII. BAB VII KOLORIMETRI
Modul ini mengajarkan siswa tentang teknik kolorimetri untuk menentukan konsentrasi zat berdasarkan warna. Siswa diharapkan dapat memahami prinsip dasar kolorimetri dan cara menerapkannya dalam praktikum.
XIII. BAB VIII SPEKTROFOTOMETRI
Bagian ini membahas tentang teknik spektrofotometri untuk analisis kuantitatif zat. Siswa belajar cara menggunakan alat spektrofotometer untuk menentukan konsentrasi zat dalam larutan.