(KARAKTERISTIK ZAT PATI)
Riska Pridamaulia, Hafiz Alim,
Eka Martya Widyowati, dan Maharani Intan Kartika
Program Studi Pendidikan Kimia, Jurusan Pendidikan Ilmu Pengetahuan Alam, Fakultas Ilmu Tarbiyah dan Keguruan, Universitas Islam Negeri Syarif Hidayatullah
Jakarta
ABSTRAK
Percobaan ini bertujuan untuk mengetahui karakteristik zat pati. Percobaan ini dilakukan dengan berbagai uji untuk mengetahui karakteristik zat pati, diantaranya uji iodium, uji hidrolisis dan uji benedict, serta uji iodium dengan reaksi balik. Hasil yang didapat dari uji iodium adalah pati yang direaksikan dengan iodium akan membentuk ikatan kompleks yang memberikan warna biru. Pati dalam suasana asam bila dipanaskan akan terhidrolisis menjadi senyawa-senyawa yang lebih sederhana. Pengujian laju hidrolisis dapat dilakukan dengan penambahan iodium. Hasil hidrolisis ini akan dibentuk amilodekstrin yang memberi warna biru dengan iodium, entrodekstrin yang memberi warna merah dengan iodium, serta berturut-turut akan dibentuk akroodekstrin, maltosa, dan glukosa yang tidak memberi warna dengan iodium. Di dalam amilum sendiri terdiri dari dua macam amilum, yaitu amilosa yang tidak larut dalam air dingin dan amilopektin yang larut dalam air dingin. Ketika amilum dilarutkan dalam air, amilosa akan membentuk micelles, yaitu molekul-molekul yang bergerombol dan tidak kasat mata karena hanya pada tingkat molekuler. Micelles ini dapat mengikat I2 yang terkandung dalam pereaksi iodium dan memberikan warna biru khas pada larutan yang di uji. Pada saat pemanasan, molekul-molekul akan saling menjauh sehingga mecelles-pun tidak lagi terbentuk akibatnya tidak bisa lagi memngikat I2 karenanya warna biru yang ditimbulkan akan menghilang. Micelles akan terbentuk kembali pada saat didinginkan dan warna biru kembali muncul. Maka dari itu pada percobaan ini dapat disimpulkan bahwa pati memiliki karakteristik, diantaranya pati atau amilum direaksikan dengan iodium menghasilkan warna biru karena reaksi antara amilum dengan iodin membentuk ikatan kompleks; pati atau amilum dapat dihidrolisis sempurna dalam suasana asam denga cara pemanasan dan menghasilkan glukosa (monosakarida); serta pati atau amilum tidak memiliki sifat mereduksi.
PENDAHULUAN
Polisakarida yang merupakan karbohidrat kompleks mempunyai sifat larut dalam air dingin. Polisakarida merupakan polimer monosakarida, mangandung banyak satuan monosakarida yang dihubungkan oleh ikatan glikosida. Hidrolisis lengkap dari polisakarida akan menghasilkan monosakarida. Glikogen dan amilum merupakan polimer glukosa.
Amilum atau pati terbentuk lebih dari 500 molekul monosakarida. Pati terdapat dalam umbi-umbian sebagai cadangan makanan pada tumbuhan. Jika dilarutkan dalam air panas, pati dapat dipisahkan menjadi dua fraksi utama, yaitu amilosa dan amilopektin. Perbedaan terletak pada bentuk rantai dan jumlah monomernya. Amilosa terdiri atas 250-300 unit D-glukosa yang terikat dengan ikatan α-1,4-glikosidik sehingga molekul amilosa berupa rantai terbuka. Sementara amilopektin memiliki 1000 unit glukosa yang membuat molekul amilopektin lebih besar daripada molekul amilosa. Amilopektin memiliki ikatan α-1,4-glikosidik namun sebagian memiliki ikatan glikosidik. Karena adanya ikatan 1,6-glikosidik tersebut ,aka molekul amilopektin berbentuk rantai terbuka dan bercabang.
Penambahan iodium pada suatu polosakarida akan menyebabkan terbentuknya kompleks adsorpsi bewarna
spesifik. Amilum atau pati dengan iodium menghasilkan warna biru atau ungu. Timbulnya warna biru menandakan bahwa bagian dari amilosa lah yang membentuk senyawa. Sementara warna ungu atau merah lembayung menandakan reaksi yang terjadi adalah antara amilopektin dengan iodium.
Pati dalam suasana asam bila dipanaskan akan terhidrolisis menjadi senyawa-senyawa yang lebih sederhana. Pengujian laju hidrolisis dapat dilakukan dengan penambahan iodium. Hasil hidrolisis ini akan dibentuk amilodekstrin yang memberi warna biru dengan iodium, entrodekstrin yang memberi warna merah dengan iodium, serta berturut-turut akan dibentuk akroodekstrin, maltosa, dan glukosa yang tidak memberi warna dengan iodium. Tahap pada saat larutan hasil hidrolisis sudah tidak menimbulkan warna biru dengan iodium disebut titik akromatik.
Uji benedict dilakukan untuk menguji kandungan karbohidrat seperti monosakarida, disakarida, dan polisakarida. Uji benedict menunjukkan hasil yang positif jika gula yang dikandung dalam karbohidrat memiliki sifat pereduksi, yang mengandung gugus aldehida atau keton bebas akan mereduksi ion Cu2+ dalam suasana alkalis, menjadi Cu+, yang mengendap sebagai Cu2O (kupro oksida) berwarna merah bata. Yang termasuk gula pereduksi adalah
sukrosa.
METODE
Dalam percobaan ini, kami menggunakan bahan dan alat yang diperlukan untuk mengetahui karakteristik pati, diantaranya adalah tabung reaksi dan raknya, plat tetes, pipet tetes, penangas air, stopwacht, penjepit kayu, serta kertas lakmus. Sementara untuk bahan yang digunakan adalah, larutan pati, larutan iodium, HCl pekat, larutan NaOH 10%, larutan Natrium tiosulfat 1%, dan juga pereaksi benedict.
Untuk mengetahui karakteristik zat pati, dalam percobaan ini kami melakukan bebrapa uji. Pada uji yang pertama, kami menguji pati dengan larutan iodium. Larutan pati yang ingin di uji, di diamkan sampai terbentuk endapan. Setelah terbentuk endapan, pisahkan endapan dengan supernatannya, masing-masing dimasukkan ke dalam tabung reaksi. Ke masing-masing tabung reaksi tersebut ditambahkan dengan larutan iodium dan kemudian perhatikan perubahan yang terjadi.
Uji kedua, yaitu hidrolisis pati. Sebelumnya pati diasakamkan terlebih dahulu dengan menggunakan HCl pekat, dalam percobaan ini kami menggunakan 10 mL larutan pati dan ditambahkan 5 tetes HCl pekat. Setelah itu, larutan tersebut dipanaskan dalam penangas air. Saat mulai memanaskan larutan, nyalakan stopwatch
ke plat tetes kemudian ditambahkan setetes larutan iodium, lakukan tahap ini sampai warna biru tidak terbentuk lagi. Setelah tidak terbentuk warna biru, hentikan pemanasan dan dinginkan larutan tersebut. Setelah dingin, larutan tersebut di lanjutkan dengan uji benedict, tetapi lakukan penetralan sebelum uji benedict dengan menambahkan larutan NaOH 10% yang diukur pH-nya menggunakan kertas lakmus/indikator universal. Setelah netral, ambil larutan tersebut sebanyak 10 tetes masukkan ke dalam tabung reaksi, kemudian tambahkan dengan pereaksi benedict sebanyak 2 mL. Lalu panaskan campuran tersebut selama 5 menit dan kemudian amati yang terjadi.
Uji selanjutnya, kami menyiapkan dua tabung reaksi yang masing-masing di isi dengan 5 mL larutan pati dan 30 tetes larutan iodin. Pada tabung reaksi pertama dipanaskan sampai hilangnya warna biru, kemudian dinginkan dan amati apakah warna biru terbentuk lagi atau tidak. Pada tabung reaksi kedua ditambahkan larutan natrium tiosulfat 1% sampai warna biru hilang, kemudian amati apakah warna biru tibul kembali atau tidak.
HASIL DAN PEMBAHASAN
Pada percobaan Karbohidrat II ini, untuk mengetahui karakteristik zat pati dilakukan tiga pengujian terhadap larutan pati atau amilum. Pengujian pertama, larutan amilum di diamkan dan dipisahkan antara
supernatan dan endapannya. Lalu ke dalam supernatan dan endapan ditambahkan larutan iodium. Pada supernatan menghasilkan warna ungu setelah penambahan larutan iodium. Begitupun pada endapan yang juga menghasilkan warna ungu. Hal ini menunjukkan bahwa pada larutan amilum yang digunakan lebih dominan kandungan amilopektinnya dibandingkan amilosa karena saat penambahan larutan iodium menghasilkan warna ungu. Ini berdasarkan dengan literatur/teori yang ada bahwa karbohidrat golongan polisakarida akan memberikan reaksi dengan larutan iodium dan memberikan warna spesifik bergantung pada jenis karbohidratnya, yaitu amilosa dengan iodium akan menghasilkan larutan berwarna biru, amilopektin akan berwarna merah violet, dan glikogen maupun dextrin akan menghasilkan warna coklat.
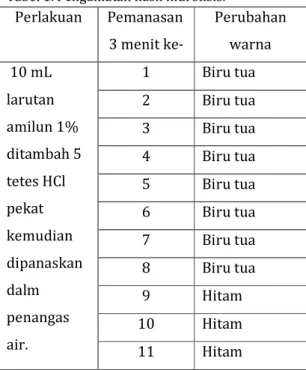
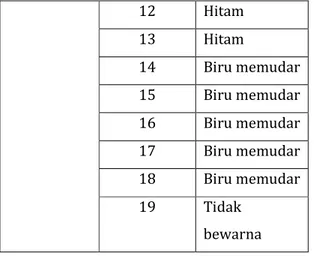
Pada pengujian kedua, uji hidrolisis pati, larutan pati ditambahkan asam, yakni HCl pekat, agar larutan bersifat asam. Larutan yang bersifat asam ini dipanaskan akan terhidrolisis menjadi senyawa-senyawa yang lebih sederhana. Hasil dari hidrolisis ini adalah berubahnya amilum menjadi glukosa karena amilum mengandung amilosa atau amilopktin yang merupakan polimer dari glukosa, oleh sebab itu amilum dihidrolisis akan menghasilkan glukosa. Hidrolisis sempurna apabila menjadi senyawa yang lebih sederhana yang terdeteksi pada perubahan warna. Hal ini terlihat pada perubahan warna setiap tiga
menit (tabel 1). Pembentukan glukosa ini dibuktikan dengan uji benedict selanjutnya. Tapi sebelum dilakukan uji benedict, larutan yang dihasilkan dinetralkan dengan larutan NaOH 10% karena larutan bersifat asam setelah penambahan HCl pekat. Larutan yang sudah netral atau sampai basa tersebut ditambahkan pereaksi benedict dan dipanaskan. Hasilnya diperoleh larutan bewarna hijau dan terbentuk endapan merah bata. Ini menunjukkan hasil positif adanya gula pereduksi pada larutan amilum tersebut. Gula perduksi yang mengandung gugus aldehida atau keton bebas akan mereduksi ion Cu2+ dalam suasana alkalis, menjadi Cu+, yang mengendap sebagai Cu2O (kupro oksida) berwarna merah bata. Ini ditunjukkan pada reaksi dibawa ini,
Tabel 1. Pengamatan hasil hidrolisis.
Perlakuan Pemanasan 3 menit ke- Perubahan warna 10 mL larutan amilun 1% ditambah 5 tetes HCl pekat kemudian dipanaskan dalm penangas air. 1 Biru tua 2 Biru tua 3 Biru tua 4 Biru tua 5 Biru tua 6 Biru tua 7 Biru tua 8 Biru tua 9 Hitam 10 Hitam 11 Hitam O O ║ ║ R—C—H + Cu2+ 2OH- → R—C—OH + Cu2O
13 Hitam 14 Biru memudar 15 Biru memudar 16 Biru memudar 17 Biru memudar 18 Biru memudar 19 Tidak bewarna
Pengujian yang ketiga dilakukan pengamatan dua tabung reaksi, dengan tabung reaksi pertama dipanaskan dan tabung reaksi kedua ditambahkan larutan natrium tisulfat 1%. Sebalumnya larutan amilum ditambahkan larutan iodin membentuk warna biru. Warna biru ini merupakan hasil dari ikatan kompleks antara amilum dengan iodin. Setalah penambahan iodin, tabung reaksi pertama dipanaskan dan warna biru yang terbentuk akan menghilang. Dan sewaktu di diamkan menurut literatur/teori, warna biru akan terbentuk kembali, tetapi pada percobaan ini warna biru tidak terbentuk kembali. Pengamatan terdapat pada tabel 2. Di dalam amilum sendiri terdiri dari dua macam amilum, yaitu amilosa yang tidak larut dalam air dingin dan amilopektin yang larut dalam air dingin. Ketika amilum dilarutkan dalam air, amilosa akan membentuk micelles, yaitu molekul-molekul yang bergerombol dan tidak kasat mata karena hanya pada tingkat molekuler. Micelles ini dapat mengikat I2 yang terkandung dalam pereaksi iodium dan memberikan warna
pemanasan, molekul-molekul akan saling menjauh sehingga mecelles-pun tidak lagi terbentuk akibatnya tidak bisa lagi memngikat I2 karenanya warna biru yang ditimbulkan akan menghilang. Micelles akan terbentuk kembali pada saat didinginkan dan warna biru kembali muncul. Tetapi pada percobaan yang dilakukan, warna biru tidak terbentuk kembali, yang secara teoritis seharunya terbentuk kembali, ini mungkin dikarenakan beberapa faktor yakni saat penambahan iodin kurang teliti dan kurang tepat, dan juga larutan iodin yang digunakan untuk pereaksi tidak dari iodin murni, tapi yang digunakan adalah iodin yang terkandung dalam obat penyembuh luka (yang kandungan iodinnya sedikit). Sedangkan pada tabung reaksi kedua ditambahkan larutan natrium tiosulfat 1%, warna biru yang terbentuk akan menghilang setelah penambahan natrium tisulfat karena ion Na+ yang bersifat alkalis akan mengikat iodium sehingga warna biru yang khas akan memudar dan menghilang.
Tabel 2. Uji iodium dengan reaksi balik
Larutan yang di uji Perlakuan pengamatan Tabung I 10 mL Larutan pati + Iodium Ungu dipanaskan Tidak bewarna didiamkan Tidak bewarna Tabung II + Iodium Ungu
10 mL larutan pati + Natrium Tiosulfat Tidak bewarna didiamkan Tidak bewarna KESIMPULAN
Karakteritik karbohidrat yang didapatkan dari hasil percobaan yang dilakukan antara lain, menghasilkan senyawa kompleks berwarna biru jika direaksikan dengan iodium, dapat dihidrolisis sempurna dalam suasana asam denga cara pemanasan dan menghasilkan glukosa (monosakarida), dan tidak memiliki sifat mereduksi seperti pada monosakarida dan disakarida kecuali sukrosa, yaitu tidak bisa mereduksi senyawa-senyawa oksidator seperti ion Cu2+.
DAFTAR PUSTAKA
• Fessenden, dan Fessenden. 1986. Kimia Organik edisi Ketiga. Jakarta: Erlangga • Fessenden, dan Fessenden. 1997.
Dasar-dasar Kimia Organik. Jakarta: Binarupa Aksara
• Poedjiadi, Anna. 2007. Dasar-dasar Biokimia. Jakarta: UI Press
• Arifqbio. Seri Pengantar Biokimia. hhtp://arifqbio.multiply.com/journal/i tem/15/seri_pengantar_Biokimia diakses pada tanggal 02 Nopember 2011 pukul 21:41
• Filzahazny. 2009. Karbohidrat. hhtp://filzahazny.wordpress.com/200 9/07/10/karbohidrat/ diakses pada tanggal 02 Nopember 2011 pukul 21:14
• Rida. Karbohidrat. hhtp:// sweetir1s.multiply.com/journal/item/ 5 diakses pada tanggal 03 Nopember 2011 pukul 00:31