TEKNIK PERBANYAKAN DAN KEKERABATAN GENETIK
PASAK BUMI (Eurycoma longifolia Jack)
ARIDA SUSILOWATI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis berjudul Teknik Perbanyakan dan Kekerabatan Genetik Pasak Bumi (Eurycoma longifolia Jack) adalah karya saya sendiri dengan arahan dosen pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka dibagian akhir tesis ini.
Bogor, Agustus 2008
Arida Susilowati
Hak cipta milik IPB, tahun 2008 Hak cipta dilindungi undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB. 2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh
Judul Tesis : Teknik Perbanyakan dan Kekerabatan Genetik Pasak Bumi (Eurycoma longifolia Jack)
Nama : Arida Susilowati NIM : E051060111
Disetujui Komisi Pembimbing
Dr Supriyanto Dr. Iskandar Z. Siregar
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Pengetahuan Kehutanan
Prof. Dr. Ir. Imam Wahyudi, MS Prof. Dr. Ir. Khairil A. Notodiputro, MS
TEKNIK PERBANYAKAN DAN KEKERABATAN GENETIK
PASAK BUMI (Eurycoma longifolia Jack)
ARIDA SUSILOWATI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Pascasarjana Institut Pertanian Bogor
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
ARIDA SUSILOWATI. Propagation Technique and Genetic Relatedness of Pasak Bumi (Eurycoma longifolia Jack). Under direction of SUPRIYANTO and ISKANDAR Z. SIREGAR
Pasak bumi (Eurycoma longifolia Jack) is a shrubs growing wildly in the forests of Southeast Asia and widely used throughout the region because of its medicinal properties. Uncontrolled harvesting of wild-grown trees has led to rapid decrease of natural populations, as well as causing a potential decrease in genetic diversity. The objectives of this research were 1). To get information about propagation technique of pasak bumi by seed and stem cutting and its suitable growing medium and 2). To estimate genetic relatedness of pasak bumi propagated by seed collected from Jambi using RAPD marker. Propagation by seed produced low germination percentage (14-34%) at different media. Seedling planted in pure carbonized rice husk medium produced the best growth variabel on vigority, primary root number, secondary root number, primary root length and secondary root length. Result from stem cutting showed that medium significantly improved secondary root length, while rooting percentage, primary root length and the number of root significantly was affected by Rootone F treatment. Genetic relatedness by RAPD marker showed that pasak bumi propagated by seed has high value of genetic diversity within population (He = 0,3076) and 78,57% all the loci tested were polimorphic, clustering analysis showed that the plant can be grouped into two group.
RINGKASAN
ARIDA SUSILOWATI. Teknik Perbanyakan dan Kekerabatan Genetik Pasak Bumi (Eurycoma longifolia Jack). Dibimbing oleh SUPRIYANTO dan ISKANDAR Z. SIREGAR.
Indonesia sebagai salah satu negara megabiodiversity yang diperkirakan memiliki 30.000 tumbuhan dan sekitar 1260 spesies di antaranya berkhasiat sebagai obat. Sampai saat ini baru sekitar 180 spesies yang telah digunakan untuk berbagai keperluan industri obat dan jamu, tetapi hanya beberapa spesies saja yang telah dibudidayakan secara intensif (Supriadi 2001).
Pasak bumi (Eurycoma longifolia Jack) merupakan salah satu tanaman obat asal hutan yang masih belum banyak dikembangkan padahal tanaman ini memiliki banyak khasiat. Berdasarkan kajian farmakologis diperoleh informasi bahwa senyawa canthin pada tanaman pasak bumi mampu menghambat pertumbuhan sel kanker (Nurhanan et al. 2005) , senyawa turunan eurycomanone sebagai anti malaria (Chan et al. 2005), senyawa quassinoid berfungsi sebagai anti leukimia, dan prospektif untuk anti HIV (Sindelar et al. 2005), serta senyawa etanol berfungsi sebagai afrodisiak (Nainggolan & Simanjuntak 2005).
Industri obat-obatan selama ini hanya mengandalkan tanaman pasak bumi dari alam tanpa adanya upaya budidaya, akibatnya terjadi penurunan populasi pasak bumi di alam. Rifai (1992) bahkan menyatakan kondisi populasi pasak bumi asal Indonesia sudah dikategorikan sebagai tanaman langka dengan status ’terkikis’. Pemerintah Malaysia pada tahun 2001 menyatakan tanaman ini sebagai tanaman yang dilindungi, hal tersebut juga mendorong eksploitasi yang lebih tinggi terhadap pasak bumi asal Indonesia.
Penelitian mengenai tanaman pasak bumi di Indonesia masih sedikit yang dilaporkan. Beberapa penelitian tersebut antara lain: manfaat ekstrak etanol pasak bumi untuk afrodisiak (Nainggolan & Simanjuntak 2005), produksi alkaloid pasak bumi dengan kultur in vitro dan kultur suspensi (Siregar et al. 2005), kajian potensi dan ekologi pasak bumi di Bengkulu (Heriyanto et al. 2006) dan kajian potensi pasak bumi di TNGL (Setyowati 2007). Belum ada satupun laporan mengenai teknik perbanyakan tanaman pasak bumi di Indonesia dan keragaman genetiknya padahal informasi tersebut penting dalam rangka kegiatan pemuliaan dan konservasi maupun usaha pemenuhan kebutuhan bahan baku obat. Berdasarkan alasan tersebut maka perlu dilakukan penelitian ” Teknik Perbanyakan dan Kekerabatan Genetik Pasak Bumi”. Adapun tujuan penelitan ini adalah: (1) Mendapatkan informasi mengenai perbanyakan tanaman pasak bumi secara generatif dan secara vegetatif dengan teknik stek pucuk serta media pertumbuhan yang sesuai, (2) Mendapatkan informasi mengenai kekerabatan genetik tanaman pasak bumi asal Jambi dari hasil perbanyakan secara generatif dengan penanda RAPD.
Untuk perbanyakan tanaman secara generatif, bahan reproduktif tanaman diperoleh dari daerah Bukit Sari, Jambi, kemudian dilakukan kegiatan penanganan benih awal dan dikecambahkan dan disemaikan dengan media yang berbeda. Pada perbanyakan dengan stek pucuk, bahan tanaman diambil dari hasil perbanyakan secara generatif yang berumur 7 bulan. Prosedur penanaman dan pemeliharaan stek disesuaikan dengan prosedur yang ada di KOFFCO system yang ada di rumah kaca Badan Litbang Kehutanan dan Konservasi Alam, Bogor.
Pada kegiatan analisis genetik bahan yang digunakan adalah sampel daun dari 20 individu, kemudian dilakukan ekstraksi dengan metode CTAB dan untuk amplifikasi digunakan 7 primer dari golongan OPY dan OPC dengan teknik PCR-RAPD.
10
dan panjang akar yang dihasilkan. Media yang menghasilkan variabel pertumbuhan terbaik adalah media arang sekam murni.
Pada perbanyakan dengan teknik stek pucuk, perbedaan media berpengaruh terhadap panjang akar sekunder pasak bumi, sedangkan pemberian Rootone F mempengaruhi persentase stek berakar, panjang akar primer dan jumlah akar primer dan sekunder. Akar stek pasak bumi berasal dari primordia akar yang berkembang menjadi akar adventif.
Hasil amplifikasi dengan PCR-RAPD menunjukkan bahwa jumlah fragmen pita DNA hasil amplifikasi 7 primer terpilih (OPY-15, OPY-17, OPY-6, OPY-8, OPY-19, OPY 20 dan OPC 7) berkisar antara 4-11 pita dengan kisaran pita yang teramplifikasi antara 100-1200bp, tergantung pada jenis primer yang digunakan. Dari total 56 pita yang teramplifikasi 78,57% atau sebanyak 44 pita menunjukkan polimorfik, sedangkan hasil analisis dengan Popgene diketahui nilai keragaman (He) sebesar 0,3076.
Nilai persentase lokus polimorfik dan keragaman pasak bumi yang diteliti lebih tinggi dibandingkan dengan penelitian yang dilakukan oleh Osman et al. (2003) yaitu antara 45%-75% dan 0,182-0,246 dengan penanda SNP, dan lebih tinggi jika dibandingkan dengan tanaman daerah tropis lainnya seperti konifer (He = 0,145; Hamrick et al. 1992), eukaliptus (He = 0,182; Moran & Hopper 1987), namun lebih rendah dibandingkan tanaman berkayu, seperti kamper (He = 0,369; Lee et al. 2000) dengan menggunakan metode Isozim. Hal ini mengindikasikan bahwa heterogenitas individu pasak bumi dan kemampuan adaptasi terhadap perubahan lingkungan yang baik cuup tinggi. Menurut Li et al. (2006) pada beberapa kasus hal tersebut bisa disebabkan oleh tingginya instabilitas pada tanaman.
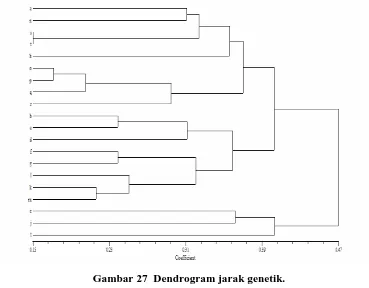
Pengelompokan tersebut kemungkinan disebabkan adanya dua tipe penyerbukan yang berbeda (outcrossing dan kleistogami) sehingga benih yang dihasilkan juga berbeda. Individu pada kelompok I diduga merupakan hasil dari
outcrossing, sedangkan kelompok II merupakan hasil dari kleistogami.
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2007 ini adalah Teknik Perbanyakan dan Kekerabatan Genetik Pasak Bumi (Eurycoma longifolia Jack)
Pada kesempatan ini penulis mengucapkan terima kasih kepada Koordinator Kopertis Wilayah I Sumut NAD dan Rektor Universitas Tri Karya Medan atas kesempatan yang telah diberikan untuk melanjutkan studi ke Program Studi Ilmu Pengetahuan Kehutanan Sekolah Pascasarjana Institut Pertanian Bogor. Terima kasih juga disampaikan kepada Direktorat Jendral Pendidikan Tinggi (Dirjen DIKTI) atas program Beasiswa Pendidikan Pascasarjana (BPPS) T.A 2006-2008.
Terima kasih penulis ucapkan kepada Dr. Supriyanto dan Dr Iskandar Z. Siregar selaku komisi pembimbing yang telah memberikan arahan, bimbingan dan motivasi dalam penyelesaian karya ilmiah ini.
Keberhasilan ini juga tidak terlepas dari doa dan dukungan kedua orang tua, suami dan keluarga, terimakasih untuk semuanya.
Semoga dengan adanya karya ilmiah ini dapat bermanfaat.
Bogor, Agustus 2008
RIWAYAT HIDUP
Penulis dilahirkan di Pekalongan, Jawa Tengah pada tanggal 13 Januari 1980 sebagai anak ketiga dari pasangan bapak Sukotjo dan ibu Sukarti. Pendidikan sarjana ditempuh di Jurusan Manajemen Hutan, Fakultas Kehutanan, IPB, lulus pada bulan September 2003. Kesempatan untuk melanjutkan ke program master pada Progran Studi Ilmu Pengetahuan Kehutanan, sekolah Pascasarjana IPB diperoleh pada tahun ajaran 2006/2007. Beasiswa pendidikan pascasarjana diperoleh dari Departemen Pendidikan Nasional Republik Indonesia.
Penulis bekerja sebagai staf pengajar di Kopertis Wilayah I Sumut-NAD Beberapa mata kuliah yang pernah diasuh antara lain Bioteknologi Tanaman, Pemuliaan Tanaman dan Teknologi Benih.
Bogor, Agustus 2008
DAFTAR ISI
Hal
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN... vi
PENDAHULUAN ... 1
Latar Belakang... 1
Perumusan Masalah ... 3
Tujuan ... 4
Kerangka Pemikiran... 4
Manfaat... 5
TINJAUAN PUSTAKA ... 6
Pasak Bumi (Eurycoma longifolia Jack) ... 6
Perbanyakan Tanaman Secara Generatif... 11
Kekerabatan Genetik... 13
Perbanyakan Secara Vegetatif Dengan Stek Pucuk... 15
METODOLOGI PENELITIAN ... 19
Perbanyakan Tanaman Secara Generatif... 19
Kekerabatan Genetik Antar Individu Pasak Bumi... 22
Perbanyakan Tanaman Dengan Stek Pucuk... 27
HASIL DAN PEMBAHASAN ... 33
Perbanyakan Tanaman Secara Generatif... 33
Kekerabatan Genetik Antar Individu Pasak Bumi ... 44
Perbanyakan Tanaman Dengan Stek Pucuk... 51
KESIMPULAN ... 59
DAFTAR PUSTAKA ... 61
iii
DAFTAR TABEL
Hal 1 Beberapa kajian etnobotanis terhadap tanaman pasak bumi 8 2 Beberapa kajian farmakologis terhadap tanaman pasak bumi 9
3 Komposisi arang sekam padi 13
4 Kandungan bahan aktif Rootone f 17
5 Komposisi bahan untuk ekstraksi DNA 23
6 Urutan basa nukleotida 28 primer (Operon Technology) 24
7 Komposisi bahan untuk reaksi PCR 25
8 Tahapan dalam proses PCR 26
9 Rekapitulasi sidik ragam pertumbuhan semai pasak bumi selama 20 minggu
35 10 Pengaruh media semai terhadap sebaran akar semai pasak bumi 41 11 Primer RAPD yang digunakan serta jumlah pita yang dihasilkan
dari 20 individu semai pasak bumi
46 12 Rekapitulasi hasil sidik ragam dan nilai rata-rata terhadap beberapa
parameter pertumbuhan stek
DAFTAR GAMBAR
Hal 1 Kerangka pemikiran perbanyakan tanaman pasak bumi 4
2 Morfologi daun dan buah pasak bumi 7
3 Tanaman pasak bumi umur 6 bulan dan akarnya 7 4 Rumus bangun beberapa kandungan senyawa pasak bumi 9
5 Bentuk bunga pasak bumi 10
6 Tahapan dalam proses PCR 15
7 Prosedur penelitian keragaman genetik 22
8 Cara penilaian pita dengan sistem skoring 26
9 Mekanisme pembuatan media stek 27
10 Bahan tanaman untuk stek pucuk 28
11 Morfologi benih pasak bumi 33
12 Grafik kumulatif perkecambahan benih pasak bumi selama 60 hari 34
13 Tipe kecambah pasak bumi 35
14 Rata-rata tinggi tanaman pasak bumi pada media tumbuh yang berbeda selama 20 minggu
36
15 Laju pertumbuhan tinggi semai tanaman pasak bumi selama 20 minggu pada tiga media tumbuh.
36 16 Pertambahan diameter semai pasak bumi selama 20 minggu dalam
tiga media tumbuh.
37 17 Kekokohan semai pasak bumi selama 20 minggu dalam tiga media
tumbuh.
37 18 Jumlah malai daun pasak bumi yang terbentuk selama 20 minggu
dalam tiga media tumbuh
38
19 Panjang akar pasak bumi yang terbentuk selama 20 minggu dalam tiga media tumbuh.
39
20 Jumlah akar pasak bumi yang terbentuk selama 20 minggu dalam tiga media tumbuh.
40
21 Semai dan distribusi akar pada tiga media semai yang berbeda 42
22 Serangan jamur penyebab busuk akar 44
23 Serangan larva Atteva sciodoxa 44
v
25 Foto hasil seleksi primer (gambar (a) primer yang terpilih adalah Y20 & C7, gambar (b) primer yang terpilih adalah Y17, Y15, Y8 dan Y6).
46
26 Hasil amplifikasi RAPD dengan primer OPY-15 dan OPY-17 47
27 Dendrogram jarak genetik 49
28 Perbedaan morfologi daun dan pucuk pasak bumi hasil perbanyakan cara generatif.
50 29 Rata-rata persentase hidup stek selama 20 minggu 52 30 Persentase berakar stek selama 20 minggu 52 31 Penampakan stek pucuk pada perlakuan yang berbeda 53 32 Panjang akar stek yang terbentuk selama 20 minggu 54 33 Jumlah akar stek yang terbentuk selama 20 minggu 55 34 Penampang melintang akar stek pasak bumi dengan perbesaran
40x
DAFTAR LAMPIRAN
Hal
1 Kandungan senyawa kimia pasak bumi 66
2 Foto Hasil Amplifikasi Primer OPY-6, OPY-8, OPY-19, OPY- 20 dan OPC-7
67
3 Skoring pita hasil amplifikasi 68
4 Hasil analisis media tanam dari Lab. Tanah dan Sumberdaya lahan, Faperta IPB
70
5 Jarak genetik (Nei’s 1972) 71
6 Sidik ragam terhadap parameter pertumbuhan semai pasak bumi selama 20 minggu
72 7 Sidik ragam terhadap parameter pertumbuhan stek pasak bumi
selama 20 minggu
PENDAHULUAN
Latar Belakang
Perubahan kebijaksanaan kehutanan dari timber management menjadi
resource base management telah mendorong peningkatan usaha pengembangan
berbagai komoditi hutan non kayu yang berpeluang sangat besar untuk kesejahteraan masyarakat. Salah satu usaha yang dilakukan adalah menggali beberapa produk unggulan melalui pengayaan jenis-jenis tumbuhan yang memiliki nilai ekonomi tinggi seperti tumbuhan obat yang bermanfaat untuk industri farmasi. Berdasarkan data Badan Kesehatan Dunia (WHO) diketahui bahwa sampai saat ini 80% lebih penduduk dunia masih menggantungkan diri terhadap pengobatan tradisional termasuk penggunaan obat yang berasal dari tumbuhan.
Indonesia sebagai salah satu negara megabiodiversity diperkirakan memiliki sekitar 30.000 jenis tumbuhan yang dapat ditemukan di dalam hutan hujan tropika, dan sekitar 1260 spesies di antaranya berkhasiat sebagai obat. Namun sampai saat ini baru sekitar 180 spesies yang telah digunakan untuk berbagai keperluan industri obat dan jamu, tetapi baru beberapa spesies saja yang telah di budidayakan secara intensif (Supriadi 2001).
Pasak bumi (Eurycoma longifolia Jack) merupakan salah satu tumbuhan obat asal hutan yang memiliki banyak khasiat. Berdasarkan kajian farmakologis diperoleh informasi bahwa senyawa canthin pada tumbuhan pasak bumi mampu menghambat pertumbuhan sel kanker (Nurhanan et al. 2005), senyawa turunan eurycomanone sebagai anti malaria (Chan et al. 2005), senyawa quassinoid berfungsi sebagai anti leukimia, dan prospektif untuk anti HIV (Sindelar et al. 2005), senyawa etanol berfungsi sebagai afrodisiak (Nainggolan & Simanjuntak 2005).
Tingginya permintaan dan mahalnya harga produk, menyebabkan eksploitasi pasak bumi di hutan alam meningkat, karena selama ini pemungutan dan pengolahan pasak bumi hanya mengandalkan pasak bumi liar, bukan berasal dari tanaman budidaya. Hal ini terjadi pula sebagai akibat dari tidak adanya peraturan baik daerah maupun pusat yang berkaitan dengan pengelolaan dan perlindungan pasak bumi. Habitatnya yang hanya di daerah tertentu (sebagian Sumatera dan Kalimantan Timur) menyebabkan pasak bumi diambang kepunahan sehingga perlu adanya upaya konservasi dan teknik budidaya agar keberadaannya tetap terjaga (Sitepu & Sutigno 2001). Bahkan Rifai (1992) menyatakan kondisi populasi pasak bumi asal Indonesia sudah dikategorikan sebagai tumbuhan langka dengan status ’terkikis’.
Pengambilan pasak bumi secara liar di hutan alam telah menyebabkan kelangkaan populasinya, bahkan mulai tahun 2001 di Malaysia tumbuhan ini sudah dinyatakan sebagai tumbuhan yang dilindungi. Akibatnya tekanan eksploitasi terhadap populasi pasak bumi di Indonesia menjadi semakin meningkat, hal tersebut berpotensi mengakibatkan hilangnya keragaman genetik. Padahal sampai saat ini informasi mengenai keragaman genetik pasak bumi di Indonesia belum diketahui.
3
bumi ini dilakukan untuk mendapatkan informasi awal bagi budidaya tumbuhan ini.
Perumusan Masalah
Pasak bumi memiliki daerah penyebaran di Semenanjung Malaysia, Sumatera dan Kalimantan. Penyebarannya yang hanya di daerah tertentu, serta pembukaan hutan alam yang terus-menerus untuk keperluan komersil, menyebabkan tumbuhan ini mengalami kepunahan di beberapa lokasi penyebarannya. Selain berakibat kepunahan, eksploitasi besar-besaran juga akan menyebabkan hilangnya sumberdaya genetik tumbuhan tersebut. Di Pulau Sumatera hanya beberapa daerah yang diduga masih ditemui tumbuhan pasak bumi yaitu kawasan Leuser, sebagian Provinsi Riau dan kawasan Kerinci Seblat.
Menurut Hussein et al. (2005), selama ini perbanyakan pasak bumi hanya mengandalkan biji di alam. Padahal sebagai tumbuhan yang memiliki tipe benih rekalsitran, persentase kecambahnya cenderung rendah dan memerlukan waktu yang cukup lama akibat embrio zigotik yang belum matang pada saat pemencaran. Selain itu perilaku berbunga yang tidak tentu dan pertumbuhannya yang lambat mengakibatkan tumbuhan ini semakin jarang ditemui.
Pengambilan tumbuhan pasak bumi secara liar di hutan alam telah menyebabkan kelangkaan populasinya, hal ini berpotensi mengakibatkan hilangnya keragaman genetik. Studi keragaman genetik sangat penting dalam rangka menyediakan informasi untuk kegiatan perbanyakan, domestikasi, program pemuliaan dan sekaligus konservasi sumberdaya genetik (Osman et al. 2003).
Berdasarkan permasalahan tersebut maka penelitian ini perlu dilakukan untuk menjawab pertanyaan berikut:
1. Adakah alternatif untuk memperoleh tumbuhan pasak bumi selain melalui cabutan alam?
Tujuan Penelitian ini bertujuan untuk:
1. Mendapatkan informasi mengenai perbanyakan tumbuhan pasak bumi secara generatif dan secara vegetatif melalui stek pucuk dengan media pertumbuhan yang sesuai.
2. Mendapatkan informasi mengenai status kekerabatan genetik pasak bumi asal Jambi hasil perbanyakan secara generatif.
Kerangka Pemikiran
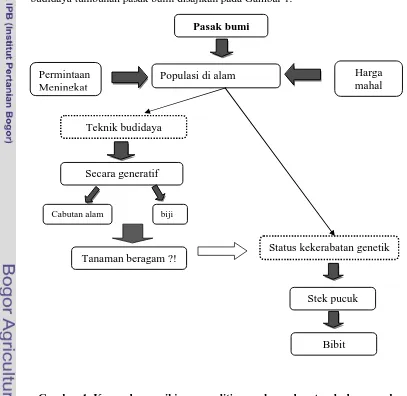
Dari rumusan permasalahan tersebut dapat dibuat kerangka pemikiran budidaya tumbuhan pasak bumi disajikan pada Gambar 1.
Gambar 1 Kerangka pemikiran penelitian perbanyakan tumbuhan pasak bumi.
Secara generatif
Cabutan alam biji
Stek pucuk Pasak bumi
Populasi di alam menurun
Harga mahal
Teknik budidaya Permintaan
Meningkat
Tanaman beragam ?! Status kekerabatan genetik
5
Manfaat
Pasak Bumi (Eurycoma Longifolia Jack)
Menurut Indonesian Botanic Garden (1998) Eurycoma Longifolia Jack memiliki beberapa nama lokal antara lain: penawar pahit, bedara pahit, bedara puteh, tongkat ali, lempedu pahit, payung ali, tongkat baginda, muntah bumi, petala bumi, akar jangat seinang, tungke ali, pasak bumi (Malaysia, Sumatera, Kalimantan), dan tung saw (Thailand).
Taksonomi dan deskripsi pohon
Menurut Angiosperm Phylogeny Group (2003), kedudukan taksonomi pasak bumi adalah sebagai berikut:
Dunia : Plantae
Divisi : Magnoliophyta Kelas : Magnoliopsida Ordo : Sapindales Famili : Simaroubaceae Genus : Eurycoma
Jenis : Eurycoma longifolia Jack
Indonesian Botanic Garden (1998) menyatakan pasak bumi umumnya berbentuk semak, atau pohon kecil yang tingginya jarang mencapai 10 meter, tetapi ada juga yang tingginya mencapai lebih dari 15 meter dan diameter mencapai 15 cm.
Batang : Umumnya tidak bercabang, tetapi ada juga yang bercabang sedikit menyerupai payung dengan kedudukan daunnya melingkar (rosette), batangnya kokoh berwarna coklat keabu-abuan, licin.
7
Bunga : Bersifat monoceous atau dioceous, tetapi biasanya dijumpai sebagai
dioceous. Berwarna merah jingga, lebar bunga 0,6 cm, berbulu halus
dengan benjolan kelenjar di ujungnya, ada 2 (dua) kelompok tumbuhan yaitu tumbuhan berbunga jantan (tidak menghasilkan buah) dan berbunga betina (mampu menghasilkan buah).
Buah : Panjang 1,25 cm, berbentuk oblong, ketika masak warnanya menjadi kuning kemudian memerah.
Berdasarkan sifat-sifatnya pasak bumi dikelompokkan bersama dengan marga
quassia, picrasma, brucea dan soulamea dalam suku Simarubaceae yang terdiri
dari tumbuhan yang mengandung substansi pahit (bitter plant).
Morfologi daun, buah serta akar tumbuhan pasak bumi terlihat pada Gambar 2 dan Gambar 3.
Gambar 2 Morfologi daun dan buah pasak bumi.
Gambar 3 Pasak bumi umur 6 bulan dan akarnya.
Habitat dan kegunaan
Heyne (1987) mengatakan pasak bumi merupakan pohon pantai yang bagus menarik, tingginya hingga 6 m, berasal dari bagian barat nusantara, tidak ditemukan di Jawa.
Tumbuhan pasak bumi telah banyak dimanfaatkan oleh masyarakat tradisional untuk keperluan penyembuhan berbagai penyakit. Hampir seluruh bagian tumbuhan ini mengandung substansi pahit yang dapat digunakan untuk obat. Beberapa kajian etnobotanis yang telah dilakukan terhadap tumbuhan pasak bumi dapat disajikan pada Tabel 1.
Tabel 1 Beberapa hasil kajian etnobotanis terhadap tumbuhan pasak bumi
Bagian tumbuhan Manfaat
Akar Akar tumbuhan ini dicampur dengan tumbuhan obat lain seperti kayu manis dan digunakan untuk tonik penyehat di Sabah. Selain itu di Malaysia kulit akarnya digunakan juga sebagai penawar demam, penyembuh luka-luka di gusi atau gangguan cacing serta tonikum setelah melahirkan (Wong KM & E. Supadmo 1995).
Batang Kulit batang digunakan untuk koagulan darah setelah melahirkan, sedangkan di Kalimantan dan Sabah kulit batang digunakan untuk mengobati nyeri pada tulang (Hadiah 2000 ).
Daun Daun pasak bumi yang muda dapat dimakan untuk pengobatan sakit perut.
Bunga dan buah Di Vietnam bunga dan buah pasak bumi digunakan untuk obat desentri.
Kayu Menurut sifat fisis, mekanis dan keawetan, kayu pasak bumi memiliki berat jenis 0,65, kelas awet 4-5, dan kelas kuat II. Kayu golongan ini dapat digunakan untuk keperluan konstruksi dan mebel (Oey Djoen Seng 1990).
9
Tabel 2 Beberapa penelitian farmakologis terhadap manfaat tumbuhan pasak bumi
No Manfaat Sumber
1 afrodisiak Ang et al. 1999
2 antihyperglycaemic Husen et al. 2004
3 anti malaria Chan et al. 2005 dan
Ridzuan et al. 2005
4 anti kanker Nurhanan et al. 2005
5 anti HIV,anti leukimia Sindelar et al. 2005
6 anti proliferatif Ueda J et al. 2002
Kandungan kimia
Pasak bumi memiliki kandungan senyawa kimia yang banyak digunakan untuk keperluan obat-obatan. Terdapat 65 jenis senyawa kimia yang terkandung pada tumbuhan pasak bumi. Adapun kandungan pasak bumi secara lengkap dapat disajikan pada Lampiran 1. Rumus bangun beberapa kandungan senyawa penting pasak bumi disajikan pada Gambar 4.
Biologi reproduksi dan tipe benih pasak bumi
Pasak bumi terdiri dari 2 tipe tumbuhan yaitu dioceous dan monoceous. Jenis dioceous tergolong unik karena terdiri dari pohon jantan dan pohon betina. Pohon jantan dapat menghasilkan buah namun gugur pada saat muda selain itu memliki bunga yang dapat tumbuh namun putiknya steril, sedangkan pohon betina mampu menghasilkan benih dan memiliki benang sari namun steril, oleh karena itu proses penyerbukannya kemungkinan dibantu oleh serangga dan penyerbukan silang (Padua et al. 1999). Bunga jantan dan betina pada pasak bumi dapat dibedakan secara mudah berdasarkan ukuran benangsarinya. Bunga betina memiliki benangsari yang besar, sedangkan bunga jantan memiliki benangsari yang tipis dan kecil (Gambar 5).
(a) (b)
Gambar 5 Bentuk bunga pasak bumi. (a) bunga jantan, (b) bunga betina. (sumber Wong K.M & Soepadmo 1995)
Pada beberapa kasus proses penyerbukan dan pembuahan terjadi pada saat bunga masih belum membuka (penyerbukan tertutup/ kleistogami). Letak benang sari yang lebih rendah daripada kepala putik menyebabkan proses penyerbukan pada tipe ini sulit dilakukan, proses penyerbukan hanya terjadi ketika ada vektor yang dapat menggerakkan bunga sehingga putik dan benangsari bertemu (Hadiah 2000).
Pasak bumi memiliki tipe benih rekalsitran. Persentase perkecambahan pasak bumi yang terjadi di habitat alamnya sangat rendah serta membutuhkan waktu yang cukup lama, hal ini disebabkan karena adanya embrio yang belum cukup masak pada saat pemencaran (Hussein et al. 2005).
11
Perbanyakan Tanaman Secara Generatif
Perkecambahan benih
Perkecambahan benih adalah proses pembentukan organ tumbuhan yang berasal dari benih yang ditandai dengan munculnya radikula untuk menjadi bibit, atau pengaktifan kembali aktifitas pertumbuhan embrionik di dalam biji untuk kemudian membentuk bibit (seedling). Secara morfologis suatu biji yang sedang berkecambah (germinate) umumnya ditandai dengan terlihatnya akar (radikula) atau daun (plumula) yang menonjol keluar dari biji.
Media tumbuh
Media tumbuh merupaka elemen penting bagi tumbuhan karena merupakan tempat berjangkarnya akar, penompang batang agar dapat berdiri kokoh dan juga sebagai sumber hara dan mineral yang diperlukan bagi kelangsungan hidupnya. Media tumbuh yang baik harus memenuhi persyaratan fisik (tekstur, struktur, porositas dan konsistensi) dan kimia (pH, unsur hara mikro dan makro).
a. Tanah
Tanah yang baik untuk usaha penanaman adalah tanah yang mampu berfungsi baik untuk penopang mekanis, mampu menahan air sesuai keperluan tumbuhan, mampu menyerap kelebihan air (porous), menjamin terjadinya pertukaran gas (aerasi) yang baik serta mampu menyediakan unsur hara yang diperlukan untuk pertumbuhan tumbuhan. Tanah harus subur, tidak asam atau basa, dalam, dan berdrainase baik agar terhindar dari terendam air, tetapi cukup menyimpan air sehingga tidak terjadi kekeringan.
b. Pasir
c. Kompos
Kompos merupakan bahan organik yang berfungsi sebagai pupuk. Selain itu dapat memperbaiki sifat fisik tanah karena tanah remah dan mikroba-mikroba tanah yang bermanfaat dapat hidup dengan subur (Wudianto 1998).
Murbandono (2001) menjelaskan bahwa bahan organik yang telah terkompos dengan baik mempunyai banyak peranan antara lain memperbesar daya ikat tanah yang berpasir sehingga struktur tanah akan lebih baik, mempertinggi kemampuan tanah untuk menyerap air dan menyediakannya untuk kepentingan tumbuhan, memperbaiki drainase dan tata udara tanah serta mempertinggi daya ikat tanah terhadap hara sehingga tidak mudah larut oleh air hujan atau pengairan.
Kompos dapat mempengaruhi kesuburan tanah terutama sifat fisik tanah, sifat kimia dan biologi tanah. Kompos juga mampu menyediakan unsur hara seperti N, P, K, Mg, Fe, S, Mn dan Cu, sehingga dapat memperbaiki sifat kimia tanah. Jumlah populasi mikroorganisme tanah juga akan meningkat akibat pemberian kompos.
d. Arang sekam
Sekam dan arang sekam padi sering digunakan di persemaian. Arang yang berwarna hitam dapat menyerap panas sehingga suhu tanah naik dan mempercepat pertumbuhan semai. Sekam padi sangat baik sebagai pendukung media atau pengganti tanah pertanian. Apabila sekam padi mengalami penguraian, maka sekam akan membebaskan unsur P dan K dengan kadar yang cukup berarti.
Hasil penelitian yang dilakukan oleh Harsono (2002) menunjukkan bahwa arang sekam memiliki kandungan silika yang tinggi (94-96%) serta kandungan unsur lain yang mendukung pertumbuhan tumbuhan. Adanya kandungan silika yang tinggi tersebut mampu menyerap kadar unsur yang berlebih. Komposisi arang sekam padi dapat disajikan pada Tabel 3.
Tabel 3 Komposisi arang sekam padi
Unsur Persentase (%)
Na 0,0065
Fe 0,0043
Ca 0,0006
K 0,0059
Mg 0,0010
Si 56,8081
P 0,0041
13
Kekerabatan Genetik
Perkembangbiakan secara generatif mempunyai arti yang penting bagi genetika, karena pada pembiakan ini terjadi terlebih dahulu pembuahan antara gamet jantan (n, haploid) dan betina (n, haploid) sehingga keturunan yang dihasilkan akan memiliki sifat yang dimiliki oleh salah satu atau kedua induknya (Suryo 1986).
Pola variasi genetik suatu jenis ditentukan oleh sistem perkawinan yang terjadi dan akan mempengaruhi struktur genetik dan dinamikan populasi dalam jenis tersebut. Dengan mengetahui proses-proses perkawinan yang terjadi pada suatu jenis akan bermanfaat bagi efektifitas konservasi sumberdaya genetik dan optimalisasi upaya pemuliaan genetik jenis tersebut.
Pasak bumi merupakan tipe tumbuhan dioceous dan hermaprodit. Pada tumbuhan tipe hermaprodit mampu melakukan selfing dan outcrossing dengan derajat yang dipengaruhi oleh kondisi lingkungan (Fingkeldey 2005).
Pengetahuan mengenai kekerabatan genetik antar individu genotip sangat berguna bagi pemulia tumbuhan. Kekerabatan ini diperkirakan berdasarkan analisis keturunan, karakter morfologi, kompatibilitas seksual dan klasifikasi taksonomi (Renganayaki et al. 2001).
RAPD (Random Amplified Polymorphic DNA )
RAPD merupakan salah satu metode penanda genetik berbasis DNA yang telah cukup banyak digunakan untuk menilai keragaman genetik tumbuhan hutan. RAPD memiliki keunggulan dibandingkan jenis penanda lain yaitu tidak dipengaruhi oleh umur tumbuhan, mudah dilakukan, biaya relatif murah dan hasil yang cepat diperoleh, namun salah satu kekurangan dari teknik ini adalah hasilnya yang terkadang tidak konsisten, namun hal tersebut dapat diminimalisir dengan prosedur teknik yang hati-hati dan teliti.
perubahan basa tunggal yang mencegah perpasangan primer dan sekuens target, delesi sisi utama, insersi atau delesi yang modifikasi ukuran DNA. Keuntungan metode ini adalah set oligonukleotida yang sama dapat digunakan untuk berbagai spesies atau organisme dan setelah amplifikasi selama 2-4 jam polimorfisme ni dapat diamati secara langsung dengan agarose normal gel elektroforesis (Nasir 2002).
Beberapa alasan pemilihan teknik RAPD untuk menganalisis keragaman genetik antara lain tidak membutuhkan latar belakang pengetahuan tentang genom yang akan dianalisis, tersedianya primer yang secara universal dapat digunakan untuk organisme prokariot maupun eukariot, mampu menghasilkan karakter yang relatif tidak terbatas jumlahnya, bahan-bahan yang digunakan relatif lebih murah, mudah dalam preparasi, dan relatif cepat memberikan hasil.
Sampai saat ini studi mengenai kekerabatan genetik tumbuhan pasak bumi yang ada di Indonesia belum pernah dilaporkan.
PCR (Polymerase Chain Reaction)
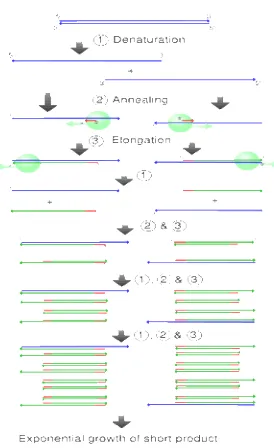
PCR adalah suatu metode untuk menggandakan atau mengamplifikasi ADN yang diisolasi pada sebuah tabung reaksi kecil dengan melalui replikasi berulang (Finkeldey 2005). Secara skematis proses PCR dapat disajikan pada Gambar 6.
15
Gambar 6 Tahapan dalam proses PCR (Anonim 2007).
Produk PCR dari individu pohon yang berbeda akan menghasilkan panjang sekuen yang berbeda pula. Perbedaan ini akan dapat dideteksi dengan elektroforesis dengan gel agarose.
Perbanyakan Secara Vegetatif dengan Stek Pucuk
Pembiakan vegetatif merupakan pembiakan tumbuhan yang menggunakan salah satu bagian vegetatif tumbuhan itu sendiri misalnya akar, batang, daun, pucuk, jaringan bunga, jaringan meristem dan sel tanpa melibatkan proses perkawinan atau pembuahan.
Zobel dan Talbert (1984) menyatakan bahwa pembiakan vegetatif memiliki beberapa kegunaan khususnya dibidang kehutanan, yaitu untuk :
1. Memperbanyak genotipe-genotipe unggul yang diinginkan. 2. Menilai genotipe dan interaksinya dengan lingkungan. 3. Memperoleh keuntungan genetik maksimum.
Pada dasarnya perbanyakan tumbuhan secara stek merupakan teknik perbanyakan dengan cara memindahkan bagian tumbuhan dari induk kemudian menumbuhkannya kembali menjadi tumbuhan utuh. Teknik stek ini dibedakan berdasarkan bagian tumbuhan induk yang digunakan untuk perbanyakan antara lain batang, pucuk, daun, maupun akar (Bir 2006).
Faktor yang mempengaruhi keberhasilan stek pucuk.
Keberhasilan stek ditentukan oleh kondisi lingkungan yang ideal bagi berlangsungnya proses fotosintesis secara optimal dan transpirasi yang seimbang. Kedua proses fisiologis tersebut sangat berperan terhadap metabolisme stek untuk pembentukan akar. Dari serangkaian penelitian diketahui bahwa tiga faktor lingkungan yang sangat berperan dalam pembentukan akar stek adalah kelembaban, temperatur dan intensitas cahaya. Ketiga faktor tersebut mempengaruhi besaran perbedaan tekanan uap daun dan udara (leaf to air
pressure deficit/VPD) pada stek (Sakai et al. 2002).
Menurut Toenyan et al. (2006), keberhasilan teknik stek dapat dilihat dari pembentukan akar. Beberapa faktor yang mempengaruhi pembentukan perakaran stek antara lain: nutrisi/karbohidrat/nitrogen, juvenility, pemilihan waktu/timing, wounding & girlding, serta hormon.
Teknik stek pucuk KOFFCO (Komatsu-FORDA Fogging Cooling System) merupakan teknologi yang dikembangkan untuk perbanyakan massal jenis-jenis meranti dan jenis indigenous lainnya. Pengembangan teknik KOFFCO melalui teknik pendinginan rumah kaca meliputi pengkabutan, proses pembuatan stek, pembuatan media, proses perawatan bibit stek pada tahap pembentukan akar dan tahap adaptasi stek di persemaian.
Zat pengatur tumbuh (ZPT)
17
hormon, pengrusakan, translokasi, atau dengan perubahan tempat pertumbuhan hormon.
Wattimena et al. (1992) membedakan 6 (enam) kelompok zat pengatur tumbuh yaitu: auksin, giberalin, sitokinin, asam absisik (ABA), etilen dan retardan. Auksin adalah jenis senyawa yang mengatur segala bentuk gejala pembentukan organ atau jaringan tumbuhan dan dapat aktif diluar titik tumbuhnya dalam jumlah yang sangat sedikit.
Menurut Hartmann et al. (1997), pemberian auksin bertujuan untuk meningkatkan persentase stek berakar, meningkatkan jumlah dan kualitas akar serta menyeragamkan kualitas akar
Yasman dan Hernawan (2002) mengemukakan bahwa sebenarnya hormon telah tersedia secara alami pada tumbuhan, namun tetap diberikan pada stek dengan tujuan untuk:1). Meningkatkan kemampuan stek berakar; 2). Mempercepat proses pertumbuhan akar; 3). Meningkatkan jumlah dan kualitas akar dan 4) Mengurangi keragaman jumlah dan kualitas perakaran.
Rootone F merupakan salah satu hormon penumbuh akar yang diperdagangkan dalam bentuk serbuk berwarna putih, tidak larut dalam air dan berguna mempercepat dan memperbanyak pertumbuhan akar-akar baru.
Bahan aktif yang terkandung dalam hormon penumbuh akar Rootone-F dapat disajikan pada Tabel 4.
Tabel 4 Kandungan bahan aktif Rootone F
Bahan Aktif Komposisi
1-Napthalena Acetamid 0,067 % 2-Methyl-1-Napthalena Acetic Acid 0,033 % 2-Methyl-1-Napthalena Acetamida 0,013 % Indole-3-Butyric Acid 0,057 %
Thiram 4,000 %
Inert Ingredient 95,330 %
Media tumbuh
Menurut Sakai dan Subiakto (2007), pemilihan media stek harus memperhatikan 3 (tiga) karakteristik yaitu:
1. Kandungan kimia.
Kandungan kimia yang harus diperhatikan adalah, kadar garam, tingkat keasaman dan tingkat ionisasi media. Kandungan kimia yang ekstrim akan menyebabkan gangguan selama proses pembentukan akar stek. Media yang baik adalah media yang memiliki kandungan kimia minimal, seperti kadar garam yang rendah, pH yang netral dan tingkat ionisasi yang rendah.
2. Sifat fisik
Sifat fisik lebih diarahkan pada karakteristik fisik dari media yang digunakan seperti kemampuan mengikat air, dan porositas media. Porositas media yang dicirikan dari tingginya unsur udara (aerasi) dalam media merupakan unsur fisik yang penting untuk media stek. Sehingga media stek yang ideal adalah media yang dapat memiliki aerasi yang cukup namun dapat mengikat air.
3. Kandungan mikrobiologi.
METODOLOGI PENELITIAN
Percobaan I. Perbanyakan Tanaman Secara Generatif Tempat dan waktu penelitian
Perbanyakan tanaman secara generatif dilaksanakan di rumah kaca Laboratorium Silvikultur, Fakultas Kehutanan IPB selama 6 bulan (Januari-Juli 2007).
Alat dan bahan
Alat yang digunakan untuk untuk perkecambahan benih dan perbanyakan secara generatif antara lain bak kecambah, sprayer, polibag, cangkul dan alat-alat tulis dan sungkup plastik untuk naungan. Sedangkan bahan yang digunakan untuk perbanyakan generatif adalah top soil, arang sekam dan pasir (untuk media tanam), Dithane M-45 sebagai fungisida, Decis® (insektisida) dan pupuk NPK.
Metode Penelitian
Eksplorasi bahan tanaman.
Eksplorasi bahan tanaman dilakukan dengan mengambil benih pasak bumi dari sebuah pohon induk yang sehat, dengan diameter ± 20 cm dan tinggi 10 meter di areal hutan dataran rendah, Bukit Sari, Kabupaten Kerinci, Provinsi Jambi. Benih tersebut kemudian disimpan dalam wadah kedap udara agar kelembabannya tidak mengalami penurunan.
Persiapan benih dan media kecambah
Untuk kegiatan perkecambahan benih media yang digunakan merupakan kombinasi dari 4 (empat) media dasar yaitu: pasir murni; pasir : tanah (1/1, v/v); pasir : arang sekam (1/1, v/v); pasir : kompos (1/1, v/v).
Media dibersihkan dari kotoran dan diayak, kemudian disangrai selama 15 menit hingga tanah menjadi panas dengan tujuan untuk mensterilkan media dari pathogen yang terbawa oleh tanah. Benih sebanyak 360 butir dikecambahkan pada 4 (empat) media kecambah yang berbeda kemudian diletakkan di rumah kaca.
Penyapihan Semai
Setelah berumur ± 8 minggu dan siap tanam, tanaman dipindahkan ke media semai yang terdiri dari 3 (tiga) perlakuan yaitu : M1 = arang sekam : tanah (1/1, v/v); M2 = arang sekam murni; M3 = pasir : tanah (1/1, v/v).
Variabel yang diamati
Variabel yang diamati dalam perkecambahan benih ini adalah : 1.Diameter benih, berat 1000 butir benih
2.Hari berkecambah. Pengamatan hari berkecambah dilakukan mulai dari saat benih ditanam hingga benih berkecambah.
3.Persentase kecambah. Persentase kecambah dihitung dengan cara membandingkan antara jumlah benih yang berkecambah dengan jumlah seluruh benih yang ditanam.
Persentase Kecambah = x100%
kan dikecambah yang benih seluruh Jumlah h berkecamba yang benih Jumlah
4.Pengamatan visual. Pengamatan visual dilakukan dengan melihat penampilan fisik kecambah yang dihasilkan pada 4 (empat) media kecambah yang berbeda selama waktu pengamatan.
5.Rasio panjang pucuk/akar. Rasio panjang pucuk/ akar dihitung dengan membandingkan panjang pucuk dengan panjang akarnya.
21
7.Diameter semai. Pengukuran diameter semai dilakukan pada awal dan akhir pengamatan.
8.Kekokohan semai. Kekokohan semai dihitung dengan membandingkan tinggi akhir dan diameter akhir semai.
Kekokohan Semai =
(cm) akhir semai Diameter
) (cm
akhir semai Tinggi
9.Jumlah akar primer dan sekunder. Pengukuran jumlah akar dilakukan pada akhir pengamatan.
10.Panjang akar primer dan sekunder. Pengukuran jumlah akar dilakukan pada akhir pengamatan.
Rancangan percobaan dan analisis data
Pada perkecambahan benih ini rancangan penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan perlakuan media tanam (M1: arang sekam-tanah dengan perbandingan 1:1; M2: arang sekam murni dan M3: kombinasi pasir- tanah dengan perbandingan 1:1(v/v) dan ulangan masing-masing 10 semai.
Model statistik linier dari rancangan percobaan ini dinyatakan dalam persamaan sebagai berikut:
Yij = µµµµ + ααααi + ΣΣΣΣij
Keterangan : Yij = Respon pengamatan pada perlakuan media tanam taraf ke-i dan ulangan ke-j
µ = Nilai rata-rata umum
αi = Pengaruh perlakuan media tanam taraf ke-i
Σij = Sisaan acak dari satuan percobaan ulangan ke-j yang dikenai perlakuan media tanam taraf ke-i
i = 1,2,3,… j = 1,2,3,…
Percobaan II. Kekerabatan antar Individu Semai Pasak Bumi
Tempat dan waktu penelitian
Penelitian mengenai kekerabatan tanaman pasak bumi dilaksanakan di Laboratorium Genetika, Departemen Silvikultur Fakultas Kehutanan IPB, sedangkan untuk dokumentasi hasil PCR dilaksanakan di Laboratorium Biorin, PAU IPB. Waktu Penelitian selama 5 bulan (Nopember 2007-Maret 2008).
Alat dan bahan
Untuk analisis keragaman genetik tanaman pasak bumi alat yang digunakan adalah tube, gelas piala, gelas ukur, sarung tangan, UV transiluminator, kamera digital, mortar dan pestel, hotplate, stirer, neraca analitik, vortex dan
Peltier Thermal Cycler, pipet, freezer dan sentrifuse.
Bahan tanaman yang digunakan adalah sampel daun pasak bumi asal Jambi sebanyak 20 buah hasil perbanyakan generatif yang berumur 7 bulan. Sedangkan bahan kimia yang digunakan adalah buffer TE, PVP (polyvinylpyrrolidone) 2%, agarose, ethidium bromida (EtBr), buffer ekstrak, CTAB, cloroform IAA, pheol, propanol, NaCl, etanol 100%, green go Taq dan primer.
Metode Penelitian
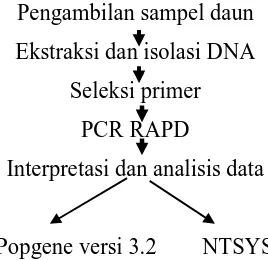
Metode analisis DNA dengan RAPD dibagi menjadi tiga tahapan yaitu ekstraksi, RAPD dan analisis data. Secara umum prosedur penelitian dengan metode RAPD dapat dilihat pada Gambar 7.
Pengambilan sampel daun Ekstraksi dan isolasi DNA
Seleksi primer PCR RAPD
Interpretasi dan analisis data
[image:39.612.268.402.524.654.2]Popgene versi 3.2 NTSYS
23
Ekstraksi dan isolasi DNA
Isolasi DNA dilakukan dengan menggunakan metode CTAB (Milligan 1989) yang meliputi beberapa kegiatan yaitu: ekstraksi, pemurnian dan presipitasi.
[image:40.612.132.507.326.417.2]Pada kegiatan ekstrasi sampel daun digerus dalam pestel dengan penambahan larutan buffer ekstraksi sebanyak 300-500 µl dan larutan PVP 2% sebanyak 100 µl sampai berbentuk serbuk. Hasil gerusan tersebut kemudian dimasukkan ke dalam tabung plastik steril yang kemudian diisi dengan buffer pengekstrak CTAB dengan komposisi seperti Tabel 5, sebanyak 500 µl dan 100 µl PVP 2%. Tabung kemudian ditutup rapat, kemudian buffer dan sampel dikocok lalu diinkubasi dalam water bath selama 45 menit – 1 jam pada suhu 65 0C. Setiap 15 menit sekali tabung-tabung tersebut diangkat dari water bath untuk dikocok perlahan-lahan.
Tabel 5 Komposisi bahan untuk ekstraksi DNA
No. Nama Bahan 1 sampel reaksi X sample reaksi 1. Tris-HCl 1 M 100 mikro liter X x 100 mikro liter 2. NaCl 5 M 280 mikro liter X x 280 mikro liter 3. EDTA 0.5 M 40 mikro liter X x 40 mikro liter 4. CTAB 10% 200 mikro liter X x 200 mikro liter 5. Merkapetanol 5 mikro liter X x 5 mikro liter 6. PVP 1% 100 mikro liter X x 100 mikro liter 7. Akuades 280 mikro liter X x 280 mikro liter
Setelah inkubasi selesai, tabung diangkat dan didinginkan pada suhu ruang selam 15 menit dan dicuci dengan menambahkan 500 µl Cloroform IAA dan phenol 10 µl, campuran digoyang perlahan dan disentrifugasi pada 13.000 rpm selama 2 menit. Supernatan yang diperoleh kemudian dipindahkan ke tabung baru dengan penambahan kembali 500 µl Cloroform IAA dan phenol 10 µl dan disentrifugasi kembali pada 13.000 rpm selama 2 menit.
selesai kemudian dikeringanginkan dalam desikator selama 15 menit. Tambahkan TE 20 µl kemudian dicampur dan disentrifugasi kembali.
Uji kualitas DNA
Untuk uji kualitas DNA, selama proses pengeringan pellet DNA disiapkan agarose 1% (0,33 gram agarose dalam 33 ml TAE). Untuk proses elektroforesis ditambahkan TE 20 µl pada pellet DNA lalu sentrifugasi, diambil 3 µl DNA ditambahkan 2 µl BJ (blue Juice) 10x dan running/elektroforesis pada tegangan 100 volt selama ± 24 menit. Hasil elektroforesis kemudian direndam dalam larutan etidium bromide (EtBr) 10 µl per 200 ml aquades selama 5-10 menit dan selanjutnya dilihat pada UV transiluminator dan didokumentasikan dengan menggunakan foto gel.
Seleksi primer
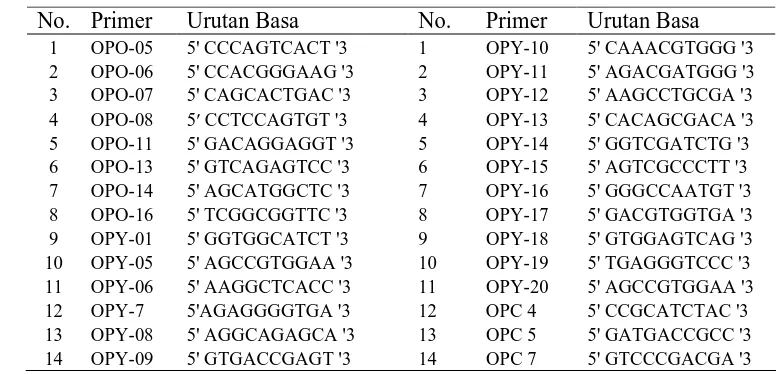
Pada kegiatan seleksi primer, dilakukan seleksi terhadap 28 primer secara
random yaitu primer golongan OPO dan OPY yang diproduksi oleh Operon
Technology. Selanjutnya dari 28 primer tersebut dipilih 5 primer yang
[image:41.612.119.508.477.664.2]menghasilkan fragmen DNA polimofik. Urutan basa nukleotida dari 28 primer produksi Operon Technology yang digunakan, disajikan pada Tabel 6.
Tabel 6 Urutan basa nukleotida 28 primer (Operon Technology) No. Primer Urutan Basa No. Primer Urutan Basa
1 OPO-05 5' CCCAGTCACT '3 1 OPY-10 5' CAAACGTGGG '3 2 OPO-06 5' CCACGGGAAG '3 2 OPY-11 5' AGACGATGGG '3 3 OPO-07 5' CAGCACTGAC '3 3 OPY-12 5' AAGCCTGCGA '3 4 OPO-08 5′ CCTCCAGTGT '3 4 OPY-13 5' CACAGCGACA '3 5 OPO-11 5' GACAGGAGGT '3 5 OPY-14 5' GGTCGATCTG '3 6 OPO-13 5' GTCAGAGTCC '3 6 OPY-15 5' AGTCGCCCTT '3 7 OPO-14 5' AGCATGGCTC'3 7 OPY-16 5' GGGCCAATGT '3 8 OPO-16 5' TCGGCGGTTC '3 8 OPY-17 5' GACGTGGTGA '3 9 OPY-01 5' GGTGGCATCT '3 9 OPY-18 5' GTGGAGTCAG '3 10 OPY-05 5' AGCCGTGGAA '3 10 OPY-19 5' TGAGGGTCCC '3 11 OPY-06 5' AAGGCTCACC '3 11 OPY-20 5' AGCCGTGGAA '3 12 OPY-7 5'AGAGGGGTGA '3 12 OPC 4 5' CCGCATCTAC '3 13 OPY-08 5' AGGCAGAGCA '3 13 OPC 5 5' GATGACCGCC '3 14 OPY-09 5' GTGACCGAGT '3 14 OPC 7 5' GTCCCGACGA '3
25
komponen campuran untuk reaksi PCR (green go Taq 7,5 µl, nuclease-free water 2,5 µl, DNA mix masing-masing 2 µl dan primer masing-masing 1,5 µl disentrifugasi selama 5-10 detik, kemudian dimasukkan ke dalam mesin PCR.
DNA hasil PCR kemudian dieletroforesis dengan menggunakan agarose 2% (0,30 g agarose, 15 ml TAE) pada tegangan 90 volt selama 24 menit, selanjutnya dilihat pada UV transiluminator. Primer yang menghasilkan pita atau jumlah amplifikasi yang terbanyak selanjutnya digunakan untuk amplifikasi DNA dari 20 sampel yang diuji.
Amplifikasi dengan PCR (Polimerase Chain Reaction)
Sebelum melakukan amplifikasi PCR, DNA hasil ekstraksi diencerkan dengan aquabides. Perbandingan antara DNA dengan aquabides tergantung pada resolusi pita genomik hasil ekstrasi (misalnya pengenceran 100x artinya 99 µl aquabides dan 1 µl DNA hasil ekstrasi).
Proses amplifikasi dilakukan dengan metode RAPD menggunakan mesin PCR MJ Research PTC-100. Untuk proses ampifikasi DNA dengan PCR terdapat empat komponen yang digunakan antara lain green go Taq, DNA sampel dari bibit tanaman, primer dan aquaidest. Komposisi bahan untuk PCR disajikan pada Tabel 7.
Tabel 7 Komposisi bahan untuk reaksi PCR
No. Nama Bahan 1 sampel reaksi X sample reaksi 1 H2O 2 mikro liter X x 2 mikro liter
2 green go Tag 7.5 mikro liter X x 7.5 mikro liter
3 Primer 1.5 mikro liter X x 1.5 mikro liter 4 Cetakan DNA 2 mikro liter X x 2 mikro liter
DNA hasil PCR dielektroforesis dengan menggunakan konsentrasi agarose 2% (0,66 gram agarose dan 33 ml TAE), di running pada tegangan 90 volt selama 24 menit, kemudian direndam dalam larutan etidium bromide 10 µl per 200 ml aquades selama 5-10 menit. Visualisasi fragmen DNA dilakukan pada
UV transiluminator. Seragam tidaknya DNA diamati dari pita yang dihasilkan.
Tabel 8 Pengaturan suhu dalam beberapa tahapan dalam proses PCR Tahapan Suhu (oC) Waktu (menit) Jumlah siklus
Pre denaturasi 95 2 1
Denaturasi Annealing Extension
95 37 72
1 2 2
45
Final Extension 72 10 1
Analisis hasil PCR
Berdasarkan foto DNA kemudian dilakukan scoring dan diterjemahkan dalam data biner berdasarkan ada tidaknya pita dengan ketentuan nilai 0 (nol) untuk tidak ada pita dan nilai 1 (satu) untuk adanya pita pada suatu posisi yang sama dari setiap individu yang dibandingkan (Gambar 10). Data yang diperoleh, diolah dengan menggunakan software Popgene versi 3.2.
Lokus Individu
1 2 3 4 5 6 7 8 9 10 11 L-1
L-2
Individu Lokus
1 2 3 4 5 6 7 8 9 10 11
L-1 1 1 1 1 1 0 1 0 1 0 1
L-2 1 1 1 0 1 1 1 1 0 1 1
Gambar 8 Cara penilaian pita dengan sistem skoring (1 = ada pita, 0 = tidak ada pita).
Variabel genetik yang diukur pada studi kekerabatan genetik pasak bumi adalah:
1. Persentase pita DNA polimorfik 2. Keragaman (He)
27
Percobaan III. Perbanyakan Tanaman Dengan Stek Pucuk
Tempat dan waktu penelitian
Penelitian Perbanyakan tanaman dengan stek pucuk dilaksanakan di Rumah kaca KOFFCO System, Puslitbang Kehutanan dan Konservasi Alam Bogor, untuk analisis tanah dilaksanakan di Laboratorium Tanah dan Sumberdaya Lahan, Fakultas Pertanian IPB dan analisis histologi akar di Laboratorium Bioteknologi, SEAMEO-BIOTROP. Waktu penelitian selama 5 bulan (Nopember 2007-April 2008).
Alat dan bahan
Untuk pembuatan stek pucuk diperlukan sungkup propagasi, gunting stek, politube. Sedangkan bahan yang digunakan adalah campuran cocodust dan sekam dengan perbandingan tertentu sebagai media tanam serta Rootone-F sebagai hormon perakaran.
Metode Penelitian
Persiapan media tanam dan bahan stek
Media tanam yang digunakan adalah campuran antara cocodust dan sekam padi dengan perbandingan yang berbeda 1:0 (media A1), 1:1 (media A2) dan 2:1 (media A3). Untuk pembuatan media tanam mengikuti prosedur KOFFCO. Secara skematis proses pembuatan media dapat disajikan pada Gambar 9.
serbuk kelapa sekam padi Steamer (100 0C, 30 menit) Mixer (1:0, 1:1, 2:1)
Dryer (80 0C) Media
Gambar 9 Mekanisme pembuatan media stek.
Bahan tanaman yang digunakan untuk pembuatan stek pucuk berasal hasil perbanyakan dengan biji dan berumur 7 bulan yang memenuhi beberapa kriteria antara lain kesehatan batang dan daun, tunas vertikal dan tunas muda (juvenil). Adapun bahan tanaman yang digunakan untuk stek pucuk dapat disajikan pada Gambar 10.
Gambar 10 Bahan tanaman untuk stek pucuk.
Setelah itu bahan stek diambil dari tanaman induk dengan pemotongan menggunakan gunting pemotong. Teknik pemotongan bahan stek dilakukan dengan memotong batang tunas dengan ukuran minimal dua ruas daun (3 nodul) atau kurang lebih berukuran 5-10 cm.
Penanaman stek dan pemeliharaan stek.
Penanaman stek dilakukan setelah media disiapkan dan potongan bahan stek tersedia. Media tanam pada pot-ray terlebih dahulu dilubangi untuk memasukkan batang stek. Bahan stek diberi perlakuan dengan diolesi hormon Rootone-F (B1) dengan konsentrasi 5 g untuk 100 stek dan tidak diolesi hormon (B2) kemudian bahan stek ditanam pada pot-ray dan dimasukkan ke dalam sungkup propagasi. Sungkup propagasi kemudian ditutup dan diletakkan di rumah kaca KOFFCO System.
29
Pengamatan histologi akar
Pengamatan histologi akar dilakukan pada akhir pengamatan untuk mengetahui daerah munculnya akar pertama kali. Untuk pengamatan ini dilakukan dengan membuat potongan longitudinal dari mulai pangkal stek. Tahapan kerja pembuatan preparat dengan menggunakan metode parafin (SASS 1951) adalah sebagai berikut:
1. Pematian dan fiksasi.
Pematian dan fikasai dilakukan dengan merendam bahan ke dalam cairan FAA (Formaldehyd-Acetic Acid Alcohol) dengan komposisi 5:5:90 (v/v/v) selama 3-4 hari. Fiksasi bertujuan untuk mengawetkan semua struktur sel sehingga sedapat mungkin berada pada keadaan yang sama dengan keadaan pada waktu masih hidup.
2. Dehidrasi
Dehidrasi dilakukan dengan merendam potongan bahan secara bertahap melalui serangkaian alkohol bertingkat yait 20%, 40%, 60% dan 100% secara rutin minimal 2 x 15 menit. Fungsi dehidrasi adalah untuk menghilangkan air dari jaringan agar dapat dimasuki cairan pelarut parafin (xylol).
3. Preparafinasi
Preparafinasi dilakukan dengan memasukkan potongan bahan ke dalam campuran alkohol 100% dan xylol dengan perbandingan 4:0, 3:1, 2:2, 1:1, 1:3 dan 0:4 (v/v) secara berurutan masing-masing minimal selama 2 x 15 menit. Tahapan ini bertujuan untuk menghilangkan alkohol dari jaringan agar dapat dimasuki larutan parafin.
4. Parafinasi
jaringan dipotong dengan mikrotom tidak akan pecah dan strukturnya dapat dipertahankan.
5. Penanaman dalam balok parafin (Blocking)
Penanaman dilakukan pada kotak dengan cetakan besi dengan cara meletakkan potongan bahan dalam cetakan, setelah sebelumnya parafin murni cair yang dituangkan terlebih dahulu dalam cetakan tersebut. Penanaman dilakukan dengan bantuan pinset sesuai dengan arah yang diinginkan (longitudinal). Setelah parafin mengeras, balok parafin beserta bahan dikeluarkan dari cetakan. Proses tersebut bertujuan menyimpan material ke dalam balok parafin agar memudahkan dalam penyayatan. 6. Penyayatan (Embeding)
Penyayatan dilakukan setelah terlebih dahulu balok parafin dibentuk trapesium dengan tujuan agar pita yang terbentuk lurus dan tidak pecah-pecah. Selanjutnya disayat pada mesin mikrotom putar dengan ketebalan diatur berkisar antara 5µ-20µ.
7. Penempelan sayatan
Sayatan ditempel pada gelas preparat dengan menggunakan zat perekat berupa albumin. Setelah penempelan dilakukan, gelas preparat dipanaskan sebentar dengan oven pada suhu 40-60oC agar sayatan merekat erat
8. Pewarnaan (staining)
Kegiatan pewarnaan berdasarkan pada metode SASS yang terbagi atas beberapa tahapan:
a.Penjernihan tahap I (Dedehidrasi I)
Penjernihan dilakukan dengan memasukkan secara berurutan ke dalam xylol, xylol-alkohol (1:1), alkohol 100%, alkohol 80%, alkohol 60% , alkohol 40% dan alkohol 20%, aquadest masing-masing selama 5 menit. Tujuan penjernihan ini adalah agar menghilangkan parafin dalam jaringan.
b.Pewarnaan.
31
dengan menggunakan pewarna Easin, setelah itu dimasukkan ke dalam aquades selama 5 menit, dilanjutkan dengan metil blue. Pencelupan ke dalam zat warna masing-masing dilakukan minimal selama 30 menit.
c.Penjernihan tahap II (Dedehidrasi II)
Proses ini merupakan kebalikan dari penjernihan tahap I dan bertujuan untuk membuang zat pewarna berlebih yang melekat pada potongan bahan. Selanjutnya sayatan bahan yang diperoleh diolesi dengan etelen, agar coverglass menempel dengan sempurna dan terlindungi.
9. Pemotretan
Pemotretan merupakan proses terakhir yang dilakukan dengan menggunakan photonic microscope dengan perbesaran 20-100 kali sesuai dengan arah yang diinginkan, dengan tujuan mengetahui asal usul primodia akarnya.
Variabel yang diamati
Variabel yang diamati pada pembuatan stek pucuk ini antara lain : 1. Persentase hidup stek (PHS).
Persentase hidup stek dihitung dengan membandingkan jumlah stek yang ditanam dengan jumlah stek yang mampu bertahan hidup sampai akhir pengamatan.
2. Persentase stek berakar (PSB).
Persentase stek berakar dihitung dengan membandingkan jumlah stek yang mampu berakar pada 3 (tiga) perlakuan yang berbeda dengan jumlah stek total yang ditanam.
3. Jumlah akar stek (JAS)
Dihitung Panjang akar dihitung dari pangkal akar sampai dengan ujung titik tumbuh.
4. Panjang akar stek (PAS)
5. Analisis histologi akar
Analisis histologi akar diperoleh melalui hasil pemotretan pada photonic
microscope untuk mengetahui keberadaan primordia akar yang terbentuk
pada stek pucuk pasak bumi. 6. Data penunjang penelitian
Sebagai data penunjang penelitian dilakukan analisis sifat fisik dan kimia media tanam dan kondisi suhu dan kelembaban rumah kaca KOFFCO. Rancangan percobaan dan analisis data
Pada perbanyakan dengan stek pucuk ini rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) Faktorial dengan 2 faktor yaitu media tanam (cocodust: sekam dengan perbandingan 1:0, 1:1 dan 2:1) dan ZPT (Rootone F dan tanpa Rootone F) dengan ulangan 10 tanaman. Adapun model statistik linier dari rancangan percobaan ini dinyatakan dalam persamaan sebagai berikut:
Model umum rancangan faktorial tersebut adalah : Yijk = µ + αi + βj + αβij + εijk
Keterangan:
Yijk = hasil pengamatan terhadap parameter sebagai pengaruh media tanam ke-i, zat pengatur tumbuh ke-j, dan ulangan ke-k; dengan i =1,2,3,4; j = 1,2,3,4; dan k = 1,2,….12.
µ = nilai rata-rata umum
αi = pengaruh media tanam ke-i
βj = pengaruh zat pengatur tumbuh ke-j
αβij = pengaruh interaksi media dasar ke-i dan zat pengatur tumbuh ke-j
εijk = pengaruh galat percobaan pada media ke-i, zat pengatur tumbuh ke-j, dan ulangan ke-k.
HASIL DAN PEMBAHASAN
Percobaan I. Perbanyakan Secara Generatif
Informasi umum mengenai benih pasak bumi (Eurycoma longifolia Jack) Fenologi benih
Pasak bumi merupakan tumbuhan yang berbunga dan berbuah sepanjang tahun. Masa berbunga dan berbuah pasak bumi berbeda untuk daerah Kalimantan dan Sumatera. Untuk pasak bumi asal Sumatera biasanya berbunga dan berbuah terbanyak pada bulan September-Nopember, sedangkan di Kalimantan masa berbunga dan berbuah terbanyak pada bulan Juli-Agustus.
Benih
Pasak bumi memiliki warna kulit buah merah kehitaman saat mulai masak. Buah tersusun atas lapisan luar yang sangat tipis, lapisan tengah dan endocarp yang keras seperti tempurung, tanpa endosperm. Biji berwarna putih dengan 2 keping, dengan plumula kecil (Gambar 11).
Tipe benih pasak bumi adalah rekalsitran, dimana tipe benih ini mudah mengalami penurunan viabilitas. Jumlah biji yang digunakan untuk penelitian ini adalah sebanyak 360 biji dengan diameter antara 0,5-0,7 cm dan berat untuk tiap butir benih berkisar antara 0,29 gram atau 290 gram untuk 1000 butir benih.
Gambar 11 Morfologi benih pasak bumi.
Perkecambahan benih
pasir–kompos (M4) benih mulai berkecambah pada hari ke-18 dan media pasir– tanah perbandingan 1:1 (M2) pada hari ke-20.
Jumlah kecambah kumulatif tertinggi diperoleh pada media M2 yaitu sebanyak 31 buah (34%), diikuti oleh media M1 yaitu sebanyak 20 buah (22%), M3 sebanyak 15 buah (16%) dan M4 sebanyak 13 buah (14%). Grafik kumulatif perkecambahan benih pasak bumi disajikan pada Gambar 12.
Gambar 12 Grafik kumulatif perkecambahan benih pasak bumi
selama 60 hari.
Hari berkecambah tercepat diperoleh pada media pasir murni. Hartmann
et al. (1997) menyatakan pasir merupakan media yang mudah tersedia bersih dan
daya rekatnya rendah, pasir tidak menyimpan kelembaban sehingga membutuhkan frekuensi penyimpanan yang lebih. Penggunaan tunggal tanpa adanya campuran media lain akan membuat pasir bersifat kasar sehingga memberikan hasil yang baik.
Media yang menghasilkan hari berkecambah paling lambat dan jumlah kecambah paling sedikit adalah media kompos, hal ini kemungkinan disebabkan karena media kompos kurang sesuai untuk perkecambahan benih pasak bumi karena terlihat beberapa kecambah mengalami lodoh dan layu.
35
Gambar 13 Tipe kecambah pasak bumi.
Penyapihan bibit dilakukan pada saat berumur 8 minggu. Bibit yang dipilih untuk disapih memiliki tinggi bervariasi antara 8-10 cm dan penampakan fisik yang sehat.
Pengaruh media terhadap pertumbuhan semai pasak bumi
Rekapitulasi sidik ragam terhadap parameter pertumbuhan semai
Pada penelitan ini media yang digunakan adalah campuran arang sekam dan tanah dengan perbandingan 1:1 (M1), arang sekam murni (M2) dan campuran pasir tanah dengan perbandingan 1:1 (M3). Pemilihan media tersebut didasarkan pada pengamatan pertumbuhan semai pada saat perkecambahan.
Tabel 9 menunjukkan bahwa media tidak berpengaruh terhadap pertumbuhan pucuk semai (kecuali jumlah malai daun), namun berpengaruh terhadap jumlah dan panjang akar yang dihasilkan. Media yang menghasilkan variabel pertumbuhan terbaik adalah media arang sekam murni.
Tabel 9 Rekapitulasi sidik ragam pertumbuhan semai pasak bumi selama 20 minggu
Media Parameter
M1 M2 M3
Signifikans i
Tinggi semai 14,3a 13,48a 12,2a tn
Diameter semai 0,42a 0,37a 0,37a tn
Kekokohan 54,33a 59,76a 59,53a tn
Jumlah malai daun 14,7 b 14,2 b 9,9 a * Panjang akar primer 4,78a 9,18b 6,38a ** Panjang akar sekunder 4,9a 5,94a 4,8a tn Jumlah akar primer 1 a 1,8 b 1 a ** Jumlah akar sekunder 24,2 a 65,2 b 24,6 a **
Keterangan : tn: tidak berbeda nyata pada selang kepercayaan 95% dan 99%
*: Angka yang diikuti huruf yang sama pada baris yang sama tidak berbeda nyata pada selang kepercayaan 95%
Pertumbuhan pucuk semai pasak bumi a. Tinggi semai
Gambar 14 menunjukkan tinggi rata-rata terbaik diperoleh pada media campuran arang sekam-tanah (M1) yaitu sebesar 20,76 cm, diikuti oleh media campuran pasir-tanah (M3) sebesar 19,22 cm dan media arang sekam murni (M2) sebesar 18,98 cm.
Gambar 14 Rata-rata tinggi tanaman pasak bumi pada media tumbuh yang berbeda selama 20 minggu.
Laju pertumbuhan tinggi semai terbaik selama 20 minggu diperoleh pada media M1 sebesar 14,3 cm, sedangkan laju pertumbuhan semai terjelek diperoleh pada media M3 yaitu sebesar 12,2 cm. Laju pertumbuhan semai pada ketiga media tersebut disajikan pada Gambar 15.
Gambar 15 Laju pertumbuhan tinggi semai tanaman pasak bumi selama 20 minggu pada tiga media tumbuh.
37
b. Diameter semai
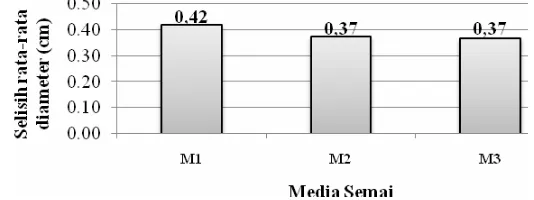
Nilai pertumbuhan diameter merupakan selisih antara pengukuran diameter akhir dengan diameter awal pengamatan. Berdasarkan hasil pengamatan diketahui bahwa rata-rata pertambahan diameter tertinggi diperoleh pada media M1 yaitu sebesar 0,42 cm, sedangkan M2 dan M3 memiliki rata-rata pertambahan diameter yang sama yaitu 0,37 cm (Gambar 16).
Gambar 16 Pertambahan diameter semai pasak bumi selama 20 minggu dalam tiga media tumbuh.
Hasil sidik ragam (Tabel 9) menunjukkan bahwa pertambahan diameter semai pasak bumi tidak dipengaruhi oleh media tumbuh yang digunakan.
c. Kekokohan semai
[image:54.612.176.443.205.305.2]Kekokohan semai merupakan perbandingan antara tinggi terhadap diameter yang diukur pada akhir pengamatan. Berdasarkan hasil pengamatan diketahui bahwa media M2 memiliki nilai kekokohan rata-rata tertinggi yaitu sebesar 59,76 sedangkan media M1 memiliki nilai kekokohan rata-rata terendah yaitu sebesar 54,33 (Gambar 17).
Hasil sidik ragam (Tabel 9) menunjukkan bahwa media semai tidak mempengaruhi kekokohan semai pasak bumi.
d. Jumlah malai daun
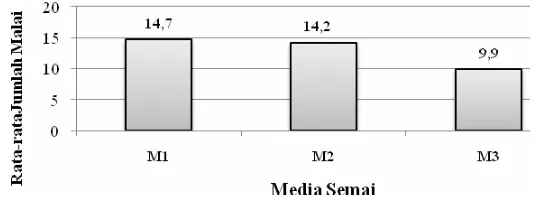
[image:55.612.175.444.243.343.2]Jumlah malai daun merupakan jumlah kumulatif malai daun yang terbentuk sampai akhir pengamatan. Gambar 18 menunjukkan media M1 menghasilkan rata-rata malai daun yang terbanyak yaitu sebesar 14,7 sedangkan media M3 menghasilkan rata-rata jumlah malai daun paling sedikit yaitu 9,9.
Gambar 18 Jumlah malai daun pasak bumi yang terbentuk selama 20 minggu dalam tiga media tumbuh.
Hasil sidik ragam dan uji Duncan (Tabel 8) menunjukkan bahwa media semai berpengaruh terhadap pembentukan malai daun pasak bumi. Semai yang ditanam pada media M3 meghasilkan rata-rata jumlah malai daun yang paling sedikit (9,9) dan berbeda nyata dengan media M2 dan M1.
39
Pertumbuhan akar semai pasak bumi a. Panjang akar
Panjang akar yang diukur adalah akar (primer dan sekunder) pasak bumi terpanjang pada akhir penelitian. Berdasarkan hasil pengamatan diketahui bahwa rata-rata panjang akar primer tertinggi diperoleh pada media M2 yaitu sebesar 9,18 cm, sedangkan rata-rata akar primer terpendek diperoleh pada media M1. Rata-rata akar sekunde