Bunga kenanga (Cananga odorata (Lmk.) Hook.F. & Thoms.) adalah salah satu tanaman tradisional khas Indonesia yang digunakan sebagai bahan kosmetik tradisional. Pada penelitian ini dilakukan isolasi dan identifikasi senyawa aktif pada ekstrak bunga kenanga yang memiliki aktivitas penangkap radikal bebas 2,2-diphenyl-1-picrylhdrazyl (DPPH), UV
protection, dan antibakteri.
Bunga kenanga diekstraksi dengan pelarut etanol 90% v/v kemudian dipekatkan hingga membentuk ekstrak. Kromatografi lapis tipis (KLT) dilakukan pada ekstrak bunga kenanga menggunakan fase gerak optimum kloroform : metanol (95 : 5 v/v) dan fase diam
silika gel 60 F254. Selanjutnya, dilakukan isolasi senyawa aktif yang dipandu dengan uji
aktivitas penangkap radikal DPPH, UV protection dengan metode inhibition of bleaching of
�-carotene, dan antibakteri dengan metode bioautografi kontak. Isolasi senyawa aktif dilakukan dengan kromatografi kolom. Isolat diuji kualitatif aktivitas penangkap radikal bebas DPPH, UV protection dengan metode inhibition of bleaching of �-carotene, dan antibakteri dengan metode disc diffusion. Selanjutnya dilakukan uji identifikasi dengan menggunakan berbagai reagen semprot pada isolat aktif.
Ylang-ylang or Cananga flower (Cananga odorata (Lmk.) Hook.F. & Thoms.) is used to be Indonesia traditional cosmetic ingredients. This research aimed to isolate and identify active compounds in cananga flower extract that has a free radical scavenging activity 2,2-diphenyl-1-picrylhdrazyl (DPPH), UV protection, and antibacterial.
Cananga flowers extracted using ethanol 90% v/v, then evaporated to form the extract. Extracts of cananga flower separated in the thin layer chromatography (TLC) using optimum mobile phase chloroform : methanol (95: 5 v/v) and stationary phase silica gel 60 F254. The isolation of the active compound guided to DPPH radical scavenging activity test,
UV protection with inhibition of bleaching of β-carotene method, and antibacterial with contact bioautografi method. Isolation of active compounds performed by column chromatography. Isolates tested qualitatively using DPPH free radical scavenging activity, UV protection with inhibition of bleaching of β-carotene method, and antibacterial with disc diffusion method. The active isolates was identified using various reagent.
By column chromatography showed 3 isolates. Isolate 1 has DPPH free radical scavenging activity and antibacterial activity. Isolate 2 and isolate 3 have DPPH free radical scavenging activity, UV protection activity, and antibacterial activity. The result showed that isolate 1, isolate 2 and isolate 3 were terpenoid compounds.
ISOLASI DAN IDENTIFIKASI SENYAWA AKTIF PENANGKAP RADIKAL BEBAS DPPH, UV PROTECTION, DAN ANTIBAKTERI
EKSTRAK BUNGA KENANGA (Cananga odorata (Lmk.) Hook.F. & Thoms.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Surya Adhi Nugraha
NIM: 118114003
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
ISOLASI DAN IDENTIFIKASI SENYAWA AKTIF PENANGKAP RADIKAL BEBAS DPPH, UV PROTECTION, DAN ANTIBAKTERI
EKSTRAK BUNGA KENANGA (Cananga odorata (Lmk.) Hook.F. & Thoms.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Surya Adhi Nugraha
NIM: 118114003
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
Persetujuan Pembimbing
ISOLASI DAN IDENTIFIKASI SENYAWA AKTIF PENANGKAP RADIKAL BEBAS DPPH, UV PROTECTION, DAN ANTIBAKTERI
EKSTRAK BUNGA KENANGA (Cananga odorata (Lmk.) Hook.F. & Thoms.)
Skripsi yang diajukan oleh :
Surya Adhi Nugraha
NIM: 118114003
telah disetujui oleh
Pembimbing Utama
iii
iv
HALAMAN PERSEMBAHAN
“ When I was 5 years old, my mother always told me that happiness was the key to life. When I went to school, they asked me what I wanted to be when I
grew up. I wrote down “happy”. They told me I didn’t understand the
assignment, and I told them they didn’t understand life”
John Lennon
Kupersembahkan Skripsi ini untuk:
Tuhan yang selalu mendampingi dan memberi kekuatan
Keluargaku yang selalu memberikan dukungan
v
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Apabila di kemudian hari ditemukan indikasi plagiarisme dalam naskah ini, maka saya bersedia menanggung segala sanksi sesuai peraturan perundang - undangan yang berlaku.
Yogyakarta, 19 Juni 2015
Penulis
vi
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma: Nama : Surya Adhi Nugraha
Nomor Mahasiswa : 118114003
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya berjudul:
ISOLASI DAN IDENTIFIKASI SENYAWA AKTIF PENANGKAP RADIKAL BEBAS DPPH, UV PROTECTION, DAN ANTIBAKTERI EKSTRAK BUNGA KENANGA (CANANGA ODORATA (LMK.) HOOK.F. & THOMS.)
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pengkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama saya tetap mencantumkan nama saya sebagai penulis.
Dengan demikian peryataan ini saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal : 2 Agustus 2015 Yang menyatakan
vii PRAKATA
Puji syukur kepada Tuhan karena atas berkat dan rahmat-Nya penulis dapat menyelesaikan skripsi yang berjudul “Isolasi dan Identifikasi Senyawa Aktif Penangkap Radikal Bebas DPPH, UV Protection, dan Antibakteri Ekstrak Bunga Kenanga (Cananga odorata (Lmk.) Hook.F. & Thoms.)” sebagai salah satu syarat guna memperoleh gelar Sarjana Farnasi Universitas Sanata Dharma Yogyakarta.
Proses penelitian dan penyusunan skripsi ini tidak lepas dari bantuan dan dukungan dari berbagai pihak sehingga skripsi ini dapat terselesaikan dengan baik. Oleh karena itu, pada kesempatan ini penulis ingin menyampaikan ucapan terimakasih yang sebesar-besarnya kepada :
1. Dr.rer.nat. Yosi Bayu Murti, Apt. sebagai Dosen Pembimbing yang telah memberikan bimbingan, arahan serta ilmu dalam penelitian dan penyusunan skripsi ini.
2. Prof. Dr. C.J. Soegihardjo, Apt. sebagai Dosen Penguji atas kritik, saran dan kesediaannya menguji skripsi ini.
3. Damiana Sapta Candrasari, S.Si, M.Sc. sebagai Dosen Penguji atas kritik, saran dan kesediaannya menguji skripsi ini.
viii
5. Segenap dosen dan karyawan Fakultas Farmasi Universitas Sanata Dharma.
6. Agustine Kurniawaty, Setio Agustin, Elyn Prameswari dan Skolastika Feranda Wardani atas kerjasama yang telah kita lewati selama proses penelitian dan penyusunan skripsi.
7. Teman- teman angkatan 2011, atas kerjasama, doa, semangat, kritik dan sarannya.
8. Semua pihak yang telah memberikan bantuan dan dukungan yang tidak dapat disebutkan satu per satu.
Penulis menyadari bahwa dalam penulisan skripsi ini banyak kesalahan dan kekurangan mengingat keterbatasan kemampuan dan pengetahuan penulis. Untuk itu penulis mengharapkan kritik dan saran yang membangun dari berbagai pihak. Akhir kata semoga penelitian dan penyusunan skripsi ini bermanfaat bagi perkembangan ilmu pengetahuan khususnya di bidang Farmasi.
Yogyakarta, Juni 2015
ix DAFTAR ISI
Halaman
HALAMAN JUDUL………i
PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERYATAAN PERSETUJUAN PUBLIKASI KARYA S ... vi
PRAKATA ... vii
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xvii
DAFTAR LAMPIRAN ... xix
INTISARI ... xxi
ABSTRACT ... xxii
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan... 3
2. Keaslian penelitian ... 3
x
B. Tujuan ... 5
1. Tujuan umum ... 5
2. Tujuan khusus ... 5
BAB II PENELAAHAN PUSTAKA... 6
A. Kenanga... 6
1. Klasifikasi tanaman ... 6
1. Deskripsi tanaman kenanga... 7
2. Kandungan kimia kenanga ... 7
B. Ekstraksi ... 8
C. Antioksidan ... 8
1. Definisi antioksidan ... 8
2. Metode penangkapan radikal DPPH ... 9
D. UV Protection ... 10
1. Definisi UV protection ... 10
2. Metode inhibition of bleaching of �-carotene ... 11
E. Antibakteri... 12
1. Definisi antibakteri ... 12
2. Metode bioautografi ... 12
3. Metode difusi ... 13
xi
1. Kromatografi lapis tipis (KLT) ... 13
2. Kromatografi kolom ... 15
G. Keterangan Empiris ... 15
BAB III METODE PENELITIAN... 16
A. Jenis dan Rancangan Penelitian ... 16
B. Bahan dan Materi Penelitian ... 16
1. Bahan penelitian ... 16
2. Alat penelitian ... 17
C. Tata Cara Penelitian ... 17
1. Determinasi sampel ... 17
2. Pengumpulan dan penyiapan bahan ... 17
3. Ekstraksi ... 19
4. Kromatografi lapis tipis ekstrak ... 20
5. Uji kualitatif aktivitas penangkapan radikal bebas DPPH ... 21
6. Uji kualitatif aktivitas UV protection ... 21
7. Uji kualitatif aktivitas antibakteri... 22
8. Identifikasi golongan senyawa ekstrak ... 25
9. Pembersihan klorofil dengan karbon aktif ... 25
10. Kromatografi kolom ... 25
xii
12. Uji kualitatif aktivitas UV protection isolat ... 28
13. Uji kualitatif aktivitas antibakteri isolat ... 28
14. Identifikasi golongan senyawa isolat ... 30
15. Bagan alur penelitian... 31
BAB IV HASIL DAN PEMBAHASAN ... 32
A. Determinasi Sampel ... 32
B. Pengumpulan dan Penyiapan Bahan ... 32
C. Ekstraksi ... 34
1. Ekstraksi bunga kenanga ... 34
2. Susut pengeringan simplisia dan ekstrak bunga kenanga (C. odorata) . 35 3. Pemerian ekstrak bunga kenanga ... 37
D. Kromatografi Lapis Tipis Ekstrak ... 37
E. Uji Kualitatif Aktivitas Penangkapan Radikal Bebas DPPH ... 40
F. Uji Kualitatif Aktivitas UV Protection ... 43
G. Uji Kualitatif Aktivitas Antibakteri Metode Bioautografi ... 47
H. Identifikasi Golongan Senyawa Ekstrak ... 49
I. Penghilangan Klorofil Ekstrak Bunga Kenanga dengan Karbon Aktif . 51 J. Kromatografi Kolom ... 54
xiii
L. Hasil Uji Kualitatif Penangkapan Radikal Bebas DPPH Isolat 1, Isolat 2,
dan Isolat 3 ... 62
M. Uji Kualitatif UV Protection Isolat 1, Isolat 2, dan Isolat 3 ... 64
N. Uji Kualitatif Antibakteri Isolat 1, Isolat 2, dan Isolat 3 ... 65
O. Hasil Identifikasi Golongan Senyawa Isolat 1, Isolat 2, dan Isolat 3 .... 66
BAB V KESIMPULAN DAN SARAN ... 71
A. Kesimpulan ... 71
B. Saran ... 71
DAFTAR PUSTAKA ... 72
LAMPIRAN ... 76
xiv
DAFTAR TABEL
Halaman
Tabel I. Hasil faktor retardasi (Rf) kromatografi lapis tipis (KLT) ekstrak bunga kenanga dengan fase gerak n-heksana : etil asetat (2 : 3 v/v) ... 38
Tabel II. Hasil faktor retardasi (Rf) kromatografi lapis tipis (KLT) ekstrak bunga kenanga dengan fase gerak etil asetat:asam formiat: asam asetat glasial : air (100:11:11:20 v/v) ... 38
Tabel III. Hasil faktor retardasi (Rf) kromatografi lapis tipis (KLT) ekstrak bunga kenanga dengan fase gerak kloroform : metanol (7 : 3 v/v) 38
Tabel IV. Hasil faktor retardasi (Rf) kromatografi lapis tipis (KLT) ekstrak bunga kenanga dengan fase gerak kloroform : metanol (95 : 5 v/v) ... 40
Tabel V. Hasil uji kualitatif aktivitas penangkapan radikal DPPH fase gerak kloroform:metanol (95 : 5 v/v) ... 42
Tabel VI. Hasil uji kualitatif aktivitas penangkapan radikal DPPH fase gerak etil asetat: asam formiat: asam asetat glasial : air (100:11:11:20 v/v) ... 42
Tabel VII. Hasil uji kualitatif aktivitas penangkapan radikal DPPH fase gerak n-heksana: etil asetat (2:3 v/v) ... 42
xv
Tabel IX. Hasil uji kualitatif aktivitas antibakteri dengan bakteri S. aureus .. 47
Tabel X. Hasil uji kualitatif aktivitas antibakteri dengan bakteri E. coli ... 48
Tabel XI. Hasil identifikasi golongan senyawa hasil pemisahan ekstrak pada berbagai reagen ... 50
Tabel XII. Optimasi fase gerak kromatografi kolom ... 56
Tabel XIII. Pengecekan hasil kromatografi kolom proses 1 dengan fase gerak n-heksana : kloroform (50 : 50 v/v) ... 58
Tabel XIV. Pengecekan hasil kromatografi kolom proses 2 dengan fase gerak n-heksana : kloroform (50 : 50 v/v) ... 59
Tabel XV. Pengecekan hasil kromatografi kolom proses 3 dengan fase gerak n-heksana : kloroform (50 : 50 v/v) ... 59
Tabel XVI. Penggabungan isolat hasil kromatografi kolom ... 60
Tabel XVII. Hasil deteksi isolat 1, isolat 2, dan isolat 3 pada UV 254 nm dan UV 366 nm pada sistem fase gerak kloroform : metanol (95 : 5 v/v) ... ... 61
Tabel XVIII. Hasil uji kualitatif penangkapan radikal bebas DPPH ekstrak, isolat 1, isolat 2, dan isolat 3 ... 63
Tabel XIX. Hasil uji kualitatif UV protection ekstrak, isolat 1, isolat 2, dan isolat 3 pada menit ke 15 ... 64
xvi
Tabel XXI. Hasil identifikasi golongan senyawa isolat 1, isolat 2, dan isolat 3 pada berbagai reagen ... 68
Tabel XXII. Rangkuman hasil uji kualitatif isolat 1, isolat 2, dan isolat 3 ... 69
xvii
DAFTAR GAMBAR
Halaman
Gambar 1. Reaksi DPPH dengan radical scavengers ... 10
Gambar 2. Struktur senyawa β-karoten ... 12
Gambar 3. Hasil optimasi fase gerak kromatografi lapis tipis ekstrak kenanga . ... 38
Gambar 4. Hasil optimasi fase gerak kloroform : metanol (95 : 5 v/v)... 39
Gambar 5. Hasil uji kualitatif aktivitas penangkapan radikal DPPH ... 41
Gambar 6. Hasil uji kualitatif aktivitas penangkapan radikal DPPH pada fase gerak kloroform : metanol (95 : 5 v/v) ... 41
Gambar 7. Optimasi intensitas sinar UV ... 44
Gambar 8. Hasil uji kualitatif aktivitas UV protection ekstrak pada menit ke 15 ... 45
Gambar 9. Hasil uji bioautografi ... 47
Gambar 10. Hasil identifikasi golongan senyawa hasil pemisahan ekstrak pada berbagai reagen semprot ... 49
Gambar 11. Reaksi antara alumunium chloride dengan senyawa flavonoid membentuk kompleks senyawa yang berfluoresensi lebih terang. . 51
Gambar 12. Hasil penghilangan klorofil dengan karbon aktif ... 52
xviii
Gambar 14. Pengecekan hasil kromatografi kolom proses 1 menggunakan fase gerak kloroform : metanol (95 : 5 v/v) ... 57
Gambar 15. Deteksi isolat 1, isolat 2, dan isolat 3 pada UV 254 nm dan UV 366 nm ... 61
Gambar 16. Hasil uji kualitatif penangkapan radikal DPPH isolat 1, isolat 2, dan isolat 3... 62
Gambar 17. Hasil uji kualitatif UV protection isolat1, isolat 2, dan isolat 3 ... 65
Gambar 18. Hasil identifikasi isolat 1 pada berbagai reagen ... 67
Gambar 19. Hasil identifikasi isolat 2 pada berbagai reagen ... 67
xix
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat pengesahan determinasi bunga kenanga (C. odorata) ... 76
Lampiran 2. Gambar sampel penelitian yang digunakan ... 77
Lampiran 3. Perhitungan rendemen ekstraksi ... 78
Lampiran 4. Perhitungan susut pengeringan simplisia bunga kenanga ... 79
Lampiran 5. Perhitungan susut pengeringan ekstrak bunga kenanga ... 81
Lampiran 6. Penguapan air pada ekstrak bunga kenanga dengan perlakuan 1 kilogram batu gamping ... 84
Lampiran 7. Penimbangan ekstrak bunga kenanga untuk kromatografi lapis tipis (KLT) ... 85
Lampiran 8. Gambar parameter warna yang digunakan dalam uji kualitatif UV
protection ... 86
Lampiran 9. Optimasi intensitas Sinar UV ... 87
Lampiran 10. Sertifikat hasil uji bakteri ... 88
Lampiran 11. Gambar kontrol uji kualitatif antibakteri pada metode bioautografi ... 90
Lampiran 12. Data penimbangan pada tahap penghilangan klorofil ... 91
xx
Lampiran 14. Data penimbangan pada tahap kromatografi kolom gradien ... 93
Lampiran 15. Hasil Uji Kualitatif UV protection isolat 1, isolat 2, isolat 3 pada menit ke 15 ... 94
Lampiran 16. Kontrol kontaminasi media dan kontrol pertumbuhan bakteri S. aureus pada metode disk diffusion ... 96
xxi INTISARI
Bunga kenanga (Cananga odorata (Lmk.) Hook.F. & Thoms.) adalah salah satu tanaman tradisional khas Indonesia yang digunakan sebagai bahan kosmetik tradisional. Pada penelitian ini dilakukan isolasi dan identifikasi senyawa aktif pada ekstrak bunga kenanga yang memiliki aktivitas penangkap radikal bebas 2,2-diphenyl-1-picrylhdrazyl (DPPH), UV protection, dan antibakteri.
Bunga kenanga diekstraksi dengan pelarut etanol 90% v/v kemudian dipekatkan hingga membentuk ekstrak. Kromatografi lapis tipis (KLT) dilakukan pada ekstrak bunga kenanga menggunakan fase gerak optimum kloroform : metanol (95 : 5 v/v) dan fase diam silika gel 60 F254. Selanjutnya, dilakukan
isolasi senyawa aktif yang dipandu dengan uji aktivitas penangkap radikal DPPH, UV protection dengan metode inhibition of bleaching of �-carotene, dan antibakteri dengan metode bioautografi kontak. Isolasi senyawa aktif dilakukan dengan kromatografi kolom. Isolat diuji kualitatif aktivitas penangkap radikal bebas DPPH, UV protection dengan metode inhibition of bleaching of � -carotene, dan antibakteri dengan metode disc diffusion. Selanjutnya dilakukan uji identifikasi dengan menggunakan berbagai reagen semprot pada isolat aktif.
Dengan kromatografi kolom, didapatkan hasil 3 isolat. Isolat 1 memiliki aktivitas penangkap radikal bebas DPPH dan antibakteri. Isolat 2 dan isolat 3 memiliki aktivitas penangkap radikal bebas DPPH, UV protection, dan antibakteri. Hasil identifikasi menunjukkan bahwa isolat 1, isolat 2, dan isolat 3 merupakan senyawa golongan terpenoid.
Kata kunci: Bunga kenanga (Cananga odorata), penangkap radikal bebas, UV
xxii ABSTRACT
Ylang-ylang or Cananga flower (Cananga odorata (Lmk.) Hook.F. & Thoms.) is used to be Indonesia traditional cosmetic ingredients. This research aimed to isolate and identify active compounds in cananga flower extract that has a free radical scavenging activity 2,2-diphenyl-1-picrylhdrazyl (DPPH), UV protection, and antibacterial.
Cananga flowers extracted using ethanol 90% v/v, then evaporated to form the extract. Extracts of cananga flower separated in the thin layer chromatography (TLC) using optimum mobile phase chloroform : methanol (95: 5 v/v) and stationary phase silica gel 60 F254. The isolation of the active compound guided to
DPPH radical scavenging activity test, UV protection with inhibition of bleaching of β-carotene method, and antibacterial with contact bioautografi method. Isolation of active compounds performed by column chromatography. Isolates tested qualitatively using DPPH free radical scavenging activity, UV protection with inhibition of bleaching of β-carotene method, and antibacterial with disc diffusion method. The active isolates was identified using various reagent.
By column chromatography showed 3 isolates. Isolate 1 has DPPH free radical scavenging activity and antibacterial activity. Isolate 2 and isolate 3 have DPPH free radical scavenging activity, UV protection activity, and antibacterial activity. The result showed that isolate 1, isolate 2 and isolate 3 were terpenoid compounds.
1 BAB I
PENGANTAR
A. Latar Belakang
Indonesia merupakan negara yang memiliki kekayaan hutan tropis terbesar kedua di dunia setelah Brazil. Indonesia memiliki lebih dari 30.000 spesies tumbuhan tingkat tinggi dari 250.000 spesies yang ada di muka bumi ini. Kekayaan alam Indonesia ini bisa dieksplorasi lebih lanjut karena setiap tumbuhan merupakan sumber bahan kimia hayati (chemical resources) yang dapat diolah menghasilkan bahan kimia berguna (chemical prospective) melalui serangkaian proses lebih lanjut (Ersam, 2004). Metabolit sekunder yang terkandung pada tumbuhan bersifat spesifik yang artinya tiap tumbuhan memiliki kekhasan tersendiri. Selain itu metabolit sekunder yang terdapat pada tumbuhan memiliki sifat bioaktif sehingga tidak akan pernah habis dan sangat menarik untuk dieksplorasi. Metabolit sekunder dapat digunakan sebagai lead compounds dalam usaha penemuan dan pengembangan obat baru (Atun, 2010).
ini menjadikan bukti bahwa nenek moyang kita sedari dulu telah mengolah bahan alam tradisional untuk perawatan kecantikan (Tilaar, 1999). Sediaan kosmetik diformulasikan untuk mengatasi penuaan dini pada kulit dan kelainan kulit, seperti munculnya jerawat dan munculnya noda hitam (Tranggono, 2007). Oleh karena itu, efektivitas kosmetik dapat dilihat dari kemampuannya terhadap beberapa aspek, yaitu antioksidan, UV protection, dan antibakteri.
Antioksidan merupakan senyawa yang mampu menghambat aktivitas dari radikal bebas. Antioksidan bekerja dengan cara menghambat reaksi oksidasi. Apabila reaksi oksidasi ini tidak dihentikan maka akan mengakibatkan kerusakan sel sehingga sel akan menjadi abnormal (Kim, Lee, Lee, dan Lee, 2002).
Indonesia merupakan negara yang memiliki iklim tropis sehingga mendapatkan paparan sinar matahari yang tinggi sepanjang tahun. Spektrum sinar matahari memancarkan energi pada rentang panjang gelombang tertentu. Spektrum sinar matahari ini disebut gelombang ultraviolet (UV) yang dapat berdampak buruk bagi kulit dan menjadi salah satu penyebab utama terjadinya eritema dan pigmentasi pada kulit manusia (Lim dan Draelos, 2009). Paparan jangka panjang dari radiasi sinar UV akan menyebabkan timbulnya efek penuaan dini pada kulit dan kanker kulit. Salah satu cara untuk mengurangi paparan radiasi sinar UV adalah dengan penggunaan tabir surya yang bersifat sebagai UV
protector (Gadri, Darijono, Mauludin, dan Iwo, 2012).
pemicu untuk terus melakukan kegiatan eksplorasi untuk menemukan obat-obatan yang memiliki aktivitas antibakteri (Fitriyah, Jose, dan Saryono, 2013). Di bidang perawatan kecantikan, senyawa yang memiliki kemampuan antibakteri sangat menarik untuk dieksplorasi. Hal ini disebabkan karena bakteri merupakan salah satu faktor yang dapat menyebabkan gangguan pada kulit, misalnya infeksi kulit dan jerawat.
Berdasarkan uraian tersebut, penulis mempertimbangkan bahwa perlunya dilakukan pembuktian ilmiah efektivitas penggunaan suatu bahan alam sebagai salah satu bahan kosmetik tradisional. Penulis memilih bunga kenanga yang digunakan sebagai salah satu bahan dalam kosmetik tradisional dengan bentuk sediaan lulur. Penelitian terhadap bunga kenanga yang belum banyak dilakukan menjadi pemicu tersendiri untuk terus melakukan eksplorasi.
1. Permasalahan
Berdasarkan latar belakang di atas, dapat dirumuskan permasalahan sebagai berikut:
a. Apakah ekstrak bunga kenanga (C. odorata) mengandung senyawa yang memiliki aktivitas penangkapan radikal bebas DPPH, UV protection dan antibakteri?
b. Golongan senyawa apakah yang bertanggung jawab terhadap aktivitas penangkapan radikal bebas DPPH, UV protection dan antibakteri ?
2. Keaslian penelitian
untuk mengevaluasi kemampuan antibakteri ekstrak daun C. odorata secara in vitro. Beberapa kultur bakteri disiapkan untuk dilakukan pengujian dengan ekstrak daun dengan beberapa variasi pelarut, yaitu metanol, kloroform, dan petroleum eter. Metode yang digunakan adalah well diffusion. Pengujian yang dilakukan mendapatkan kesimpulan bahwa ekstrak yang paling efektif adalah ekstrak dengan pelarut metanol (Indrakumar dkk., 2012).
Penelitian lain tentang C. odorata pernah dilakukan oleh Brokl, Fauconnier, Benini, Lognay, Jardin, dan Focant (2013). Penelitian ini bertujuan untuk melakukan karakterisasi kandungan kimia yang terdapat dalam minyak atsiri C. odorata. Karakterisasi dilakukan dengan instrumentasi GCxGC-TOFMS dan menghasilkan kesimpulan bahwa terdapat 161 senyawa kimia termasuk 75 senyawa baru yang terdiri dari terpen, terpenoid ester, dan alkohol.
3. Manfaat
a. Manfaat teoritis : penelitian ini diharapkan dapat memberikan informasi apakah bunga C. odorata memiliki aktivitas penangkapan radikal bebas DPPH, UV protection, dan antibakteri serta mengetahui golongan senyawa yang bertanggung jawab terhadap aktivitasnya.
b. Manfaat praktis : penelitian ini diharapkan dapat memberikan informasi apakah penggunaan bunga C. odorata sebagai bahan baku kosmetik tradisional sudah efektif.
B. Tujuan
1. Tujuan umum
Membuktikan kebenaran ilmiah penggunaan bunga kenanga sebagai bahan baku kosmetik dilihat dari parameter aktivitas penangkapan radikal bebas DPPH, UV protection, dan antibakteri.
2. Tujuan khusus
a. Mengetahui apakah ada komponen senyawa dalam ekstrak C. odorata
yang memiliki aktivitas penangkapan radikal bebas, UV protection, dan antibakteri.
b. Melakukan isolasi dan identifikasi golongan senyawa yang bertanggung jawab terhadap aktivitas penangkapan radikal bebas DPPH, UV protection,
6 BAB II
PENELAAHAN PUSTAKA
A. Kenanga
1. Klasifikasi tanaman
Menurut United States Department of Agriculture (2014) klasifikasi tanaman kenanga adalah sebagai berikut.
Kingdom : Plantae
Subkingdom : Tracheobionta
Superdivisi : Spermatophyta
Divisi : Magnoliophyta
Kelas : Magnoliopsida
Sub Kelas : Magnoliidae
Ordo : Magnoliales
Famili : Annonaceae
Genus : Cananga
Sinonim : menurut Plant Resources of South-East Asia (2015) sinonim dari
C. odorata yaitu Uvaria odorata Lamk (1785), Canangium odoratum (Lamk) Baillon (1868), Cananga scortechinii King (1922).
1. Deskripsi tanaman kenanga
Ciri-ciri tanaman kenanga adalah habitus pohon tahunan, batangnya besar dengan diameter 0,1-0,7 m. Tinggi dapat mencapai 5-20 m. Daun bertangkai, berbentuk bulat telur memanjang dengan ujung dan pangkal runcing, pangkal membulat atau bentuk jantung, panjangnya 10-23 cm dan lebarnya 4,5-14 cm. Ciri-ciri bunga kenanga adalah bunga majemuk dalam karangan bunga yang berbentuk payung, pendek, menggantung, duduk di ketiak. Bunga mempunyai enam lembar daun mahkota yang berbentuk lanset, pada waktu masih muda berwarna hijau dan ketika sudah tua berubah menjadi warna kuning. Bunga kenanga mempunyai bau harum dan khas, buah 7-15, perkembangannya tidak sama, bulat telur terbalik dan berwarna hijau (Hembing, 2000).
2. Kandungan kimia kenanga
Zat kimia yang terkandung pada bunga kenanga adalah minyak atsiri (Hariana, 2008). Kandungan kimia utama minyak atsiri yang terdapat pada bunga kenanga antara lain: geraniol, kresol, linalool, benzil alkohol, eugenol, iso-eugenol, dan metil eugenol (Chooi, 2004). Sebagian besar monoterpen dan seskuiterpen dalam minyak atsiri cukup aman, namun dapat menyebabkan iritasi dan reaksi alergi pada beberapa orang yang sensitif. Lakton seskuiterpen merupakan senyawa yang dapat menyebabkan reaksi alergi dan sitotoksik (Heinrich, Barnes, Gibbons, dan Williamson, 2010).
B. Ekstraksi
Ekstraksi atau penyarian merupakan proses perpindahan massa atau zat aktif yang berada di dalam sel kemudian ditarik masuk ke dalam larutan penyari. Proses ekstraksi akan bertambah baik bila permukaan simplisia yang bersentuhan dengan pelarut semakin besar (Harborne, 1987).
Syarat cairan penyari yang baik menurut Depkes RI (1986) adalah murah, mudah diperoleh, stabil secara fisika dan kimia, tidak mudah menguap dan tidak mudah terbakar, selektif, tidak berpengaruh terhadap zat berkhasiat, serta diperbolehkan oleh peraturan yang berlaku. Metode penyarian dibedakan menjadi: infundasi, maserasi, perkolasi, dan penyarian berkesinambungan.
C. Antioksidan
1. Definisi antioksidan
bekerja dengan cara mendonorkan satu elektronnya kepada senyawa yang bersifat oksidan sehingga aktivitas senyawa oksidan tersebut bisa dihambat (Winarsi, 2007). Secara umum, antioksidan dikelompokkan menjadi antioksidan enzimatis dan non enzimatis. Antioksidan enzimatis contohnya superoksida dismutase, katalase, dan glutation peroksidase. Antioksidan non enzimatis dibagi menjadi 2, yaitu antioksidan larut lemak, dan antioksidan larut air. Antioksidan larut lemak contohnya tokoferol, karotenoid, flavonoid, quinon, dan bilirubin. Antioksidan larut air contohnya asam askorbat, asam urat, protein pengikat logam, dan protein pengikat heme (Winarsi, 2007).
Radikal bebas diproduksi di dalam sel-sel tubuh dengan berbagai cara. Adanya radiasi sinar ultraviolet, sinar X, sinar gamma radioaktif adalah sumber-sumber yang mempengaruhi. Radiasi ini akan memecah ikatan di antara atom sehingga terjadi berbagai radikal dengan elektron tunggal yang dapat menimbulkan reaksi berantai yang menimbulkan kerusakan sel (Youngson, 1998).
2. Metode penangkapan radikal DPPH
Parameter aktivitas antioksidan dilihat dari nilai IC. IC50 merupakan
[image:36.595.99.504.192.602.2]konsentrasi yang menyebabkan penurunan 50% dari konsentrasi DPPH awal (Sunarni, 2005).
Gambar 1. Reaksi DPPH dengan radical scavengers (Marston, 2011)
Senyawa yang beraksi sebagai penangkal radikal bebas akan mereduksi DPPH dan mampu diamati dengan adanya perubahan warna DPPH dari ungu menjadi kuning. Perubahan warna terjadi ketika elektron ganjil dari radikal DPPH sudah berpasangan dengan hidrogen dari senyawa penangkal radikal bebas yang akan membentuk DPPH-H tereduksi (Molyneux, 2004).
D. UV Protection
1. Definisi UV protection
2. Metode inhibition of bleaching of �-carotene
Metode β-karoten adalah metode yang digunakan untuk memperkirakan kemampuan relatif dari ekstrak terhadap oksidasi dari asam linoleat yang akan mengoksidasi β-karoten dalam emulsi. Akibat dari adanya oksidasi oleh asam linoleat ini maka β-karoten akan kehilangan warna karena putusnya ikatan rangkap sehingga terjadi perubahan warna (Miguel, 2010).
Gambar 2. Struktur senyawa β-karoten
E. Antibakteri
1. Definisi antibakteri
Konsentrasi Hambat Minimum (KHM) adalah suatu konsentrasi paling rendah suatu zat yang mampu menghambat pertumbuhan mikroorganisme (Sacher, 2004). Kadar bunuh minimum (KBM) adalah kadar paling rendah suatu zat yang diperlukan untuk membunuh mikroba (Nugroho, 2012).
2. Metode bioautografi
Metode bioautografi dapat digunakan untuk pengujian aktivitas antibakteri dan antikapang sekaligus mendeteksi golongan senyawa. Bioautografi dibedakan menjadi bioautografi kontak, bioautografi agar overlay, dan bioautografi langsung. Bioautografi kontak dilakukan dengan menempelkan kromatogram pada media padat berisi bakteri uji. Senyawa dengan aktivitas antibakteri ditunjukkan dengan daerah jernih. Bioautografi agar overlay dilakukan dengan cara melapisi kromatogram dengan agar cair yang berisi bakteri uji dan setelah mengeras diberi pewarnaan. Adanya senyawa antibakteri ditunjukkan dengan adanya pita-pita yang terbentuk. Bioautografi langsung dilakukan dengan cara menyemprot kromatogram dengan bakteri uji dan dilakukan inkubasi. Adanya senyawa antibakteri ditunjukkan dengan bantuan pewarnaan menggunakan
Keuntungan metode bioautografi dibandingkan metode yang lain adalah dapat digunakan untuk mengetahui secara langsung aktivitas biologi dari hasil pemisahan senyawa yang kompleks, cepat, mudah, dan murah untuk dilakukan. Selain itu interpretasi hasilnya juga mudah dan akurat (Kusumaningtyas, 2008).
3. Metode difusi
Salah satu metode difusi yang biasa dilakukan untuk menentukan aktivitas antimikroba adalah dengan menggunakan cakram (disc). Zat yang akan diuji ditampung dalam cakram kertas yang ditempelkan pada media agar yang telah diinokulasikan bakteri uji. Selanjutnya dilakukan inkubasi pada waktu dan suhu tertentu sesuai persyaratan dan kondisi optimum mikroba uji. Hasil positif ditandai dengan adanya zona penghambatan berupa daerah bening di sekitar cakram kertas (Pelczar dan Chan, 1988).
Prinsip penentuan aktivitas antimikroba dengan metode difusi adalah kemampuan difusi dari zat uji pada media agar yang telah diinokulasikan bakteri tertentu. Hasil positif ditandai dengan adanya zona hambatan di sekeliling zat yang diuji setelah dilakukan inkubasi selama waktu tertentu (Brooks, Butel, Carrol, dan Morse, 2007).
F. Kromatografi
1. Kromatografi lapis tipis (KLT)
plastik. Fase gerak akan bergerak sepanjang fase diam diam karena pengaruh kapiler pada pengembangan secara menaik (ascending), atau karena pengaruh gravitasi pada pengembangan secara menurun (descending) (Gandjar dan Rohman, 2007).
Pemisahan pada KLT akan optimal apabila penotolan sampel dilakukan dengan ukuran bercak sekecil dan sesempit mungkin sehingga menghasilkan resolusi yang baik. Hasil penelitian menunjukkan bahwa penotolan secara otomatis lebih dipilih daripada penotolan manual bila jumlah sampel lebih dari 15 μl. Penotolan sampel yang tidak tepat akan menyebabkan bercak menyebar dan
puncak ganda (Gandjar dan Rohman, 2007).
Bercak hasil pemisahan pada KLT umumnya merupakan bercak yang tidak berwarna. Oleh karena itu, beberapa cara yang dapat dilakukan untuk mendeteksi bercak antara lain:
1. Menyemprot lempeng KLT dengan reagen kromogenik yang akan bereaksi secara kimia dengan solut yang mempunyai gugus fungsi tertentu sehingga bercak menjadi berwarna khas.
2. Mengamati lempeng di bawah sinar ultraviolet pada panjang gelombang 254 atau 366 untuk menampakkan solut sebagai bercak yang gelap atau bercak yang berfluorosensi terang pada dasar yang berfluoresensi seragam.
4. Melakukan scanning lempeng hasil pemisahan menggunakan instrumen densitometer. Solut yang mampu menyerap sinar akan dicatat sebagai peak oleh
recorder (Gandjar dan Rohman, 2007).
2. Kromatografi kolom
Kromatografi kolom merupakan metode pemisahan dengan menggunakan kolom gelas diisi dengan adsorbent yang dilewatkan oleh desorbent berupa larutan campuran. Masing-masing komponen akan dipisahkan dalam kolom yang diatur dengan afinitas adsorpsi setiap komponen (Lazo, 1999).
Solven murni dapat digunakan untuk mengelusi semua komponen. Selain itu, sistem gradien pelarut juga digunakan. Pada elusi gradien, polaritas sistem solven ditingkatkan secara perlahan dengan meningkatkan konsentrasi solven ke tingkat yang lebih polar. Pemilihan eluen tergantung pada jenis adsorben yang digunakan dan kemurnian senyawa yang dipisahkan. Pelarut harus mempunyai kemurnian yang tinggi. Keberadaan pengganggu seperti air, alkohol, atau asam pada solven yang kurang polar mampu mengganggu aktivitas adsorben (Braithwaite dan Smith, 1995).
G. Keterangan Empiris
16 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian Penelitian ini termasuk jenis penelitian eksploratif.
B. Bahan dan Materi Penelitian
1. Bahan penelitian
a. Bahan utama berupa bunga kenanga yang berasal dari Boyolali, Jawa Tengah.
b. Bahan kimia yang digunakan meliputi DPPH pro analitik dan �-karoten pro analitik yang berasal dari Sigma Chem. Co., USA. n-heksana, etanol, metanol, kloroform, NaCl, barium klorida, dan asam sulfat pro analitik yang berasal dari Merck, Jerman. Akuades berasal dari Brataco Chemica. Reagen Dragendorff, alumunium chloride, ferric chloride, sitroborat, iod, vanilin sulfat berasal dari Laboratorium Farmakognosi-Fitokimia Universitas Sanata Dharma. Silika gel 60 F254 for thin layer chromatography dan silika gel 60
(0,040-0,063 mm) for column chromatography dari Merck, Jerman. Bakteri
Staphylococcus aureus ATCC 25923dan Escherichia coli ATCC 25922 yang berasal dari Laboratorium Balai Kesehatan Yogyakarta. Amoksisilin berasal dari PT. Indofarma. Trypticasein soy broth (TSB) berasal dari Agarindo
2. Alat penelitian
Alat-alat yang digunakan dalam penelitian ini berupa micro haematocrit tubes, light meter (Lutron) LX-1118 Digital Instruments, lampu UV 254 nm, lampu UV 366 nm,vortex (Buchi), mikropipet 1-10 mL (Acura Socorex), mikropipet 10-1000 μL (Acura Socorex), timbangan analitik (Scaltec SBC 22 dan BP 160P), vacuum rotary evaporator (Buchi), blender, kertas saring, tabung reaksi bertutup dan alat-alat gelas yang biasa digunakan di laboratorium analisis (Pyrex-Germany dan Iwaki), autoclave (YX-400Z), freezer, dan oven (WTB binder).
C. Tata Cara Penelitian
1. Determinasi sampel
Determinasi bunga kenanga dilakukan di Bagian Biologi Farmasi, Fakultas Farmasi Universitas Gadjah Mada Yogyakarta. Determinasi tersebut memastikan bahwa sampel yang digunakan untuk penelitian benar-benar bunga kenanga (Cananga odorata (Lmk.) Hook. F. & Thoms.).
2. Pengumpulan dan penyiapan bahan a. Pengumpulan bahan
b. Sortasi basah
Bahan baku dipisahkan dari bahan-bahan pengotor yang mungkin terdapat pada simplisia seperti kerikil, tanah, rumput, serta bagian tanaman yang tidak dibutuhkan (batang dan daun), bagian tanaman lain, bahan yang rusak dan lain-lain.
c. Pencucian
Bunga kenanga dicuci menggunakan air mengalir lalu dibersihkan kotoran-kotoran yang melekat. Tahap pencucian ini dilakukan sebanyak tiga kali untuk menjamin kebersihan bahan.
d. Pengeringan
Bunga kenanga yang masih basah diletakkan pada tampah bambu dengan ketebalan seminimal mungkin. Tampah bambu ditutup dengan kain hitam yang diberi sedikit sirkulasi udara lalu dijemur dibawah sinar matahari. Akhir pengeringan ditandai dengan warna bahan menjadi lebih gelap dan mudah dipatahkan.
e. Sortasi kering
Bunga kenanga yang sudah kering dipisahkan dari bahan-bahan lain seperti tanah, kerikil, ranting, daun, bahan yang rusak dan lain-lain.
f. Pengepakan dan penyimpanan
g. Susut pengeringan simplisia bunga kenanga
Bobot tetap dilakukan terhadap cawan petri yang akan digunakan selama 60 menit menggunakan oven pada suhu 105°C. Setelah didapatkan bobot tetap petri, serbuk simplisia bunga kenanga ditimbang 1 g dan dilakukan replikasi 3 kali. Cawan berisi serbuk simplisia dipanaskan dalam oven bersuhu 105°C hingga bobot tetap.
3. Ekstraksi
a. Ekstraksi bunga kenanga
Simplisia bunga kenanga ditimbang sebanyak 1,0 kg dan diblender dengan etanol 90% sampai seluruh bahan tercampur homogen. Campuran dimaserasi pada suhu ruangan selama satu hari. Dilakukan remaserasi dengan cara yang sama dengan tahap maserasi. Filtrat diperoleh melalui penyaringan dan penguapan pelarut dengan vacuum rotary evaporator sehingga dihasilkan ekstrak.
b. Susut pengeringan ekstrak bunga kenanga
Saat kadar air ekstrak yang diuji lebih dari 10%, maka pada ekstrak perlu dilakukan penguapan air dengan cara dimasukkan dalam desikator berisi batu gamping.
c. Pemerian ekstrak bunga kenanga
Ekstrak bunga kenanga diamati warna, bau, bentuk dan rasa.
4. Kromatografi lapis tipis ekstrak a. Preparasi sampel
Sebanyak 5 mg ekstrak bunga kenanga ditimbang lalu dilarutkan dalam etanol p.a 1 mL.
b. Optimasi fase gerak
Sampel ekstrak bunga kenanga ditotolkan sebanyak 3 spot pada pelat KLT dengan jarak elusi 5 cm (Wolf, 2012). Sampel ditotolkan menggunakan pipa kapiler. Pelat KLT kemudian dielusi dengan 3 jenis fase gerak berikut :
1) Fase gerak nonpolar = n-heksana: etil asetat (2:3 v/v) 2) Fase gerak semipolar = kloroform:metanol (7:3 v/v)
3) Fase gerak polar = etil asetat : asam formiat : asam asetat glasial : air (100:11:11:20 v/v) (Wagner dan Bladt, 1996).
c. Deteksi pemisahan KLT
5. Uji kualitatif aktivitas penangkapan radikal bebas DPPH a. Preparasi pereaksi semprot DPPH
Pereaksi DPPH dibuat dengan konsentrasi 0,2% b/v dalam pelarut metanol, lalu dimasukkan dalam wadah gelap dan tertutup (Marston, 2011). b. Uji kualitatif aktivitas penangkapan radikal dengan pereaksi DPPH
Pelat KLT hasil elusi yang telah kering disiapkan untuk disemprot dengan pereaksi DPPH, hasil positif ditandai dengan adanya bercak kuning dengan latar ungu pada pelat KLT.
6. Uji kualitatif aktivitas UV protection a. Preparasi pereaksi �-karoten
Pereaksi �-karoten dibuat dengan konsentrasi 0,05% b/v dalam pelarut kloroform, lalu dimasukkan dalam wadah gelap dan tertutup (Marston, 2011). b. Optimasi intensitas sinar UV
Pelat KLT kosong disiapkan, kemudian pelat tersebut dicelupkan dalam pereaksi �-karoten. Warna diukur dengan parameter warna lalu dicatat. Pelat tersebut kemudian disinari dengan menggunakan lampu UV. Perubahan warna yang terjadi diamati lalu diukur dengan parameter warna pada menit ke 1, 3, 6, 9, dan 15. Posisi dari lampu UV diatur dalam posisi tinggi (100 cm), sedang (50 cm), rendah (35 cm) dan dihitung intensitas sinar dengan alat light meter. Tiap posisi lampu dilakukan uji dengan replikasi 5 kali. Perubahan warna yang terjadi dicatat lalu dihitung rata-rata dan SD.
c. Uji kualitatif UV protection (�-karoten bleaching test)
Pelat KLT hasil elusi yang telah dikeringkan beberapa saat dicelupkan dalam pereaksi �-karoten. Sebelum warna pelat KLT tersebut diukur dengan menggunakan parameter warna lalu dicatat. Pelat KLT tersebut kemudian disinari sinar UV dengan jarak sesuai hasil optimasi dan dihitung intensitas sinar dengan alat light meter. Perubahan warna yang terjadi diamati lalu diukur dengan parameter warna pada menit ke 1, 3, 6, 9, dan 15. Replikasi 5 kali dilakukan dan perubahan warna yang terjadi dicatat lalu dihitung rata-rata dan SD.
7. Uji kualitatif aktivitas antibakteri a. Pembuatan media TSB cair
Sebanyak 3 g media TSB (30g/L) dilarutkan dalam 100 mL akuades,
diaduk dengan batang pengaduk hingga homogen, kemudian media tersebut diautoklaf.
b. Pembuatan media agar
Sebanyak 3 g media TSB (30g/L) ditambahkan 1,2% b/v agar dilarutkan dalam 100 mL akuades. Diaduk dengan batang pengaduk hingga homogen, kemudian media tersebut diautoklaf.
c. Pembuatan larutan McFarland 0,5 (1,6 x 108 CFU)
Larutan barium klorida 1,175% (b/v) 0,05 mL ditambah 9,95 mL larutan 1% (b/v) asam sulfat (Schwalbe, Moore, dan Goodwin, 2007).
d. Pembuatan NaCl 0,9% (b/v)
e. Preparasi bakteri uji
Bakteri uji yang digunakan adalah E.coli dan S.aureus. Kultur bakteri induk dari media miring diambil sebanyak 1 ose lalu dikulturkan pada media TSB cair. Kultur bakteri diinkubasi selama 18 jam.
f. Pembuatan larutan induk bakteri
Bakteri uji yang digunakan adalah E.coli dan S.aureus. Sebanyak 2 tabung reaksi disiapkan, masing-masing diisi dengan saline water 10 mL dan setarakan kekeruhannya menggunakan larutan standar Mc Farland 0,5 (konsentrasi mikroba 1,6. 108 CFU/ml) dengan penambahan bakteri ke dalam tabung reaksi.
g. Penyimpanan kultur bakteri
Sisa kultur bakteri yang belum digunakan untuk diuji, diambil 0,5 mL lalu dimasukkan ke dalam microtube. Gliserol sebanyak 5% v/v dari 0,5 mL kultur bakteri ditambahkan, yaitu 25. 10-3mL pada masing-masing microtube. Campuran dihomogenkan lalu diinkubasi selama 1 jam dalam inkubator bersuhu 37°C. Setelah itu kultur bakteri disimpan dalam freezer.
h. Pembuatan kontrol kontaminasi media
Media agar sebanyak 15 mL diambil, dituang ke dalam petri steril secara
pour plate lalu dibiarkan memadat. Media diinkubasi selama 18 jam.
i. Pembuatan kontrol pertumbuhan bakteri uji
spreading dengan menggunakan cotton buds steril. Inkubasi dilakukan selama 18 jam.
j. Pembuatan kontrol positif
Media agar sebanyak 15 mL TSB lalu dibiarkan memadat. 100 mikroliter bakteri diinokulasikan secara spreading menggunakan cotton buds steril. Amoksisilin 5 mg ditimbang dan dilarutkan dalam 1 mL akuades. Sebanyak 75; 100;150 µg amoksisilin diambil lalu diteteskan pada paper disc dalam media agar yang telah diinokulasikan bakteri. Inkubasi dilakukan selama 18 jam.
k. KLT ekstrak bunga kenanga
Ekstrak bunga kenanga dengan konsentrasi 5 mg/mL dalam etanol disiapkan untuk ditotolkan pada pelat KLT sebanyak 75; 100; 150 µg dengan menggunakan mikropipet. Pelat KLT dielusi dengan fase gerak kloroform : metanol (95 : 5 v/v). Pelat KLT kemudian dikeringkan pada suhu ruang secara aseptis (dibuat 2 kali replikasi: sebagai acuan dan sebagai pelat uji bioautografi).
l. Bioautografi
8. Identifikasi golongan senyawa ekstrak
Pelat KLT hasil elusi disiapkan untuk diidentifikasi menggunakan reagen semprot. Reagen semprot yang digunakan yaitu Dragendorff, alumunium chloride, ferric chloride, sitroborat, iodium, dan vanilin sulfat, kemudian diamati perubahan warna dan dihitung nilai Rf dari bercak.
9. Pembersihan klorofil dengan karbon aktif
Sebanyak 28 g ekstrak bunga kenanga diambil dan ditampung dalam gelas beaker. Sebanyak 1,6 g karbon aktif ditumbuk halus dan dipanaskan dalam oven dengan suhu 1050 C selama 30 menit. Ekstrak bunga kenanga dilarutkan dengan pelarut kloroform : metanol (1 : 1 v/v) sambil diaduk dengan batang pengaduk. Taburkan karbon aktif yang sudah diaktivasi lalu diaduk dengan batang pengaduk. Campuran disaring lalu filtrat dipekatkan menggunakan tangas air.
10. Kromatografi kolom
a. Preparasi sampel untuk uji kromatografi lapis tipis
Ekstrak hasil pembersihan klorofil ditimbang 2,5 mg dilarutkan dalam 0,5 mL metanol.
c. Preparasi sampel untuk kromatografi kolom
Ekstrak hasil sebanyak 300 mg pembersihan klorofil ditimbang dan dicampurkan dengan silika gel 60 untuk kolom kromatografi dengan perbandingan 1:1.
d. Preparasi kolom kromatografi
Kolom kromatografi disiapkan dengan urutan dari bawah yaitu kapas yang telah dibilas n-heksana, silika gel 60 untuk kolom kromatografi dengan tinggi 3 cm, sampel yang telah dicampur dengan silika gel 60 untuk kolom kromatografi 0,5 cm, silika gel 60 untuk kolom kromatografi 1 cm, dan ditutup dengan kapas yang telah dicuci dengan n-heksana.
e. Kromatografi kolom
Kolom kromatografi yang telah disiapkan, dialiri fase gerak dengan urutan sebagai berikut: n-heksana: kloroform (70 : 30 v/v), (60 : 40 v/v), (50:50 v/v), (40:60 v/v), kloroform, kloroform : metanol (90:10 v/v). Masing – masing fase gerak disiapkan 5 mL. Tiap 2 mL hasil elusi kolom kromatografi ditampung pada tabung yang telah diberi tanda.
f. Konfirmasi hasil kromatografi kolom dengan kromatografi lapis tipis (KLT)
g. Penyimpanan isolat
Isolat hasil pemekatan dilarutkan pada pelarut sesuai dan dipindahkan pada microtube dengan konsentrasi 1 mg/100 µL kemudian dipekatkan dan disimpan dalam freezer.
11. Uji kualitatif aktivitas penangkapan radikal DPPH isolat a. Preparasi sampel
Isolat disiapkan dengan konsentrasi 1mg/mL dengan menggunakan pelarut yang sesuai.
b. Kromatografi lapis tipis (KLT) isolat
Isolat di totolkan pada pelat kromatografi lapis tipis (KLT) dengan mass loading sebesar 10, 20, dan 30 µg, dibandingkan dengan ekstrak bunga kenanga yang ditotolkan dengan mass loading sebesar 10 µg, dielusi dengan jarak elusi 5 cm menggunakan fase gerak kloroform : metanol (95 : 5 v/v) dan dikeringkan pada suhu ruang.
c. Uji kualitatif penangkapan radikal DPPH
12. Uji kualitatif aktivitas UV protection isolat a. Preparasi sampel
Isolat disiapkan dengan konsentrasi 1 mg/mL dengan menggunakan pelarut yang sesuai.
b. Kromatografi lapis tipis (KLT) isolat
Isolat ditotolkan pada pelat kromatografi lapis tipis (KLT) dengan mass loading sebesar 10, 20, dan 30 µg, dielusi dengan jarak 5 cm menggunakan fase gerak kloroform : metanol (95 : 5 v/v) dan dikeringkan pada suhu ruang. c. Uji kualitatif UV protection
Pelat KLT hasil elusi yang telah dikeringkan dicelupkan dalam pereaksi
�-karoten 0,05% b/v dalam kloroform. Sebelum disinari dengan UV, warna pelat KLT diukur menggunakan parameter warna. Pelat KLT kemudian disinari dengan sinar UV dengan jarak sesuai hasil optimasi yaitu pada ketinggian 50 cm dan dihitung intensitas sinar dengan alat light meter. Perubahan warna yang terjadi diamati pada menit ke 1, 3, 6, 9, 12, dan 15.
13. Uji kualitatif aktivitas antibakteri isolat a. Preparasi sampel
Isolat disiapkan dengan konsentrasi 1 mg/mL menggunakan pelarut yang sesuai.
b. Pembuatan media agar
c. Pembuatan NaCl 0,9% b/v
Sebanyak 0,9 g NaCl ditimbang dan dilarutan dalam 100 mL akuades. d. Pembuatan larutan induk bakteri
Bakteri uji yang digunakan adalah S.aureus. Tabung reaksi yang diisi dengan saline water 10 mL disiapkan dan setarakan kekeruhannya menggunakan larutan standar Mc Farland 0,5 (konsentrasi mikroba 1,6. 108 CFU/ml) dengan penambahan bakteri ke dalam tabung reaksi.
e. Pembuatan kontrol kontaminasi media
Media agar sebanyak 15 mL diambil, dituang ke dalam cawan petri steril secara pour plate lalu dibiarkan memadat. Inkubasi dilakukan selama 18 jam.
f. Pembuatan kontrol pertumbuhan bakteri uji
Media agar TSB sebanyak 15 mL dalam tabung diambil, dibiarkan memadat pada cawan petri steril.100 µL bakteri diinokulasikan secara
spreading dengan menggunakan cotton buds steril. Inkubasi dilakukan selama 18 jam.
g. Pembuatan kontrol positif
Media agar sebanyak 15 mL diambil, TSB dalam tabung, dibiarkan memadat pada cawan petri steril. 100 mikroliter bakteri diinokulasikan secara
spreading menggunakan cotton buds steril. Amoksisilin 5 mg ditimbang dan dilarutkan dalam 5 mL akuades. Sebanyak 75, 100, dan 150 µg diambil lalu masing-masing ditotolkan pada paper disc dalam media agar yang telah diinokulasikan bakteri. Inkubasi dilakukan selama 18 jam.
Isolat dengan konsentrasi 1 mg/mL disiapkan dengan pelarut yang sesuai.
Paper disc diletakkan dalam cawan petri steril dan diisikan isolat senyawa dengan massa isolat sebesar 50, 100, dan 200 µg secara aseptis. Paper disc
dibiarkan kering dari sisa pelarut isolat. Paper disc diletakkan pada media yang telah diinokulasikan bakteri S. aureus secara aseptis. Inkubasi selama 18 jam dilakukan. Hasil positif ditandai dengan adanya zona hambat pada media tersebut.
14. Identifikasi golongan senyawa isolat a. Kromatografi lapis tipis (KLT) isolat
Isolat disiapkan dengan konsentrasi1 mg/mL. Tiap isolat ditotolkan 10 µ L pada pelat KLT. Dielusi dengan jarak elusi 5 cm menggunakan fase gerak kloroform : metanol (95 : 5 v/v) dan dikeringkan pada suhu ruang.
b. Identifikasi senyawa dengan reagen semprot
Pelat KLT hasil elusi disiapkan untuk diidentifikasi senyawa dengan menggunakan beberapa reagen yaitu reagen Dragendorff, alumunium chloride,
15. Bagan alur penelitian
Bunga kenanga
Simplisia bunga kenanga
Ekstrak bunga kenanga
Ekstrak bebas klorofil Uji kualitatif aktivitas
penangkapan radikal bebas DPPH, UV protection dan
antibakteri
Isolat Diketahui bercak KLT ekstrak
bunga kenanga yang aktif
Uji kualitatif aktivitas penangkapan radikal bebas
32 BAB IV
HASIL DAN PEMBAHASAN
A. Determinasi Sampel
Determinasi sampel dilakukan di Bagian Biologi Farmasi Fakultas Farmasi Universitas Gadjah Mada. Tujuan dilakukan determinasi sampel adalah untuk memastikan kebenaran identitas sampel yang digunakan sehingga menghindari kesalahan analisis dalam fitokimia. Hasil determinasi menunjukkan bahwa tanaman yang digunakan adalah (Cananga odorata (Lmk.) Hook.F.& Thoms.) dan dikenal dengan nama lokal bunga kenanga.
B. Pengumpulan dan Penyiapan Bahan
Bunga kenanga yang digunakan sebagai sampel penelitian berasal dari Boyolali, Jawa Tengah. Bunga kenanga dipanen pada bulan Juli waktu dini hari dari pohon kenanga berumur 7 tahun dengan umur bunga 2 minggu. Pengambilan sampel berasal dari daerah yang sama untuk menghindari variasi kandungan kimia tanaman yang disebabkan aspek lingkungan (edafik, tempat tumbuh, geografis, cuaca, dan iklim).
sudah banyak berkurang, sedangkan bila sampel terlalu muda maka dikhawatirkan metabolit sekunder yang terkandung pada sampel masih belum sempurna.
Sampel bunga kenanga dipanen pada bulan Juli agar kandungan kimia pada sampel tetap maksimal sebab pemanenan yang ideal dilakukan pada musim kemarau. Secara umum, metabolit sekunder pada tanaman yang dipanen pada musim kemarau akan terkandung lebih banyak daripada saat musim hujan. Pemanenan bunga kenanga dilakukan pada dini hari untuk menghindari berkurangnya metabolit sekunder, sebab pada siang hari metabolit sekunder dapat berkurang karena mengalami proses penguapan atau kerusakan senyawa karena paparan radiasi UV.
kering untuk memisahkan bunga kenanga dari pengotor yang kemungkinan melekat saat proses pengeringan atau pengotor yang belum dbersihkan pada proses-proses sebelumnya. Simplisia yang dihasilkan disimpan pada amplop kertas yang diberi penambahan silika pengering dengan tujuan menghindari adanya lembab.
C. Ekstraksi
1. Ekstraksi bunga kenanga
Prinsip ekstraksi adalah proses pengambilan senyawa-senyawa kimia yang semula berada dalam sel, ditarik oleh larutan penyari sehingga senyawa-senyawa kimia berada dalam larutan penyari. Proses ekstraksi pada penelitian ini dilakukan dengan 2 tahap, yaitu simplisia diblender dengan larutan etanol 90% v/v lalu dilanjutkan dengan proses maserasi. Proses pemblenderan simplisia dilakukan untuk menyari langsung komponen minyak atsiri yang kemungkinan akan menguap apabila dilakukan penyerbukan simplisia. Selanjutnya dilakukan dengan maserasi untuk memaksimalkan penyarian. Pada proses maserasi, cairan penyari akan menembus dinding sel lalu masuk menembus rongga sel yang berisi senyawa kimia. Senyawa kimia tersebut akan larut dalam cairan penyari lalu berdifusi keluar sel hingga terjadi kesetimbangan senyawa di dalam dan luar sel. Adanya shaker pada proses maserasi bertujuan untuk meningkatkan energi mekanik sehingga seluruh serbuk hasil blender dapat terbasahi sehingga membantu proses difusi komponen senyawa.
dihindari. Hal ini sangat mendukung proses isolasi karena proses ekstraksi komponen kimia tumbuhan dapat berjalan optimal. Larutan penyari yang digunakan adalah etanol 90% v/v. Tujuan digunakan penyari etanol 90% v/v karena komposisi ini merupakan pelarut yang bersifat universal sehingga relatif dapat menyari komponen kimia yang cenderung lebih nonpolar maupun polar.
Setelah proses maserasi selesai, hasil maserasi disaring menggunakan kain mori yang terlebih dulu dicuci dengan air mendidih yang bertujuan untuk menghilangkan komponen lilin yang melekat pada kain. Setelah itu filtrat disaring kembali dengan kertas saring Whatman nomor 41 sebelum kemudian dipekatkan dengan vacuum rotary evaporator. Dengan alat ini, etanol yang digunakan sebagai pelarut dapat diuapkan dan dikondensasikan kembali sehingga etanol dapat diperoleh kembali dan sudah terpisah dari ekstrak. Adanya pompa vakum akan membuat tekanan pada sistem akan turun sehingga akan terjadi penguapan pelarut dibawah titik didih normal. Labu yang berputar pada proses ini berfungsi untuk meratakan pemanasan sehingga proses penguapan pelarut dapat berjalan dengan baik. Hasil dari pemekatan dengan vacuum rotary evaporator adalah ekstrak bebas penyari.
pemanasan. Keuntungan menggunakan metode susut pengeringan adalah cepat, mudah, murah, dan hanya membutuhkan jumlah sampel yang sedikit.
Persentase yang diperoleh pada susut pengeringan simplisia dan ekstrak berturut-turut adalah 15,40 % b/b dan 24,61 % b/b. Berdasarkan monografi resmi terbitan Departemen Kesehatan RI, persyaratan kadar air pada simplisia yang akan digunakan sebagai bahan baku obat adalah tidak lebih dari 10% b/b. Karena penelitian ini bertujuan untuk melakukan isolasi senyawa maka persentase susut pengeringan diatas dapat diterima. Selain itu metode susut pengeringan merupakan metode yang tidak spesifik untuk pengukuran kadar air dan hanya memberikan batasan maksimal untuk total senyawa yang menguap selama pemanasan. Sampel bunga kenanga memiliki banyak kandungan senyawa yang mudah menguap seperti minyak atsiri, sehingga bila diukur penetapan kadar air dengan metode yang lebih spesifik akan memberikan persentase hasil yang lebih rendah. Hal ini menyimpulkan bahwa proses pembuatan simplisia sudah cukup baik.
sebanyak 65,9 g. Keuntungan menggunakan metode ini adalah menghindari pemanasan dalam melakukan pemekatan sehingga kerusakan senyawa kimia yang terkandung dalam ekstrak dapat diminimalisir.
3. Pemerian ekstrak bunga kenanga
Pada tahap ini, ekstrak yang dihasilkan diamati secara organoleptis. Pengamatan organoleptis yang dilakukan pada ekstrak meliputi bentuk, warna, rasa, dan bau. Bentuk yang dihasilkan cairan kental, warna hijau kehitaman, rasa hambar, dan bau harum khas bunga kenanga.
D. Kromatografi Lapis Tipis Ekstrak
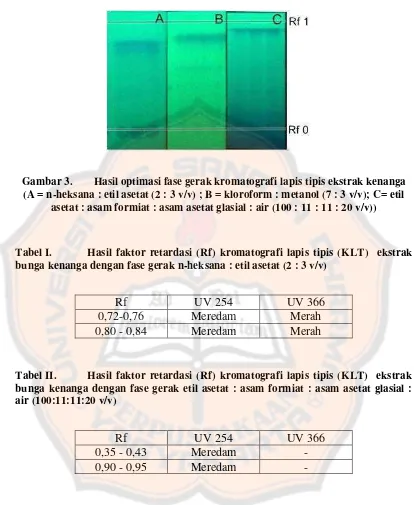
Tahap selanjutnya adalah dilakukan optimasi fase gerak kromatografi lapis tipis (KLT). Tujuan dilakukan optimasi fase gerak adalah untuk mendapatkan hasil pemisahan yang baik dari senyawa-senyawa kimia yang terkandung pada ekstrak. Prinsip kromatografi lapis tipis adalah pemisahan analit berdasarkan interaksi dengan fase diam dan fase gerak pada suatu lempeng pemisahan.
Gambar 3. Hasil optimasi fase gerak kromatografi lapis tipis ekstrak kenanga (A = n-heksana : etil asetat (2 : 3 v/v) ; B = kloroform : metanol (7 : 3 v/v); C= etil
asetat : asam formiat : asam asetat glasial : air (100 : 11 : 11 : 20 v/v))
Tabel I. Hasil faktor retardasi (Rf) kromatografi lapis tipis (KLT) ekstrak bunga kenanga dengan fase gerak n-heksana : etil asetat (2 : 3 v/v)
Rf UV 254 UV 366
0,72-0,76 Meredam Merah 0,80 - 0,84 Meredam Merah
Tabel II. Hasil faktor retardasi (Rf) kromatografi lapis tipis (KLT) ekstrak bunga kenanga dengan fase gerak etil asetat : asam formiat : asam asetat glasial : air (100:11:11:20 v/v)
Rf UV 254 UV 366
0,35 - 0,43 Meredam -
0,90 - 0,95 Meredam -
Tabel III. Hasil faktor retardasi (Rf) kromatografi lapis tipis (KLT) ekstrak bunga kenanga dengan fase gerak kloroform : metanol (7 : 3 v/v)
Rf UV 254 UV 366
Dari ketiga jenis fase gerak diatas, hasil pemisahan yang paling optimal terjadi pada fase gerak kloroform : metanol (7 : 3 v/v) dimana terdapat 3 bercak dengan Rf tidak terlalu tinggi maupun terlalu rendah. Selanjutnya, dilakukan optimasi lanjutan dengan melakukan pemisahan dengan menggunakan fase gerak kloroform : metanol (95 : 5 v/v) untuk menurunkan Rf yang terbentuk pada pemisahan dengan fase gerak kloroform : metanol (7 : 3 v/v). Hasil pemisahan paling optimum didapatkan menggunakan fase gerak kloroform : metanol (95 : 5 v/v) yang dapat memisahkan 7 bercak dengan resolusi yang baik. Selain itu, pemilihan fase gerak optimum didukung dengan panduan uji aktivitas penangkapan radikal DPPH.
Tabel IV. Hasil faktor retardasi (Rf) kromatografi lapis tipis (KLT) ekstrak bunga kenanga dengan fase gerak kloroform : metanol (95 : 5 v/v)
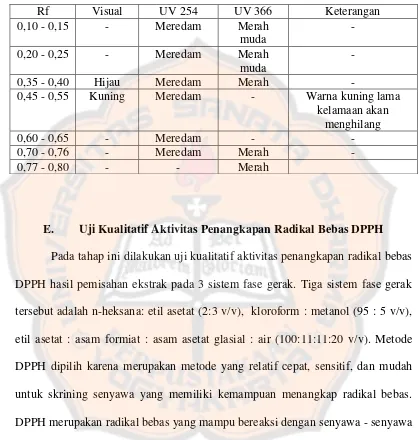
Rf Visual UV 254 UV 366 Keterangan
0,10 - 0,15 - Meredam Merah muda
- 0,20 - 0,25 - Meredam Merah
muda
-
0,35 - 0,40 Hijau Meredam Merah -
0,45 - 0,55 Kuning Meredam - Warna kuning lama kelamaan akan
menghilang
0,60 - 0,65 - Meredam - -
0,70 - 0,76 - Meredam Merah -
0,77 - 0,80 - - Merah
Gambar 5. Hasil uji kualitatif aktivitas penangkapan radikal DPPH ( A= n-heksana: etil asetat (2:3 v/v); B= fase gerak kloroform : metanol (95 : 5 v/v); C= etil
asetat: asam formiat: asam asetat glasial : air (100:11:11:20 v/v) )
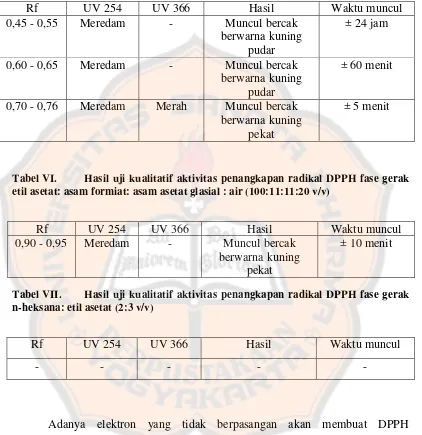
[image:67.595.100.504.205.598.2]Tabel V. Hasil uji kualitatif aktivitas penangkapan radikal DPPH fase gerak kloroform : metanol (95 : 5 v/v)
Rf UV 254 UV 366 Hasil Waktu muncul
0,45 - 0,55 Meredam - Muncul bercak berwarna kuning
pudar
± 24 jam
0,60 - 0,65 Meredam - Muncul bercak berwarna kuning
pudar
± 60 menit
0,70 - 0,76 Meredam Merah Muncul bercak berwarna kuning
pekat
[image:68.595.101.523.156.591.2]± 5 menit
Tabel VI. Hasil uji kualitatif aktivitas penangkapan radikal DPPH fase gerak etil asetat: asam formiat: asam asetat glasial : air (100:11:11:20 v/v)
Rf UV 254 UV 366 Hasil Waktu muncul
0,90 - 0,95 Meredam - Muncul bercak berwarna kuning
pekat
± 10 menit
Tabel VII. Hasil uji kualitatif aktivitas penangkapan radikal DPPH fase gerak n-heksana: etil asetat (2:3 v/v)
Rf UV 254 UV 366 Hasil Waktu muncul
- - - - -
Berdasarkan hasil uji kualitatif penangkapan radikal DPPH, tampak bahwa hasil pemisahan dengan fase gerak kloroform : metanol (95 : 5 v/v) merupakan fase gerak yang optimum karena terdapat 3 bercak berwarna kuning dimana salah satu bercak dengan Rf antara 0,70 - 0,76 merupakan bercak yang diperkirakan memiliki kemampuan terkuat dalam menangkap radikal DPPH. Bercak berwarna kuning tersebut juga tampak pada hasil pemisahan dengan fase gerak etil asetat : asam formiat : asam asetat glasial : air (100:11:11:20 v/v) sebanyak 1 bercak sedangkan pada pemisahan dengan fase gerak n-heksana : etil asetat (2 : 3 v/v) tidak tampak ada bercak kuning. Hal ini juga menjadi dasar pertimbangan dalam menentukan fase gerak optimum.
Fase gerak etil asetat:asam formiat: asam asetat glasial : air (100:11:11:20 v/v) memisahkan senyawa yang bersifat polar yang ada pada ekstrak namun hanya terdapat satu bercak kuning pada Rf yang tinggi yang menandakan pemisahan yang terjadi kurang optimal. Isolasi senyawa – senyawa yang bersifat terlalu polar seperti ini akan sulit untuk dilakukan. Tidak adanya bercak kuning pada pemisahan dengan fase gerak n-heksana : etil asetat (2 : 3 v/v) kemungkinan disebabkan karena senyawa yang terelusi adalah senyawa - senyawa lipid dan klorofil. Beberapa hal tadi memperkuat bahwa fase gerak kloroform : metanol (95 : 5 v/v) merupakan fase gerak optimum dalam penelitian.
F. Uji Kualitatif Aktivitas UV Protection
sinar UV adalah untuk memudahkan pengamatan yang dilakukan oleh peneliti. Jarak lampu UV menuju pelat KLT merupakan variabel yang diubah-ubah sebab semakin dekat jarak lampu UV akan semakin kuat intensitas sinarnya sehingga akan merusak warna �-karoten dengan cepat dan merubah warnanya menjadi pudar.
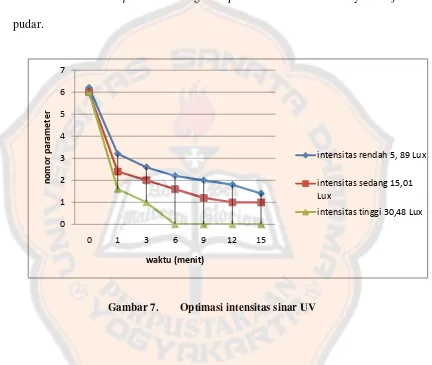
Gambar 7. Optimasi intensitas sinar UV
Hasil optimasi menunjukkan bahwa jarak optimum yang diperoleh adalah 50 cm (intensitas sedang) dengan rata-rata intensitas sinarnya 15,01 Lux. Pada kondisi ini warna �-karoten tidak memudar terlalu lambat ataupun terlalu cepat seperti yang ditunjukkan pada hasil optimasi pada jarak 100 cm dan 35 cm. Kondisi optimum akan mempermudah peneliti melakukan pengamatan perubahan warna menggunakan parameter warna. Parameter warna (terlampir) dibuat dengan mempertimbangkan gradasi warna dari kuning oranye hingga memudar.
0 1 2 3 4 5 6 7
0 1 3 6 9 12 15
n o m o r p ar am e te r waktu (menit)
intensitas rendah 5, 89 Lux
intensitas sedang 15,01 Lux
Parameter warna memiliki 8 skala (skala 0 - 7), dimana skala tertinggi merupakan warna kuning oranye yang paling pekat sedangkan skala terendah merupakan warna paling pudar.
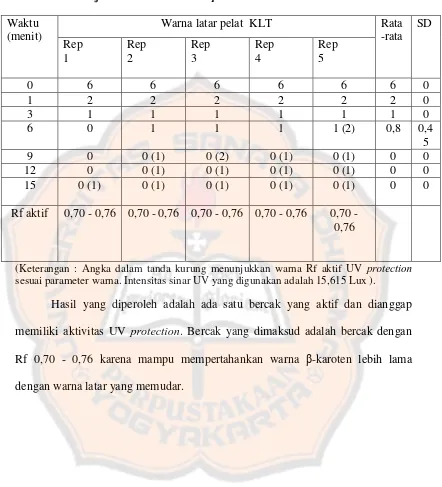
Setelah melakukan optimasi intensitas sinar UV maka dilanjutkan dengan uji kualitatif UV protection ekstrak. Senyawa yang memiliki aktivitas antioksidan dan UV protection adalah senyawa yang mampu mempertahankan warna β -karoten lebih lama (Rochmaulana dan Wahyudi, 2009). Tujuan uji kualitatif UV
protection adalah melakukan skrining hasil pemisahan senyawa pada ekstrak yang mampu mempertahankan warna β-karoten sehingga dianggap memiliki kemampuan sebagai UV protector. Hasil uji kualitatif UV protection ekstrak dapat dilihat pada data dibawah ini.
[image:71.595.102.509.328.632.2](Keterangan : Tanda panah menunjukkan letak bercak yang berperan sebagai UV protector)
Gambar 8. Hasil uji kualitatif aktivitas UV protection ekstrak pada menit ke 15 (A = replikasi 1; B= replikasi 2; C= replikasi 3; D = replikasi 4; E=
Tabel VIII. Uji kualitatif aktivitas UV protection ekstrak
Waktu (menit)
Warna latar pelat KLT Rata -rata SD Rep 1 Rep 2 Rep 3 Rep 4 Rep 5
0 6 6 6 6 6 6 0
1 2 2 2 2 2 2 0