II.
TINJAUAN PUSTAKA
2.1. Jarak Pagar (Jatropha curcas L.)
Jarak pagar (Jatropha curcas L) telah lama dikenal masyarakat luas di Indonesia sejak dikenalkan oleh bangsa Jepang pada tahun 1942. Tanaman ini merupakan tanaman tahunan yang mempunyai potensi menghasilkan minyak nabati (minyak jarak/curcas oil) sebagai bahan baku energi baru terbarukan termasuk sebagai biodiesel. Tanaman ini dapat tumbuh dan berkembang di lahan marginal/kering sehingga dapat dikembangkan di wilayah Indonesia Timur. Selain sebagai upaya konservasi lahan, meningkatkan pendapatan masyarakat penanaman jarak pagar ini juga sebagai salah satu alternatif sumber bahan baku enegi terbarukan (Hambali, 2009).
Jarak pagar memiliki buah yang terdiri dari daging buah, cangkang biji dan inti biji. Buah berupa buah kotak berbentuk bulat, diameter 2 – 4 cm, berwarna hijau ketika masih muda dan kuning jika masak. Buah jarak terbagi 3 ruang yang masing-masing ruang diisi 3 biji. Biji berbentuk bulat lonjong, warna coklat kehitaman. Inti biji merupakan sumber bagian yang menghasilkan minyak dengan proses awal ekstraksi. Kandungan minyak yang terdapat dalam biji baik cangkang maupun buah berkisar 25-35% berat kering biji. Jarak pagar mampu menghasilkan 7,5-10 ton/ha/tahun tergantung dari kualitas benih, agroklimat, tingkat kesuburan tanah dan pemeliharaan (Hambali et al., 2007). Sebagai perhitungan kasar produksi crude jatropha oil (CJO), dari 1 ton biji kering maka dapat diperoleh minyak hasil ekstraksi sebesar 250-270 kg minyak jarak. Minyak jarak pagar berwujud cairan bening berwarna kuning dan tidak menjadi keruh sekalipun disimpan dalam jangka waktu lama. Penampakan dari buah dan biji jarak pagar dapat dilihat pada Gambar 1.
Gambar 1. Buah Jarak Pagar (Jatropha curcas L.) dan Biji Jarak pagar (www.Chem-Is-Try.Org)
Tabel 1. Komponen Penyusun Biji Jarak Pagar Komposisi (%) Nilai Minyak (% b/b) 34.38 a 56.8− 58.4 b Protein (% b/b) 17.08 a 22.2 – 27.2 b 29.40±1.04 c Serat (% b/b) 22.96 a 2.57±0.35 c Abu (% b/b) 3.17 a 3.6 – 4.3 b Air (% b/b) 5.77 a 3.1 – 5.8 b 5.00 ±0.01 c Karbohidrat (% b/b) 16.89±0.91 c
Sumber : Winkler et al. (1997) a , Gubitz et al. (1999) b, Peace dan Aladesanmi (2008) c
2.2. Minyak Jarak Pagar
Proses ekstraksi jarak pagar menjadi minyak dilakukan secara mekanik menggunakan mesin press, baik sederhana dengan skala kecil maupun skala produksi industri. Jenis alat press dibedakan menjadi dua macam yaitu press hidrolik (hydraulic pressing) dan press ulir (expeller pressing) yang memiliki kelemahan dan keunggulan masing masing, biasanya disesuaikan dengan tingkat produksi minyak. Setelah biji jarak dikeringkan dan disortir berdasarkan kualitas, biji jarak pagar dimasukkan ke dalam mesin press mekanik. Hasil pengepresan diperoleh minyak mentah atau crude jatropha oil (CJO) dan bungkil berupa sisa ampas. Untuk memurnikan CJO selanjutnya dilakukan penyaringan dan diperoleh limbah berupa sludge. Beberapa industri pengolahan mengikutkan cangkang inti biji untuk proses, sehingga tidak diperlukan proses pengelupasan cangkang dari inti buah (Hambali et al., 2007).
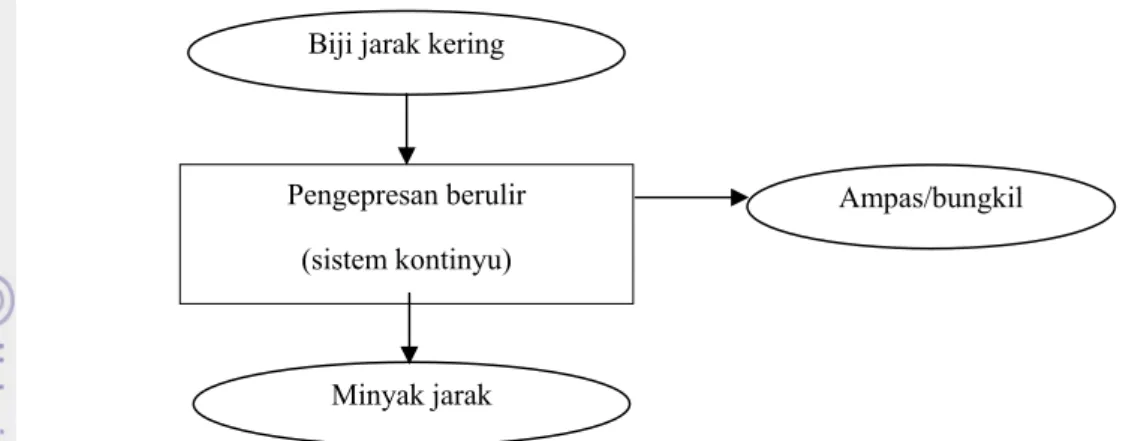
screw press) dihasilkan rendemen minyak sekitar 27 - 30 persen. Pada Gambar 2 disajikan diagram
alir proses pengepresan biji jarak menggunakan metode pengepresan berulir (Hambali et al., 2009).
Gambar 2. Diagram alir proses pengepresan biji jarak menggunakan metode pengepresan berulir (Hambali et al., 2009)
Alat ekstraksi minyak jarak yang dikembangkan oleh Pusat Penelitian Surfaktan dan Bioenergi (SBRC)-LPPM IPB adalah alat press tipe ulir (screw press). Bahan yang masuk ke dalam alat akan terdorong ke depan, kemudian bahan akan mendapat tekanan yang semakin membesar sampai berada di ujung alat. Tekanan ini menyebabkan keluarnya minyak dari bahan. Minyak jarak masih mengandung kotoran yang terbawa selama pengepresan sehingga perlu dilakukan penyaringan. Pada Tabel 2 disajikan spesifikasi mutu minyak jarak pagar berdasarkan beberapa literatur.
Tabel 2. Spesifikasi Mutu Minyak Jarak Pagar
No Parameter Satuan Nilai mutu
1 Kadar air % (b/b) 0.25 b
2 Bobot jenis/densitas g/cm3 0,9177a
3 Bilangan iod Mg iod/g sampel 82-90 b
4 Bilangan penyabunan Mg KOH/g lemak 177-187 b
5 FFA % 2 b
Sumber : a Hambali et al (2007), b Peace dan Aladesanmi (2008)
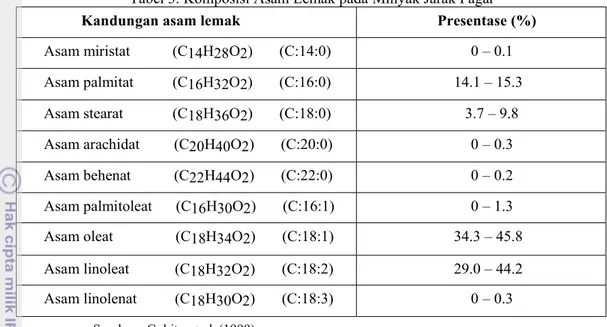
Menurut Hambali, et al. (2007), minyak jarak pagar mengandung 21% asam lemak jenuh dan 79% asam lemak tak jenuh. Adapun komposisi asam lemak pada minyak jarak pagar dapat dilihat pada Tabel 3.
Biji jarak kering
Pengepresan berulir (sistem kontinyu)
Minyak jarak
Tabel 3. Komposisi Asam Lemak pada Minyak Jarak Pagar
Kandungan asam lemak Presentase (%)
Asam miristat (C14H28O2) (C:14:0) 0 – 0.1
Asam palmitat (C16H32O2) (C:16:0) 14.1 – 15.3
Asam stearat (C18H36O2) (C:18:0) 3.7 – 9.8
Asam arachidat (C20H40O2) (C:20:0) 0 – 0.3
Asam behenat (C22H44O2) (C:22:0) 0 – 0.2
Asam palmitoleat (C16H30O2) (C:16:1) 0 – 1.3
Asam oleat (C18H34O2) (C:18:1) 34.3 – 45.8
Asam linoleat (C18H32O2) (C:18:2) 29.0 – 44.2
Asam linolenat (C18H30O2) (C:18:3) 0 – 0.3
Sumber : Gubitz et al. (1999)
Asam lemak dominan pada minyak jarak pagar adalah asam oleat, asam linoleat, dan asam palmitat. Asam oleat dan asam linoleat merupakan asam lemak tak jenuh, sedangkan asam palmitat merupakan asam lemak jenuh. Asam oleat merupakan asam lemak yang terdapat di sebagian besar minyak atau lemak dengan rata-rata komposisinya 50% dari total asam lemak. Menurut Sheats dan MacArthur (2002), semakin tinggi jumlah asam lemak tak jenuh dalam suatu minyak, maka akan menyebabkan minyak tersebut semakin mudah teroksidasi.
Keuntungan minyak jarak pagar apabila dibuat menjadi metil ester (biodiesel) antara lain adalah minyak jarak pagar tidak termasuk kategori minyak makan (edible oil) sehingga pemanfaatannya tidak mengganggu penyediaan kebutuhan minyak makan. Minyak jarak pagar tidak dapat dikonsumsi manusia karena mengandung racun yang disebabkan adanya senyawa forbol ester dan cursin (Hambali et al., 2007).
2.3.Metil Ester (Biodiesel)
Metil ester atau biodiesel merupakan salah satu jenis bahan bakar yang bersifat terbarukan karena bersumberkan dari sumber daya hayati, seperti minyak nabati. Minyak nabati memiliki potensi sebagai sumber bahan bakar yang terbarukan, sekaligus sebagai alternatif bahan bakar minyak yang berbasis petroleum atau minyak bumi (Hambali et al., 2007).
Biodiesel sebagai bahan bakar alternatif memiliki beberapa kelebihan dibanding bahan bakar diesel petroleum (Haryanto, 2007). Kelebihan tersebut antara lain (1) merupakan bahan bakar yang tidak beracun dan dapat dibiodegradasi, (2) mempunyai bilangan setana yang tinggi, (3) mengurangi emisi karbon monoksida, hidrokarbon dan NOx dan (4) terdapat dalam fase cair. Hambali et al. (2007) menambahkan bahwa penggunaan biodiesel memiiki keuntungan antara lain emisi biodiesel bebas sulfur, meningkatkan pendapatan petani, mengurangi beban impor akan bahan bakar, serta karakteristik biodiesel tidak berbeda jauh dengan solar.
Gambar 4. Diagram alir proses pembuatan metil ester
(Hambali et al., 2007)
untuk menurunkan viskositas minyak jarak dan meningkatkan daya pembakaran sehingga dapat digunakan sesuai standar minyak diesel untuk kendaraan bermotor (Joelianingsih et al., 2006).
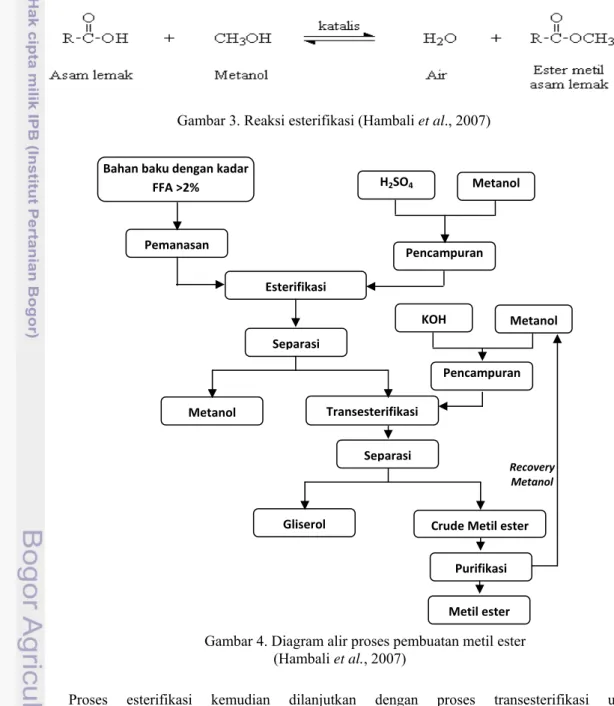
Sumber alkohol yang digunakan dapat bermacam-macam. Apabila direaksikan dengan metanol, maka akan didapat metil ester, apabila direaksikan dengan etanol akan didapat etil ester. Metanol lebih banyak digunakan sebagai sumber alkohol karena rantainya lebih pendek, lebih mudah direkoveri, lebih polar, dan harganya lebih murah dari alkohol lainnya (Hambali et al., 2007). Metil ester dapat terbentuk dari reaksi antara trigliserida dan metanol maupun asam lemak bebas dan metanol. Gambaran reaksi esterifikasi FFA menjadi metil ester dan diagram alir proses pembuatan metil ester dengan dua tahap dapat dilhat pada Gambar 3 dan 4.
Gambar 3. Reaksi esterifikasi (Hambali et al., 2007)
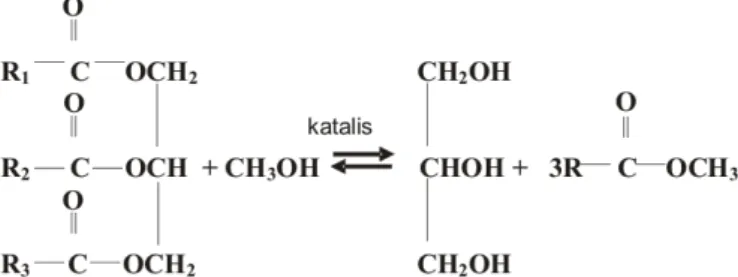
Proses esterifikasi kemudian dilanjutkan dengan proses transesterifikasi untuk menyempurnakan konversi trigliserida menjadi alkil ester. Reaksi transesterifikasi trigliserida menjadi alkil ester disajikan pada Gambar 5.
O + + ‐OCH 3 + ‐OR2 + ‐OR2 CH3OH R 2‐OH ‐OCH 3 (1) (2) (3) R1 C OR2 _ ‐O _ OCH3 R1 C OR2 = R1 C OCH3 =O R1 C OR2 _ ‐O _ OCH3 Katalis basa Katalis basa Katalis basa
Gambar 5. Reaksi transesterifikasi trigliserida menjadi alkil ester (Hargreaves, 2003)
Transesterifikasi trigliserida diawali dengan protonisasi satu gugus karbonil pada molekul trigliserida menghasilkan senyawa intermediet II berupa senyawa karboksi. Bentuk karboksi kemudian akan bereaksi dengan alkohol membentuk senyawa intermediet III berupa molekul tetrahedral. Senyawa intermediet tetrahedral kemudian akan terpecah menjadi ester yang baru dan digliserida. Langkah ini terjadi berulang pada molekul digliserida dan molekul monogliserida (Jungermann, 1979).
Proses transesterifikasi dilakukan dengan mereaksikan jarak pagar setelah proses esterifikasi dengan 15%-v/v methanol. Reaksi transesterifikasi dipercepat dengan penambahan katalis KOH sebesar 1%-v/v. Reaksi transesterifikasi diawali dengan penyerangan ion alkoksida pada atom karbon gugus karbonil dalam molekul trigliserida menghasilkan senyawa intermediet berbentuk tetrahedral. Pada tahap kedua, senyawa intermediet ini akan terpecah menjadi metil ester dan anion digliserida. Anion digliserida kemudian akan bereaksi dengan metanol membentuk molekul digliserida. Molekul digliserida kemudian akan dikonversi menjadi molekul monogliserida dan gliserol melalui mekanisme yang sama. Mekanisme reaksi transesterifikasi trigliserida dengan katalis basa disajikan pada Gambar 6 (Jungermann, 1979).
Gambar 6. Mekanisme reaksi transesterifikasi trigliserida menggunakan katalis basa (Jungermann, 1979).
Tabel 4. Standar Mutu Biodiesel (SNI 04- 7182-2006)
No. Parameter Satuan Metode Uji Nilai
1. Massa jenis pada 40 oC kg/m3 ASTM D1298 850-890
2. Viskositas kinematik pada 40 oC mm2 /s(cSt) ASTM D445 2,3-6,0
3. Bilangan setana - ASTM D613 Min. 51
4. Titik nyala (mangkok tertutup) oC ASTM D93 Min. 100
5. Titik kabut oC ASTM D2500 Maks. 18
6. Korosi kepingan tembaga (3 jam pada 50 oC)
- ASTM D130 Maks.no 3
7. Residu karbon dalam :
-Contoh asli % massa ASTM D4530 Maks.0,05
-10% ampas distilasi Maks.0,30
8. Air dan sedimen % volume ASTM D1796 Maks.0,05
9. Suhu distilasi 90% oC ASTM D1160 Maks. 360
10. Abu tersulfatkan % massa ASTM D874 Maks.0,02
11. Belerang ppm-m (mg/kg) ASTM D1266 Maks. 100
12. Fosfor ppm-m (mg/kg) ASTM D1091 Maks. 10
13. Bilangan asam mg KOH/g AOCS Cd 3d-63 Maks. 0,8
14. Gliserol total % massa AOCS Ca 14-56 Maks.0.24
15. Kadar ester alkil % massa SNI04-7182-2006* Min. 96,5
16. Bilangan iodium % massa (g I2
/100 g)
AOCS Cd1-25 Maks. 115
Catatan: * diperoleh dari hasil perhitungan antara bilangan penyabunan dan bilangan asam
2.4. Surfaktan
(a) (b)
Gambar 7. Gambar molekul surfaktan (a) dan gambaran mikroskopik surfaktan (b) (Elefani, 2008) Surfaktan memiliki dua gugus dalam molekul yang sama yaitu gugus hidrofobik (grup nonpolar) yang memiliki sifat hidrofobik dalam media air tetapi bersifat hidrofilik dalam media hidrokarbon. Sedangkan gugus hidrofilik (grup polar) bersifat hidrofilik dalam media air tetapi bersifat hidrofobik dalam media hidrokarbon (Hargreaves, 2003).
Surfaktan sebagai senyawa aktif penurun tegangan permukaan (surface active agent) yang digunakan sebagai bahan penggumpal, pembasah, pembusaan, emulsifier dan komponen bahan adhesif telah diaplikasikan secara luas pada berbagai bidang industri. Kehadiran gugus hidrofobik dan hidrofilik yang berada dalam satu molekul menyebabkan surfaktan cenderung berada pada antar muka antara fase yang berbeda derajat polaritas dan ikatan hidrogen seperti minyak dan air. Pembentukan film pada antarmuka ini menurunkan energi antarmuka dan menghasilkan sifat-sifat khas molekul surfaktan (Hargreaves, 2003).
Surfaktan dibagi menjadi empat kelompok penting dan digunakan secara luas pada hampir semua sektor industri modern. Jenis-jenis surfaktan tersebut adalah surfaktan anionik, surfaktan kationik, surfaktan nonionik dan surfaktan amfoterik (Hargreaves, 2003). Sedangkan Swern (1979) membagi surfaktan menjadi empat kelompok sebagai berikut:
1. Surfaktan kationik, merupakan surfaktan yang bagian pangkalnya berupa gugus hidrofilik dengan ion bermuatan positif (kation). Umumnya merupakan garam-garam amonium kuarterner atau amina.
2. Surfaktan anionik, merupakan surfaktan yang gugus hidrofiliknya dengan ion bermuatan negatif (anion). Umumnya berupa garam natrium, akan terionisasi menghasilkan Na+ dan ion
surfaktan yang bermuatan negatif.
3. Surfaktan nonionik, merupakan surfaktan yang tidak berdisosiasi dalam air, kelarutannya diperoleh dari sisi polarnya. Surfaktan jenis ini tidak membawa muatan elektron, tetapi mengandung heteroatom yang menyebabkan terjadinya momen dipol.
4. Surfaktan amfoterik, mengandung gugus yang bersifat anionik dan kationik seperti pada asam amino. Sifat surfaktan ini tergantung pada kondisi media dan nilai pH.
Surfaktan pada umumnya disintesis dari turunan minyak bumi, seperti Linier Alkilbensen
Sulfonat (LAS), Alkil Sulfonat (AS), Alkil Etoksilat (AE) dan Alkil Etoksilat Sulfat (AES). Surfaktan
dari turunan minyak bumi dan gas alam ini dapat menimbulkan pencemaran terhadap lingkungan, karena surfaktan ini setelah digunakan akan menjadi limbah yang sukar terdegradasi. Disamping itu, minyak bumi yang digunakan merupakan sumber bahan baku yang tidak dapat diperbaharui. Masalah inilah yang menyebabkan banyak pihak mencari alternatif surfaktan yang mudah terdegradasi dan
Hidrofilik
berasal dari bahan baku yang dapat diperbaharui (Swern, 1979).
2.5. Metil Ester Sulfonat (MES)
Metil ester sulfonat (MES) merupakan zat yang disintesis dari bahan metil ester dan agen sulfonasi melalui proses reaksi sulfonasi. MacArthur et al. (2002) menyebutkan bahwa studi tentang C16-C18 MES yang dilakukan oleh Lion-Jepang menunjukkan bahwa MES memiliki sifat yang lebih
baik daripada surfaktan LAS atau AS (alcohol sulfate) dalam hal pencucian di air dingin dan air sadah hingga 100 ppm (CaCO3).
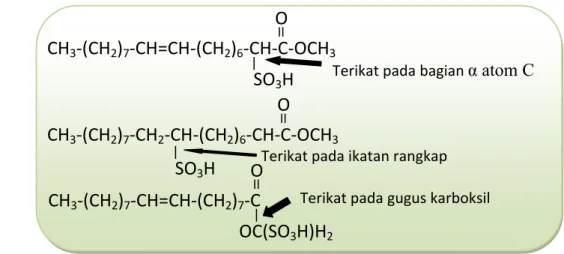
Proses produksi surfaktan MES dilakukan dengan mereaksikan metil ester dengan agen sulfonasi. Menurut Bernardini (1983) dan Pore (1976), pereaksi yang dapat dipakai pada proses sulfonasi antara lain asam sulfat (H2SO4), oleum (larutan SO3 di dalam H2SO4), sulfur trioksida (SO3),
NH2SO3H, dan ClSO3H. Untuk menghasilkan kualitas produk terbaik, beberapa perlakuan penting
yang harus dipertimbangkan adalah rasio mol, suhu reaksi, konsentrasi grup sulfat yang ditambahkan, waktu netralisasi, jenis dan konsentrasi katalis, pH dan suhu netralisasi.
Pada mekanisme reaksi sulfonasi, lokasi terjadinya proses sulfonasi adalah pada bagian α-atom karbon. Menurut Jungermann (1979), terdapat tiga lokasi terjadinya reaksi sulfonasi molekul ester dengan basis asam lemak yaitu (1) gugus karboksil; (2) bagian α -atom karbon; (3) rantai tidak jenuh (ikatan rangkap). Kemungkinan terikatnya pereaksi SO3 dalam proses sulfonasi dapat dilihat pada
Gambar 8.
Gambar 8. Kemungkinan terikatnya pereaksi kimia dalam proses sulfonasi (Jungermann,1979)
Mekanisme reaksi yang terjadi selama reaksi sulfonasi dapat dijelaskan pada Gambar 9. (dalam hal ini dijelaskan dengan menggunakan salah satu asam lemak penyusun yang dominan dari ME Jarak Pagar yaitu asam lemak oleat sekitar 34,3 – 45,8 %) (Gubitz et al.,1999).
Gambar 9. Mekanisme reaksi pembentukan MESA (Gubitz et al.,1999)
Metil ester Jarak Pagar (I) dalam hal ini menggunakan senyawa asam lemak yang dominan yaitu oleat C18 bereaksi dengan gas SO3 membentuk senyawa intermediet (II), pada umumnya berupa
senyawa anhidrad. Dalam kondisi reaksi yang setimbang, senyawa intermediet (II) tersebut akan mengaktifkan gugus alfa (α) pada rangkaian gugus karbon metil ester sehingga membentuk senyawa intermediet (III). Selanjutnya, senyawa intermediet (III) tersebut mengalami restrukturisasi dengan melepaskan gugus SO3. Gugus SO3 yang dilepaskan bukanlah gugus yang terikat pada ikatan alfa.
Dengan terlepasnya gas SO3 selama proses post digestion tersebut, maka terbentuklah MESA (IV).
Di industri, proses sulfonasi secara langsung dilakukan dengan cara mereaksikan agen sulfonasi ke minyak pada suhu reaksi yang lebih tinggi dari titik leleh minyak. Setelah sulfonasi, sisa pereaksi yang tidak bereaksi dipisahkan dari produk hasil sulfonasi, kemudian dinetralisasi menggunakan larutan alkali. Pencucian dan netralisasi dilakukan pada suhu antara 40-50 oC
(Pore,1976).
Proses sulfonasi metil ester dengan gas SO3 dapat dilakukan pada skala laboratorium, skala
pilot maupun skala industri. Peralatan sulfonasi yang dilakukan pada skala laboratorium yaitu bejana gelas berbentuk silinder dengan diameter bagian dalam 4 cm dan tingginya 45 cm. Gelas tersebut dilengkapi dengan jaket pendingin, saluran masuk dan keluar gas, dan termometer. Gas masuk melalui saluran atas dengan diameter saluran 8 mm. Proses sulfonasi pada skala ini dapat berlangsung secara kontinyu dengan lapisan tipis pada reaktor. Untuk menghasilkan surfaktan metil ester sulfonat dengan kapasitas besar dapat meningkatkan skala peralatan produksi tersebut (Hambali et al., 2007).
Penggunaan suhu 70-90 oC dengan rasio mol metil ester dan gas SO
3 yaitu 1:1,3 (eksotermis),
merupakan kondisi ideal dalam sulfonasi pada falling film reactor. Pada awal reaksi, terjadi kontak bahan dengan gas SO3 secara cepat hingga mencapai keseimbangan reaksi. Pada suhu tersebut dapat
menghasilkan MES dengan bahan aktif 30%-65% (Hambali et al., 2009).Metil ester sulfonat yang dihasilkan larut dalam air sehingga dapat menurunkan tegangan permukaan dan tegangan antar muka. Reaksi sulfonasi metil ester dengan gas SO3 dapat digambarkan sebagai berikut:
+ SO3 (I) + SO3 (II) (II) O CH3‐(CH2)7‐CH=CH‐(CH2)7‐(C‐OCH3):SO3 O CH3‐(CH2)7‐CH=CH‐(CH2)7‐C‐OCH3 O
CH3‐(CH2)7‐CH=CH‐(CH2)7‐(C‐OCH3):SO3 (III)
Gambar 10. Reaksi sulfonasi pembuatan MES (Watkins, 2001)
Kemampuan surfaktan MES dalam menurunkan tegangan antarmuka minyak-air disebabkan oleh kemampuan surfaktan MES dalam meningkatkan gaya tarik-menarik antara dua fasa yang berbeda polaritasnya. Hal ini terjadi karena struktur dari surfaktan yang memiliki dua gugus fungsional yang berbeda (Suryani et al., 2008). Fenomena tegangan antarmuka (Interfacial Tension, IFT) memiliki peran yang penting di dalam analisis surfaktan.
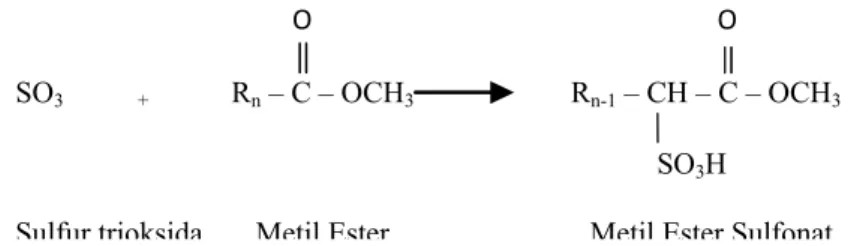
Pengotor utama dalam proses pembuatan MES adalah terbentuknya disalt pada proses hidrolisis saat reaksi penetralan. Walaupun disalt merupakan surfaktan, namun di-salt memiliki sifat yang tidak diinginkan, yaitu cenderung menurunkan kinerja MES. Kraft point C16 disalt (65 °C) lebih tinggi daripada C16 MES (17 °C) dan disalt lebih sensitif (tidak tahan) terhadap air sadah (Mac Arthur, 2002). Akibatnya kelarutan MES di dalam air sadah dan air dingin menjadi turun. Untuk itu diperlukan proses pemurnian C16 MES dan pengoptimalan kondisi proses produksi MES. Terbentuknya disalt terjadi pada saat proses netralisasi berlangsung dengan menggunakan sodium hidroksida (NaOH). Apabila NaOH ditambahkan dalam jumlah berlebih, maka ion Na+ akan
mensubsitusi gugus metil pada ester sehingga terbentuk molekul dengan dua gugus sodium yang disebut sebagai disalt seperti yang terlihat pada Gambar 11.
Gambar 11. Reaksi Kimia Pembentukan Disalt (Mac Arthur, 2002)
2.6. Proses Pemurnian (Bleaching-Netralisasi) Surfaktan MESA
Pemurnian merupakan suatu proses untuk meningkatkan kualitas suatu bahan agar mempunyai
O O
SO3 + Rn – C – OCH3 Rn-1 – CH – C – OCH3
SO3H
Sulfur trioksida Metil Ester Metil Ester Sulfonat
O O
NaOH + Rn – CH –C – OCH3 Rn-1 – CH – C – OCH3 + H2O (I)
SO3H SO3Na
Basa MESA Metil Ester Sulfonat Air
O O
NaOH + Rn – CH –C – OCH3 Rn-1 – CH – C – ONa + CH3OH (II)
SO3Na SO3Na
fisika. Pemurnian secara fisika memerlukan peralatan penunjang yang cukup spesifik, akan tetapi bahan yang dihasilkan baik, karena warnanya lebih jernih dan komponen utamanya menjadi lebih tinggi. Untuk metode pemurnian kimiawi bisa dilakukan dengan menggunakan peralatan yang sederhana dan hanya memerlukan pencampuran dengan adsorben atau senyawa pengomplek tertentu (Hernani, 2007).
Menurut Ketaren (1986), proses pemucatan (bleaching) merupakan suatu tahapan proses pemurnian surfaktan yang bertujuan untuk menghilangkan zat-zat warna yang tidak disukai dan menghilangkan bau. Dalam proses pemucatan ini, produk surfaktan MESA akan mengalami peningkatan/pencerahan warna.
Proses pemucatan bertujuan untuk membuat penampakan dan bau surfaktan yang lebih baik. Proses pemucatan dilakukan dengan pencampuran metanol dengan hidrogen peroksida (H2O2). Reaksi
bleaching lalu dilanjutkan dengan metanol reflux dan pengontrolan temperatur yang presisi. Acid
ester yang terbentuk dalam proses sulfonasi bersifat tidak stabil dan mudah terhidrolisis. Oleh karena itu, pencampuran yang sempurna antara asam sulfonat dan aliran basa dibutuhkan dalam proses netralisasi untuk mencegah lokalisasi kenaikan pH dan temperatur yang dapat mengakibatkan reaksi hidrolisis yang berlebih. Neutralizer beroperasi secara kontinu, mempertahankan komposisi dan pH dari pasta secara otomatis (Elefani, 2008).
Proses pemucatan dapat dilakukan dengan adsorben, bahan kimia, maupun dengan cara pemanasan. Pemucatan dapat juga dilakukan dengan cara mencampur produk dengan sejumlah kecil adsorben, seperti tanah lempung (feller earth), lempung aktif (activated clay), dan arang aktif atau dapat juga menggunakan bahan kimia lainnya (Ketaren, 1986)
Peristiwa adsorbsi dapat terjadi bila dua fase bergabung, sehingga terjadi suatu proses dimana molekul dari satu fase melekat pada permukaan fase lain. Kedua fase tersebut dapat berupa fase cair dengan fase cair, fase cair dengan fase gas, fase cair dengan fase padat, atau fase gas dengan fase padat (Priatna et al., 1990)
Pemucatan dengan bahan kimia pada umumnya dibagi atas 2 macam reaksi pemucatan, yaitu pemucatan dengan proses oksidasi dan pemucatan dengan proses reduksi. Pemucatan dengan menggunakan bahan kimia banyak digunakan karena pemucatan zat warna dengan menggunakan bahan kimia lebih baik dibandingkan dengan menggunakan adsorben. Keuntungan bahan kimia sebagai bahan pemucat adalah karena hilangnya sebagian produk dapat dihindarkan dan zat warna diubah menjadi zat yang tidak berwarna, yang tetap tinggal dalam produk (Djatmiko dan Ketaren, 1985)
2.7. Bahan Pemucat (Bleaching Agents)
Bahan pemucat (Bleaching agents) merupakan suatu bahan yang dapat memucatkan atau memudarkan warna suatu substrat melalui proses fisika dan kimia. Proses ini melibatkan proses oksidasi, reduksi, atau adsorbsi yang membuat bagian-bagian yang berwarna pada substrat menjadi lebih larut atau diserap sehingga mudah dihilangkan selama proses pemucatan. Pemucatan dapat juga melibatkan proses kimia yang mengubah kemampuan bagian molekul berwarna untuk menyerap cahaya, yaitu dengan mengubah derajat ketidakjenuhan (Kirk dan Othmer, 1964).
Karbon/arang aktif adalah suatu bentuk karbon yang telah diaktifkan menggunakan panas uap air atau bahan kimia sehingga daya penyerapannya tinggi. Karbon aktif mengandung 5 – 15% air, 2 – 3% abu dan sisanya terdiri dari karbon. Adsorbsi arang aktif disebabkan karena arang aktif memiliki pori-pori dalam jumlah besar dan proses ini terjadi karena adanya perbedaan energi potensial antara permukaan arang dan zat yang diserap (Jacobs, 1951).
Keuntungan penggunaan arang aktif sebagai bahan pemucat adalah lebih efektif untuk menyerap zat warna dibandingkan dengan bleaching clay, sehingga arang aktif dapat digunakan dalam jumlah kecil. Arang aktif dapat juga menyerap sebagian bau yang tidak dikehendaki dan mengurangi jumlah peroksida sehingga dapat meningkatkan mutu. Kelemahan arang aktif adalah proses autooksidasi terjadi lebih cepat (Ketaren, 1986).
Bentonit merupakan istilah dalam perdagangan untuk lempung mineral yang mengandung montmorilonit sebagai komponen utamanya (Kirk dan Othmer, 1985). Ukuran partikel bentonit sangat kecil dan mempunyai kapasitas penukar ion yang tinggi dengan pertukaran ion terutama diduduki oleh ion-ion Ca dan Mg. Bentonit berwarna dasar putih dengan sedikit kecoklatan atau kemerahan atau kehijauan tergantung dari jenis dan jumlah mineral-mineralnya. Selain itu, bentonit bersifat agak lunak, ringan, mudah pecah, terasa seperti sabun, mudah menyerap air dan dapat melakukan pertukaran ion (Priatna, 1982).
Bahan kimia yang bertindak sebagai pemucat/pemutih disebut dengan bleaching agents, seperti hidrogen peroksida, ammonium persulfat, azodicarbonamide, CaSO4, TiO2, Sodium Hypochlorite,
Isocyanurates and Cyanuric Acid, dan lain-lain. Dalam penggunaannya, efek pemutihan yang cukup
baik hanya diperoleh dengan larutan hidrogen peroksida yang cukup kuat. Berikut tabel perbedaan tingkat oksidasi berbagai bahan pemucat dalam proses pemucatan (Shafii, 2008).
Tabel 5. Nilai Potensial Oksidasi Bahan Pemucat (Shafii, 2008)
Oksidan Potensial Oksidasi, V
Fluorin 3.0 Hidroksil radikal 2.8 Ozon 2.1 Hidrogen peroksida 1.8 Potasium permanganate 1.7 Klorin dioksida 1.5 Klorin 1.4
Hidrogen peroksida merupakan oksidator yang lebih kuat dibandingkan dengan klorin, klorin dioksida dan potassium permanganate. Di samping itu dengan adanya katalis, H2O2 dapat dikonversi
menjadi hidroksi radikal dengan tingkat reaktivitas kedua setelah fluorin. Sementara fluorin lebih banyak diaplikasikan pada proses pengolahan limbah. Di beberapa industri penghasil detergen, dalam proses produksinya menggunakan beraneka ragam jenis bleaching agents sesuai dengan tujuan dan kebutuhannya. Beberapa bleaching agents yang dapat diaplikasikan dalam skala laboratorium, seperti Hidrogen peroksida (H2O2), Sodium hipoklorit, Asam Isosianurat dan Asam Sianurik (Shafii, 2008).
warna dari produk digunakan gas sulfur dioksida, sodium dioksida, sodium sulfit, sodium metabisulfit dan sodium hidrosulfit (Priatna, 1982).
2.8. Hidrogen Peroksida (H
2O
2)
Hidrogen peroksida adalah cairan bening, agak lebih kental daripada air, yang merupakan oksidator kuat. Sifatnya sebagai oksidator kuat ini dimanfaatkan manusia sebagai bahan pemutih (bleach), desinfektan, oksidator dan dapat digunakan sebagai bahan bakar roket. Sifat lainnya yaitu, berbau khas agak keasaman dan larut dengan baik dalam air. Dalam kondisi normal (kondisi ambient), hidrogen peroksida sangat stabil dengan laju dekomposisi kira-kira kurang dari 1% per tahun. Mayoritas penggunaan hidrogen peroksida adalah dengan memanfaatkan dan merekayasa reaksi dekomposisinya, yang intinya menghasilkan oksigen (Prasetyo, 2008).
Hidrogen peroksida dijual bebas, dengan berbagai merek dagang dalam konsentrasi rendah (3 – 5%) sebagai pembersih luka atau sebagai pemutih gigi (pada konsentrasi terukur). Dalam konsentrasi agak tinggi dijual sebagai pemutih pakaian dan desinfektan. Penggunaan hidrogen peroksida dalam kosmetika dan makanan tidak dibenarkan karena zat ini mudah bereaksi dengan rumus kimia H2O2
ditemukan oleh Louis Jacques Thenard di tahun 1818 (Prasetyo, 2008). Senyawa ini merupakan bahan kimia anorganik yang memiliki sifat oksidator kuat. Bahan baku pembuatan hidrogen peroksida adalah gas hidrogen (H2) dan gas oksigen (O2). Teknologi yang banyak digunakan di dalam industri
hidrogen peroksida adalah autooksidasi anthraquinone. Bentuk molekul hidrogen peroksida dapat dilihat pada Gambar 12. (Prasetyo, 2008).
Gambar 12. Molekul hidrogen peroksida (Prasetyo, 2008)
Stabilisasi dari hydrogen peroxide ini dapat dicapai pada tingkat keasaman atau pH stabil sehingga dapat memperlambat dekomposisi peroksida. Bleaching agent lain seperti Sodium
Hypochlorite digolongkan dalam bleaching agent untuk produk detergen yang banyak diaplikasikan
di Asia dan Amerika. Sedangkan Isocyanurates and Cyanuric Acid digunakan sebagai pembersih toilet dan sebagai pencegah adanya alga, jamur serta bakteri di kolam renang (Waldhoff and Rudiger, 2005).
Penguraian hidrogen peroksida menjadi air dan oksigen merupakan reaksi eksoterm (Wood et
al., 1966). Untuk menjaga kestabilan kondisi hidrogen peroksida dalam larutan yang dipasarkan
dalam dunia perdagangan bisa ditambahkan bahan stabilizer seperti Gliserin, Kalsium Klorida, atau Alkohol. Larutan hidrogen peroksida sendiri mempunyai sifat oksidator sekaligus reduktor kuat (Priyanto, 1990)
Na2O2 + H2SO4 Na2SO4 + H2O2
Gambar 13. Reaksi pembentukan hidrogen peroksida (Priyanto, 1990)
Larutan yang terbentuk kemudian dilakukan pemisahan dengan filtrasi dan destilasi. hidrogen peroksida hasil destilasi ini biasanya mempunyai konsentrasi 30 persen dan biasa disebut hidrogen peroksida Teknis atau “Perhidrol” (Durrant, 1960).
Menurut Wood et al.,(1966), sifat hidrogen peroksida mempunyai kecenderungan yang kuat untuk membebaskan oksigen, maka bahan ini merupakan bahan yang istimewa, karena bisa digunakan untuk reaksi oksidasi pada suhu rendah. Persamaan reaksi proses pemutihan oleh hidrogen peroksida dapat dilihat pada Gambar 14.
H2O2 + X H2O + XO
(Dark pigmen) (pigmen terokdisasi)
Gambar 14. Reaksi pemucatan oleh hidrogen peroksida (Wood et al.,1966)
Hidrogen peroksida bisa digunakan sebagai zat pengelantang atau bleaching agent pada industri pulp, kertas dan tekstil. Senyawa ini juga biasa dipakai pada proses pengolahan limbah cair, industri kimia, pembuatan deterjen, makanan dan minuman, medis, serta industri elektronika (pembuatan PCB). Hidrogen peroksida bersifat oksidator dan akan merusak ikatan rangkap pigmen menjadi komponen yang tidak berwarna. Aktivitas ini meningkat dengan semakin meningkatnya konsentrasi H2O2 (Wood et al., 1966).