TESIS
KADAR
GLUCAGON LIKE PEPTIDE-1
(GLP-1) DAN
INSULIN
POSTPRANDIAL
PADA PENDERITA
DIABETES MELITUS TIPE II TERKENDALI DAN
TIDAK TERKENDALI DENGAN OBAT
HIPOGLIKEMIK ORAL
PETRUS IRIANTO
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
i
TESIS
KADAR GLUCAGON LIKE PEPTIDE-1 (GLP-1) DAN
INSULIN POSTPRANDIAL PADA PENDERITA
DIABETES MELITUS TIPE II TERKENDALI DAN
TIDAK TERKENDALI DENGAN OBAT
HIPOGLIKEMIK ORAL
PETRUS IRIANTO NIM 0914048104
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
DENPASAR
ii
KADAR GLUCAGON LIKE PEPTIDE-1 (GLP-1) DAN
INSULIN POSTPRANDIAL PADA PENDERITA
DIABETES MELITUS TIPE II TERKENDALI DAN
TIDAK TERKENDALI DENGAN OBAT
HIPOGLIKEMIK ORAL
Tesis untuk Memperoleh Gelar Magister pada Program Magister, Program Combined Degree,
Program Pascasarjana Universitas Udayana
PETRUS IRIANTO NIM 0914048104
PROGRAM MAGISTER
PROGRAM STUDI ILMU BIOMEDIK
PROGRAM PASCASARJANA
UNIVERSITAS UDAYANA
DENPASAR
2016
iii
TESIS INI TELAH DISETUJUI
TANGGAL 4 Pebruari 2016
Pembimbing I,
Prof.Dr.dr AAG. Budhiarta, Sp.PD- KEMD, FINASIM NIP. 19441221 197206 1001
Pembimbing II,
Dr.dr. Made Ratna Saraswati, Sp.PD-KEMD, FINASIM NIP. 197006272003122001
Mengetahui
Ketua Program Studi Ilmu Biomedik Program Pascasarjana
Universitas Udayana
Dr. dr. Gde. Ngurah Indraguna Pinatih,MSc,Sp.GK NIP. 195805211985031002
Direktur Program Pascasarjana
Universitas Udayana
iv
Tesis Ini Telah Diuji pada
Tanggal………..
Panitia Penguji Tesis Berdasarkan SK Rektor
Universitas Udayana,
No : 725/UN14.4/HK/2016.,Tanggal 2 Pebruari 2016…… …………
Ketua : Prof. Dr. dr. AAG. Budiartha, Sp.PD-KEMD, FINASIM
Anggota :
1. Dr. dr. Made Ratna Saraswati, Sp.PD-KEMD,FINASIM
2. Prof. dr. Nyoman Agus Bagiada, Sp.BIOK
3. Prof. Dr. dr. J. Alex Pangkahila, M.SC.,Sp.And
vi
UCAPAN TERIMA KASIH
Pertama-tama perkenankanlah penulis memanjatkan puji syukur ke hadapan
Ida Sang Hyang Widhi Wasa/ Tuhan Yang Maha esa, karena hanya atas asung wara
nugraha-Nya/ kurnianya, tesis ini dapat diselesaikan.
Pada kesempatan ini perkenankanlah penulis mengucapkan terimakasih yang
sebesar- besarnya kepada Prof. Dr. dr. AAG. Budiarta SpPD KEMD, FINASIM
pembimbing I yang dengan penuh perhatian telah memberikan dorongan, semangat,
bimbingan, dan saran selama penulis mengikuti program magister, khususnya dalam
penyelesaian tesis ini. Terima kasih sebesar-besarnya pula penulis sampaikan kepada
Dr.dr. Made Ratna Saraswati SpPD KEMD,FINASIM pembimbing II yang dengan
penuh perhatian dan kesabaran telah memberikan bimbingan dan saran kepada
penulis.
Ucapan yang sama juga ditujukan kepada Rektor Universitas Udayana Prof.
Dr. dr. Ketut Suastika SpPD KEMD, FINASIM atas kesempatan dan fasilitas yang
diberikan kepada penulis untuk mengikuti dan menyelesaikan pendidikan Program
Magister di Universitas Udayana. Ucapan terimakasih ini juga ditujukan kepada
Direktur Program Pascasarjana Universitas Udayana yang dijabat Prof. Dr. dr. A.A.
Raka Sudewi, Sp.S (K) atas kesempatan yang diberikan kepada penulis untuk
menjadi mahasiswa Program S2 pada Program Pascasarjana Universitas Udayana.
Tidak lupa penulis ucapkan terimakasih kepada Prof. Dr. dr. Putu Astawa, SpOT,
M.Kes, Dekan Fakultas Kedokteran Universitas Udayana atas ijin yang diberikan
kepada penulis untuk mengikuti pendidikan program magister. Pada kesempatan ini,
penulis juga menyampaikan rasa terimakasih kepada Kepala Program Studi Ilmu
vii
SpPD KHOM selaku Kepala Laboratorium Ilmu Penyakit Dalam RSUP Sanglah
Denpasar. Ungkapan terima kasih penulis sampaikan pula kepada para penguji, yaitu
Prof. dr. Nyoman Agus Bagiada Sp.BIOK, Prof. Dr. dr. Alex Pangkahila
M.SC.,Sp.And dan Dr.dr. Ida Sri Iswari SpMK.,M.Kes, yang telah memberikan
masukan, saran, sanggahan, dan koreksi sehingga tesis ini dapat terwujud seperti ini.
Pada kesempatan ini ijinkan juga penulis mengucapkan terima kasih dan
penghormatan yang tulus kepada Prof. Dr. dr Tjok Raka Putra, SpPD-KR, sebagai
mantan Kepala Bagian /SMF Ilmu Penyakit Dalam FK Unud/ RSUP Sanglah dan
Prof. Dr. dr Ketut Suwitra, SpPD-KGH sebagai mantan Ketua Program Studi Ilmu
Penyakit Dalam FK Unud/ RSUP Sanglah yang pada masanya telah memberi
kesempatan kepada penulis untuk mengikuti pendidikan spesialisasi. Penulis juga
memberikan ucapan yang sama kepada Dr.dr. Wayan Sudhana, SpPD-KGH sebagai
pembimbing akademik penulis atas arahan dan bimbingan selama mengikuti
pendidikan spesialis Ilmu Penyakit Dalam.
Pada kesempatan ini penulis menyampaikan ucapan terima kasih yang tulus
disertai penghargaan kepada seluruh guru-guru yang telah membimbing penulis,
mulai dari sekolah dasar sampai perguruan tinggi. Juga penulis ucapkan terima kasih
kepada kedua orang tua, Bpk. Samuel Patoding dan Ny. Ludya Roteng serta kedua
mertua penulis, Bpk. Bitti Pagiling dan Ny. Ludwina Patiung yang telah memberikan
motivasi dan nasehat kepada penulis. Akhirnya penulis sampaikan terima kasih
kepada istri tercinta dr. Irmanty Patiung, serta ananda Matthew Lionel Patoding
tersayang, yang dengan penuh pengorbanan telah sabar menunggu dan memberikan
dukungan kepada penulis untuk menyelesaikan tesis ini. Penulis juga mengucapkan
viii
dr. Hendrata Erry A, dr. Baskoro Trilaksono, dr. Anselmus Ake dan dr. Yosef Samon
Sugi serta teman-teman lainnya, terimakasih atas motivasi dan persahabatan yang
kalian berikan selama ini. Juga kepada paramedis, staf tata usaha Bagian /SMF Ilmu
Penyakit Dalam FK Unud/ RSUP Sanglah atas segala bantuan serta kerjasama yang
baik selama menjalani pendidikan spesialis Ilmu Penyakit Dalam.
Semoga Ida Sang Hyang Widhi Wasa/ Tuhan Yang Mahaesa selalu
melimpahkan rahmat-Nya kepada semua pihak yang telah membantu pelaksanaan
dan penyelesaian tesis ini, serta kepada penulis sekeluarga.
Denpasar, 4 februari 2016
ix ABSTRAK
KADAR GLUCAGON LIKE PEPTIDE-1 (GLP-1) DAN INSULIN
POSTPRANDIAL PADA PENDERITA DIABETES MELITUS TIPE
II TERKENDALI DAN TIDAK TERKENDALI DENGAN OBAT
HIPOGLIKEMIK ORAL
Diabetes melitus tipe II merupakan salah satu penyakit metabolik yang angkanya terus bertambah seiring dengan pertumbuhan ekonomi dan perubahan pola hidup. Pengobatan DMT2 khususnya dengan metformin baik sebagai monoterapi maupun kombinasi dengan terapi lain telah banyak dilaporkan mengalami kegagalan, sehingga saat ini banyak dikembangkan terapi baru; salah satunya agonis GLP-1 yaitu suatu hormon inkertin yang disekresikan oleh sel L usus yang terutama menurunkan glukosa postprandial dan saat ini dipandang sebagai terapi ideal pada DMT2.
Tujuan penelitian ini untuk mengetahui perbedaan kadar GLP-1 postprandial dan insulin postprandial antara DMT2 yang terkendali dan tidak terkendali terapi OHO, melihat korelasi antara kadar GLP-1 postprandial dengan kadar insulin
postprandial pada DMT2 yang terkendali dan tidak terkendali terapi OHO dengan
rancangan observasional potong lintang analitik yang dilaksanakan di Rumah Sakit Sanglah Denpasar. Subjek penelitian melibatkan 25 orang masing-masing kelompok,
matching umur dan jenis kelamin, berumur lebih 30 tahun, rasio laki : perempuan
32:18. Kelompok penderita DMT2 tidak terkendali terapi OHO adalah penderita DMT2 yang menggunakan terapi OHO (metformin dan SU) selama 3 bulan terakhir
dengan HbA1C ≥ 7%. Sedangkan kelompok penderita DMT2 terkendali terapi OHO
adalah penderita DMT2 yang menggunakan terapi OHO (metformin dan SU) selama 3 bulan terakhir dengan HbA1C < 7%.
Dari 50 subjek penelitian didapatkan rerata umur pada kedua kelompok 54,4 ± 8,0 tahun, lama sakit DM 7,3 ± 7,1 tahun, kadar gula darah puasa 152,3 ± 48 mg/dl, kadar gula darah postprandial 243,1 ± 52,8 mg/dl, IMT 27 ± 4,1 kg/m2,
GLP-1 postprandial 2,3 ± 0,8 ng/ml, insulin postprandial 32,8 ± 20,2 µIU/ml. Pada
penelitian ini tidak didapatkan perbedaan yang bermakna antara kadar GLP-1
postprandial kelompok terkendali dan tidak terkendali terapi OHO (p= 0,65). Tidak
didapatkan juga perbedaan yang bermakna antara kadar insulin postprandial kelompok terkendali dan tidak terkendali terapi OHO (p= 0,56), sedangkan korelasi antara kadar GLP-1 postprandial dengan insulin postprandial pada kedua kelompok didapatkan tidak bermakna, (p= 0,50) dan (p= 0,24).
Pada penelitian ini tidak didapatkan perbedaan kadar GLP-1 dan insulin
postprandial antara kedua kelompok. Korelasi yang tidak bermakna antara GLP-1
x ABSTRACT
POST PRANDIAL GLUCAGON LIKE PEPTIDE-1 (GLP-1) LEVELS AND PLASMA INSULIN IN PATIENTS TYPE 2 DIABETES MELLITUS WITH
CONTROLLED AND UNCONTROLLED ORAL ANTI DIABETIC
Type II Diabetes mellitus (T2DM) is a metabolic disease which numbers continue to grow in line with economic growth and changes in lifestyle. Treatment of T2DM in particular either metformin as monotherapy or combination with other therapy have been widely reported to have failed, so that many new therapies are developed; one to be mentioned is GLP-1 agonist, an incretin hormone secreted by intestinal L cells that primarily lowers postprandial glucose and is now seen as an ideal therapy in for T2DM.
The aim of this study were to determine differences in the levels of GLP-1 postprandial and insulin postprandial between type 2 diabetes who controlled and uncontrolled with therapy, to understand the correlation between the levels of GLP-1 postprandial and the levels of insulin postprandial in type 2 diabetes in patients who controlled and uncontrolled with therapy with OAD with using observational cross-sectional analysis and implemented in Sanglah Hospital Denpasar. Subject of the study is involving 25 people each group, matching age and gender, in which age over 30 years, the ratio of male: women is 32:18. The group of patients with type 2 diabetes uncontrolled with OAD therapies, is the group using OAD therapy (metformin and SU) during the last 3 months with HbA1c ≥ 7%. While the group of patients with type 2 diabetes controlled with OAD therapies is the group using OAD therapy (metformin and SU) during last 3 months with HbA1c < 7%.
Fifty research subjects are devided in both groups the mean age 54.4 ± 8.0 years, disease duration 7.3 ± 7.1 years DM, of whose fasting blood glucose levels 152.3 ± 48 mg / dl, postprandial blood glucose level 243, 1 ± 52.8 mg / dl, BMI 27 ± 4.1 kg / m2, postprandial GLP-1 2.3 ± 0.8 ng / ml, postprandial insulin 32.8 ± 20.2 μIU / ml. In the present study there is no significant difference in the levels of postprandial GLP-1 between controlled and uncontrolled with OAD therapy group (p = 0.65), and there is no significant differences in postprandial insulin levels between controlled and uncontrolled OAD therapy group (p = 0.56). As well as the correlation between postprandial levels of GLP-1 and postprandial insulin in both groups showed that there was no significant difference, (p = 0.50) and (p = 0.24).
In this study found no difference in the levels of GLP-1 and insulin postprandial between the two groups. No significant correlation between GLP-1 and insulin postprandial in both groups. Nevertheless from the distribution pattern of data without any difference, it apparently is affected efficacy of metformin, a good lifestyle, and the possibility of a less number of samples.
xi
DAFTAR ARTI LAMBANG, SINGKATAN, DAN ISTILAH ... xvii
DAFTAR LAMPIRAN ... xix
2.5.1 Penemuan Hormon Inkretin ... 19
2.5.2 Struktur GLP-1 ... 22
2.5.3 Sekresi dan regulasi GLP-1 ... 22
2.5.4 Metabolisme GLP-1 ... 24
xii
2.5.6 Mekanisme Kerja GLP-1 pada sel Beta Pankreas ... 25
2.6 Hubungan GLP-1 dan Sekresi Insulin Postprandial ... 27
2.7 Terapi DMT2.. ... 28
BAB III KERANGKA BERPIKIR, KONSEP, DAN HIPOTESIS PENELITIAN 41 3.1 Kerangka Berpikir ... 41
4.4.2.1.1 Kriteria Inklusi Penelitian ... 45
4.4.2.1.2 Kriteria Eksklusi Penelitian ... 45
4.4.2.2 Besaran Sampel Penelitian ... 45
xiii
4.5 Variabel Penelitian ... 46
4.5.1 Klasifikasi dan Identifikasi Variabel ... 46
4.5.2 Definisi Oprasional variabel ... 46
4.6 Bahan dan Instrumen Penelitian ... 49
4.7 Prosedur Penelitian ... 49
4.8 Analisis Data ... 51
BAB V HASIL DAN PEMBAHASAN ... 53
BAB VI SIMPULAN DAN SARAN ... 62
DAFTAR PUSTAKA ... 64
xiv
DAFTAR TABEL
Tabel 2.1 Kriteria diagnosis DMT2 ... 9
Tabel 5.1 Karakteristik penelitian ... 55
Tabel 5.2 Hasil analisa uji beda kadar GLP-1 postprandial dan Insulin
postprandial pada kedua kelompok ... 56
Tabel 5.3 Korelasi kadar GLP-1 postprandial dan Insulin postprandial pada
xv
DAFTAR GAMBAR
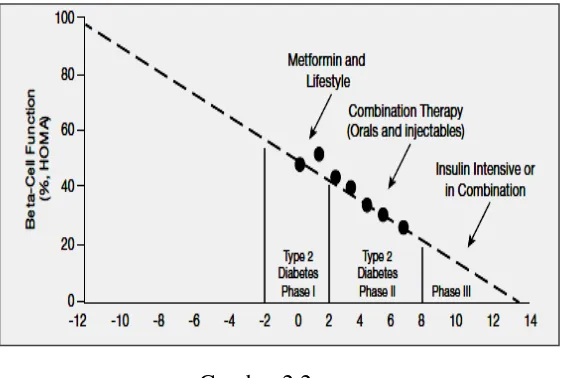
Gambar 2.1 Perjalanan Progresifitas DMT2 ... 11
Gambar 2.2 Perjalanan Terapi Pada DMT2 ... 12
Gambar 2.3 Struktur Insulin Manusia ... 13
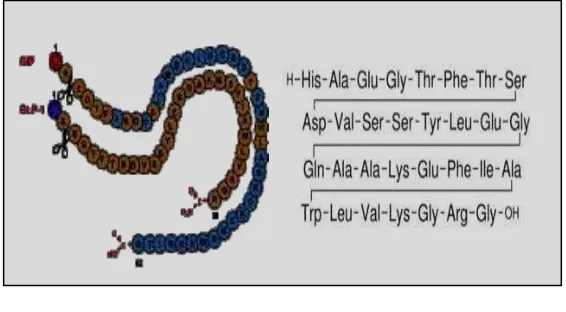
Gambar 2.4 Struktur GLP-1 ... 22
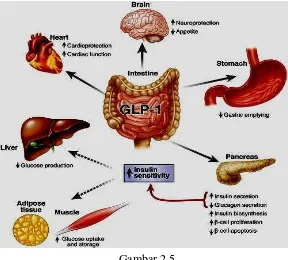
Gambar 2.5 Fisiologis GLP-1 dalam Menurunkan Kadar Glukosa ... 25
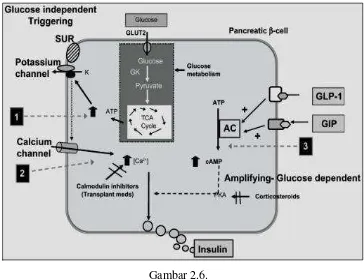
Gambar 2.6 Mekanisme Kerja GLP-1 pada sel B Pankreas ... 26
Gambar 2.7 Efek GLP-1 terhadap Sekresi Insulin postprandial ... 28
Gambar 2.8 Penurunan Respon Sekresi GLP-1 postprandial ... 28
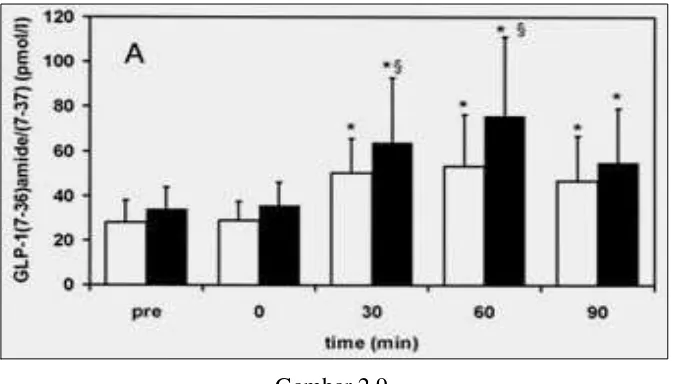
Gambar 2.9 Pemberian metformin meningkatkan kadar GLP-1 ... 32
Gambar 2.10 Rekomendasi Umum Terapi Antihiperglikemia pada DMT2 .... 33
Gambar 3.1 Konsep Penelitian ... 42
Gambar 4.1 Bagan Rancangan Penelitian ... 43
Gambar 4.2 Alur Penelitian... 51
Gambar 5.1 Pola sebaran data kadar GLP-1 postprandial pada kedua kelompok ... 56
xvi
DAFTAR ARTI LAMBANG, SINGKATAN, DAN ISTILAH
DM : Diabetes Melitus
UKPDS : United Kingdom Prospective Diabetes Study
DMT2 : Diabetes Melitus Tipe 2
OHO : Obat Hipoglikemik Oral
GLP-1 : Glukagon Like Peptide-1
TTGO : Tes Toleransi Glukosa Oral
WHO : World Health Organization
HbA1C : Glycosylated Hemoglobin
c-AMP : Cyclic Adenosine Monophosphate
NADPH : Nicotinamide Adenine Dinucleotide Phosphate
PEPCK : Phosphoenolpyruvate Carboxykinase
RNA : Ribonucleic Acid
mRNA : Mesengger Ribonucleic Acid
DNA : Deoxyribonucleic Acid
TNF a : Tumor Necrosis Factor Alpha
GLUT-4 : Glucose Transporter Type- 4
sdLDL : small Dense Low-Density Lipoprotein
IKK-beta : Inhibitor of Nuclear Factor Kappa-B Kinase Subunit Beta
NF Kappa B : Nuclear Factor Kappa-light-chain-enhancer of Activated B cells
NAFLD : Non-Alcoholic Fatty Liver Disease
GIP : Gastric Inhibitory Polypeptide
GRP : Glucose-Regulated Protein
xvii NH2 : Amidogen
NEP 24.11 : Neutral Endopeptidase 24.11
GPCRs : G Protein-Coupled Receptors
PKA : Protein Kinase A
K-ATP : ATP-Sensitive Potassium Channel
PI3K : Phosphatidylinositol-4,5-bisphosphate 3-kinase
MAPK : Mitogen-Activated Protein Kinases
ERK : Extracellular-signal-Regulated Kinases
PKC : Protein Kinase C
PKB : Protein Kinase B
SNARE : Solubel NSF Attachment Protein Reseptor
SNAP-25 : Synaptosomal-Associated Protein 25
IVGTT : Intravenous Glucose Tolerance Test
GLUT-2 : Glucose Transporter 2
GCK : Glucokinase
PDX-1 : Pancreatic and Duodenal Homeobox 1
DCCT : Diabetes Control and Complication Trial
ADA : American Diabetes Association
TZD : Thiazolidinedione
GLPr : Glukagon Like Peptide Reseptor
xviii
DAFTAR LAMPIRAN
Lampiran 1 : Keterangan Kelaikan Etik ... 72
Lampiran 2 : Surat Ijin Penelitian. ... 73
Lampiran 3 : Informasi Penelitian ... 74
Lampiran 4 : Formulir Persetujuan.. ... 76
Lampiran 5 : Jadwal Penelitian dan Anggaran Biaya Penelitian ... 77
Lampiran 6 : Formulir Pengumpulan Data ... 78
Lampiran 7 : Prosedur Pemeriksaan Kadar GLP-1 postprandial ... 81
Lampiran 8 : Prosedur Pemeriksaan Kadar Insulin postprandial ... 84
Lampiran 9 : Hasil Penelitian ... 86
1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Kemajuan teknologi dan ilmu pengetahuan membuat perubahan besar dalam
peradaban manusia. Perubahan dari pola agraris menuju industrial membuat banyak
dampak pada aspek-aspek kehidupan. Seiring perubahan itu, dalam dunia kesehatan
pun terjadi suatu transformasi pola penyakit dengan makin tingginya angka kejadian
penyakit endokrin dan metabolisme. Penyakit diabetes melitus (DM) kini
merupakan salah satu masalah potensial dalam dunia kedokteran dengan angka
kejadian yang makin meningkat.
Data dari United Kingdom prospective diabetes Study (UKPDS) tahun
2011, diabetes melitus tipe 2 (DMT2) meliputi lebih dari 90% dari semua populasi
diabetes. Prevalensi DMT2 pada bangsa kulit putih berkisar antara 3-6% dari orang
dewasa. Prevalensi DMT2 dilaporkan lebih dari 40% adalah dewasa dengan umur
lebih dari 40 tahun, rata-rata prevalensi di Amerika Latin antara 15-41% orang
dewasa dengan umur lebih dari 45 tahun dengan gaya hidup barat dan sebesar 3%
yang menderita DMT2 dengan gaya hidup setempat (UKPDS, 2011). Dari data
Diabetes Control and Complications Trial Research Group (DCCT) tahun 2003,
prevalensi umur 30-64 tahun di Kepulauan pasifik Kiribati dan Samoa barat
11-16%, dan Melanesian Papua New Guinea 37%. Sedangkan prevalensi DM di
Indonesia dilaporkan sebesar 6,15% di Manado, Jakarta sebesar 12,8%, Jawa Barat
sebesar 1,1%, dan Makasar sebesar 2,9% (Soegondo, 2004). Sedangkan data tahun
2
penduduk usia 20-79 tahun penderita DMT2 dan akan meningkat menjadi 5,1 juta
penderita DMT2 pada 2025 (Chan dkk., 2009).
Metformin dipergunakan sebagai dasar terapi pada penderita DMT2 karena
sifat kerjanya yang menurunkan pengeluaran glukosa hati dan kadar glukosa puasa
serta mudah ditolerir oleh kebanyakan penderita, disamping harganya yang murah.
Monoterapi metformin menurunkan HbA1C sebesar 1,5%, sehingga tidak cukup
kuat mencapai dan mempertahankan target yang diharapkan. Untuk itulah
diperlukan penambahan terapi lini kedua; terapi lini kedua yang sering
dipergunakan adalah golongan sulfonilurea (SU); sulfonilurea mempunyai efek
meningkatkan sekresi insulin dari pankreas dan dapat menurunkan HbA1C sebesar
1,5% dengan harga yang cukup murah (Nathan dkk., 2008).
Penggunaan SU sebagai terapi lini kedua awalnya dianggap dapat menjadi
solusi dari keterbatasan monoterapi metformin, sehingga kombinasi keduanya telah
lama menjadi tulang punggung penanganan DMT2 (ADA, 2014). Namun,
kombinasi keduanya ternyata meningkatkan efek samping yang merugikan bagi
penderita. Sebagai contoh, hipoglikemia dapat menjadi efek samping yang tidak
menyenangkan dari terapi obat hipoglikemik oral (OHO) yang bisa mempengaharui
kepatuhan penderita terhadap pengobatan, bahkan kejadian hipoglikemik serius
yang dapat menyebabkan hilangnya kesadaran, kerusakan otak ataupun kematian.
Penambahan berat badan sebagai konsekuensi dari pengobatan SU atau insulin,
dapat mengurangi kualitas hidup dan menghambat kepatuhan terhadap pengobatan.
Obesitas juga merupakan faktor risiko independen untuk penyakit jantung (Hubert
3
Target glisemik yang diharapkan adalah HbA1C < 7 %, karena dapat
menggambarkan kadar glukosa darah dalam 3 bulan terakhir (ADA, 2014). Tidak
terpenuhinya target ini dapat disebabkan karena pada DMT2 kapasitas fungsional
sel beta pankreas sudah sangat menurun, sehingga pemakaian OHO khususnya SU
sudah tidak efektif lagi memacu produksi insulin (Han dkk., 2008; Odegard, 2007).
Hal ini juga telah dibuktikan pada A Diabetes outcome Progression Trial (ADOPT)
yang menyebutkan banyaknya kejadian gagalnya kendali glisemik pada terapi OHO
pada penderita DMT2 (Kahn dkk., 2011). Hal ini menyebabkan pencarian jenis obat
lain yang dapat dipergunakan untuk alternatif terapi non insulin baik sebagai
pengganti SU dalam lini kedua maupun sebagai obat ketiga dalam kombinasi
metformin-SU.
Tantangan terbesar dalam mengobati penderita dengan DMT2 adalah
mengoptimalkan terapi untuk dapat mengatasi kebutuhan yang tak terpenuhi
berupa: tercapainya kendali glikemik tanpa menimbulkan hipoglikemia,
mempertahankan fungsi dan massa sel beta, tidak meningkatkan berat badan,
mengurangi faktor risiko kardiovaskular yang menyertai DMT2, serta menawarkan
obat yang sederhana serta fleksibel (Hubert dkk., 2013; Han dkk., 2008; Odegard,
2007).
Penemuan inkretin merupakan suatu langkah penting dalam perkembangan
terapi DMT2. Inkretin adalah hormon yang dilepaskan dari usus sebagai respon diet
yang mengandung glukosa dan meningkatkan sekresi insulin dari pankreas
(Hansotia dkk., 2004). Penemuan inkretin diketahui dari pengamatan bahwa
pemberian suatu beban glukosa oral menyebabkan rangsangan yang jauh lebih besar
4
dkk., 2012). Hubungan antara usus dan pulau pankreas ini disebut sebagai axis
enteroinsular dan berperan terhadap 50% dari sekresi insulin postprandial (Parley
dan Kipnis, 2007).
Inkretin pertama yang berhasil diisolasi adalah Glucoce dependent
insulinotropic peptide (GIP). GIP dilepaskan dari enteroendokrin Sel K dalam
duodenum, terutama setelah konsumsi glukosa atau lemak (Yip dan Wolfe, 2000;
Ross dkk., 2008) dan meningkatkan sekresi insulin tergantung glukosa (Pederson
dkk., 2005; Dupre dkk., 2003). Kemudian diikuti penemuan Glukagon Like Peptide
1 (GLP-1); suatu peptide yang banyak dihasilkan oleh usus dan otak, yang
memegang peranan penting dalam metabolisme glukosa sehingga sangat esensial
pada toleransi glukosa normal (Drucker, 2007). GIP dan GLP-1 adalah hormon
inkretin yang paling banyak diketahui, memiliki efek kerja yang hampir sama
kecuali efek penghambatan sekresi glukagon yang hanya dimiliki GLP-1 (Holst
dkk., 2009).
Efek GLP-1 pada reseptor sel beta meningkatkan sekresi insulin dari sel beta
pankreas setelah proses pencernaan makanan (Nauck dkk, 2008; Drucker, 2007).
GLP-1 juga menekan pelepasan glukagon dari pankreas (Zander dkk., 2002;
Marathe dkk., 2011). Penurunan kadar glukagon akan meningkatkan kendali
terhadap glukosa darah (Holst dkk., 2009; Zander dkk., 2002). GLP-1 memiliki
kemampuan untuk melestarikan fungsi sel beta dengan menekan apoptosis sel beta
dengan merangsang neogenesis dan proliferasi sel beta pankreas (Bulotta dkk.,
2002, Farilla, 2003). GLP-1 menekan nafsu makan (Zander dkk., 2002) dan
5
mempunyai efek perlindungan pada miokardium, terutama pada kondisi iskemik
(Buse dkk., 2011; Thraindottir dkk., 2005; Nikolaidis dkk., 2004). Peningkatan
fungsi endotel juga telah dilaporkan (Nystrom dkk., 2004; Patel dkk., 2007).
Sehingga obat-obat terbaru berdasarkan kerja GLP-1 dianggap terapi ideal non
insulin sebagai pengganti maupun subtitusi kombinasi SU-metformin, walaupun
memiliki kelemahan dari segi biaya yang lebih mahal (ADA, 2014).
Inkretin sebagai hormon yang berperan dalam pengaturan kadar glukosa
postprandial melalui perangsangan sekresi insulin, ternyata didapatkan menurun
pada penderita DMT2. Hal ini dibuktikan oleh beberapa penelitian: pertama, bahwa
sekresi GLP-1 sebagai respon terhadap makanan pada DMT2 mengalami penurunan
(Nauck dkk., 2006; Visboll dkk., 2001; Muscelli dkk., 2008; Toft Nielsen dkk.,
2001; Rask dkk., 2001), walaupun penemuan ini tidak seragam (Vollmer dkk.,
2008; Meier dan Nauck, 2004). Kedua, sensitivitas sekresi insulin terhadap GLP-1
eksogen menurun pada penderita DMT2 (Kjeems dkk., 2003). Ketiga, terjadi
penurunan stimulasi sekresi insulin selama absorbsi glukosa di usus, yang
menguatkan bukti bahwa GLP-1 tidak normal pada penderita diabetes melitus
(Nauck dkk., 2006; Visboll dkk., 2001; Muscelli dkk., 2008; Toft Nielsen dkk.,
2001; Rask dkk., 2001). Hal ini selaras dengan temuan Lastya dkk (2014) bahwa
pada penderita DMT2 di indonesia juga dijumpai penurunan kadar GLP-1, hanya
saja penelitian-penelitian tersebut tidak spesifik pada populasi DMT2 tidak
terkendali OHO, sehingga penelitian ini bertujuan untuk mencari bagaimanakah
perbedaan kadar GLP-1 antara penderita DMT2 tidak terkendali dan DMT2
6
1.2 Rumusan Masalah
Berdasarkan uraian dan latar belakang tersebut di atas maka dapat dirumuskan
masalah sebagai berikut :
1. Apakah ada perbedaan kadar GLP-1 postprandial antara penderita DMT2
terkendali dan tidak terkendali terapi OHO?
2. Apakah ada perbedaan kadar insulin postprandial antara penderita DMT2
terkendali dan tidak terkendali terapi OHO?
3. Apakah ada hubungan antara kadar GLP-1 postprandial dan kadar Insulin
plasma postprandial pada penderita DMT2 terkendali terapi OHO?
4. Apakah ada hubungan antara kadar GLP-1 postprandial dan kadar Insulin
plasma postprandial pada penderita DMT2 tidak terkendali terapi OHO?
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut :
- Untuk mengetahui perbedaan kadar GLP-1 postprandial antara penderita
DMT2 terkendali dibandingkan tidak terkendali terapi OHO.
- Untuk mengetahui perbedaan kadar Insulin postprandial antara penderita
DMT2 terkendali dibandingkan tidak terkendali terapi OHO.
- Untuk mengetahui hubungan antara kadar GLP-1 postprandial dan insulin
postprandial pada penderita DMT2 terkendali terapi OHO.
- Untuk mengetahui hubungan antara kadar GLP-1 postprandial dan Insulin
7
1.4 Manfaat Penelitian
1.4.1 Manfaat Akademik
Penelitian ini merupakan penelitian analitik yang hasilnya dapat menambah
pengetahuan kita tentang bagaimana perbedaan antara kadar GLP-1 postprandial
dan Insulin plasma postprandial pada penderita DMT2 terkendali dan tidak
terkendali terapi terapi OHO.
1.4.2 Manfaat Klinis Praktis
Dengan mengetahui adanya perbedaan antara kadar GLP-1 postprandial dan
Insulin plasma postprandial pada penderita DMT2 terkendali dan tidak terkendali
terapi OHO, diharapkan dapat lebih menyokong pemberian terapi berbasis inkretin
1
BAB II
TINJAUAN PUSTAKA
2.1 Diabetes Melitus
Diabetes melitus adalah suatu kelompok penyakit metabolik dengan
karakteristik hiperglikemia yang terjadi karena kelainan sekresi insulin, kerja
insulin atau keduanya. Diabetes melitus tipe 1 mempunyai latar belakang kelainan
berupa kurangnya insulin secara absolut akibat proses autoimun, sedangkan
diabetes melitus tipe 2 mempunyai latar belakang resistensi insulin. Pada awalnya
resistensi insulin belum menyebabkan klinis diabetes. Sel beta pankreas masih
dapat mengkompensasi, sehingga terjadi hiperinsulinemia, kadar glukosa darah
masih normal atau sedikit meningkat, selanjutnya terjadi kelelahan sel beta
pankreas, baru terjadi DMT2 yang ditandai dengan peningkatan kadar glukosa
darah (ADA, 2014). Penderita DMT2 mengalami penurunan sensitivitas insulin
terhadap kadar glukosa, yang berakibat kadar glukosa yang tinggi. Keadaan ini
disertai dengan ketidakmampuan otot dan jaringan lemak untuk meningkatkan
ambilan glukosa, sehingga mekanisme ini menyebabkan meningkatnya resistensi
insulin perifer (Perkeni, 2014).
Diabetes melitus adalah suatu penyakit metabolik dengan karakteristik
hiperglikemia sebagai akibat dari kelainan sekresi insulin, kerja insulin atau
keduanya (Abate dan Chandalia, 2001). Diabetes Melitus merupakan masalah
kesehatan yang komplek karena didalamnya terdapat peran berbagai problematika
fisiologi dan biokimia akibat kondisi dimana terdapat defisiensi insulin dan
gangguan fungsi insulin. Meningkatnya angka kejadian DMT2 banyak dipengaruhi
2
oleh pola hidup diabetogenik, yang melengkapi defek genetik yang sebelumnya
telah ada pada sel beta pankreas. Beberapa gaya hidup yang dimaksud adalah
asupan kalori yang berlebihan oleh karena cara makan atau pola makan yang salah,
mengkonsumsi banyak makanan tinggi kalori, serta pengeluaran kalori yang tidak
memadai terutama pada mereka yang jarang berolah raga dan aktifitas di luar
ruangan yang minimal (Meier dkk., 2011).
Tabel.2.1.
Kriteria diagnosis DM (Perkeni, 2014)
1. Gejala klasik DM + glukosa plasma sewaktu ≥ 200 mg/dl (11,1 mmol/L)
Glukosa plasma sewaktu merupakan hasil pemeriksaan sesaat pada suatu hari
tanpa memperhatikan waktu makan terakhir
atau
2. Gejala klasik DM + glukosa plasma puasa ≥ 126 mg/dl (7.0 mmol/L)
Puasa diartikan penderita tak mendapat kalori tambahan sedikitnya 8 jam
atau
3. Kadar gula plasma 2 jam pada TTGO ≥ 200 mg/dl (11,1 mmol/L) TTGO
yang dilakukan dengan standar WHO, menggunakan glukosa yang setara
dengan 75 g glukosa anhidrous yang dilarutkan kedalam air.
Pemeriksaan HbA1C ≥ 6,5 oleh ADA 2014 sudah dimasukkan menjadi salah satu kriteria diagnosis DM, jika dilakukan pada sarana laboratorium yang terstandarisasi dengan baik.
Pada individu sehat, hormon kunci untuk mengontrol glukosa darah adalah
glukagon dan insulin. Insulin adalah hormon pengatur glukosa darah, yang
menstimulasi pemasukan glukosa ke dalam sel untuk digunakan sebagai sumber
energi, insulin diproduksi oleh sel beta Langerhans kelenjar pankreas (Stumvoll
3
Setelah makan sekresi insulin akan meningkat sehingga terjadi pengambilan
glukosa postprandial di hati dan jaringan perifer sedangkan sekresi glukagon
berkurang. Pada saat kadar glukosa plasma rendah, sekresi glukagon akan
meningkatkan konsentrasi glukosa plasma dengan menstimulasi pemecahan
glikogen yang tersimpan dalam hati menjadi glukosa dan meningkatkan hepatic
gluconeogenesis. Glukagon berfungsi sebagai kontra regulasi insulin dalam
menjaga homeostasis glukosa normal (Theodorakis dkk., 2011).
Pada penderita DMT2, terdapat relatif kekurangan insulin sehingga regulasi
gula darah terganggu. Pada kondisi DMT2, walau pun kadar glukosa darah sudah
tinggi, pemecahan lemak dan protein menjadi glukosa (glukoneogenesis) di hati
tidak dihambat sehingga kadar glukosa darah makin meningkat (Abate dan
Chandalia, 2001). Jika dibiarkan kondisi ini akan berlanjut menjadi disregulasi
metabolik dimana kadar gula darah yang tinggi akan mengalami oksidasi dan
mencederai tubuh pada tingkat seluler. Disregulasi gula darah jika berlanjut akan
menimbulkan komplikasi bahkan kegawatan seperti ketoasidosis diabetik, koma
hiperosmolar non ketosis atau laktat asidosis. Pada tingkat organ akan terjadi mikro
angiopati dan makro angiopati. Kondisi ini bila berlanjut dapat mengakibatkan
kematian (Jain dan Saraf, 2010).
2.2 Perjalanan Alamiah Penderita DMT2
Patofisiologis DMT2 adalah penurunan fungsi sel beta secara progresif,
resistensi insulin yang menetap dan hilangnya efek inkretin (AACE, 2007; UKPDS,
2011). Walaupun demikian kejadian kronik hiperglikemia baru akan akan berlanjut
menjadi DMT2 jika sudah terjadi penurunan fungsi sel beta pankreas, biasanya
4
didiagnosis (Pratley dan Weyer, 2001; Weyer dkk., 2001; Brown dkk., 2010).
Penyebabnya ternyata lebih berhubungan dengan disfungsi sel beta pankreas
dibandingkan adanya resistensi insulin. Hilangnya fase cepat pelepasan insulin
merupakan defek utama pada DMT2 (disamping peningkatan level glukosa
postprandial) (Brown dkk., 2010).
Gambar 2.1.
Perjalanan progresifitas DMT2 ( AACE, 2007; UKPDS, 2011)
Umumnya penderita DMT2 pasti memerlukan terapi kombinasi yang bekerja
pada berbagai defek patofisiologi. Usia muda sampai dewasa pertengahan dengan
peningkatan kadar glukosa puasa dan berat badan berlebih saat didiagnosis sebagai
DMT2, akan lebih cepat mengalami perburukkan dan lebih cepat memerlukan
penambahan terapi (Kellow dkk., 2011). Pemberian terapi untuk menurunkan kadar
glukosa pada penderita DMT2 secepat mungkin dapat menurunkan kegagalan
kendali. Data dari ADOPT menunjukkan thiazolidione mempunyai efikasi yang
lebih baik dibandingkan metformin maupun sulfonilurea (Kahn dkk., 2011).
Evaluasi terapi 2-3 bulan dilakukan pada pemberian monoterapi, dan bila tidak
5
(Nathan dkk., 2009); penambahan obat dengan target kerja berbeda harus diberikan
(Rodbar dan Jellinger, 2010). Perlu diketahui bahwa penyakit diabetes merupakan
multiorgan, multifaktorial bukan hanya disebabkan disfungsi sel beta dan resistensi
insulin pada jaringan perifer dan hati tetapi juga terjadi pada jaringan lemak
(peningkatan lipolisis), penurunan sekresi dan sensitifitas inkretin (gastrointestinal),
peningkatan sekresi glukagon (sel alfa), reabsopsi glukosa (ginjal) dan resistensi
insulin karena gangguan neurotransmiter pada sistem saraf pusat (otak). Pemberian
berbagai obat yang bekerja pada beberapa defek patofisiologi tersebut adalah wajar,
tetapi dengan pemberian berbagai jenis terapi tersebut akan meningkatkan risiko
baik efek samping, penurunan kepatuhan dan tentunya pertimbangan ekonomi
(Nathan dkk., 2009). Inkretin seperti GLP-1 agonis reseptor bekerja pada banyak
tempat patofiologi DMT2 seperti peningkatan sekresi insulin dan menurunkan
sekresi glukagon, efek pada otak, memperlambat pengosongan lambung,
menurunkan nafsu makan, dan efek preservasi sel beta pankreas (khan dkk., 2011).
Sehingga saat ini terapi inkretin dipandang sebagai terapi yang idel pada penderita
DMT2 (Zinman, 2011).
Gambar 2.2.
6
2.3 Insulin
Insulin adalah polipeptida yang tersusun dari dua rantai asam amino yang
dihubungkan oleh struktur disulfida. Rantai pertama dan kedua masing-masing
mempunyai 21 dan 30 asam amino. Substitusi terjadi pada beberapa posisi dalam
kedua rantai tanpa mempengaruhi bioaktifitas (gambar 2.3). Insulin disintesis
sebagai suatu preprohormon dengan berat molekul sekitar 11.500 Dalton serta
merupakan prototipe untuk peptida yang diproses dari prekursor molekul yang lebih
besar. Preproinsulin bersifat hidrofobik dengan 23 asam amino yang digunakan
melalui proses metabolisme didalam sisterna retikulum endoplasm. Proses ini
menghasilkan proinsulin dengan berat molekul 9.000 Dalton yang diperlukan bagi
pembentukan jembatan disulfida yang sempurna (Butler dkk., 2010).
Gambar 2.3.
Struktur insulin manusia (Butler dkk., 2010)
Susunan proinsulin dimulai dari bagian terminal yaitu amino rantai B-peptida
C (penghubung) dan rantai A. Molekul proinsulin akan dipecah secara spesifik
sehingga terbentuk insulin matur dan peptida C dengan jumlah ekuimolar.
Proinsulin mempunyai panjang yang bervariasi antara 78 hingga 86 asam amino,
dengan variasi yang terdapat pada regio peptida C. Proinsulin memiliki kelarutan
7
heksamer dengan kristal Zeng dan bereaksi kuat dengan antiserum insulin (Drucker,
2001). Proinsulin memiliki bioaktifitas 5% kurang dari bioaktifitas insulin.
Sebagian proinsulin dilepas bersama insulin dan pada keadaan tertentu, lebih besar
dari pada biasanya. Karena waktu paruh proinsulin dalam plasma secara bermakna
lebih panjang dari pada waktu paruh insulin, sehingga insulin dan proinsulin bisa
bereaksi silang secara kuat dengan antiserum insulin yang menyebabkan
pemeriksaan radioimmuno assay untuk menentukan kadar insulin kadang-kadang
memperkirakan secara berlebihan bioaktivitas insulin dalam plasma (Dungan dan
Buse, 2005).
C-peptida merupakan molekul yang berbeda bila dilihat dari sudut pandang
sifat antigeniknya. Karena itu pemeriksaan immunoassay terhadap C-peptida dapat
membedakan apakah insulin yang ada disekresikan dari dalam dengan insulin yang
diberikan dari luar. Insulin dibentuk dalam retikulum endoplasma sel B, kemudian
diangkut ke kompleks golgi dan akan dibungkus dalam granula berselaput.
Granula-granula ini bergerak ke dinding sel, oleh proses yang diperantarai mikrotubulus,
kemudian bersatu dengan membran sel. Proses ini diakhiri pelepasan insulin secara
eksositosis. Insulin kemudian harus menyeberangi lamina-lamina basalis sel B,
melalui celah endotel kapiler untuk mencapai aliran darah (Drucker, 2001).
Pankreas manusia mensekresi 40-50 unit insulin perhari, yang
menggambarkan kira-kira 15-20% hormon yang disimpan dalam kelenjar pankreas.
Sekresi insulin adalah proses yang membutuhkan energi dan melibatkan sistem
mikrotubulus mikrofilamen dalam sel beta pankreas. Peningkatan konsentrasi
glukosa dalam plasma merupakan faktor fisiologik paling penting yang mengatur
8
puasa plasma (80-100 mg/dl) dan respon maksimal diperoleh pada kadar glukosa
yang berkisar dari 300 hingga 500 mg/dl (Kjems dkk., 2003).
Sejumlah hormon mempengaruhi pelepasan insulin. Preparat agonis alfa
adrenergik, khususnya epinefrin menghambat pelepasan insulin. Preparat agonis ß
adrenergik merangsang pelepasan insulin, yang mungkin dengan cara meningkatkan
c-AMP intrasel. Pajanan yang terus menerus dari hormon pertumbuhan, kortisol,
laktogen plasenta, estrogen dan progestin dalam jumlah yang berlebihan juga akan
meningkatkan sekresi insulin. Banyak obat yang dapat merangsang sekresi insulin,
senyawa sulfonilurea salah satunya, yang dewasa ini digunakan paling banyak
sebagai pengobatan pada manusia. Insulin disekresikan dalam sel Beta normal
sebagai reaksi terhadap stimulus glukosa dengan mode bifasik dengan lonjakan dini
(fase awal) yang diikuti dengan peningkatan sekresi insulin secara progresif (fase
kedua) sepanjang ada stimulus hiperglikemik. Dengan keberadaan resistensi insulin,
sekresi insulin sel B pankreas meningkat dengan cara kompensasi dan DMT2
berkembang bila peningkatan kompensasi dalam kadar insulin tidak lagi mencukupi
untuk menjaga euglikemia (Kjems dkk., 2003).
2.4 Sekresi dan Resistensi Insulin
Insulin berfungsi mengurangi produksi glukosa dalam tubuh (terutama dari
hepar) dan menyebabkan ambilan glukosa di otot dan jaringan adiposa. Insulin
menghambat digesti protein dari usus dan meningkatkan ambilan asam amino ke
dalam sel untuk dibentuk protein (Eckel dan Grundy, 2005). Selama periode 24
jam, 50% total insulin disekresi oleh pankreas pada keadaan basal, sedang sisanya
9
unit/24 jam (0,7-1,3 mg). Respon sekresi insulin berlangsung cepat sesudah makan
dan meningkat 5 kali dari keadaan basal dan mencapai puncak dalam 60 menit.
Profil sekresi insulin normal ditandai oleh adanya serial pulsasi dari sekresi insulin.
Sesudah makan pagi terdapat 1,8 ± 0,2 pulsasi sekresi pada sukarelawan normal dan
mencapai puncak 42,8 ± 3,4 sesudah makan. Multipel pulsasi sekresi insulin
mencapai 4 kali juga didapatkan sesudah makan siang dan makan malam. Pada
interval 5 jam sesudah makan siang didapatkan rerata pulsasi sekresi 2,5 ± 0,3 dan
2,6 ± 0,2 sesudah makan malam. Pulsasi sekresi insulin yang tidak berhubungan
dengan makan terjadi pada waktu antara jam 23.00 hingga jam 06.00 hari
berikutnya, dan 3 jam sebelum makan pagi dengan rerata pulsasi sekresi 3,9 ± 0,3
pada subjek normal. Jadi selama periode 24 jam terdapat total 11,1 ± 0,5 pulsasi
pada subjek normal (Polansky dkk., 2008; Buse dkk.,2011).
Sensitifitas insulin menurun dimulai sejak masa pubertas demikian pula kadar
insulin puasa meningkat 2-3 kali sesudah masa prapubertas (Grumbach dan Styne,
2003). Pada pengamatan selama 7 tahun, terjadi peningkatan rerata insulin puasa
10-25%, peningkatan rerata glukosa puasa 7-10% tanpa membedakan ras dan jenis
kelamin. Prediktor terkuat terjadinya peningkatan insulin dan glukosa adalah
peningkatan massa tubuh dalam 7 tahun. Insulin puasa meningkat 5 µU/ml tiap
peningkatan IMT 5 kg/m2 (p < 0,05) dan insulin puasa meningkat 2,5 µU/ml tiap
peningkatan 0,08 unit rasio pinggang/pinggul (p < 0,05) (Folsom dkk., 2004).
Resistensi insulin adalah kondisi di mana jumlah normal insulin tidak
memadai untuk menghasilkan respon insulin normal dari lemak, otot dan sel hati.
Resistensi insulin dalam sel lemak mengurangi efek insulin dan mengakibatkan
10
Peningkatan mobilisasi depot lipid akan meningkatkan asam lemak bebas
dalam plasma darah. Resistensi insulin dalam sel otot mengurangi pengambilan
glukosa dan penyimpanan lokal glukosa sebagai glikogen, sedangkan resistensi
insulin dalam sel hati mempengaruhi sintesis glikogen dan kemampuan untuk
menekan produksi glukosa (Girard, 2008).
Peningkatan konsentrasi asam lemak darah sehubungan dengan resistensi
insulin dapat mengurangi pengambilan glukosa otot, dan meningkatkan produksi
glukosa hati, sehingga berkontribusi terhadap peningkatan konsentrasi glukosa
darah. Kadar plasma insulin yang tinggi dan glukosa yang tinggi akibat resistensi
insulin diyakini merupakan awal dari sindrom metabolik dan DMT2, termasuk
komplikasinya (Asmar, 2011).
Pada orang dengan metabolisme normal, insulin dilepaskan dari sel beta
Langerhans pankreas setelah makan ( " postprandial " ), dan berikatan pada reseptor
di jaringan sensitif insulin misalnya otot dan adiposa untuk menyerap glukosa. Hal
ini akan menurunkan kadar glukosa darah. Sel beta kemudian menurunkan produksi
insulin setelah kadar glukosa darah turun, dimana glukosa darah dipertahankan
sekitar 5 mmol / L ( mM ) (90 mg / dL ). Pada penderita dengan resistensi insulin,
kadar normal insulin yang ada tidak berefek baik pada otot dan sel-sel adiposa,
sehingga hasilnya kadar glukosa tetap lebih tinggi dari normal. Untuk
mengkompensasi hal ini, pankreas dirangsang untuk melepaskan lebih banyak
insulin sehingga terjadi hiperinsulinemia (Hui, 2005).
Berbagai kondisi dapat membuat jaringan tubuh lebih resisten terhadap
insulin. Diantaranya adalah infeksi (dimediasi oleh sitokin TNFa) dan asidosis.
11
sel terpapar insulin, produksi GLUT-4 (reseptor glukosa tipe 4) pada membran sel
menurun. Hal ini menyebabkan kebutuhan akan meningkat untuk memperoleh
suplai insulin, yang kemudian mengurangi kembali GLUT-4 (Timothy James
Kieffer dan Habener, 2009).
Resistensi insulin sering ditemukan pada orang dengan adipositas visera yaitu
kandungan jaringan lemak yang tinggi di bawah dinding otot perut, yang berbeda
dengan adipositas subkutan atau lemak antara kulit dan dinding otot (khususnya di
tempat lain pada tubuh, seperti pinggul atau paha), hipertensi, hiperglikemia dan
dislipidemia yang disertai trigliserida yang tinggi, partikel small dense low-density
lipoprotein (sdLDL), dan penurunan kadar kolesterol HDL. Sehubungan dengan
adipositas viseral, banyak bukti menunjukkan adanya hubungan erat dengan
resistensi insulin. Pertama, tidak seperti jaringan adiposa subkutan, sel-sel adiposa
viseral menghasilkan sejumlah besar sitokin pro-inflamasi seperti tumor necrosis
factor-alpha (TNF-a), dan interleukin-1 serta interleukin-6 (Perfetti dan Merkel,
2000).
Pada beberapa model eksperimental, sitokin pro-inflamasi ini sangat
mengganggu aksi normal insulin dalam lemak dan sel-sel otot, dan mungkin
menjadi faktor utama dalam menyebabkan resistensi insulin seluruh tubuh yang
diamati pada penderita dengan adipositas viseral. Banyak perhatian pada produksi
sitokin pro-inflamasi yang terfokus kepada jalur IKK-beta/NF-kappa-B, jaringan
protein yang meningkatkan transkripsi gen sitokin. Kedua, adipositas viseral terkait
dengan akumulasi lemak dalam hati, suatu kondisi yang dikenal sebagai penyakit
hati berlemak non alkohol (NAFLD). Substansi hasil yang berlebihan pada NAFLD
12
lipolisis), dan peningkatan produksi glukosa hepatik, yang keduanya mempunyai
efek memperburuk resistensi insulin perifer dan meningkatkan kecenderungan
DMT2 (Philippe, 2009).
2.5 Fisiologi dan Patologi GLP-1
2.5.1 Penemuan Hormon Inkretin
Bayliss dan starling menemukan secretin pada 1902, saat itu berkembang
teori bahwa saluran pencernaan mampu merangsang pelepasan hormon pankreas
melalui sinyal yang dilepaskan sebagai respon adanya nutrisi di saluran pencernaan.
Pada 1906 Moore mencoba menawarkan kemungkinan menyembuhkan diabetes
dengan menggunakan ekstrak duodenum. Zunz dan Labarre menyambut ide ini
dengan melakukan serangkaian percobaan dengan ekstrak usus, yang mampu
membuat hewan percobaannya menjadi hipoglikemia. Mereka memperkenalkan
istilah INKRETIN untuk substansi kimia yang terkandung dari ekstrak usus
tersebut.
Perkembangan pesat penelitian mengenai inkretin dimulai setelah
ditemukannya Radioimmunoassay tahun 1960 oleh Yalow dan Berson (Girard,
2008). Pada 1969, Uger dan Eisentraut memberikan nama ‘Entero Insular Axis’
untuk mengambarkan hubungan antara saluran pencernaan dan pankreas (Green dan
Flatt, 2007). Creutzfelt memperkirakan aksis ini melibatkan beberapa komponen
diantaranya nutrisi, serat saraf, dan sinyal yang signifikan dari usus kepada
pankreas yang mampu merangsang pengeluaran beberapa hormon seperti: insulin,
glukagon dan somatostatin. Lebih jauh lagi Creutzfelt memberikan batas pada aksis
entero insular sebagai suatu proses yang melibatkan nutrisi pada saluran cerna,
13
akan menstimulasi pelepasan insulin saat kadar gula darah mulai meningkat (Holst
dkk., 2009).
Mengacu pada batasan Cruetzfetl, saat itu Gastric inhibitory polipeptide (GIP)
yang dapat disebut sebagai Inkretin. GIP saat itu dikenal sebagai enterogastron oleh
karena mampu menghambat pelepasan asam lambung sebagai akibat kehadiran
lemak di lumen saluran pencernaan (Girard, 2008). Dupre pada 2003
mengemukakan pandangan bahwa GIP tidak hanya merupakan suatu enterogastron
tetapi juga suatu Inkretin. Hal ini didasarkan pada percobaan yang dilakukannya,
dimana peningkatan aktifitas insulin lebih bermakna pada pemberian GIP dan
glukosa dibandingkan glukosa saja. Lebih jauh lagi ditemukan bahwa GIP yang
timbul sebagai hasil dari konsumsi lemak tidak akan menimbulkan release insulin
bila tidak disertai kehadiran glukosa. Kondisi ini sebenarnya merupakan efek
protektif terhadap pelepasan insulin dimana efek hipoglikemia tidak akan muncul.
Kondisi inilah pula yang menyebabkan selain disebut sebagai Gastric inhibitory
polipeptide oleh karena menghambat sekresi asam lambung, GIP juga dikenal
sebagai Glucose-dependent Insulinotropik Polipeptide. Sehubungan dengan
fungsinya sebagai Enterogastron dan Inkretin, GIP banyak ditemukan pada daerah
tengah dari villus duodenum, serta sangat sedikit pada jejenum (Salvatore dkk.,
2007).
GIP merupakan Inkretin pertama yang ditemukan. Tetapi para ahli pada 1970,
meyakini adanya inkretin kedua setelah GIP. Hal ini dipertimbangkan dari adanya
sekresi hormon Pankreas yang menyerupai respon inkretin pada saluran cerna saat
hewan percobaan diberikan ekstrak usus yang telah dimurnikan dari GIP. Penelitian
14
(GRP) sebagai glukagon related peptide yang dikodekan pada gen hewan ini. Secara
genetik GRP memiliki homologi yang kuat dengan GIP. GRP diyakini merupakan
inkretin berdasarkan analisa mRNA yang sesuai pada pankreas dan saluran
pencernaan Anglefish. Disamping itu ternyata ditemukan bahwa mRNA yang
dikloning dari manusia dan tikus identik dengan mRNA pankreas Anglefish.
Setelah adanya temuan ini para ahli semakin bersemangat mengidentifikasi adanya
inkretin selain GIP. Berdasarkan analisa c-DNA preproglukagon pada manusia
ditemukan homologi dengan c-DNA GRP Anglefish, yang sekarang dikenal sebagai
GLP-1. Maka disimpulkanlah bahwa GLP-1 merupakan inkretin kedua setelah GIP
(Theodorakis dkk., 2011).
GIP merupakan suatu hormon yang dilepaskan oleh sel K duodenum. Sel K
terletak terbanyak pada awal duodenum. Pelepasan GIP merupakan respon dari
penyerapan glukosa dan lemak. Sedangkan GLP-1 disintesis dan dilepaskan oleh
sel enteroendokrine, sel L, yang terletak pada distal ileum dan usus besar. Sel L
merupakan suatu sel dengan banyak granula sekretin pada daerah basal lamina. Sel
L merupakan sel terbanyak kedua setelah sel enterochromafin. Sel L banyak
terdapat pada distal jejenum, ileum, kolon dan terbanyak di rektum. Sel L
ditemukan pada fetus manusia pada usia gestasi 8 minggu pada ileum serta 12
minggu pada kolon (Theodorakis dkk., 2011).
GIP merupakan suatu peptide aktif 42 asam amino dengan berat molekul 4984
Da. Sedangkan GLP-1 merupakan suatu peptida non aktif 37 asam amino dengan
berat molekul 3298 Da, dimana terdapat enam asam amino pada akhir N-terminal.
Bentuk aktif dari GLP-1 adalah suatu gugus 17-36 amida. Konsentrasi kedua
inkretin ini dalam plasma adalah 5-10 Pmaol / L dan meningkatkan dalam 5-15
15
beredar yaitu GLP-17-37 dan GLP-17-36 amida. Dalam sirkulasi, GIP dan GLP-1
dapat menurun dengan cepat sebagai akibat metabolime serta inaktivasi oleh enzim
dipeptidyl peptidase 4 (DPP4) yang kemudian dikeluarkan lewat ginjal. Waktu
paruh kedua inkretin ini sekitar 1-2 menit untuk GLP-1 serta 5-7 menit untuk GIP
(Girard, 2008).
2.5.2 Struktur GLP-1
Gen proglukagon manusia terletak pada kaki panjang dari kromosom 2 yang
memiliki 6 ekson dan 5 intron (Hansotia dkk., 2004). Melalui proses transkripsi dan
translasi dari gen proglukagon sel L pada usus memproduksi GLP-1 (Gromada
dkk., 2007; Dunning dkk., 2007). GLP-1 tersebut tidak aktif sampai diikat oleh
NH2 dari asam amino 1 - 6. (Sinclair dkk., 2012). Suatau peptide aktif hormon
termasuk GLP-1 (7-36) dan GLP-1 (7-37). Sel L didistribusikan pada usus tetapi
paling banyak pada jejunum, ilium, kolon dan sebagainya. (Schirra dkk., 2009).
Gambar. 2.4.
Struktur GLP-1 (Deacon, 2004)
2.5.3 Sekresi dan Regulasi GLP-1
Sekresi fase awal GLP-1 diinisiasi oleh pencernaan makanan dan biasanya
16
dengan neural dan hormon mediator (Hansotia dkk., 2004). Siklus proksimal ke
distal telah banyak diduga tetapi belum ditetapkan pada manusia (Theodorakis dkk.,
2011). Fase kedua berlangsung 1-3 jam karena adanya interaksi langsung antara
bahan makanan dengan sel L (Deacon, 2004, Sinclair dkk., 2012). Kadar plasma
dari bioaktif GLP-1 berkisar 5-10 pmol/L pada keadaan puasa ( Deacon, 2004).
Mekanisme regulasi sekresi GLP-1 dipengaruhi oleh nutrient, neuron dan
endokrin (Deacon, 2004). Pelepasan GLP-1 terjadi karena asupan nutrient (Dunning
dkk., 2007). Sebagai bukti kadar GLP-1 dalam sirkulasi akan meningkat 2-3 kali
sebagai respon terhadap asupan glukosa (Deacon, 2004). Lemak dan karbohidrat
dapat menstimulasi sekresi GLP-1 dengan cara kontak langsung dengan mukosa
usus halus. Pada manusia, makanan mengandung protein tidak akan meningkatkan
sekresi GLP-1, tetapi proses pencernaan campuran asam amino nampaknya
berpengaruh pada sekresi GLP-1 (Deacon, 2004; Dunning dkk., 2007).
Sekresi GLP-1 juga berhubungan dengan pengosongan lambung terutama
laju pencernaan nutrient ke dalam usus kecil; makanan cair menyebabkan pelepasan
GLP-1 lebih tinggi daripada bahan makanan padat. Beberapa studi telah
membuktikan adanya peran nervus vagus dalam mediasi signal nutrient pada
duodenum untuk mengontrol sekresi GLP-1 di distal usus halus (Deacon, 2004;
Hansotia dkk., 2004), dan regulasi vagus yang bersifat kolinergik dan muskarinik
tersebut telah dapat dijelaskan. Sistem nervus simpatik dan persarafan non
kolinergik non adrenergik juga telah dijelaskan terlibat dalam regulasi GLP-1
(Deacon, 2004). Sistem enteroendokrin antara duodenum dan jejunum mungkin
juga terlibat dalam regulasi sekresi GLP-1 (Schirra dkk., 2009). Signal endokrin
dari bagian proksimal usus halus mungkin juga memegang peranan dalam sekresi
17
2.5.4 Metabolisme GLP-1
Sekresi GLP-1 dari Sel L usus yang dilepaskan ke dalam sirkulasi akan
segera dipecah oleh GPP-4 menjadi GLP-1 (9-36) dan GIP (9-37) (Gromada dkk.,
2007). Waktu paruh GLP-1 pada manusia kurang dari 2 menit (Sinclair dkk., 2012).
GPP-4 adalah plasma membran glikoprotein ektopeptidase dengan berat 110 kilo
Dalton yang diekpresikan pada permukaan sel endotel dan epitel, konsentrasi
terbanyaknya pada manusia dilaporkan pada usus kecil, sumsum tulang dan ginjal.
(Volmer dkk., 2008). Enzim ini dipecah pada penultimat alanin residu untuk
memproduksi NH2 terminal yang dapat menyebabkan stimulus pelepasan insulin
melalui reseptor GLP-1 (Sinclair dkk., 2012). Endopeptidase netral 24.11(NEP
24.11 atau disebut juga neprilisin) adalah membran yang dibalut oleh zink
metalopeptidase (Plamboeck dkk., 2005). Ini akan memecah peptida pada nukleasid
C terminal dari GLP-1, molekul dan dibersihkan sisa-sisa metabolisme (Deacon,
2004; Volmer dkk., 2008). Pengeluaran klirens GLP-1 primernya melalui ginjal
(Deacon, 2004; Hansotia dkk., 2004).
2.5.5 Fisiologi GLP-1
GLP-1 menstimulasi sekresi insulin memegang peranan yang penting untuk
mempertahankan homeostasis glukosa. GLP-1 juga peningkatan biosintesis insulin
GLP-1r dan banyak ditemukan pada sel Beta, sel Alpa dan sel gamma pankreas
(Deacon, 2004). Inhibisi dari pelepasan glukagon oleh GLP-1 dapat terjadi karena
efek langsung maupun tidak langsung melalui pelepasan somatostatin. Fungsi
inhibisi tidak tergantung glukosa (Deacon, 2004; Sinclair dkk., 2012). GLP-1 tidak
akan menyebabkan terjadinya hipoglikemia (Gromada dkk., 2007). Sebaliknya
18
langsung regulasi glukosa hepatik dan peningkatan sintesis glukogen, oksidasi dan
utilisasi glukosa (Deacon, 2004). GLP-1 meningkatkan massa sel beta pankreas
dengan cara menstimulus proliferasi dan neogenesis sel beta serta menghambat
apoptosis (Holst dkk., 2009) dan meningkatkan viabilitas (Deacon, 2004) serta
mengambil peranan pada regulasi CAS phase 3 dan regulasi antiapoptik protein
BCL-2 (Hansotia dkk., 2004). Sebagai akibatnya GLP-1 juga menurunkan nafsu
makan dan memperlambat pengosongan lambung. Fungsi ini biasanya berhubungan
dengan sistem nervus vagus (Dunning dkk., 2007). Oleh sebab itu dipandang
sebagai terapi ideal diabetes.
Gambar 2.5.
Fisiologis GLP-1 dalam menurunkan kadar glukosa (Dunning dkk., 2007).
2.5.6 Mekanisme Kerja GLP-1 pada Sel Beta Pankreas
GLP-1 bekerja dengan cara berikatan dengan reseptor G Protein (GPCRs)
(Sinclair dkk., 2012). Ikatan GLP-1 dengan reseptor ini pada sel beta menyebabkan
peningkatan c-AMP intraseluler sehingga terjadi eksositosis insulin melalui dua
19
(Combettes dkk., 2006). Setelah aktivasi PKA dan c-AMP guanine nukleotida
exchange factor II (cAMP-GEF II) akan memfasilitasi terbentuknya
molekul-molekul yang terlibat dalam sekresi insulin oleh GLP-1 (Dunning dkk., 2007).
GLP-1 mempengaruhi potensial membran sel beta pankreas dengan cara
menghambat K-ATP dan KV channels dan memfasilitasi depolarisasi membran.
Perubahan ini akan menyebabkan peningkatan calcium channel voltage gate dengan
akibatnya masuknya kalsium dan inisiasi eksositosis insulin dependen kalsium
(Deacon, 2004; Dunning dkk., 2007). Sebagai tambahan GLP-1 menghambat
aktivitas dari KV channels menyebabkan repolarisasi sel beta (Deacon, 2004).
Gambar 2.6.
Mekanisme kerja GLP1 pada Sel B pankreas (Deacon, 2004)
Efek anti apoptotik GLP-1 adalah diakibatkan karena aktivasi c-AMP dan
phospotilidinositol 3 kinase (PI3KA). Kedua jalur ini saling mengisi. Jalur c-AMP
dimediasi oleh aktivasi respon elemen binding protein (kreb) dan interaksi dengan
20
aktivasi ekspresi gen reseptor insulin substrak 2 dan menuntun pada protein kinase
b (PKB) (Combettes dkk., 2006). GLP-1 merangsang ekspresi gen insulin melalui
aktivasi dari faktor inti pada T sel teraktivasi (N fat) dan aktivasi sinyal
ekstraseluler regulative kinase (ERK) dengan mekanisme dependen pada
mitogen-activated protein kinase-kinase (MAPKK atau MEK) (Combettes dkk., 2006; Holst
dkk., 2009). GLP-1 juga meningkatkan aktivitas duodenal homeobox 1 (PDX-1)
yang menyebabkan regulasi dari ekspresi gen (Combettes dkk., 2006).
Aktivasi reseptor GLP-1 mencetuskan stimulasi dari PI3K melalui 2 jalur.
Aktivasi PI3K melalui down stream target: Mitogen activated protein kinase
(MAPK), ERK, PKC, dan PKB dalam sel beta PKC dan MAPK berhubungan
dengan proliferasi GLP-1. Sementara ERK dan MAPK menyebabkan diferensiasi
sel beta. Mekanisme molekuler pada regulasi pankreas oleh GLP-1 tidak
sepenuhnya dipahami sehingga diperlukan studi yang lebih lanjut (Combettes dkk.,
2006).
2.6 Hubungan GLP-1 dan Sekresi Insulin Postprandial
Pada pemberian beban glukosa oral dan intravenus didapatkan efek inkretin
dapat memacu sekresi insulin sebanyak 2/3 dari kapasitas total pada subjek dengan
non diabetes, sedangkan efek tersebut pada DMT2 kurang dari 20% (Nauck
dkk.,2006). Penurunan respon inkretin memberikan kontribusi pada disregulasi
insulin dan sekresi glukagon khususnya pada periode postprandial sehingga
menyebabkan hiperglikemia (Pratley dan Weyer, 2001). Eviden memperlihatkan
penurunan respon inkretin pada penderita DMT2 diakibatkan karena penurunan
21
Gambar 2.7.
Efek GLP-1 terhadap Sekresi Insulin postprandial (Nauck dkk.,2006)
Gambar 2.8.
Penurunan respon sekresi GLP-1 postprandial ( Toeft nielsen dkk., 2001)
2.7 Terapi Diabetes Melitus Tipe II
Penelitian UKPDS dan Studi Kumamoto pada penderita DMT2
menunjukkan target glikemik terapi DMT2 yang menghasilkan perbaikan prognosis
jangka panjang. Hasil penelitian klinik dan epidemiologik menunjukkan bahwa
22
neuropati akan menurun. Target kadar glukosa darah yang terbaik berdasarkan
pemeriksaan harian dan HbA1C sebagai indeks glikemia kronik belum diteliti
secara sistematik. Tetapi hasil penelitian Diabetes Control and Complication Trial
(DCCT) (pada penderita diabetes tipe 1) dan UKPDS (pada penderita diabetes tipe
2) mengarahkan gol pencapaian kadar glikemik pada rentang nondiabetik. Dari
kedua studi tersebut bahkan pada grup penderita yang mendapat pengobatan
intensif, kadar HbA1C tidak dapat dipertahankan pada rentang nondiabetik.
Studi tersebut mencapai kadar rata-rata HbA1C ~7% yang merupakan 4SD
diatas rata-rata non diabetik (DCCT, 2013). Target glikemik yang paling baru
adalah dari ADA yang dibuat berdasarkan kepraktisan dan projeksi penurunan
kejadian komplikasi, yaitu HbA1C < 7%. Konsensus ini menyatakan bahwa kadar
HbA1C ≥ 7% harus dianggap sebagai alarm untuk memulai atau mengubah terapi
dengan target HbA1C < 7%.
Para ahli juga menyadari bahwa target ini mungkin tidak tepat atau tidak
praktis untuk penderita tertentu, dan penilaian klinik dengan mempertimbangkan
potensi keuntungan dan kerugian dari rejimen yang lebih intensif perlu
diaplikasikan pada setiap penderita. Faktor-faktor seperti harapan hidup, risiko
hipoglikemia dan adanya CVD perlu menjadi pertimbangan pada setiap penderita
sebelum memberikan regimen terapi yang lebih intensif (ADA, 2014). Dikenal 4
pilar pengobatan pasien-pasien DMT2 yakni edukasi, pengaturan diet, latihan fisik,
dan obat (Perkeni, 2014) sedangkan menurut ADA pengobatan ini dibagi menjadi
23
2.7.1 Modifikasi Pola Hidup
Modifikasi pola hidup merupakan terapi non farmakologis yang meliputi
edukasi, pengaturan pola diet, latihan fisik (Perkeni, 2014). Modifikasi pola hidup
merupakan dasar terapi setiap pasien DMT2, dikarenakan pola hidup yang buruk
merupakan faktor resiko terjadinya DMT2 (UKPDS, 2011). Beberapa penelitian
telah membuktikan bahwa pengaturan pola hidup yang baik dikaitkan dengan
kendali glisemik yang lebih baik (Nathan dkk., 2008). Hal ini terutama dikarenakan
dengan pengaturan pola hidup yang baik dapat menurunkan kejadian resistensi
insulin (Folsom dkk., 2004).
Edukasi yang baik akan mempengarui prilaku pasien DMT2, dengan tingkat
pengetahuan yang lebih baik ternyata dapat meningkatkan kendali glisemik
pasien-pasien DMT2 (Da Qing study, 2007; Finnish study, 2003). Edukasi yang diberikan
kepada penderita DMT2 meliputi pemahaman tentang: perjalanan penyakit
diabetes, perlunya pengendalian dan pemantauan diabetes, penyulit dan risikonya,
intervensi farmakologis dan non farmakologis, cara pemantauan gula darah mandiri
dan pemahaman tentang hasil pemantauan, mengatasi sementara keadaan darurat
antara lain hipoglikemia, pentingnya latihan jasmani yang teratur, pentingnya
perawatan diri, dan keadaan khusus yang dihadapi seperti : hiperglikemia pada
kehamilan (ADA, 2014; Perkeni, 2014).
Pengaturan makanan yang seimbang dan sesuai dengan kebutuhan kalori
dan zat gizi masing-masing individu telah dikaitkan dengan keberhasilan kendali
glisemik pada pesien-pasien DMT2 (Da Qing study, 2007; Finnish study, 2003).
Perlu ditekankan tentang pentingnya keteraturan makan dalam hal jadwal makan,
24
kebutuhan kalori basal 25-30 kalori/kgbb, ditambah dan dikurangi bergantung pada
beberapa faktor yaitu jenis kelamin, umur, aktivitas, berat badan. Makanan
sejumlah kalori tersebut kemudian dibagi dalam 3 porsi besar untuk makan pagi
(20%), siang (30%) dan sore (25%), serta 2-3 porsi makanan ringan (10-15%).
Untuk diabetisi yang menderita penyakit lain, makanan diatur dengan
menyesuaikan dengan penyakit penyertanya. Komposisi makanan yang dianjurkan
terdiri dari karbohidrat 45-65% totao asupan kalori, lemak 20-25% kebutuhan
kalori, dan protein 15-20% kebutuhan kalori (ADA, 2014; Perkeni, 2014).
Kegiatan jasmani sehari-hari seperti berjalan kaki, menggunakan tangga,
berkebun harus tetap dilakukan. Latihan jasmani dilakukan secara teratur 3-4 kali
seminggu selama 30 menit ternyata berkaitan erat dengan kendali glisemik yang
lebih baik (DPP, 2002). Latihan jasmani yang dianjurkan adalah yang bersifat
aerobik seperti jalan kaki, bersepeda santai, jogging, dan berenang. Latihan jasmani
ini disesuaikan dengan usia dan status kesegaran jasmani (ADA, 2014; Perkeni,
2014).
2.7.2 Metformin
Efek utama metformin adalah menurunkan “hepatic glucose output” dan
menurunkan kadar glukosa puasa (Kirpichnikov dkk., 2002). Mekanisme kerja
molekular metformin belum sepenuhnya dipahami. Beberapa teori yang ada
meliputi : metformin menghambat kerja respirasi mitokondria, aktivasi
AMP-activated protein kinase (AMPK), inhibisi sekresi glukagon melalui hambatan pada
c-AMP, inhibis pada mitokondrial glycerophosphate dehydrogenase (Rena dkk.,
2013) dan efek pada mikrobakteri pada usus (Burcelin, 2013). Metformin dapat