PENETAPAN KANDUNGAN FENOLIK TOTAL DAN UJI AKTIVITAS ANTIOKSIDAN DENGAN METODE DPPH (1,1-diphenyl-2-picrylhydrazyl)
EKSTRAK METANOLIK DAUN APU-APU (Pistia stratiotes L.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh: Nessya Trivianni NIM : 108114132
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
PENETAPAN KANDUNGAN FENOLIK TOTAL DAN UJI AKTIVITAS ANTIOKSIDAN DENGAN METODE DPPH (1,1-diphenyl-2-picrylhydrazyl)
EKSTRAK METANOLIK DAUN APU-APU (Pistia stratiotes L.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh: Nessya Trivianni NIM : 108114132
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
Persetujuan Pembimbing
PENETAPAN KANDUNGAN FENOLIK TOTAL DAN UJI AKTIVITAS ANTIOKSIDAN DENGAN METODE DPPH (1,1-diphenyl-2-picrylhydrazyl)
EKSTRAK METANOLIK DAUN APU-APU (Pistia stratiotes L.)
Skripsi yang diajukan oleh: Nessya Trivianni NIM : 108114132
telah disetujui oleh :
Pembimbing Utama
iii
Pengesahan Skripsi Berjudul
PENETAPAN KANDUNGAN FENOLIK TOTAL DAN UJI AKTIVITAS ANTIOKSIDAN DENGAN METODE DPPH (1,1-diphenyl-2-picrylhydrazyl)
EKSTRAK METANOLIK DAUN APU-APU (Pistia stratiotes L.)
Oleh : Nessya Trivianni NIM : 108114132
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sanata Dharma pada tanggal : ...
Mengetahui Fakultas Farmasi Universitas Sanata Dharma
Dekan
(Ipang Djunarko, M.Sc., Apt.)
Panitia Penguji : Tanda tangan
1. Yohanes Dwiatmaka, M.Si. ...
2. Prof. Dr. C.J. Soegihardjo, Apt. ...
iv
God knows every struggle that we face. God also knows for
sure that we able to conquer our struggle. Try, pray,
surrender, and believe that God will win us in every struggle.
Tuhan tahu setiap pergumulan yang kita hadapi. Tuhan juga tahu
dengan pasti bahwa kita mampu untuk menghadapi pergumulan
tersebut. Berusaha, berdoa, berserah, dan percayalah bahwa Tuhan
akan memenangkan kita di setiap pergumulan.
(Nessya Trivianni)
v
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Apabila di kemudian hari ditemukan indikasi plagiarisme dalam naskah ini, maka saya bersedia menanggung segala sanksi sesuai peraturan perundang-undangan yang berlaku.
Yogyakarta, 14 April 2014 Penulis
vi
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma : Nama : Nessya Trivianni
Nomor mahasiswa : 108114132
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
“PENETAPAN KANDUNGAN FENOLIK TOTAL DAN UJI AKTIVITAS ANTIOKSIDAN DENGAN METODE DPPH (1,1-diphenyl-2-picrylhydrazyl)
EKSTRAK METANOLIK DAUN APU-APU (Pistia stratiotes L.)” beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pengkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama saya tetap mencantumkan nama saya sebagai penulis.
Dengan demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal : 14 April 2014 Yang menyatakan
vii PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Esa atas berkat, kasih, dan penyertaan-Nya yang begitu besar, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Penetapan Kandungan Fenolik Total dan Uji Aktivitas Antioksidan dengan Metode DPPH (1,1-diphenyl-2-picrylhydrazyl) Ekstrak Metanolik Daun Apu-Apu (Pistia stratiotes L.)” dengan baik. Skripsi ini disusun untuk memenuhi salah satu syarat dalam memperoleh gelar Sarjana Farmasi (S. Farm.) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam proses penelitian dan penyusunan skripsi, penulis mendapatkan banyak bantuan, bimbingan, saran, kritik, dan dukungan dari banyak pihak, baik secara langsung maupun tidak langsung. Oleh karena itu, pada kesempatan ini, penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada :
1. Bapak Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
2. Ibu C.M. Ratna Rini Nastiti, M.Pharm., Apt., selaku Ketua Program Studi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta sekaligus Dosen Pembimbing Akademik penulis atas bimbingan dan nasehat yang diberikan selama ini.
viii
4. Bapak Prof. Dr. C.J. Soegihardjo, Apt., selaku Dosen Penguji Skripsi atas saran dan kritik yang membangun, serta atas kesediaannya dalam menguji skripsi ini.
5. Bapak Jeffry Julianus, M.Si., selaku Dosen Penguji Skripsi atas saran dan kritik yang membangun, serta atas kesediaannya dalam menguji skripsi ini. 6. Segenap dosen dan karyawan Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta.
7. Mas Wagiran dan Mas Sigit, selaku laboran di Laboratorium Farmakognosi-Fitokimia dan Laboratorium Biologi Dasar Fakultas Farmasi Universitas Sanata Dharma Yogyakarta atas bantuan yang telah banyak diberikan kepada penulis saat proses penelitian.
8. Eunike Yosefina Kurniawan, sahabat sekaligus teman seperjuangan dalam penelitian, atas keceriaan, semangat, dan diskusi selama ini.
9. Desi Irwanta Kate, sebagai teman seperjuangan dalam penelitian, atas semangat, ketegasan, dan diskusi selama proses penelitian.
10.Edward Dwiputra Prajitno, Eliza Telamiana Riyani Purbo, Chrisilia Cahyani, dan Baktiman Ande, para sahabat yang selalu memberikan keceriaan, semangat, dukungan, saran, dan kritik yang membangun bagi penulis.
11.Teman-teman FST B angkatan 2010 atas kebersamaan, kekompakan dan keceriaan selama ini.
ix
Penulis menyadari bahwa dalam penyusunan skripsi ini masih jauh dari kesempurnaan. Oleh karena itu, dengan kerendahan hati penulis bersedia menerima saran dan kritik dalam menyempurnakan skripsi ini. Penulis berharap skripsi ini dapat bermanfaat bagi para pembaca dan pengembangan ilmu pengetahuan, khususnya di bidang farmasi.
Yogyakarta, 14 April 2014 Penulis
x DAFTAR ISI
Halaman
HALAMAN JUDUL...i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ...iv
LEMBAR PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUANPUBLIKASI KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
INTISARI ... xvii
ABSTRACT ... xviii
BAB I PENGANTAR...1
A. Latar Belakang ... 1
1. Permasalahan ... 3
2. Keaslian penelitian ... 3
xi
B. Tujuan Penelitian ... 4
1. Tujuan umum ... 4
2. Tujuan khusus ... 4
BAB II PENELAAHAN PUSTAKA...5
A. Apu - Apu ... 5
1. Nama lain dan sistematika apu-apu ... 5
2. Gambaran umum apu-apu ... 6
3. Kegunaan dan khasiat apu-apu ... 7
B. Senyawa Fenolik ... 7
C. Ekstraksi ... 8
D. Radikal Bebas dan Antioksidan ... 8
E. Metode Folin-Ciocalteu ... 9
F. Metode DPPH ... 10
G. Landasan Teori ... 11
H. Hipotesis ... 13
BAB III METODOLOGI PENELITIAN...14
A. Jenis dan Rancangan Penelitian ... 14
B. Variabel dan Definisi Operasional ... 14
xii
2. Definisi operasional... 14
C. Bahan Penelitian ... 15
D. Alat Penelitian ... 15
E. Tata Cara Penelitian ... 16
1. Determinasi tanaman ... 16
2. Pengumpulan bahan ... 16
3. Preparasi daun apu-apu ... 16
4. Pembuatan larutan pembanding dan uji ... 17
5. Uji pendahuluan ... 18
6. Optimasi metode penetapan kandungan fenolik total ... 19
7. Penetapan kandungan fenolik total ... 19
8. Optimasi metode uji aktivitas antioksidan ... 20
9. Uji aktivitas antioksidan ... 21
F. Analisis Hasil... 22
BAB IV HASIL DAN PEMBAHASAN...23
A. Hasil Determinasi Tanaman ... 23
B. Hasil Pengumpulan Tanaman ... 23
C. Hasil Preparasi Sampel ... 24
D. Hasil Uji Pendahuluan ... 28
xiii
2. Uji pendahuluan aktivitas antioksidan ... 29
E. Hasil Optimasi Metode Penetapan Kandungan Fenolik Total ... 30
1. Penentuan operating time (OT) ... 30
2. Penentuan panjang gelombang serapan maksimum ... 31
F. Hasil Penetapan Kandungan Fenolik Total ... 33
G. Hasil Optimasi Metode Uji Aktivitas Antioksidan dengan Radikal DPPH...36
1. Penentuan panjang gelombang serapan maksimum ... 36
2. Penentuan operating time (OT) ... 37
H. Estimasi Aktivitas Antioksidan dengan Radikal DPPH ... 39
BAB V KESIMPULAN DAN SARAN...46
A. Kesimpulan ... 46
B. Saran ... 46
DAFTAR PUSTAKA...47
LAMPIRAN...50
xiv
DAFTAR TABEL
Halaman Tabel I. Hasil scanning panjang gelombang serapan maksimum asam galat
yang direaksikan dengan reagen Folin-Ciocalteu dalam suasana
basa... 32 Tabel II. Pembuatan kurva baku asam galat... 34 Tabel III. Kandungan fenolik total ekstrak metanolik daun apu-apu... 35 Tabel IV. Hasil scanning panjang gelombang serapan maksimum DPPH.... 37 Tabel V. Hasil pengukuran aktivitas antioksidan rutin dengan metode
DPPH... 41 Tabel VI. Hasil pengukuran aktivitas antioksidan ekstrak metanolik daun
apu-apu dengan metode DPPH... 42 Tabel VII. Hasil IC50rutin dan ekstrak metanolik daun apu-apu... 43
xv
DAFTAR GAMBAR
Halaman
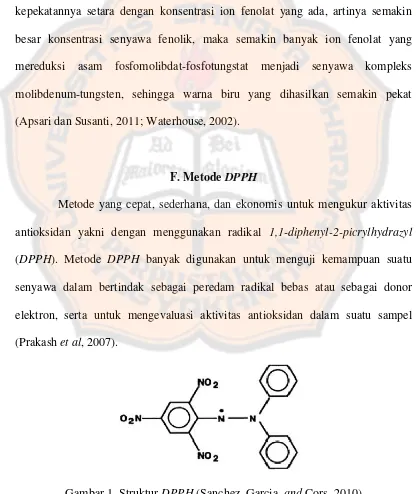
Gambar 1. Struktur DPPH... 10
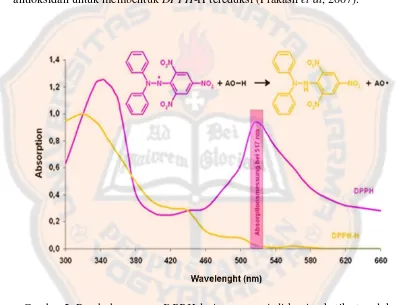
Gambar 2. Perubahan warna DPPH dari ungu menjadi kuning ketika tereduksi oleh senyawa antioksidan... 11
Gambar 3. Hasil uji pendahuluan kandungan fenolik... 29
Gambar 4. Hasil uji pendahuluan aktivitas antioksidan... 30
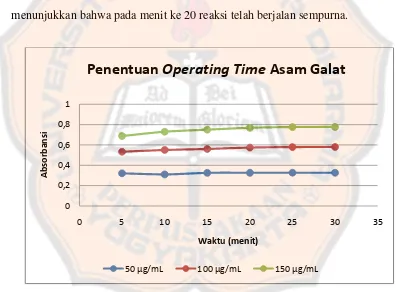
Gambar 5. Grafik penentuan OT asam galat... 31
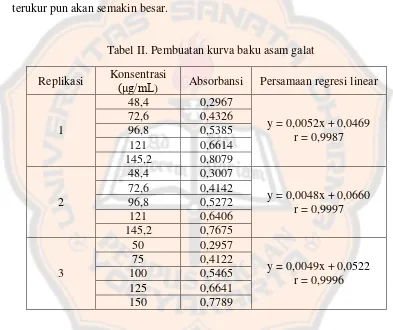
Gambar 6. Kurva baku asam galat untuk penetapan kandungan fenolik total ekstrak metanolik daun apu-apu... 35
Gambar 7. Grafik penentuan OT rutin... 38
Gambar 8. Grafik penentuan OT ekstrak metanolik daun apu-apu... 38
Gambar 9. Struktur rutin... 40
Gambar 10. Grafik konsentrasi rutin vs. %IC... 42
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat pengesahan determinasi tanaman... 50
Lampiran 2. Gambar tanaman apu-apu... 51
Lampiran 3. Perhitungan rendemen... 52
Lampiran 4. Data penimbangan untuk penetapan kandungan fenolik total.... 53
Lampiran 5. Scanning kontrol asam galat... 53
Lampiran 6. Optimasi penetapan kandungan fenolik total... 54
Lampiran 7. Penetapan kandungan fenolik total... 59
Lampiran 8. Data penimbangan untuk pengujian aktivitas antioksidan... 66
Lampiran 9. Data konsentrasi bahan untuk pengujian aktivitas antioksidan.. 67
Lampiran 10. Scanning larutan... 74
Lampiran 11. Penentuan λ maksimum dan operating time (OT) untuk pengujian aktivitas antioksidan... 76 Lampiran 12. Pengujian aktivitas antioksidan... 85
Lampiran 13. Perhitungan IC50 rutin dan ekstrak metanolik daun apu-apu... 89
xvii INTISARI
Daun apu-apu (Pistia stratiotes L.) memiliki kandungan senyawa fenolik. Senyawa fenolik dapat berperan sebagai antioksidan. Antioksidan merupakan senyawa yang dapat menghambat reaksi radikal bebas dalam tubuh. Penelitian ini bertujuan untuk menetapkan kandungan fenolik total dan menguji aktivitas antioksidan dengan metode DPPH (1,1-diphenyl-2-picrylhydrazyl) ekstrak metanolik daun apu-apu.
Kandungan fenolik total ditentukan dengan metode Folin-Ciocalteu dan baku standar berupa asam galat dengan prinsip senyawa fenolik teroksidasi dan pereaksi Folin-Ciocalteu tereduksi, sehingga larutan berwarna biru. Warna yang ditimbulkan diukur absorbansinya dengan spektrofotometer visibel. Aktivitas antioksidan ditentukan dengan metode DPPH yang prinsipnya penurunan intensitas absorbansi DPPH yang sebanding dengan kenaikan konsentrasi senyawa antioksidan yang dinyatakan dalam IC50 (Inhibition Concentration 50).
Penelitian menunjukkan bahwa kandungan fenolik total ekstrak metanolik daun apu-apu sebesar (0,5078 ± 0,0168) mg ekivalen asam galat per gram ekstrak metanolik. Aktivitas antioksidan ekstrak metanolik daun apu-apu tergolong lemah dengan nilai IC50 sebesar (350,8152 ± 2,8591) μg/mL.
xviii ABSTRACT
Apu-apu leaves (Pistia stratiotes L.) contain phenolic compound that can act as antioxidant. Antioxidant is a compound that can inhibit the reaction of free radical within the body. The aims of this study are to determine total phenolic content and antioxidant activity with DPPH (1,1-diphenyl-2-picrylhydrazyl) method in apu-apu leaves methanolic extract.
Total phenolic content determined by Folin-Ciocalteu method with gallic acid as standard compound, which the principle of this method is phenolic compound oxidized and Folin-Ciocalteu reagent reducted, which result a blue solution and the absorbance measured with spectrophotometer visible. Antioxidant activity determined by DPPH radical scavenging method, which the principle is the DPPH absorbance intensity decreasing proportional with the increasing of antioxidant compound concentration. Antioxidant activity expressed as IC50 (Inhibition Concentration 50).
Research showed that total phenolic content of apu-apu leaves methanolic extract is (0,5078 ± 0,0168) miligrams gallic acid equivalent per gram of methanolic extract. Antioxidant activity of apu-apu leaves methanolic extract relatively weak with the IC50 value (350,8152 ± 2,8591) μg/mL.
1 BAB I PENGANTAR
A.Latar Belakang
Reaksi oksidasi yang berlebihan di dalam tubuh menyebabkan timbulnya berbagai penyakit, misalnya kanker, penuaan dini, artritis, dan sebagainya. Reaksi oksidasi mencetuskan terbentuknya radikal bebas yang sangat aktif, yang dapat merusak fungsi dan struktur sel. Akan tetapi, reaktivitas radikal bebas tersebut dapat dihambat oleh sistem antioksidan yang melengkapi sistem kekebalan tubuh.
Reactive Oxygen Species (ROS) merupakan salah satu bentuk radikal bebas yang memiliki elektron tidak berpasangan. Senyawa radikal bebas terbentuk secara terus-menerus di dalam tubuh, baik melalui proses metabolisme sel normal, peradangan, kekurangan gizi, serta akibat respons terhadap pengaruh eksternal, seperti polusi lingkungan, sinar ultraviolet, asap rokok, dan sebagainya. Radikal bebas memiliki reaktivitas yang sangat tinggi, tidak stabil, dan umurnya sangat singkat. Karena memiliki reaktivitas yang sangat tinggi, senyawa radikal bebas akan sesegera mungkin menyerang komponen seluler yang ada di sekitarnya, baik berupa lipid, lipoprotein, protein, karbohidrat, RNA, maupun DNA. Reaktivitas ini mengakibatkan kerusakan fungsi dan struktur dari sel (Marx, 1985; Winarsi, 2007).
menetralkan radikal bebas, sehingga kerusakan sel bisa terhambat. Senyawa antioksidan dapat diperoleh dari senyawa-senyawa metabolit sekunder tanaman yang dalam strukturnya memiliki cincin aromatis fenol atau senyawa fenolik. Cincin aromatis fenol tersebut yang akan berkontribusi terhadap aktivitas antioksidan (Shahidi, 1997; Winarsi, 2007).
Senyawa antioksidan sintetis seperti butylated hydroxytoluene (BHT),
butylated hydroxyanisole (BHA), tert-butylhydroquinone (TBHQ), dan propyl gallate (PG), telah banyak digunakan secara luas selama beberapa dekade. Namun, senyawa antioksidan sintetis ini kemungkinan memiliki efek toksik dan karsinogenik. Selama beberapa tahun terakhir, banyak penelitian yang mengeksplorasi senyawa antioksidan dari alam yang baru, aman, dan juga efektif. Banyak penelitian yang menunjukkan bahwa senyawa antioksidan dalam tanaman efektif dalam menghambat terbentuknya radikal bebas (Zou, Lu, and Wei, 2004; Azlim et al., 2010).
Apu-apu merupakan tanaman air yang biasa ditemukan di sawah, sungai, maupun danau. Daun dari tanaman ini telah digunakan sebagian masyarakat untuk mengobati berbagai penyakit, seperti batuk rejan, demam, dan luka. Daun apu-apu memiliki kandungan senyawa fenolik. Senyawa fenolik berpotensi sebagai antioksidan. Penggunaan ekstrak metanolik didasarkan pada senyawa fenolik yang lebih larut dalam pelarut polar, seperti metanol, etanol, aseton, dan lain-lain (Markham, 1988; Adi, 2007; Dalimartha, 2007; Pengelly, 2006).
digunakan sebagai standar penentuan kandungan fenolik total yang setara dengan massa ekivalen asam galat (Aqil, Ahmad, and Mehmood, 2006). Pengujian aktivitas antioksidan pada penelitian ini menggunakan metode DPPH ( 1,1-diphenyl-2-picrylhydrazyl), suatu metode spektrofotometri visibel yang cepat, efektif, dan sensitif dalam memperkirakan aktivitas antiradikal. Metode DPPH ini banyak digunakan dalam penelitian fitokimia untuk menguji aktivitas peredaman radikal bebas ekstrak. Parameter aktivitas antioksidan yang dihitung, yaitu IC50
atau konsentrasi yang ekivalen memberikan 50% aktivitas antioksidan (Windono, Budiono, Ivone, Valentina, dan Saputro, 2004).
1. Permasalahan
a. Berapa kandungan fenolik total ekstrak metanolik daun apu-apu? b. Berapa nilai IC50ekstrak metanolik daun apu-apu?
2. Keaslian penelitian
Sejauh penelusuran peneliti, penelitian yang serupa pernah dilakukan oleh Jha, Ganesh, and Sharma (2010). Penelitian tersebut menggunakan daun apu-apu yang dipanen dari Lower Lake, Bhopal (M.P), India dan melalui proses pengeringan. Metode ekstraksi yang digunakan adalah soxhletasi. Pada penelitian tersebut aktivitas antioksidan diuji dengan berbagai metode, yaitu
reductive ability, nitric oxide radical assay, dan superoxide scavenging activity.
fenolik total. Dalam penelitian ini metode ekstraksi yang digunakan, yaitu maserasi dan metode pengujian aktivitas antioksidan menggunakan metode
DPPH, serta menggunakan metode Folin-Ciocalteu untuk menetapkan kandungan fenolik total.
3. Manfaat penelitian a. Manfaat teoritis
Hasil penelitian diharapkan dapat memperkaya pengetahuan tentang aktivitas antioksidan ekstrak metanolik daun apu-apu dengan menggunakan metode DPPH.
b. Manfaat praktis
Hasil penelitian ini diharapkan dapat memberikan informasi tentang aktivitas antioksidan daun apu-apu, sehingga dapat dimanfaatkan sebagai antioksidan alami.
B.Tujuan Penelitian 1. Tujuan umum
Untuk mengetahui aktivitas antioksidan ekstrak metanolik daun apu-apu terhadap radikal DPPH.
2. Tujuan khusus
a. Untuk mengetahui kadar fenolik total dalam ekstrak metanolik daun apu-apu.
b. Untuk mengetahui nilai IC50 ekstrak metanolik daun apu-apu terhadap
5 BAB II
PENELAAHAN PUSTAKA
A. Apu - Apu 1. Nama lain dan sistematika apu-apu
Tanaman apu-apu dikenal juga dengan nama : kiambang, kapu-kapu, empieng ara, sarme-sarme, gajambang, sirambon, ki apu, kayu apu, apon-apon, kajeng apu, payapeh, apung-apung, capo-capo, poda-poda, water cabbage,
duck weed, tropical duck weed, jalkumbhi (Suhono, 2010).
Sistematika tanaman apu-apu menurut USDA (2014) adalah sebagai berikut :
Kingdom : Plantae
Sub kingdom : Tracheobionta Super divisi : Spermatophyta
Divisi : Magnoliophyta
Kelas : Liliopsida
Sub kelas : Arecidae
Ordo : Arales
Famili : Araceae
Genus : Pistia L.
2. Gambaran umum apu-apu
Tanaman apu-apu merupakan herba tahunan yang banyak terdapat di seluruh dunia. Di Indonesia, apu-apu dapat ditemukan mengapung di perairan. Tanaman ini dapat tumbuh di perairan di dataran rendah, rawa sampai di danau di daerah pegunungan. Tanaman air ini tingginya 5-30 cm, berupa kumpulan daun membulat yang mengapung di air. Batangnya hampir tidak terlihat karena kecil dan dijejali oleh beberapa daun yang melingkar letaknya. Daun apu-apu berbentuk lonjong dengan ujung daun membulat. Daunnya berwarna hijau muda atau hijau tua, tebal, serta berambut banyak. Permukaan daun akan terasa seperti beludru ketika disentuh. Satu tanaman memiliki 3-7 lembar daun. Akar apu-apu mengambang dalam air dengan jumlah yang banyak dan tebal. Akar memiliki stolon dengan panjang mencapai 40 cm yang mengeluarkan tunas-tunas, sehingga tanaman hidup berumpun. Bunga terdapat dalam tongkol yang berseludang berwarna putih dengan ukuran 1-1,5 cm. Bunga jantan berada di bagian atas dan bunga betina di bagian bawah tongkol. Tangkai bunga sangat pendek, berbulu, keluar dari ketiak daun. Buah berupa buah buni berwarna merah berukuran kecil. Buah memiliki biji fertil yang dapat ditanam menjadi individu baru (Suhono, 2010).
3. Kegunaan dan khasiat apu-apu
Di Indonesia, daun apu-apu dimanfaatkan untuk memijahkan ikan, sebagai tanaman hias di akuarium, pakan babi, bebek, itik, ayam, ikan gurami, serta ikan mas. Remasan daun digunakan untuk tapal bila terkena air panas. Rebusan daun atau akarnya dapat digunakan sebagai obat pencahar. Daun muda dapat direbus untuk lalap (Suhono, 2010).
Herba apu-apu rasanya pedas dan terasa sejuk, berkhasiat antireumatik, anti radang, diaforetik, dan diuretik. Herba apu-apu dapat digunakan untuk mengobati flu, demam, batuk rejan, memar, reumatik, edema, disuria, kencing nanah, gatal-gatal, disentri, serta penyakit kulit seperti bisul dan eksim. Kandungan kimia yang terdapat dalam tanaman apu-apu ini antara lain flavonoid, tanin, dan polifenol. (Dalimartha, 2007).
B. Senyawa Fenolik
Senyawa fenolik adalah kelompok terbesar metabolit sekunder pada tanaman. Senyawa fenolik termasuk dalam alkohol aromatik sebab gugus hidroksilnya selalu melekat pada cincin benzen. Seyawa fenolik secara umum memiliki potensi sebagai bakterisidal, antiseptik, antioksidan, dan sebagainya (Pengelly, 2006). Senyawa fenolik merupakan kelompok mayoritas senyawa yang dapat bertindak sebagai antioksidan. Alasan inilah yang mendukung untuk melakukan analisis kandungan fenolik total dalam suatu ekstrak tanaman (Veeru, Kishkar, and Meennakashi, 2009).
aromatisnya. Senyawa fenolik dapat mengkompleks protein, sehingga dapat menghambat beberapa enzim. Sifat ini menguntungkan pada proses ekstraksi karena reaksi enzimatik tidak diharapkan selama proses ekstraksi terjadi (Simpson, 1985).
C. Ekstraksi
Ekstraksi merupakan proses pemisahan bahan dari campurannya dengan menggunakan pelarut. Sedangkan, ekstrak adalah sediaan yang diperoleh dengan cara ekstraksi tanaman obat dengan ukuran partikel tertentu menggunakan cairan penyari yang sesuai. Metode ekstraksi yang paling sederhana, yaitu maserasi. Pada maserasi penyarian simplisia dilakukan dengan menggunakan bermacam pelarut pada suhu kamar selama beberapa waktu (Agoes, 2009).
Pada saat proses maserasi, cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif. Zat aktif akan larut dan karena adanya perbedaan konsentrasi antara larutan zat aktif dalam sel dengan yang berada di luar sel, maka larutan dengan konsentrasi tinggi didesak keluar. Peristiwa tersebut terjadi berulang sampai terjadi keseimbangan konsentrasi antara larutan di dalam dan di luar sel (Departemen Kesehatan Republik Indonesia, 1986).
D. Radikal Bebas dan Antioksidan
terbentuk melalui homolisis ikatan kimia yang biasanya dipacu oleh cahaya. Satu spesies radikal bebas dapat memacu pembentukan radikal bebas yang lain melalui berbagai reaksi pengambilan dan adisi. Reaksi radikal bebas kebanyakan merupakan reaksi rantai yang setiap tahapnya memberikan hasil yang mengakibatkan terbentuknya radikal bebas yang memperpanjang runtunan reaksi (Ardhie, 2011; Joedodibroto dan Hadiwidjoyo, 1988).
Antioksidan merupakan senyawa yang memiliki kemampuan untuk meredam radikal bebas. Radikal bebas dapat mengoksidasi asam nukleat, protein, lipid, serta DNA, dan dapat menginisiasi timbulnya penyakit degeneratif. Senyawa antioksidan seperti asam fenolik, polifenol, dan flavonoid meredam radikal bebas peroksida, hidroperoksida atau lipid peroksil dan menghambat mekanisme oksidatif yang menimbulkan penyakit degeneratif (Prakash, Rigelhof,
and Miller, 2007).
E. Metode Folin-Ciocalteu
Ion fenolat dari senyawa fenolik bereaksi dengan reagen Folin-Ciocalteu menjadi suatu kompleks molibdenum-tungsten melalui reduksi asam fosfomolibdat - fosfotungstat dalam reagen Folin-Ciocalteu. Senyawa fenolik bereaksi dengan reagen Folin-Ciocalteu dalam suasana basa agar terjadi disosiasi proton pada senyawa fenolik menjadi ion fenolat. Warna biru yang terbentuk kepekatannya setara dengan konsentrasi ion fenolat yang ada, artinya semakin besar konsentrasi senyawa fenolik, maka semakin banyak ion fenolat yang mereduksi asam fosfomolibdat-fosfotungstat menjadi senyawa kompleks molibdenum-tungsten, sehingga warna biru yang dihasilkan semakin pekat (Apsari dan Susanti, 2011; Waterhouse, 2002).
F. Metode DPPH
Metode yang cepat, sederhana, dan ekonomis untuk mengukur aktivitas antioksidan yakni dengan menggunakan radikal 1,1-diphenyl-2-picrylhydrazyl
(DPPH). Metode DPPH banyak digunakan untuk menguji kemampuan suatu senyawa dalam bertindak sebagai peredam radikal bebas atau sebagai donor elektron, serta untuk mengevaluasi aktivitas antioksidan dalam suatu sampel (Prakash et al, 2007).
Elektron tak berpasangan pada radikal bebas DPPH memberikan serapan kuat pada panjang gelombang 517 nm dengan warna ungu. Warna ungu akan berubah menjadi kuning sebanding dengan penurunan serapan molar radikal
DPPH pada panjang gelombang 517 nm. Hal tersebut terjadi ketika elektron tak berpasangan pada radikal bebas DPPH berpasangan dengan elektron dari antioksidan untuk membentuk DPPH-H tereduksi (Prakash et al, 2007).
Gambar 2. Perubahan warna DPPH dari ungu menjadi kuning ketika tereduksi oleh senyawa antioksidan (Perez and Aguilar, 2013)
G. Landasan Teori
sekitarnya. Radikal bebas dapat mengoksidasi asam nukleat, protein, lipid, DNA, dan dapat memicu penyakit degeneratif. Senyawa antioksidan dapat meredam radikal bebas dan menghambat reaksi oksidatif, sehingga kerusakan sel akibat radikal bebas dapat tercegah.
Apu-apu merupakan tanaman air yang mudah ditemukan dan berkhasiat sebagai antireumatik, anti radang, diaforetik, dan diuretik. Masyarakat biasanya menggunakan apu-apu untuk mengobati flu, demam, batuk rejan, memar, reumatik, edema, disuria, kencing nanah, gatal-gatal, disentri, bisul, dan eksim. Apu-apu telah diketahui memiliki kandungan senyawa fenolik, sehingga dapat berpotensi sebagai antioksidan.
Kandungan fenolik total dalam suatu sampel dapat dianalisis dengan menggunakan metode Folin-Ciocalteu. Prinsipnya, yaitu reduksi reagen campuran asam fosfomolibdat-fosfotungstat dengan adanya senyawa fenolik akan menghasilkan senyawa kompleks berwarna biru yang serapannya kuat pada panjang gelombang 760 nm. Intensitas serapan pada panjang gelombang tersebut sebanding dengan jumlah senyawa fenolik dalam sampel.
H. Hipotesis
1. Ekstrak metanolik daun apu-apu memiliki kandungan senyawa fenolik yang dinyatakan dengan mg ekivalen asam galat.
14 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk penelitian eksperimental dengan rancangan acak lengkap pola searah.
B. Variabel dan Definisi Operasional 1. Variabel
a. Variabel bebas : konsentrasi ekstrak metanolik daun apu-apu. b. Variabel tergantung : aktivitas antioksidan (%IC).
c. Variabel pengacau terkendali : waktu pemanenan, tempat tumbuh. d. Variabel pengacau tak terkendali : umur daun yang dipanen. 2. Definisi operasional
a. Daun apu-apu adalah daun dari tanaman apu-apu yang dipanen dari kolam di Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma, Paingan, Maguwoharjo, Sleman, Yogyakarta, dengan bentuk daun yang lonjong dan membulat di bagian ujungnya, memiliki permukaan seperti beludru, berwarna hijau, dengan panjang ± 6 cm dan lebar ± 4 cm.
c. Persen inhibition concentration (%IC) adalah persen yang menyatakan kemampuan ekstrak metanolik daun apu-apu dalam meredam radikal
DPPH.
d. Inhibition concentration 50 (IC50) adalah nilai konsentrasi ekstrak
metanolik daun apu-apu yang dapat meredam 50% radikal DPPH.
C. Bahan Penelitian
Bahan yang digunakan dalam penelitian ini, antara lain : daun apu-apu yang diperoleh dari Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma, Paingan, Maguwoharjo, Sleman, Yogyakarta; bahan kimia kualitas farmasetis berupa akuades (Farmasi Sanata Dharma); bahan kimia kualitas pro analitik E.Merck berupa metanol; bahan kimia kualitas pro analitik Sigma Chem. Co., USA berupa rutin, DPPH, reagen Folin-Ciocalteu, dan asam galat; serta bahan kimia kualitas teknis CV. General Labora berupa metanol dan alumunium foil.
D. Alat Penelitian
Alat yang digunakan dalam penelitian ini, antara lain : blender (Maspion),
shaker (Innova TM 2100), vortex (Janke & Kunkel), spektrofotometer UV-Vis (Shimadzu UV mini-1240 UV-Vis Spektrofotometer), neraca analitik (Scaltec SBC 22, BP 160P), waterbath (labo-tech, Heraeus), vacuum rotary evaporator
serta alat-alat gelas yang lazim digunakan di laboratorium (Pyrex-Germany dan Iwaki).
E. Tata Cara Penelitian 1. Determinasi tanaman
Determinasi tanaman apu-apu yang diperoleh dari Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma, Paingan, Maguwoharjo, Sleman, Yogyakarta, dilakukan di Laboratorium Kebun Tanaman Obat Farmasi Universitas Sanata Dharma berdasarkan USDA (2014).
2. Pengumpulan bahan
Pengumpulan daun apu-apu dilakukan pada bulan Januari 2014. Pemanenan dari kolam Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma, Paingan, Maguwoharjo, Sleman, Yogyakarta dilakukan sebelum tanaman berbunga dan saat pagi hari. Daun yang dipanen adalah daun dewasa berwarna hijau dengan panjang ± 6 cm dan lebar ± 4 cm.
3. Preparasi daun apu-apu
24 jam, dan dilakukan penyaringan kembali. Filtrat yang diperoleh sebanyak 2,1 L kemudian diuapkan pelarutnya dengan vacuum rotary evaporator,
waterbath, dan oven dengan suhu 50◦ C, sehingga diperoleh ekstrak metanolik kental dengan bobot tetap yang akan digunakan untuk analisis lebih lanjut. Ekstrak metanolik kental dengan bobot tetap berupa ekstrak kental berwarna hijau tua kecoklatan dengan aroma khas daun.
4. Pembuatan larutan pembanding dan uji a. Pembuatan larutan DPPH
Sebanyak 15,8 mg DPPH dilarutkan dalam metanol p.a hingga 100,0 mL, sehingga diperoleh larutan DPPH dengan konsentrasi 0,4 mM. Larutan tersebut ditutup dengan alumunium foil dan harus selalu dibuat baru.
b. Pembuatan larutan stok rutin
Sebanyak 2,5 mg rutin dilarutkan dengan metanol p.a hingga 10,0 mL. c. Pembuatan larutan pembanding
Larutan stok rutin diambil sebanyak 0,5; 1,0; 1,5; 2,0; dan 2,5 mL kemudian diencerkan dengan metanol p.a hingga 25,0 mL, sehingga diperoleh konsentrasi larutan standar rutin sebesar 5, 10, 15, 20, dan 25 µg/mL.
d. Pembuatan larutan uji
i. Larutan uji untuk aktivitas antioksidan
hingga 10,0 mL, sehingga akan diperoleh konsentrasi larutan uji sebesar 100, 200, 300, 400, dan 500 µg/mL.
ii. Larutan uji untuk penetapan kandungan fenolik total
Sebanyak 100 mg ekstrak metanolik ditimbang dan dilarutkan dengan metanol p.a hingga 10,0 mL, sehingga akan diperoleh konsentrasi larutan uji sebesar 10000 µg/mL.
e. Pembuatan larutan asam galat
Larutan asam galat dibuat dengan konsentrasi 500 µg/mL dalam campuran akuades dengan metanol p.a (1:1). Larutan tersebut diambil sebanyak 1,0; 1,5; 2,0; 2,5; dan 3,0 mL kemudian ditambah dengan akuades : metanol p.a (1:1) hingga 10,0 mL dan diperoleh konsentrasi larutan baku asam galat sebesar 50, 75, 100, 125, dan 150 µg/mL.
5. Uji pendahuluan a. Uji fenolik
Sebanyak 0,5 mL larutan uji dan larutan pembanding asam galat dengan konsentrasi 150,0 µg/mL masing-masing dimasukkan ke dalam tabung reaksi, kemudian ditambah dengan 2,5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan akuades (1:10 v/v). Campuran didiamkan selama 10 menit kemudian ditambah dengan 7,5 mL larutan natrium karbonat 1 M. Warna larutan tersebut diamati.
b. Uji pendahuluan aktivitas antioksidan
larutan pembanding rutin 25 µg/mL, dan larutan uji 500,0 µg/mL. Campuran tersebut ditambah dengan 3 mL metanol p.a dan divortex selama 30 detik. Setelah 30 menit, warna pada larutan tersebut diamati.
6. Optimasi metode penetapan kandungan fenolik total a. Penentuan operating time (OT)
Sebanyak 0,5 mL larutan asam galat 50, 100, dan 150 µg/mL ditambah dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan akuades (1:10 v/v). Kemudian dilakukan penambahan 4,0 mL larutan natrium karbonat 1 M dan dibaca serapannya dengan menggunakan spektrofotometer visibel pada panjang gelombang 760 nm selama 30 menit. b. Penentuan panjang gelombang serapan maksimum
Sebanyak 0,5 mL larutan asam galat 50, 100, dan 150 µg/mL ditambah dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan akuades (1:10 v/v). Kemudian dilakukan penambahan 4,0 mL larutan natrium karbonat 1 M dan didiamkan selama OT. Kemudian dilakukan scanning panjang gelombang serapan maksimum pada panjang gelombang 600-800 nm.
7. Penetapan kandungan fenolik total a. Pembuatan kurva baku asam galat
serapan maksimum terhadap blanko yang terdiri atas akuades : metanol p.a (1:1), reagen Folin-Ciocalteu, dan larutan natrium karbonat 1 M. Dilakukan replikasi sebanyak 3 kali.
b. Estimasi kandungan fenolik total larutan uji
Larutan uji diambil sebanyak 0,5 mL dan dimasukkan ke dalam labu ukur 10 mL, kemudian diberi perlakuan seperti pada pembuatan kurva baku asam galat. Kandungan fenolik total dinyatakan sebagai massa ekivalen asam galat (mg ekivalen asam galat per g ekstrak metanolik). Dilakukan replikasi sebanyak 3 kali.
8. Optimasi metode uji aktivitas antioksidan a. Penentuan operating time (OT)
Dalam tiga buah labu ukur 5 mL, masing-masing ditambah dengan 1 mL larutan DPPH, 1 mL larutan pembanding rutin 5, 15, dan 25 µg/mL, kemudian ditambah dengan metanol p.a hingga tanda batas. Larutan divortex selama 30 detik dan dibaca serapannya dengan menggunakan spektrofotometer visibel pada panjang gelombang 517 nm selama 1 jam. Perlakuan yang sama juga dilakukan pada larutan uji dengan konsentrasi 100, 300, dan 500 µg/mL.
b. Penentuan panjang gelombang serapan maksimum
selama 30 detik, lalu didiamkan selama OT teoritis 30 menit. Dilakukan
scanning panjang gelombang serapan maksimum dengan menggunakan spektrofotometer visibel pada panjang gelombang 400-600 nm.
9. Uji aktivitas antioksidan
a. Pengukuran absorbansi larutan kontrol DPPH
Sebanyak 2 mL larutan DPPH dimasukkan ke dalam labu ukur 10 mL dan ditambah dengan metanol p.a hingga tanda batas. Setelah OT, larutan dibaca serapannya dengan menggunakan spektrofotometer visibel pada panjang gelombang maksimum. Pengerjaan dilakukan replikasi sebanyak 3 kali. Larutan ini digunakan sebagai larutan kontrol untuk menguji larutan pembanding dan uji.
b. Pengukuran absorbansi larutan pembanding dan uji
Sebanyak 2 mL larutan DPPH dimasukkan ke dalam labu ukur 10 mL dan ditambah dengan 2 mL larutan pembanding dan larutan uji pada berbagai seri konsentrasi yang telah dibuat, kemudian ditambah dengan metanol p.a hingga tanda batas. Larutan divortex selama 30 detik, lalu didiamkan selama OT. Dilakukan pembacaan serapan menggunakan spektrofotometer visibel pada panjang gelombang maksimum. Pengerjaan dilakukan replikasi sebanyak 3 kali.
c. Estimasi aktivitas antioksidan
F. Analisis Hasil
Kandungan fenolik total dalam ekstrak metanolik daun apu-apu dinyatakan sebagai mg ekivalen asam galat per g ekstrak metanolik daun apu-apu. Nilai absorbansi larutan uji dimasukkan ke dalam persamaan kurva baku asam galat, sehingga diperoleh nilai ekivalensi larutan uji terhadap asam galat. Kandungan fenolik total diperoleh berdasarkan rumus :
nilai ekivalensi larutan uji terhadap asam galat × volume larutan uji massa ekstrak yang ditimbang
Aktivitas peredaman radikal DPPH (% IC) dihitung berdasarkan rumus :
absorbansi larutan kontrol−absorbansi larutan pembanding atau larutan uji
absorbansi larutan kontrol × 100 %
Data aktivitas peredaman radikal DPPH tersebut dianalisis dan dihitung nilai IC50
menggunakan persamaan regresi linear y = bx + a, di mana x merupakan konsentrasi larutan pembanding atau larutan uji dan y merupakan %IC. Data nilai
IC50 dianalisis secara statistik untuk mengetahui ada atau tidak adanya perbedaan
23 BAB IV
HASIL DAN PEMBAHASAN
A.Hasil Determinasi Tanaman
Determinasi tanaman perlu dilakukan sebelum melakukan proses penelitian dengan tujuan untuk mengetahui dan memastikan kebenaran tanaman yang akan digunakan dalam penelitian. Pemastian kebenaran tanaman diperlukan untuk mencegah terjadinya kesalahan dalam pengambilan sampel. Determinasi tanaman yang digunakan dalam penelitian ini dilakukan berdasarkan USDA (2014). Hasil determinasi menunjukkan bahwa tanaman yang digunakan merupakan Pistia stratiotes L. yang dikenal juga dengan sebutan apu-apu (Lampiran 1).
B.Hasil Pengumpulan Tanaman
banyak berkurang. Pada daun dewasa, kandungan metabolit sekunder diharapkan maksimal.
Daun dipanen sebelum tanaman berbunga pada pagi hari untuk mendapatkan kandungan metabolit sekunder yang maksimal. Menurut Caduto (2007), ketika tanaman berbunga, kandungan metabolit yang ada dalam daun akan berkurang karena tanaman akan memfokuskan metabolit sekundernya untuk proses pembungaan. Pemanenan pada pagi hari dilakukan karena kandungan metabolit sekunder yang berperan sebagai antioksidan akan berkurang ketika sudah terpapar sinar UV dari matahari.
C.Hasil Preparasi Sampel
Preparasi sampel dilakukan untuk memperoleh ekstrak metanolik yang diduga mengandung senyawa fenolik dan memiliki aktivitas antioksidan. Setelah proses pemanenan, maka dilakukan sortasi basah dan pencucian dengan air mengalir untuk memisahkan daun dari pengotor-pengotor yang tidak diinginkan, misalnya tanah dan bagian tanaman yang lain. Daun kemudian dikering-anginkan pada udara terbuka yang terlindung dari sinar matahari dengan tujuan menghilangkan sisa air pencuci pada permukaan daun.
Sampel daun yang digunakan pada penelitian ini merupakan daun segar, sehingga ketika daun sudah terbebas dari air pencuci, maka dapat dilakukan proses selanjutnya. Penelitian Wangcharoen and Gomolmanee (2013) mengenai pengaruh pengeringan terhadap aktivitas antioksidan pada daun Moringa oleifera
60% dari aktivitas antioksidan daun segar. Oleh karena itu, dalam penelitian ini digunakan daun yang masih segar yang diharapkan memiliki aktivitas antioksidan lebih maksimal dibandingkan daun yang dikeringkan.
Daun apu-apu segar dimasukkan ke dalam blender untuk memperkecil ukuran partikel, sehingga akan lebih mudah tersari ketika dilakukan proses ekstraksi. Dalam pengecilan ukuran partikel ini, ditambahkan sedikit cairan penyari dengan tujuan untuk mempermudah proses pengecilan ukuran partikel dalam blender. Menurut Meireles (2009), pengecilan ukuran partikel akan meningkatkan proses penetrasi cairan penyari ke dalam matriks partikel padat, sehingga pengecilan ukuran partikel yang dilakukan dalam penelitian ini dimaksudkan untuk mengefektifkan proses penyarian yang akan terjadi.
Pemilihan cairan penyari didasarkan pada kemampuan pelarut dalam menyari senyawa yang dikehendaki semaksimal mungkin. Pada penelitian ini, cairan penyari yang digunakan adalah metanol. Metanol dapat melarutkan senyawa baik yang polar maupun non polar. Menurut Tiwari, Kumar, and Kaur (2011), viskositas metanol lebih rendah (0,6 cPoise) dibandingkan dengan air (1,00 cPoise) dan etanol (1,20 cPoise), sehingga metanol lebih efektif dalam menembus membran sel tanaman dan menyari senyawa-senyawa yang ada di dalam sel. Metanol juga dapat menginaktifkan enzim polifenol oksidase yang menyebabkan penurunan aktivitas ekstrak air.
yang sesuai. Metode ekstraksi yang digunakan dalam penelitian ini adalah maserasi dinamis. Metode maserasi dinamis dipilih dengan tujuan menghindari perubahan senyawa-senyawa kimia yang ada dalam tanaman akibat adanya pemanasan. Menurut Filho (2012), kelebihan metode maserasi dinamis dibandingkan metode ekstraksi lainnya, yaitu lebih cepat dibandingkan metode maserasi statis, menggunakan peralatan yang sederhana, dan prosesnya dilakukan tanpa adanya pemanasan, sehingga cocok untuk senyawa-senyawa yang termolabil. Prinsip metode maserasi dinamis, yaitu menyari senyawa yang diinginkan dengan cara merendam daun yang telah halus dalam cairan penyari yang sesuai pada suhu kamar dan terlindung dari cahaya, serta dengan penggojogan yang konstan. Cairan penyari akan masuk ke dalam sel dan melarutkan isi sel melalui peristiwa difusi yang terjadi berulang-ulang hingga tercapai keseimbangan konsentrasi antara larutan di dalam dan di luar sel.
Hasil maserasi dan remaserasi kemudian disaring dengan menggunakan kertas saring dalam corong Buchner dengan bantuan pompa vakum untuk mendapatkan ekstrak cair. Pompa vakum dalam proses penyaringan ini dimaksudkan untuk mempercepat dan mengoptimalkan proses penyaringan. Ekstrak cair yang diperoleh kemudian diuapkan pelarutnya dengan menggunakan
vacuum rotary evaporator dengan suhu 50 ̊ C. Prinsip penguapan pelarut dengan alat ini, yaitu menguapkan pelarut di bawah titik didih dengan tekanan rendah dan mengkondensasikannya, sehingga dapat diperoleh pelarutnya kembali secara terpisah. Penguapan pelarut dengan alat ini menguntungkan karena prosesnya cepat dan dapat mencegah rusaknya senyawa-senyawa kimia dalam ekstrak akibat suhu yang tinggi. Ekstrak kental yang diperoleh dari hasil penguapan dengan
D.Hasil Uji Pendahuluan
1. Uji pendahuluan kandungan fenolik
Uji pendahuluan kandungan fenolik dimaksudkan untuk mengetahui secara kualitatif keberadaan senyawa fenolik dalam ekstrak metanolik daun apu-apu. Pengujian secara kualitatif ini penting dilakukan sebelum melakukan pengujian secara kuantitatif. Uji kualitatif senyawa fenolik dilakukan dengan prinsip reaksi oksidasi-reduksi dalam suasana basa menggunakan reagen Folin-Ciocalteu dan natrium karbonat. Senyawa fenolik akan berubah menjadi ion fenolat dalam suasana basa. Ion fenolat yang terbentuk akan mereduksi asam fosfomolibdat-fosfotungstat dalam reagen Folin-Ciocalteu selama proses oksidasi fenol menjadi senyawa kompleks berwarna biru (Haci, Didi, Bekkara, and Gherib, 2009).
bahwa ekstrak metanolik daun apu-apu memiliki kandungan senyawa fenolik (Gambar 3).
A B C
Gambar 3. Hasil uji pendahuluan kandungan fenolik (A=kontrol positif [asam galat + reagen Folin-Ciocalteu + Na2CO3]; B=sampel [larutan uji ekstrak metanolik daun apu-apu + reagen Folin-Ciocalteu + Na2CO3]; C=kontrol negatif
[air:metanol (1:1) + reagen Folin-Ciocalteu + Na2CO3])
2. Uji pendahuluan aktivitas antioksidan
Tujuan dilakukannya uji pendahuluan aktivitas antioksidan pada ekstrak metanolik daun apu-apu, yaitu untuk mengetahui aktivitas antioksidannya secara kualitatif. Pengujian dilakukan menggunakan DPPH yang dicampurkan dengan larutan uji ekstrak metanolik daun apu-apu dan diamati perubahan warna yang terjadi. Menurut Molyneux (cit., Sanchez, Garcia, and Cors, 2010), DPPH
dapat mendonorkan elektronnya, maka DPPH akan tereduksi, sehingga absorbansi akan menurun. Dalam uji kualitatif, tereduksinya DPPH ditandai dengan terbentuknya senyawa kompleks berwarna kuning.
A B C
Gambar 4. Hasil uji pendahuluan aktivitas antioksidan
(A=kontrol negatif [larutan DPPH]; B=kontrol positif [larutan DPPH + larutan rutin]; C=sampel [larutan DPPH + larutan uji ekstrak metanolik daun apu-apu])
Uji pendahuluan aktivitas antioksidan yang dilakukan ini menggunakan kontrol positif dan kontrol negatif sebagai pembanding hasil. Kontrol positif berupa campuran larutan DPPH dengan larutan rutin yang merupakan senyawa antioksidan kuat, sedangkan kontrol negatif berupa larutan DPPH. Pengujian menunjukkan hasil positif pada larutan uji ekstrak metanolik daun apu-apu dengan adanya perubahan warna dari ungu ke kuning (Gambar 4).
E.Hasil Optimasi Metode Penetapan Kandungan Fenolik Total
1. Penentuan operating time (OT)
mengukur absorbansi dari larutan asam galat dengan reagen Folin-Ciocalteu dalam suasana basa dengan menggunakan spektrofotometer visibel pada panjang gelombang serapan maksimum teoritis menurut Blainski, Lopes, and Mello (2013), yaitu 760 nm. OT ditentukan berdasarkan waktu ketika nilai absorbansi mulai stabil atau selisih nilai absorbansi tiap selang waktu mulai kecil. Pengukuran absorbansi untuk penentuan OT ini dilakukan tiap selang waktu 5 menit selama 30 menit. Hasil OT yang diperoleh, yaitu 20 menit (Gambar 5), yang menunjukkan bahwa pada menit ke 20 reaksi telah berjalan sempurna.
Gambar 5. Grafik penentuan OT asam galat
2. Penentuan panjang gelombang serapan maksimum
Penentuan panjang gelombang serapan maksimum dilakukan untuk mendapatkan panjang gelombang yang akan digunakan untuk pengukuran absorbansi dalam pengujian kandungan fenolik total sampel. Panjang gelombang
0
Penentuan
Operating Time
Asam Galat
serapan maksimum merupakan daerah serapan maksimum yang dihasilkan oleh reaksi yang terjadi antara senyawa fenolik dengan reagen Folin-Ciocalteu dalam suasana basa. Pada panjang gelombang serapan maksimum, adanya sedikit perubahan pada konsentrasi akan memberikan perubahan yang besar pada absorbansi yang dihasilkan, sehingga kepekaan analisisnya lebih baik.
Panjang gelombang serapan maksimum ditentukan melalui tiga konsentrasi larutan asam galat, yaitu konsentrasi 50, 100, dan 150 μg/ml yang
merupakan konsentrasi tinggi, tengah, dan rendah. Penggunaan tiga konsentrasi tersebut diharapkan dapat merepresentasikan panjang gelombang serapan maksimum dari konsentrasi yang berbeda. Panjang gelombang maksimum yang didapatkan, yaitu 760,5 nm (Tabel I), sedangkan panjang gelombang serapan maksimum secara teoritisnya adalah 760 nm. Perbedaan panjang gelombang yang diperoleh dengan panjang gelombang secara teoritis masih dapat diterima karena menurut Farmakope Indonesia edisi IV (1995), pergeseran panjang gelombang yang diperbolehkan, yaitu 2 nm dari batas yang ditentukan.
Tabel I. Hasil scanning panjang gelombang serapan maksimum asam galat yang direaksikan dengan reagen Folin-Ciocalteu dalam suasana basa
Konsentrasi
dilakukan dengan cara melakukan scanning kedua larutan tersebut pada panjang gelombang 600-800 nm dan spektranya diamati pada panjang gelombang maksimum. Hasil scanning larutan asam galat dan larutan uji ekstrak metanolik daun apu-apu menunjukkan tidak adanya serapan dari kedua larutan uji pada panjang gelombang serapan maksimum (Lampiran 10).
F. Hasil Penetapan Kandungan Fenolik Total
Penetapan kandungan fenolik total bertujuan untuk mengetahui kandungan senyawa fenolik secara total dalam ekstrak metanolik daun apu-apu yang diperkirakan memiliki aktivitas antioksidan. Penetapan kandungan fenolik total ekstrak metanolik daun apu-apu dilakukan menggunakan metode spektrofotometri visibel. Prinsip metode spektrofotometri visibel dalam penelitian ini adalah pengukuran absorbansi dari senyawa kompleks yang terbentuk dari reaksi antara reagen Folin-Ciocalteu dengan senyawa fenolik dalam suasana basa yang absorbansinya diukur menggunakan spektrofotometer visibel pada OT dan panjang gelombang serapan maksimum yang telah ditetapkan sebelumnya. Kandungan fenolik total dalam ekstrak metanolik daun apu-apu ditetapkan berdasarkan regresi linear dari kurva baku asam galat. Kandungan fenolik total yang diperoleh ditetapkan sebagai massa ekivalen asam galat.
Folin-Ciocalteu selama proses oksidasi fenol menjadi senyawa kompleks berwarna biru. Menurut Blainski, Lopes, and Mello (2013), serapan kromofor yang terbentuk dalam kompleks fosfomolibdat-fosfotungstat bergantung pada kebasaan dan konsentrasi senyawa fenolik yang ada. Semakin besar konsentrasi senyawa fenolik, maka semakin pekat warna biru yang terbentuk, sehingga absorbansi yang terukur pun akan semakin besar.
Tabel II. Pembuatan kurva baku asam galat Replikasi Konsentrasi (μg/mL
) Absorbansi Persamaan regresi linear
paling baik, yaitu pada replikasi kedua. Persamaan yang diperoleh pada replikasi kedua, yaitu y = 0,0048x + 0,0660 dengan r = 0,9997.
Gambar 6. Kurva baku asam galat untuk penetapan kandungan fenolik total ekstrak metanolik daun apu-apu
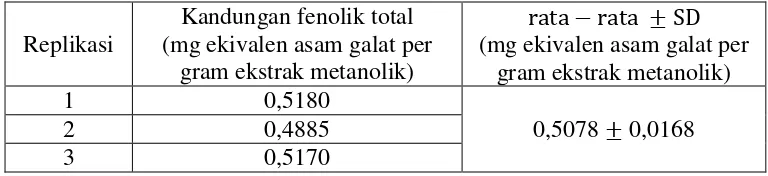
Kandungan fenolik total dalam ekstrak metanolik daun apu-apu dihitung berdasarkan persamaan regresi linear yang telah diperoleh sebelumnya. Hasil penghitungan dari ketiga replikasi ekstrak metanolik daun apu-apu menunjukkan bahwa kandungan fenolik total rata-ratanya adalah 0,5078 ± 0,0168 mg ekivalen asam galat per gram ekstrak metanolik daun apu-apu (Tabel III).
Tabel III. Kandungan fenolik total ekstrak metanolik daun apu-apu Replikasi
Kandungan fenolik total (mg ekivalen asam galat per
gram ekstrak metanolik)
rata−rata ± SD
(mg ekivalen asam galat per gram ekstrak metanolik)
G.Hasil Optimasi Metode Uji Aktivitas Antioksidan dengan Radikal DPPH
1. Penentuan panjang gelombang serapan maksimum
Penentuan panjang gelombang serapan maksimum bertujuan untuk memperoleh panjang gelombang yang akan digunakan untuk mengukur serapan sampel. Pada panjang gelombang serapan maksimum inilah DPPH memberikan serapan yang maksimum. Pengukuran aktivitas antioksidan dilakukan pada panjang gelombang serapan maksimum karena pada panjang gelombang maksimum, adanya sedikit perubahan pada konsentrasi akan memberikan perubahan yang besar pada absorbansi yang dihasilkan, sehingga kepekaan analisisnya lebih baik.
Scanning panjang gelombang serapan maksimum larutan DPPH
dilakukan pada panjang gelombang visibel, yaitu rentang antara 600-800 nm.
DPPH memiliki kromofor dan auksokrom pada strukturnya, serta adanya delokalisasi elektron di sekeliling molekulnya, sehingga menimbulkan warna ungu yang dapat diukur serapannya pada panjang gelombang visibel. Penentuan panjang gelombang serapan maksimum dilakukan dengan menggunakan tiga konsentrasi larutan DPPH, yaitu konsentrasi 0,020 ; 0,040 dan 0,060 mM yang merupakan konsentrasi tinggi, tengah, dan rendah. Penggunaan tiga konsentrasi tersebut diharapkan dapat merepresentasikan panjang gelombang serapan maksimum dari konsentrasi yang berbeda. Panjang gelombang serapan maksimum yang didapatkan, yaitu 515 nm (Tabel IV), sedangkan panjang gelombang serapan maksimum secara teoritisnya adalah 517 nm (Blois cit.,
panjang gelombang secara teoritis masih dapat diterima karena menurut Farmakope Indonesia edisi IV (1995), pergeseran panjang gelombang yang diperbolehkan, yaitu 2 nm dari batas yang ditentukan.
Tabel IV. Hasil scanning panjang gelombang serapan maksimum DPPH
Konsentrasi dipastikan tidak memberikan absorbansi yang mengganggu pengukuran absorbansi yang dilakukan pada panjang gelombang maksimum. Hasil scanning
larutan rutin dan larutan uji ekstrak metanolik daun apu-apu pada panjang gelombang 400-600 nm tidak menunjukkan adanya serapan dari kedua larutan pada panjang gelombang serapan maksimum DPPH yang didapatkan (Lampiran 10).
2. Penentuan operating time (OT)
OT ditentukan dengan tujuan mengetahui waktu yang dibutuhkan agar suatu reaksi berlangsung sempurna. Penentuan OT dilakukan dengan cara mengukur absorbansi dari larutan DPPH dengan larutan rutin dan larutan ekstrak metanolik daun apu-apu menggunakan spektrofotometer visibel pada panjang gelombang serapan maksimum teoritis, yaitu 517 nm (Blois cit., Kedare and
absorbansi untuk penentuan OT ini dilakukan tiap selang waktu 5 menit selama 60 menit. Hasil OT yang diperoleh baik pada larutan rutin dan larutan ekstrak metanolik daun apu-apu, yaitu 35 menit (Gambar 6), yang menunjukkan bahwa pada menit ke 35 reaksi telah berjalan sempurna.
Gambar 7. Grafik penentuan OT rutin
Gambar 8. Grafik penentuan OT ekstrak metanolik daun apu-apu
0
Penentuan
Operating Time
Rutin
5 μg/mL 15 μg/mL 25 μg/mL
Penentuan
Operating Time
Ekstrak
Metanolik Daun Apu-Apu
H.Estimasi Aktivitas Antioksidan dengan Radikal DPPH
Pengukuran aktivitas antioksidan ekstrak metanolik daun apu-apu dilakukan dengan metode DPPH. DPPH adalah radikal bebas yang stabil dan paling sering digunakan untuk mengevaluasi peredaman radikal bebas pada bahan alam. DPPH stabil akibat adanya delokalisasi elektron di keseluruhan molekulnya. Menurut Moniruzzaman, Khalil, Sulaiman, and Gan, (2011), metode
DPPH merupakan metode yang sangat sederhana dan cepat untuk keperluan analisis aktivitas antioksidan. Metode DPPH tidak spesifik untuk antioksidan jenis tertentu, tetapi dapat digunakan untuk pengujian aktivitas antioksidan secara keseluruhan dalam sampel yang dianalisis. Pengujian dengan metode DPPH
didasarkan pada kemampuan radikal bebas DPPH yang stabil untuk bereaksi dengan donor elektron. Pada pengujian ini, larutan DPPH mengalami perubahan warna dari ungu ke kuning karena adanya reduksi DPPH oleh senyawa antioksidan. Perubahan intensitas warna yang terjadi sebanding dengan jumlah elektron yang ditangkap.
Dalam ekstrak metanolik daun apu-apu dan rutin, yang berperan sebagai donor elektron adalah gugus hidroksil yang dimiliki senyawa fenolik. Gugus hidroksil akan mendonorkan elektronnya kepada DPPH, sehingga elektron bebas
aktivitas antioksidan antara sampel dengan pembanding, maka nilai IC50 perlu
dihitung. Nilai IC50 merupakan konsentrasi sampel yang diperlukan untuk
meredam 50% radikal bebas. Nilai IC50 diperoleh berdasarkan persamaan regresi
linear antara serapan dengan konsentrasi sampel. Semakin kecil nilai IC50, maka
semakin besar aktivitas antioksidannya.
Gambar 9. Struktur rutin (Macikova, Halouzka, Hrbac, Bartak and Skopalova, 2012)
Pembanding yang digunakan untuk penetapan aktivitas antioksidan ekstrak metanolik daun apu-apu adalah rutin. Rutin digunakan sebagai pembanding karena rutin merupakan senyawa fenolik yang dalam strukturnya memiliki gugus hidroksil yang bertanggung jawab terhadap peredaman radikal bebas (Gambar 9).
daun apu-apu. Hal ini dikarenakan semakin besar konsentrasi larutan rutin maupun ekstrak metanolik daun apu-apu, maka semakin banyak pula pendonor elektron, sehingga terjadi reduksi serta peluruhan warna DPPH. Pengukuran aktivitas antioksidan rutin dan ekstrak metanolik daun apu-apu dilakukan sebanyak tiga kali replikasi. Persamaan regresi linear yang diperoleh pada masing-masing replikasi digunakan untuk menghitung nilai IC50.
Tabel V. Hasil pengukuran aktivitas antioksidan rutin dengan metode DPPH
Replikasi Konsentrasi aktivitas antioksidan rutin replikasi 2 dan ekstrak metanolik replikasi 1. Kedua grafik tersebut menunjukkan bahwa nilai IC50 diperoleh dari hasil intrapolasi.
Tabel VI. Hasil pengukuran aktivitas antioksidan ekstrak metanolik daun apu-apu
Gambar 10. Grafik konsentrasi rutin vs. %IC
y = 2,3309x + 1,4794
Gambar 11. Grafik konsentrasi ekstrak metanolik daun apu-apu vs. %IC
Tabel VII. Hasil IC50rutin dan ekstrak metanolik daun apu-apu
Rutin
Hasil pengukuran aktivitas antioksidan yang dinyatakan dalam nilai IC50
ditunjukkan pada Tabel VII. Rata-rata IC50 rutin adalah 21,6167 μg/mL (SD =
0,7792). Rata-rata IC50 ekstrak metanolik daun apu-apu adalah 350,8152 μg/mL
(SD = 2,8591), sedangkan IC50 yang diperoleh dalam penelitian Jha, Ganesh, and
Sharma (2010) yaitu 26 μg/mL. Perbedaan IC50 yang besar tersebut disebabkan
Konsentrasi Ekstrak Metanolik vs. %
IC
Konsentrasi Ekstrak Metanolik vs. %IC
oleh adanya kandungan air dalam daun yang bercampur dengan metanol saat proses ekstraksi, sehingga cairan penyari tidak murni metanol seperti pada penelitian Jha, Ganesh, and Sharma (2010). Berdasarkan tingkatan kekuatan antioksidan dengan metode DPPH, rutin termasuk antioksidan yang sangat kuat, sedangkan ekstrak metanolik daun apu-apu termasuk antioksidan lemah (Tabel VIII).
Tabel VIII. Tingkatan kekuatan antioksidan dengan metode DPPH (Blois cit., Fidrianny, Darmawati and Sukrasno, 2014)
Sampel IC50
perbedaan yang besar di antara keduanya. Namun, untuk memastikan adanya perbedaan tersebut, dilakukan uji statistik dengan menggunakan software R 3.0.2. Pengujian statistik yang pertama kali dilakukan adalah uji normalitas data. Uji normalitas data dilakukan untuk mengetahui apakah data IC50 rutin dan ekstrak
normalitas pada data IC50 rutin dan ekstrak metanolik daun apu-apu menunjukkan
bahwa data terdistribusi normal karena p-value tidak kurang dari 0,05 dengan taraf kepercayaan 95% (Lampiran 14).
Data IC50 rutin dan ekstrak metanolik daun apu-apu kemudian diuji
homogenitasnya dengan menggunakan uji F. Uji F merupakan pengujian data dengan membandingkan kedua variansi data dengan tujuan untuk mengetahui homogenitas data. Hipotesis null-nya (H0), yaitu data homogen, sedangkan hipotesis alternatifnya (H1) adalah data tidak homogen. H0 akan diterima dan H1 ditolak apabila p-value tidak kurang dari 0,05 dengan taraf kepercayaan 95% (Pujiati dan Andayani, 2010). Hasil yang diperoleh pada data IC50 rutin dan
ekstrak metanolik daun apu-apu menunjukkan p-value tidak kurang dari 0,05 dengan taraf kepercayaan 95% (Lampiran 14), sehingga data tersebut homogen.
Uji statistik yang selanjutnya dilakukan setelah diketahui bahwa data terdistribusi normal dan homogen adalah uji t independen. Uji t independen digunakan untuk membandingkan dua kelompok data yang bukan diperoleh dari satu obyek yang sama, tetapi untuk membandingkan dua kelompok data yang diperoleh dari dua obyek yang berbeda. Hipotesis null-nya (H0), yaitu data tidak berbeda secara signifikan, sedangkan hipotesis alternatifnya (H1) adalah data berbeda secara signifikan. H0 akan ditolak dan H1 diterima apabila p-value kurang dari 0,05 dengan taraf kepercayaan 95% (Istyastono, 2012). Hasil pengujian menunjukkan bahwa data IC50 rutin dan ekstrak metanolik daun apu-apu berbeda
46 BAB V
KESIMPULAN DAN SARAN
A.Kesimpulan
1. Kandungan fenolik total dalam ekstrak metanolik apu-apu sebesar (0,5078 ±
0,0168) mg ekivalen asam galat per gram ekstrak metanolik daun apu-apu. 2. Nilai aktivitas antioksidan ekstrak metanolik daun apu-apu menggunakan
radikal bebas DPPH yang dinyatakan sebagai IC50 sebesar (350,8152 ±
2,8591) μg/mL.
B.Saran
1. Perlu dilakukan pengujian aktivitas antioksidan terhadap fraksi etil asetat dan air ekstrak metanolik daun apu-apu.
47
DAFTAR PUSTAKA
Adi, L.T., 2007, Tanaman Obat dan Jus untuk Mengatasi Penyakit Jantung, Kolesterol, Hipertensi, dan Stroke, Agromedia Pustaka, Jakarta, hal. 92. Agoes, G., 2009, Seri Farmasi Industri-2 : Teknologi Bahan Alam, edisi revisi,
Penerbit ITB, Bandung, hal.31-32.
Apsari, P.D, dan Susanti, H, 2011, Perbandingan Kadar Fenolik Total Ekstrak Metanol Kelopak Merah dan Ungu Bunga Rosella (Hibiscus sabdariffa, Linn) secara Spektrofotometri, Seminar Nasional "Home Care", Universitas Ahmad Dahlan, Yogyakarta.
Aqil, F., Ahmad, I., and Mehmood, Z., 2006, Antioxidant and Free Radical Scavenging Properties of Twelve Traditionally Used Indian Medical Plants, Turk J Biol, 30, 177-183.
Ardhie, A.M., 2011, Radikal Bebas dan Peran Antioksidan Dalam Mencegah Penuaan, Medicinus, 24 (1), 5-7.
Azlim, A.A.A, Ahmed, J.K.C., Syed, Z.I., Mustapha, S.K., Aisyah, M.R., and Kamarul, R.K, 2010, Total phenolic content and primary antioxidant activity of methanolic and ethanolic extracts of aromatic plants’ leaves,
International Food Research Journal ,17, 1077-1084.
Blainski, A., Lopes, G.C. and Mello, J.C.P.D, Application and Analysis of the Folin Ciocalteu Method for the Determination of the Total Phenolic Content from Limonium brasiliense L., Molecules, 18, 6852-6864.
Caduto, M.J., 2007, Everyday Herbs in Spiritual Life : A Guide to Many Practices, SkyLight Paths, Woodstock, Vermont, pp. 165-168.
Dalimartha, S., 2007, Atlas Tumbuhan Obat Indonesia, Jilid IV, Puspa Swara, Jakarta, hal. 8.
Departemen Kesehatan Republik Indonesia, 1986, Sediaan Galenik, Jilid 2, Direktorat Jenderal Pengawasan Obat dan Makanan, Jakarta, hal.11-12. Fidrianny, I., Darmawati, A., dan Sukrasno, 2014, Antioxidant Capacities From
Different Polarities Extracts of Cucurbitaceae Leaves Using FRAP, DPPH Assays and Correlation With Phenolic, Flavonoid, Carotenoid Content, International Journal of Pharmacy and Pharmaceutical Science, 6(2), 858-862.
Filho, V.C., 2012, Plant Bioactives and Drug Discovery: Principles, Practice, and Perspective, John Wiley & Sons, Inc., Hoboken, New Jersey, pp. 365-367.
Haci, I.A.E., Didi, A., Bekkara, F.A., and Gherib, M., 2009, In Vitro Atioxidant Activity and Total Phenolic Contents in Methanol Crude Extracts From The Algerian Medicinal Plant Limoniastrum feei, Scientific Study and Research, X(4), 329-336.