BAB 2
TINJAUAN PUSTAKA
2.1. Abu Cangkang Sawit
Abu boiler kelapa sawit yang merupakan limbah dari sisa pembakaran cangkang dan serabut buah kelapa sawit di dalam dapur atau tungku pembakaran (boiler) dengan suhu 7000C sampai dengan 8000C (Elhusna. dkk, 2013). Abu cangkang sawit tersebut merupakan salah satu material sisa dari proses pengolahan yang selama ini dianggap sebagai limbah. Limbah tersebut masih belum dimanfaatkan secara maksimal penggunaannya (Rosalia dkk ,2013).
Cangkang sawit merupakan salah satu limbah pengolahan dari minyak kelapa sawit yang cukup besar yaitu mencapai 60% dari produksi minyak (Elly, 2013). Cangkang sawit merupakan bagian paling keras yang terdapat pada kelapa sawit yang menghasilkan kalori mencapai 20000 KJ/kg. Pada industri pengolahan minyak Crude Palm Oil (CPO) salah satu kegunaan utama cangkang kelapa sawit sebagai bahan bakar untuk ketel uap (boiler). Dimana, ketel uap ini yang menjadi tenaga sumber uap yang akan dipakai mengolah kelapa sawit. Adapun alasan digunakannya serabut dan cangkang sebagai bahan bakar adalah :
1. Bahan bakar cangkang cukup tersedia dan mudah diperoleh di pabrik
2. Cangkang dan serabut merupakan limbah dari pabrik kelapa sawit apabila tidak digunakan
3. Nilai kalor bahan bakar cangkang dan serabut memenuhi persyaratan untuk menghasilkan panas yang diperlukan
4. Harga lebih ekonomis jika dibandingkan dengan menggunakan bahan bakar batubara
Tabel 2.1 Komposisi Abu Cangkang Sawit Hasil Pembakaran Serat Dan Cangkang
Unsur/senyawa Serat (%) Cangkang (%) Kalium (K)
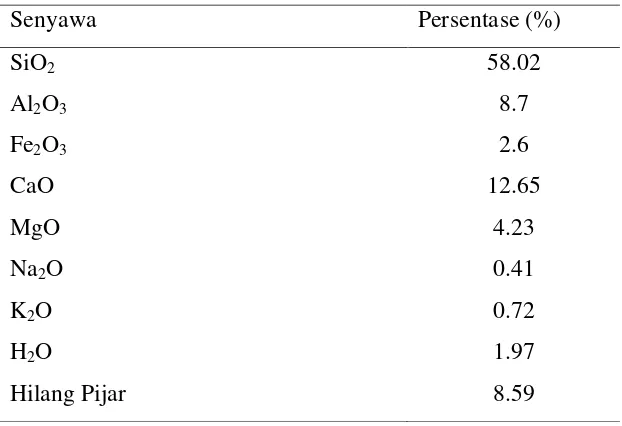
Menurut Hutahean (2007) kandungan unsur kimia abu cangkang sawit adalah sebagai berikut (Tabel 2.2):
Tabel 2.2 Kandungan Unsur Kimia Abu Cangkang Sawit
Senyawa Persentase (%)
Tabel 2.3 Komposisi Abu Hasil Pembakaran Cangkang Dan Serabut Kelapa
Berdasarkan pengamatan secara visual abu kelapa sawit memiliki karakteristik sebagai berikut: bentuk partikel abu sawit tidak beraturan, ada yang memiliki butiran bulat panjang, bulat dan persegi dengan ukuran butiran 0 – 2.3 mm serta memiliki warna abu-abu kehitaman (Kurniawandy dkk, 2012).
2.2. Silika (SiO2)
Silika (silicon dioxide) merupakan senyawa kimia dengan rumus molekul SiO2 yang dapat di peroleh dari silica mineral dan sistesis Kristal. Mineral silica adalah senyawa yang banyak mengandung SiO2 yang di temukan dalam bahan tambang dan galian yang berupa mineral seperti pasir kuarsa, granit, dan fledsfar (Kalapathy, 1999).
Bentuk –bentuk silika merupakan beberapa struktur kristal yang penting bukan saja karena silika merupakan zat yang melimpah dan berguna, tetapi karena strukturnya (SiO2) adalah unit yang mendasar dalam kebanyakan mineral. Kristal memiliki dua cirri utama yaitu:
1. Setiap atom silicon berada pada pusat suatu tetrahedron yang terdiri dari empat atom oksigen
2. Setiap atom oksigen berada di tengah-tengah antara dua atom silicon (Keenan, 1992).
dengan struktur kristobalit. Silika dapat di bentuk dengan mereaksikan silicon dengan oksigen atau udara pada suhu tinggi (Iler, 1979).
2.2.1. Sifat-Sifat Silika
Sifat Hasil
Berat jenis (g/cm3) 2.6
Bentuk Padat
Daya larut dalam air Tidak larut
Titik cair (oC) 1610
Titik didih (oC) 2230
Kekerasan (Kg/mm2) 650
Kekeuatan tekuk (MPa) 70
Kekuatan tarik (MPa) 110
Modulus elastisitas (GPa) 73-75
Resistivitas (m) >1014
Koordinasi geometri Tetrahedral
Struktur Kristal Kristobalit, trimidit, kuarsa
Selain sifat diatas silika juga memiliki sifat kimia anatara lain sebagi berikut: a. Reaksi dengan asam
Silika relative terhadap asam kecuali hidrofluorifda seperti reaksi berikut SiO2(S) + 4HF(aq) SiF4(aq) + 2H2O(l)
Dengan asam hidrofluorida berlebih reaksi nya menjadi: SiO2(S) + 6HF(aq) H2[SiF6](aq) + 2H2O(l) (Besset,j. 1988)
b. Reaksi basa
Silika dapat bereaksi dengan basa, terutama dengan basa kuat, seperti dengan hidroksida alkali.
Secara komersial, silika di buat dengan mencampur larutan natrium silikat dengan suatu asam mineral. Reaksi ini menghasilkan suatu disperse pekat yang kahirnya memisahkan partikel dari silika terhidrat, yang dikenal sebagai silika hydrosol atau asam silikat yang kemudian di keringkan pada suhu 110oC agar terbentuk silika gel. Reaksi yang terjadi:
Na2SiO3(aq) + 2HCl(aq) H2SiO3(l) + 2NaCl(aq)
H2SiO3 (S) SiO2.H2O(S) (Bakri, dkk 2008)
2.3. Ekstraksi
Ekstraksi adalah proses pemisahan suatu zat dari campurannya dengan menggunakan pelarut. Pelarut yang digunakan harus dapat mengekstrak substansi yang di inginkan tanpa melarutkan material lainnya. Secara garis besar, proses pemisahan secara ekstraksi terdiri dari tiga langkah yaitu:
1. Penambahan sejumlah massa pelarut untuk di kontakkan dengan sampel, biasanya melalui proses di fusi
2. Zat terlarut akan terpisah dari sampel dan larut oleh pelarut membentuk fase ekstrak
3. Pemisahan fase ekstrak dengan sampel (Wilson, et al., 2010).
2.3.1. Ekstraksi Cair-Cair
keadaan setimbang merupakan pendorong terjadinya pelaruta pelepasan zat terlarut dari larutan yang ada. Gaya dorong (driving force) yang menyebabkan terjadinya proses ekstraksi dapat di tentukan dengan mengukur jarak system dari kondisi setimbang (Indra Wibawa., 2012).
Fase rafinat = fase residu, berisi cairan pembawa dan sisa zat terlarut. Fase ekstrak = fase yang berisi zat terlarut dan pelarut
a. Kemampuan tinggi melarutkan komponen zat terlarut di dalam campuran b. Kemampuan tinggi untuk diambil kembali
c. Perbedaan berat jenis antara ektrak dan rafinat lebih besar
d. Pelarut dan larutan yang akan di ekstraksi harus tidak mudah campur e. Tidak mudah berisi dengan zat yang akan di ekstraksi
f. Tidak merusak alat secara korosi
g. Tidak mudah terbakar, tidak beracun dan harganya relative murah (Martunus & Helwani, 2004;2005).
2.3.2 Ekstraksi Padat-Cair
Pada ekstraksi padat-cair, komponen yang dapat larut dipisahkan dari bahan padat dengan bantuan pelarut (ekstraktan). Pada ekstraksi ini, ketika bahan ekstraksi dicampur dengan pelarut maka pelarut akan bereaksi dengan bahan padat dan membentuk larutan ekstrak. Larutan ekstrak dengan konsentrasi yang tinggi terbentuk dibagian dalam bahan ekstraksi. Dengan cara ini difusi akan terjadi kesetimbangan konsentrasi antara larutan tersebut dengan larutan di luar bahan padat. Syarat yang harus dipenuhi untuk mencapai kecepatan ekstraksi yang tinggi pada ekstraksi padat cair adalah sebagi berikut:
a. Karena perpindahan masa berlangsung pada bidang kontak antara fase padat dab fase cair, maka bahan itu perlu memiliki permukaan yang seluas mungkin
b. Kecepatan alir pelarut sedapat mungkin besar dibandingkan dengan laju alir bahan ekstraksi
Ekstraksi padat-cair merupakan suatu proses yang melibatkan perpindahan massa antara fasa. Perbedahan aktivitas kimia anatara fasa padatan dan fasa pelarut mencerminkan seberapa jauh sistem berada dari kesetimbangan, sehingga akan menentukan pula laju zat terlarut antar fasa. Proses ini merupakan proses yang merupakan proses yang bersifat fisik karena komponen terlarut kemudiankembali lagi kekeadaan semula tanpa mengalami perubahan kimiawi (Lucas, 1949).
Dalam proses ekstraksi padat-cair diperlukan kontak yang sangat lama antara pelarut dan padatan. Proses ini paling banyak ditemui didalam usaha untuk mengisolasi suatu substansi yang terkandung didalam suatu bahan alam sehingga yang berperan penting dalam menentukan sempurnanya proses ekstraksi ini adalah sifat-sifat bahan alam tersebut dan juga bahan yang akan di ekstraksi. Tingkat ekstraksi bahan ditentukan oleh ukuran bahan partikel tersebut. Bahan yang di ekstrak sebaiknya berukuran seragam untuk mempermudah kontak antara bahan dan pelarut sehingga ekstraksi berlangsung dengan baik (Sudarmadji & suhardi, 1996).
Faktor-faktor yang berpengaruh dalam proses ekstraksi antara lain: a. Jenis pelarut
Jenis pelarut mempengaruhi senyawa yang tersari, jumlah zat terlarut yang terekstrak dan kecepatan ekstraksi
b. Suhu
Secara umum, kenaikan suhu akan meningkatkan jumlah zat terlarut ke dalam pelarut.
c. Rasio pelarut dan bahan baku
Jika rasio pelarut-bahan baku besar maka akan memperbesar pula jumlah senyawa yang terlarut. Akibat laju reaksi akan semakin meningkat.
d. Ukuran partikel
Laju reaksi juga meningkatkan apabila ukuran partikel dalam suatu bahan baku semakin kecil. Dalam arti lain, rendemen ekstrak akan semakin besar bila ukuran partikel semakin kecil.
e. Pengadukan
f. Lama waktu
Lama waktu ekstraksi akan menghasilkan ekstrak yang lebih banyak, karena kontak antara zat terlarut dengan pelarut lebih lama.
Silika terbentuk melalui ikatan kovalen yang kuat serta memiliki struktur dengan empat atom oksigen terikat pada posisi sudut tetrahedral di sekitar atom pusat yaitu atom silicon (Cestari,2000).
2.3. Luas Permukaan Dan Luas Porositas
Luas permukaan dan porositas merupakan karakteristik yang sangat penting pada berbagai material. Penentuan dari isotherm adsorbs pada desorbsi merupakan variable yang sangat penting untuk menentukan stuktur pori dan metode BET digunakan untuk menentukan total luas permukaan (Brown, 2003).
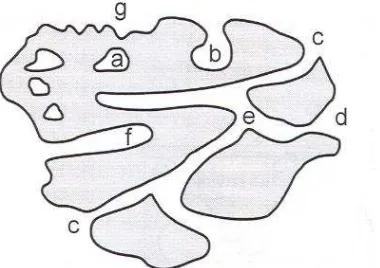
Suatu padatan dapat dikatakan sebagai berpori apabila memiliki pori-pori berupa lubang, terusan (chanel) atau celah yang lebih dalam dari luasnya. Pori-pori memiliki tipe yang berbeda dan diklasifikasikan berdasarkan aliran zat yang masuk melalui pori seperti Gambar 2.1. berikut.
Gambar 2.2. Perbedaan jenis pori (Schubert and Husing, 2006)
Tipe pori umumnya diklasifikasikan menjadi dua tipe yaitu:
1. Pori yang terisolasi dari pori yang lain disebut closed-pores (a)
pores) (e), silinder tertutup (silinder blind) (f) dan porositas yang kasar (roughness) pada permukaan luar (g) (Schubert and Husing, 2006).
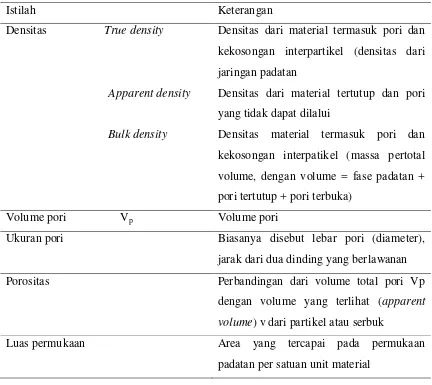
Dalam karaktrisasi pori sering digunakan istilah seperti yang terdapat pada Table 2.2 berikut ini:
Table 2.2 Istilah yang digunakan dalam karakterisasi padatan
Istilah Keterangan
Densitas True density
Apparent density
Bulk density
Densitas dari material termasuk pori dan kekosongan interpartikel (densitas dari jaringan padatan
Densitas dari material tertutup dan pori yang tidak dapat dilalui
Densitas material termasuk pori dan kekosongan interpatikel (massa pertotal volume, dengan volume = fase padatan + pori tertutup + pori terbuka)
Volume pori Vp Volume pori
Ukuran pori Biasanya disebut lebar pori (diameter), jarak dari dua dinding yang berlawanan Porositas Perbandingan dari volume total pori Vp
dengan volume yang terlihat (apparent volume) v dari partikel atau serbuk
Luas permukaan Area yang tercapai pada permukaan padatan per satuan unit material
Luas pori atau diameter pori didefinisikan seabagi diameter untuk pori silinder dan jarak antara dinding pori yang berlawanan dalam pori bentuk celah. Luas pori diklasifikasikan oleh International Union of Pure and Applied Chemistry (IUPAC) terbagi 3 (Gates, 1992):
1. Mikropori, diameter lebih kecil dari 2 nm (d<2 nm)
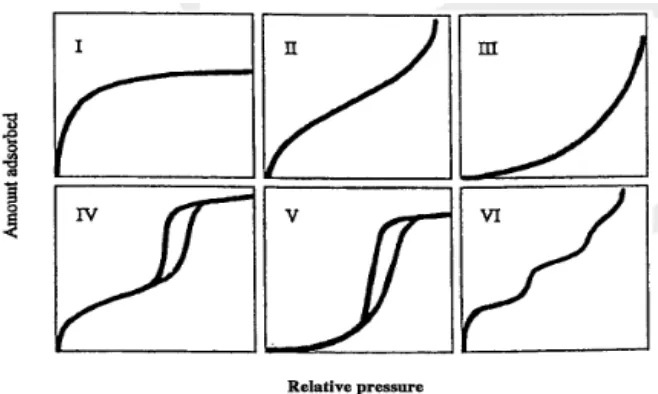
Untuk menjelaskan pori padatan secara kualitatif dan kuantitatif diperlukan informasi tentang porositas, densitas, luas permukaan spesifik atau ukuran pori dan distribusi ukuran pori pada padatan berpori. Nilai hasil pengukurannya sangat ditentukan oleh metode yang digunakan, biasanya metode hanya dapat mendeteksi pori yang terbuka. Metode yang digunakan berupa adsorpsi molekul ke dalam celah. Hasil yang diperoleh tergantung pada ukuran molekul yang dilewatkan pada permukaan pori. Misalnya untuk nilai luas permukaan akan lebih kecil jika digunakan molekul yang besar, sebaliknya nilai luas permukaan akan semakin besar jika digunakan molekul yang lebih kecil. Berikut ini skema adsorbsi gas pada permukaan menggunakan ukuran molekul yang berbeda (Schubert and Husing, 2006)
Gambar 2.3. Skema Adsorbsi gas pada permukaan pori material dengan perbedaan ukuran molekul gas (Schubert and Husing, 2006)
sedangkan Tipe VI merupakan karakteristik padatan dua dimensi yang sangat homogeny seperti grafit (Kanellopoulos, N. 2011)
Gambar 2.4. Klasifikasi Isotherm Adsorbsi menurut International Union Of Pure and Applied Chemistry (IUPAC)
Silika berpori merupakan variasi dari bentuk silika amorf. Material berbahan silika banyak diteliti karena memiliki struktur variasi yang luas, dapat diatur ada reaksi hidrolisis dan kondensasi, stabilitas termal yang tinggi pada jaringan amorf dan memiliki kekuatan grafting pada fungsi organik. Silika berpori dibuat dengan mengasamkan larutan silikat basa berair dan diperoleh gel silika pori. Material padatannya diperoleh dengan proses sol-gel dalam larutan yang dikeringkan pada temperatur rendah dimana terjadi penekanan gel menjadi xerogel
Parameter yang dapat mengkarakterisasi pori adalah luas permukaan spesifik (S) dengan satuan [m2/g], volume mikropori (WMP) dengan satuan [cm3/g], Volume pori (W) merupakan jumlah volume mikropori dan mesopori adsorben dalam [cm3/g] dan Pores Size Distribution (PSD) yang merupakan suatu grafik dari Vp/Dp versus Dp
dimana Vp adalah akumulasi pori hingga luas pori Dp diukur [cc-STP/GA]. Unit cc-STP
2.5 Karakterisasi Silika
Analisis karakterisasi silika dapat dilakukan melalui pengujian XRD (X-ray diffraction) untuk mengetahui struktur kristal silika, FT-IR untuk mengetahui gugus fungsi silika dan BET (Brunauer, Emmet, Teller) surface area analysser untuk analisis mengenai luas permukaan spesifik partikel silika yang dihasilkan.
2.5.1 Difraksi Sinar-X (XRD)
Spektroskopi difraksi sinar-x (X-ray diffraction/ XRD) merupakan salah satu metode karakterisasi material. Teknik ini digunakan untuk mengidentifikasi fasa kristalin dan material dengan cara menentukan parameter struktur kisi serta umtuk mendapatkan ukuran partikel. Difraksi sinar-x terjadi pada hamburan elastic foton-foton sinar-x oleh atom dalam sebuah kisi periodik. Hamburan monokromatis sinar x dalam fasa tersebut memberikan interfensi yang konstruktif. Dasar penggunaan difraksi sinar-x untuk mempelajari kisi Kristal adalah berdasarkan persamaan Bragg (Cullity, 1978):
n. λ = 2.d.sin θ ; n1,2,…
dengan; λ adalah panjang gelombang sinar-x yang digunakan, d adalah jarak antar dua bidang kisi, θ adalah sudut antara sinar dating dengan bidang normal, n adalah bilangan bulat yang di sebut sebagai orde pembiasan.
2.5.2 Brunauer-Emmet-Teller (BET)
Teori BET adsorpsi multilayer untuk menentukan luas permukaan (S) di kembangkan oleh Brunauer, Emmet dan teller. Proses adsorpsi digambarkan sebagai proses lapisan dengan lapisan (layer-by-layer), permukaan secara energetic dianggap homogen, medan adsorbsi sama dalam setiap tempat permukaan. Proses adsorb dianggap tidak bergerak (setiap molekul yang di adsorbsi pada sisi dasar adsorbs pada permukaan). Lapisan pertama molekul yang diadsorb memiliki energy interaksi dengan medan adsorbs (Ea0) dan interaksi pertikal antar molekul setelah lapisan pertama (EL0) sama terhadap panas liqufaksi adsorbat dan molekul yang diadsorb tidak berinteraksi secara menyamping. Model adsorbsi BET digambarkan sebagai berikut (Roque-Malherbe, 2007).
Untuk menerapkan persamaan isotherm BET terhadap data adsorpsi yang diperoleh digunakan persamaan linear berikut:
V = Vm.C.p
(po – p).[1 + (C – 1). p / po] Atau ditulis sebagai berikut:
Dimana
p =tekanan akhir po =tekanan jenuh
V =volume gas yang terserap pada tekanan p Vm =volume gas yang terserap pada monolayer
C =merupakan parameter yang dapat di tentukan dengan cara berikut:
C =
Dimana
A = konstanta
E1 = panas yang di serap lapisan pertama EL = panas yang kondensasi dari gas.
Metode BET tidak tepat untuk perhitungan mikropi, karena ketika metode ini di terapkan pada adsorben mikro maka akan terjadi penyerapan pada tekanan yang rekatif rendah sehingga memungkinkan volume monolayer yang dihitung lebih dari satu lapisan terserap. Jika nilai ini diubah menjadi luas permukaan BET maka nilai yang dihasilkan akan lebih besar dari nilai yang sebenarnya. Meskipun metode BET tidak menggambarkan keadaan yang sebenarnya, namun metode ini lebih umum untuk digunakan untuk analisa isotherm adsorbs. Ini disebabkan metode BET relatif sederhana dan dianggap memberikan kapasitas adsorbsi yang baik dari adsorben yang digunakan (Kanellopoulus, N., 2011).
2.5.3 Spektroskopi Inframerah (FT-IR)
Spektroskopi inframerah merupakan metode yang digunakan untuk mengamati interaksi interaksi molekul dengan radiasi elektromagnetik. Prinsip dasar spektroskopi inframerah yaitu interaksi antara vibrasi atom-atom yang berikatan/ gugus fungsi dalam molekul yang mengadsorbsi radiasi gelombang elektromagnetik inframerah. Adsorbsi terhadap radiasi inframerah dapat menyebabkan eksitasi energi vibrasi molekul ketingkat energi vibrasi yang lebih tinggi. Untuk dapat mengadsorbsi, molekul harus mempunyai perubahan momen dipol sebagai akibat dari vibrasi. Daerah radiasi spektroskopi inframerah berkisar pada bilangan gelombang 12800-10 cm-1. Umumnya daerah radiasi inframerah terbagi dalam daerah inframerah dekat (12800-4000 cm-1), daerah inframerah tengah (4000-200 cm-1), daerah inframerah jauh (200-10 cm-1). Daerah yang paling banyak digunakan untuk berbagai keperluan adalah 4000-690 cm-1, daerah ini biasa disebut sebagai inframerah tengah (Khopkar, 2008).
Terdapat dua macam vibrasi molekul, yaitu vibrasi ulur dan vibrasi tekuk. Vibrasi ulur adalah suatu gerakan berirama disepanjang sumbu ikatan sehingga jarak antar atom bertambah atau berkurang dalam satu bidang datar. Vibrasi ulur dibagi menjadi dua yaitu simetri dan asimetri. Vibrasi ulur simetri terjadi akibat ikatan antar atom bergerak bersamaan sedangkan vibrasi ulur asimetri terjadi akibat ikatan antar atom bergerak tidak bersamaan dalam satu bidang datar. Perbedaan ini terdapat pada gugus Si-O-Si, dimana terdapat perbedaan antara vibrasi asimetri Si dengan vibrasi simetri Si-O-Si. Pada vibrasi asimetri Si-O-Si, pergerakan molekul antar Si-O tidak bersamaan sedangkan pada vibrasi simetri Si-O-Si, pergerakan molekul antar Si-O bersamaan pada satu bidang datar. Perbedaan pergerakan molekul ini menyebabkan perbedaan energi serapan inframerah pada gugus Si-O-Si (Silverstein, 1986).
Vibrasi tekuk dapat terjadi karena perubahan sudut-sudut ikatan antara ikatan-ikatan pada sebuah atom atau karena gerakan sebuah gugusan. Contohnya liukan (twisting), goyangan (rocking), dan getaran putar yang menyangkut perubahan sudut-sudut ikatan dengan acuan seperangkat koordinat yang disusun arbiter dalam molekul. Hanya vibrasi yang menghasikan perubahan momen dwikutub secara berirama saja yang teramati di dalam inframerah (Hartomo, 1986).